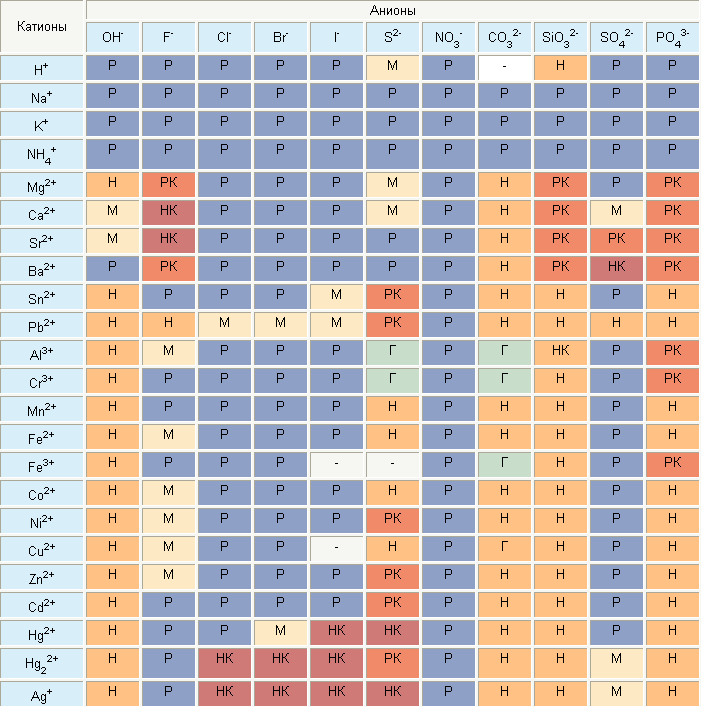
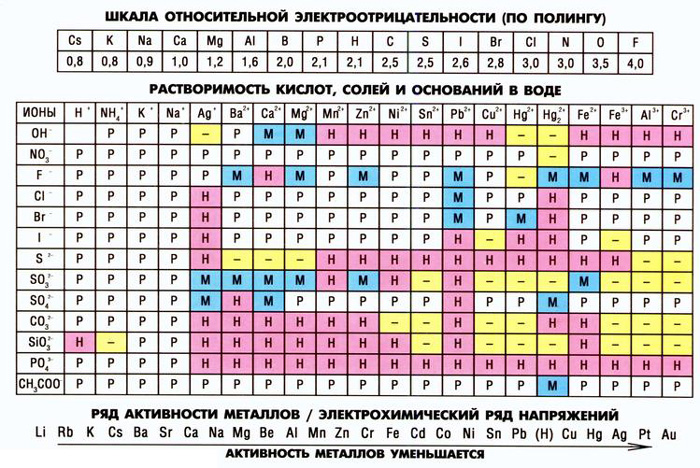
Как пользоваться таблицей растворимости в химии
Содержание:
- Функции таблицы растворимости
- Растворимость веществ
-
Полная таблица растворимости
- Школьная таблица растворимости
- Полная таблица растворимости
- Условные обозначения
- Как применять таблицу
Функции таблицы растворимости
Таблица Менделеева — не единственный помощник в работе химика. Не менее важным инструментом для решения химических уравнений является таблица растворимости веществ. Прежде всего она помогает определить, растворяется ли вещество в воде. Если оно не растворяется, можно узнать каким будет осадок и решить ионное уравнение.
Растворимость веществ
Если вещество может образовать с другим однородное соединение, значит оно растворимо. Степень растворимости у всех веществ разная. В зависимости от этого все вещества делят на группы:
- растворимые — в 100 г воды растворяется больше 10 г (например, соль, спирт, аммиак);
- малорастворимые — в 100 г воды растворяется менее 1 г (кислород, бензол, алебастр);
- нерастворимые — в 100 г воды растворяется менее 0,01 г (стекло, бензин, гелий).
Каждое вещество имеет коэффициент растворимости, показывающий величину массы, которую оно может растворить. На растворение зачастую влияет температура и давление, при которых происходит реакция.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Полная таблица растворимости
В школьном курсе химии используется упрощенная таблица растворимости. Для более высокого уровня изучения или работы необходима полная, где приводятся данные о большем количестве реакций и включено больше химических элементов и соединений.
Школьная таблица растворимости
Полная таблица растворимости
Условные обозначения
В таблице указаны названия химических элементов и соединений, а также условные обозначения, говорящие о степени растворимости. Часть обозначений действительна и для школьной. В полной таблице учтена способность веществ растворяться в кислотах.
- Катионы — положительно заряженные частицы и соединения.
- Анионы — отрицательно заряженные соединения.
- Р — растворимое.
- М — малорастворимое.
- Н — нерастворимое в воде.
- РК — растворимое только в неорганических кислотах.
- НК — нерастворимое ни в воде, ни в кислотах.
- Г — не существует в контакте с водой, гидролизуется.
- «-» — не существует.
Как применять таблицу
Пользоваться пособием не сложно. Достаточно посмотреть на то, какое значение находится на пересечении строчек двух частей интересующего соединения. Например, чтобы узнать, образуется ли раствор соли MgSo4 (сульфат магния), необходимо найти столбик Mg2+ и опуститься по нему до строки SO42-. Там, где строки пересекаются, написано Р, то есть соединение растворимо.
Если посмотреть на результат реакции металла серебра с бромом — AgBr — можно увидеть, что бромид серебра не растворяется в воде или кислотах, так как в таблице на пересечении этих элементов стоит НК.
Насколько полезной была для вас статья?
Рейтинг: 2.78 (Голосов: 37)
Выделите текст и нажмите одновременно клавиши «Ctrl» и «Enter»
Текст с ошибкой:
Расскажите, что не так
Поиск по содержимому
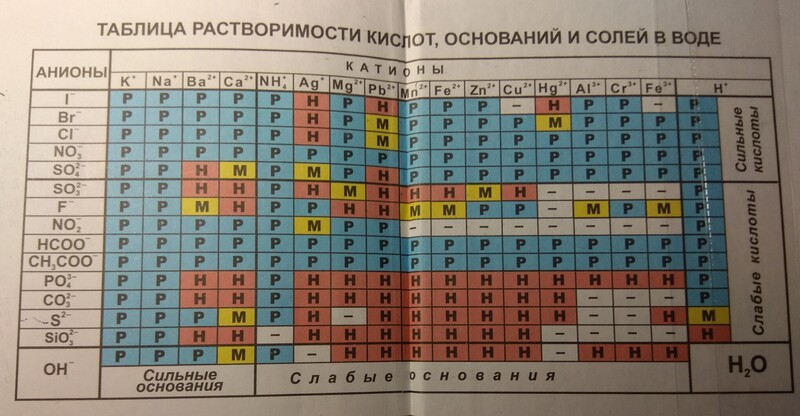
Таблица растворимости солей, кислот и оснований
Растворимость – это способность одного вещества взаимодействовать с другими веществами, образуя при этом однородные растворы.
На сегодняшний день существует таблица способная помочь в определении растворимости химического соединения.
Чтобы пользоваться таблицей не обязательно иметь специальных навыков. Для определения растворимости какого-либо химического вещества, достаточно в таблице провести перпендикуляр от выбранного вещества начиная от крайней левой колонки до химического вещества в верхней колонке. Точка пересечения и укажет нам насколько растворимы выбранные вещества.
Рассмотрим на примере, как пользоваться таблицей растворимости солей, кислот и оснований:
В левой колонке выберем вещество Ba2+, проводим линию до 3-й колонки с веществом F—, на пересечении видим символы «РК». Это означает, что соединение нерастворимо в воде и растворяется только в сильных неорганических кислотах.
Таблица условных обозначений
| Р | растворимо в воде (больше 1 грамма вещества на 100 грамм воды) |
| М | малорастворимо в воде (от 0,001 грамма до 1 грамма вещества в 100 граммах воды) |
| Н | нерастворимо в воде, но хорошо растворимо в слабых кислотах (меньше 0,001 грамма до 1 грамма вещества в 100 граммах воды) |
| РК | нерастворимо в воде, но растворимо в сильных неорганических кислотах |
| НК | химическое вещество не растворимо ни в воде, ни в любых кислотах |
| Г | химическое вещество подвергается гидролизу |
| — | данные о растворимости химического вещества отсутствуют |
Таблица растворимости солей, кислот и оснований по химии
| Катионы |
Анионы | ||||||||||
| OH— | F— | Cl— | Br— | I— | S2- | NO3— | CO32- | SiO32- | SO42- | PO43- | |
| H+ | Р | Р | Р | Р | Р | М | Р | — | Н | Р | Р |
| Na+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| K+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| NH4+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| Mg2+ | Н | РК | Р | Р | Р | М | Р | Н | РК | Р | РК |
| Ca2+ | М | НК | Р | Р | Р | М | Р | Н | РК | М | РК |
| Sr2+ | М | НК | Р | Р | Р | Р | Р | Н | РК | РК | РК |
| Ba2+ | Р | РК | Р | Р | Р | Р | Р | Н | РК | НК | РК |
| Sn2+ | Н | Р | Р | Р | М | РК | Р | Н | Н | Р | Н |
| Pb2+ | Н | Н | М | М | М | РК | Р | Н | Н | Н | Н |
| Al3+ | Н | М | Р | Р | Р | Г | Р | Г | НК | Р | РК |
| Cr3+ | Н | Р | Р | Р | Р | Г | Р | Г | Н | Р | РК |
| Mn2+ | Н | Р | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Fe2+ | Н | М | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Fe3+ | Н | Р | Р | Р | — | — | Р | Г | Н | Р | РК |
| Co2+ | Н | М | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Ni2+ | Н | М | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Cu2+ | Н | М | Р | Р | — | Н | Р | Н | Н | Р | Н |
| Zn2+ | Н | М | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Cd2+ | Н | Р | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Hg2+ | Н | Р | Р | М | НК | НК | Р | Н | Н | Р | Н |
| Hg22+ | Н | Р | НК | НК | НК | РК | Р | Н | Н | М | Н |
| Ag+ | Н | Р | НК | НК | НК | НК | Р | Н | Н | М | Н |
Содержание:
- Полная таблица растворимости солей, кислот и оснований
- Стандартная (школьная) таблица растворимости
Таблица растворимости вместе с
таблицей Менделеева
являются основным теоретическим материалом при изучении химии! Растворимость — способность вещества образовывать с другими веществами
однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц.
Если при изучении материала на данной странице у Вас возникнут вопросы, Вы всегда можете задать их на нашем
форуме. Также на Вам помогут
решить задачи по химии,
теории вероятности, математике,
геометрии и многим другим предметам!
Полная таблица растворимости солей, кислот и оснований
Условные обозначения таблицы растворимости:
Р — вещество хорошо растворимо в воде;
М — вещество малорастворимо в воде;
Н — вещество практически нерастворимо в воде, но легко растворяется в слабых или разбавленных кислотах;
РК — вещество нерастворимо в воде и растворяется только в сильных неорганических кислотах;
НК — вещество нерастворимо ни в воде, ни в кислотах;
Г — вещество полностью гидролизуется при растворении и не существует в контакте с водой;
— — вещество не существует.
Стандартная (школьная) таблица растворимости
Таблица растворимости используют для проверки условий протекания реакции, так как одним из условий протекания
реакции является образование осадка (необратимость протекания реакции), то по таблице расворимости можно проверить образование осадка и тем самым определить,
протекает реакиция или нет.
Помимо таблицы растворимости на сайте Вы можете посмотреть
тригонометрические формулы,
таблицу производных и
таблицу интегралов. Пользуйтесь на здоровье!

236
проверенных автора готовы помочь в написании работы любой сложности
Мы помогли уже 4 430 ученикам и студентам сдать работы от решения задач до дипломных на отлично! Узнай стоимость своей работы за 15 минут!
Таблица растворимости
Интерактивная таблица
Таблица растворимости — наглядная инфографика о растворимости солей. На пересечении катиона (по горизонтали) и аниона (по вертикали) отображается информация о соли, состоящей из данного катиона и данного аниона. Смотрите вкладки ниже, чтобы понять, какая информация там содержится.
Часто таблицу используют, чтобы предсказать возможность протекания реакции ионного обмена: если в процессе такой реакции образуется осадок (то есть нерастворимое вещество Н или малорастворимое М в этой таблице), то скорее всего реакция осуществима.
$$ce{BaCl2 + Na2SO4 ->[ce{H2O}] BaSO4 v + 2NaCl}$$
Однако, для совсем точного знания о ходе реакции обмена потребуется вычислить константу равновесия реакции, для которой необходимы знания произведений растворимости (ПР) малорастворимых и нерастворимых веществ. А чтобы узнать ПР, можно навести мышь на любое мало- или нерастворимое вещество: появится окошко со значением ПР вещества.
$$ce{BaSO4 <=> Ba^2+ + SO4^2-}, K_{s} = [ce{Ba^2+}][ce{SO4^2-}]$$
У таблицы растворимости есть следующие возможности:
- При наведении на пересечение катиона и аниона, если соединение нерастворимо (Н) или малорастворимо (М), отобразится значение произведения растворимости (ПР) этого соединения.
- При наведении на анион появится его название (гидроксид, фторид…);
- При наведении на любую клеточку отобразится подсказка о содержании данной ячейки.
Обозначения, используемые в таблице растворимости:
- Р: соединение растворимо (более 1 г на 100 г H2O);
- М: соединение малорастворимо (от 0,1 до 1 г на 100 г H2O);
- Н: соединение нерастворимо (менее 0,1 г на 100 г H2O);
- 🞩: нет данных о существовании соединения;
- —: соединение существует, но его невозможно получить обменом в водном растворе, то есть оно необратимо гидролизуется (Al2S3 + 6H2O = 2Al(OH)3 + 3H2S).
Все данные о растворимости приведены при стандартных условиях: 1 атм внешнего давления, температура 25°C.
Все данные о растворимости и о ПР веществ взяты из следующих источников:
- David R. Lide, ed., CRC Handbook of Chemistry and Physics, Internet Version 2005, <http://www.hbcpnetbase.com>, CRC Press, Boca Raton, FL, 2005
- «Неорганическая химия» в 3-х т. под ред. Ю. Д. Третьякова.
Если вы нашли ошибку, пожалуйста, сообщите об этом, выделив ошибку и нажав Ctrl+Enter, при необходимости добавив комментарий.
Спасибо за помощь, уважаемый читатель!
| Анион | H+ | NH4+ | Li+ | Na+ | K+ | Be2+ | Mg2+ | Ca2+ | Ba2+ | Al3+ | Zn2+ | Cr2+ | Cr3+ | Fe2+ | Fe3+ | Cu2+ | Pb2+ | Hg22+ | Hg2+ | Ag+ |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
OH− Гидроксид |
Р | Р | Р | Р | Р | Н
ПР: 6,92 * 10-22 |
Н
ПР: 6,8 * 10-12 |
М
ПР: 6,3 * 10-6 |
Р | Н
ПР: 5,7 * 10-32 |
Н
ПР: 3,0 * 10-16 |
Н
ПР: 1,0 * 10-17 |
Н
ПР: 1,1 * 10-30 |
Н
ПР: 7,9 * 10-16 |
Н
ПР: 6,3 * 10-38 |
Н
ПР: 5,6 * 10-20 |
Н
ПР: 5,5 * 10-16 |
🞩 | 🞩 | 🞩 |
|
F− Фторид |
Р | Р | М
ПР: 1,5 * 10-3 |
Р | Р | Р | Н
ПР: 6,4 * 10-9 |
Н
ПР: 4,0 * 10-11 |
М
ПР: 1,7 * 10-6 |
М | М
ПР: 3,04 * 10-2 |
М
ПР: |
Р | Р | Р | Н | Н
ПР: 2,7 * 10-8 |
Н | — | Р |
|
Cl− Хлорид |
Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | М
ПР: 1,7 * 10-5 |
Н
ПР: 1,5 * 10-18 |
Р | Н
ПР: 1,8 * 10-10 |
|
Br− Бромид |
Р | Р | Р | Р | Р | М
ПР: |
Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | М
ПР: 5,0 * 10-5 |
Н
ПР: 7,9 * 10-23 |
М
ПР: |
Н
ПР: 5,3 * 10-13 |
|
I− Иодид |
Р | Р | Р | Р | Р | — | Р | Р | Р | Р | Р | Р | М
ПР: ? |
Р | 🞩 | 🞩 | Н
ПР: 8,7 * 10-9 |
Н
ПР: 5,4 * 10-29 |
Н | Н
ПР: 2,3 * 10-16 |
|
NO3− Нитрат |
Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
|
SO42− Сульфат |
Р | Р | Р | Р | Р | Р | Р | М
ПР: 3,7 * 10-5 |
Н
ПР: 1,8 * 10-10 |
Р | Р | Р | Р | Р | Р | Р | Н
ПР: 1,7 * 10-8 |
— | — | М
ПР: 1,2 *10-3 |
|
SO32− Сульфит |
Р | Р | Р | Р | Р | 🞩 | М
ПР: 3,0 * 10-3 |
Н
ПР: 3,2 * 10 -7 |
Н
ПР: 8,0 * 10-7 |
🞩 | М | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | Н | Н | 🞩 | Н
ПР: 1,5 * 10-14 |
|
CH3COO− Ацетат |
Р | Р | Р | Р | Р | Н | Р | Р | Р | 🞩 | Р | М
ПР: |
Р | 🞩 | 🞩 | Р | Р | Р | Р | М
ПР: |
|
CO32− Карбонат |
Р | Р | М
ПР: 1,9 * 10-3 |
Р | Р | М | М
ПР: 4,9 * 10-11 |
Н
ПР: 4,4 * 10-9 |
Н
ПР: 4,9 * 10-9 |
🞩 | Н
ПР: 5,3 * 10-11 |
🞩 | 🞩 | Н
ПР: 2,9 * 10-11 |
🞩 | — | Н
ПР: 3,6 * 10-14 |
Н
ПР: ? |
🞩 | Н
ПР: 1,2 * 10-12 |
|
S2− Сульфид |
Р | Р | Р | Р | Р | — | — | М
ПР: — |
Р | — | Н
ПР: 1,2 * 10-25 |
Н | — | Н | Н | Н
ПР: 1,4 * 10-36 |
Н
ПР: 8,7 * 10-29 |
Н | Н
ПР: 1,4 * 10-45 |
Н
ПР: 7,2 * 10-50 |
|
SiO32− Силикат |
Н | 🞩 | Н | Р | Р | 🞩 | М
ПР: N |
М
ПР: N |
Н | 🞩 | Н | 🞩 | 🞩 | Н | 🞩 | 🞩 | Н | 🞩 | 🞩 | Н |
|
PO43− Фосфат |
Р | — | Н
ПР: 3,2 * 10-9 |
Р | Р | 🞩 | Н
ПР: 1,04 * 10-24 |
Н
ПР: 1,0 * 10-25 |
Н
ПР: 6,0 * 10-39 |
М
ПР: 9,84 * 10-21 |
Н
ПР: 9,1 * 10-33 |
🞩 | Н | Н | Н | Н | Н | Н | Н | Н
ПР: 1,8 * 10-18 |
|
HPO4− Гидрофосфат |
Р | Р | 🞩 | Р | Р | Н | М | Н | Н | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | — | 🞩 | 🞩 | 🞩 |
|
H2PO4− Дигидрофосфат |
Р | Р | Р | Р | Р | 🞩 | 🞩 | Р | Р | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | Р | 🞩 | 🞩 | 🞩 |
|
ClO4− Перхлорат |
Р | Р | Р | Р | М
ПР: 1,0 * 10-2 |
Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
|
ClO3− Хлорат |
Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | 🞩 | 🞩 | Р | Р | Р | Р | 🞩 |
|
HCOO− Формиат |
Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | — | Н |
|
C2O42− Оксалат |
Р | Р | Р | Р | Р | Р | Н
ПР: 8,6 * 10-3 |
Н
ПР: 2,3 * 10-9 |
Н
ПР: 1,1 * 10-9 |
Р | Н
ПР: 1,38 * 10-9 |
🞩 | Н | Н
ПР: 2,1 * 10-7 |
Н | Н | Н | Н | Н | Н
ПР: 3,5 * 10-11 |
|
MnO4− Перманганат |
Р | М | Н | М | М | 🞩 | 🞩 | 🞩 | Р | 🞩 | Р | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | М |
|
CrO42− Хромат |
Р | Р | Р | Р | Р | Р | Р | Р | Н
ПР: 1,1 * 10-10 |
— | Н | 🞩 | Р | — | Р | Н | Н
ПР: 2,8 * 10-15 |
М | Н | Н
ПР: 1,1 * 10-12 |
|
Cr2O72− Дихромат |
Р | Р | Р | Р | Р | Р | Р | Р | Р | 🞩 | Р | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | Н
ПР: 1,1 * 10-10 |
|
ReO4− Перренат |
Р | Р | Р | Р | М | 🞩 | 🞩 | 🞩 | Р | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | М |
|
MoO42− Метамолибдат |
Н | Р | Р | Р | Р | 🞩 | Р | Н
ПР: 1,46 * 10-8 |
Н
ПР: 3,54 * 10-8 |
Н | Н | 🞩 | 🞩 | Н | 🞩 | Н | Н | 🞩 | 🞩 | Н
ПР: 2,8 * 10-12 |
|
WO42− Метавольфрамат |
Н | Р | Р | Р | Р | 🞩 | 🞩 | Н | Н | 🞩 | Н | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | Н | 🞩 | 🞩 | Н
ПР: 5,5 * 10-12 |
|
[Fe(CN)6]4− Гексацианоферрат(II) |
Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | 🞩 | — | Н | Н | Н | Н | Н | — | Н |
|
S2O32− Тиосульфат |
— | Р | Р | Р | Р | 🞩 | Р | Р | М | 🞩 | Р | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | Н | Н | — | Н |
|
N3− Азид |
Р | Р | Р | Р | Р | 🞩 | Р | Р | Р | — | 🞩 | 🞩 | 🞩 | 🞩 | Р | Н | Н
ПР: 2,6 * 10-9 |
Н | Н | Н |
|
SeO42− Селенат |
Р | Р | Р | Р | Р | Р | Р | Р | Н
ПР: |
🞩 | Р | 🞩 | 🞩 | 🞩 | 🞩 | Р | Н
ПР: |
🞩 | 🞩 | 🞩 |
|
CN− Цианид |
Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Н
ПР: |
Н
ПР: |
🞩 | Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Р | Н
ПР: 1,4 * 10-16 |
|
[Fe(CN)6]3− Гексацианоферрат(III) |
Р | Р | Р | Р | Р | 🞩 | Р | Р | Р | 🞩 | Н
ПР: |
🞩 | — | Н
ПР: |
Р | Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
|
CNS− Тиоцианат |
Р | Р | Р | Р | Р | Н
ПР: |
Р | Р | Р | Р | Р | Р | 🞩 | Р | Р | Р | М
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
|
VO43− Ортованадат |
🞩 | 🞩 | Р | Р | Р | 🞩 | 🞩 | 🞩 | Н
ПР: |
🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | Н
ПР: |
|
BO2− Метаборат |
Р | Р | Р | Р | Р | 🞩 | М
ПР: |
М
ПР: |
М
ПР: |
Н
ПР: |
Н
ПР: |
🞩 | Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
— | — | М
ПР: |
|
IO3− Иодат |
Р | Р | Р | Р | Р | Р | Р | М
ПР: |
Н
ПР: |
Н
ПР: |
М
ПР: |
🞩 | 🞩 | 🞩 | Н
ПР: |
М
ПР: |
Н
ПР: |
🞩 | Н
ПР: |
Н
ПР: |
|
SiF62− Гексафторосиликат |
Р | Р | Р | М
ПР: |
Н
ПР: |
🞩 | Р | Р | Н
ПР: |
🞩 | Р | 🞩 | 🞩 | Р | 🞩 | Р | Р | 🞩 | 🞩 | Р |
|
C17H35COO− Стеарат |
Н
ПР: |
Р | Н
ПР: |
Р | Р | 🞩 | Н
ПР: |
Н
ПР: |
Р | Н
ПР: |
Н
ПР: |
🞩 | Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
|
C6H5COOH− Бензоат |
М
ПР: |
Р | Р | Р | Р | 🞩 | Р | Р | Р | 🞩 | Р | 🞩 | 🞩 | 🞩 | 🞩 | Н
ПР: |
М
ПР: |
🞩 | М
ПР: |
М
ПР: |
|
[PtCl6]2− Гексахлороплатинат |
Р | М
ПР: |
Р | Р | М
ПР: |
🞩 | 🞩 | 🞩 | Р | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 |
|
AsO33− Арсенит |
🞩 | Р | 🞩 | Р | Р | 🞩 | Н
ПР: |
Н
ПР: |
Н
ПР: |
— | — | 🞩 | Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
|
AsO43− Ортоарсенат |
Р | Р | Н
ПР: |
Р | Р | Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
🞩 | Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Физическая химия
Степан Чичулин
20.02.2021
Таблица растворимости веществ (кислот и солей) по химии
Игорь Борисович Львов
Эксперт по предмету «Химия»
Задать вопрос автору статьи
Таблица растворимости химических элементов — это таблица с растворимостями в воде наиболее известных неорганических кислот, оснований и солей.
Определение 1
В таблице растворимости по химии представлена растворимость при 20 °С, с увеличением температуры растворимость увеличивается.
Вещество растворимо в воде, если его растворимость больше чем 1 г в 100 г воды и нерастворимо, если менее 0,1 г/100 г.
Например, найдя в таблице растворимости по химии литий, можно убедиться, что практически все его соли образуют растворы.
На рис. 1 и рис. 2 представлены фото полной таблицы растворимости по химии с названиями кислотных остатков.
Рисунок 1. Фото таблица растворимости по химии 2018-2019
Сдай на права пока
учишься в ВУЗе
Вся теория в удобном приложении. Выбери инструктора и начни заниматься!
Получить скидку 3 000 ₽
Рисунок 2. Таблица по химии кислотами и кислотными остатками
Чтобы составить название соли, необходимо воспользоваться таблицей Менделеева и растворимости. К названию кислотного остатка прибавляется название металла из таблицы Менделеева, например:
$mathrm{Zn_3(PO_4)_2}$ — фосфат цинка;
$mathrm{FeSO_4}$ — сульфат железа (II) .
В скобках с текстовым названием необходимо указать валентность металла, если их несколько. В случае с железом также существует соль $mathrm{Fe_2(SO_4)_3}$ — сульфат железа (III).
Что можно узнать, используя таблицу растворимости в химии
Таблицу растворимости веществ по химии с осадками используют для определения возможности протекания какой-либо реакции, так как для необратимого протекания реакции необходимо образование осадка или газа.
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме
Дата последнего обновления статьи: 26.11.2022