- Entertainment & Pop Culture
- Geography & Travel
- Health & Medicine
- Lifestyles & Social Issues
- Literature
- Philosophy & Religion
- Politics, Law & Government
- Science
- Sports & Recreation
- Technology
- Visual Arts
- World History
- On This Day in History
- Quizzes
- Podcasts
- Dictionary
- Biographies
- Summaries
- Top Questions
- Infographics
- Demystified
- Lists
- #WTFact
- Companions
- Image Galleries
- Spotlight
- The Forum
- One Good Fact
- Entertainment & Pop Culture
- Geography & Travel
- Health & Medicine
- Lifestyles & Social Issues
- Literature
- Philosophy & Religion
- Politics, Law & Government
- Science
- Sports & Recreation
- Technology
- Visual Arts
- World History
- Britannica Explains
In these videos, Britannica explains a variety of topics and answers frequently asked questions. - Britannica Classics
Check out these retro videos from Encyclopedia Britannica’s archives. - Demystified Videos
In Demystified, Britannica has all the answers to your burning questions. - #WTFact Videos
In #WTFact Britannica shares some of the most bizarre facts we can find. - This Time in History
In these videos, find out what happened this month (or any month!) in history.
- Student Portal
Britannica is the ultimate student resource for key school subjects like history, government, literature, and more. - COVID-19 Portal
While this global health crisis continues to evolve, it can be useful to look to past pandemics to better understand how to respond today. - 100 Women
Britannica celebrates the centennial of the Nineteenth Amendment, highlighting suffragists and history-making politicians. - Saving Earth
Britannica Presents Earth’s To-Do List for the 21st Century. Learn about the major environmental problems facing our planet and what can be done about them! - SpaceNext50
Britannica presents SpaceNext50, From the race to the Moon to space stewardship, we explore a wide range of subjects that feed our curiosity about space!
| Ароматы в физике элементарных частиц |
|---|
| Ароматы |
|
| Чётность |
|
| Квантовые числа |
|
| Заряды |
|
| Комбинации |
|
| См. также |
|
Заря́довое сопряже́ние (С-преобразование) — операция замены частицы на соответствующую античастицу (напр., электрон на позитрон).
Оператор зарядового сопряжения обозначается [math]displaystyle{ hat{C} }[/math]. По определению, [math]displaystyle{ tilde{X} = hat{C} X }[/math], где[math]displaystyle{ X }[/math] волновая функция частицы, [math]displaystyle{ tilde{X} }[/math] — волновая функция античастицы. Оператор зарядового сопряжения [math]displaystyle{ hat{C} }[/math] является эрмитовым, поэтому он описывает некоторую физическую величину. При измерении этой физической величины можно получить лишь одно из собственных значений [math]displaystyle{ eta_{C} }[/math] оператора [math]displaystyle{ hat{C} }[/math]: [math]displaystyle{ hat{C} X = eta_{C} X }[/math]. Квантовое число [math]displaystyle{ eta_{C} }[/math] называется зарядовой четностью[1][2].
Зарядовая чётность
Зарядовая чётность (С-чётность) — одно из квантовых чисел истинно нейтральной частицы (или другой квантовомеханической системы), определяющее поведение её вектора состояний при зарядовом сопряжении. При операции зарядового сопряжения волновая функция такой частицы умножается на значение С-чётности, то есть меняет знак (зарядово нечетная частица) либо остаётся прежней (зарядово чётная частица). С-чётность является мультипликативным квантовым числом.
При сильных, электромагнитных, и, согласно общей теории относительности, гравитационных взаимодействиях[3] выполняется закон сохранения зарядовой чётности, при слабом взаимодействии он нарушается.[4] Это следует уже из первого опыта Ву Цзяньсюн с сотрудниками, доказавшего несохранение пространственной чётности в слабом взаимодействии.
Зарядовая чётность фотона отрицательна: С = −1 (это можно увидеть из того, что при зарядовом сопряжении электрические заряды меняют знак, поэтому и электромагнитные поля, квантами которых являются фотоны, тоже должны изменить знак, чтобы эволюция системы не изменилась). В любых процессах, обусловленных электромагнитным или сильным взаимодействием, зарядовая чётность сохраняется. Вследствие этого, при любых электромагнитных процессах невозможно превращение нечётного числа фотонов в чётное и наоборот (Теорема Фарри).
Зарядовая чётность пиона [math]displaystyle{ pi^{0} }[/math] положительна. Это следует из его распада на два фотона за счёт электромагнитного взаимодействия: [math]displaystyle{ pi^{0} rightarrow gamma + gamma }[/math]. В силу сохранения зарядовой чётности получаем: [math]displaystyle{ eta_{C}(pi^{0}) = eta_{C} (2 gamma) }[/math]. Зарядовая чётность является мультипликативным квантовым числом, поэтому [math]displaystyle{ eta_{C}(pi^{0}) = eta_{C}(gamma) eta_{C} (gamma) = (-1)(-1)= +1 }[/math][1].
| Симметрия в физике | ||
|---|---|---|
| Преобразование | Соответствующая инвариантность |
Соответствующий закон сохранения |
| ↕ Трансляции времени | Однородность времени |
…энергии |
| ⊠ C, P, CP и T-симметрии | Изотропность времени |
…чётности |
| ↔ Трансляции пространства | Однородность пространства |
…импульса |
| ↺ Вращения пространства | Изотропность пространства |
…момента импульса |
| ⇆ Группа Лоренца (бусты) | Относительность Лоренц-ковариантность |
…движения центра масс |
| ~ Калибровочное преобразование | Калибровочная инвариантность | …заряда |
См. также
- Истинно нейтральная частица
Примечания
- ↑ 1,0 1,1 Наумов А. И. Физика атомного ядра и элементарных частиц. — М., Просвещение, 1984. — С. 276-277
- ↑ Ландау Л. Д., Лившиц Е. М. Квантовая механика. — М., Наука, 1972. — с. 306-308
- ↑ В. Паули Нарушение зеркальной симметрии в законах атомной физики // Теоретическая физика 20 века. Памяти Вольфганга Паули. — М., ИЛ, 1962. — c. 383
- ↑ Герштейн С. С. Зарядовое сопряжение // Физика микромира. — М., Советская энциклопедия, 1980. — с. 172
Сопряжения
В этой небольшой статье, будут рассмотрены основные виды сопряжений и Вы узнаете о том, как построить сопряжение углов, прямых линий, окружностей и дуг, окружностей с прямой.
Сопряжением называют плавный переход одной линии в другую. Для того чтобы построить сопряжение, нужно найти центр сопряжения и точки сопряжений.
Точка сопряжения – это общая точка для сопрягаемых линий. Точку сопряжения также называют точкой перехода.
Ниже будут рассмотрены основные типы сопряжений.
Сопряжение углов (Сопряжение пересекающихся прямых)
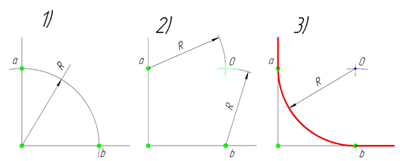
Сопряжение прямого угла(Сопряжение пересекающихся прямых под прямым углом)
В данном примере будет рассмотрено построение сопряжения прямого угла заданным радиусом сопряжения R. Первым делом найдём точки сопряжения. Для нахождения точек сопряжения, нужно поставить циркуль в вершину прямого угла и провести дугу радиусом R до пересечения со сторонами угла. Полученные точки и будут являться точками сопряжения. Далее нужно найти центр сопряжения. Центром сопряжения будет точка равноудалённая от сторон угла. Проведём из точек a и b две дуги радиусом сопряжения R до пересечения друг с другом. Полученная на пересечении точка О и будет центром сопряжения. Теперь из центра сопряжения точки О описываем дугу радиусом сопряжения R от точки a до точки b. Сопряжение прямого угла построено.
Сопряжение острого угла(Сопряжение пересекающихся прямых под острым углом)
Ещё один пример сопряжения угла. В этом примере будет построено сопряжение
острого угла. Для построения сопряжения острого угла раствором циркуля,равным радиусу сопряжения R, проведём из двух произвольных точек на каждой стороне угла по две дуги. Затем проведём касательные к дугам до пересечения в точке О, центре сопряжения. Из полученного центра сопряжения опустим перпендикуляр к каждой из сторон угла. Так мы получим точки сопряжения a и b. Затем проведём из центра сопряжения, точки О, дугу радиусом сопряжения R, соединив точки сопряжения a
и b. Сопряжение острого угла построено.
Сопряжение тупого угла(Сопряжение пересекающихся прямых под тупым углом)
Сопряжение тупого угла строится по аналогии с сопряжением острого угла. Мы также, сначала радиусом сопряжения R проводим по две дуги из двух произвольно взятых точек на каждой из сторон, а затем проводим касательные к этим дугам до пересечения в точке О, центре сопряжения. Затем опускаем перпендикуляры из центра сопряжения к каждой из сторон и соединяем дугой, равной радиусу сопряжения тупого угла R, полученные точки a и b.
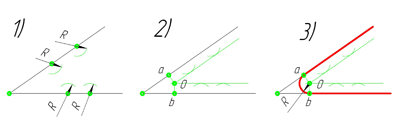
Сопряжение параллельных прямых линий
Построим сопряжение двух параллельных прямых. Нам задана точка сопряжения a, лежащая на одной прямой. Из точки a проведём перпендикуляр до пересечения его с другой прямой в точке b. Точки a и b являются точками сопряжения прямых линий. Проведя из каждой точки дугу, радиусом больш отрезка ab, найдём центр сопряжения — точку О. Из центра сопряжения проведём дугу заданного радиуса сопряжения R.
Сопряжение окружностей(дуг) с прямой линией
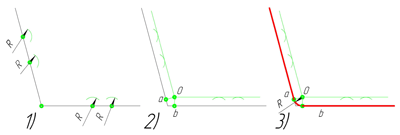
Внешнее сопряжение дуги и прямой линии
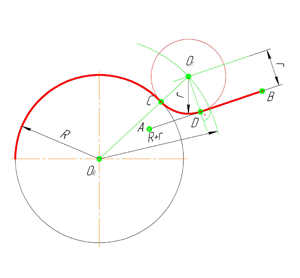
В этом примере будет построено сопряжение заданным радиусом r прямой линии, заданной отрезком AB, и дуги окружности радиусом R.
Сначала найдём центр сопряжения. Для этого проведём прямую, параллельную отрезку AB и отстоящую от него на расстояние радиуса сопряжения r, и дугу, из центра окружности OR радиусом R+r. Точка пересечения дуги и прямой и будет центром сопряжения – точкой Оr.
Из центра сопряжения, точки Оr, опустим перпендикуляр на прямую AB. Точка D, полученная на пересечении перпендикуляра и отрезка AB, и будет точкой сопряжения. Найдём вторую точку сопряжения на дуге окружности. Для этого соединим центр окружности ОR и центр сопряжения Оr линией. Получим вторую точку сопряжения – точку C. Из центра сопряжения проведём дугу сопряжения радиусом r, соединив точки сопряжения.
Внутреннее сопряжение прямой линии с дугой
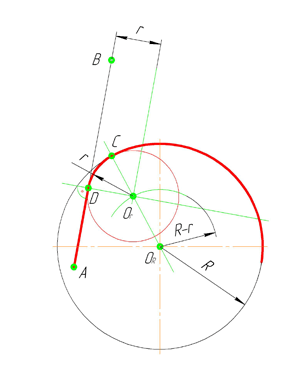
По аналогии строится внутреннее сопряжение прямой линии с дугой. Рассмотрим пример построения сопряжения радиусом r прямой линии, заданной отрезком AB, и дуги окружности радиуса R. Найдём центр сопряжения. Для этого построим прямую, параллельную отрезку AB и отстоящую от него на расстояние радиуса r, и дугу, из центра окружности OR радиусом R-r. Точка Оr, полученная на пересечении прямой и дуги, и будет центром сопряжения.
Из центра сопряжения(точка Оr) опустим перпендикуляр на прямую AB. Точка D, полученная на основании перпендикуляра, и будет точкой сопряжения.
Для нахождения второй точки сопряжения на дуге окружности, соединим центр сопряжения Оr и центр окружности ОR прямой линией. На пересечении линии с дугой окружности получим вторую точку сопряжения – точку C. Из точки Оr, центра сопряжения, проведём дугу радиусом r, соединив точки сопряжения.
Сопряжение окружностей (дуг)
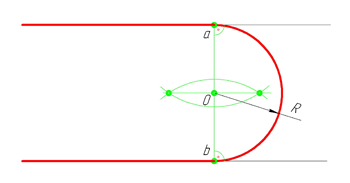
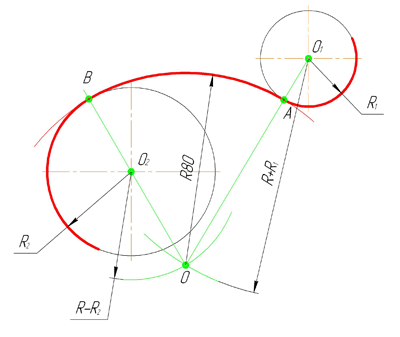
Внешнее сопряжение дуг окружностей
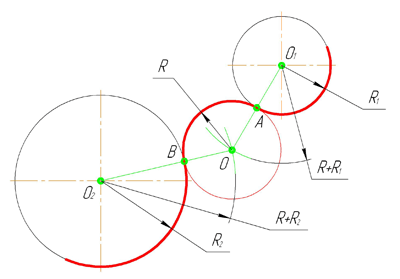
Внешним сопряжением считается сопряжение, при котором центры сопрягаемых окружностей(дуг) O1( радиус R1) и O2 (радиус R2) располагаются за сопрягающей дугой радиуса R. На примере рассмотрено внешнее сопряжение дуг. Сначала находим центр сопряжения. Центром сопряжения является точка пересечения дуг окружностей с радиусами R+R1 и R+R2, построенных из центров окружностей O1(R1) и O2(R2) соответственно. Затем центры окружностей O1 и O2 соединяем прямыми с центром сопряжения, точкой O, и на пересечении линий с окружностями O1 и O2 получаем точки сопряжения A и B. После этого, из центра сопряжения строим дугу заданного радиуса сопряжения R и соединяем ей точки A и B.
Внутреннее сопряжение дуг окружностей
Внутренним сопряжением называется сопряжение, при котором центры сопрягаемых дуг O1, радиуса R1, и O2, радиус R2, располагаются внутри сопрягающей их дуги заданного радиуса R. На картинке ниже приведён пример построения внутреннего сопряжения окружностей(дуг). Вначале мы находим центр сопряжения, которым является точка O, точка пересечения дуг окружностей с радиусами R-R1 и R-R2 проведённых из центров окружностей O1и O2 соответственно. После чего соединяем центры окружностей O1 и O2 прямыми линиями с центром сопряжения и на пересечении линий с окружностями O1 и O2 получаем точки сопряжения A и B. Затем из центра сопряжения строим дугу сопряжения радиуса R и строим сопряжение.
Смешанное сопряжение дуг окружностей
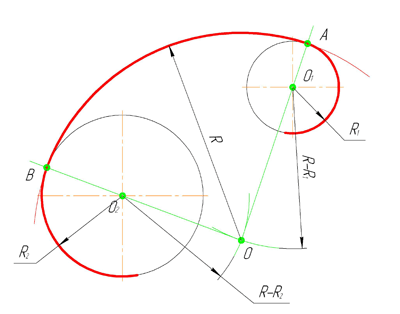
Смешанным сопряжением дуг является сопряжение, при котором центр одной из сопрягаемых дуг (O1) лежит за пределами сопрягающей их дуги радиуса R, а центр другой окружности(O2) – внутри её. На иллюстрации ниже приведён пример смешанного сопряжения окружностей. Сначала находим центр сопряжения, точку O. Для нахождения центра сопряжения строим дуги окружностей с радиусами R+R1, из центра окружности радиуса R1 точки O1, и R-R2, из центра окружности радиуса R2 точки O2. После чего соединяем центр сопряжения точку O с центрами окружностей O1 и O2 прямыми и на пересечении с линиями соответствующих окружностей получаем точки сопряжения A и B. Затем строим сопряжение.
Сопряжение связей
- Сопряжение связей (конъюгация связей, мезомерия, от греч. mesos — средний) — это явление выравнивания связей и зарядов в реальной молекуле по сравнению с несуществующей идеальной структурой этой молекулы. Происходит из-за взаимодействия между собой электронных систем атомов (прежде всего валентных электронов). За счёт сопряжения происходит изменение длины кратных и одинарных связей, что в свою очередь вызывает геометрическое изменение строения молекулы. Главным признаком сопряжения является распределение электронной плотности по всей системе. Системы, в которых происходит сопряжение, называются сопряжёнными системами, которые делятся на открытые и циклические. Чтобы сопряжение произошло, необходимо, чтобы все электронные системы находились в одной плоскости для взаимодействия друг с другом, и для образования плоского σ-скелета. Если этого не происходит из-за структурного строения молекулы, то говорят о пространственных препятствиях сопряжению.
Источник: Википедия
Связанные понятия
Донорно-акцепторное взаимодействие — перенос заряда между молекулами донора и акцептора без образования между ними химической связи (обменный механизм); или передача неподеленной электронной пары от донора к акцептору, приводящая к образованию связи (донорно-акцепторный механизм).
σ-связь (сигма-связь) — ковалентная связь, образующаяся перекрыванием электронных облаков «по осевой линии», соединяющей ядра атомов. Характеризуется осевой симметрией.
Пи-связь (π-связь) — ковалентная связь, образующаяся перекрыванием атомных p-орбиталей. В отличие от сигма-связи, осуществляемой перекрыванием s-орбиталей вдоль линии соединения атомов, пи-связи возникают при перекрывании p-орбиталей по обе стороны от линии соединения атомов. Считается, что пи-связь реализуется в кратных связях — двойная связь состоит из одной сигма- и одной пи-связи, тройная — из одной сигма- и двух ортогональных пи-связей.Концепцию сигма- и пи-связей разработал Лайнус Полинг в…
Длина химической связи — расстояние между ядрами химически связанных атомов. Длина химической связи — важная физическая величина, определяющая геометрические размеры химической связи, её протяжённость в пространстве.
Теория кристаллического поля — квантовохимическая модель, в которой электронная конфигурация соединений переходных металлов описывается как состояние иона либо атома, находящегося в электростатическом поле, создаваемым окружающими его ионами, атомами или молекулами. Концепция кристаллического поля была предложена Беккерелем для описания состояния атомов в кристаллах и затем развита Хансом Бете и Джоном Ван Флеком для описания низших состояний катионов переходных металлов, окруженных лигандами — как…
Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d, f) орбиталей центрального атома многоатомной молекулы с возникновением одинаковых орбиталей, эквивалентных по своим характеристикам.
Мезомерный эффект (эффект сопряжения, резонансный эффект) — смещение электронной плотности химической связи по π-связям. Объясняется теорией химического резонанса.
Индукти́вный эффе́кт (полярный эффект) — смещение электронной плотности химической связи по σ-связям. Является разновидностью эффекта поля.
Автопротолиз — гомофазный процесс самоионизации, обратимый процесс передачи протона от одной нейтральной молекулы жидкости к другой и образования в результате равного числа катионов и анионов.
Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в гомогенных (однородных) системах.
Двойная связь — ковалентная связь двух атомов в молекуле посредством двух общих электронных пар. Строение двойной связи отражено в теории валентных связей. В этой теории считалось, что двойная связь образуется комбинацией сигма- и пи-связей.
Ио́нный ра́диус — характерный размер шарообразных ионов, применяемый для вычисления межатомных расстояний в ионных соединениях. Понятие «ионный радиус» основано на предположении, что размеры ионов не зависят от состава молекул, в которые они входят. На него влияет количество электронных оболочек и плотность упаковки атомов и ионов в кристаллической решётке.
Сингле́тный кислоро́д — общее название для двух метастабильных состояний молекулярного кислорода (O2) с более высокой энергией, чем в основном, триплетном состоянии. Энергетическая разница между самой низкой энергией O2 в синглетном состоянии и наименьшей энергией триплетного состояния составляет около 11400 кельвин (Te (a1Δg ← X3Σg−) = 7918,1 см−1), или 0,98 эВ. Открыт Х. Каутским.
Энергия ионизации — разновидность энергии связи или, как её иногда называют, первый ионизационный потенциал (I1), представляет собой наименьшую энергию, необходимую для удаления электрона от свободного атома в его низшем энергетическом (основном) состоянии на бесконечность.Энергия ионизации является одной из главных характеристик атома, от которой в значительной степени зависят природа и прочность образуемых атомом химических связей. От энергии ионизации атома существенно зависят также восстановительные…
Стереоселективность — преимущественное образование в химической реакции одного стереоизомера над другим. Если образующиеся стереоизомеры являются энантиомерами, то данное явление называется энантиоселективностью, если стереоизомерные продукты являются диастереомерами — диастереоселективностью. Количественно стереоселективность выражается при помощи энантиомерного или диастереомерного избытка.
Теория молекулярных орбиталей (МО) даёт представление о распределении электронной плотности и объясняет свойства молекул.
Двуха́томная моле́кула — молекула, состоящая из двух атомов одного или разных элементов. Если двухатомная молекула состоит из двух атомов того же элемента, например, водород (H2) или азот (N2), тогда она называется гомоядерной. В другом случае, если двухатомная молекула состоит из двух атомов разных элементов, например, монооксид углерода (CO) или оксид азота(II) (NO), то она называется гетероядерной. Атомы двухатомной молекулы связаны при помощи ковалентной связи.
Электронная пара — связанное состояние двух взаимодействующих электронов. Обладает нулевым спином и зарядом, равным удвоенному заряду электрона.
Карбкатион (карбокатион) — частица, в которой на атоме углерода сосредоточен положительный заряд, атом углерода имеет вакантную p-орбиталь. Карбкатион — сильная кислота Льюиса, обладает электрофильной активностью.
Полуреакции — реакции окисления или восстановления компонента окислительно-восстановительной реакции. Полуреакции происходят с учётом изменения степеней окисления отдельных веществ, участвующих в окислительно-восстановительной реакции. Каждая полуреакция характеризуется электродным окислительно-восстановительным потенциалом, величина которого определяет лёгкость передачи электронов.
В электрохимии стандартный электродный потенциал, обозначаемый Eo, E0, или Eθ, является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации в 1 моль/кг и в газах при давлении в 1 атмосферу или 100 кПа (килопаскалей). Объёмы чаще всего взяты при 25 °C. Основой для электрохимической ячейки, такой, как гальваническая ячейка, всегда является окислительно-восстановительная реакция, которая может быть…
Межа́томное взаимоде́йствие — электромагнитное взаимодействие электронов и ядра одного атома с электронами и ядром другого атома. Межатомное взаимодействие зависит от расстояния между атомами и электронных оболочек атомов. Мерой межатомного взаимодействия является энергия взаимодействия атомов. Энергия взаимодействия атомов лежит в широком диапазоне. Энергия межатомного взаимодействия является отчётливо выраженной периодической функцией положительного заряда ядра атома.
Окислительно-восстановительный потенциал (редокс-потенциал от англ. redox — reduction-oxidation reaction, Eh или Eh) — мера способности химического вещества присоединять электроны (восстанавливаться). Окислительно-восстановительный потенциал выражают в милливольтах (мВ). Примером окислительно-восстановительного электрода являются: Pt/Fe3+,Fe2+
Криохимия — раздел химии, который изучает превращения в жидкой и твёрдой фазах при низких (вплоть до 70 К) и сверхнизких (ниже 70 К) температурах. По изучаемым явлениям имеет пересечения с физикой конденсированных сред и астрохимией.
Координационное число (в химии и кристаллографии) — характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле.
Радиус атома — расстояние между атомным ядром и самой дальней из стабильных орбит электронов в электронной оболочке этого атома.
Триоксид диводорода (триоксид водорода, триоксидан) — неорганическое соединение состава H2O3, простейший представитель класса полиоксидов (в т.ч. гидротриоксидов и триоксидов). Может рассматриваться как высший гомолог пероксида водорода H2O2.
Органические дисульфиды — сераорганические соединения общего состава R-S-S-R’, которые содержат в молекулах два атома серы, связанных друг с другом. Дисульфиды могут рассматриваться как органические производные дисульфана H2S2.
Ковалентная связь (от лат. co — «совместно» и vales — «имеющий силу») — химическая связь, образованная перекрытием (обобществлением) пары валентных (находящихся на внешней оболочке атома) электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
Нитроалканы (нитропарафины) — это производные алканов, в молекулах которых один или несколько атомов водорода замещены на нитрогруппу. Относятся к классу нитросоединений.
Пластоцианин — медьсодержащий белок, вовлечённый в транспорт электронов от фотосистемы II к фотосистеме I. Этот мономерный белок, состоящий у большинства сосудистых растений из 99 аминокислот, имеет молекулярную массу около 10,5 кДа. Он является представителем пластоцианинового семейства медьсвязывающих белков.
Гидроксо́ний (оксоний, гидроний) Н3О+ — комплексный ион, соединение протона с молекулой воды.
Карбанион — анион, содержащий чётное число электронов со свободной электронной парой на четырехвалентном атоме углерода. К карбанионам относят как анионы с локализованным на углеродном атоме отрицательном заряде, так и анионы с делокализованным отрицательным зарядом, у которых по крайней мере в одной из канонических структур заряд локализован на атоме углерода…
Когезия (англ. cohesion от лат. cohaesus — «связанный», «сцепленный») — связь между одинаковыми молекулами (атомами, ионами) внутри тела в пределах одной фазы. Когезия характеризует прочность тела и его способность противостоять внешнему воздействию.
Изонитрилы (изоцианиды, карбиламины) — органические соединения общей формулы , изомерны нитрилам R—C≡N. ИЮПАК рекомендует использовать название «изоцианиды». Изонитрилы токсичны и обладают сильным отвратительным запахом, низшие изонитрилы представляют собой жидкости.
Обрати́мые реа́кции — химические реакции, протекающие одновременно в двух противоположных направлениях (прямом и обратном), например…
Правило октета (октетная теория) — предложено Г. Н. Льюисом для объяснения причин образования ковалентных химических связей. Согласно этому правилу при образовании молекул атомы удовлетворяют свою потребность в достижении 8 электронной валентной оболочки, подобной электронной конфигурации благородных газов за счет попарного обобществления своих валентных электронов. По своей важности это фундаментальное открытие Льюиса стоит в одном ряду с такими открытиями, как Периодический закон элементов и теория…
Автокатализ — катализ химической реакции одним из её продуктов или исходных веществ. Одним из наиболее широко известных примеров автокатализа является окисление щавелевой кислоты перманганатом…
Межмолекулярное взаимодействие — взаимодействие между молекулами и/или атомами, не приводящее к образованию ковалентных (химических) связей.
Седиментацио́нный ана́лиз — совокупность методов определения размеров частиц в дисперсных системах и молекулярной массы макромолекул в растворах полимеров по скорости седиментации в условиях седиментационно-диффузного равновесия.
Функциональная группа — структурный фрагмент органической молекулы (некоторая группа атомов), определяющий её химические свойства. Старшая функциональная группа соединения является критерием его отнесения к тому или иному классу органических соединений.
Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания…
Химическая связь — это взаимодействие атомов, обусловливающее устойчивость молекулы или кристалла как целого. Химическая связь определяется взаимодействием между заряженными частицами (ядрами и электронами). Современное описание химической связи проводится на основе квантовой механики…
Самосборка (англ. self-assembly) — процесс образования упорядоченной надмолекулярной структуры или среды, в котором в практически неизменном виде принимают участие только компоненты (элементы) исходной структуры, аддитивно составляющие или «собирающие», как части целого, результирующую сложную структуру.
Автоокисление — процесс окисления органических соединений, самопроизвольно протекающий при их взаимодействии с кислородом воздуха.
Оптически активные вещества — среды, обладающие естественной оптической активностью. Оптическая активность — это способность среды (кристаллов, растворов, паров вещества) вызывать вращение плоскости поляризации проходящего через неё оптического излучения (света). Метод исследования оптической активности — поляриметрия.
В химии валентными электронами называют электроны, находящиеся на внешней (валентной) оболочке атома. Валентные электроны определяют поведение химического элемента в химических реакциях. Чем меньше валентных электронов имеет элемент, тем легче он отдаёт эти электроны (проявляет свойства восстановителя) в реакциях с другими элементами. И наоборот, чем больше валентных электронов содержится в атоме химического элемента, тем легче он приобретает электроны (проявляет свойства окислителя) в химических…
Подробнее: Валентный электрон
Фуллери́т (англ. fullerite) — молекулярные кристаллы, продукты объемной полимеризации сферических углеродных молекул фуллеренов C60 и C70 при давлении более 90 000 атмосфер и температуре более 300 ° C. Полученный материал полностью сохраняет жесткую структуру фуллеренов, которые при полимеризации соединяются между собой прочными алмазоподобными связями. Это приводит к появлению пространственных каркасов, имеющих аномально высокую жесткость и твердость.
Цвиттер-ион (биполярный ион; нем. Zwitter — «гермафродит») — молекула, которая, являясь в целом электронейтральной, в своей структуре имеет части, несущие как отрицательный, так и положительный заряды. Их иногда называют внутримолекулярными солями (например, внутримолекулярные соли аминокислот) и, иногда, (ошибочно) ионными диполярными соединениями. Некоторые химики относят к цвиттер-ионам лишь соединения с зарядами на несоседних атомах, поскольку существуют также соединения с зарядами на соседних…
Поля́рные вещества́ в химии — соединения, молекулы которых обладают электрическим дипольным моментом. Для полярных веществ, в сравнении с неполярными, характерны высокая диэлектрическая проницаемость (более 10 в жидкой фазе), повышенные температура кипения и температура плавления.
Что мы делаем. Каждая страница проходит через несколько сотен совершенствующих техник. Совершенно та же Википедия. Только лучше.
Сопряжение связей
Из Википедии — свободной энциклопедии
Сопряжение связей (конъюгация связей, мезомерия, от греч. mesos — средний) — это явление выравнивания связей и зарядов в реальной молекуле по сравнению с несуществующей идеальной структурой этой молекулы. Происходит из-за взаимодействия между собой электронных систем атомов (прежде всего валентных электронов). За счёт сопряжения происходит изменение длины кратных и одинарных связей, что в свою очередь вызывает геометрическое изменение строения молекулы.[1] Главным признаком сопряжения является распределение электронной плотности по всей системе.[2] Системы, в которых происходит сопряжение, называются сопряжёнными системами, которые делятся на открытые и циклические. Чтобы сопряжение произошло, необходимо, чтобы все электронные системы находились в одной плоскости для взаимодействия друг с другом, и для образования плоского σ-скелета. Если этого не происходит из-за структурного строения молекулы, то говорят о пространственных препятствиях сопряжению.[2]
Классификация
Сопряжение может быть двух видов: 


Сопряжение в открытых системах
— Сопряжение — происходит в молекуле, в составе которой есть несколько кратных связей (как минимум две), которые чередуются между собой одинарными связями. В таких соединениях все атомы углерода находятся в
— гибридизации и каждый из них несёт одну негибридную p-орбиталь. При этом происходит боковое перекрытие орбиталей у каждого атома углерода. За счёт наличия одинарных связей между двойными, образуется единая
-система, охватывающая всю молекулу — делокализованная ковалентная связь. Если в системе есть гетероатом (атом кислорода, серы, азота или галогенов, имеющий неподелённую электронную пару), то для формирования единой
-системы он вносит свой p-электрон. Сопряжение приводит к выравниванию длин связей: двойные связи удлиняются, одинарные укорачиваются.
,
-cопряжение — происходит при наличии рядом с
— связью любого атома, у которого есть негибридизированная p-орбиталь (винилметиловый эфир, ацетамид, ацетат-ион, аллил-катион, аллил-радикал и т. д.). Наибольшее значение имеют соединения с гетероатомом, то есть соединения, имеющие в своём составе структурный фрагмент:
, где X — гетероатом. Из-за того, что атомы углерода при двойной связи и атом, имеющий неподелённую электронную пару, находятся в
— гибридизации, три негибридные p-орбитали перекрываются между собой. Образуется трёхцентровая делокализованная ковалентная связь.
Сопряжение в замкнутых системах
Среди циклических соединений, относящихся к группе ароматических, также встречаются оба вида сопряжения.
Наглядным примером является бензол, так как его атомно-орбитальная модель наиболее чётко проявляет особенности электронного строения ароматических углеводородов. Он состоит из шести 


- Для шестичленных гетероциклов с одним или несколькими гетероатомами характерно
-cопряжение. Простейшим представителем является пиридин, в котором атом азота находится в
-гибридизации и отдаёт в ароматический секстет один p-электрон. Такой атом азота называют пиридиновым. Системы, имеющие в своём составе пиридиновый атом азота, называются
—недостаточными, так как из-за большей электроотрицательности азота, чем у углерода, первый оттягивает на себя электронную плотность атомов углерода во всём ароматическом кольце. Также примером
—недостаточной системы является пиримидин, в составе которого два пиридиновых атома азота.
- Для пятичленных гетероциклов, с атомами азота, кислорода, серы, характерно
,
-cопряжение. Примером служит пиррол — гетероцикл с атомом азота, который включает в ароматический секстет пару электронов от негибридизированной p-орбитали. При этом три электрона на
-гибридных орбиталях образуют три σ-связи. Имеющий такое электронное состояние атом азота называется пиррольным. Из-за того, что шестиэлектронное облако делокализовано на пяти атомах цикла, пиррол представляет собой
—избыточную систему. Также к представителям
,
-cопряжения относят фуран и тиофен, так как они тоже являются
—избыточными системами. В их ароматические секстеты также включены p-электроны с негибридизированных p-орбиталей от атома кислорода (фуран) и серы (тиофен).
Небольшим исключением является имидазол. В его составе есть пиррольный атом азота, который поставляет пару 


Гетероциклические ароматические соединения имеют очень большую термодинамическую устойчивость. Они играют роль «структурных единиц» в нуклеиновых кислотах.
Устойчивость сопряжённых систем
Для органических соединений образование сопряжённой системы является энергетически выгодным процессом, так как из-за этого увеличивается степень перекрытия орбиталей, что в свою очередь приводит к делокализации p-электронов. По этой причине, сопряжённые системы имеют более низкий энергетический уровень, в отличие от несопряжённых, что обуславливает их повышенную термодинамическую устойчивость. При увеличении длины сопряжённой цепи возрастает энергия сопряжения, что, в свою очередь, приводит к увеличению термодинамической устойчивости соединения.
Примечания
- ↑ Химическая энциклопедия, 1995, с. 387–388.
- ↑ 1 2 Большая советская энциклопедия.
Литература
- Тюкавкина Н. А., Бауков Ю. И. Биоорганическая химия: учебник для вузов. — 6-ое издание, стереотипное. — Москва: Дрофа, 2007. — 542 с. — ISBN 978-5-358-03464-8.
- Базилевский М. В. Метод молекулярных орбит и реакционная способность органических молекул // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров. — М.: Большая Российская энциклопедия, 1995. — Т. 4: Полимерные — Трипсин. — С. 387—388. — 639 с. — 40 000 экз. — ISBN 5-85270-039-8.
- Сопряжение связей // Большая советская энциклопедия. — М. : Советская энциклопедия, 1969—1978. — (Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров ; 1969—1978).
Эта страница в последний раз была отредактирована 4 апреля 2023 в 12:09.
Как только страница обновилась в Википедии она обновляется в Вики 2.
Обычно почти сразу, изредка в течении часа.