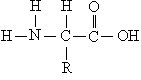Что такое белок. Химический состав и образование белков
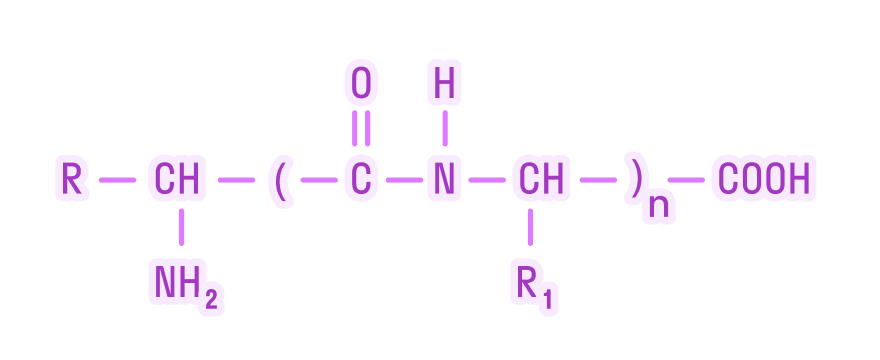
Белки — это высокомолекулярные органические соединения, которые состоят из аминокислотных остатков, соединенных между собой пептидной связью. Важно уточнить, что в состав белков входит только 20 альфа-аминокислот, тогда как всего ученым известно около 500 аминокислот. Общая формула белков выглядит следующим образом:
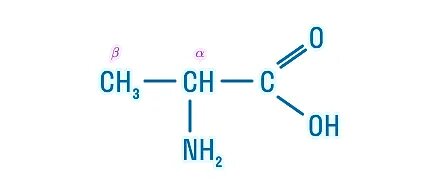
Греческая приставка «альфа-» в названиях альфа-аминокислот взялась из систематической номенклатуры. По ее правилам, следующий после карбоксильной группы углерод получает название первой буквы греческого алфавита — альфа, затем идет буква бета и так далее. В названии аминокислоты указывается греческая буква того углерода, у которого есть заместитель, в данном случае — аминогруппа.
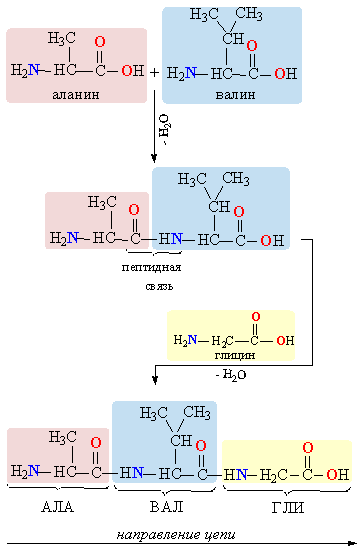
Рассмотрим пример образования молекулы белка. Для этого познакомимся сначала с представителем альфа-аминокислот — альфа-аминопропановой кислотой.
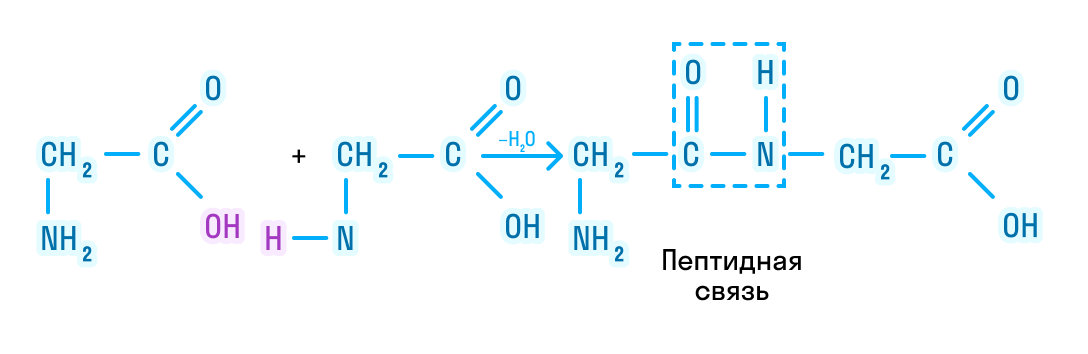
Рассматривая строение молекулы, можно увидеть две конкурирующие по свойствам группы: карбоксильную, которая отвечает за кислотные свойства, и аминогруппу, которая отвечает за оснóвные свойства. Две молекулы аминокислот и более могут вступать в реакцию между собой, реагируя по разным функциональным группам. Именно таким образом получается пептид:
Соединение, которое образуется в результате взаимодействия двух аминокислот, называется дипептидом. Благодаря наличию двух свободных функциональных групп (карбоксильной и аминогруппы) дипептид может взаимодействовать с другими аминокислотами, увеличивая свое строение и превращаясь в полипептид.
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Полезные подарки для родителей
В колесе фортуны — гарантированные призы, которые помогут наладить учебный процесс и выстроить отношения с ребёнком!
Аминокислоты и их значение для человеческого организма
Говоря об аминокислотах, важно рассмотреть понятие незаменимости. Основной критерий определения биологической ценности аминокислоты — это способность поддерживать рост человека, что, в свою очередь, связано с синтезом белка в живом организме.
Незаменимые аминокислоты — это такие кислоты, которые либо не синтезируются в организме, либо синтезируются со скоростью, недостаточной для обмена веществ и образования новых клеток и тканей.
Если исключить из рациона хотя бы одну из незаменимых аминокислот, это повлечет за собой задержку роста и снижение массы тела растущего организма.
К незаменимым аминокислотам относятся валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин.
Заменимые аминокислоты — это те, которые организм может синтезировать самостоятельно или получить с продуктами питания. К ним относятся:
Давайте рассмотрим основные функции некоторых аминокислот в организме человека, чтобы лучше понять их значение:
-
аспартат используется для процессов регенерации;
-
гистидин необходим маленьким детям, у которых недостаточен эндогенный синтез;
-
глютамин нужен для регенерационных процессов, важный энергетический субстрат в критических состояниях;
-
таурин нужен новорожденным, у которых недостаточен эндогенный синтез, а также больным в критических состояниях. Дефицит таурина возникает при недостатке метионина и цистеина;
-
тирозин необходим маленьким детям, у которых недостаточен эндогенный синтез. При нарушении функции почек снижено образование тирозина из фенилаланина;
-
цистеин необходим маленьким детям, у которых недостаточен эндогенный синтез. Дефицит цистеина возникает при недостаточном содержании метионина в питании. Необходим при нарушениях функции печени, а также больным в критических состояниях.
Пептиды
Вернемся к продукту синтеза двух аминокислот — пептиду — и дадим ему определение.
Пептид — это продукт конденсации двух аминокислот или более, соединенных пептидной связью.
Пептид и белок — это одно и то же? Между ними действительно есть сходство, но есть и различия:
-
Основные различия — это структура и размер. Белки значительно больше пептидов. Пептиды состоят из 2–50 аминокислот, а белки — из более чем 50 аминокислот.
-
Пептиды менее строго определены в структуре, в то время как белки могут принимать сложные конформации.
-
Пептиды делятся на олигопептиды и полипептиды, а белок состоит из нескольких полипептидов.
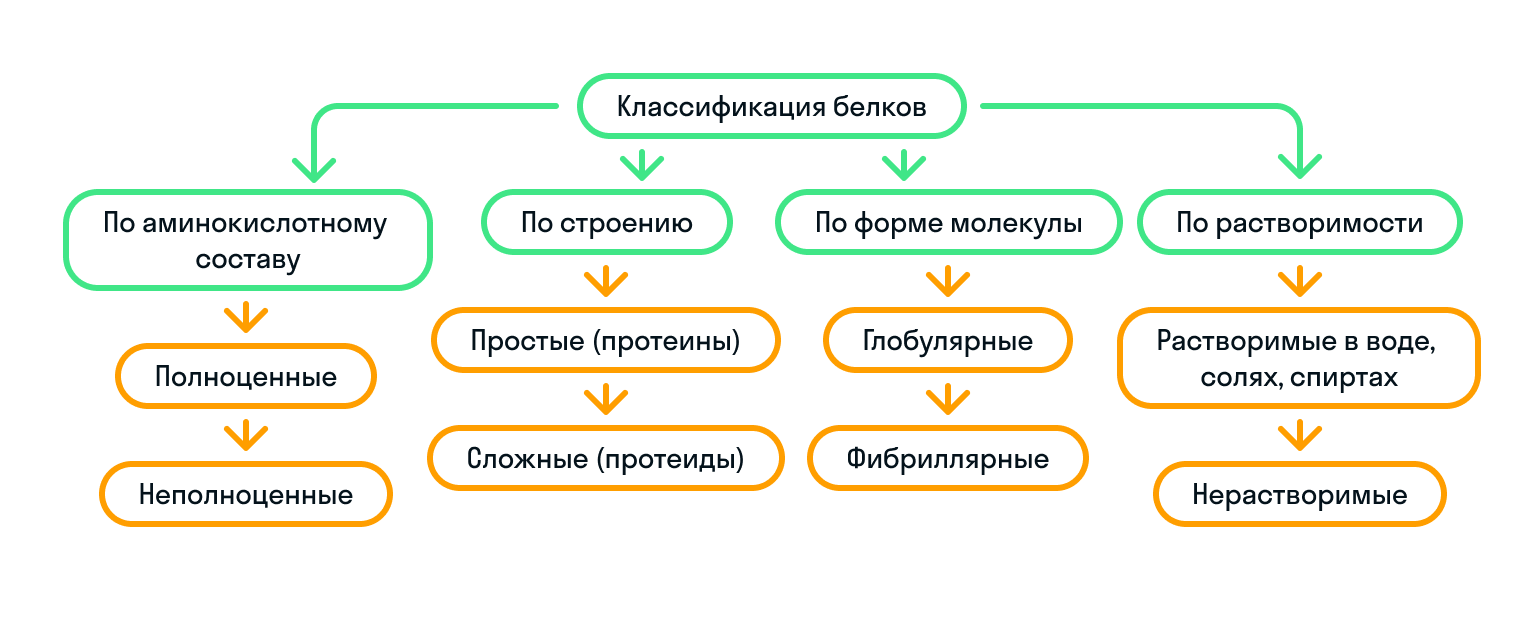
Какие бывают белки
По строению
По строению белки делятся на простые (протеины) и сложные (протеиды):
-
составными частями простых белков являются в большинстве 20 различных остатков α–аминокислот;
-
сложные белки могут содержать ионы металлов или образовывать комплексные соединения с углеводами, липидами и др.
По форме молекулы
По форме молекулы белки подразделяются на глобулярные и фибриллярные:
-
форма молекулы глобулярных белков — глобула (сфера или эллипс). Например, альбумин (яичный белок), казеин (молочный белок). Такие белки растворимы в воде;
-
форма молекулы фибриллярных белков — фибрилла (нити или волокна). Например, кератин (волосы, ногти, перья), коллаген (мускулы, сухожилия). Эти белки в воде не растворяются.
По аминокислотному составу
Как мы уже знаем, существуют незаменимые аминокислоты. Так вот, исходя из их наличия, белки бывают либо полноценные, либо неполноценные:
-
к полноценным относятся белки животного происхождения, также полноценные белки содержат некоторые растения: картофель, бобовые и другие;
-
к неполноценным относятся желатин и белки преимущественно растительного происхождения.
По растворимости
Растворимость белков зависит от их структуры, величины рН, солевого состава раствора, температуры и определяется природой тех групп, которые находятся на поверхности белковой молекулы.
Так, существуют белки (глобулины), которые растворяются только в растворах солей и не растворяются в чистой воде, а противоположные им альбумины хорошо растворимы в чистой воде.
К нерастворимым белкам относятся кератин (волосы, ногти, перья), коллаген (сухожилия), фиброин (шелк, паутина).
Чтобы запомнить классификацию белков было проще, показали ее на картинке:
Структура белков
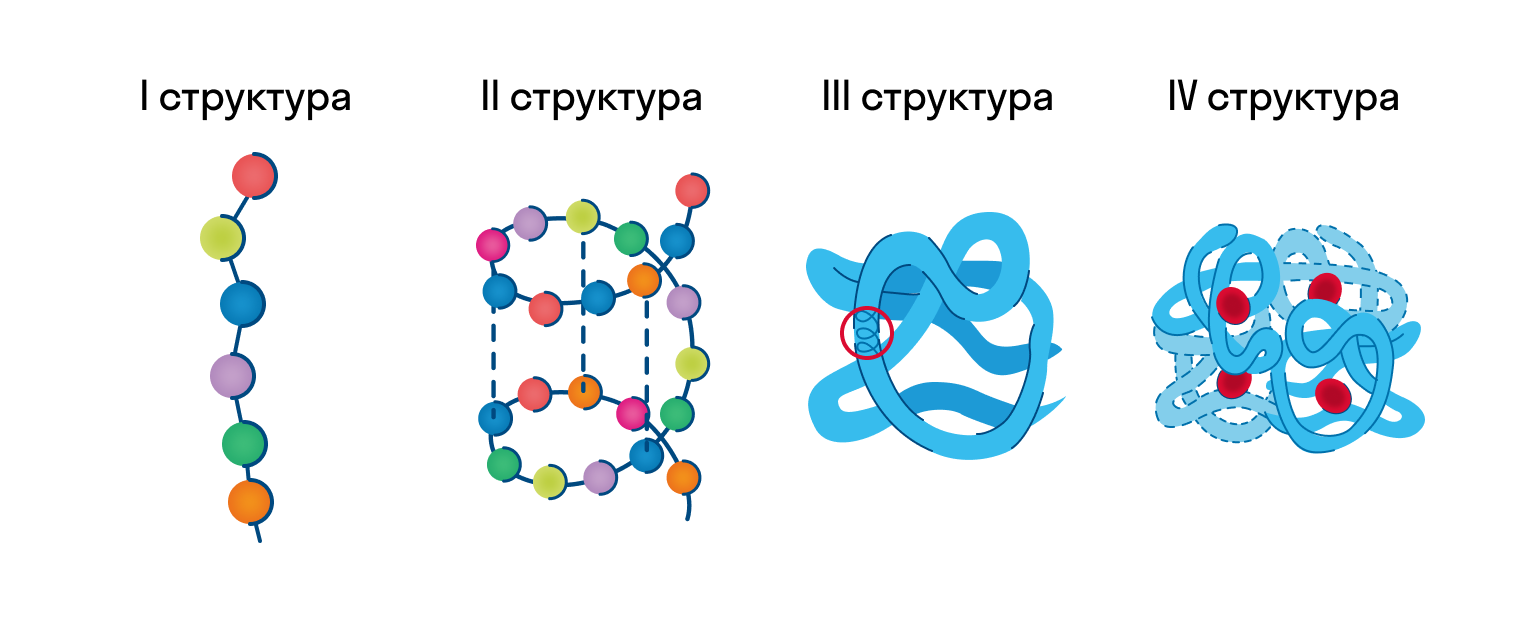
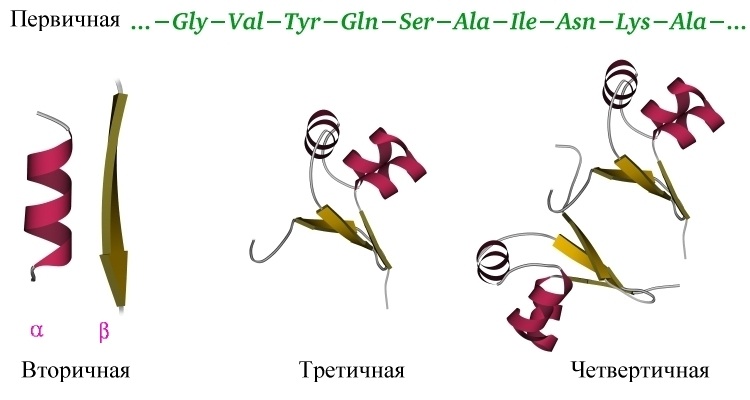
После того как мы рассмотрели все производные белков, пора переходить к структуре белков.
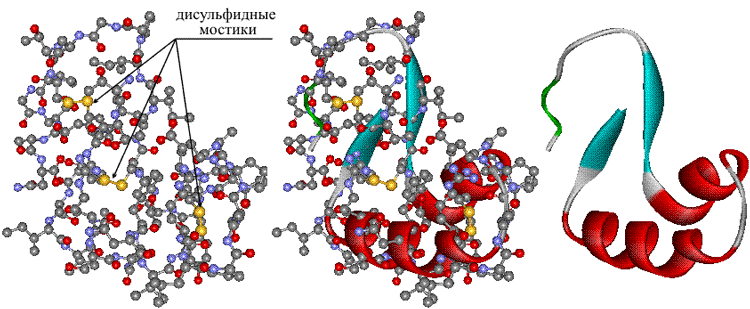
Как видно из рисунка, белки имеют 4 структуры: первичную, вторичную, третичную и четвертичную. Рассмотрим каждую чуть более подробно.
-
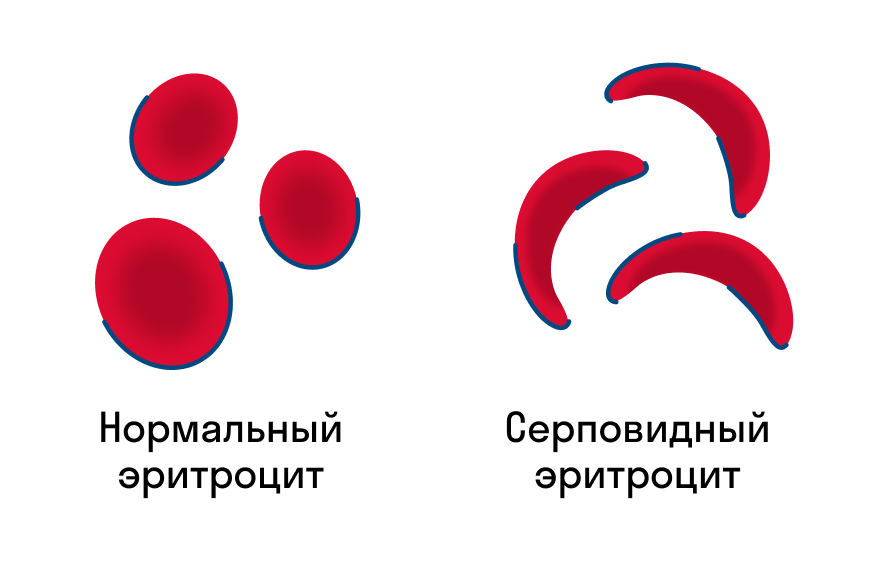
Первичная структура белка — это простейший вид белковой структуры. Представляет собой последовательность аминокислот в полипептидной цепи. Последовательность аминокислот в белке определяется ДНК, а именно геном, кодирующим этот белок. Изменение всего лишь одной аминокислоты влечет за собой последствия: например, если вместо глутаминовой кислоты в молекуле гемоглобина находится валин, то у человека образуется серповидноклеточная анемия. При замене глутаминовой кислоты на валин клетки гемоглобина вытягиваются и принимают форму месяца или серпа.
-
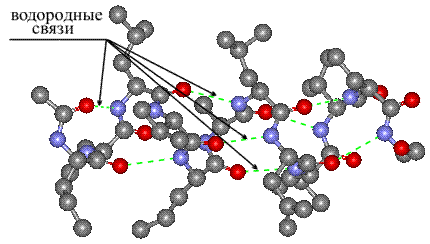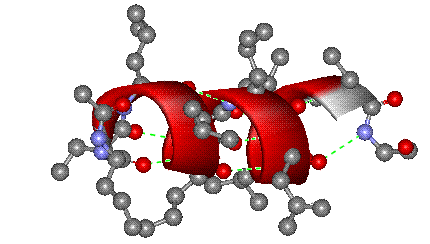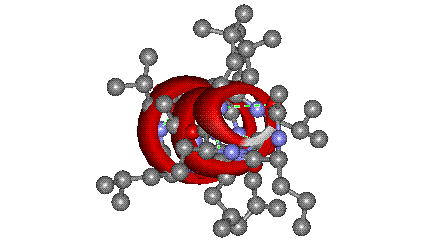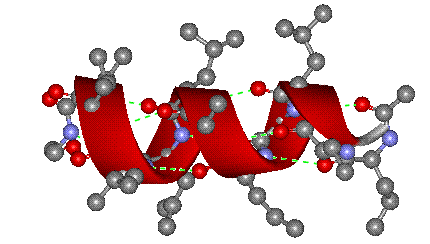
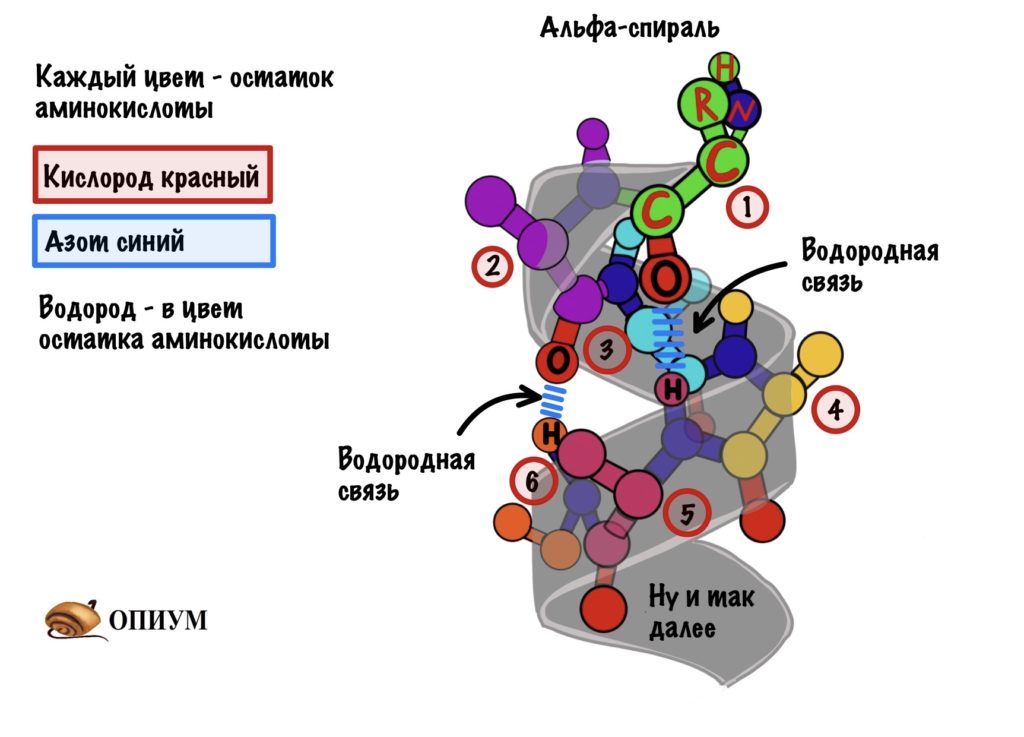
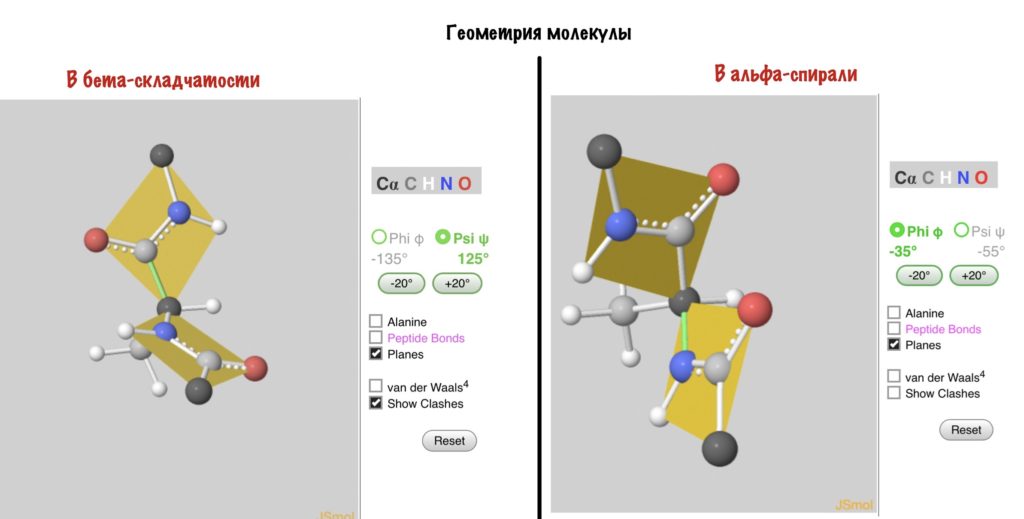
Вторичная структура — пространственная структура, которая образуется в результате взаимодействия функциональных групп пептидного остова (полипептидная цепь без атомов R-групп). Самые распространенные формы вторичной структуры — это α-спираль и β-лист. Обе структуры удерживают форму благодаря водородным связям между кислородом карбонильной группы одной аминокислоты и водородом аминогруппы другой аминокислоты.
-
Третичная структура — это пространственное строение всей молекулы белка, состоящей из единственной цепи. Эта структура обусловлена взаимодействиями между R-группами аминокислот, которые входят в состав белка. Среди взаимодействий между R-группами, формирующими третичную структуру, встречаются водородные, ионные и диполь-дипольные связи, а также дисперсионные силы.
-
Четвертичная структура — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса.
Подробнее об основных функциях белков и их химических свойствах можно узнать из другой нашей статьи. А чтобы убедиться, что вы запомнили характеристику белков, их строение, структуру и функции, приходите на онлайн-курсы химии в школу Skysmart. Здесь вас ждут интересные факты из мира химии, интерактивные задания и опытные преподаватели, которые всегда помогут и поддержат.
Структура белка: введение для айтишников
Время на прочтение
17 мин
Количество просмотров 153K
Приятно видеть, что хабравчане регулярно интересуется другими предметными областями – например, биологией (более конкретно – структурой и функцией биологических макромолекул). Однако некоторые посты (например, этот), вызывают у специалиста просто физическую боль из-за обилия совершенно диких фактологических ошибок. В этом посте мне хочется рассказать о структуре и функции белка. О том, что мы знаем и о том, чего не знаем, а так же об имеющихся в этой области вычислительных задачах, требующих решения и интересных IT-специалистам. Постараюсь рассказывать сжато и тезисно, чтобы информации было больше, а воды – меньше. Всех, интересующихся структурой белков, прошу под кат, там очень много букв.
1. Почему белки важны?
Как сказал Фридрих Энгельс, “Жизнь есть способ существования белковых тел”. В 19 веке еще не знали о роли ДНК в наследовании генетической информации, но утверждение дяди Фридриха в значительной мере справедливо до сих пор – основную работу в наших клетках совершают именно белки. Это и поддержание структуры (формы клеток), и химический катализ, и моторная функция (сокращение мышц, например), и транспорт (скажем, белок гемоглобин переносит кислород из легких в ткани и углекислый газ в обратном направлении) и сложные регуляторные функции по поддержанию постоянства внутренней среды (скажем, белковые гормоны и всякие внутриклеточные регуляторные системы) и многие другие. Словом, если в нашем организме что-то происходит, в это обязательно вовлечены белки (хотя и не только они).
2. Что такое белок?
С химической точки зрения белок – это линейный (неветвящийся) полимер, состоящий из монотонно повторяющихся одинаковых блоков «основной цепи», к которым приделаны различные «боковые группы». Так как блоки основной цепи несимметричны, вся полипептидная цепь белка имеет направление, различают N- и C-конец полипептидной цепи.
Длина цепи – от 70 до более чем 1000 мономеров (аминокислотных остатков), средняя длина для высших организмов – примерно 500-600 аминокислотных остатков, для бактерий эта величина будет меньше, скорее 300-400 остатков. Всего в природе существует 20 стандартных аминокислот, одинаковых и для бактерии и для человека, то есть из основной цепи могут торчать 20 разных боковых групп.
(Тут возможна поправка – некоторые химические группы могут быть модифицированны после синтеза белка, например, фосфорилированы. Однако это не рассматривается как другая аминокислота, а рассматривается как продукт модификации исходной. Так же у высших организмов возможно встраивание двух неканонических аминокислот, но это редкое событие. То есть, строго говоря, разных аминокислот 22, из них 20 основных и 2 редкие, плюс некоторые боковые группы могут быть изредка химически модифицированы).
Из поколения в поколение генетическая информация передается в виде ДНК, в ней есть так называемые «белок-кодирующие области». В этих местах ДНК однозначным образом (для ботанов – с точностью до альтернативного сплайсинга и редактирования РНК) закодирована информация о линейной последовательности аминокислот для синтеза данного белка, плюс в клетке есть соответствующие машины, способные синтезировать белок по информации, изначально закодированной в ДНК.
Так как белок – линейный полимер, собранный из 20 стандартных мономеров, его так называемую «первичную структуру» легко представить в виде строки, например так:
>small ubiquitin-related modifier 3 precursor [Homo sapiens] MSEEKPKEGVKTENDHINLKVAGQDGSVVQFKIKRHTPLSKLMKAYCERQG LSMRQIRFRFDGQPINETDTPAQLEMEDEDTIDVFQQQTGGVPESSLAGHSF
Это аминокислотная последовательность маленького человеческого белка в формате FASTA, первая строчка, начинающаяся с «>», описывает его название, после чего следует последовательность аминокислот в соответствии со стандартной кодировкой (например, М –метиони, S – серин и тд, всего 20 букв стандартного однобуквенного кода), слева – N-конец белка, справа – его С-конец. Для разных белков длина строки будет очевидно разной, так как белки имеют разную длину. Последовательности всех известных белков можно найти в открытом доступе здесь: www.ncbi.nlm.nih.gov
3. Структура белка
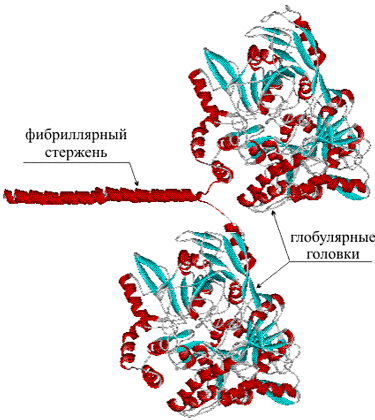
Хорошо, с первичной структурой разобрались, но разве белок работает в развернутом линейном виде? Конечно нет. Тут надо заметить, что со структурной точки зрения есть разные классы белков: глобулярные, мембранные и фибриллярные. Мембранные белки, как следует из названия, живут только в клеточных мембранах, для стабилизации их структуры нужно особое окружение мембраны, мы не будем их рассматривать в этом обзоре. Фибриллярные белки имеют простое регулярное строение, похожи на вытянутые волокна, они не растворимы в воде и выполняют структурные функции (например, из кератина состоят волосы, к фибриллярным белкам относится белок из натурального шёлка). Недавно стали выделять класс разупорядоченных белков – белков, не обладающих постоянной трехмерной структурой, либо приобретающих ее только на короткое время при взаимодействии с другими белками. Наиболее интересный с практической точки зрения класс белков, который мы и будем рассматривать – глобулярные водорастворимые белки, к этому классу относится большинство белков.
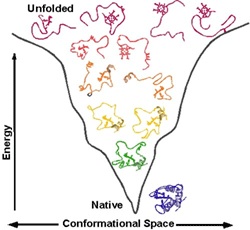
Линейная полипептидная цепь в воде способна самопроизвольно сворачиваться в сложную трехмерную структуру (глобулу) и только в таком свернутом виде белки могут выполнять химический катализ и прочую интересную работу. Поэтому нам принципиально важно знать именно трехмерную укладку белка, так как только на этом уровне становится понятно, как белок работает.
Вопрос: сколько трехмерных структур соответствует конкретному белку?
Ответ: Одна, с точностью до небольшой подвижности маленьких «разупорядоченных» петель. Известно ровно одно исключение, когда одной последовательности соответствуют 2 достаточно разные структуры, это прионы.
Вопрос: Почему у белка только одна трехмерная структура?
Ответ: для химического катализа нам нужно расположить соответствующие химические группы строго определенным образом в пространстве. Для этого нужна жесткая структура. То есть весь белок должен быть жестким, чтобы поддерживать химические группы аминокислот активного центра в нужных местах (в реальности многие белки состоят из двух и более жестких частей, которые могут двигаться друг относительно друга, это нужно для регуляции активности белка (аллостерическая регуляция), чтобы некий сигнал мог включать и выключать химическую активность белка-фермента). Чтобы структура была жесткой и стабильной, природа позаботилась о том, чтобы структура каждого белка соответствовала энергетическому минимуму данной системы атомов и этот минимум был настолько глубоким, чтобы белок из него не «выпрыгнул». Все другие, паразитные структуры, обладают большей энергией и белок все равно сваливается в энергетический минимум, соответствующий нативной структуре.
Вопрос: на чем держится трехмерная структура белка?
Ответ: если коротко, то в основном на большом количестве нековалентных взаимодействий. В принципе, химические группы белка могут образовывать: (1) водородную связь, эти группы есть и в основной цепи и у некоторых боковых групп, (2) ионную связь – электростатическое взаимодействие между разноименно заряженными боковыми группами, (3) Ван-дер-Ваальсово взаимодействие и (4) гидрофобный эффект, на котором держится общая структура белка. Суть в том, что в белке всегда есть гидрофобные ароматические остатки, им энергетически невыгодно контактировать с полярными молекулами воды, а выгодно «слипнуться» друг с другом. Таким образом, при сворачивании белка гидрофобные группы выталкиваются из водного окружения, «слипаясь» друг с другом и формируя «гидрофобное ядро», а полярные и заряженные группы, наоборот, стремятся в водное окружение, формируя поверхность белковой глобулы. Так же (5) боковые группы двух остатков цистеина могут образовать между собой дисульфидный мостик – полноценную ковалентную связь, жестко фиксирующую белок.
Соответственно, все аминокислоты делятся на гидрофобные, полярные (гидрофильные), положительно и отрицательно заряженные. Плюс цистеины, способные образовывать ковалентную связь между собой. Особыми свойствами обладают глицин – у него отсутствует боковая группа, сильно ограничивающая конформационную подвижность других остатков, поэтому он может очень сильно «гнуться» и находится в местах, где белковую цепь надо развернуть. У пролина же, наоборот, боковая группа образует кольцо, ковалентно связанное с основной цепью, жестко фиксируя ее конформацию. Пролины встречаются там, где надо сделать белковую цепь жесткой и негнущейся. Многие заболевания связаны с мутацией пролина на глицин, из-за чего структура белка слегка «плывет».
Вопрос: откуда вообще мы знаем о трехмерных структурах белка?
Ответ: из эксперимента, это абсолютно надежные данные.
Сейчас есть 3 метода для экспериментального определения структуры белка: ядерно-магнитный резонанс (ЯМР), cryo-EM (электронная микроскопия) и рентгеноструктурный анализ кристаллов белка.
ЯМР позволяет определить структуру белка в растворе, но он работает только для очень маленьких белков (для больших невозможно сделать деконволюцию).

Этот метод был важен для общего доказательства того, что у белка только одна трехмерная структура и что структура белка в кристалле идентична структуре в растворе. Это очень дорогой метод, так как требуется получить белок с изотопными метками.
Cryo-EM заключается в простой заморозке раствора белка и микроскопии. Минус метода – низкое разрешение (видна лишь общая форма молекулы, но не видно, как она устроена внутри), плюс плотность белка близка к плотности воды/растворителя, поэтому сигнал тонет в высоком уровне шума. В этом методе активно применяются компьютерные технологии работы с картинками и статистика для вытягивания сигнала из шума.

Отбираются миллионы картинок молекул белка, проводится разделение на классы в зависимости от ориентации молекулы относительно подложки, усреднение по классам, генерация eigenimages, новый раунд усреднения и так пока не сойдется. Потом из информации из разных классов можно восстановить трехмерный вид молекулы с низким разрешением. Если же есть внутренняя симметрия частиц (например, при cryo-EM анализе вирусов), то можно еще каждую частицу поусреднять в соответствии с операторами симметрии – тогда разрешение будет еще лучше, но хуже, чем в случае рентгеноструктурного анализа.
Рентгеноструктурный анализ – основной способ определения структур белка. Главный плюс – потенциально можно получить кристаллы даже очень больших комплексов из многих десятков белков (например, именно так была определена структура рибосомы – Нобелевская премия 2009 года). Минус метода – вначале нужно получить кристалл белка, но далеко не каждый белок хочет кристаллизоваться.
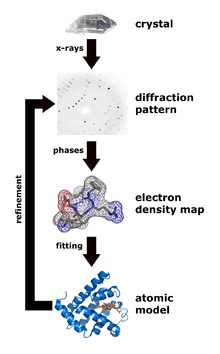
Зато после того, как кристалл получен, по дифракции рентгеновского излучения можно однозначно определить положения всех (упорядоченных) атомов в молекуле белка, этот метод дает самое высокое разрешение и позволяет в лучших случаях видеть позиции отдельных атомов. Было доказано, что структура белка в кристалле однозначно соответствует структуре в растворе.
Сейчас действует конвенция – если ты определил структуру белка любым из экспериментальных физических методов, структура должна быть помещена в открытый доступ в банк данных белковых структур (Protein Data Bank – PDB, www.pdb.org ), в настоящее время там находится более 90 000 структур (впрочем, многие из них повторяющиеся, например, комплексы одного и того же белка с разными малыми молекулами, такими, как лекарственные средства). В PDB все структуры лежат в стандартном формате, называющемся, внезапно, pdb. Это текстовый формат, в котором каждому атому структуры соответствует одна строчка, в которой указан номер атома в структуре, название атома (углерод, азот и тд), название аминокислоты, в которую входит атом, название цепи белка (A, B, C и тд, если это кристалл комплекса из нескольких белков), номер аминокислоты в цепи и трехмерные координаты атома в ангстремах относительно ориджина, плюс так называемые температурный фактор и заселённость (это сугубо кристаллографические параметры).
ATOM 1 N HIS A 17 -12.690 8.753 5.446 1.00 29.32 N ATOM 2 CA HIS A 17 -11.570 8.953 6.350 1.00 21.61 C ATOM 3 C HIS A 17 -10.274 8.970 5.544 1.00 22.01 C ATOM 4 O HIS A 17 -10.193 8.315 4.491 1.00 29.95 O ATOM 5 CB HIS A 17 -11.462 7.820 7.380 1.00 23.64 C ATOM 6 CG HIS A 17 -12.551 7.811 8.421 1.00 21.18 C ATOM 7 ND1 HIS A 17 -13.731 7.137 8.194 1.00 28.94 N ATOM 8 CD2 HIS A 17 -12.634 8.384 9.644 1.00 21.69 C ATOM 9 CE1 HIS A 17 -14.492 7.301 9.267 1.00 27.01 C ATOM 10 NE2 HIS A 17 -13.869 8.058 10.168 1.00 22.66 N ATOM 11 N ILE A 18 -9.269 9.660 6.089 1.00 19.45 N ATOM 12 CA ILE A 18 -7.910 9.377 5.605 1.00 18.67 C ATOM 13 C ILE A 18 -7.122 8.759 6.749 1.00 16.24 C ATOM 14 O ILE A 18 -7.425 8.919 7.929 1.00 18.80 O ATOM 15 CB ILE A 18 -7.228 10.640 5.088 1.00 20.22 C ATOM 16 CG1 ILE A 18 -7.062 11.686 6.183 1.00 18.52 C ATOM 17 CG2 ILE A 18 -7.981 11.176 3.889 1.00 24.61 C ATOM 18 CD1 ILE A 18 -6.161 12.824 5.749 1.00 28.21 C ATOM 19 N ASN A 19 -6.121 8.023 6.349 1.00 15.46 N ATOM 20 CA ASN A 19 -5.239 7.306 7.243 1.00 14.34 C ATOM 21 C ASN A 19 -4.012 8.178 7.507 1.00 14.83 C ATOM 22 O ASN A 19 -3.431 8.715 6.575 1.00 18.03 O ATOM 23 CB ASN A 19 -4.825 6.003 6.573 1.00 17.71 C ATOM 24 CG ASN A 19 -6.062 5.099 6.413 1.00 21.26 C ATOM 25 OD1 ASN A 19 -6.606 4.651 7.400 1.00 26.18 O ATOM 26 ND2 ASN A 19 -6.320 4.899 5.151 1.00 31.73 N
Далее есть специальные программы, которые по данным из этого текстового файла могут графически отображать красивую трехмерную структуру молекулы белка, которую можно покрутить на экране монитора и, как говорил Гай Додсон, «дотронуться мышкой до молекулы» (например, PyMol, CCP4mg, старый RasMol). То есть смотреть на структуры белка просто – ставишь программу, загружаешь нужную структуру из PDB и наслаждаешься красотой природы.
4. Анализируем структуру
Итак, мы поняли основную идею: белок — линейный полимер, сворачивающийся в водном растворе под действием множества слабых взаимодействий в стабильную и единственную для данного белка трехмерную структуру, и способный в таком виде выполнять свою функцию. Различают несколько уровней организации белковых структур. Выше мы уже познакомились с первичной структурой – линейной последовательностью аминокислот, которую можно выписать в строчку.
Вторичная структура белка определяется взаимодействием атомов основной цепи белка. Как уже было сказано выше, в состав основной цепи белка входят доноры и акцепторы водородной связи, таким образом, основная цепь может приобретать некоторую структуру. Точнее, несколько разных структур (детали все-таки зависят от различающихся боковых групп), так как возможно образование разных альтернативных водородных связей между группами основной цепи. Структуры бывают такие: альфа-спираль, бета-листы (состоящие из нескольких бета-тяжей), которые бывают параллельными и анти-параллельными, бета-поворот. Плюс часть цепи может и не иметь выраженной структуры, например в районе поворота петли белка. Эти типы структур имеют свои устоявшиеся схематичные обозначения – альфа-спираль в виде спирали или цилиндра, бета-тяжи в виде широких стрелок. Вторичную структуру удается достаточно достоверно предсказывать по первичной (стандартом является JPred), альфа-спирали предсказываются наиболее точно, с бета-тяжами бывают накладки.
Третичная структура белка определяется взаимодействием боковых групп аминокислотных остатков, это и есть трехмерная структура белка. Можно представить себе, что вторичная структура сформирована и теперь эти спирали и бета-тяжи хотят уложиться все вместе в компактную трехмерную структуру, чтобы все гидрофобные боковые группы спокойно «слиплись» вместе в глубине белковой глобулы, сформировав гидрофобное ядро, а полярные и заряженные остатки торчали наружу в воду, формируя поверхность белка и стабилизируя контакты между элементами вторичной структуры. Третичную структуру изображают схематически несколькими способами. Если просто отрисовать все атомы, то получится каша (хотя когда мы анализируем активный центр белка, то мы хотим смотреть как раз на все атомы активных остатков).
Если мы хотим посмотреть, как устроен весь белок в общем, можно отобразить только некоторые атомы основной цепи, чтобы увидеть ее ход. Как вариант, можно нарисовать красивую схему, где поверх реального расположения атомов схематично нарисованы элементы вторичной структуры – так с первого взгляда видна укладка белка. После изучения всей структуры в общем, схематичном виде, можно отобразить химические группы активного центра и уже сосредоточиться на них. Задача предсказания третичной структуры белка – нетривиальная и в общем случае не решается, хотя может быть решена в частных случаях. Подробнее – ниже.
Четвертичная структура белка – да, есть и такая, правда не у всех белков. Многие белки работают сами по себе (мономеры, в данном случае под мономером имеется в виду одиночная свернутая полипептидная цепь, то есть белок целиком), тогда их четвертичная структура равна третичной. Однако достаточно много белков работает только в комплексе, состоящем из нескольких полипептидных цепей (субъединиц или мономеров — димеры, тримеры, тетрамеры, мультимеры), тогда вот такая сборка из нескольких отдельных цепей и называется четвертичной структурой. Самый банальный пример – состоящий из 4 субъединиц гемоглобин, самый красивый на мой взгляд пример – состоящий из 11 одинаковых субъединиц бактериальный белок TRAP.
5. Вычислительные задачи
Белок – сложная система из тысяч атомов, поэтому без использования компьютеров в структуре белка не разобраться. Задач, как решенных на приемлемом уровне, так и совсем не решенных, множество. Перечислю наиболее актуальные:
На уровне первичной структуры
– поиск белков с похожей аминокислотной последовательностью, построение по ним эволюционных деревьев и тд – классические задачи биоинформатики. Главным хабом является NCBI — The National Center for Biotechnology Information, www.ncbi.nlm.nih.gov. Для поиска белков со сходной последовательностью стандартно используется BLAST: blast.ncbi.nlm.nih.gov/Blast.cgi
Предсказание растворимости белка. Речь идет о том, что если мы прочитаем геном какого-нибудь животного, определим по нему последовательности белков, переклонируем эти гены в кишечную палочку или baculovirus expression system, то окажется, что при экспрессии в этих системах примерно треть белков не будет сворачиваться в правильную структуру, и, как следствие, будет нерастворима. Тут выясняется, что большие белки на самом деле состоят из отдельных «доменов», каждый из которых представляет автономную, функциональную часть белка (несущую одну из его функций) и часто «вырезав» из гена отдельный домен, можно получить растворимый белок, определить его структуру и провести с ним опыты. Люди пытаются использовать машинное обучение (нейронные сети, SVM и прочие классификаторы), чтобы предсказывать растворимость белка, однако работает оно достаточно плохо (Гугл много чего покажет по запросу “protein solubility prediction” – есть много серверов, но по моему опыту все они работают отвратительно на моих белках). В идеале я хотел бы видеть сервис, который надежно сказал бы, где в белке находятся те самые растворимые домены, чтобы их можно было вырезать и работать с ними – такого сервиса нет.
На уровне вторичной структуры
– предсказание той самой вторичной структуры по первичной (JPred)
На уровне третичной структуры
– поиск белков со сходными трехмерными структурами (DALI, en.wikipedia.org/wiki/Structural_alignment ),
Поиск структур по заданной суб-структуре. Например, у меня есть расположение трех аминокислот активного центра в пространстве. Хочу найти структуры, которые содержать такие же три аминокислоты в таком же относительном расположении, либо найти структуры белков, мутирование которых даст возможность расположить нужные аминокислоты нужным образом. (гуглить «protein substructure search»)
Предсказание потенциальной подвижности трехмерной структуры, возможных конформационных изменений – normal mode analysis, ElNemo.
На уровне четвертичной структуры
– предположим, известны структуры двух белков. Известно, что они образуют комплекс. Предсказать структуру комплекса (определить, как эти два белка будут взаимодействовать посредством shape matching, например). Гуглить «protein-protein docking»
6. Предсказание структуры белка
Выделил эту вычислительную задачу в отдельный раздел, ибо велика она, фундаментальна и не решается в общем случае.
Экспериментально мы знаем, что если взять белок, полностью развернуть его и бросить в воду, то он свернется обратно в исходное состояние за время от миллисекунд до секунд (это утверждение справедливо по крайней мере для небольших глобулярных белков без всяких патологий). Это значит, что вся информация, необходимая для определения трехмерной структуры белка, в неявном виде содержится в его первичной последовательности, поэтому так хочется научиться предсказывать трехмерную структуру белка по последовательности аминокислот in silico! Однако эта задача в общем случае не решена до сих пор. В чем же дело? Дело в том, что в первичной последовательности отсутствует в явном виде информация, необходимая для построения структуры. Во-первых, нет информации о конформации основной цепи – а она обладает значительной подвижностью, хотя и несколько ограниченной по стерическим причинам. Плюс каждая боковая цепь каждой аминокислоты может находиться в разных конформациях, для длинных боковых групп типа аргинина, это может быть больше десятка конформаций.
Что же делать? Есть достаточно известный хабравчанам самый общий подход, называемый «молекулярная динамика» и подходящий для любых молекул и систем. Берем развернутый белок, приписываем всем атомам случайные значения скоростей, считаем взаимодействия между атомами, повторяем до тех пор, пока система не придет в стабильное состояние, соответствующее свернутому белку. Почему это не работает? Потому что современные вычислительные мощности позволяют за месяцы работы кластера считать десятки наносекунд для системы из тысяч атомов, какой является белок, помещенный в воду. Время же сворачивания белка – миллисекунды и больше, то есть вычислительных мощностей не хватает, разрыв – в несколько порядков. Впрочем, пару лет назад американцы совершили некоторый прорыв. Они использовали специальное железо, оптимизированное для векторных вычислений и после оптимизации на аппаратном уровне у них за месяцы работы машины получилось посчитать молдинамику до миллисекунд для очень маленького белка и белок свернулся, структура соответствовала экспериментально определенной ( http://en.wikipedia.org/wiki/Anton_(computer) )! Однако праздновать победу еще рано. Они взяли очень маленький (его размер раз в 5-10 меньше среднего белка) и один из самых быстросворачивающихся белков, классический модельный белок, на котором изучалось сворачивание. Для больших белков время расчетов увеличивается нелинейно и потребуются уже годы, то есть еще есть над чем работать.
Другой подход реализован в Rosetta. Они разбивают последовательность белка на очень короткие (3-9 остатков) фрагменты и смотрят, какие конформации для этих фрагментов присутствуют в PDB, после чего запускают Монте-Карло по всем вариантам и смотрят, что получится. Иногда получается что-то годное, но в моих случаях через несколько дней работы кластера получаешь такой бублик, что возникает немой вопрос: «Кто писал их оценочную функцию, ставящую какую-то хорошую оценку вот этой загогулине?».
Есть инструменты и для моделирования вручную – можно предсказать вторичную структуру и попробовать вручную крутить ее, находя лучшую укладку. Некие гениальные люди даже выпустили игрушку FoldIt, представляющую белок схематично и позволяющую укладывать его, как-бы собирая головоломку (для интересующихся структурой – рекомендую!). Есть абсолютно официальное соревнование для предсказателей белковых структур, называемое CASP. Суть в том, что когда экспериментаторы определяют новую структуру белка, не имеющую аналогов в PDB, они могут не выкладывать ее сразу в PDB, а выставить последовательность этого белка на конкурс предсказаний CASP. Через некоторое время, когда все закончат свои предсказательные модели, экспериментаторы выкладывают свою экспериментально определенную структуру белка и смотрят, насколько хорошо сработали предсказатели. Самое интересное, что игроки FoldIt, не будучи учеными, как-то выиграли CASP у профессионалов моделирования белковых структур и предсказали структуру белка точнее. Однако даже эти успехи не позволяют утверждать, что проблема предсказания структуры белка решается – очень часто модель очень далека от реальной структуры.
Все это относилось к моделированию белков ab initio, когда нет никакой априорной информации о структуре. Однако очень часто бывают ситуации, когда для некоторого белка в PDB присутствует его отдаленный родственник с уже известной структурой. Под родственником подразумевается белок с похожей первичной последовательностью. Считается, что для белков со сходством по первичной последовательности больше 30% одинаковая укладка основной цепи (хотя одинаковая укладка наблюдалась и для белков, не проявляющих никакого статистически достоверного сходства по первичной последовательности). В случае наличия гомолога (похожего белка) с известной структурой, можно сделать «гомологичное моделирование», то есть попросту «натянуть» последовательность твоего белка на известную структуру гомолога, а потом погонять минимизацию энергии, чтобы как-то все это дело утрясти. Такое моделирование показывает хорошие результаты при наличие очень близких гомологов, чем дальше гомолог – тем больше ошибка. Инструменты для гомологичного моделирования – Modeller, SwissModel.
Можно решать и другие задачи, например, пытаться моделировать, что произойдет, если внести в белок ту или иную мутацию. Например, если заменить гидрофильную аминокислоту на поверхности белка на другую гидрофильную, то скорее всего структура белка не изменится вообще. Если заменить аминокислоту из гидрофобного ядра на другую гидрофобную, но другого размера, то скорее всего укладка белка останется той же, но слегка «съедет» на доли ангстрема. Если же заменить аминокислоту из гидрофобного ядра на заряженную, то скорее всего белок просто «взорвется» и не сможет свернуться.
Может показаться, что все не так уж и плохо и мы достаточно хорошо пониманием сворачивание белка. Да, мы понимаем кое-что, например до некоторой степени мы понимаем общие физические принципы, лежащие в основе сворачивания полипептидной цепи – они рассматриваются в замечательном учебнике Птицына и Финкельштейна «Физика белка». Однако это общее понимание не позволяет нам ответить на вопросы «Свернется ли данный белок или не свернется?», «Какая структура будет у этого белка?», «Как сделать белок с желаемой структурой?».
Вот одна из иллюстраций: мы хотим локализовать один из доменов большого белка, это стандартная задача. У нас есть фрагмент, который сворачивается и растворим, то есть это живой и здоровый белок. Мы же хотим найти его минимальную часть и начинаем методами генетической инженерии с обоих концов удалять по 2-3 аминокислоты, экспрессировать такой обрезанный белок в бактерии и смотреть его сворачиваемость экспериментально. Мы делаем десятки конструкций с такими маленькими делециями и видим такую картину – полностью растворимый и живой белок отличается от полностью мертвого и несворачивающегося на 3 аминокислоты. Повторюсь, это объективный экспериментальный результат. Проблема в том, что сейчас не существует вычислительного метода, который предсказал бы сворачиваемость белка хотя бы на уровне «да/нет» и сказал мне, где проходит граница между сворачивающимся и несворачивающимся белком, потому мы вынуждены клонировать и экспериментально проверять десятки вариантов. Это лишь одна из иллюстраций того, что наше понимание структуры белка весьма далеко от совершенства. Как говорил Ричард Фейнман, «Чего не могу воссоздать, того не понимаю».
Так что, господа программисты, физики и математики, нам еще есть над чем работать.
На этой оптимистичной ноте разрешите откланяться, благодарю всех, кто осилил сей опус.
Для глубоко знакомства с предметной областью рекомендую следующий минимум:
1) «Физика белка» Птицын и Финкельштейн. Большую часть материала Алексей Витальевич Финкельштейн выложил в онлайн, чем и рекомендую с благодарностью воспользоваться: phys.protres.ru/lectures/protein_physics/index.html (а я утащил оттуда несколько картинок)
2) Патрушев, «Искусственные генетические системы», особенно часть II «Белковая инженерия». Есть на торрентах в формате Djvu
3) Для информации, опубликованной в биологических научных журналах, есть официальный поисковик PubMed ( www.pubmed.org ) — у него стоит попросить почитать про «protein engineering» и тому подобное.
- Состав белков.
- Структура белков.
- Химические свойства белков.
- Роль белков в организме.
- Регуляторные белки.
- Искусственный синтез белков.
- Белки как источники питания.
- БЕЛКИ (статья 2)
- ФИЗИЧЕСКИЕ СВОЙСТВА
- ХИМИЧЕСКИЕ СВОЙСТВА
- Строение.
- Оптическая активность.
- Последовательность аминокислот.
- Сложные белки.
- Третичная структура.
- Белки у разных видов организмов.
- Денатурация.
- СИНТЕЗ БЕЛКОВ
- Активация ферментов.
- Метаболический кругооборот.
- Синтетические белки.
- БЕЛКИ И ПИТАНИЕ
- Источники аминокислот.
- Потребность в белках.
- Азотистый баланс.
- Незаменимые аминокислоты.
- Питательная ценность белков.
- Синтетические белки в рационе.
БЕЛКИ (статья 1) – класс биологических полимеров, присутствующих в каждом живом организме. С участием белков проходят основные процессы, обеспечивающие жизнедеятельность организма: дыхание, пищеварение, мышечное сокращение, передача нервных импульсов. Костная ткань, кожный, волосяной покров, роговые образования живых существ состоят из белков. Для большинства млекопитающих рост и развитие организма происходит за счет продуктов, содержащих белки в качестве пищевого компонента. Роль белков в организме и, соответственно, их строение весьма разнообразно.
Состав белков.
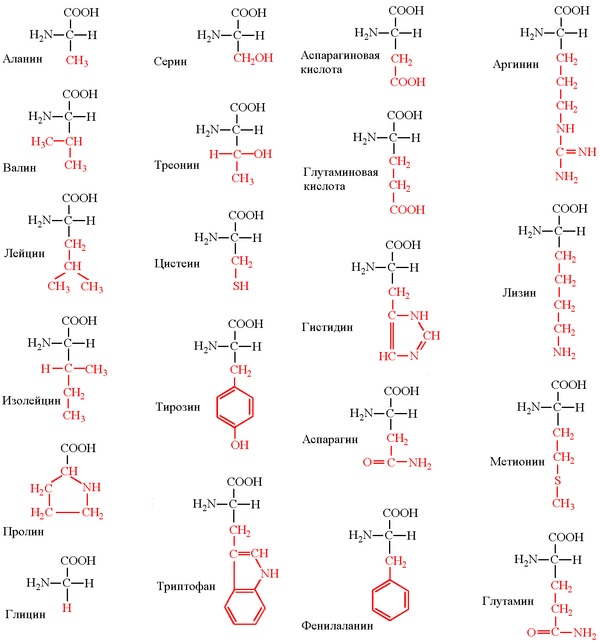
Все белки представляют собой полимеры, цепи которых собраны из фрагментов аминокислот. Аминокислоты – это органические соединения, содержащие в своем составе (в соответствии с названием) аминогруппу NH2 и органическую кислотную, т.е. карбоксильную, группу СООН. Из всего многообразия существующих аминокислот (теоретически количество возможных аминокислот неограниченно) в образовании белков участвуют только такие, у которых между аминогруппой и карбоксильной группой – всего один углеродный атом. В общем виде аминокислоты, участвующие в образовании белков, могут быть представлены формулой: H2N–CH(R)–COOH. Группа R, присоединенная к атому углерода (тому, который находится между амино- и карбоксильной группой), определяет различие между аминокислотами, образующими белки. Эта группа может состоять только из атомов углерода и водорода, но чаще содержит помимо С и Н различные функциональные (способные к дальнейшим превращениям) группы, например, HO-, H2N- и др. Существует также вариант, когда R = Н.
В организмах живых существ содержится более 100 различных аминокислот, однако, в строительстве белков используются не все, а только 20, так называемых «фундаментальных». В табл. 1 приведены их названия (большинство названий сложилось исторически), структурная формула, а также широко применяемое сокращенное обозначение. Все структурные формулы расположены в таблице таким образом, чтобы основной фрагмент 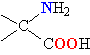
| Название | Структура | Обозначение |
| ГЛИЦИН | 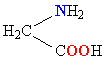 |
ГЛИ |
| АЛАНИН | 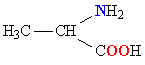 |
АЛА |
| ВАЛИН | 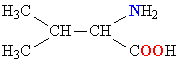 |
ВАЛ |
| ЛЕЙЦИН | 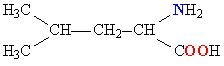 |
ЛЕЙ |
| ИЗОЛЕЙЦИН | 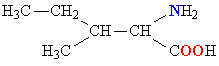 |
ИЛЕ |
| СЕРИН | 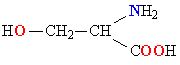 |
СЕР |
| ТРЕОНИН | 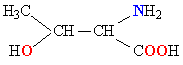 |
ТРЕ |
| ЦИСТЕИН | 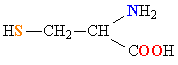 |
ЦИС |
| МЕТИОНИН | 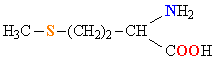 |
МЕТ |
| ЛИЗИН | 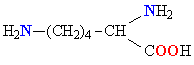 |
ЛИЗ |
| АРГИНИН | 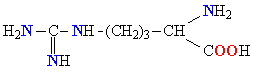 |
АРГ |
| АСПАРАГИНОВАЯ КИСЛОТА | 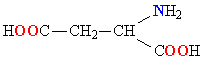 |
АСН |
| АСПАРАГИН | 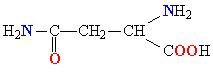 |
АСН |
| ГЛУТАМИНОВАЯ КИСЛОТА | 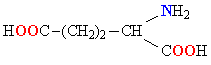 |
ГЛУ |
| ГЛУТАМИН | 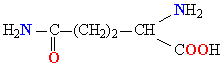 |
ГЛН |
| ФЕНИЛАЛАНИН | 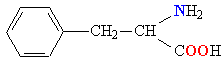 |
ФЕН |
| ТИРОЗИН | 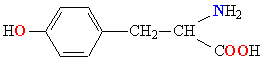 |
ТИР |
| ТРИПТОФАН | 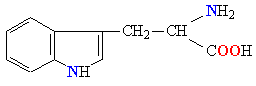 |
ТРИ |
| ГИСТИДИН | 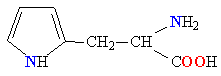 |
ГИС |
| ПРОЛИН | 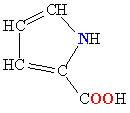 |
ПРО |
| В международной практике принято сокращенное обозначение перечисленных аминокислот с помощью латинских трехбуквенных или однобуквенных сокращений, например, глицин – Gly или G, аланин – Ala или A. |
Среди этих двадцати аминокислот (табл. 1) только пролин содержит рядом с карбоксильной группой СООН группу NH (вместо NH2), так как она входит в состав циклического фрагмента.
Восемь аминокислот (валин, лейцин, изолейцин, треонин, метионин, лизин, фенилаланин и триптофан), помещенные в таблице на сером фоне, называют незаменимыми, поскольку организм для нормального роста и развития должен постоянно получать их с белковой пищей.
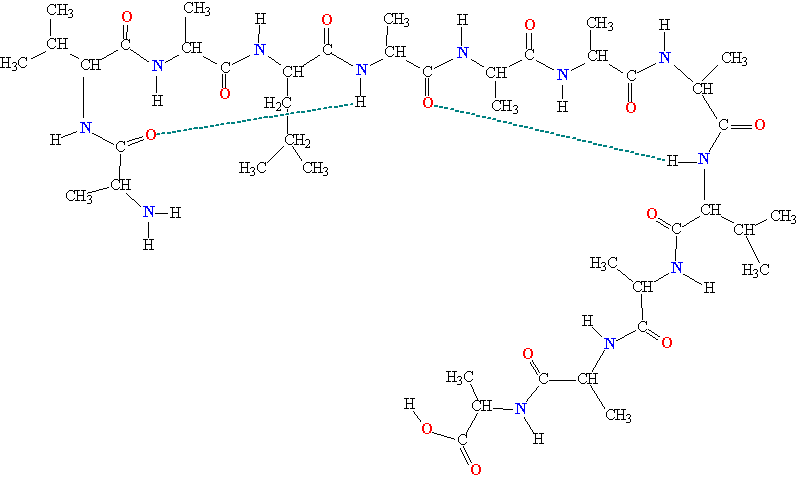
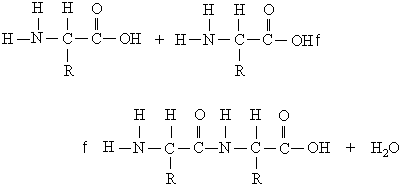
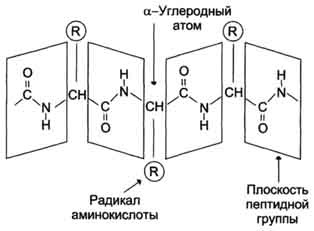
Белковая молекула образуется в результате последовательного соединения аминокислот, при этом карбоксильная группа одной кислоты взаимодействует с аминогруппой соседней молекулы, в результате образуется пептидная связь –CO–NH– и выделяется молекула воды. На рис. 1 показано последовательное соединение аланина, валина и глицина.
Рис. 1 ПОСЛЕДОВАТЕЛЬНОЕ СОЕДИНЕНИЕ АМИНОКИСЛОТ при образовании белковой молекулы. В качестве основного направления полимерной цепи выбран путь от концевой аминогруппы H2N к концевой карбоксильной группе COOH.
Чтобы компактно описать строение белковой молекулы, используют сокращенные обозначения аминокислот (табл. 1, третий столбец), участвующих в образовании полимерной цепи. Фрагмент молекулы, показанный на рис. 1, записывают следующим образом: H2N-АЛА-ВАЛ-ГЛИ-COOH.
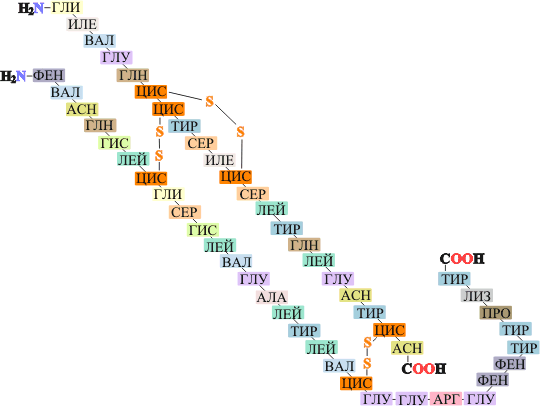
Белковые молекулы содержат от 50 до 1500 аминокислотных остатков (более короткие цепи называют полипептидами). Индивидуальность белка определяется набором аминокислот, из которых составлена полимерная цепь и, что не менее важно, порядком их чередования вдоль цепи. Например, молекула инсулина состоит из 51 аминокислотного остатка (это один из самых короткоцепных белков) и представляет собой две соединенных между собой параллельных цепи неодинаковой длины. Порядок чередования аминокислотных фрагментов показан на рис. 2.
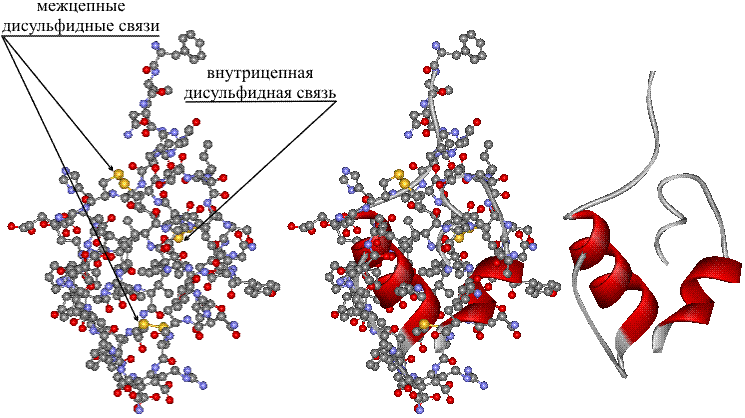
Рис. 2 МОЛЕКУЛА ИНСУЛИНА, построенная из 51 аминокислотного остатка, фрагменты одинаковых аминокислот отмечены соответствующей окраской фона. Содержащиеся в цепи остатки аминокислоты цистеина (сокращенное обозначение ЦИС) образуют дисульфидные мостики –S-S-, которые связывают две полимерных молекулы, либо образуют перемычки внутри одной цепи.
Молекулы аминокислоты цистеина (табл. 1) содержат реакционно-способные сульфгидридные группы –SH, которые взаимодействуют между собой, образуя дисульфидные мостики –S-S-. Роль цистеина в мире белков особая, с его участием образуются поперечные сшивки между полимерными белковыми молекулами.
Объединение аминокислот в полимерную цепь происходит в живом организме под управлением нуклеиновых кислот, именно они обеспечивают строгий порядок сборки и регулируют фиксированную длину полимерной молекулы (см. НУКЛЕИНОВЫЕ КИСЛОТЫ).
Структура белков.
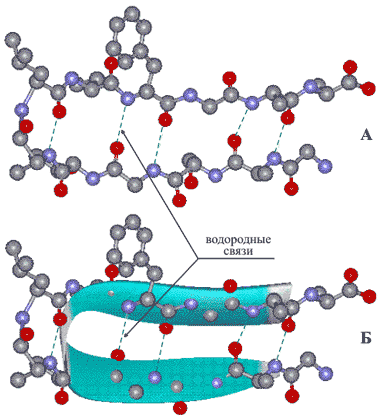
Состав белковой молекулы, представленный в виде чередующихся остатков аминокислот (рис. 2), называют первичной структурой белка. Между присутствующими в полимерной цепи имино-группами HN и карбонильными группами CO возникают водородные связи (см. ВОДОРОДНАЯ СВЯЗЬ), в результате молекула белка приобретает определенную пространственную форму, называемую вторичной структурой. Наиболее распространены два типа вторичной структуры белков.
Первый вариант, называемый α-спиралью, реализуется с помощью водородных связей внутри одной полимерной молекулы. Геометрические параметры молекулы, определяемые длинами связей и валентными углами, таковы, что образование водородных связей оказывается возможным для групп H-N и C=O, между которыми находятся два пептидных фрагмента H-N-C=O (рис. 3).
Рис. 3
Состав полипептидной цепи, показанной на рис. 3, записывают в сокращенном виде следующим образом:
H2N-АЛА ВАЛ-АЛА-ЛЕЙ-АЛА-АЛА-АЛА-АЛА-ВАЛ-АЛА-АЛА-АЛА-COOH.
В результате стягивающего действия водородных связей молекула приобретает форму спирали – так называемая α-спираль, ее изображают в виде изогнутой спиралевидной ленты, проходящей через атомы, образующие полимерную цепь (рис. 4)
Рис. 4 ОБЪЕМНАЯ МОДЕЛЬ МОЛЕКУЛЫ БЕЛКА в форме α-спирали. Водородные связи показаны зелеными пунктирными линиями. Цилиндрическая форма спирали видна при определенном угле поворота (атомы водорода на рисунке не показаны). Окраска отдельных атомов дана в соответствии с международными правилами, которые рекомендуют для атомов углерода черный цвет, для азота – синий, для кислорода – красный, для серы – желтый цвет (для не показанных на рисунке атомов водорода рекомендован белый цвет, в этом случае всю структуру изображают на темном фоне).
Другой вариант вторичной структуры, называемый β-структурой, образуется также при участии водородных связей, отличие состоит в том, что взаимодействуют группы H-N и C=O двух или более полимерных цепей, расположенных параллельно. Поскольку полипептидная цепь имеет направление (рис. 1), возможны варианты, когда направление цепей совпадает (параллельная β-структура, рис. 5), либо они противоположны (антипараллельная β-структура, рис. 6).
В образовании β-структуры могут участвовать полимерные цепи различного состава, при этом органические группы, обрамляющие полимерную цепь (Ph, CH2ОН и др.), в большинстве случаев играют второстепенную роль, решающее значение имеет взаиморасположение групп H-N и C=O. Поскольку относительно полимерной цепи H-N и C=O группы направлены в различные стороны (на рисунке – вверх и вниз), становится возможным одновременное взаимодействие трех и более цепей.
Состав первой полипептидной цепи на рис. 5:
H2N-ЛЕЙ-АЛА-ФЕН-ГЛИ-АЛА-АЛА-COOH
Состав второй и третей цепи:
H2N-ГЛИ-АЛА-СЕР-ГЛИ-ТРЕ-АЛА-COOH
Рис. 5
Состав полипептидных цепей, показанных на рис. 6, тот же, что и на рис. 5, отличие в том, что вторая цепь имеет противоположное (в сравнении с рис. 5) направление.
Рис. 6
Возможно образование β-структуры внутри одной молекулы, когда фрагмент цепи на определенном участке оказывается повернутым на 180°, в этом случае две ветви одной молекулы имеют противоположное направление, в результате образуется антипараллельная β-структура (рис. 7).
Рис. 7
Структура, показанная на рис. 7 в плоском изображении, представлена на рис. 8 в виде объемной модели. Участки β-структуры принято упрощенно обозначать плоской волнистой лентой, которая проходит через атомы, образующие полимерную цепь.
Рис. 8
В структуре многих белков чередуются участки α-спирали и лентообразные β-структуры, а также одиночные полипептидные цепи. Их взаиморасположение и чередование в полимерной цепи называют третичной структурой белка.
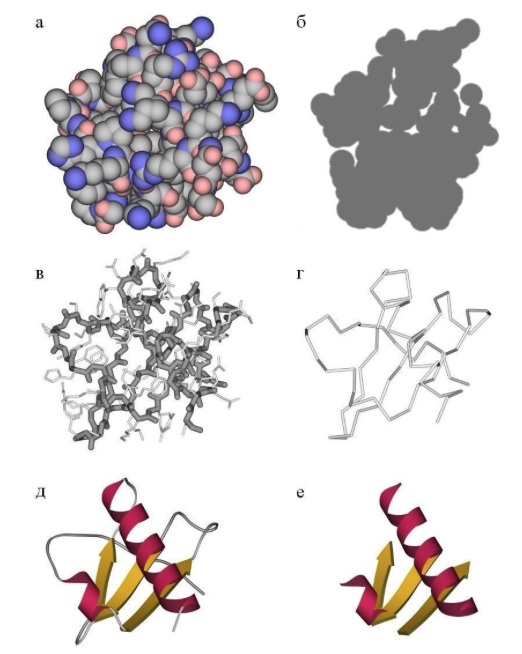
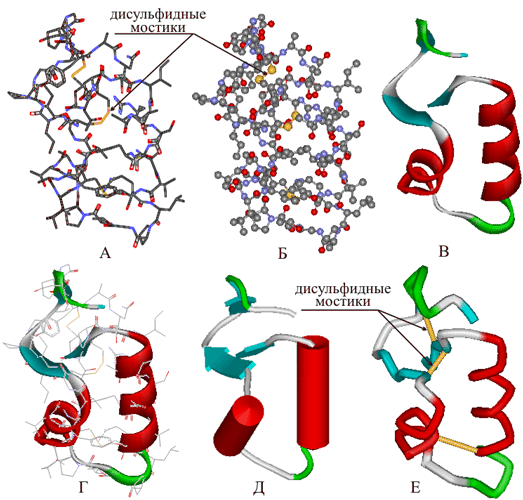
Способы изображения структуры белков показаны далее на примере растительного белка крамбина. Структурные формулы белков, содержащих часто до сотни аминокислотных фрагментов, сложны, громоздки и трудны для восприятия, поэтому иногда используют упрощенные структурные формулы – без символов химических элементов (рис. 9, вариант А), но при этом сохраняют окраску валентных штрихов в соответствии с международными правилами (рис. 4). Формулу при этом представляют не в плоском, а в пространственном изображении, что соответствует реальной структуре молекулы. Такой способ позволяет, например, различить дисульфидные мостики (подобные тем, которые есть в инсулине, рис. 2), фенильные группы в боковом обрамлении цепи и др. Изображение молекул в виде объемных моделей (шарики, соединенные стержнями) несколько более наглядно (рис. 9, вариант Б). Однако оба способа не позволяют показать третичную структуру, поэтому американский биофизик Джейн Ричардсон предложил изображать α-структуры в виде спирально закрученных лент (см. рис. 4), β-структуры – в виде плоских волнистых лент (рис. 8), а соединяющие их одиночные цепи – в форме тонких жгутов, каждый тип структуры имеет свою окраску. Сейчас широко применяют такой способ изображения третичной структуры белка (рис. 9, вариант В). Иногда для большей информативности показывают совместно третичную структуру и упрощенную структурную формулу (рис. 9, вариант Г). Есть и модификации способа, предложенного Ричардсоном: α-спирали изображают в виде цилиндров, а β-структуры – в форме плоских стрелок, указывающих и направление цепи (рис. 9, вариант Д). Менее распространен способ, при котором всю молекулу изображают в виде жгута, где неодинаковые структуры выделяют различающейся окраской, а дисульфидные мостики показывают в виде желтых перемычек (рис. 9, вариант Д).
Наиболее удобен для восприятия вариант В, когда при изображении третичной структуры особенности строения белка (аминокислотные фрагменты, порядок их чередования, водородные связи) не указывают, при этом исходят из того, что все белки содержат «детали», взятые из стандартного набора двадцати аминокислот (табл. 1). Основная задача при изображении третичной структуры – показать пространственное расположение и чередование вторичных структур.
Рис. 9 РАЗЛИЧНЫЕ ВАРИАНТЫ ИЗОБРАЖЕНИЯ СТРУКТУРЫ БЕЛКА КРАМБИНА.
А– структурная формула в пространственном изображении.
Б – структура в виде объемной модели.
В – третичная структура молекулы.
Г – сочетание вариантов А и В.
Д – упрощенное изображение третичной структуры.
Е – третичная структура с дисульфидными мостиками.
Наиболее удобна для восприятия объемная третичная структура (вариант В), освобожденная от деталей структурной формулы.
Белковая молекула, обладающая третичной структурой, как правило, принимает определенную конфигурацию, которую формируют полярные (электростатические) взаимодействия и водородные связи. В результате молекула приобретает форму компактного клубка – глобулярные белки (globules, лат. шарик), либо нитевидную – фибриллярные белки (fibra, лат. волокно).
Пример глобулярной структуры – белок альбумин, к классу альбуминов относят белок куриного яйца. Полимерная цепь альбумина собрана, основном, из аланина, аспаргиновой кислоты, глицина, и цистеина, чередующихся в определенном порядке. Третичная структура содержит α-спирали, соединенные одиночными цепями (рис. 10).
Рис. 10 ГЛОБУЛЯРНАЯ СТРУКТУРА АЛЬБУМИНА
Пример фибриллярной структуры – белок фиброин. Он содержат большое количество остатков глицина, аланина и серина (каждый второй аминокислотный остаток – глицин); остатки цистеина, содержащего сульфгидридные группы, отсутствуют. Фиброин – основной компонент натурального шелка и паутины, содержит β-структуры, соединенные одиночными цепями (рис. 11).
Рис. 11 ФИБРИЛЛЯРНЫЙ БЕЛОК ФИБРОИН
Возможность образования третичной структуры определенного типа заложена в первичной структуре белка, т.е. определена заранее порядком чередования аминокислотных остатков. Из определенных наборов таких остатков преимущественно возникают α-спирали (подобных наборов существует достаточно много), другой набор приводит к появлению β-структур, одиночные цепи характеризуются своим составом.
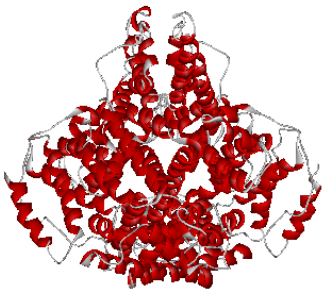
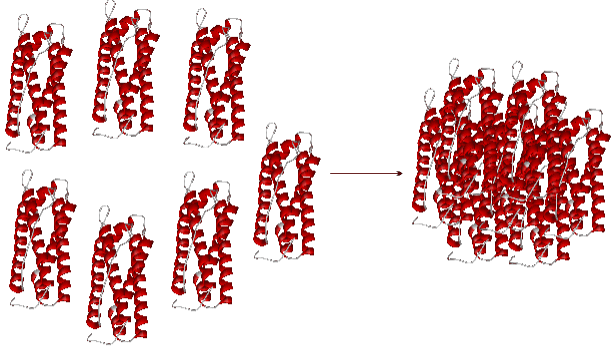
Некоторые белковые молекулы, сохраняя третичную структуру, способны объединяться в крупные надмолекулярные агрегаты, при этом их удерживают вместе полярные взаимодействия, а также водородные связи. Такие образования называют четвертичной структурой белка. Например, белок ферритин, состоящий в основной массе из лейцина, глутаминовой кислоты, аспарагиновой кислоты и гиститдина (в феррицине есть в различном количестве все 20 аминокислотных остатков) образует третичную структуру из четырех параллельно уложенных α-спиралей. При объединении молекул в единый ансамбль (рис. 12) образуется четвертичная структура, в которую может входить до 24 молекул ферритина.
Рис.12 ОБРАЗОВАНИЕ ЧЕТВЕРТИЧНОЙ СТРУКТУРЫ ГЛОБУЛЯРНОГО БЕЛКА ФЕРРИТИНА
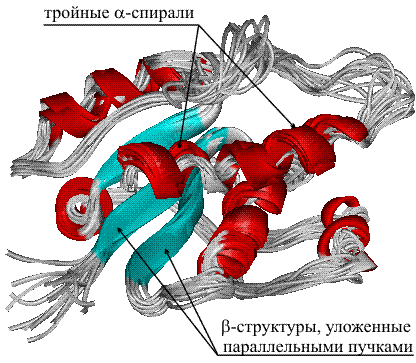
Другой пример надмолекулярных образований – структура коллагена. Это фибриллярный белок, цепи которого построены в основном из глицина, чередующегося с пролином и лизином. Структура содержит одиночные цепи, тройные α-спирали, чередующиеся с лентообразными β-структурами, уложенными в виде параллельных пучков (рис. 13).
Рис.13 НАДМОЛЕКУЛЯРНАЯ СТРУКТУРА ФИБРИЛЛЯРНОГО БЕЛКА КОЛЛАГЕНА
Химические свойства белков.
При действии органических растворителей, продуктов жизнедеятельности некоторых бактерий (молочнокислое брожение) или при повышении температуры происходит разрушение вторичных и третичных структур без повреждения его первичной структуры, в результате белок теряет растворимость и утрачивает биологическую активность, этот процесс называют денатурацией, то есть потерей натуральных свойств, например, створаживание кислого молока, свернувшийся белок вареного куриного яйца. При повышенной температуре белки живых организмов (в частности, микроорганизмов) быстро денатурируют. Такие белки не способны участвовать в биологических процессах, в результате микроорганизмы погибают, поэтому кипяченое (или пастеризованное) молоко может дольше сохраняться.
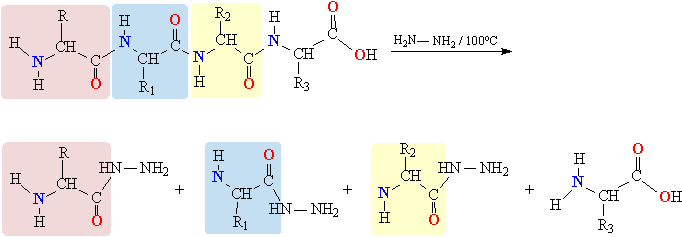
Пептидные связи H-N-C=O, образующие полимерную цепь белковой молекулы, в присутствии кислот или щелочей гидролизуются, при этом происходит разрыв полимерной цепи, что, в конечном итоге, может привести к исходным аминокислотам. Пептидные связи, входящие в состав α-спиралей или β-структур, более устойчивы к гидролизу и различным химическим воздействиям (по сравнению с теми же связями в одиночных цепях). Более деликатную разборку белковой молекулы на составляющие аминокислоты проводят в безводной среде с помощью гидразина H2N–NH2, при этом все аминокислотные фрагменты, кроме последнего, образуют так называемые гидразиды карбоновых кислот, содержащие фрагмент C(O)–HN–NH2 (рис. 14).
Рис. 14. РАСЩЕПЛЕНИЕ ПОЛИПЕПТИДА
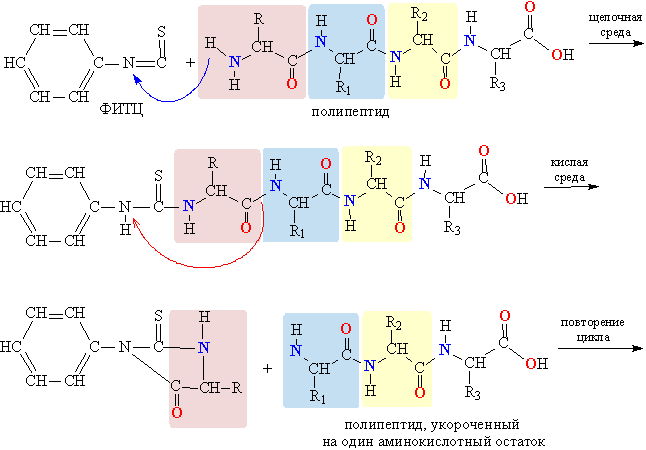
Подобный анализ может дать информацию об аминокислотном составе того или иного белка, однако важнее знать их последовательность в белковой молекуле. Одна из широко применяемых для этой цели методик – действие на полипептидную цепь фенилизотиоцианата (ФИТЦ), который в щелочной среде присоединяется к полипептиду (с того конца, который содержит аминогруппу), а при изменении реакции среды на кислую, отсоединяется от цепи, унося с собой фрагмент одной аминокислоты (рис. 15).
Рис. 15 ПОСЛЕДОВАТЕЛЬНОЕ РАСЩЕПЛЕНИЕ ПОЛИПЕПТИДА
Разработано много специальных методик для подобного анализа, в том числе и такие, которые начинают «разбирать» белковую молекулу на составляющие компоненты, начиная с карбоксильного конца.
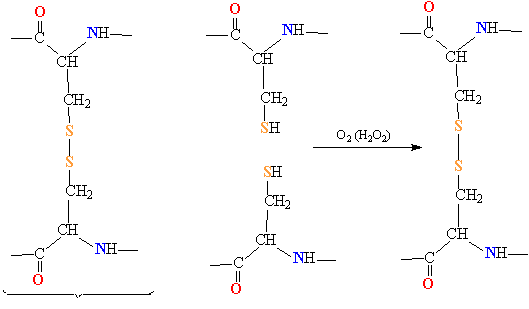
Поперечные дисульфидные мостики S-S (образовавшиеся при взаимодействии остатков цистеина, рис. 2 и 9) расщепляют, превращая их в HS-группы действием различных восстановителей. Действие окислителей (кислорода или перекиси водорода) приводит вновь к образованию дисульфидных мостиков (рис. 16).
Рис. 16. РАСЩЕПЛЕНИЕ ДИСУЛЬФИДНЫХ МОСТИКОВ
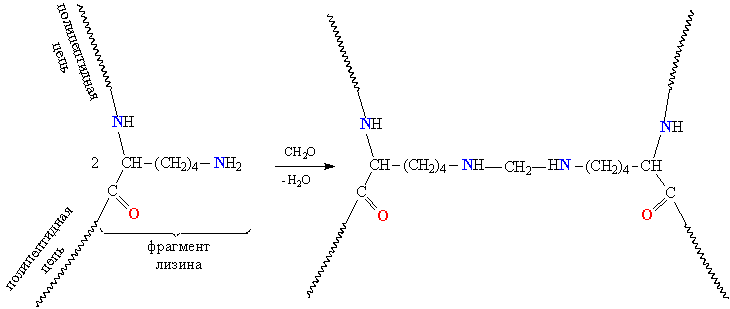
Для создания дополнительных поперечных сшивок в белках используют реакционную способность амино- и карбоксильных групп. Более доступны для различных взаимодействий аминогруппы, которые находятся в боковом обрамлении цепи – фрагменты лизина, аспарагина, лизина, пролина (табл. 1). При взаимодействии таких аминогрупп с формальдегидом идет процесс конденсации и возникают поперечные мостики –NH–CH2–NH– (рис. 17).
Рис. 17 СОЗДАНИЕ ДОПОЛНИТЕЛЬНЫХ ПОПЕРЕЧНЫХ МОСТИКОВ МЕЖДУ МОЛЕКУЛАМИ БЕЛКА.
Концевые карбоксильные группы белка способны реагировать с комплексными соединениями некоторых поливалентных металлов (чаще применяют соединения хрома), при этом также возникают поперечные сшивки. Оба процесса используются при дублении кожи.
Роль белков в организме.
Роль белков в организме разнообразна.
Ферменты (fermentatio лат. – брожение), другое их название – энзимы (en zumh греч. – в дрожжах) – это белки, обладающие каталитической активностью, они способны увеличивать скорости биохимических процессов в тысячи раз. Под действием ферментов составные компоненты пищи: белки, жиры и углеводы – расщепляются до более простых соединений, из которых затем синтезируются новые макромолекулы, необходимые организму определенного типа. Ферменты принимают участие и во многих биохимических процессах синтеза, например, в синтезе белков (одни белки помогают синтезировать другие). См. ФЕРМЕНТЫ
Ферменты не только высокоэффективные катализаторы, но и селективные (направляют реакцию строго в заданном направлении). В их присутствии реакция проходит практически со 100%-ным выходом без образования побочных продуктов и при этом условия протекания – мягкие: обычное атмосферное давление и температура живого организма. Для сравнения, синтез аммиака из водорода и азота в присутствии катализатора – активированного железа – проводят при 400–500° С и давлении 30 МПа, выход аммиака 15–25% за один цикл. Ферменты считаются непревзойденными катализаторами.
Интенсивное исследование ферментов началось в середине 19 в., сейчас изучено более 2000 различных ферментов, это самый многообразный класс белков.
Названия ферментов составляют следующим образом: к наименованию реагента, с которым взаимодействует фермент, или к названию катализируемой реакции добавляют окончание -аза, например, аргиназа разлагает аргинин (табл. 1), декарбоксилаза катализирует декарбоксилирование, т.е. отщепление СО2 от карбоксильной группы:
– СООН → – СН + СО2
Часто, для более точного обозначения роли фермента в его названии указывают и объект, и тип реакции, например, алкогольдегидрогеназа – фермент, осуществляющий дегидрирование спиртов.
Для некоторых ферментов, открытых достаточно давно, сохранилось историческое название (без окончания –аза), например, пепсин (pepsis, греч. пищеварение) и трипсин (thrypsis греч. разжижение), эти ферменты расщепляют белки.
Для систематизации ферменты объединяют в крупные классы, в основу классификации положен тип реакции, классы именуют по общему принципу – название реакции и окончание – аза. Далее перечислены некоторые из таких классов.
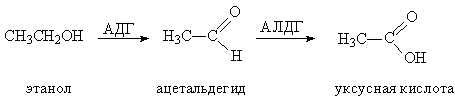
Оксидоредуктазы – ферменты, катализирующие окислительно-восстановительные реакции. Входящие в этот класс дегидрогеназы осуществляют перенос протона, например алкогольдегидрогеназа (АДГ) окисляет спирты до альдегидов, последующее окисление альдегидов до карбоновых кислот катализируют альдегиддегидрогеназы (АЛДГ). Оба процесса происходят в организме при переработке этанола в уксусную кислоту (рис. 18).
Рис. 18 ДВУХСТАДИЙНОЕ ОКИСЛЕНИЕ ЭТАНОЛА до уксусной кислоты
Наркотическим действием обладает не этанол, а промежуточный продукт ацетальдегид, чем ниже активность фермента АЛДГ, тем медленнее проходит вторая стадия – окисление ацетальдегида до уксусной кислоты и тем дольше и сильнее проявляется опьяняющее действие от приема внутрь этанола. Анализ показал, что более чем у 80% представителей желтой расы относительно низкая активность АЛДГ и потому заметно более тяжелая переносимость алкоголя. Причина такой врожденной пониженной активности АЛДГ состоит в том, что часть остатков глутаминовой кислоты в молекуле «ослабленной» АЛДГ заменена фрагментами лизина (табл. 1).
Трансферазы – ферменты, катализирующие перенос функциональных групп, например, трансиминаза катализирует перемещение аминогруппы.
Гидролазы – ферменты, катализирующие гидролиз. Упомянутые ранее трипсин и пепсин осуществляют гидролиз пептидных связей, а липазы расщепляют сложноэфирную связь в жирах:
–RС(О)ОR1 +Н2О → –RС(О)ОН + НОR1
Лиазы – ферменты, катализирующие реакции, которые проходят не гидролитическим путем, в результате таких реакций происходит разрыв связей С-С, С-О, С-N и образование новых связей. Фермент декарбоксилаза относится к этому классу
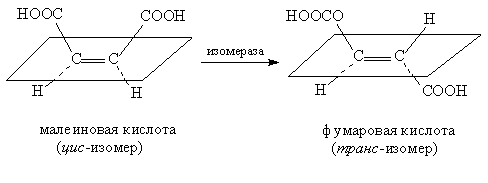
Изомеразы – ферменты, катализирующие изомеризацию, например, превращение малеиновой кислоты в фумаровую (рис. 19), это пример цис – транс изомеризации (см. ИЗОМЕРИЯ).
Рис. 19. ИЗОМЕРИЗАЦИЯ МАЛЕИНОВОЙ КИСЛОТЫ в фумаровую в присутствии фермента.
В работе ферментов соблюдается общий принцип, в соответствии с которым всегда есть структурное соответствие фермента и реагента ускоряемой реакции. По образному выражению одного из основателей учения о ферментах Э.Фишера, реагент подходит к ферменту, как ключ к замку. В связи с этим каждый фермент катализирует определенную химическую реакцию или группу реакций одного типа. Иногда фермент может действовать на одно единственное соединение, например, уреаза (uron греч. – моча) катализирует только гидролиз мочевины:
(H2N)2C = O + H2O = CO2 + 2NH3
Наиболее тонкую избирательность проявляют ферменты, различающие оптически активные антиподы – лево- и правовращающие изомеры. L-аргиназа действует только на левовращающий аргинин и не затрагивает правовращающий изомер. L-лактатдегидрогеназа действует только на левовращающие эфиры молочной кислоты, так называемые лактаты (lactis лат. молоко), в то время как D-лактатдегидрогеназа расщепляет исключительно D-лактаты.
Большая часть ферментов действует не на одно, а на группу родственных соединений, например, трипсин «предпочитает» расщеплять пептидные связи образованные лизином и аргинином (табл. 1.)
Каталитические свойства некоторых ферментов, таких как гидролазы, определяются исключительно строением самой белковой молекулы, другой класс ферментов – оксидоредуктазы (например, алкогольдегидрогеназа) могут проявлять активность только в присутствии связанных с ними небелковых молекул – витаминов, активирующих ионов Mg, Са, Zn, Мn и фрагментов нуклеиновых кислот (рис. 20).
Рис. 20 МОЛЕКУЛА АЛКОГОЛЬДЕГИДРОГЕНАЗЫ
Транспортные белки связывают и переносят различные молекулы или ионы через мембраны клеток (как внутрь клетки, так и вовне), а также от одного органа к другому.
Например, гемоглобин связывает кислород при прохождении крови через легкие и доставляет его к различным тканям организма, где кислород высвобождается и затем используется для окисления компонентов пищи, этот процесс служит источником энергии (иногда употребляют термин «сжигание» пищевых продуктов в организме).
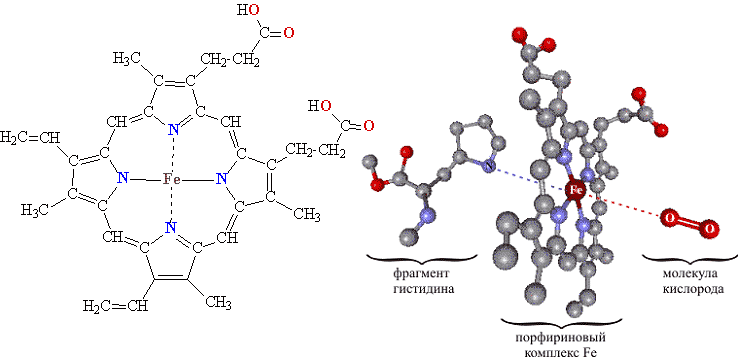
Помимо белковой части гемоглобин содержит комплексное соединение железа с циклической молекулой порфирином (porphyros греч. – пурпур), что и обусловливает красный цвет крови. Именно этот комплекс (рис. 21, слева) играет роль переносчика кислорода. В гемоглобине порфириновый комплекс железа располагается внутри белковой молекулы и удерживается с помощью полярных взаимодействий, а также координационной связи с азотом в гистидине (табл. 1), входящем в состав белка. Молекула О2, которую переносит гемоглобин, присоединяется с помощью координационной связи к атому железа со стороны, противоположной той, к которой присоединен гистидин (рис. 21, справа).
Рис. 21 СТРОЕНИЕ КОМПЛЕКСА ЖЕЛЕЗА
Справа показано строение комплекса в форме объемной модели. Комплекс удерживается в белковой молекуле с помощью координационной связи (синий пунктир) между атомом Fe и атомом N в гистидине, входящим в состав белка. Молекула О2, которую переносит гемоглобин, присоединена координационно (красный пунктир) к атому Fe с противоположной страны плоского комплекса.
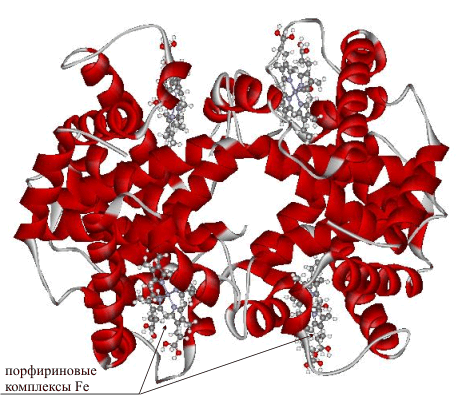
Гемоглобин – один из наиболее подробно изученных белков, он состоит из a-спиралей, соединенных одиночными цепями, и содержит в своем составе четыре комплекса железа. Таким образом, гемоглобин представляет собой как бы объемистую упаковку для переноса сразу четырех молекул кислорода. По форме гемоглобин соответствует глобулярным белкам (рис. 22).
Рис. 22 ГЛОБУЛЯРНАЯ ФОРМА ГЕМОГЛОБИНА
Основное «достоинство» гемоглобина состоит в том, что присоединение кислорода и последующее его отщепление при передаче различным тканям и органам проходит быстро. Монооксид углерода, СО (угарный газ), связывается с Fe в гемоглобине еще быстрее, но, в отличие от О2, образует трудно разрушающийся комплекс. В результате такой гемоглобин не способен связывать О2, что приводит (при вдыхании больших количеств угарного газа) к гибели организма от удушья.
Вторая функция гемоглобина – перенос выдыхаемого СО2, но в процессе временного связывания углекислоты участвует не атом железа, а H2N-группы белка.
«Работоспособность» белков зависит от их строения, например, замена единственного аминокислотного остатка глутаминовой кислоты в полипептидной цепи гемоглобина на остаток валина (изредка наблюдаемая врожденная аномалия) приводит к заболеванию, называемому серповидноклеточная анемия.
Существуют также транспортные белки, способные связывать жиры, глюкозу, аминокислоты и переносить их как внутрь, так и вовне клеток.
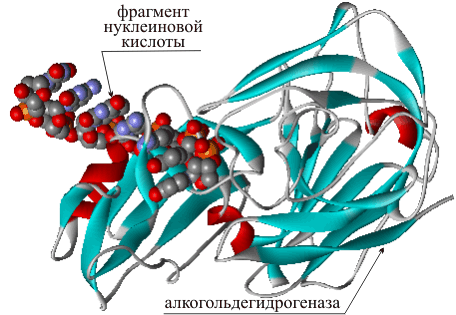
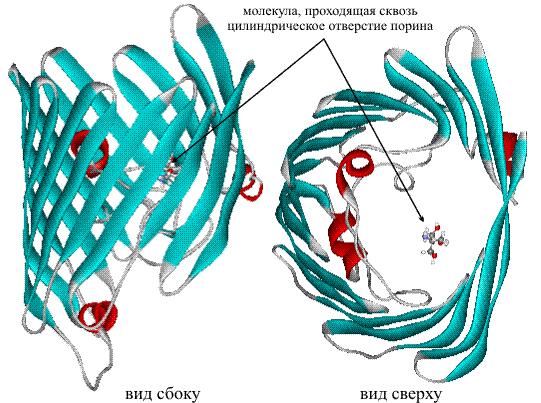
Транспортные белки особого типа не переносят сами вещества, а выполняют функции «транспортного регулировщика», пропуская определенные вещества сквозь мембрану (внешнюю стенку клетки). Такие белки чаще называют мембранными. Они имеют форму пустотелого цилиндра и, встраиваясь в стенку мембраны, обеспечивают перемещение некоторых полярных молекул или ионов внутрь клетки. Пример мембранного белка – порин (рис. 23).
Рис. 23 БЕЛОК ПОРИН
Пищевые и запасные белки, как следует из названия, служат источниками внутреннего питания, чаще для зародышей растений и животных, а также на ранних стадиях развития молодых организмов. К пищевым белкам относят альбумин (рис. 10) – основной компонент яичного белка, а также казеин – главный белок молока. Под действием фермента пепсина казеин в желудке створаживается, это обеспечивает его задержку в пищеварительном тракте и эффективное усвоение. Казеин содержит фрагменты всех аминокислот, необходимых организму.
В ферритине (рис. 12), который содержится в тканях животных, запасены ионы железа.
К запасным белкам относят также миоглобин, по составу и строению напоминающий гемоглобин. Миоглобин сосредоточен, главным образом, в мышцах, его основная роль – хранение кислорода, который ему отдает гемоглобин. Он быстро насыщается кислородом (намного быстрее, чем гемоглобин), а затем постепенно передает его различным тканям.
Структурные белки выполняют защитную функцию (кожный покров) или опорную – скрепляют организм в единое целое и придают ему прочность (хрящи и сухожилия). Их главным компонентом является фибриллярный белок коллаген (рис. 11), наиболее распространенный белок животного мира, в организме млекопитающих, на его долю приходится почти 30% от всей массы белков. Коллаген обладает высокой прочностью на разрыв (известна прочность кожи), но из-за малого содержания поперечных сшивок в коллагене кожи, шкуры животных мало пригодны в сыром виде для изготовления различных изделий. Чтобы уменьшить набухание кожи в воде, усадку при сушке, а также для увеличения прочности в обводненном состоянии и повышения упругости в коллагене создают дополнительные поперечные сшивки (рис. 15а), это, так называемый процесс дубления кожи.
В живых организмах молекулы коллагена, возникшие в процессе роста и развития организма, не обновляются и не замещаются заново синтезированными. По мере старения организма увеличивается количество поперечных сшивок в коллагене, что приводит к снижению его эластичности, а поскольку обновление не происходит, то проявляются возрастные изменения – увеличение хрупкости хрящей и сухожилий, появление морщин на коже.
В суставных связках содержится эластин – структурный белок, легко растягивающийся в двух измерениях. Наибольшей эластичностью обладает белок резилин, который находится в местах шарнирного прикрепления крыльев у некоторых насекомых.
Роговые образования – волосы, ногти, перья состоя, в основном, из белка кератина (рис. 24). Его основное отличие – заметное содержание остатков цистеина, образующего дисульфидные мостики, что придает высокую упругость (способность восстанавливать исходную форму после деформации) волосам, а также шерстяным тканям.
Рис. 24. ФРАГМЕНТ ФИБРИЛЛЯРНОГО БЕЛКА КЕРАТИНА
Для необратимого изменения формы кератинового объекта нужно вначале разрушить дисульфидные мостики с помощью восстановителя, придать новую форму, а затем вновь создать дисульфидные мостики с помощью окислителя (рис. 16), именно так делается, например, химическая завивка волос.
При увеличении содержания остатков цистеина в кератине и, соответственно, возрастании количества дисульфидных мостиков способность к деформации исчезает, но при этом появляется высокая прочность (в рогах копытных животных и панцирях черепах содержится до 18% цистеиновых фрагментов). В организме млекопитающих содержится до 30 различных типов кератина.
Родственный кератину фибриллярный белок фиброин, выделяемый гусеницами шелкопряда при завивке кокона, а также пауками при плетении паутины, содержит только β-структуры, соединенные одиночными цепями (рис. 11). В отличие от кератина, у фиброина нет поперечных дисульфидных мостиков, он обладает очень прочен на разрыв (прочность в расчете на единицу поперечного сечения у некоторых образцов паутины выше, чем у стальных тросов). Из-за отсутствия поперечных сшивок фиброин неупруг (известно, что шерстяные ткани почти несминаемы, а шелковые легко мнутся).
Регуляторные белки.
Регуляторные белки, чаще называемые гормонами, участвуют в различных физиологических процессах. Например, гормон инсулин (рис. 25) состоит из двух α-цепей, соединенных дисульфидными мостиками. Инсулин регулирует обменные процессы с участием глюкозы, его отсутствие ведет к диабету.
Рис. 25 БЕЛОК ИНСУЛИН
В гипофизе мозга синтезируется гормон, регулирующий рост организма. Существуют регуляторные белки, контролирующие биосинтез различных ферментов в организме.
Сократительные и двигательные белки придают организму способность сокращаться, изменять форму и перемещаться, прежде всего, речь идет о мышцах. 40% от массы всех белков, содержащихся в мышцах, составляет миозин (mys, myos, греч. – мышца). Его молекула содержит одновременно фибриллярную и глобулярную часть (рис. 26)
Рис. 26 МОЛЕКУЛА МИОЗИНА
Такие молекулы объединяются в крупные агрегаты, содержащие 300–400 молекул.
При изменении концентрации ионов кальция в пространстве, окружающем мышечные волокна, происходит обратимое изменение конформации молекул – изменение формы цепи за счет поворота отдельных фрагментов вокруг валентных связей. Это приводит к сокращению и расслаблению мышц, сигнал для изменения концентрации ионов кальция поступает от нервных окончаний в мышечных волокнах. Искусственное сокращение мышц можно вызвать действием электрических импульсов, приводящих к резкому изменению концентрации ионов кальция, на этом основана стимуляция сердечной мышцы для восстановления работы сердца.
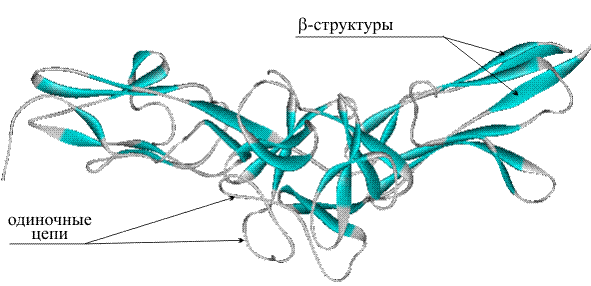
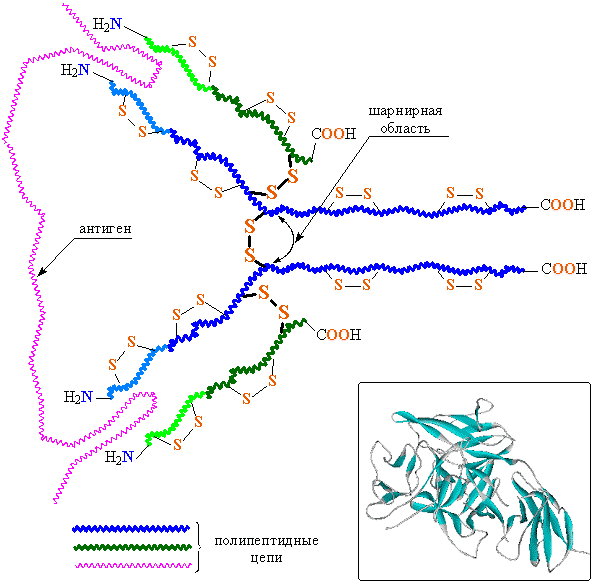
Защитные белки позволяют уберечь организм от вторжения атакующих его бактерий, вирусов и от проникновения чужеродных белков (обобщенное название чужеродных тел – антигены). Роль защитных белков выполняют иммуноглобулины (другое их название – антитела), они распознают антигены, проникшие в организм, и прочно связываются с ними. В организме млекопитающих, включая человека, есть пять классов иммуноглобулинов: M, G, A, D и E, их структура, как следует из названия, глобулярная, кроме того, все они построены сходным образом. Молекулярная организация антител показана далее на примере иммуноглобулина класса G (рис. 27). Молекула содержит четыре полипептидные цепи, объединенные тремя дисульфидными мостиками S-S (на рис. 27 они показаны с утолщенными валентными связями и крупными символами S), кроме того, каждая полимерная цепь содержит внутрицепные дисульфидные перемычки. Две большие полимерные цепи (выделены синим цветом) содержат 400–600 аминокислотных остатков. Две другие цепи (выделены зеленым цветом) почти вдвое короче, они содержат приблизительно 220 аминокислотных остатков. Все четыре цепи расположены таким образом, что концевые H2N-группы направлены в одну сторону.
Рис. 27 СХЕМАТИЧЕСКОЕ ИЗОБРАЖЕНИЕ СТРУКТУРЫ ИММУНОГЛОБУЛИНА
После контакта организма с чужеродным белком (антигеном), клетки иммунной системы начинают вырабатывать иммуноглобулины (антитела), которые накапливаются в сыворотке крови. На первом этапе основную работу совершают участки цепей, содержащие концевые H2N (на рис. 27 соответствующие участки отмечены светло-синим и светло-зеленым цветом). Это области захвата антигенов. В процессе синтеза иммуноглобулина эти участки формируется таким образом, чтобы их строение и конфигурация максимально соответствовали структуре приблизившегося антигена (как ключ к замку, подобно ферментам, но задачи в данном случае иные). Таким образом, для каждого антигена в качестве иммунного ответа создается строго индивидуальное антитело. Столь «пластично» изменять строение в зависимости от внешних факторов, помимо иммуноглобулинов, не может ни один известный белок. Ферменты решают задачу структурного соответствия реагенту иным путем – с помощью гигантского набора разнообразных ферментов в расчете на все возможные случаи, а иммуноглобулины каждый раз заново перестраивают «рабочий инструмент». Сверх того, шарнирный участок иммуноглобулина (рис. 27) обеспечивает двум областям захвата некоторую независимую подвижность, в результате молекула иммуноглобулина может «найти» сразу два наиболее удобных для захвата участка в антигене с тем, чтобы его надежно зафиксировать, это напоминает действия ракообразного существа.
Далее включается цепь последовательных реакций иммунной системы организма, подключаются иммуноглобулины других классов, в результате происходит дезактивация чужеродного белка, а затем уничтожение и удаление антигена (постороннего микроорганизма или токсина).
После контакта с антигеном максимальная концентрация иммуноглобулина достигается (в зависимости от природы антигена и индивидуальных особенностей самого организма) в течение нескольких часов (иногда нескольких дней). Организм сохраняет память о таком контакте, и при повторной атаке таким же антигеном иммуноглобулины накапливаются в сыворотке крови значительно быстрее и в большем количестве – возникает приобретенный иммунитет.
Приведенная классификация белков носит в определенной степени условный характер, например белок тромбин, упомянутый среди защитных белков, по существу представляет собой фермент, катализирующий гидролиз пептидных связей, то есть, относится к классу протеаз.
К защитным белкам часто относят белки змеиного яда и токсичные белки некоторых растений, поскольку их задача – уберечь организм от повреждений.
Есть белки, функции которых настолько уникальны, что это затрудняет их классификацию. Например, белок монеллин, содержащийся в одном из африканских растений, – очень сладкий на вкус, он стал предметом изучения как нетоксичное вещество, которое может быть использовано вместо сахара для предотвращения ожирения. Плазма крови некоторых антарктических рыб содержит белки со свойствами антифриза, который предохраняет кровь этих рыб от замерзания.
Искусственный синтез белков.
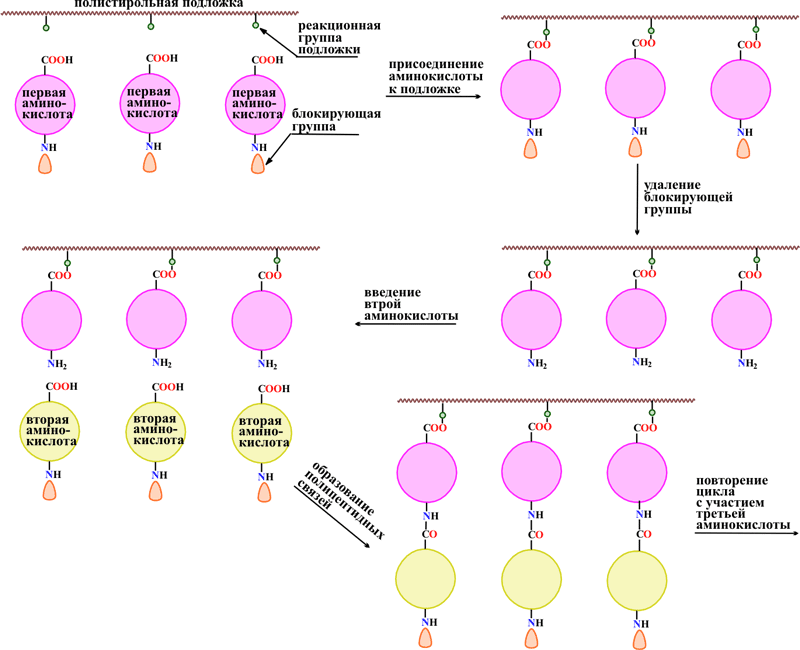
Конденсация аминокислот, приводящая к полипептидной цепи, представляет собой хорошо изученный процесс. Можно провести, например, конденсацию какой – либо одной аминокислоты или смеси кислот и получить, соответственно, полимер, содержащий одинаковые звенья, либо различные звенья, чередующиеся в случайном порядке. Такие полимеры мало похожи на природные полипептиды и не обладают биологической активностью. Основная задача состоит в том, чтобы соединять аминокислоты в строго определенном, заранее намеченном порядке, чтобы воспроизвести последовательность аминокислотных остатков в природных белках. Американский ученый Роберт Меррифилд предложил оригинальный метод, позволивший решить такую задачу. Сущность метода состоит в том, что первую аминокислоту присоединяют к нерастворимому полимерному гелю, который содержит реакционно-способные группы, способные соединяться с –СООН – группами аминокислоты. В качестве такой полимерной подложки был взят сшитый полистирол с введенными в него хлорметильными группами. Чтобы взятая для реакции аминокислота не прореагировала сама с собой и чтобы она не присоединилась H2N-группой к подложке, аминогруппу этой кислоты предварительно блокируют объемистым заместителем [(С4Н9)3]3ОС(О)-группой. После того, как аминокислота присоединилась к полимерной подложке, блокирующую группу удаляют и в реакционную смесь вводят другую аминокислоту, у которой также предварительно заблокирована H2N-группа. В такой системе возможно только взаимодействие H2N-группы первой аминокислоты и группы –СООН второй кислоты, которое проводят в присутствии катализаторов (солей фосфония). Далее всю схему повторяют, вводя третью аминокислоту (рис. 28).
Рис. 28. СХЕМА СИНТЕЗА ПОЛИПЕПТИДНЫХ ЦЕПЕЙ
На последней стадии полученные полипептидные цепи отделяют от полистирольной подложки. Сейчас весь процесс автоматизирован, существуют автоматические синтезаторы пептидов, действующие по описанной схеме. Таким методом синтезировано множество пептидов, используемых в медицине и сельском хозяйстве. Удалось также получить улучшенные аналоги природных пептидов с избирательным и усиленным действием. Синтезированы некоторые небольшие белки, например гормон инсулина и некоторые ферменты.
Существуют также методы синтеза белков, копирующие природные процессы: синтезируют фрагменты нуклеиновых кислот, настроенных на получение определенных белков, затем эти фрагменты встраивают в живой организм (например, в бактерию), после чего организм начинает вырабатывать нужный белок. Таким способом сейчас получают значительные количества труднодоступных белков и пептидов, а также их аналогов.
Белки как источники питания.
Белки в живом организме постоянно расщепляются на исходные аминокислоты (с непременным участием ферментов), одни аминокислоты переходят в другие, затем белки вновь синтезируются (также с участием ферментов), т.е. организм постоянно обновляется. Некоторые белки (коллаген кожи, волос) не обновляются, организм непрерывно их теряет и взамен синтезирует новые. Белки как источники питания выполняют две основные функции: они поставляют в организм строительный материал для синтеза новых белковых молекул и, кроме того, снабжают организм энергией (источники калорий).
Плотоядные млекопитающие (в том числе и человек) получают необходимые белки с растительной и животной пищей. Ни один из полученных с пищей белков не встраивается в организм в неизменном виде. В пищеварительном тракте все поглощенные белки расщепляются до аминокислот, и уже из них строятся белки, необходимые конкретному организму, при этом из 8 незаменимых кислот (табл. 1) в организме могут синтезироваться остальные 12, если они не поступают в достаточном количестве с пищей, но незаменимые кислоты должны поступать с пищей непременно. Атомы серы в цистеине организм получает с незаменимой аминокислотой – метионином. Часть белков распадается, выделяя энергию, необходимую для поддержания жизнедеятельности, а содержавшийся в них азот выводится из организма с мочой. Обычно организм человека теряет 25–30 г. белка в сутки, поэтому белковая пища должны постоянно присутствовать в нужном количестве. Минимальная суточная потребность в белке составляет у мужчин 37 г, у женщин 29 г, однако рекомендованные нормы потребления почти вдвое выше. При оценке пищевых продуктов важно учитывать качество белка. При отсутствии или низком содержании незаменимых аминокислот белок считается малоценным, поэтому такие белки должны потребляться в большем количестве. Так, белки бобовых культур содержат мало метионина, а в белках пшеницы и кукурузы низкое содержанием лизина (обе аминокислоты незаменимые). Животные белки (исключая коллагены) относят к полноценным пищевым продуктам. Полный набор всех незаменимых кислот содержит казеин молока, а также приготовляемые из него творог и сыр, поэтому вегетарианская диета, в том случае, если она очень строгая, т.е. «безмолочная», требует усиленного потребления бобовых культур, орехов и грибов для снабжения организма незаменимыми аминокислотами в нужном количестве.
Синтетические аминокислоты и белки используют и как пищевые продукты, добавляя их в корма, которые содержат незаменимые аминокислоты в малом количестве. Существуют бактерии, которые могут перерабатывать и усваивать углеводороды нефти, в этом случае для полноценного синтеза белков их нужно подкармливать азотсодержащими соединениями (аммиак или нитраты). Получаемый таким способом белок используют в качестве корма для скота и домашней птицы. В комбикорм домашних животных часто добавляют набор ферментов – карбогидраз, которые катализируют гидролиз трудно разлагаемых компонентов углеводной пищи (клеточные стенки зерновых культур), в результате чего растительная пища усваивается более полно.
Михаил Левицкий
БЕЛКИ (статья 2)
(протеины), класс сложных азотсодержащих соединений, наиболее характерных и важных (наряду с нуклеиновыми кислотами) компонентов живого вещества. Белки выполняют многочисленные и разнообразные функции. Большинство белков – ферменты, катализирующие химические реакции. Многие гормоны, регулирующие физиологические процессы, тоже являются белками. Такие структурные белки, как коллаген и кератин, служат главными компонентами костной ткани, волос и ногтей. Сократительные белки мышц обладают способностью изменять свою длину, используя химическую энергию для выполнения механической работы. К белкам относятся антитела, которые связывают и нейтрализуют токсичные вещества. Некоторые белки, способные реагировать на внешние воздействия (свет, запах), служат в органах чувств рецепторами, воспринимающими раздражение. Многие белки, расположенные внутри клетки и на клеточной мембране, выполняют регуляторные функции.
В первой половине 19 в. многие химики, и среди них в первую очередь Ю.фон Либих, постепенно пришли к выводу, что белки представляют собой особый класс азотистых соединений. Название «протеины» (от греч. protos – первый) предложил в 1840 голландский химик Г.Мульдер.
ФИЗИЧЕСКИЕ СВОЙСТВА
Белки в твердом состоянии белого цвета, а в растворе бесцветны, если только они не несут какой-нибудь хромофорной (окрашенной) группы, как, например, гемоглобин. Растворимость в воде у разных белков сильно варьирует. Она изменяется также в зависимости от рН и от концентрации солей в растворе, так что можно подобрать условия, при которых один какой-нибудь белок будет избирательно осаждаться в присутствии других белков. Этот метод «высаливания» широко используется для выделения и очистки белков. Очищенный белок часто выпадает в осадок из раствора в виде кристаллов.
В сравнении с другими соединениями молекулярная масса белков очень велика – от нескольких тысяч до многих миллионов дальтон. Поэтому при ультрацентрифугировании белки осаждаются, и притом с разной скоростью. Благодаря присутствию в молекулах белков положительно и отрицательно заряженных групп они движутся с разной скоростью и в электрическом поле. На этом основан электрофорез – метод, применяемый для выделения индивидуальных белков из сложных смесей. Очистку белков проводят и методом хроматографии.
ХИМИЧЕСКИЕ СВОЙСТВА
Строение.
Белки – это полимеры, т.е. молекулы, построенные, как цепи, из повторяющихся мономерных звеньев, или субъединиц, роль которых играют у них aльфа-аминокислоты. Общая формула аминокислот
где R – атом водорода или какая-нибудь органическая группа.
Белковая молекула (полипептидная цепь) может состоять всего лишь из относительно небольшого числа аминокислот или из нескольких тысяч мономерных звеньев. Соединение аминокислот в цепи возможно потому, что у каждой из них имеются две разные химические группы: обладающая основными свойствами аминогруппа, NH2, и кислотная карбоксильная группа, СООН. Обе эти группы присоединены к a-атому углерода. Карбоксильная группа одной аминокислоты может образовать амидную (пептидную) связь с аминогруппой другой аминокислоты:
После того как две аминокислоты таким образом соединились, цепь может наращиваться путем добавления ко второй аминокислоте третьей и т.д. Как видно из приведенного выше уравнения, при образовании пептидной связи выделяется молекула воды. В присутствии кислот, щелочей или протеолитических ферментов реакция идет в обратном направлении: полипептидная цепь расщепляется на аминокислоты с присоединением воды. Такая реакция называется гидролизом. Гидролиз протекает спонтанно, а для соединения аминокислот в полипептидную цепь требуется энергия.
Карбоксильная группа и амидная группа (или сходная с ней имидная – в случае аминокислоты пролина) имеются у всех аминокислот, различия же между аминокислотами определяются природой той группы, или «боковой цепи», которая обозначена выше буквой R. Роль боковой цепи может играть и один атом водорода, как у аминокислоты глицина, и какая-нибудь объемистая группировка, как у гистидина и триптофана. Некоторые боковые цепи в химическом смысле инертны, тогда как другие обладают заметной реакционной способностью.
Синтезировать можно многие тысячи различных аминокислот, и множество различных аминокислот встречается в природе, но для синтеза белков используется только 20 видов аминокислот: аланин, аргинин, аспарагин, аспарагиновая кислота, валин, гистидин, глицин, глутамин, глутаминовая кислота, изолейцин, лейцин, лизин, метионин, пролин, серин, тирозин, треонин, триптофан, фенилаланин и цистеин (в белках цистеин может присутствовать в виде димера – цистина). Правда, в некоторых белках присутствуют и другие аминокислоты, помимо регулярно встречающихся двадцати, но они образуются в результате модификации какой-нибудь из двадцати перечисленных уже после того, как она включилась в белок.
Оптическая активность.
У всех аминокислот, за исключением глицина, к α-атому углерода присоединены четыре разные группы. С точки зрения геометрии, четыре разные группы могут быть присоединены двумя способами, и соответственно есть две возможные конфигурации, или два изомера, относящиеся друг к другу, как предмет к своему зеркальному отражению, т.е. как левая рука к правой. Одну конфигурацию называют левой, или левовращающей (L), а другую – правой, или правовращающей (D), поскольку два таких изомера различаются направлением вращения плоскости поляризованного света. В белках встречаются только L-аминокислоты (исключение составляет глицин; он может быть представлен лишь одной формой, поскольку у него две из четырех групп одинаковы), и все они обладают оптической активностью (поскольку имеется только один изомер). D-аминокислоты в природе редки; они встречаются в некоторых антибиотиках и клеточной оболочке бактерий.
Последовательность аминокислот.
Аминокислоты в полипептидной цепи располагаются не случайным образом, а в определенном фиксированном порядке, и именно этот порядок определяет функции и свойства белка. Варьируя порядок расположения 20 видов аминокислот, можно получить огромное число разных белков, точно так же, как из букв алфавита можно составить множество разных текстов.
В прошлом на определение аминокислотной последовательности какого-нибудь белка уходило нередко несколько лет. Прямое определение и теперь достаточно трудоемкое дело, хотя созданы приборы, позволяющие вести его автоматически. Обычно проще бывает определить нуклеотидную последовательность соответствующего гена и вывести из нее аминокислотную последовательность белка. К настоящему времени уже определены аминокислотные последовательности многих сотен белков. Функции расшифрованных белков, как правило, известны, и это помогает представить себе возможные функции сходных белков, образующихся, например, при злокачественных новообразованиях.
Сложные белки.
Белки, состоящие из одних только аминокислот, называют простыми. Часто, однако, к полипептидной цепи бывают присоединены атом металла или какое-нибудь химическое соединение, не являющееся аминокислотой. Такие белки называются сложными. Примером может служить гемоглобин: он содержит железопорфирин, который определяет его красный цвет и позволяет ему играть роль переносчика кислорода.
В названиях большинства сложных белков содержится указание на природу присоединенных групп: в гликопротеинах присутствуют сахара, в липопротеинах – жиры. Если от присоединенной группы зависит каталитическая активность фермента, то ее называют простетической группой. Нередко какой-нибудь витамин играет роль простетической группы или входит в ее состав. Витамин А, например, присоединенный к одному из белков сетчатки, определяет ее чувствительность к свету.
Третичная структура.
Важна не столько сама аминокислотная последовательность белка (первичная структура), сколько способ ее укладки в пространстве. По всей длине полипептидной цепи ионы водорода образуют регулярные водородные связи, которые придают ей форму спирали либо слоя (вторичная структура). Из комбинации таких спиралей и слоев возникает компактная форма следующего порядка – третичная структура белка. Вокруг связей, удерживающих мономерные звенья цепи, возможны повороты на небольшие углы. Поэтому с чисто геометрической точки зрения число возможных конфигураций для любой полипептидной цепи бесконечно велико. В действительности же каждый белок существует в норме только в одной конфигурации, определяемой его аминокислотной последовательностью. Структура эта не жесткая, она как бы «дышит» – колеблется вокруг некой средней конфигурации. Цепь складывается в такую конфигурацию, при которой свободная энергия (способность производить работу) минимальна, подобно тому как отпущенная пружина сжимается лишь до состояния, соответствующего минимуму свободной энергии. Нередко одна часть цепи бывает жестко сцеплена с другой дисульфидными (–S–S–) связями между двумя остатками цистеина. Отчасти именно поэтому цистеин среди аминокислот играет особо важную роль.
Сложность строения белков столь велика, что пока еще невозможно вычислить третичную структуру белка, если даже известна его аминокислотная последовательность. Но если удается получить кристаллы белка, то его третичную структуру можно определить по дифракции рентгеновских лучей.
У структурных, сократительных и некоторых других белков цепи вытянуты и несколько лежащих рядом слегка свернутых цепей образуют фибриллы; фибриллы, в свою очередь, складываются в более крупные образования – волокна. Однако большинство белков в растворе имеет глобулярную форму: цепи свернуты в глобуле, как пряжа в клубке. Свободная энергия при такой конфигурации минимальна, поскольку гидрофобные («отталкивающие воду») аминокислоты скрыты внутри глобулы, а гидрофильные («притягивающие воду») находятся на ее поверхности.
Многие белки – это комплексы из нескольких полипептидных цепей. Такое строение называется четвертичной структурой белка. Молекула гемоглобина, например, состоит из четырех субъединиц, каждая из которых представляет собой глобулярный белок.
Структурные белки благодаря своей линейной конфигурации образуют волокна, у которых предел прочности на разрыв очень высок, глобулярная же конфигурация позволяет белкам вступать в специфические взаимодействия с другими соединениями. На поверхности глобулы при правильной укладке цепей возникают определенной формы полости, в которых размещены реакционноспособные химические группы. Если данный белок – фермент, то другая, обычно меньшая, молекула какого-то вещества входит в такую полость подобно тому, как ключ входит в замок; при этом меняется конфигурация электронного облака молекулы под влиянием находящихся в полости химических групп, и это вынуждает ее определенным образом реагировать. Таким способом фермент катализирует реакцию. В молекулах антител тоже имеются полости, в которых различные чужеродные вещества связываются и тем самым обезвреживаются. Модель «ключа и замка», объясняющая взаимодействие белков с другими соединениями, позволяет понять специфичность ферментов и антител, т.е. их способность реагировать только с определенными соединениями.
Белки у разных видов организмов.
Белки, выполняющие одну и ту же функцию у разных видов растений и животных и потому носящие одно и то же название, имеют и сходную конфигурацию. Они, однако, несколько различаются по своей аминокислотной последовательности. По мере того как виды дивергируют от общего предка, некоторые аминокислоты в определенных положениях замещаются в результате мутаций другими. Вредные мутации, являющиеся причиной наследственных болезней, выбраковываются естественным отбором, но полезные или по крайней мере нейтральные могут сохраняться. Чем ближе друг к другу два каких-нибудь биологических вида, тем меньше различий обнаруживается в их белках.
Некоторые белки меняются относительно быстро, другие весьма консервативны. К последним принадлежит, например, цитохром с – дыхательный фермент, имеющийся у большинства живых организмов. У человека и шимпанзе его аминокислотные последовательности идентичны, а в цитохроме с пшеницы иными оказались лишь 38% аминокислот. Даже сравнивая человека и бактерии, сходство цитохромов с (различия затрагивают здесь 65% аминокислот) все еще можно заметить, хотя общий предок бактерии и человека жил на Земле около двух миллиардов лет назад. В наше время сравнение аминокислотных последовательностей часто используют для построения филогенетического (генеалогического) древа, отражающего эволюционные связи между разными организмами.
Денатурация.
Синтезированная молекула белка, складываясь, приобретает свойственную ей конфигурацию. Эта конфигурация, однако, может разрушиться при нагревании, при изменении рН, под действием органических растворителей и даже при простом взбалтывании раствора до появления на его поверхности пузырьков. Измененный таким образом белок называют денатурированным; он утрачивает свою биологическую активность и обычно становится нерастворимым. Хорошо знакомые всем примеры денатурированного белка – вареные яйца или взбитые сливки. Небольшие белки, содержащие всего лишь около сотни аминокислот, способны ренатурировать, т.е. вновь приобретать исходную конфигурацию. Но большинство белков превращается при этом просто в массу спутанных полипептидных цепей и прежнюю конфигурацию не восстанавливает.
Одна из главных трудностей при выделении активных белков связана с их крайней чувствительностью к денатурации. Полезное применение это свойство белков находит при консервировании пищевых продуктов: высокая температура необратимо денатурирует ферменты микроорганизмов, и микроорганизмы погибают.
СИНТЕЗ БЕЛКОВ
Для синтеза белка живой организм должен располагать системой ферментов, способных присоединять одну аминокислоту к другой. Необходим также источник информации, которая бы определяла, какие именно аминокислоты следует соединять. Поскольку в организме имеются тысячи видов белков и каждый из них состоит в среднем из нескольких сотен аминокислот, необходимая информация должна быть поистине огромной. Хранится она (подобно тому, как хранится запись на магнитной ленте) в молекулах нуклеиновых кислот, из которых состоят гены.
Активация ферментов.
Синтезированная из аминокислот полипептидная цепь – это далеко не всегда белок в его окончательной форме. Многие ферменты синтезируются сначала в виде неактивных предшественников и переходят в активную форму лишь после того, как другой фермент удалит на одном из концов цепи несколько аминокислот. В такой неактивной форме синтезируются некоторые из пищеварительных ферментов, например трипсин; эти ферменты активируются в пищеварительном тракте в результате удаления концевого фрагмента цепи. Гормон инсулин, молекула которого в активной форме состоит из двух коротких цепей, синтезируется в виде одной цепи, т.н. проинсулина. Затем средняя часть этой цепи удаляется, а оставшиеся фрагменты связываются друг с другом, образуя активную молекулу гормона. Сложные белки образуются лишь после того, как к белку будет присоединена определенная химическая группа, а для этого присоединения часто тоже требуется фермент.
Метаболический кругооборот.
После скармливания животному аминокислот, меченных радиоактивными изотопами углерода, азота или водорода, метка быстро включается в его белки. Если меченые аминокислоты перестают поступать в организм, то количество метки в белках начинает снижаться. Эти эксперименты показывают, что образовавшиеся белки не сохраняются в организме до конца жизни. Все они, за немногими исключениями, находятся в динамичном состоянии, постоянно распадаются до аминокислот, а затем вновь синтезируются.
Некоторые белки распадаются, когда гибнут и разрушаются клетки. Это постоянно происходит, например, с эритроцитами и клетками эпителия, выстилающего внутреннюю поверхность кишечника. Кроме того, распад и ресинтез белков протекают и в живых клетках. Как ни странно, о распаде белков известно меньше, чем об их синтезе. Ясно, однако, что в распаде участвуют протеолитические ферменты, сходные с теми, которые расщепляют белки до аминокислот в пищеварительном тракте.
Период полураспада у разных белков различен – от нескольких часов до многих месяцев. Единственное исключение – молекулы коллагена. Однажды образовавшись, они остаются стабильными, не обновляются и не замещаются. Со временем, однако, меняются некоторые их свойства, в частности эластичность, а поскольку они не обновляются, следствием этого оказываются определенные возрастные изменения, например появление морщин на коже.
Синтетические белки.
Химики давно уже научились полимеризовать аминокислоты, но аминокислоты соединяются при этом неупорядоченно, так что продукты такой полимеризации мало похожи на природные. Правда, имеется возможность соединять аминокислоты в заданном порядке, что позволяет получать некоторые биологически активные белки, в частности инсулин. Процесс достаточно сложен, и таким способом удается получать лишь те белки, в молекулах которых содержится около сотни аминокислот. Предпочтительнее вместо этого синтезировать или выделить нуклеотидную последовательность гена, соответствующую желаемой аминокислотной последовательности, а затем ввести этот ген в бактерию, которая и будет вырабатывать путем репликации большое количество нужного продукта. У этого метода, впрочем, тоже есть свои недостатки.
БЕЛКИ И ПИТАНИЕ
Когда белки в организме распадаются до аминокислот, эти аминокислоты могут быть снова использованы для синтеза белков. В то же время и сами аминокислоты подвержены распаду, так что они реутилизируются не полностью. Ясно также, что в период роста, при беременности и заживлении ран синтез белков должен превышать распад. Некоторые же белки организм непрерывно теряет; это белки волос, ногтей и поверхностного слоя кожи. Поэтому для синтеза белков каждый организм должен получать аминокислоты с пищей.
Источники аминокислот.
Зеленые растения синтезируют из СО2, воды и аммиака или нитратов все 20 аминокислот, встречающихся в белках. Многие бактерии тоже способны синтезировать аминокислоты при наличии сахара (или какого-нибудь его эквивалента) и фиксированного азота, но и сахар, в конечном счете, поставляется зелеными растениями. У животных способность к синтезу аминокислот ограниченна; они получают аминокислоты, поедая зеленые растения или других животных. В пищеварительном тракте поглощенные белки расщепляются до аминокислот, последние всасываются, и уже из них строятся белки, характерные для данного организма. Ни один поглощенный белок не включается в структуры тела как таковой. Единственное исключение заключается в том, что у многих млекопитающих часть материнских антител может в интактном виде попасть через плаценту в кровоток плода, а через материнское молоко (особенно у жвачных) быть передано новорожденному сразу же после его появления на свет.
Потребность в белках.
Ясно, что для поддержания жизни организм должен получать с пищей некоторое количество белков. Однако размеры этой потребности зависят от ряда факторов. Организму необходима пища и как источник энергии (калорий), и как материал для построения его структур. На первом месте стоит потребность в энергии. Это значит, что, когда углеводов и жиров в рационе мало, пищевые белки используются не для синтеза собственных белков, а в качестве источника калорий. При длительном голодании даже собственные белки расходуются на удовлетворение энергетических нужд. Если же углеводов в рационе достаточно, то потребление белков может быть снижено.
Азотистый баланс.
В среднем ок. 16% всей массы белка составляет азот. Когда входившие в состав белков аминокислоты расщепляются, содержавшийся в них азот выводится из организма с мочой и (в меньшей мере) с калом в виде различных азотистых соединений. Удобно поэтому для оценки качества белкового питания использовать такой показатель, как азотистый баланс, т.е. разность (в граммах) между количеством азота, поступившего в организм, и количеством выведенного азота за сутки. При нормальном питании у взрослого эти количества равны. У растущего организма количество выведенного азота меньше количества поступившего, т.е. баланс положителен. При нехватке белков в рационе баланс отрицателен. Если калорий в рационе достаточно, но белки в нем полностью отсутствуют, организм сберегает белки. Белковый обмен при этом замедляется, и повторная утилизация аминокислот в синтезе белка идет с максимально возможной эффективностью. Однако потери неизбежны, и азотистые соединения все же выводятся с мочой и частично с калом. Количество азота, выведенного из организма за сутки при белковом голодании, может служить мерой суточной нехватки белка. Естественно предположить, что, введя в рацион количество белка, эквивалентное этому дефициту, можно восстановить азотистый баланс. Однако это не так. Получив такое количество белка, организм начинает использовать аминокислоты менее эффективно, так что для восстановления азотистого баланса требуется некоторое дополнительное количество белка.
Если количество белка в рационе превышает необходимое для поддержания азотистого баланса, то вреда от этого, по-видимому, нет. Избыток аминокислот просто используется как источник энергии. В качестве особенно яркого примера можно сослаться на эскимосов, которые потребляют мало углеводов и примерно в десять раз больше белка, чем требуется для поддержания азотистого баланса. В большинстве случаев, однако, использование белка в качестве источника энергии невыгодно, поскольку из определенного количества углеводов можно получить намного больше калорий, чем из такого же количества белка. В бедных странах население получает необходимые калории за счет углеводов и потребляет минимальное количество белка.
Если необходимое число калорий организм получает в форме небелковых продуктов, то минимальное количество белка, обеспечивающее поддержание азотистого баланса, составляет для взрослого человека ок. 30 г в день. Примерно столько белка содержится в четырех ломтиках хлеба или 0,5 л молока. Оптимальным считают обычно несколько большее количество; рекомендуется от 50 до 70 г.
Незаменимые аминокислоты.
До сих пор белок рассматривался как нечто целое. Между тем для того, чтобы мог идти синтез белка, в организме должны присутствовать все необходимые аминокислоты. Некоторые из аминокислот организм животного сам способен синтезировать. Их называют заменимыми, поскольку они не обязательно должны присутствовать в рационе, – важно лишь, чтобы в целом поступление белка как источника азота было достаточным; тогда при нехватке заменимых аминокислот организм может синтезировать их за счет тех, что присутствуют в избытке. Остальные, «незаменимые», аминокислоты не могут быть синтезированы и должны поступать в организм с пищей. Для человека незаменимыми являются валин, лейцин, изолейцин, треонин, метионин, фенилаланин, триптофан, гистидин, лизин и аргинин. (Хотя аргинин и может синтезироваться в организме, его относят к незаменимым аминокислотам, поскольку у новорожденных и растущих детей он образуется в недостаточном количестве. С другой стороны, для человека зрелого возраста поступление некоторых из этих аминокислот с пищей может стать необязательным.)
Этот список незаменимых аминокислот приблизительно одинаков также и у других позвоночных и даже у насекомых. Питательную ценность белков обычно определяют, скармливая их растущим крысам и следя за прибавкой веса животных.
Питательная ценность белков.
Питательную ценность белка определяют по той незаменимой аминокислоте, которой более всего не хватает. Проиллюстрируем это на примере. В белках нашего тела содержится в среднем ок. 2% триптофана (по весу). Допустим, что в рацион входит 10 г белка, содержащего 1% триптофана, и что других незаменимых аминокислот в нем достаточно. В нашем случае 10 г этого неполноценного белка по сути эквивалентны 5 г полноценного; остальные 5 г могут послужить только источником энергии. Отметим, что, поскольку аминокислоты в организме практически не запасаются, а для того чтобы мог идти синтез белка, должны одновременно присутствовать все аминокислоты, эффект от поступления незаменимых аминокислот можно обнаружить лишь в том случае, если все они поступят в организм одновременно.
Усредненный состав большей части животных белков близок к усредненному составу белков человеческого тела, так что аминокислотная недостаточность нам вряд ли грозит, если наш рацион богат такими продуктами, как мясо, яйца, молоко и сыр. Однако есть белки, например желатин (продукт денатурации коллагена), которые содержат очень мало незаменимых аминокислот. Растительные белки, хотя они в этом смысле и лучше желатина, тоже бедны незаменимыми аминокислотами; особенно мало в них лизина и триптофана. Тем не менее и чисто вегетарианскую диету вовсе нельзя считать вредной, если только при этом потребляется несколько большее количество растительных белков, достаточное для того, чтобы обеспечить организм незаменимыми аминокислотами. Больше всего белка содержится у растений в семенах, особенно в семенах пшеницы и различных бобовых культур. Богаты белком также и молодые побеги, например у спаржи.
Синтетические белки в рационе.
Добавляя небольшие количества синтетических незаменимых аминокислот или богатых ими белков к неполноценным белкам, например к белкам кукурузы, можно значительно повысить питательную ценность последних, т.е. тем самым как бы увеличить количество потребляемого белка. Другая возможность состоит в выращивании бактерий или дрожжей на углеводородах нефти с добавлением нитратов или аммиака в качестве источника азота. Полученный таким путем микробный белок может служить кормом для домашней птицы или скота, а может и непосредственно потребляться человеком. Третий, широко применяющийся, метод использует особенности физиологии жвачных животных. У жвачных в начальном отделе желудка, т.н. рубце, обитают особые формы бактерий и простейших, которые превращают неполноценные растительные белки в более полноценные микробные белки, а эти, в свою очередь, – после переваривания и всасывания – превращаются в животные белки. К корму скота можно добавить мочевину – дешевое синтетическое азотсодержащее соединение. Обитающие в рубце микроорганизмы используют азот мочевины для превращения углеводов (которых в корме значительно больше) в белок. Около трети всего азота в корме скота может поступать в виде мочевины, что по сути и означает в определенной мере химический синтез белка.
Эта тема входит в бесплатную часть моего курса по биохимии.
Перед тем, как начать разбираться со строением белка и его функциями нужно кое-что прояснить. А что вообще такое белок? Как организм создает такое многообразие белков, если имеет ограниченный запас аминокислот?
Белок — это полимерная молекула, которая состоит из молекул поменьше — мономеров. Мономеры для белка — аминокислоты, которые соединяются между собой пептидными связями. Но здесь появляется вопрос, а сколько аминокислот нужно соединить между собой для того, чтобы получить белок? Больше 50. Если их будет меньше, то такая молекула называется пептид.
Все аминокислоты соединяются друг с другом в определенной последовательности, которая уникальна для каждого белка. Кто это контролирует? ДНК — ведь она и кодирует все эти аминокислоты. Ну а теперь можем начинать разбираться со структурой.
Первичная структура белка
Представляем себе огромную цепь, которая состоит из кучи звеньев. Такой же вид у первичной структуры белка — это просто полипептидная цепь, которая включает в себя аминокислоты. Их всего 20 штук. Но представьте себе сколько комбинаций можно сделать с этими 20 аминокислотами, соединяя их в разных последовательностях? Правильно, бесконечное множество.
Теперь посмотрим на молекулу поближе. Можно увидеть, что у этой большой молекулы есть свободная аминогруппа — N-конец, и свободная карбоксильная группа — C-конец. Молекулу всегда рисуют с N-конца и заканчивают C-концом.
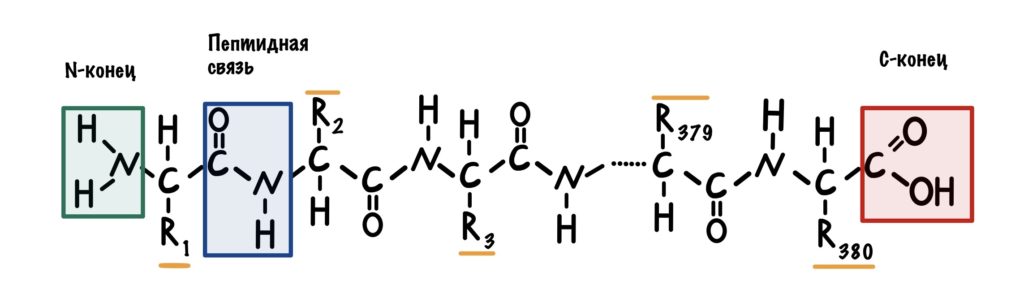
Все остальные аминокислоты связаны друг с другом пептидной связью. Сумма всех пептидных связей — это пептидный остов. В него не входят радикалы, N-концы и C-концы. Будет понятнее, если я нарисую всё в одну линию.
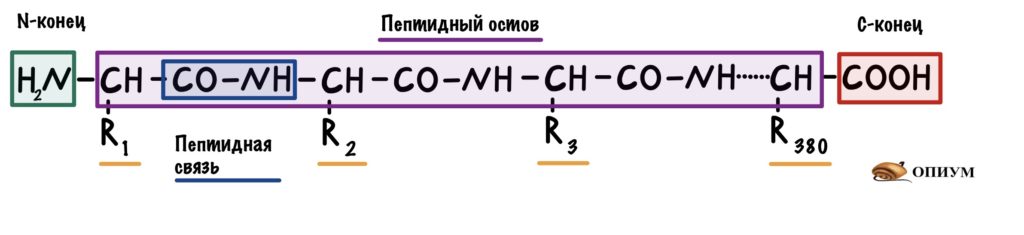
В первичной структуре есть только пептидные связи
Важный момент! Первичная структура определяет какими будет вторичная, третичная и четвертичная (если такая есть) структуры. Это как мини-ДНК для белковой молекулы. Но я об этом еще напомню, даже несколько раз, вот такая я зануда.
Вторичная структура белка
Ну что, а теперь давайте усложнять все! Что можно сделать с цепью, которую мы рассмотрели до этого? Может закрутим цепь вокруг чего-то? Или просто растянем ее вдаль? Можно даже растянуть цепь и повернуть ее обратно, чтобы начало и конец были в одном месте. Что вам больше нравится?
Какой бы вариант не выбрали — он верный, но все зависит от того, какой тип вторичной структуры будет у белка. Напоминаю, что это определяется первичной :]
1. Альфа-спираль
Это для ребят, которые выбрали закрутить цепь вокруг чего-то. Правда закручивается она вокруг самой себя. В этой цепи происходит образование водородной связи между кислородом (карбоксильного атома углерода) и водородом (связан с азотом).
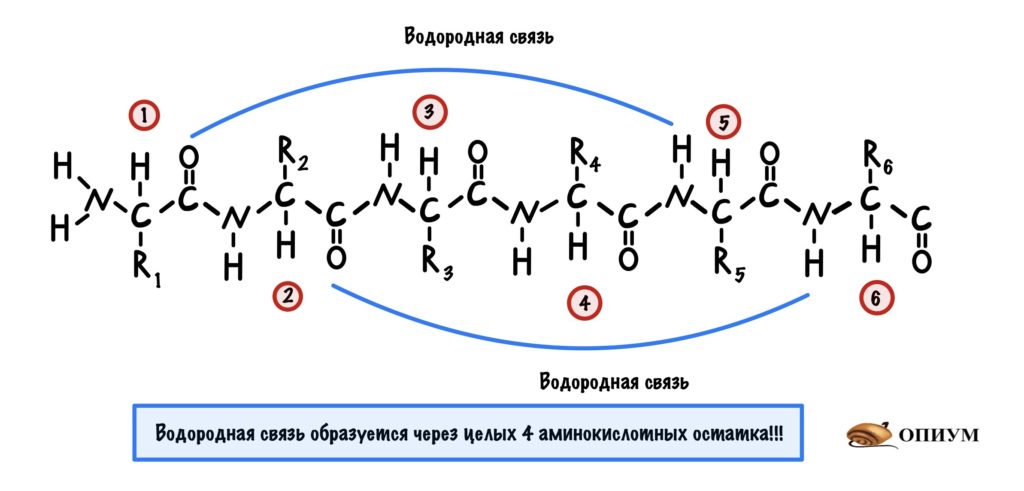
Далековато как-то. Как так выходит? Все из-за того, что происходит закручивание пептидного остова. Сделаем такую же картинку как сверху, но в виде атомов. Не забудем крутануть её немного…
Каждый цвет — это остаток аминокислоты, только азоты и кислороды я оставил одного цвета, а то запутаемся ещё. Ещё альфа-углерод тут трех валентный и все атомы отмечать не стал, а то слишком громоздко получается. Думаю, что смысл понятен.
Какой сделаем вывод? Альфа-спираль похожа на корсет!!! Правда вместо него — водородные связи, которые стягивают её. Если присмотреться к радикалам, то они выглядывают как иголки из ёлки в разные стороны. Вот рисунок попроще.
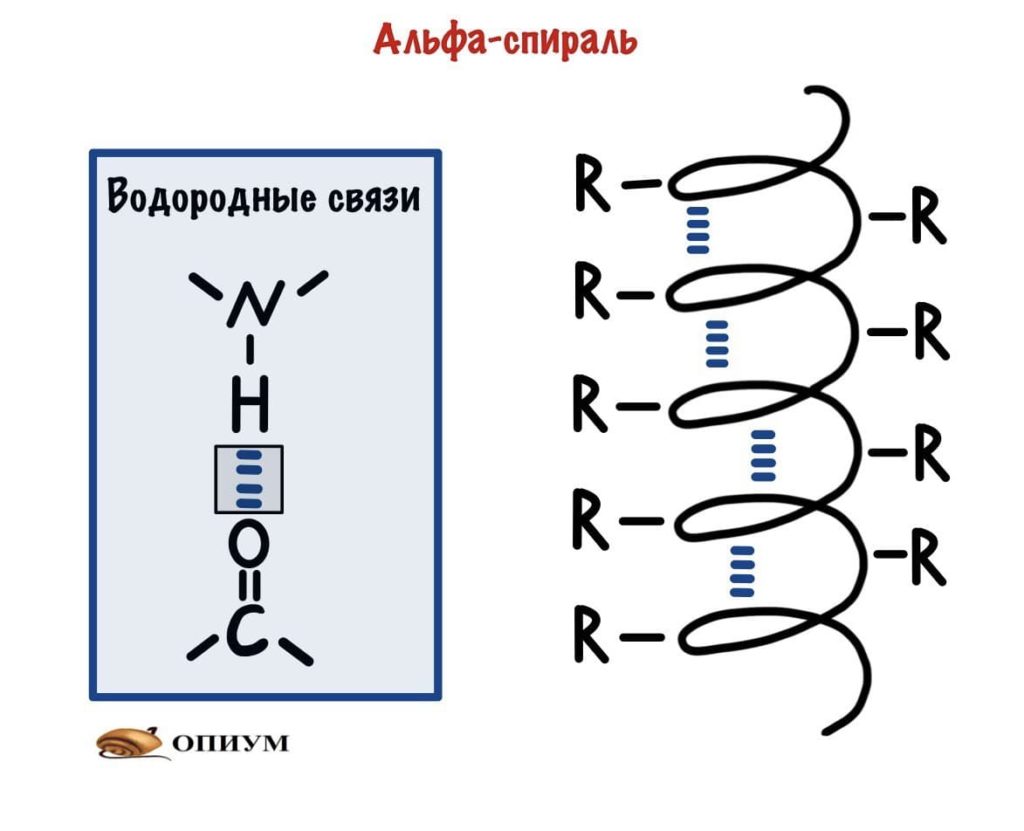
Ой, а вы, наверное, ждали какой то супер крутой рисунок? А я тут такое подсунул, ладно держите вот немного получше. Правда он без радикалов и водородных связей. Но здесь лучше видно, что на один виток спирали приходится 3,6 аминокислотных остатка.

Альфа-спираль, конечно, очень красивый вариант, но он не всегда образуется. Есть аминокислоты, которые могут помешать этому:
Пролин. В его молекуле находится жесткое кольцо, которое всегда вызывает поворот. Такая уж у него структура. Если вставить его в альфа спираль, то произойдет поворот на 180 градусов. Ещё у пролина нет свободного водорода у азота. Получается, что он не может образовывать водородную связь, которая так важна для альфа-спирали.
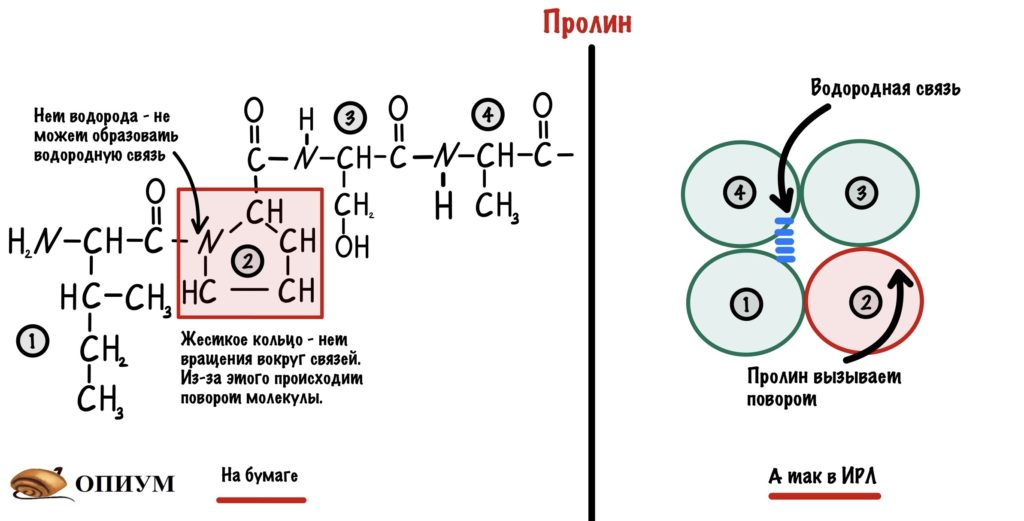
Глицин. Если пролин слишком жесткий, то глицин, наоборот, очень гибкий. У него ведь нет радикала, поэтому если вставить слишком много глицинов, то прощай альфа-спираль. Иногда из-за него тоже происходит поворот молекулы на 180 градусов — прямо как на картинке выше.
Аминокислоты с большими радикалами. Большие радикалы круто, но если они будут расположены рядом, то это может помешать формированию альфа-спирали. Они просто мешают друг другу.
И последнее, одинаково заряженные аминокислоты. При одинаковом заряде они отталкиваются допустим: рядом расположены лизин и аргинин, или аспартат и глутамат. Ну и другие комбинации.
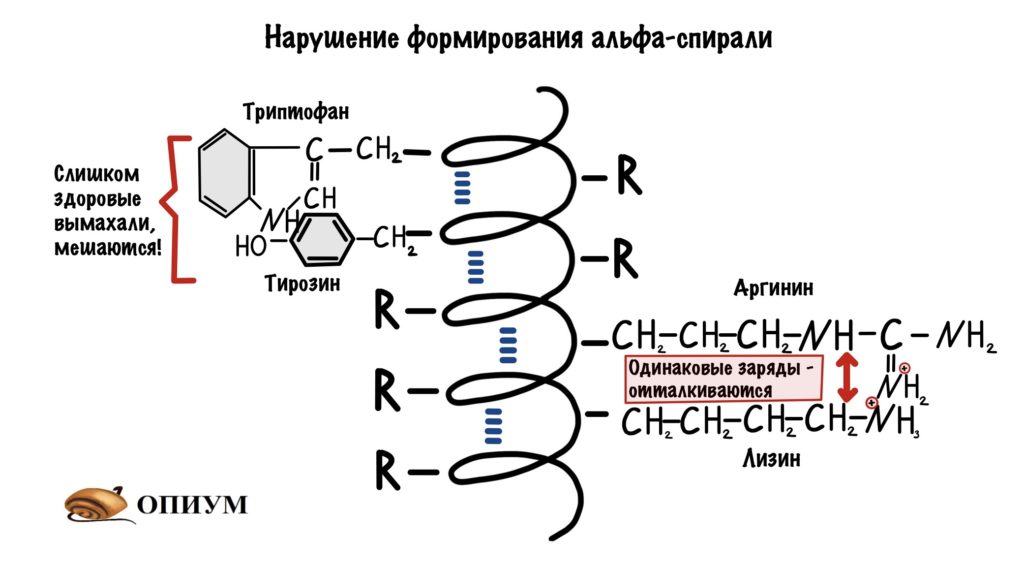
Если в полипептидной цепи много включений с такими радикалами, то чаще всего образуется…
2. Бета-складчатый слой
Здесь молекула будет похожа на лист, который состоит из нескольких тяжей. А они похожи на горки из игры Gravity defied. Хотя кому я это говорю….
Ладно, давайте просто посмотрим на рисунок, а лучше на два — один сбоку, а другой сверху. Что видим? Один тяж с горками, которые идут то вверх, то вниз. Радикалы аминокислот расположены над или под плоскостью листа.
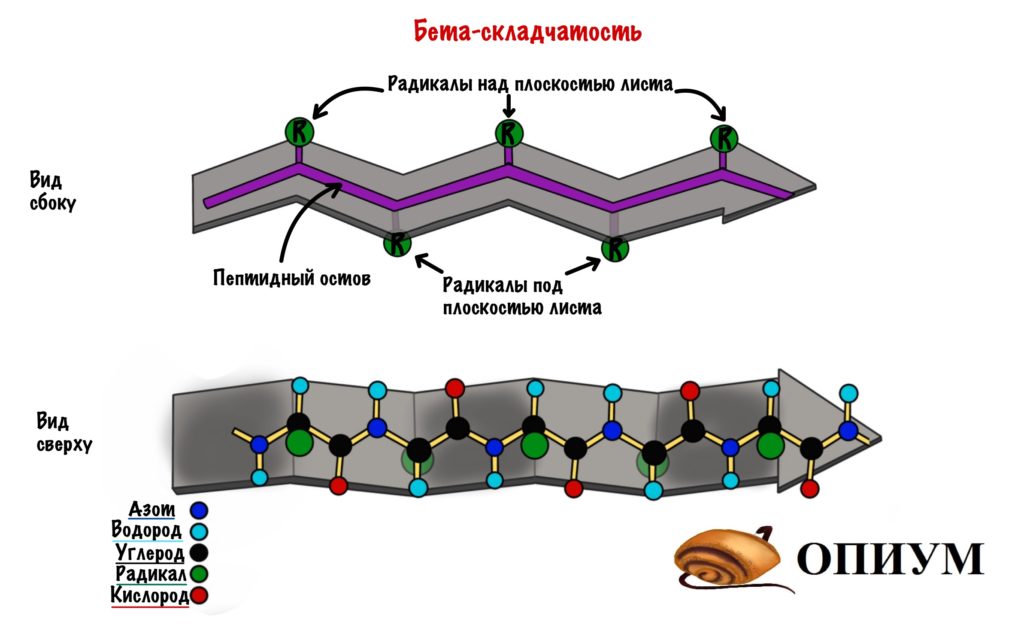
Теперь можно составить из тяжей бета-складчатый слой. Здесь, как всегда, несколько вариантов. Первый вариант — параллельный лист, тогда направление тяжей одинаковое. Если оно разное, то он антипараллельный. Стабилизируется этот лист тоже с помощью водородных связей, прямо как альфа-спираль. Только вот есть один нюанс. Если в альфа-спирали есть четкая зависимость образования связей — через 4 аминокислотных остатка, то здесь такого нет. Например, водородными связями могут соединяться 5 остаток и 22.
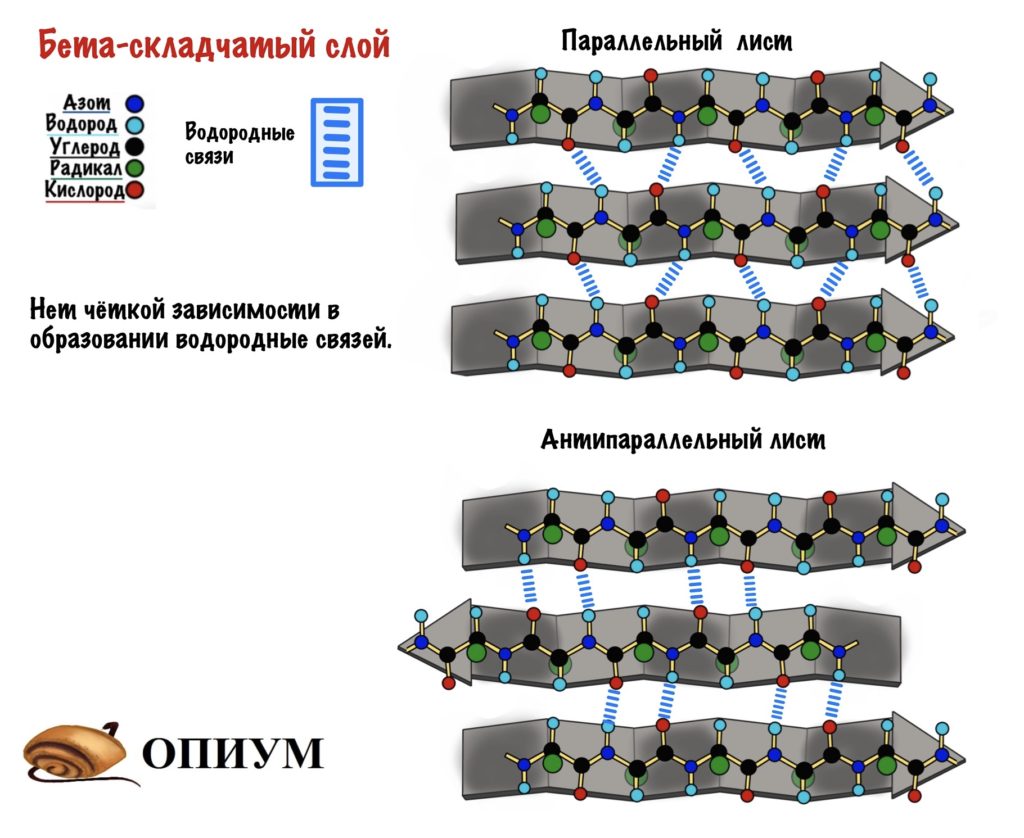
Когда мы разбирали альфа-спираль, то сказали что пролин и иногда глицин вызывают поворот на 180 градусов. У этого есть свое название: бета-поворот.
3. Беспорядочный клубок
Это последний вариант. Здесь нет никаких спиралей или бета-складчатости, просто получается вот такая белиберда.

Что общего у всех вторичных структур? В их образовании участвует только пептидный остов. Радикалы пока что отдыхают. Ну и второе:
Водородные связи стабилизируют вторичную структуру
Ой, а от чего зависит какую вторичную структуру примет молекула?
А действительно, почему какая-то молекула принимает форму альфа-спирали, а другая бета-складчатости? Хороший вопрос, и у меня есть ответ на него: от торсионных углов. Я разбирал это в прошлой статье — кликай сюда, а потом возвращайся. Так, мы говорили о том, что углы бывают разными, но для каждой вторичной структуры характерны строго определенные углы. Есть специальные карты Рамачандрана, на которых указаны эти углы — все данные получены экспериментально.
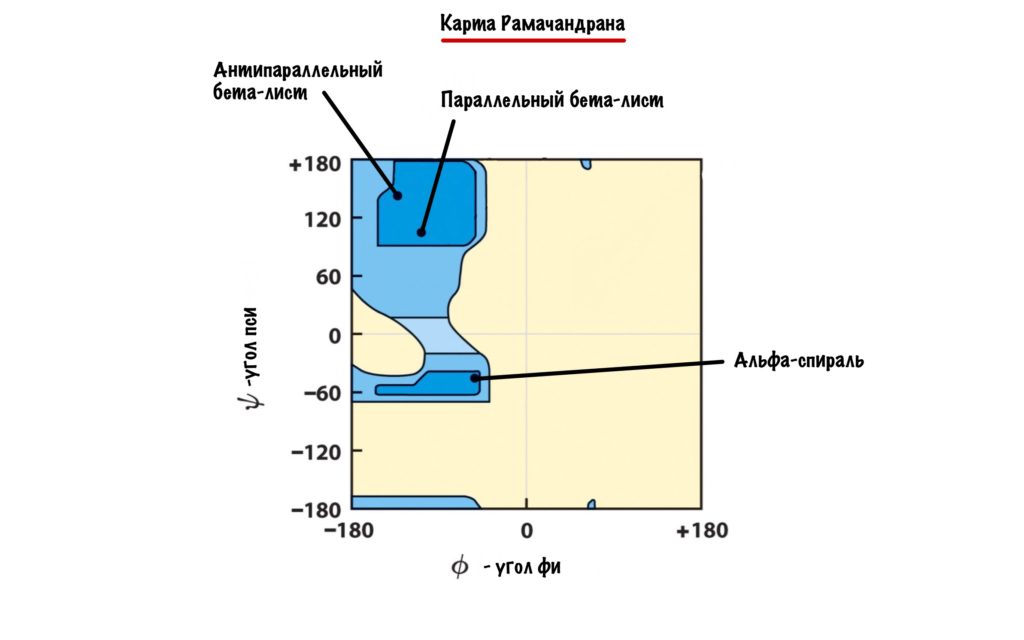
Здесь можно посмотреть как будут выглядеть молекулы аминокислот с такими углами. Но вот вам фоточка, если лень.
Надеюсь, что теперь понятно почему и как формируется вторичная структура. Ах да, конечно же, все эти углы определяются первичной структурой!
Супервторичная
структура белка
До этого мы разбирали вторичные структуры изолированно, но представьте себе очень длинную полипептидную цепь. Не может же она вся закручиваться в альфа-спираль или становиться бета-складчатой. Хотя иногда и может, но об этом позднее. Чаще всего белок — это комбинация из альфа-спиралей, бета-тяжей и беспорядочных клубков. То есть может это выглядеть примерно вот-так.
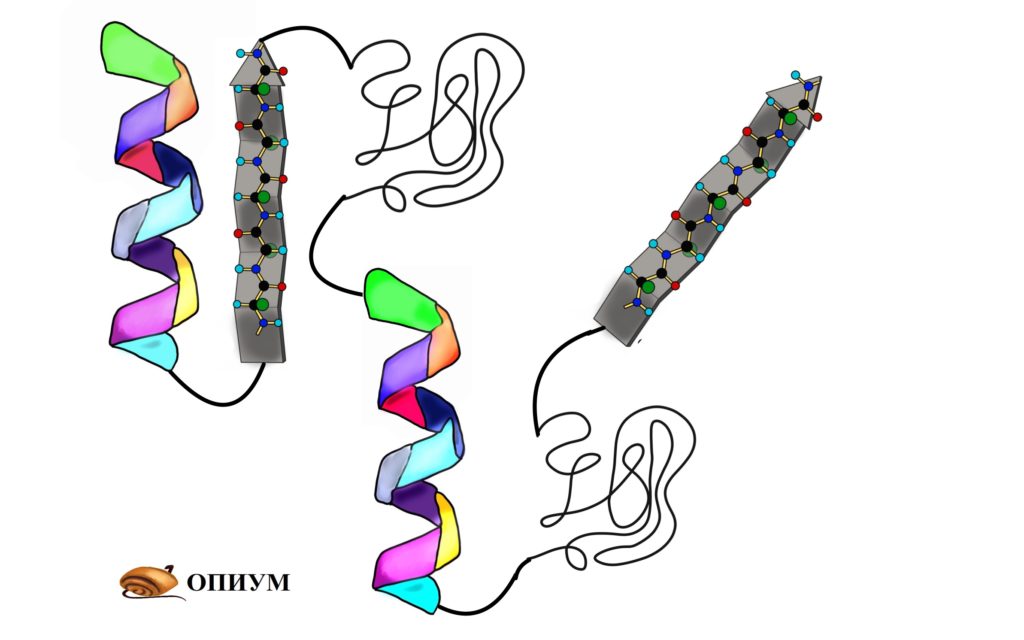
Поймите, что супервторичная структура белка не стоит выше, чем вторичная. Это просто название, которое неправильно отражает суть, поэтому оно мне не нравится. На западе используют другое название — структурные мотивы, оно намного лучше. Вот в чем его суть: хоть у нас огромное количество самых разных белков, но в них есть определенные повторяющиеся паттерны — это и есть мотивы. Наиболее частые из них: бета-тяж + альфа-спираль + бета-тяж (бета-альфа-бета петля); альфа-спираль + бета-поворот + альфа-спираль; бета-бочонок.
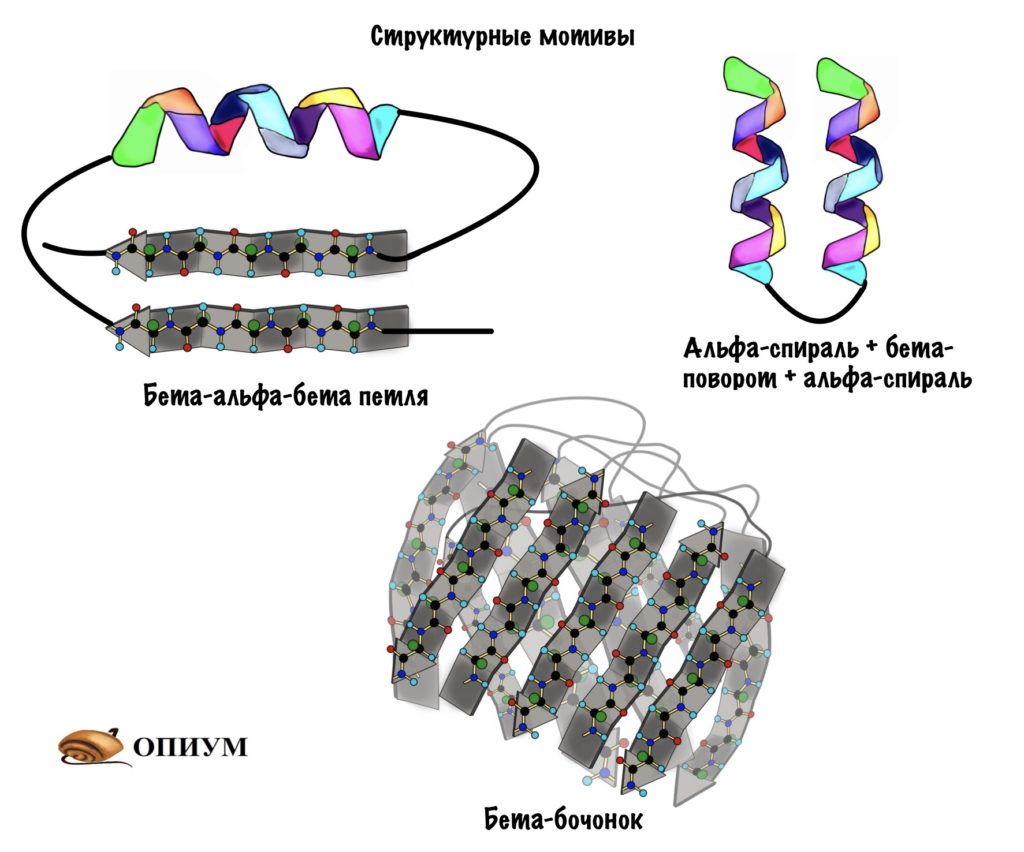
Мотивов очень много, но думаю смысл понятен. Простые мотивы могут объединяться и образовывать мотивы посложнее.
Я использовал в иллюстрациях прошлые картинки, но помните, что эти альфа-спирали и бета-тяжи отличаются друг от друга аминокислотными остатками — они очень разные! Просто перерисовывать все это не хочется.
Третичная структура белка
Вот этот уровень уже повыше, на нем белок начинает выполнять свою функцию — впахивать, как проклятый. Но сначала нужно остановиться ненадолго и поговорить. Спокойно, я же сказал — ненадолго.
Согласитесь, что у белков очень много функций. Какой-то переносит кислород, а другой входит в состав кости и обеспечивает ее прочность. Белки мышечной ткани вообще обеспечивают движение. Давайте попробуем выделить две глобальные, но не совсем верные, функции: структурная и связывания. Одни белки входят в структуру мышц, костей, волос и так далее. А другие что-то связывают: ферменты связываются с субстратом, а гемоглобин с кислородом. А где-то бравое антитело падает на амбразуру для того, чтобы не пропустить бактерию в организм. Это конечно все очень грубо, но пусть будет так.
И все это я к чему. Существует два больших класса белков: фибриллярные — коллаген, эластин, кератин. Эти ребята занимаются поддержкой, такие вот суппорты. Фибрилла — это нить. Так что они очень длинные, а когда огромное количество нитей связывается в одну, то они становятся очень прочными. Фибриллярные белки — это атланты, которые держат наш организм на своих плечах. А мы не особо благодарные ребята, потому что забьем на них. Но только в этой статье.
В основном биохимия занимается другим классом — глобулярными белками. Эти ребята не только связывают — у них огромное количество функций. С этими функциями и пытается разобраться биохимия. Глобула — шар. Вроде это все, теперь можем приступать.
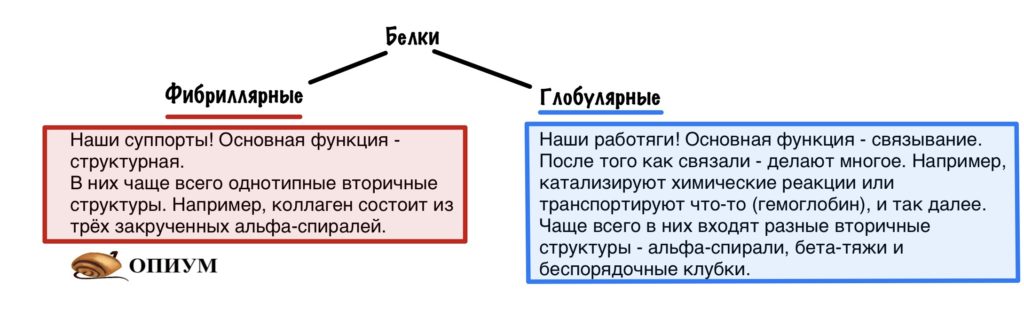
На прошлом этапе мы собрали разные вторичные структуры в мотивы, ну а дальше то что? Теперь нам нужно скрутить все это в компактный шарик — глобулу. Здесь, наконец-то, пригодятся наши лентяи — радикалы. Вспоминаем, что радикалы бывают полярные и неполярные. Когда глобула скручивается, то она прячет гидрофобные остатки аминокислот внутрь этого шарика, а гидрофильные выставляет наружу. Оно и понятно, все-таки глобулы находятся в организме, а у нас почти везде вода.
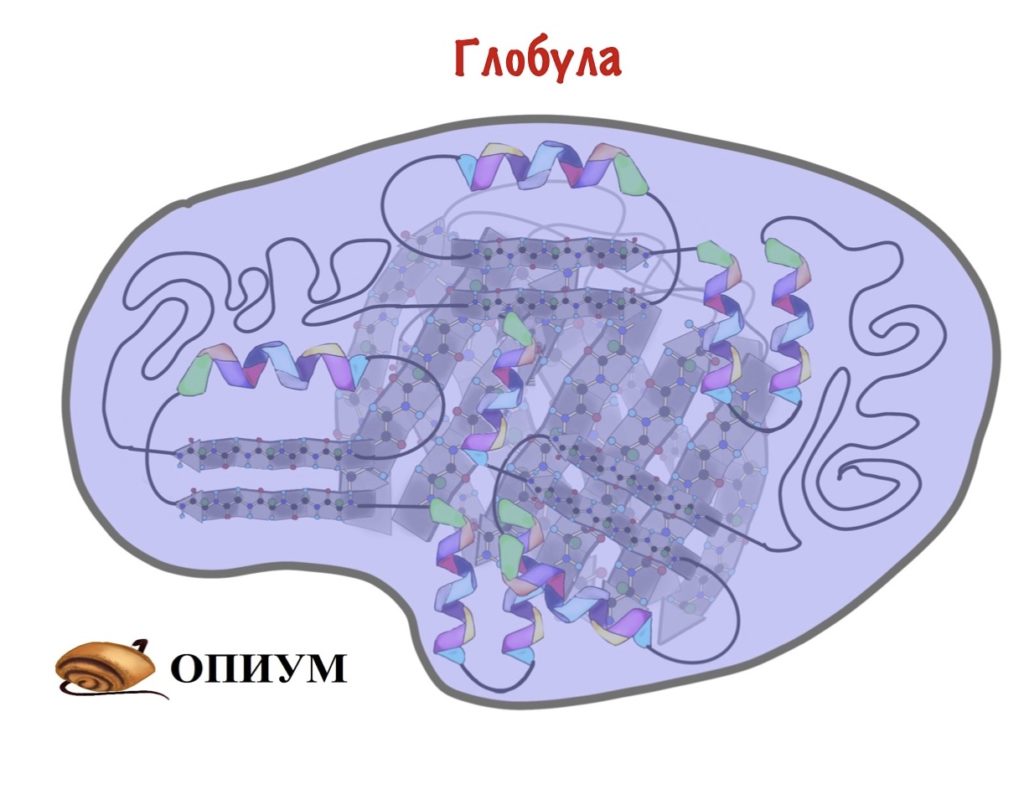
Скручивание — удивительный процесс. Здесь начинают взаимодействовать очень (очень-очень!) отдаленные аминокислотные остатки. Представьте, что тридцатый остаток взаимодействует с триста семидесятым. При этом все настолько предопределено первичной структурой, что радикалы взаимодействуют максимально точно. А взаимодействий ведь не мало!
Кстати о них, какими они бывают:
- Водородные связи — куда уж без них.
- Гидрофобное слипание — ведь глобула прячет свои гидрофобные остатки, так что они взаимодействуют друг с другом.
- Ионные связи — между разнозаряженными радикалами.
- Ван-дер-Вальсовы силы.
- Ковалентная связь между остатками цистеина (дисульфидная) — самая прочная.
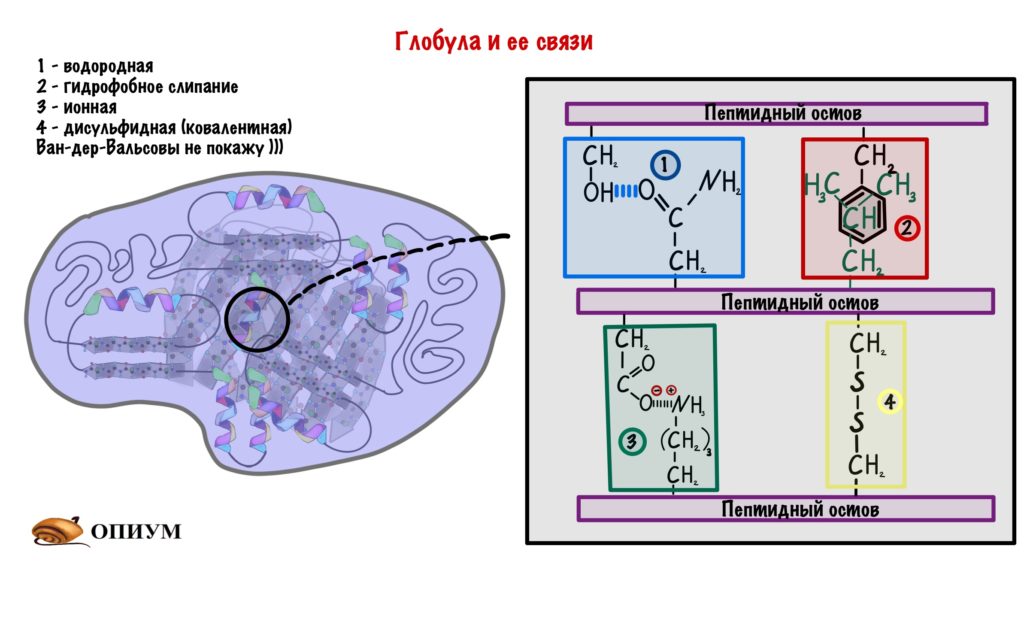
Про все эти связи у меня есть статейка ;] Ещё раз сказу, что здесь взаимодействуют только радикалы.
Когда глобула сложилась в пространстве, то всю эту сложную структуру называют конформацией (получается, что конформация — это положение атомов друг относительно друга в пространстве). Есть еще кое-что интересное: посмотрите на связи, которые образуют эту структуру. Большая часть из них — это силы слабого взаимодействия между молекулами. Это значит, что они очень легко рвутся, даже простого повышения температуры на несколько градусов хватит для того, чтобы эти связи разорвались. Как выйти из такого положения такой большой молекуле? Дело в том, что таких связей настолько много, что существует конформационная лабильность. По сути это означает, что некоторые связи могут рваться, а другие тут же образовываться.
Какой можно сделать вывод из всего этого? Не стоит думать о третичной структуре белка, как о чем-то статичном. Представьте ее как дом, который меняет свой цвет при повышении или понижении температуры, еще он может менять свой размер в зависимости от того идет дождь или нет. Какой странный дом…. В таком долго не проживешь.
Некоторые участки глобулы такие чсвшники, что собираются отдельно от всей остальной молекулы. Эти части называются доменами. Домен собирается в мини-третичную структуру самостоятельно, их даже может быть несколько. Чаще всего они имеют какую-то важную задачу, например, входят в состав активного центра.
Строение активного центра
Стоп-стоп-стоп. Это тиво еще такое? Ты про это ничего не говорил. Точно, помните мы сказали, что с этого уровня белок начинает пахать? А задача глобулы — это связать что-то, опять же грубо. Так вот, как она все это делает? Да-да, через активный центр, такие вы умные конечно… В чем прикол активного центра? Он должен соответствовать молекуле, с которой будет взаимодействовать. Это называется комплементарностью. Не путать с комплиментами.
Активный центр — это замок, а другая молекула — ключ, которые должны подходить друг другу. Такие вот соулмейты. Хотя к некоторым активным центрам могут подходить много ключиков. Связи, которые образуются в активном центре — слабые: чаще всего ионные, водородные и Ван-дер-Вальсовы. Но иногда могут быть и ковалентными, но не будем забегать вперёд — об этом мы поговорим, когда будем разбирать ферменты.
Ну а теперь, как все это работает. В активном центре располагается уникальная последовательность аминокислот, допустим там будет две положительнозаряженных и две отрицательнозаряженных аминокислоты. А у молекулы, с которой происходит взаимодействие, будет: две отрицательных группы и две положительных. Форма молекулы совпадает с формой активного центра. Кстати, у молекулы, которая взаимодействует с активным центром тоже есть свое название — лиганд. Надоели уже эти названия? Мне тоже…
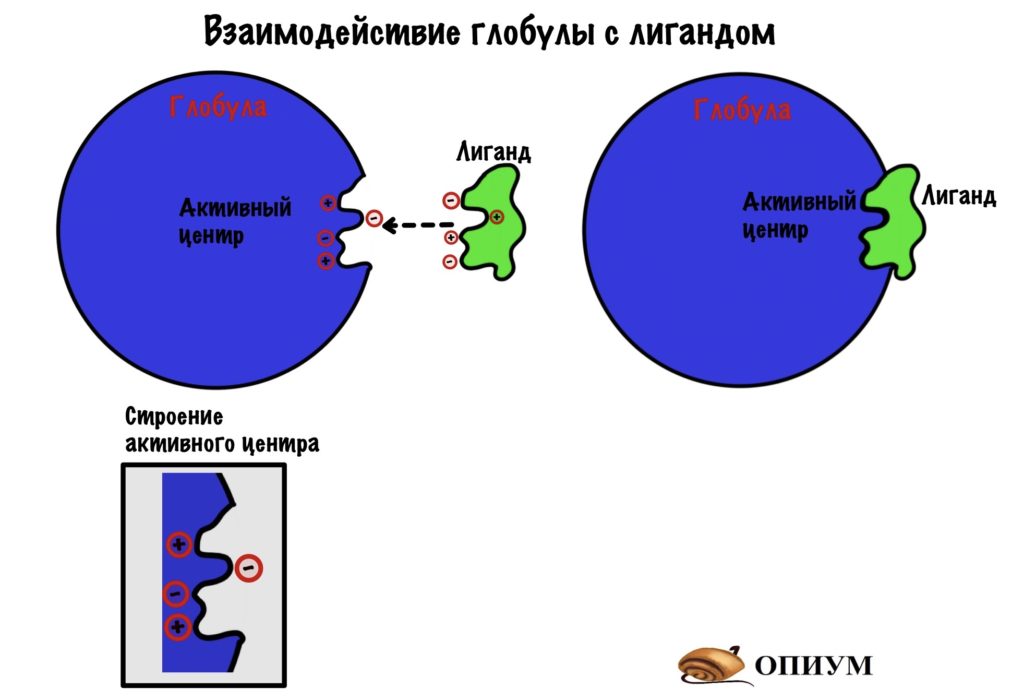
Ах, да — вся третичная структура определяется первичной…. Я знаю, что вы запомнили, но хочу немного понадоедать.
5 типов связей стабилизируют третичную структуру: водородные, гидрофобные, Ван-дер-Вальсовы, ионные и дисульфидные. Эти связи образуются между радикалами.
Четвертичная структура белка
Последняя, но самая большая! Не пугайтесь, только по размеру. Она есть не у всех белков, некоторые прекрасно работают в виде третичной структуры и не парятся. Но представьте, что мы возьмем несколько третичных структур и как соединим их вместе. Пусть их будет 4 штуки, берем 4 шарика и соединяем их. Получаем четвертичную, но не из-за того, что мы взяли 4 шарика….
Эти шарики комплементарны друг другу в участках связывания — не активный центр, но чем-то похоже. Таких участков связывания много, поэтому ошибиться и не узнать своего товарища очень трудно.
Каждая глобула, которую мы взяли — это отдельная полипептидная цепь. Прочитай это еще раз. До этого все касалось только одной полипептидной цепи, а теперь их несколько. Такая цепь называется мономером (или субъединицей), а при соединении мономеров образуется олигомер. Так что вся большая молекула — это олигомер.
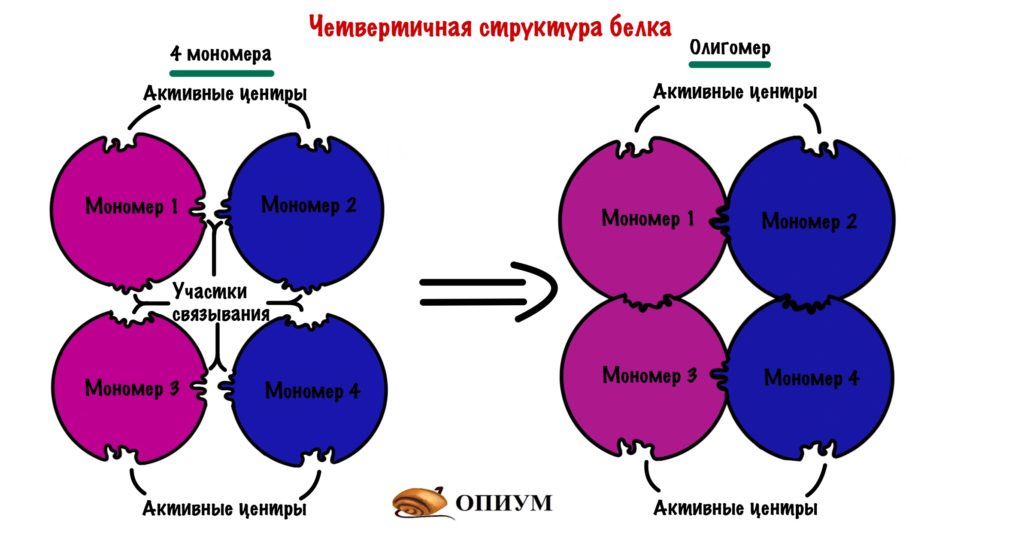
Какие связи все это стабилизируют? Чаще всего это водородные, ионные и Ван-дер-Вальсовы, так как каждый мономер прячет свои гидрофобные остатки вглубь молекулы, то они образуются редко. Получается, что четвертичную структуру стабилизируют силы слабого взаимодействия, ковалентных связей здесь почти никогда не бывает — очень редко могут быть дисульфидные. Поэтому можем спокойно забить на них.
В чем отличие четвертичной структуры от третичной? Ну кроме того, что тут объединено несколько полипептидных цепей. А вот какое — у олигомерных белков есть не только активный центр, но и другой — аллостерический центр. К этому замку не подойдут лиганды от активного центра, у него есть свои собственные ключики. Это очень важно, нужно запомнить! Господи, я превращаюсь в препода….
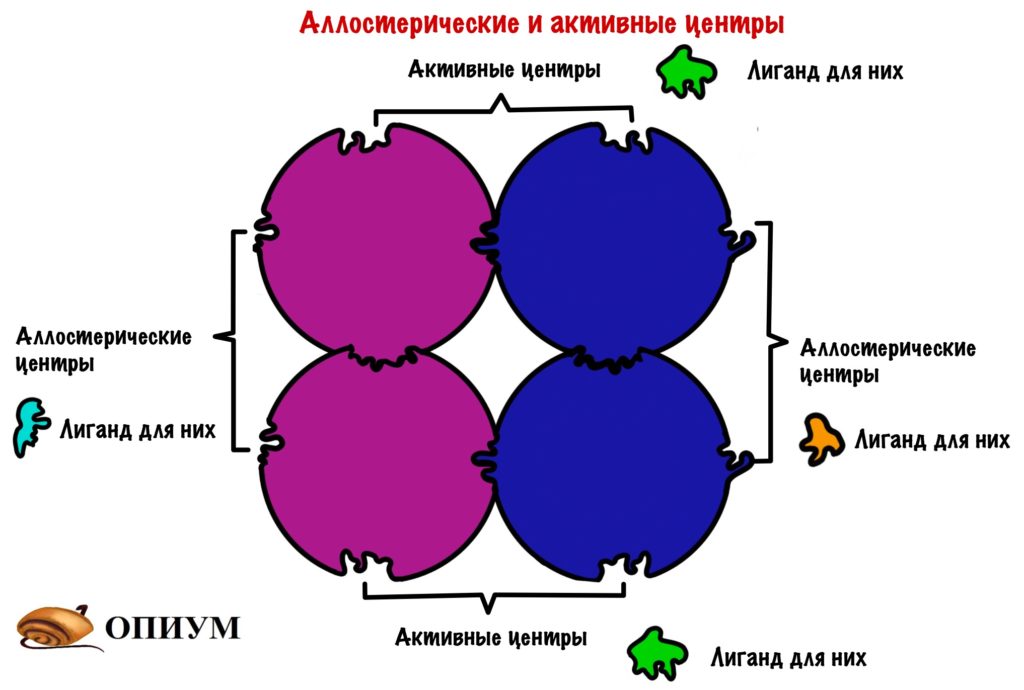
Проведем аналогию с нашим домиком, только теперь их будет несколько. У каждого будет по главному и черному входу! Главный вход — активный центр, а черный ход — это аллостерический центр.
Аллострические центры дают кое-что важное — регуляцию. Маленькая молекула, которая соединится с аллостерическим центром может остановить работу целого огромного белка. Круто? Получается, что размер не важен — не удержался.
Но каким образом одна молекула останавливает работу целого белка? Очень просто — хотел бы я так сказать. Присоединение молекулы к мономеру изменяет его конформацию. А это ведет к тому, что мономер изменяет конформацию других мономеров — происходят конформационные изменения всей структуры белка. В результате этих изменений закрывается активный центр — лиганд не может к нему подойти. У всех этих изменений есть, как и всегда, свое название — кооперативный эффект.
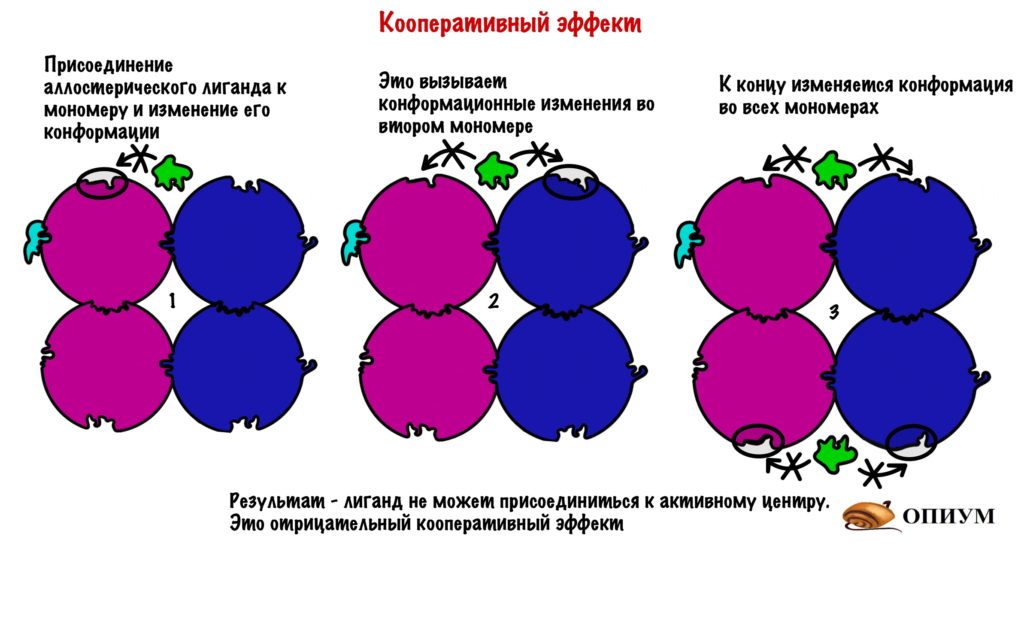
И опять я про дом, если открыть черный ход, то нельзя открыть главный вход, ну и наоборот. Не всегда регуляция работает в таком ключе: черный ход может, наоборот, открывать парадную дверь. Но сейчас это не суть, главное понять смысол. Кстати, на самом деле чаще одна субъединица несет на себе аллостерический центр, а другая активный. Я решил запихнуть все в одну — думаю, что так будет нагляднее.
Кроме этого, присоединение к активному центру также изменяет конформацию остальных мономеров, что приводит к облегченному присоединению лигандов. Хоть на картинке этого и не видно, но поверьте на слово!
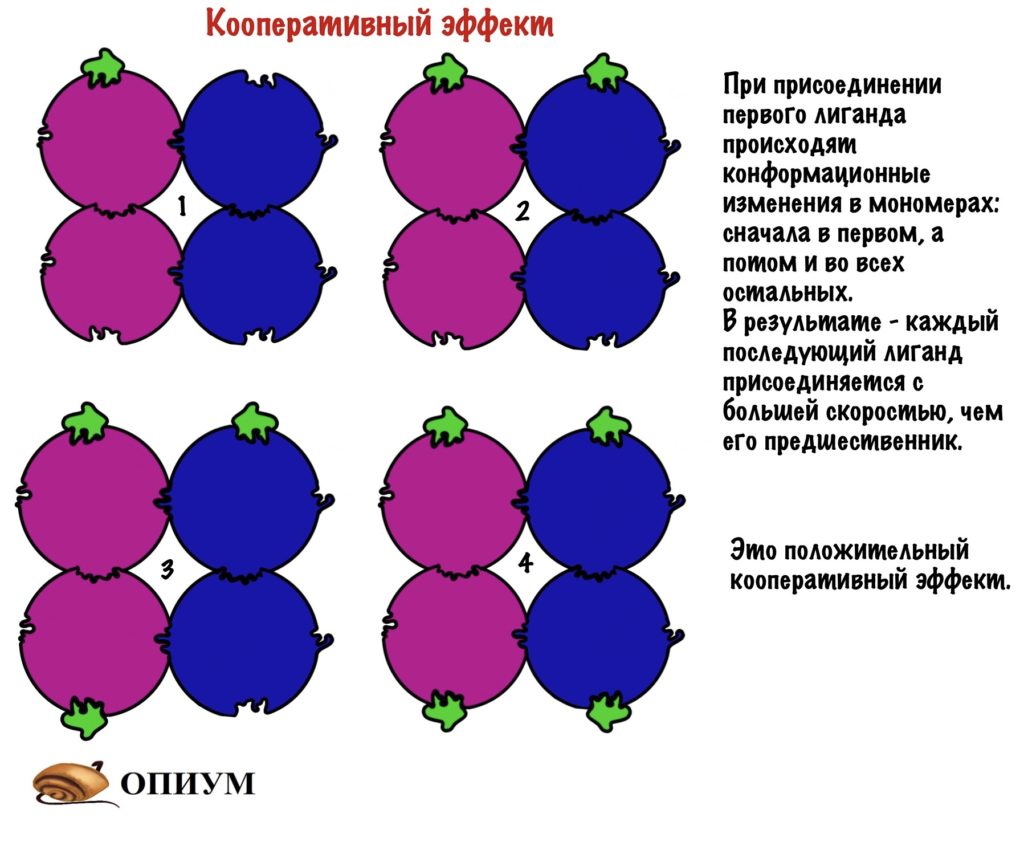
В четвертичной структуре взаимодействуют несколько полипептидных цепей!
Стабилизируется молекула силами слабого взаимодействия.
Давайте заканчивать уже со строением.
Простые и сложные белки
До этого мы говорили, что белок — это полипептидная цепь, которая что-то там делает. Иногда даже несколько цепей соединяются и образуют олигомер. Но мы кое-что упускали все это время. Ведь не все белки состоят только из полипептидных цепей. У гемоглобина есть гем, а это не белковая часть, ого! Белки, которые располагаются на поверхности мембран соединяются с углеводами, которые спасают их от разрушения.
Получается, что у некоторых белков есть дополнительные компоненты. Есть простые белки — они состоят только из аминокислотных остатков, а есть белки сложные. Они включают в себя белковую часть (апопротеин), и небелковую (простетическая группа). Простетические группы связана с белком с помощью ковалентных связей — просто так её не оторвёшь. Она очень важна, потому что белки без неё уже не могут работать. Простетических групп много — это могут быть металлы, углеводы, гем, липиды и еще куча всего. Но это так, для общего развития.

У нас осталось последнее.
Денатурация белка
Так долго мы добирались до четвертичной структуры, но теперь время все УНИЧТОЖИТЬ. Денатурация — это потеря функции белка, через разрушение его четвертичной, третичной и вторичной структуры. Но не первичной! Процесс может остановиться и раньше, не дойдя до первичной. Но самое важное — белок перестает работать. Это значит вот что: если у белка есть только третичная структура, то её потеря приведёт к потере функций. Тоже самое касается белков с четвертичной структурой.
Денатурирующие факторы делятся на физические и химические.
Физические факторы
У всех этих факторов общий механизм действия. Они вносят в систему дополнительное количество энергии. Это вызывает увеличение амплитуды колебательных движений фрагментов полипептидной цепи. Из-за этого рвутся слабые связи, стабилизирующие белковую молекулу — водородные, гидрофобные и Ван-дер-Вальсовы. Вот некоторые из этих факторов:
- Повышение температуры больше 42 градусов;
- Повышение давления;
- Ультрафиолетовое излучение;
- Рентгеновское излучение;
- Инфракрасное излучение (коротковолновое);
- Сверхчастотное излучение;
- Вибрация.
Химические факторы
Химические денатурирующие факторы различаются по механизму действия. Так что разбираемся с каждым отдельно. Представим, что мы рвём каждую связь:
1) Добавим кислоту или щелочь в раствор, где находится белок — произойдет изменение заряда некоторых аминокислот. Раз изменился заряд, то происходит разрушение водородных и ионных связей.
2) Детергенты — это вещества, у которых есть гидрофобные и гидрофильные участки. Если засунуть их внутрь молекулы, то гидрофобное взаимодействие нарушится. Примеры детергентов — фенолы, додецилсульфат.
3) С помощью тяжелых металлов мы порвем дисульфидные мостики в третичной структуре. Такими тяжелыми металлами будут: свинец, медь и ртуть.
4) Восстанавливающие агенты — восстанавливают дисульфидные связи. Смысл такой же, как и с тяжелыми металлами: разрушение дисульфидных мостиков. Пример — меркаптоэтанол.
5) Вещества, образующие водородные связи — мочевина. Это ужасная воровка, она перетягивает водородные связи с белка на себя.
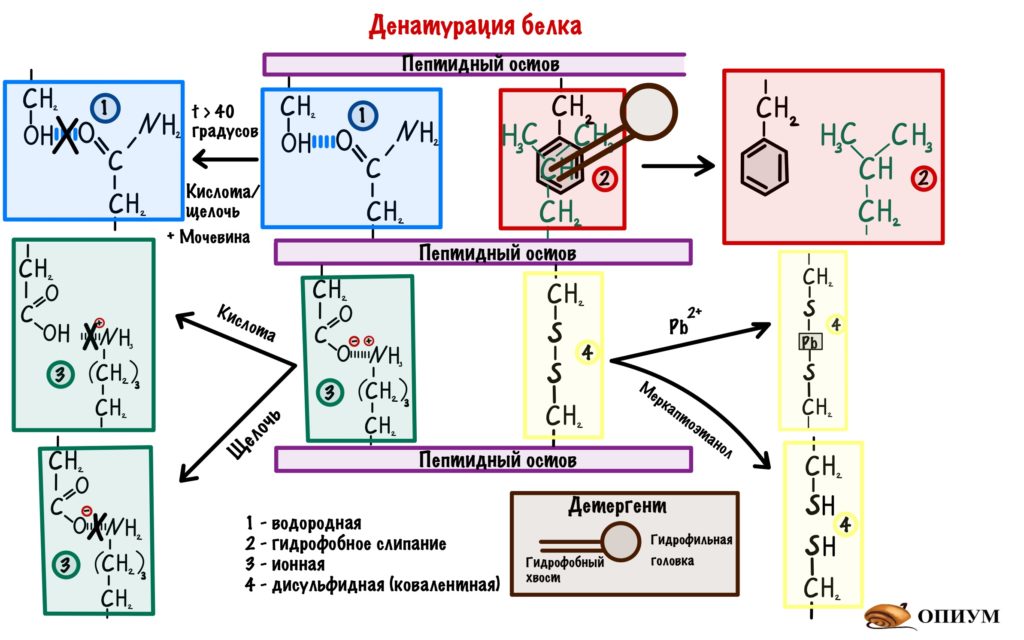
Но, мы сказали, что это разрушает вторичную, третичную и четвертичную структуры, но не первичную. Она остается целой. А так как она отвечает за формирование всех остальных, то при удалении денатурирующего фактора белок может снова стать работоспособным, восстановив свою структуру. Это процесс называется ренативация белка. Для этого нужны определённые условия, но они не всегда достижимы в клетке. Поэтому для большинства белков денатурация — это необратимый процесс.