В уроке 2 «Изотопы элементов» из курса «Химия для чайников» рассмотрим что такое изотопы элементов и как правильно их обозначают; кроме того мы научимся определять массовое число, дефект массы и энергию связи ядра. Данный урок полностью опирается на основы химии, изложенные в первом уроке, в котором мы рассмотрели строение атома и атомного ядра, поэтому настоятельно вам рекомендую его изучить от корки до корки.
Что такое изотоп?
Хотя все атомы одного элемента имеют одинаковое число протонов, эти атомы могут отличаться числом имеющихся у них нейтронов. Такие различные атомы одного и того же элемента называются изотопами. Количество протонов, а также количество электронов у изотопа и исходного элемента совпадает. По этой причине в природе существует гораздо больше химических элементов, чем указано в таблице Менделеева, которая систематизирует элементы по числу протонов (порядковый номер).
Например, все атомы Li имеют 3 протона, но в природе существуют изотопы, содержащие от 3 до 5 нейтронов. Для обозначения изотопа, слева от символа элемента подписывают нижним индексом его порядковый номер, а верхним — массовое число. Массовое число — это суммарное число нуклонов (протонов и нейтронов) в атомном ядре, численно близкое к атомной массе элемента. Нижний индекс, обозначающий порядковый номер элемента, указывать не обязательно, так как все атомы лития имеют в своем ядре по 3 протона. Также, обсуждая эти изотопы, можно пользоваться записью «литий-6» и «литий-8».
На рисунке выше изображен состав четырех изотопов гелия (Не). Все атомы гелия содержат два протона (и, следовательно, два электрона), но число нейтронов у них может быть разным. В природе большинство атомов гелия имеет два нейтрона (гелий-4) и реже одного раза на миллион встречаются атомы гелия с одним нейтроном (гелий-3). Другие изотопы гелия — гелий-5 , гелий-6 и гелий-8 (не показанный на рисунке) — неустойчивы и обнаруживаются лишь на очень непродолжительное время в ядерных реакциях (подробнее об этом будем говорить еще не скоро). Размеры ядер на рисунке очень сильно увеличены. Если бы они были такими, как это показано на рисунке, диаметр атома должен был достигать примерно 0,5 км.
Пример 1. Сколько протонов, нейтронов и электронов содержится в атоме урана-238? Запишите символ этого изотопа.
Решение: Порядковый номер урана (см. таблицу Менделеева) равен 92, а массовое число изотопа равно 238 (по условию). Следовательно, он содержит 92 протона, 92 электрона и 238 — 92 = 146 нейтронов. Его символ 238U.
Дефект массы и энергия связи ядра
Затронув тему изотопов, нельзя пройти мимо феномена дефект массы ядра. Когда из отдельных нуклонов образуется атомное ядро, часть их массы превращается в энергию. Другими словами, вот взяли вы щепотку протонов и нейтронов, хорошенько их смяли вместе, и получили ядро, но его масса будет меньше массы исходных компонентов. Это и есть дефект масс. Формула для расчета дефекта массы ядра:
- ∆m=(Zmp+Nmn)-Mя
где Mя – масса ядра, Z – число протонов в ядре, N – число нейтронов в ядре, mp – масса протона, mn – масса нейтрона.
Если к атому подвести энергию (которая эквивалентна дефекту масс), то можно разделить его ядро обратно на нуклоны. Эта энергия носит название энергия связи ядра. Формула для расчета энергии связи ядра:
- ∆Eсв=∆mc2
где с — скорость света, ∆m — дефект массы ядра
Проверьте себя, как вы усвоили понятия дефект массы и энергия связи ядра, самостоятельно решив задачу пользуясь формулами выше.
Пример 2. Если образовать атом углерода-12 из субатомных частиц, какое значение будет иметь дефект масс?
Показать
Ответ: 0,0990 а.е.м.
[свернуть]
Теперь нам известно, что каждый изотоп элемента характеризуется порядковым номером (суммарным числом протонов), массовым числом (суммарным числом протонов и нейтронов) и атомной массой (массой атома, выраженной в атомных единицах массы). Поскольку дефект массы при образовании атома очень мал, массовое число обычно совпадает с атомной массой изотопа, округленной до ближайшего целого числа. (Например, атомная масса хлора-37 равна 36,966, что после округления дает 37.) Если в природе встречается несколько изотопов одного элемента, то экспериментально наблюдаемая атомная масса (естественная атомная масса) равна средневзвешенному значению атомных масс отдельных изотопов. Это средневзвешенное значение определяется соответственно относительному содержанию изотопов в природе. Хлор существует в природе в виде смеси из 75,53% хлора-35 (атомная масса 34,97 а.е.м.) и 24,47% хлора-37 (36,97 а.е.м.), поэтому средневзвешенное значение масс этих изотопов равно
- (0,7553·34,97 а.е.м.) + (0,2447·36,97 а.е.м.) = 35,46 а.е.м.
Атомные массы, указанные в таблице Менделеева представляют собой во всех случаях средневзвешенные значения атомных масс изотопов, встречающихся в природе, и именно этими значениями мы будем пользоваться в дальнейшем, за исключением тех случаев, когда будет обсуждаться какой-нибудь конкретный изотоп. Все изотопы одного элемента в химическом отношении ведут себя практически одинаково. На рисунке ниже изображены состав и свойства некоторые атомов, ионов и изотопов элементов.
Пример 3. Магний (Mg) в основном состоит из трех естественных изотопов: 78,70% всех атомов магния имеют атомную массу 23,985 а.е.м., 10,13% — 24,986 а.е.м. и 11,17% — 25,983 а.е.м. Сколько протонов и нейтронов содержится в каждом из этих трех изотопов? Чему равно средневзвешенное значение их атомных масс?
Решение: Все изотопы магния содержат по 12 протонов. Изотоп с атомной массой 23,985 а.е.м. имеет массовое число 24 (суммарное число протонов и нейтронов), следовательно, он имеет 24 — 12 = 12 нейтронов. Символ этого изотопа 24Mg. Аналогично находим, что изотоп с атомным весом 24,986 а.е.м. имеет массовое число 25, содержит 13 нейтронов и имеет символ 25Mg. Третий изотоп (25,983 а.е.м.) имеет массовое число 26, содержит 14 нейтронов и имеет символ 26Mg. Средняя атомная масса магния находится следующим образом:
- (0,7870·23,985 а.е.м.) + (0,1013·24,986 а.е.м.) + (0,1117·25,983 а.е.м.) = 24,31 а.е.м.
Надеюсь урок 2 «Изотопы элементов» помог вам понять что из себя представляют изотопы. Если у вас возникли вопросы, пишите их в комментарии.
Что такое изотоп?
Изотопами называют видоизменные элементы периодической таблицы Менделеева, которые имеют один и тот же порядковый номер, но различную атомную массу. Название характеризует нахождение подобных структур в одной клеточке периодической таблицы с нормальными элементами (изо – равное, топ – положение, место – в переводе с английского). Состав изотопов представляет собой совокупность протонов, электронов и нейтронов (количество нейтронов обычно больше, чем в обычных элементах периодической таблицы).
Обозначения изотопов
Видоизмененные элементы периодической таблицы Менделеева обозначаются следующим образом: к символу химического элемента, к которому принадлежит изотоп, подписывается верхний левый индекс с обозначением массового числа. Так, например, изотоп кислорода, обладающий массовым числом равным восемнадцати атомных единиц, будет обозначаться следующим образом: 18O. Имеется также другое обозначение подобных атомов (например, кислород – 18).
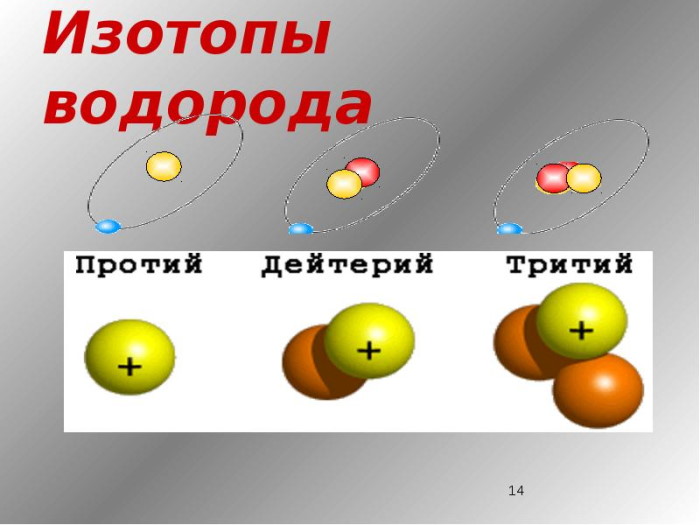
Изотопы водорода
Выделяют три видоизменённых атома водорода, обладающих разными массовыми числами:
-
протий (Н) – одна атомная единица массы;
-
дейтерий (D) – две атомные единицы массы;
-
тритий (Т) – три атомные единицы массы.
В природе чаще всего встречается протий (в 99,98 процентах случаев), именно поэтому среднее массовое число водорода будет равняться приблизительно 1 а.е.м. Стоит, отметить, что бета-распад трития составляет порядка 12 лет, после чего он переходит в форму Гелий — 3.
Отдельно необходимо выделить, видоизменённые атомы водорода, массовое число которого может колебаться в районе 4 – 7 а.е.м.
Изотопы урана
Изотопный ряд урана включает в себя изотопы, имеющие массу от 219 а.е.м. до 243 а.е.м. Элементы, обладающие наибольшей изотопной распространенностью – это уран – 235 и уран – 238.
Изотопные атомные урана с массовыми числами 235 и 238 представляют собой основной компонент для производства плутония – 239 (основного компонента ядерного оружия и ядерного топлива для реакторов нового поколения).
Нуклиды
Нуклиды подразделяются на две больших категории:
-
радиоактивные нуклиды;
-
стабильные нуклиды.
Химический элемент периодической таблицы ртуть (гидраргирум) обладает наибольшей изотопной распространенностью стабильных нуклидов. Так, стабильные нуклиды ртути – это вещества изотопного ряда гидраргиума, обладающие атомной массой от 170 а.е.м. до 219 а.е.м.
Термин нуклид (в понятии радионуклид) был предложен в двадцатом веке американцем Трумэном Команом. Радионуклиды отличаются длительным периодом полураспада, который в большинстве случаев имеет значение порядка 5*108
лет. Таким образом, радионуклиды населяют Землю с момента ее зарождения как планеты. В зависимости от массового числа нуклиды могут подвергать различным видам превращения, обозначим некоторые из них:
-
бета-распад;
-
двойной бета-распад;
-
электронный захват;
-
альфа-распад (для большинства радионуклидов подобный вид распада не наблюдается и из-за большого периода полураспада);
-
позитронный распад;
-
нейтронный и двухнейтронный распады.
Изотопы галлия
Изотопный ряд галлия представлен элементами, обладающими промежутком массовых числен от 49 а.е.м. до 71 а.е.м. Наиболее часто в природе встречаются следующие изотопные атомы: галлий – 69, галлий -71. Природный галлий обычно представлен смесью двух данных видоизмененных атомов, имеющих малый период полураспада (порядка 68 минут). Для представителей изотопного ряда галлия характерные следующие виды ядерных превращений:
-
электронный захват (наблюдается в 13% случаев);
-
позитронный распад (наблюдается в 87% случаев).
Превращения изотопов
Превращения изотопов могут протекать двумя способами:
-
при участии технологий, созданных человеком (используется в промышленности);
-
самопроизвольно (протекает в природе).
Выделяют следующие виды ядерных превращений, связанных со изменением атомной массы химических элементов: распад (альфа, бета, двойной бета, нейтронный, позитронный), электронный захват (происходит присоединение электрона, вследствие чего изменяется заряд и состав нуклида).
Применение радиоактивных изотопов
Изотопы химических элементов представляют собой элементы периодической таблицы Менделеева, обладающие нестабильными ядрами и свойством подвергаться различного ядерному распаду. В научной терминологии подобные атомы называют также радионуклидами. Радиоактивные изотопы применяются в различных сферах человеческой деятельности.
В сельском хозяйстве использования радиоизотопов необходимо для изучения особенностей роста, развития и функционирования корневых систем растений (такой способ изучения получил название – метод меченных атомов).
В авиастроительстве радионуклиды применяют для испытания авиационных конструкций на предмет износостойкости.
В сфере градостроительстве радиоактивные изотопы нашли свое применение как универсальные измерители плотности почвы.
В области коммунального хозяйства видоизмененные химические элементы, обладающие радиоактивной способностью, применяют в целях стерилизации постельного белья.
В текстильной промышленности радионуклиды используются для удаления электрических зарядов с поверхности одежды.
В машиностроительной отрасли радионуклиды используются для определения толщины металлического покрытия.
Особое место в этом списке занимает использование радиоактивных изотопов в химической промышленности и в сфере медицинских услуг. Так, получение различных полимерных соединений, которые составляют основу большинства современных предметов обихода, письменных принадлежностей, резиновых изделий того или иногда вида использования происходит при помощи взаимодействия y-излучения с различными химическими соединениями органической природы. В медицине радиоизотопы применяются в лечебных целях в рамках радиационной терапии (процедура, при которой под воздействием радионуклидов происходит разрушение любого типа живой ткани). Радиотерапия нашла свое применения в области лечения онкологических заболеваний (на данный момент, по эффективности радиотерапия уступает только химиотерапии, но зачастую данные способы лечения составляют две стадии одного процесса).
В заключении, стоит отметить, что научный прогресс в области получения новых видов изотопов тех или иных химических элементов не стоит на месте, поэтому возможно в будущем при помощи грамотного и целесообразного использования видоизмененных атомов можно будет лечить неизлечимые на данный момент заболеваний и строить космические корабли для покорения других планет и галактик.
Строение атома. Состав атомных ядер. Изотопы. Химический элемент
С помощью данного урока вы узнаете, из чего состоит атом, а также познакомитесь с историей появления и развития представлений о сложном строении атома. На уроке рассматриваются результаты некоторых физических опытов, которые позволили установить состав и строение атома.
I. Атом: термин и эволюция понятия
Идея о том, что все вещества состоят из мелких, невидимых частиц возникла у людей еще до нашей эры в Древней Индии и Древней Греции. Известный греческий философ Демокрит, будучи одним из первых материалистов, впервые ввел термин «атом» (от греч.atomos- неделимый). Последователь идей Демокрита, Эпикур (341-270 г. до н.э.) впервые высказал предположение об атомном весе.

Согласно его теории атом — неделимая частица, которая существует вечно. По теории Демокрита:
- все тела состоят из бесчисленного количества сверхмалых, невидимых глазом, неделимых частиц-атомов;
- атомы непрерывно двигаются в пустоте;
- атомы никто не создавал, они были всегда;
- никто не может уничтожить атомы;
- атомы материальны: имеют вес, размеры, форму;
- одни атомы имеют крючочки, другие петельки с помощью которых соединяются друг с другом.
Дальнейшее развитие атомизм, как теория, получил в философии и науке Средних веков и Нового времени. В середине XVII в. французский философ и физик Пьер Гассенди (1592—1655) заново пересказал учение Демокрита и Эпикура, дополнив его новым понятием «молекула» для обозначения различного сочетания атомов друг с другом.
Р. Бойль (1627-1691 г.г.) написал знаменитую книгу «Химик-скептик», в которой доказал нереальность «начал» Аристотеля и ввел представление о химических элементах как о веществах, не поддающихся дальнейшему разложению. Определив задачей химии изучение элементов и их соединений. Р. Бойль поставил ее на научную основу.
Далее атомистическая теория получила свое логическое развитие в работах Ломоносова, Лавуазье, Дальтона и оформилась в атомно-молекулярное учение.
II. Модель Дж. Томсона («сливовый пудинг» или «булочка с изюмом»). Открытие электрона
До 1897 г атом считался мельчайшей неделимой частицей (элементарной). Именно этот год считается датой открытия электрона, первой субатомной частицы. Во второй половине 19 в. многие физики занимались исследованием так называемых «катодных лучей» — лучей, исходящих с поверхности катода при пропускании электрического разряда между катодом и анодом в стеклянной трубке с сильно разреженным газом.
В своих опытах по отклонению катодных лучей в электрических и магнитных полях, Томсон убедительно показал, что эти лучи представляют собой поток заряженных частиц, а самое главное, ему удалось измерить удельный заряд (e/m) этих частиц. (Он оказался примерно в 2000 раз меньше удельного заряда иона водорода, известного из опытов по электролизу.) Томсон сразу же предположил, что электроны входят в состав атомов – откуда еще им было взяться? Дальнейшие работы ученых-физиков подтвердили это предположение. Таким образом, к концу 19 века электрон считался элементарной заряженной частицей, масса которой в 2000 раз меньше массы атома водорода.
После открытия электрона Томпсон предложил модель строения атома, которую обычно называют «сливовый пудинг» (или «пудинг с изюмом») или на русский манер «булочка с изюмом». Согласно Томпсону атом представляет собой положительно заряженную сферу, в которую вкраплены (как изюм в булочке) отрицательно заряженные электроны. Однако, эта модель была опровергнута опытом Резерфорда.

Так появилась одна из первых моделей строения атома, которую предложил английский физик Джозеф Томсон (Рис. 1). В соответствии с этой моделью, атом представляет собой шар, состоящий из положительно заряженного вещества с вкраплениями отрицательно заряженных электронов (наподобие изюма в бисквите).
Рис. 1. Модель строения атома, предложенная Дж. Томсоном
Особенность модели Томсона заключалась в предположении того, что положительный заряд «размыт» внутри атома и не «вылетает» из него, т. к. обладает значительно большей массой по сравнению с электронами.
III. Модель Э. Резерфорда
Следующим удивительным экспериментальным фактом было открытие Беккерелем в 1896 г. явления радиоактивности. Было обнаружено, что атомы некоторых элементов самопроизвольно распадаются с образованием новых атомов, электронов и α-частиц. Также установили, что α-частицы имеют положительный заряд и относительно большую массу.
В 1911 г англ. учёный Э. Резерфорд доказал нa опыте, что в центре атома имеется положительно заряженное ядро.
Например, модель атома азота
С помощью α-частиц Эрнест Резерфорд и его ученики провели эксперимент, результаты которого опровергли модель строения атома Дж. Томсона. Англичанин Эрнест Резерфорд и его ученики поставили следующий эксперимент: направляли быстрый поток α-частиц на тонкую золотую фольгу. Оказалось, что большинство α-частиц проходит через фольгу беспрепятственно, небольшая часть отклоняется на различные углы, а примерно 1 на 10 000 частиц отскакивает в обратном направлении (Рис. 2).
Рис. 2. Схема опыта Э. Резерфорда
Результаты опыта противоречили модели Томсона. Частица с большой массой и положительным зарядом может отскочить назад, если только встретит в качестве препятствия большой положительный заряд, сконцентрированный в одном месте.
Положительный заряд, сконцентрированный в центре атома, Резерфорд назвал ядром и предложил свою модель строения атома: в центре атома находится положительно заряженное ядро, вокруг которого вращаются отрицательно заряженные электроны (Рис.3). При этом основная масса атома сосредоточена в ядре, масса электронов очень мала.
Суммарный заряд ядра и электронов должен быть равен нулю, т. к. атом в целом электронейтрален.
Модель Резерфорда напоминает Солнечную систему, поэтому ее назвали «планетарной».
Рис. 3. Планетарная модель атома, предложенная Резерфордом
III. Модель Бора (планетарная модель)
В 1913 Нильсом Бором была предложена модель строения атома, известная как «планетарная модель». По Бору электроны вращаются по орбитам расположены на строго определенном удалении от атомного ядра, точно также как планеты Солнечной системы вращаются вокруг солнца (отсюда и название модели). Эти орбиты (сейчас всем известны как энергетические уровни)- стационарные и вне их электрон существовать не может. К сожалению, объяснить это утверждение Бору на тот момент не удалось. Кроме того, предложенная модель Бора противоречила законам физики:
В начале прошлого века на смену планетарной модели строения атома пришла волновая модель, которая разрешила возникшие противоречия и на сегодняшний момент считается общепринятой.
Современное представление о строении атома было бы невозможно без открытия явления радиоактивности, элементарных частиц (электрона, протона и нейтрона). Решающий вклад в установлении строения атома внесли Дальтон, Дж.Дж. Томпсон (или Томсон), Э. Резерфорд, Н. Бор, Э. Шредингер, М. Планк, Люис, Паули.
История развития представлений о строении атома условно изображена на схеме ниже:
IV. Современное строение атома
Атом — электронейтрален, то есть количество положительно заряженных частиц в нем равно количеству отрицательно заряженных частиц.
Долгое время считалось, что протоны и нейтроны являются элементарными (то есть неделимыми) частицами. Но на сегодняшний момент признано, что они имеют сложное строение и состоят из кварков. Электрон же до сих пор считается элементарной частицей. Положительно и нейтрально заряженные частицы (протоны и нейтроны, соответственно) сосредоточены в ядре, чья масса составляет около 99,97% от массы атома. Радиус атома, как правило, составляет несколько ангстрем (10−10 м), радиус ядра в 10 000 раз меньше радиуса атома.
Ядро — самая тяжелая и самая маленькая часть атома.
Заряд ядра равен порядковому номеру химического элемента
Из курса физики вам известно, что вокруг положительного ядра находятся отрицательно заряженные частицы электроны — е— . В электронейтральном атоме число электронов должно быть равно заряду ядра и, следовательно, порядковому номеру элемента. Масса электрона очень мала и принимается равной нулю, таким образом, масса атома сосредоточена в ядре, в котором расположены протоны – p+ и нейтроны – n0.
Заряд ядра атома = Порядковому номеру = Числу протонов = Число электронов
Число нейтронов = Атомная масса (Ar) – Порядковый номер
Например, определите состав атома бора?
Бор
N (порядковый номер) – 5
Ar(B) = 11
e—=5
p+=5
n0= 11 – 5 = 6
Например:
- Изотопы хлора
- Изотопы природного водорода: Протий 11 H, Дейтерий 12Н, Тритий 13Н
- Модели изотопов водорода
Изотопы одного и того же химического элемента имеют разную массу, так как в ядрах содержится разное количество нейтронов.
Задача:
Какое количество электронов, протонов и нейтронов содержится в изотопах углерода 12 и 13?
Решение:
Дано: 612C и 613C
Для изотопа углерода 12:
Z→6A→12C , порядковый номер N=6, массовое число A=12
N=N(e¯)=N(p^+)=6
N(n0) = A — Z = 12 — 6 = 6
Углерод-12 содержит 6 электронов, 6 протонов и 6 нейтронов
Для изотопа углерода 13:
Z→6A→13C, порядковый номер N=6, массовое число A=13
N=N(e¯)=N(p^+)=6
N(n0) = A — Z = 13 — 6 = 7
Углерод-13 содержит 6 электронов, 6 протонов и 7 нейтронов
V. Химический элемент
Химический элемент – это вид атомов с одинаковым зарядом ядра.
В природе химические элементы существуют в виде смесей изотопов. Изотопный состав одного и того же химического элемента выражают в атомных долях (ωат.), которые указывают какую часть составляет число атомов данного изотопа от общего числа атомов всех изотопов данного элемента, принятого за единицу или 100%.
Например:
ωат (35Сl) = 0,754 или 75,4%
ωат (37Сl) = 0,246 или 24,6%
В таблице Менделеева приведены средние значения относительных атомных масс химических элементов с учётом их изотопного состава. Поэтому Ar , указанные в таблице являются дробными.
Ar средняя= ωат.(1) ∙ Ar(1) + … + ωат.(n) ∙ Ar(n)
Например:
Arсредняя (Cl) = 0,754 ∙ 35 + 0,246 ∙ 37 = 35,453
VI. Задания для закрепления
Задание №1. Определите атомный состав изотопов хлора 35Cl и 37Сl. Почему изотопы хлора имеют разное массовое число?
Задание №2. Определите относительную атомную массу элемента кремния, если известно, что он состоит из трёх изотопов: 28Si (атомная доля 92,3%), 29Si (4,7%), 30Si (3%).
ЦОРы
Видео: “Строение атома”
Every atom has a certain number of protons, electrons and neutrons. Protons carry a positive charge, electrons carry a negative charge and neutrons do not carry a charge. Protons and neutrons make up the nucleus or central part of the atom. Electrons orbit around the nucleus. Most atoms have isotopes that occur naturally. An isotope is an atom with a different number of neutrons, but the same number of protons and electrons. Each element has a standard number of neutrons that can be found by looking at a periodic table. From the periodic table, you will get the atomic number on the top left corner of the box. This is the number of protons. The atomic weight of the element can be found on the bottom of the box on the periodic table.
How to Find the Most Common Isotope
-
It is helpful to write out each step and clearly label each value so that if you find you have made an error, it will be easier to check your work.
-
Finding the most common isotope is a fairly simple calculation. It is also possible to reverse the process and use the isotope values to find the atomic weight.
••• Michael Gann/Demand Media
Find the element on the periodic table. Record the atomic weight (on the bottom) and the atomic number (top left).
••• Michael Gann/Demand Media
Round the atomic weight to the nearest whole number. If the decimal is .5 or higher, round up, if it is .49 or lower, round down.
••• Michael Gann/Demand Media
Subtract the atomic number (the number of protons) from the rounded atomic weight. This gives you the number of neutrons in the most common isotope.
••• Michael Gann/Demand Media
Use the interactive periodic table at The Berkeley Laboratory Isotopes Project to find what other isotopes of that element exist.
Tips
Warnings
Положение
химического элемента зависит от заряда ядра атома, или от числа протонов.
И, если изменить число протонов в ядре, то будет образовываться совсем другой
химический элемент. Эти процессы называются ядерными.
Ядерные
процессы протекают с выделением большого количества энергии, как,
например, на Солнце, когда ядра атомов водорода соединяются и образуют ядра
атомов гелия. Но если не изменять число протонов, т.е. заряд ядра, а только
число нейтронов, то другого химического элемента не образуется, образуется тот
же элемент, но с другой массой. Эти разновидности элементов с разной массой
называют изотопами.
Изотопы
– разновидности атомов одного и того же химического элемента, имеющие
одинаковый заряд ядра, но разное массовое число. Слово изотоп состоит из
двух греческих слов: изос – «одинаковый» и топос – «место».
Химические
элементы, встречающиеся в природе, являются смесью изотопов. Например, у
водорода есть три изотопа, каждый из которых отличается не только массовым
числом, но и имеет свое название. Первый изотоп – это протий, с массовым
числом равным единице, второй изотоп – это дейтерий, у которое массовое
число равно двум, третий называется тритием и массовое число его
равно трем. Но число протонов одинаково, т.е. в ядре каждого из них содержится
один протон.
Относительная
атомная масса имеет дробное значение. В природе один и тот же
химический элемент представляет собой смесь изотопов, тогда
относительная атомная масса является средним значением атомных масс
природной смеси изотопов данного химического элемента с учетом содержания
их в природе.
Разберём
это на примере. Атомы хлора состоят из смеси двух изотопов с
массовым числом 35, их в природе 75% и с массовым числом 37, которых в природе
встречается 25%. Следовательно, относительная атомная масса хлора вычисляется
таким образом:
На
основании знаний о строении атома, существования изотопов, можно дать более
точное определение химического элемента – это совокупность атомов с
одинаковым зарядом ядра.