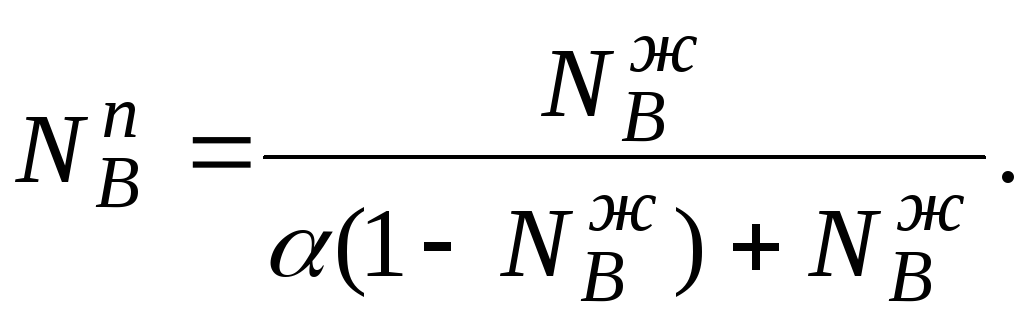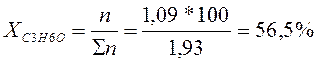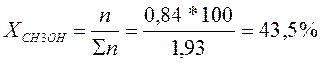Если раствор образован из двух летучих
жидкостей, то пар, находящийся в
равновесии с жидким раствором, будет
содержать оба компонента. В общем случае
состав пара отличается от состава
идеального жидкого раствора, из
которого он получен.
Для нахождения
взаимосвязи между ними воспользуемся
уравнениями Дальтона и Рауля. Запишем
выражение для давления насыщенного
пара одного из компонентов идеального
бинарного раствора, например, В :
РВ = Р
NВп(7)
РВ = РВо
NВж(8)
Отсюда:
Р NВп
= PВо
NВж,
тогда
мольная доля компонента В в паре:
(9)

(6) для общего давления насыщенного
пара:
(10)
Из этого уравнения следует, что состав
пара равен составу жидкости (NВп
= NВж) для идеальных
растворов лишь при равенстве давлений
насыщенного пара обоих чистых компонентов
(РАо = РВо).
Это наблюдается очень редко, т.к. каждое
вещество имеет свое давление насыщенного
пара, которое является индивидуальной
характеристикой этого вещества.
Равенство давлений паров чистых веществ
характерно лишь для оптических изомеров.
Во всех остальных случаяхРАо
РВои, следовательноNВп
NВж,
т.е. в общем случаесоставы пара и
жидкости различны. Если, например,
компонент В более летучий (РВо
> РАо), то можно
показать, что пар по сравнению с жидкостью
содержит больше более летучего
компонента.
Преобразуем уравнение (10). Разделим
правую часть уравнения на РВо:
(11)
Если считать РВо
> РАо, т.е.
компонент В более летучий и обозначитьРАо/РВо=, имеем
(12)
Для нашего случая <
1, следовательно, знаменатель уравнения
(12) меньше 1, тогда:
NВп > NВж, (13)
т.е. пар содержит больше более летучего
компонента.
1.4. Диаграммы состояния для идеальных систем. 1 закон Коновалова.
В связи с тем, что состав пара и жидкости
не совпадают, возникает необходимость
в выборе нового типа диаграммы, на
которых бы отражалась зависимость
какого-то свойства системы как от
состава пара, так и от состава жидкости.
Для изучения равновесия пар — жидкий
раствор применяют два типа диаграмм
состояния:
1) диаграммы: давление насыщенного пара
— состав ( Р = f (N)приТ = const);
2) диаграммы: температура кипения —
состав (Ткип = f (N)приP = const).
При построении диаграмм первого и
второго типа принято приводить две
кривые, одна из которых связывает
давление (температуры кипения) с составом
жидкой фазы, а другая показывает
зависимость давления насыщенного пара
(температуры кипения) от состава пара.
Соответственно, первая линия называется
линией жидкости, а вторая —линией
пара.
Т
как компоненты с большей температурой
кипения имеют меньшее давление
насыщенного пара, то диаграмматемпература кипения — составдолжна
быть обратна диаграммедавление
насыщенного пара-состав. Пример
диаграмм для идеальных растворов
приведены на рис. 5.
Рис. 5. Зависимость давления от состава
пара и жидкости
при Т = const
Р
6. Зависимость температуры кипения
раствора от состава пара и жидкости
при Р = const
На диаграмме Р — состав (Т = const) для
идеальных бинарных жидкостей (рис.5)
линия жидкости представляет собой
прямую в соответствии с законом Рауля
(6). Линия пара располагается в данном
случае правее линии жидкости, так как
PBo> PAo, и пар
обогащен по сравнению с жидкостью более
летучим компонентом (уравнение 13). Выше
линии жидкости находится областьI,
соответствующая жидкому состоянию
системы, а ниже линии пара находится
областьII, отвечающая
парообразному состоянию системы.
Зависимости температур кипения от
состава жидкости и пара при P = const (рис.6)
не являются линейными, так как давление
и температура фазовых переходов связаны
логарифмической зависимостью в
соответствии с уравнением
Клайперона-Клаузиуса:
; (14)
Выше линии пара на этой диаграмме
находится область II,
соответствующая парообразному состоянию
системы, а ниже линии жидкости
располагается областьI,
соответствующая жидкому раствору.
Между кривыми на диаграммах любого
типа располагается область, отвечающая
гетерогенному состоянию системы — смеси
пара и жидкости. Например, система
состава М(рис. 5) при давленииРМсостоит из равновесной смеси жидкости
составаx1и пара составаx2.
При этомNBп >
NBж .
Система состава Dпри температуреТD(рис. 6) представляет собой смесь
жидкости составаx1
и пара составаx2,
находящихся в равновесии.
Соотношение между количествами пара
и жидкости в любой точке гетерогенной
области определяется по правилу рычага.
Например, для системы, характеризуемой
точкой D:
(15)
где mпиmж— количество пара и количество жидкости,
находящихся в равновесии.
На основании экспериментальных данных
по изучению равновесия жидкость-пар
для бинарных систем, подчиняющихся
закону Рауля, был сформулирован I закон
Коновалова:
Пар по сравнению с равновесным
раствором богаче тем компонентом,
добавление которого в систему повышает
общее давление пара или понижает
температуру кипения смеси при данном
внешнем давлении.
Можно дать и
более простую формулировку I закона
Коновалова:
Парообразная фаза по сравнению с
жидкой обогащена более летучим
компонентом, т.е. тем компонентом,
температура кипения которого ниже.
Это подтверждается
уравнением (13), полученным ранее.
Соседние файлы в папке физическая химия 1
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
График зависимости состава пара от состава жидкой фазы при постоянном давлении. Вариантность системы в азеотропной точке
Страницы работы
Содержание работы
Домашняя работа №1. Вариант 13
Дана
зависимость составов жидкой фазы и находящейся с ней в равновесии пара от
температуры для двухкомпонентной жидкой системы А – В при постоянном давлении.
Молярный состав жидкой фазы x и насыщенного пара y выражен в
процентах вещества А. По приведенным данным :
1.
постройте график зависимости
состава пара от состава жидкой фазы при постоянном давлении.
2.
постройте диаграмму кипения
системы А – В.
3.
определить температуру кипения
системы с молярной долей a % вещества А. Каков состав первого пузырька пара над
этой системой; при какой температуре закончиться кипение системы; каков состав
последней капли жидкой фазы?
4.
определите состав пара,
находящегося в равновесии с жидкой фазой, кипящей при температуре Т1
.
5.
при помощи какого эксперимента
можно установить состав жидкой бинарной системы, если она начнет кипеть при
температуре Т1 при наличии диаграммы кипения системы.
6.
какой компонент и в каком
количестве может быть выделен из системы, состоящей из b кг вещества А
и с кг вещества В.
7.
какого компонента и какое
количество необходимо добавить к указанной в п. 6 смеси, чтобы получилась
азеотропная система.
8.
какое количество вещества А будет
в парах и в жидкой фазе, если 2 кг смеси с молярным содержанием a % вещества А нагреть до
температуры Т1.
9.
Определить вариантность системы в
азеотропной точке.
|
№ варианта |
Система |
Р*10-4, Па |
Молярная доля А,% |
Т, К |
|
|
x — жидкая фаза |
у — пар |
||||
|
13 |
A — С3Н6О B — СН3ОН |
10,133 |
0,00 |
0,0 |
337,7 |
|
4,8 |
14,0 |
335,9 |
|||
|
17,6 |
31,7 |
333,1 |
|||
|
28,0 |
42,0 |
331,3 |
|||
|
40,0 |
51,6 |
330,2 |
|||
|
60,0 |
65,6 |
329,1 |
|||
|
80,0 |
80,0 |
328,6 |
|||
|
95,0 |
94,0 |
328,6 |
|||
|
98,2 |
97,6 |
329,1 |
|||
|
100,0 |
100,0 |
329,5 |
[1], стр. 302
|
№ варианта |
T1 |
a |
b |
c |
|
13 |
329,25 |
60 |
73 |
27 |
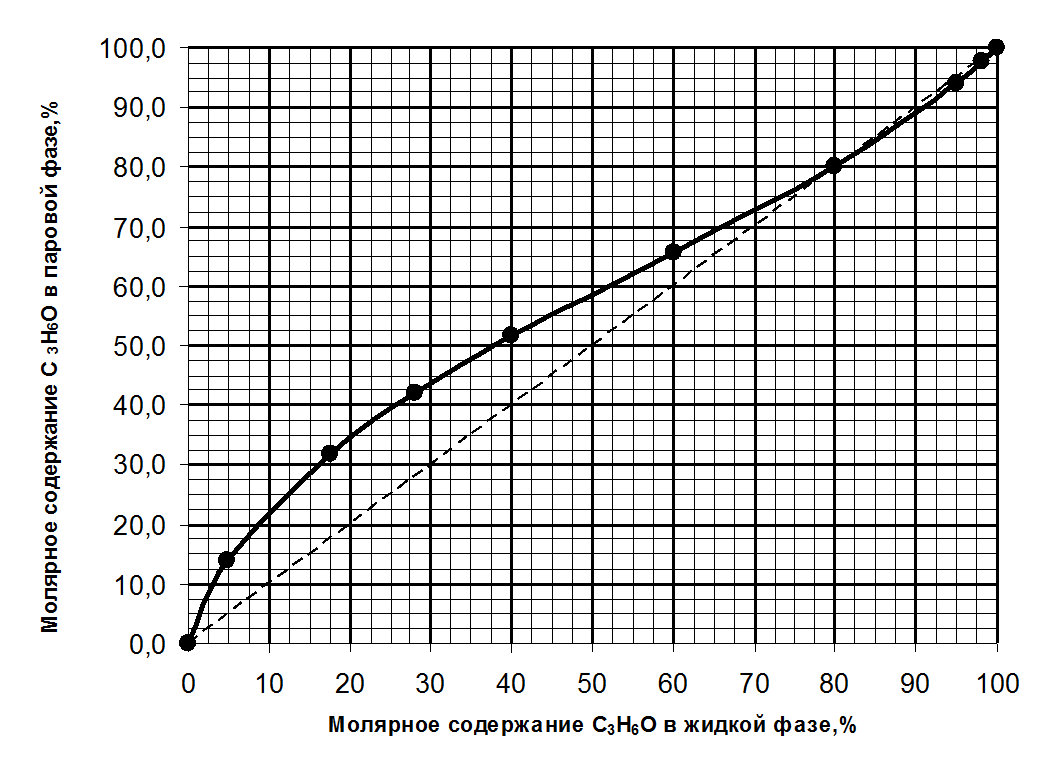
1. Зависимость состава пара от состава жидкой фазы при
постоянном давлении для системы С3Н6О – СН3ОН
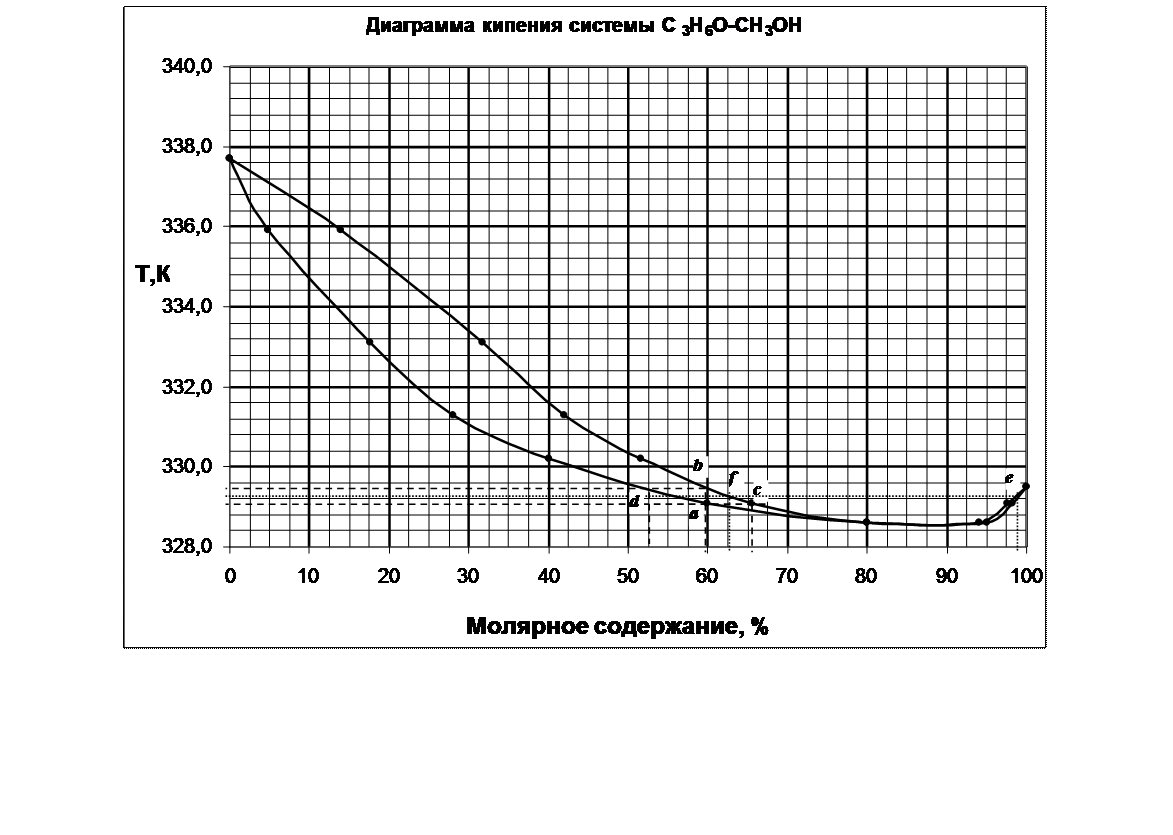
3. Определение температуры
кипения системы с молярной долей 60 % С3Н6О.
Для
определения температуры кипения системы необходимо провести перпендикуляр от
оси Х, соответствующий содержанию в системе 60% С3Н6О. Пересечение
перпендикуляра с кривой состава кипящей жидкости (нижней кривой диаграммы)
показывает точку начала кипения системы – a,
соответствующей температуре 329,1 К. Вплоть до 329,1 К система жидкая,
гомогенная. При 329,1 К начинается кипение системы, состоящей из 60% С3Н6О
и 40% СН3ОН. Для определения состава паровой фазы необходимо
провести изотерму через точку а. Пересечение изотермы с кривой
насыщенного пара показывает состав пара (точка с) – 66% С2Н6О и 34% СН3ОН.
(Это будет состав первого пузырька пара над системой). Состав пара богаче С2Н6О, чем жидкость. Следовательно, жидкая фаза обедняется С3Н6О и ее состав меняется по линии ad. Состав пара меняется по линии cb. В точке b (при Т≈329,5)вся жидкая фаза превратиться в
пар (отсюда, 329,5 – температура конца кипения). Состав пара сравняется с
исходной жидкостью (60% С3Н6О). Состав последней капли жидкой фазы определяется по точке
d – примерно 53 % С3Н6О
и 47% СН3ОН.
4. Определение состава пара, находящегося в равновесии с
жидкой фазой, кипящей при температуре 329,25 К.
Проводим изотерму Т=345 К, ее пересечение с кривой состава паровой
фазы дает 2 точки – fиe. По ним определяем состав парообразной
фазы. Соответственно 63% С3Н6О и 37% СН3ОН
(слева от азеотропной точки) и 98% С3Н6О и 2% СН3ОН (справа
от азеотропной точки).
5. При помощи какого эксперимента можно установить состав
жидкой бинарной системы, если она начнет кипеть при температуре Т1 при
наличии диаграммы кипения системы.
К исходной смеси необходимо
добавить какой-нибудь из компонентов, например компонент А и снова измерить
температуру кипения. Если Ткип уменьшиться по сравнению с Т1,
значит система содержала недостаток А по сравнению с азеотропной смесью и ее
состав определяем по левой части диаграммы (ок. 63% С3Н6О),
в противном случае – содержала недостаток В и состав определяется по правой
части диаграммы (98% С3Н6О).
6. Какой компонент и в каком
количестве может быть выделен из системы, состоящей из 73
кг С3Н6О и 27
кг СН3ОН.
∑n = 1,09 + 0,84 = 1,93 кмоль
Так как заданный состав находиться слева от азеотропной точки, то
выделить ректификацией в чистом виде можно только СН3ОН. Весь С3Н6О (1,09 кмоль) перейдет в азеотропную смесь с молярным
содержанием 80%. (Азеотропная точка определяется по графику на пересечении
линий жидкого и твердого состояния). Остальные 20% в азеотропном растворе
составит СН3ОН.
Определим
количество СН3ОН, перешедшего в азеотроп:
1,09 кмоль —
80%
x — 20%
Тогда в чистом
виде можно выделить 0,84 – 0,27 = 0,57 кмоль или 0,57*32 = 18,2
кг СН3ОН.
7. Какого компонента и какое количество необходимо
добавить к указанной в п. 6 смеси, чтобы получилась азеотропная система.
В п.6 система состоит из 56,5% С3Н6О и 43,5% СН3ОН.
Азеотроп состоит из 80% С3Н6О и 20% СН3ОН. Метанол в системе находится в недостатке, относительно азеотропа,
следовательно, к системе необходимо добавлять С3Н6О, чтобы получить из исходной системы азеотропную.
Число моль СН3ОН в азеотропе – 0,84 кмоль, что составляет 20%. Тогда пропорцией
найдем количество С3Н6О
в азеотропе.
Тогда количество
бензола, которое необходимо добавить к исходной системе 3,36 – 1,09 = 2,27
кмоль или 2,27*58 = 131,6 кг
8. Какое количество вещества С3Н6О
будет в парах и в жидкой фазе, если 2
кг смеси с молярным содержанием 60% С3Н6О нагреть до
температуры 329,25 К.
Сначала
определим количество молей вещества, которое содержится в системе массой 2
кг. Для этого вычислим среднюю молекулярную массу:
Мср = 58*0,6 + 32*0,4 = 47,6.
В 2
кг содержится 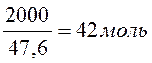
и метанола.
По диаграмме определяем
молярный состав жидкой и парообразной фаз системы при Т=329,25 К при содержании
в исходной жидкости 60% С3Н6О – 56% С3Н6О
в жидкой и 63% С3Н6О — в парообразной.
По правилу рычага определяем
количество С2Н6О:
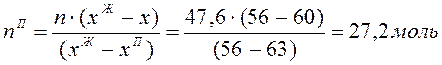
Тогда
9. Определить вариантность
системы в азеотропной точке.
С = 2 – 2 + 1 – 1 = 0
Вариантность в азеотропной
точки равна 0, т.е. инвариантна.
Литература:
[1] «Сборник примеров и задач по физической химии»,
Киселева Е.В., Каретников Г.С., изд. 4, 1976
г., 381 стр.
Похожие материалы
- Диаграмма плавкости 2-х компонентных систем. Диаграммы плавкости систем с конгруэнтно и инконгруэнтно плавящимися соединениями
- Зависимость константы скорости реакции от температуры. Вычисление константы скорости бимолекулярной реакции по числу соударений
- Истинная и средняя скорость реакции. Связь между б/р концентрацией и степенью превращения. Факторы, влияющие на скорость химической реакции.Энергия активации, порядок реакции по реагентам и методы их определения
Информация о работе
В трехкомпонентных системах имеются две независимые переменные концентрации. Поэтому в этих системах возможно бесчисленное множество способов изменения состава жидкости. Например, состав жидкости может изменяться так, чтобы отношение концентраций двух компонентов оставалось постоянным, или так, чтобы оставалась постоянной концентрация одного из компонентов. В этих случаях в треугольных диаграммах, обычно применяемых для изображения составов фаз в трехкомпонентных системах, изменение состава выражается прямыми линиями, выходящими из вершины треугольника, — секущими или линиями, параллельными одной из его сторон, — сечениями. Применение обычных методов графической интерполяции для сглаживания данных о равновесии между жидкостью и паром возможно, очевидно, лишь в случае закономерного изменения состава жидкой фазы, например по секущим или по сечениям. При беспорядочном расположении в треугольной диаграмме точек, изображающих составы жидкой фазы, графическая интерполяция становится ненадежной. Это обстоятельство следует иметь в виду при пользовании диаграммами, выражающими условия равновесия в трехкомпонентных системах. Именно по этой причине диаграммы равновесия помещены в справочнике только для тех систем, для которых в литературе не приведены в виде таблиц фактические данные опытов. [c.543]
Использовать правило фаз для интерпретации диаграмм состав жидкости — состав пара (стр. 318). [c.310]
Как интерпретировать диаграмму состав жидкости — состав пара. [c.318]
Диаграмма температура — состав для неограниченно смешивающихся жидкостей. Одним из способов разделения смеси жидкости на составные части является перегонка. Перегонка основывается на том, что состав пара над жидкой смесью при температуре ее кипения, как правило, неоди наков с составом взятой смеси. Соотношения между составами разновесных жидкостей и пара и влияние добавления того или другого из компонентов на общее давление пара устанавливает первый закон Д. П. Коновалова (1881) над двойной жидкой системой пар по сравнению с находящейся с ним в равновесии жидкостью относительно богаче тем ком-нентом, прибавление которого к системе повышает общее давление пара, т. е. понижает температуру кипения смеси при данном давлении. На диаграмме температура кипения — состав смеси (рис. 26) нижняя кривая отвечает составу кипящей жидкости, верхняя — составу пара над кипящей смесью. Рассмотрим состав, отвечающий точке Е. Температура кипения его t. Состав пара при температуре характеризуется точкой Р. Спроектировав точки Е п Р на ось состава, можно убедиться в том, что в парах находится легколетучего компонента В больше (точка С , чем в жидкой смеси (точка Сх). Соответственно высококипящего компонента А больше в жидкой фазе. При повышении содержания данного вещества в жидкой смеси увеличивается его содержание в парах. Если полученный пар (точка Р) сконденсировать в жидкость и снова нагреть до кипения (точка О), то образуется пар, еще более богатый компонентом В (точка Сз). В результате многократного повторения таких операций можно обогатить пар легкокипящей жидкостью. В остатке будет накапливаться высококипящая малолетучая жидкость. [c.107]
Для этого необходимо построить диаграмму состав-жидкость — состав-<пар X—У) для бинарной смеси бензол—толуол. Данные для построения этой диаграммы вычисляют на основании закона Рауля и кривых упругости пара для бензола и толуола (рис. 138). [c.345]
Любая точка, соответствующая составу гетерогенной смеси в интервале СО, будет иметь пар одного и того же состава О. Эта зависимость более наглядно показана на диаграммах состав жидкости — состав пара (рис. 34). [c.129]
Подробно диаграммы состав — свойство изучают в физикохимическом анализе. Здесь будут рассмотрены в общем виде лишь те типы диаграмм в системах Т—Ж и Ж—Г, которые встретятся при изложении технологии важнейших химических продуктов. В диаграммах состояния для системы Т—Ж определяемой величиной (свойством) является температура плавления л и соответствующие каждой температуре составы твердой и жидкой фаз. Для системы Ж—Г (или жидкость — пар) определяются 4ип и составы жидкости и пара. [c.76]
На основании диаграммы температура — состав можно построить диаграмму равновесия состав-жидкость—состав-пар (диаграмма X—У) (рис. 136). [c.342]
Из диаграмм состав пара—состав жидкости, приведенных на рж. 31, видно, что системы, имеющие гетероазеотропы, не могут быть разделены на чистые компоненты в процессе ректификации, тогда как для систем, не образующих гетероазеотропов, это вполне возможно. Поэтому определение принадлежности систем к одной из этих групп имеет важное практическое значение. [c.98]
С помощью диаграммы t-x-y можно понять принцип разделения смесей на чистые компоненты методом перегонки. Пусть дана жидкость состава Хз. При температуре ti будем иметь практически только одну жидкую фазу. По мере нагревания до температуры 1з смесь начинает кипеть. Равновесный с жидкостью состав пара при (з определится точкой Вз, а после его конденсации получится смесь состава уз. Если теперь полученную смесь отобрать, снова довести до кипения и сконденсировать, то получим смесь с еще большим содержанием НК. Наиболее [c.14]
На основании данных, приведенных в условии примера 2, построить диаграмму давление пара — состав (жидкости и пара) для системы анилин — вода при 100. Для расчета воспользоваться уравнениями (в) и (г), выведенными при решении примера 1, и результатов решения примера 2. [c.206]
Почему идеальные растворы могут иметь различный состав жидкости и пара Расскажите об основных типах диаграмм состояния для идеальных и неидеальных растворов, находящихся в равновесии с паром. [c.298]
Рассмотрим давление пара над смесями с более близкими температурами кипения, например, вода—бензол. В этом случае парциальные давления пара определяются только температурой и не зависят от состава смесей жидкостей. Общее давление равно сумме парциальных давлений и также не зависит от состава жидкости. Поэтому на диаграмме состав жидкости — давление, линия общего давления пара идет параллельно оси абсцисс. [c.90]
На рис. 32.11 даны фазовые диаграммы системы ННз—НгО, на которые нанесены — кривая равновесия между жидкой и твердой фазами и изобары составов насыщенных жидкости и пара рис. 32.11, а), а на рис. 32.11, б — изотермы составов насыщенных жидкости и пара, сходящиеся в критических точках (указаны наверху). Эти диаграммы позволяют определить состав жидкости при заданном составе пара или наоборот. При этом содержание аммиака в газовой фазе всегда больще, чем в равновесной с ней жидкой фазе при одинаковых температуре и давлении. [c.336]
Диаграмма состав пара—состав жидкости для полностью смешивающихся жидкостей [c.179]
При конечной кратности циркуляции температуры кипящей жидкости на входе и выходе из аппарата определяют по составу жидкости или равновесного пара на соответствующей диаграмме равновесия. При этом состав жидкости и пара после частичного испарения могут быть найдены графически или на ЭЦВМ теми же способами, что и при расчете процесса дросселирования (см. гл. III). Для случая кипения бинарной смеси основные соотношения подробно описаны в работе [55]. [c.166]
Для построения диаграммы тёмпе-ратура — состав (рис. 120) нанесем температуры кипения чистых жидкостей и при заданном общем давлении Р (точки а и Ъ) после этого подберем температуру, при которой Р[ Р2= -Р- Температура кипения смеси будет меньше и 1%, так как общег давление больше давления пара над каждой из чистых жидкостей. Так, при Р = 760 мм рт. ст. / 70, т. е. линией кипения является прямая а Ь. Содержание бензола в парах при / = 70 будет равно 550 760 = 0,725 (точка I). Кривую а1 строят следующим путем. Выбирают ряд температур между tl и й и находят Р и Р1 = Р — Р] после этого вычисляют N2 = р11р. Подобным путем строят и кривую Ы точек росы второго компонента. Так, при / = 75 Рнр = 289 мм рт. ст. и Рс.,н, = 760 — 289 = 471 мм рт. ст., т. е. = 471 760 = 0,62 (точка /1) аналогично РсвЫ5 = 648 и Р,-1,о = 760 —648 = 112 мм рт. ст., т. е. [c.314]
Диаграммам, выражающим зависимость температуры кипения от состава смесей, можно придать иной вид отложить по оси абсцисс убывание температуры кипения раствора с увеличением концентрации низкокипящего компонента, а по оси ординат состав жидкости и пара. Для водноспиртового раство- [c.95]
Из диаграммы х — у (рис. 4-32) можно получить состав жидкости и пара в любом месте колонны. [c.238]
При расчете колонны сверху вниз состав стекающей жидкости находится по диаграмме равновесия N2 — Аг — О2, исходя из условия равновесного состояния между паром и стекающей жидкостью. Состав пара, поднимающегося с нижележащей тарелки, определяется по уравнениям (5-60) и (5-61) [c.309]
Диаграмма равновесия. Диаграмма равновесия жидкость — пар , или диаграмма X—У, показана на рис. 102 (составы жидкости и пара выражены в молях легколетучего компонента). В соответствии с диаграммой каждому составу жидкости будет отвечать состав пара, выходящего из жидкости при этом пар богаче компонентом а, чем сама жидкость. Таким образом, если точка а определяет состав жидкости Х , а линия аЬ пересекает кривую равновесия в точке Ь, то проекция точки Ь на ось состава пара (точка с) дает ординату У , превышающую по величине Х . [c.267]
Построив эти прямые (линии рабочих концентраций на диаграмме л —у), можно узнать состав жидкости и пара между тарелками для любого сечения колонны. [c.69]
Горизонтальная линия //, связывающая состав жидкости и пара, называется линией связи. Из диаграммы видно, что в идеальных системах состав пара отличается от состава жидкости. [c.117]
На схемах /, П, 11, IV приведены диаграммы перехода жидкости в пар при температурах 20, 40, 60, 80° С. Чем выше температура, тем более высоким давлениям отвечают кривые жидкости и кривые пара. Если мы хотим построить диаграмму перехода жидкости в пар при постоянном давлении, то нам нужно найти точки, отвечающие выбранному давлению, на кривых пара и кривых жидкости диаграмм I, II, III, /У и перенести эти точки на диаграмму V, построенную в координатах состав — температура для выбранного давления, например, для 1 атм. Этому давлению отвечает пунктирная прямая, проходящая через диаграммы I, II, III, IV. Точки пересечения пунктирной линии с кривыми и отвечающие им точки на диаграмме V обозначены одинаковыми буквами. [c.205]
На основании данных, приведенных в условии примера 2, построить диаграмму давление пара — состав (жидкости и пара) для системы анилин — вода при t = 100. Для расчета воспользоваться [c.220]
Цель работы — определить для данной бинарной системы равновесные концентрации паров и жидкостей при постоянном давлении и при различных температурах и построить на основании опытных данных диаграммы температура — состав и состав пара — состав жидкости. [c.112]
Результаты расчета представляют также в виде диаграммы состав жидкости — состав пара, причем обычно на осях откладывают содбржание легколетучего компонента. Тогда получается кривая, соединяющая углы квадрата и отклоняющаяся вверх от диагонали . Это отклонение тем меньше, чем меньше различие в летучести жидкостей совпадение с диагональю является редким исключением (некоторые стереоизомеры, смесь этиленхлоргидрина с иропиленхлоргидрином). [c.285]
Любая точка, соответствующая составу гетерогенной смеси в интервале составов ХсХо имеет пар одного и того же состава Хо. Эта зависимость наглядно показана на диаграммах состав жидкости — состав пара (рис. V. 29). Здесь по осям отложены значения составов жидкости и пара. На диагонали квадрата эти составы равны. На участке Ахс и ХоЪ находятся точки составов, соответствующие гомогенным растворам, на отрезке хсХа — гетерогенным смесям. Вся кривая АСОВ выражает зависимость между равновесными составами жидкости и пара. Гомогенный раствор состава Х1 (или Xf) имеет равновесный пар состава xf [или Гетерогенные смеси, точки составов которых лежат в интервале ХсХо имеют пар одного и того же состава [c.303]
Наряду с диаграммами температура — состав и давление-состав часто используют диаграммы состав жидкости — состав пара. В схематическом виде она показана на рис. 69, а. По оси абсцисс отложено содержание данного компонента в кипящей жидкости, по оси ординат — его содержание в сухом насыщенном паре (состав обычно выражают через мольную долю лвгколетучего компонента, поэтому можно считать, что рис. 69, в [c.164]
По мере испарения более летучего компонента температура кипения смеси непрерывно растет, находясь в зависимости от меняющегося состава смеси. Эта зависимость может быть выражена диаграммой состав — температура кипения . Обычно ее принято строить двумя кривыми, одна из которых связывает эти температуры с составом жидкой фазы, другая — с составом пара (рис. 41). Для построения диаграммы должны быть известны состав ) идкости и состав пара при данной температуре. Если пары сконденсировать, то дистиллат, как сказано, будет отличаться от исходной смесй большим содержанием легколетучих компонентов А, а оставшаяся жидкость обогатится менее летучими составными частями В. [c.165]
На рис. 1Х-8 показана поверхность температуры насыщенной жидкости для системы метилэтилкетон — м-гептан — толуол, которая разделена линиями постоянной температуры изотермами (сплошные линии). Линии, принадлежащие поверхности температуры Н гидкости ири температурах 88 и 104 С, соединяются стрелками (соединительные линии или конноды) с изотермами соответствующих поверхностей температуры пара. Стрелками соединены точки, выражающие состав жидкости и пара, находящихся в равновесии, и поэтому характеризующие разделение (обогащение), достигаемое на ступени равновесия. Изотермы показывают, что высшая точка поверхности соответствует чистому толуолу, низшая точка — бинарному азеотропу МЭК — гептан. Все остальные точки диаграммы занимают промежуточное положение, поэтому среди них пе существует тройного азеотропа. [c.221]
Рассмотрим фракционную перегонку двухкомпонентний жидкой смеси, не образующей азеотропного раствора, пользуясь диаграммой кипения (рис. 136). Для разделения исходную смесь состава X о нагревают при постоянном давлении до кипения (фигуративная точка а ), при этом получается первый пузырек пара (фигуративная точка Ьо) состава <Уо- Пар по сравнению с исходной жидкостью более богат легколетучим компонентом В, а раствор обогащается компонентом А и его температура кипения при подводе теплоты возрастает (фигуративная точка а ). В процессе перегонки состав жидкого раствора изменяется от до а состав пара —от Ко ДО Кр Если весь полученный пар сконденсировать (первая фракция), то конденсат будет иметь состав К , промежуточный между Ко и При кипении оставшейся жидкости (фигуративная точка 1) состава Х1 получается пар, также обогащенный легколетучим компонентом В. При изменении состава жидкого раствора от Х1 до Хз состав пара меняется от К, до Кг и получается конденсат состава Ка (вторая фракция). При дальнейшем испарении оставшейся жидкости аналогично можно получить третью, четвертую и т. д. фракцию, при этом кипящая жидкость по составу будет приближаться к чистому компоненту А с температурой кипения Т. Если каждую из полученных фракций подвергнуть аналогичной перегонке, то получится набор новых фракций, обогащенных легколетучим компонентом. Сходные по составу фракции объединяют и подвергают дальнейшему фракционированию до тех пор, пока конденсат не будет представлять собой практически чистый компонент В, а перегоняемая жидкость — чистый компонент А. [c.394]
Совершенно так же можно проследить за состоянием системы по диаграмме состав — давление пара при постоянной температуре (рис. 22, б). Очевидно, что в этом случае однофазная жидкость располагается итлше кривой I, однофазный пар — ниже кривой II, а область мел.ду этими кривыми соответствует двухфазной системе жидкость — — пар. [c.142]
В простейшем случае жидкость является идеальным раствором, а паровая фаза — смесью идеальных газов. Изотермическая диаграмма равновесия жидкость — газ имеет вид, изображенный на рис. 140, где линии Аа, ВЬ и Сс представляют давления паров чистых компонентов. На гранях призмы построены кривые равновесия жидкость — пар соответствующих бинарных систем. Плоскость кипящей жидкости асОЬЕ выражает зависимость давления пара от состава раствора, поверхность пара а1сОЬН характеризует состав сухого насыщенного пара. Проведя изобарное сечение ОСЬ НЕ, получим соединительные линии 0С (1ц) и ЕН ек) для соответствующих двойных систем. На плоскости ООНЕ между прямыми 0Е <1е) и 0Н(д11) находятся фигуративные точки, характеризующие при данных Р и Т равновесие жидкость — пар в тройных системах. [c.343]
Затем на треугольник наносят точку Р, характеризующую состав. дестиллата, и точку W, характеризующую состав кубового остатка. По точке W, характеризующей состав жидкости в кубе, находим тачку В, определяющую состав пара, поднимающегося из куба. Стекающая в куб. из нижней тарелки флегмовая жидкость имеет состав, характеризуемый точкой, находящейся на прямой,, проходящей через точки В и Р. Эту точку С найдем, проводя из точки В горизонталь до пересечения ее с диагональю диаграммы в точке L, опуская из точки L вертикаль до пересечения с рабочей линией колонны в точке Н и проводя из точки Н гори- зонталь до пересечения линии РВ. По найденной точке С находим состав пара, поднимающегося с нижней тарелки колонны, в точке D затем, проводя горизонталь до пересечения с диагональю в точке К, опуская из точки К вертикаль до пересечения с рабочей линией в точке М и проводя из этой точки горизонталь до пересечения с линией PD, находим точку Е, характеризующую состав жидкости на второй тарелке колонны. По этой точке находим точку f и т. д. Построениё продолжаем до тех пор, пока -состав пара не совпадет с заданным составом дестиллата. Число ступеней, полученлых таким образом на диаграмме, и дает теоретиче- [c.499]
Диаграмма равновесия жидкость пар. При р = = onst каждому составу жидкой смеси отвечает определенная т-ра равновесия с паром и определенный состав пара, отличающийся, как правило, от состава жидкой смеси. На Д. с. (рис. 8, а) кривые кипения и конденсации изображают зависимости т-р начала кипения и конденсации от состава и отделяют поля жидкости L и пара V от поля (L + V) гетерог. состояний жидкость пар. На кривой кипения м. б экстремум максимум (рис. 8,5) или минимум (рис. 8, в) в этих точках кривая кипения касается кривой конденсации, т. е. составы равновесных жидкости и пара совпадают Жидкие смеси такого состава полностью выкипают, подобно чистым жидкостям, при постоянной т-ре без изменения состава (см. Азеотропные смеси). Д.с., описывающие равновесия двухкомпонентных твердых р-ров с жидкими р-рами и жидких р-ров с паром, подобны [c.35]
На рис. VII. 16 приведена л — г/-фазовая диаграмма, состав пара ( )—состав жидкости (х). Зависимость у от х выражена линиями равновесий, расположенными выше диагонали. Следовательно, ординаты равновесия больше абсцисс, т. е. пары обогащены низкокипящим компонентом В. На этой фазовой диаграмме кривая равновесия и диагональ ограничивают область сосущество- [c.144]
Одной из главных особенностей систем соль — вода является практическое отсутствие твердых растворов на основе льда (исключение представляет фтористый аммоний) и твердых растворов воды в солях или гидратах. Поскольку при атмосферном давлении водные растворы солей не расслаиваются на две жидкие фазы, диаграммы растворимости в этом случае могут быть представлены тремя простейшими видами (рис. 1). Диаграмма первого вида отражает образование безводной соли ( 5 ), второго — гидрата (51), растворимого конгруэнтно, третьего — гидрата (5 ), растворимого инконгруэнтно. Буквами V, Ь в. 8 обозначены области существования пара, жидкости и твердого вещества буквой 5 о обозначен лед. Поле V от поля V Ь отделяет кривая кипения. В случае нелету- ей соли эта кривая показывает зависи- сть температуры кипения от состава явора состав пара при этом постоян-— он содержит только воду. [c.3]
Диаграмма, изображенная на рис. 79, отвечает системе, в которой гетероазеотрон не образуется. В этом случае во всем диапазоне концентраций пар богаче жидкости компонентом Л, имеющим более низкую температуру кипения. В соответствии с этим, кривая у— х для таких систем (кривая 2 на рис. 80) лежит выше диагонали. Характерной особенностью таких систем является то, что состав пара, находящегося в равновесии с жидкими фазами (точка С на рис. 79), не является промежуточным между составами последних, а температура трехфазного равновесия не является наинизшей температурой системы, как в случае образования гетероазеотропов. Поскольку температура кипения и давление паров взаимосвязата, системы первой группы, в которых образуются гетероазеотропы, [c.240]
В дальнейшем кривой равновесия мы будем называть такую кривую линию, которая в прямоугольной системе осей координат дает зависимость между составом жидкости и составом пара, находящимся в равновесии с жидкостью при некотором постоянном давлении. Выражая состав жидкости и пара в долях моля легколетучего компонента, кривую равновесия находят как линию, проведенную через точки пересечения абсцисс и ординат диаграммы, причем абсциссы представляют собой состав жидкости при некоторых температурах, а ординаты — состав пара над жикостью при тех же температурах. [c.476]
Диаграммы у — х. Диаграммы состав пара — состав жидкостй, т. е. у — X, соответствующие диаграммам р — х, изображенным на рис. 140(случай 1), 141 (случай II) и 142 (случай III), иллюстрируются на рис. 145 соответственно кривыми I, II и III. Общая форма этой д граммы одинакова, независимо оттого, поддерживаются ли постоянными давление или температура. [c.639]