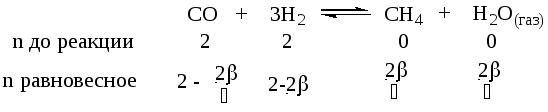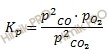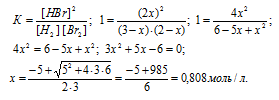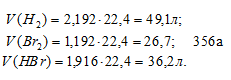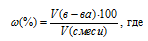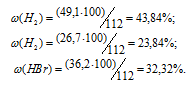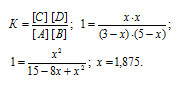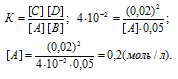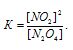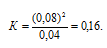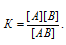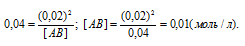Состав равновесной
смеси можно выразить, используя:
а) степень диссоциации
()
б) степень превращения
()
в) выход продукта
(х)
Рассмотрим
на примерах все эти случаи:
а)
по степени
диссоциации
Степень
диссоциации
()
– это доля продиссоциировавших молекул
от исходного числа молекул. Ее можно
выразить через количество вещества
, (1.20)
где nдисс
– число распавшихся молей исходного
вещества;n
исх
– число молей исходного вещества до
реакции.
Пусть до реакции
было, например, 5 моль NO2,
а α – степень диссоциации NO2.
По уравнению (1.20)
,
непрореагировавшим NO2
останется (5 – 5).
По уравнению
реакции при диссоциации 2 молей NO
2
получается 2 моля NO
и 1 моль O2,
а из 5
получается соответственно 5
молей NO
и
молей
О2.
Равновесная строчка будет такой:
б)
по степени превращения
Степень
превращения вещества
()
– это доля прореагировавших молекул
данного веществa
к исходному числу молекул этого вещества.
Выражаем через количество вещества в
молях
(1.21)
Пусть взято 2 моля
СО и 2 моля Н2,
— степень превращения водорода в реакции
Поясним равновесную
строчку. Исходим из вещества, для которого
известна степень превращения, т. е.
Н2.
Из уравнения (1.21) получаем nреаг=
nисх·
= 2 .
Из стехиометрического
уравнения видно, что СО расходуется в
3 раза меньше, чем Н2,
то есть если Н2
реагирует 2,
то СО прореагирует,
а остальное останется к моменту равновесия
не прореагировавшим. Также рассуждаем
в отношении продуктов, используя
стехиометрическое уравнение.
в) по
выходу продукта.
Выход продукта
(х) – количество конечного вещества в
молях. Пусть «х» выход метанола в
реакции
в
всех трех случаях рассуждения аналогичны
и исходят из вещества, для которого
что-либо известно (в примерах эта величина
подчеркнута).
Зная состав
равновесной смеси, можно выразить
константу равновесия. Так, для случая
«в»
а из уравнения
(1.19)
Выход вещества
в долях (или
%) – отношение количества образовавшегося
продукта к общему количеству вещества
в равновесной смеси:
В данном примере:
1.3.4 Влияние различных факторов на смещение равновесия (на состав равновесной смеси)
Влияние давления
(или объема) при Т= const
Если
система является идеальной, то константа
равновесия Кр
не зависит от давления (или объема). Если
же реакция идет при высоких давлениях,
то надо пользоваться уравнением:

где f
– фугитивность.
K
не зависит
от давления, величина же Kp
от давления зависит, но по мере уменьшения
давления приближается к величине Кf,
поскольку реальная газовая смесь
приближается к идеальному состоянию,
f
p.
Так, для
реакции:
при 350 атм Kf
= 0,00011 KР
= 0,00037
При невысоких
давлениях можно считать КР
не
зависящей от давления, то есть
.
В дальнейшем будем рассматривать именно
этот случай.
Из соотношения
(1.12) видно, что величины
,
будут зависеть от давления, поэтому, не
влияя на константу равновесия
,
изменение давления может влиять на
состав равновесной смеси, на выход
продуктов.

(1.23)
Уравнение (1.23)
показывает, что влияние давления на
обусловлено величинойn:
-
n
0, реакция идет с увеличением числа
молей газообразных продуктов, например:
n
= 1
,
то есть при повышении общего давления
Кх
уменьшается, уменьшается и количество
продуктов в равновесной смеси, то есть
равновесие смещается влево, в сторону
образования COCl2.
-
n
0
n
= 0-2-1= -3
,
то есть с увеличением давления Kx
(и выход продукта) увеличивается.
-
n
= 0
K=
K
= const.
В данном случае состав равновесной
смеси не зависит от давления.
Добавление
инертного газа
при Р = const
влияет на смещение равновесия аналогично
уменьшению давления. Инертным газом в
химическом равновесии считаются газы,
не взаимодействующие с реагентами или
продуктами реакции.
Увеличение объема
при постоянном давлении влияет на
смещение равновесия аналогично
уменьшению давления.
Влияние соотношения
между компонентами
На состав равновесной
смеси оказывает влияние и соотношение
взятых для реакции реагентов.
Наибольший выход
продуктов будет при стехиометрическом
соотношении. Так для реакции
соотношение
водорода и азота 3:1 даст наибольший
выход аммиака.
В ряде случаев
необходима высокая степень превращения
одного из реагентов даже в ущерб выходу
продукта.
Например, при
образовании хлористого водорода по
реакции
необходимо более
полное превращение хлора, чтобы в
равновесной смеси было как можно меньше
Cl2.
Равновесная смесь растворяется в воде
и таким образом получается соляная
кислота. При этом водород почти не
растворяется в воде и не содержится в
кислоте, в то время как свободный хлор
растворяется и ухудшается качество
соляной кислоты.
Для достижения
максимальной степени превращения Cl2
берут второй реагент, Н2,
в большом избытке.
Увеличение степени
превращения обоих компонентов можно
добиться, если выводить из реакционной
зоны продукты реакции, связывая их в
малодиссоциирующие, труднорастворимые
или нелетучие вещества.
Влияние температуры
на равновесие
Опыт показывает,
что температура оказывает большое
влияние на состав равновесной смеси, в
одних реакциях увеличивая содержание
продуктов реакции, в других — уменьшая.
Количественно эта зависимость отражается
уравнениями
изобары
(1.24) и изохоры
(1.25) Вант-Гоффа:
(1.24)
(1.25)
Из этих уравнений
видно, что изменение константы равновесия
при увеличении температуры (а значит и
изменение выхода продукта реакции)
определяется знаком теплового эффекта
H
и U:
-
H0
или U0
— реакция эндотермическая (с поглощением
тепла). Правые части уравнений больше
нуля, это означает, что и производные
больше нуля:
> 0;
> 0
Таким образом,
функции lnKp
и lnKc
(а также Kp
и Kc)
увеличиваются с ростом температуры.
-
H0
или U0
— реакция экзотермическая (с выделением
тепла).
< 0;
< 0
Константа равновесия
убывает с ростом температуры, т.е. убывает
содержание продуктов реакции в равновесной
смеси, а увеличивается содержание
исходных веществ.
Таким
образом, повышение температуры
способствует более полному протеканию
эндотермических
процессов. Проинтегрируем уравнение
изобары.
Пусть Hf(Т)
разделим переменные и интегрируем,
;
(1.26)
Как видим, константа
равновесия зависит от температуры по
экспоненциальному закону:
,
а в координатах ln
K
= f()
зависимость линейная (уравнение 1.26,
рисунок 1.7)
|
|
|
Рисунок
1.7 – Температурная зависимость константы
равновесия
Определенное
интегрирование уравнения изобары дает:
(1.27)
Зная величину
константы равновесия при одной какой-либо
температуре, можно найти Кр
при любой другой при известном значении
H.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Состав реакционной смеси
Объемный состав реакционной смеси в момент равновесия для реакции 2CO2 = 2CO + O2 был следующий: 88,7 % CO2, 7,52 % CO, 3,76 % O2. Найдите Kp и Kc для этой реакции, если общее давление в системе при данной температуре (273 К) равно 1,0133 ⋅ 105 Па.
Решение задачи
Для реакций, протекающих между газами, при вычислении константы равновесия удобно пользоваться парциальными давлениями реагирующих веществ. Константу равновесия Kp вычисляют через парциальные давления:
Где:
Kp – константа химического равновесия;
р (CO), р (O2), р (CO2)– парциальные давления соответственно CO, O2, CO2, Па.
Состав реакционной смеси. Определяем парциальные давления реагирующих веществ:
р (CO2) = 1,0133 ⋅ 105 ⋅ 0,8872 = 0,899 ⋅ 105 (Па);
р (CO) = 1,0133 ⋅ 105 ⋅ 0,0752 = 0,0762 ⋅ 105 (Па);
р (CO2) = 1,0133 ⋅ 105 ⋅ 0,0376 = 0,0381 ⋅ 105 (Па).
Получаем:
Kp = (0,0762 ⋅ 105)2 ⋅ 0,0381 ⋅ 105 /(0,899⋅ 105)2 = 27,35 (Па).
Состав реакционной смеси.
На основании уравнения состояния идеального газа Менделеева – Клайперона:
Где:
Δn – разность между числом молей газообразных веществ после и до реакции:
Δn = 3 – 2 = 1;
R = 8,3144 Дж/(моль ⋅ K);
T = 273 К.
Получаем:
Kc = 27,35 /8,3144 ⋅ 2273 = 1,44 ⋅ 10-3.
Ответ:
Kp равна 27,35 Па;
Kc равна 1,44 ⋅ 10-3.
Похожие задачи
Определение — состав — реакционная смесь
Cтраница 1
Определение состава реакционных смесей помимо получения данных для управления процессом полимеризации имеет большое значение и для изучения кинетики процессов гомо — и сопо-лимеризации.
[1]
Определение состава реакционных смесей при полимеризации 4-метилпентена — 1 или З — метилпентена-1 в среде бензина, а также возвратных мономеров проводят на хроматографе с детектором по теплопроводности.
[2]
Определение состава реакционной смеси этилен — винилацетат проводят на хроматографе с детектором ионизации в пламени.
[3]
Для определения состава реакционной смеси в расчетах приня — fbi следующие исходные данные: содержание свободной серной кислоты в сатураторе 5 % ( масс.); концентрация исходной серной кислоты, поступающей в сатуратор, 78 % ( масс.) H2SO4; масса воды, вводимой в сатуратор с аммиаксодержащими газами и промывной водой-1173 32 кг на 1000 кг сульфата аммония, содержащегося в реакционной смеси в сатураторе при установившемся режиме.
[4]
Хотя для определения состава реакционной смеси, состоявшей из четырех компонентов, достаточно было найти содержание одного из них ( остальные можно было определить расчетным путем, так как количественное соотношение взятых в реакцию исходных веществ было известно), мы предпочли строить аналитическую схему таким образом, чтобы все четыре компонента определялись исключительно на основании данных, добытых путем соответствующих анализов. Если бы определялся только один компонент, то каждая ошибка в таком определении расчетом была бы перенесена на все остальные компоненты, и возможность контроля правдоподобности полученных данных была бы утрачена.
[5]
Одним из методов определения состава реакционных смесей является рефрактометрический метод, позволяющий измерять коэффициент ( показатель) преломления ( рефракции), который зависит от концентрации растворенного вещества. При измерении обычно сравнивают показатели преломления исследуемого и эталонного растворов.
[6]
Основными экспериментальными методами определения Кр или АГС) являются: 1) метод, основанный на прямом измерении равновесия в данной реакции ( определение состава реакционной смеси при достижении равновесия в данных условиях); 2) динамические методы, основанные на закалке потока равновесной смеси газов; 3) метод, основанный на измерении электродвижущей силы обратимого гальванического элемента, в котором изотермически осуществляется данная реакция.
[8]
Основными экспериментальными методами определения Кр ( или Кс) являются: 1) метод, основанный на прямом измерении равновесия в данной реакции ( определение состава реакционной смеси при достижении равновесия в данных условиях); 2) динамические методы, основанные на закалке потока равновесной смеси газов; 3) метод, основанный на измерении электродвижущей силы обратимого гальванического элемента, в котором изотермически осуществляется данная реакция.
[10]
Следует отметить, что при выводе приведенных соотношений сделаны следующие предположения: только две концентрации необходимы для определения состава реакционной смеси; состав загрузки постоянен и отсутствует промежуточная загрузка. Кроме того, предполагалось, что М не зависит от температуры каждого из реакторов.
[11]
Яффе и Даук [22] детально изучили кинетику реакции диспропорционирования арилстибиноксидов. Они показали, что превращение фенилстибинок-сида в дифенилстибиноксид при 75 — 100 С в атмосфере азота протекает гладко и без побочных процессов. Для определения состава реакционной смеси ее многократно обрабатывали эфиром, причем количественно извлекался только чистый дифенилстибиноксид.
[12]
Существуют и другие методы, в частности разработанный Нернстом и его школой метод, основанный на использовании так называемых химических постоянных. Второй из указанных выше методов рассмотрен в главе XIII; третьему — специально посвящены § 103 и следующие. Необходимо отметить, что первый метод-прямого определения состава реакционной смеси при равновесии — хотя и непосредственно отвечает поставленной задаче, однако связан с большими трудностями экспериментального характера, которые часто препятствуют получению точных результатов и нередко делают его практически неприменимым.
[13]
Существуют и другие методы, в частности разработанный Нернстом и его школой метод, основанный на использовании так называемых химических постоянных. Второй из указанных выше методов рассмотрен в главе XIII; третьему-специально посвящены § 103 и следующие. Необходимо отметить, что первый метод-прямого определения состава реакционной смеси при равновесии-хотя и непосредственно отвечает поставленной задаче, однако связан с большими трудностями экспериментального характера, которые часто препятствуют получению точных результатов и нередко делают его практически неприменимым.
[14]
Страницы:
1
Определение состава и концентраций веществ в равновесной реакционной смеси
Задача 356.
Для реакции Н2(г) + Br2(г) = 2HBr(г) при некоторой температуре К = 1. Определить состав (в процентах по объему) равновесной реакционной смеси, если исходная смесь состояла из 3 молей Н2 и 2 молей Вг2.
Решение:
Уравнение реакции имеет вид:
Н2(г) + Br2(г) = 2HBr(г)
Согласно уравнению реакции из 1 моля Н2 и 1 Br2 образуется 2 моль HBr. Обозначим количество израсходованных исходных веществ через x. Тогда равновесные концентрации реагирующих веществ будут раны:
[Н2] = (3 – х) моль/л, [Br2] = (2 – х) моль/л, [HBr] = (2х) моль/л. Подставив эти значения концентраций в выражение константы равновесия реакции, рассчитаем значение x:
Тогда равновесные концентрации веществ будут равны:
[Н2] = 3 — 0,808 = 2,192 моль/л;
[Br2] = 2 – 0,808 = 1,192 моль/л;
[HBr] = 2 . 0,808 = 1,616 моль/л.
Находим объёмы газов в равновесной системе, учитывая, что 1 моль любого газа при нормальных условиях занимает 22,4л, получим:
Тогда общий объём газовой равновесной системы будет равен 112 л (49,1 + 26,7 + 36,2 = 112).
Теперь определим состав газов (в процентах по объему) равновесной реакционной смеси по формуле:
w% — объёмная доля вещества, выраженная в процентах, V(в-ва) — объём вещества, V(смеси) — общий объём газовой смеси.
Тогда
Ответ: 43,84% Н2; 23,84% Br2; 32,32%HBr.
Задача 357.
Константа равновесия реакции равна единице. Сколько процентов вещества А подвергнется превращению, если смешать З моля вещества А и 5 молей вещества В?
Решение:
Уравнение реакции имеет вид:
А(г) + В(г) = С(г) + D(г)
Согласно уравнению реакции из 1 моля вещества А и 1 моля вещества В образуется по 1 молю веществ С и D. Обозначим равновесные концентрации веществ С и D через x. Тогда равновесные концентрации веществ будут раны: [C] = [D] = моль/л, [A] = (3 – х)моль/л, [B] = (5 – х)моль/л. Подставив эти значения концентраций в выражение кон-станты равновесия реакции, рассчитаем значение x:
Теперь рассчитаем, сколько процентов вещества А подвергнется превращению из пропорции:
3 : 100 = 1,875 : x; x = (1,875 . 100)/3 = 62,5%
Ответ: 62,5%.
Задача 358.
После смешивания газов А и В в системе А(г) + В(г) = С(г) + D(г) устанавливается равновесие при следующих концентрациях: [B] = 0,05 моль/л; [C] = 0,02 моль/л. Константа равновесия реакции равна 4.102. Найти исходные концентрации веществ А и В.
Решение:
Уравнение реакции имеет вид:
А(г) + В(г) = С(г) + D(г) .
Согласно уравнению реакции из 1 моля вещества А и 1 моля вещества В образуется по 1 молю веществ С и D.
Поскольку по условию задачи в каждом литре системы образовалось 0,02 моля вещества С, то такое же количество образовалось вещества D, было израсходовано по 0,02 моля веществ А и В.
Сначала найдём концентрацию вещества А из выражения для константы равновесия реакции:
Отсюда рассчитаем искомые исходные концентрации веществ А и В:
[A]0 = 0,2 + 0,02 = 0,22 моль/л;
[B]0 = 0,05 + 0.02 = 0,07 моль/л.
Ответ: [A]0 = 0,22 моль/л; [B]0 = 0,07 моль/л.
Задача 359.
Найти константу равновесия реакции N2O4 ⇔ 2NO2, если начальная концентрация N2O4 составляла 0,08 моль/л, а к моменту наступления равновесия диссоциировало 50% N2O4.
Решение:
Уравнение реакции имеет вид: N2O4 ⇔ 2NO2. Из уравнения реакции следует, что из 1 моля N2O4 образуется 2 моля NO2. Поскольку по условию задачи 50% N2O4 диссоциировало, то количество N2O4, продиссоциировавшегося составляет 0,04 моль/л (0,08 . 0,5 = 0,04).
Тогда равновесные концентрации участвующих веществ будут равны:
[N2O4]0 = 0,08 – 0,04 = 0,04 моль/л;
[NO2]0 = 0,04 . 2 = 0,08 моль/л
Выражение для константы равновесия для данной реакции будет иметь вид:
Подставляя в это выражение данные из задачи, получим:
Ответ: 0,16
Задача 360.
В замкнутом сосуде протекает реакция АВ(г) ⇔ А(г) + В(г) Константа равновесия реакции равна 0,04, а равновесная концентрация вещества В составляет 0,02 моль/л. Найти начальную концентрацию вещества АВ. Сколько процентов вещества АВ разложилось?
Решение:
Уравнение реакции имеет вид: АВ(г) ⇔ А(г) + В(г). Из уравнения реакции следует, что из 1 моля вещества АВ образуется 1 моль вещества А и 1 моль вещества В. Поскольку по условию задачи в каждом литре системы образовалось 0,02 моля вещества В, то столько же образовалось и вещества А, при этом было израсходовано 0,02 моля вещества АВ.
Константа равновесия данной реакции выражается уравнением
Подставляя в это выражение данные задачи, рассчитаем равновесную концентрацию вещества АВ:
Таким образом, искомая исходная концентрация вещества АВ будет равна:
[AB]0 = 0,02 + 0,01 = 0,03 моль/л
Сколько процентов вещества АВ разложилось находим из пропорции:
0,03 : 100 = 0,02 : х = (0,02 . 100)/0,03 = 66,7%
Ответ: [AB]0 = 0,03 моль/л; 66,67%.
Расчет состава смеси по химической реакции
Стандартный сценарий подобных задач сводится к тому, что смесь двух
веществ реагирует с одним реагентом. Зная количество израсходованного
реагента (полученного продукта), и массу смеси веществ, можно
определить доли каждого из веществ. Возможны несколько усложненные
варианты: например, когда масса смеси веществ неизвестна, но смесь
веществ участвует в двух реакциях, или когда дана смесь из трех веществ
с известной массой и две серии реакций. Встречаются задачи, когда смесь
из трех веществ неизвестной массы участвует в трех сериях реакций.
Анализу различных способов решения этих задач посвящена данная
глава.
Задача 2.1.
В результате полного восстановления 30,4 г смеси монооксида
железа FeO и триоксида дижелеза Fe2O3 избытком CO
было получено 11,2 л (н. у.) углекислого газа. Определите массовую долю
монооксида железа в смеси.
Способ 2А. Составлением системы уравнений. Начнем решение задачи с
составления уравнений реакций:
FeO + CO Fe + CO2
Fe2O3 + 3CO 2Fe + 3CO2
Под уравнениями подставим данные, соответствующие молярному уровню
прочтения уравнения. Например, уравнение взаимодействия триоксида
дижелеза с СО можно прочитать так: В результате взаимодействия 1 моля
Fe2O3 c 3 молями угарного газа образуется 2 моля металлического железа
и 3 моля углекислого газа. Над уравнением поместим данные,
соответствующие условию задачи, введя минимальное число неизвестных.
Предварительно переведем полученный объем углекислого газа в количество
вещества n(СО2)=11,2:22,4=0,5 моль
x
г
(0,5-y)
FeO + СО ® Fe + СО2
1
моль
1 моль
72
г
(30,4-x)г
y
Fe2O3 + 3СО ® 2Fe + 3СО2
1
моль
3 моль
160
г
Отношение массы реагента из условия задачи к массе реагента,
подставленной из уравнения реакции, равно такому же отношению масс,
молей, объемов для продукта реакции, т. е.: x/72=(0,5-y):1 и
(30,4-x)/160=y/3. Таким образом, мы получили систему уравнений с двумя
неизвестными. Решение системы уравнений даст количество диоксида
углерода, полученного при восстановлении Fe2O3 равное 0,3 молям.
Следовательно, при восстановлении FeO образовалось 0,2 моль CO2. Значит
в исходной смеси находилось 0,2 моль FeO и 0,1 моль Fe2O3. Общая масса
такой смеси будет равна 0,2·72 + 0,1·160=30,4. Массовая доля FeO будет
равна 14,4:30,4=0,4737 или 47,37%.
Способ 2Б. Составлением системы уравнений в неявном виде.
Этот способ является более простым в сравнении с предыдущим, т. к.
связан с более легкими расчетами. Отличие его от способа 2а состоит в
том, что количества продуктов, выражаем двумя неизвестными, например,
y1 и y2.
x г
y1
FeO + CO ® Fe + CO2
1
моль
1 моль
72
г
(30,4-x)г
y2
Fe2O3 + 3CO ® 2Fe + 3CO2
1
моль
3 моль
160
г
Нам известно, что y1 + y2 = 0,5 моль (11,2 л). Из пропорций выразим y1
и y2, подставив полученные значения в предыдущее уравнение, получим:
х:72 + 3(30,4-x):160 = 0,5. Решив уравнение получим х=14,4.
Способ 2В. С использованием количества вещества.
х
у
FeO + CO ® Fe + CO2
у
3у
Fe2O3 + 3CO ® 2Fe + 3CO2
Примем количество FeO за х, а количество Fe2O3 за у. Из уравнений реакций следует, что 1 моль FeO позволит получить 1 моль углекислого газа. А 1 моль Fe2O3 — 3 моль углекислого газа. Следовательно из х моль FeO получится х моль углекислого газа, а из у моль Fe2O3 — 3у моль СО2. Выразим массу оксидов железа через принятые нами количества вещества. m(FeO)=72x; m(Fe2O3) = 160y. Полученные значения масс позволяют получить первое уравнение m(FeO) + m(Fe2O3)
= 30,4 или 72х + 160у = 30,4. Найдём полученное количество углекислого
газа 11,2/22,4=0,5. Найдя суммарное в обеих реакциях количество
углекислого газа, получим второе уравнение. х + 3у = 0,5. Таким образом
нам удалось получить систему уравнений с двумя неизвестными: 72х + 160у
= 30,4
х + 3у = 0,5
Умножив второе уравнение на 72 получим: 72х + 216у = 36. Отняв от
первого уравнения второе найдем: 56у=5,6. Откуда у=0,1, а х = 0,2.
Таким образом массовая доля монооксида железа будет равна w(FeO)= 0,2·72/30,4= 14,4/30,4=0,4737 или 47,37%.
Задача 2.2.
Смесь муравьиной и уксусной кислот была поделена на 2 равные части.
Одна часть смеси при взаимодействии с магнием выделила 5,6 л водорода,
а другая была сожжена. Продукты ее сгорания были пропущены в
избыток раствора известковой воды. Масса выпавшего при этом осадка
составила 80 г. Определите состав исходного раствора (в мольных долях)
и его массу.
Для решения задачи воспользуемся способом 2в. Начнем с
составления уравнений реакций химических процессов, описанных в задаче.
2CH3COOH + Mg ® Mg(CH3COO)2 + H2
2HCOOH + Mg ® Mg(HCOO)2 + H2
CH3COOH + 2O2 ® 2CO2 + 2H2O
HCOOH + 0,5O2 ® CO2 + H2O
CO2 + Ca(OH)2 ® CaCO3 + H2O
Найдем количество выделившегося водорода. n (Н2) = 5,6/22,4=0,25 моль.
Из уравнений реакции кислот с магнием следует, что количество кислот
вдвое превышает количество выделившегося водорода. Значит n(СН3СООН) +
n(НСООН) = 0,5 моль.
С
другой стороны, из уравнения реакции углекислого газа с гидроксидом
кальция следует, что количество выпавшего в осадок карбоната кальция
равно количеству образовавшегося в ходе реакции горения кислот
углекислого газа. n(СаСО3) = m/M=80/100 = 0,8 моль. Þ n(СО2) = 0,8 моль.
Каждый моль муравьиной кислоты в результате горения образует 1 моль
углекислого газа, а каждый моль уксусной кислоты образует 2 моль
углекислого газа. Þ n(НСООН) + 2n(СН3СООН) = 0,8 моль.
Решим полученную систему уравнений:
n(СН3СООН) + n(НСООН) = 0,5 моль.
n(НСООН) + 2n(СН3СООН) = 0,8 моль.
Решив найдем, что n(СН3СООН) = 0,3 моль (после разделения)
n(НСООН)=0,2 моль (после разделения).
Нетрудно определить, что количество исходной уксусной смеси в смеси
до её разделения было равно 0,3*2=0,6 моль; количество исходной
муравьиной кислоты было равно 0,2*2=0,4 моль. Мольная доля уксусной
кислоты в исходной смеси равна c(СН3СООН) = 0,6/1=0,6 или 60%. Мольная
доля муравьиной кислоты равна c(НСООН) = 0,4/1=0,4 или 40%.
Масса исходного раствора равна m(НСООН) + m(СН3СООН) = 0,4*46 + 0,6*60= 18,4 + 36 = 54,4 г.
Задача 2.3. При
сжигании 2,48 г смеси пропана, пропена, пропина образовалось 4,03 л
углекислого газа (н. у.). Сколько граммов воды получилось при этом?
Для решения найдем количество углекислого газа. n(СО2)= V:Vм=4,03 л: 22,4 л/моль =0,18 моль. n(С)= n(СО2)=0,18 моль. Найдем массу углерода m(C)= n·M= 0,18 моль·12 г/моль=2,16 г. Масса водорода, входящего в состав углеводородов будет равна m(H) = 2,48 г — 2,16 г = 0,32 г. Найдем количество водорода n(Н)= m/M 0,32 г/1 г/моль = 0,32 моль. n(Н)= n(Н2О)·2. n(Н2О)=0,16 моль. m(H2O) = n·M = 0,16моль·18=2,88 г.
|
Физически двойные звезды
Физически двойные звезды по эллипсам вращаются вокруг общего центра масс. Однако, если отсчитывать координаты одной звезды относительно другой, то получится, что звезды движутся друг относительно друга тоже по эллипсам. На этом рисунке за начало отсчета мы взяли более массивную голубую звезду. В такой системе центр масс (зеленая точка) описывает вокруг голубой … |
Задание 6
Задание 6 Перед ребенком на столе раскладываются четыре карточки (см. ниже). Учитель уточняет, знает ли ученик названия предметов, изображенных на них, просит назвать их. Затем, обращаясь к ученику, говорит: «Отбери из этих четырех картинок ту, в названии которой первый звук такой же, как и в слове «ласточка». Задание для углубленной диагностики. |
|
Формы естественного отбора
В настоящее время выделяют несколько форм естественного отбора, главными из которых являются стабилизирующий, движущий, или направленный, и дизруптивный. |
Тип Хордовые
К типу относится около 43 тыс. видов животных, заселивших моря, океаны, реки и озера, поверхность и почву континентов и островов. Внешний облик и размеры хордовых разнообразны, так же как и их размеры: от мелких рыбок и лягушек в 2—3 см до гигантов (некоторые виды китов достигают длины 30 м и массы 150 т). |