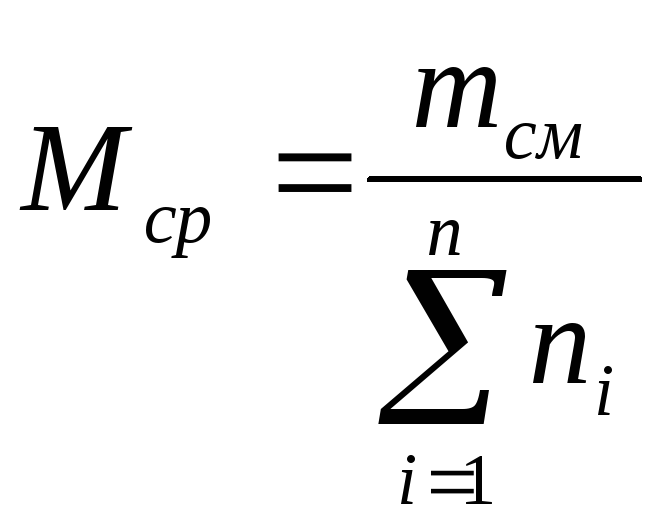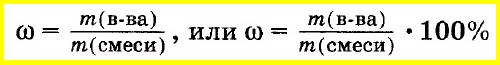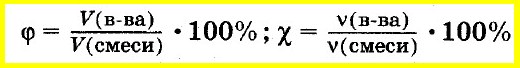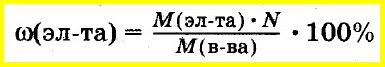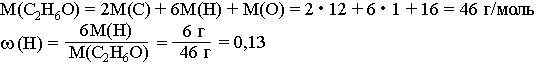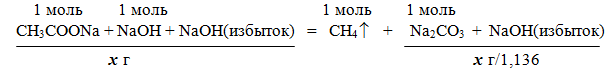Смесь, состоящая из
двух и более компонентов, характеризуется
свойствами и содержанием этих компонентов.
Состав смеси может быть задан массой,
объемом, количеством (числом молей или
килограмм-молей) отдельных компонентов,
а также значениями их концентраций.
Концентрацию компонента в смеси можно
выразить в весовых, мольных и объемных
долях или процентах, а также в других
единицах.
Массовая
доля i
какого-либо компонента определяется
отношением массы mi
данного компонента к массе всей смеси
mсм:
Учитывая,
что суммарная масса смеси равна сумме
масс отдельных компонентов, т.е.
можно написать:
или сокращенно:
Пример
4. Смесь
состоит из двух компонентов: m1
= 500 кг, m2
= 1500 кг. Определить массовую долю каждого
компонента в смеси.
Решение.
Массовая
доля первого компонента:
mсм=
m1
+ m2
= 500 + 1500 = 2000 кг
Массовая доля второго компонента:
Массовую
долю второго компонента можно определить
также, используя равенство:
1
+ 2
= 1
2
= 1 – 1
= 1 – 0,25 = 0,75
Объемная
доля i
компонента в смеси равна отношению
объема Vi
данного компонента к объему всей смеси
V:
Учитывая, что:
можно написать:
Пример
5.
Газ состоит из двух компонентов: V1
= 15,2 м3
метана и V2
= 9,8 м3
этана. Подсчитать объемный состав смеси.
Решение.
Общий объем смеси равен:
V
= V1
+ V2
= 15,2 + 9,8 = 25 м3
Объемная доля в смеси:
метана
этана
v2
= 1 – v1
= 1 – 0,60 = 0,40
Мольная
доля ni
какого-либо компонента смеси определяется
как отношение числа киломолей Ni
данного компонента к общему числу
киломолей N
смеси:
Учитывая,
что:
получим:
Пересчет мольных
долей в массовые можно проводить по
формуле:
Пример
6. Смесь
состоит из 500 кг бензола и 250 кг толуола.
Определить мольный состав смеси.
Решение.
Молекулярный
вес бензола (С6Н6)
равен 78, толуола (С7Н8)
– 92. Число килограмм-молей равно:
бензола
толуола
общее число
килограмм-молей:
N
= N1
+ N2
= 6,41 + 2,72 = 9,13
Мольная доля
бензола равна:
Для толуола мольная
доля может быть найдена из равенства:
n1
+ n2
= 1
откуда: n2= 1 –n1= 1 – 0,70 = 0,30
Среднюю молекулярную
массу смеси можно определить, зная
мольную долю и молекулярную массу
каждого компонента смеси:
(21)
где
ni
— содержание
компонентов в смеси, мол. доли; Mi
— молекулярная
масса компонента смеси.
Молекулярную массу смеси нескольких
нефтяных фракций можно определить по
формуле

или
(23)
где
m1,
m2,…,
mn
— масса
компонентов смеси, кг; M1,
М2,….,.Мп
— молекулярная масса компонентов смеси;
— % масс. компонента.
Молекулярную
массу нефтепродукта можно определить
также по формуле Крэга

Пример
7.
Определить среднюю молекулярную массу
смеси бензола с изооктаном, если мольная
доля бензола составляет 0,51, изооктана
0,49.
Решение.
Молекулярная масса бензола 78, изооктана
114. Подставляя эти значения в формулу
(21), получаем
Мср
= 0,51
78 + 0,48114
= 95,7
Пример
8. Смесь
состоит из 1500кг бензола и 2500кг н-октана.
Определить среднюю молекулярную массу
смеси.
Решение.
Используем формулу (22)
Объемный
молярный состав пересчитывают в массовый
следующим образом. Данный объемный
(молярный) состав в процентах принимают
за 100 молей. Тогда концентрация каждого
компонента в процентах будет выражать
число его молей. Затем число молей
каждого компонента умножают на его
молекулярную массу и получают массу
каждого компонента в смеси. Разделив
массу каждого компонента на общую массу,
получают его массовую концентрацию.
Массовый
состав пересчитывают в объемный
(молярный) следующим образом. Принимают,
что смеси взято 100 (г, кг, т) (если массовый
состав выражен в процентах), массу
каждого компонента делят на его
молекулярную массу. Получают число
молей. Делением числа молей каждого
компонента на их общее число получают
объемные (молярные) концентрации каждого
компонента.
Средняя плотность
газа определяется по формуле:
кг/м3;
г/см3
или, исходя из
объемного состава:
,
или, исходя из
массового состава смеси:

Относительную плотность определяют по
формуле:
Пример 9.Пересчитать массовый
состав газа в объемный и определить его
молекулярную массу, его плотность и
относительную плотность.
|
Компоненты |
М г/моль |
массовый % масс. |
mi |
Число
|
Объемный |
|
|
доли единицы |
% об. |
|||||
|
Метан |
16 |
40 |
40 |
40:16=2,50 |
0,669 |
66,9 |
|
Этан |
30 |
10 |
10 |
10:30=0,33 |
0,088 |
8,8 |
|
Пропан |
44 |
15 |
15 |
15:44=0,34 |
0,091 |
9,1 |
|
Бутан |
58 |
25 |
25 |
25:58=0,43 |
0,115 |
11,5 |
|
Пентан + высшие |
72 |
10 |
10 |
10:72=0,14 |
0,037 |
3,7 |
|
100 |
100 |
3,74 |
1,000 |
100,0 |
Для
простоты расчета примем массу смеси за
100 г, тогда масса каждого компонента
будет численно совпадать с процентным
составом. Найдем число молей ni
каждого компонента. Для этого массу
каждого компонента mi
разделим на мольную массу:
Находим объемный
состав смеси в долях единицы
i(CH4)
= 2,50 : 3,74 = 0,669;
(C2H6)
= 0,33 : 3,74 = 0,088;
(C5H8)
= 0,34 : 3,74 = 0,091;
(C4H10)
= 0,43 : 3,74 = 0,115;
(C5H12)
= 0,14 : 3,74 = 0,037.
Находим
объемный состав смеси в процентах,
умножив данные в долях единицы на 100%.
Все полученные данные заносим в таблицу.
Рассчитываем
среднюю массу смеси.
Мср
= 100 : 3,74 =
26,8 г/моль
Находим
плотность смеси
Находим относительную
плотность:
Пример 10.Пересчитать объемный
состав в массовый и определить его
молекулярную массу, его плотность и
относительную плотность.
|
Компоненты |
М г/моль |
Объемный % об. |
число |
Масса г. |
Весовой |
|
|
доли единицы |
% масс. |
|||||
|
Метан |
16 |
30 |
30 |
3016=480 |
0,117 |
11,7 |
|
Этан |
30 |
15 |
15 |
15·30=450 |
0,109 |
10,9 |
|
Пропан |
44 |
20 |
20 |
20·44=880 |
0,214 |
21,4 |
|
Бутан |
58 |
15 |
15 |
15·58=870 |
0,211 |
21,1 |
|
Пентан + высшие |
72 |
20 |
20 |
20·72=1440 |
0,349 |
34,9 |
|
100 |
100 |
4120 |
1,000 |
100,0 |
(CH4)
= 480 : 4120 = 0,117;
(C2H6)
= 450 : 4120 = 0,109;
(C3H8)
= 880 : 4120 = 0,214;
(C4H10)
= 870 : 4120 = 0,211;
(C5H12)
= 1440 : 4120 = 0,349.
Мср
= 4120 : 100 =
41,2 г/моль.
г/л
Задача 15. Смесь состоит из пяти
компонентов. Определить массовую,
объемную и мольную долю каждого компонента
в смеси, среднюю молекулярную массу
смеси.
|
Компоненты смеси |
Вариант |
|||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
mi |
mi |
mi |
||||||||
|
метан |
5 |
30 |
55 |
80 |
100 |
75 |
50 |
25 |
5 |
30 |
|
этан |
10 |
35 |
60 |
85 |
95 |
70 |
45 |
20 |
10 |
35 |
|
пропан |
15 |
40 |
65 |
90 |
90 |
65 |
40 |
15 |
15 |
40 |
|
н-бутан |
20 |
45 |
70 |
95 |
85 |
60 |
35 |
10 |
20 |
45 |
|
изобутан |
25 |
50 |
75 |
100 |
80 |
55 |
30 |
5 |
25 |
50 |
Задача 16.Пересчитать массовый
состав газа в объемный и определить его
молекулярную массу, плотность и
относительную плотность по воздуху.
|
Компоненты смеси |
ω% массовый |
|||||||||
|
Варианты |
||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
метан |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
40 |
45 |
50 |
|
этан |
50 |
45 |
40 |
35 |
30 |
25 |
20 |
15 |
10 |
5 |
|
пропан |
5 |
10 |
20 |
10 |
5 |
10 |
15 |
20 |
25 |
30 |
|
бутан |
10 |
10 |
20 |
15 |
30 |
25 |
20 |
15 |
10 |
5 |
|
пентан |
30 |
25 |
5 |
20 |
10 |
20 |
10 |
10 |
10 |
10 |
Задача 17. Пересчитать объемный
состав газа в массовый и определить его
молекулярную массу, плотность и
относительную плотность по воздуху.
|
Компоненты смеси |
объемный состав |
|||||||||
|
Варианты |
||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
метан |
10 |
5 |
20 |
5 |
20 |
10 |
10 |
35 |
40 |
10 |
|
этан |
45 |
50 |
15 |
20 |
25 |
30 |
10 |
20 |
15 |
5 |
|
пропан |
10 |
5 |
10 |
20 |
10 |
5 |
25 |
15 |
20 |
30 |
|
бутан |
10 |
10 |
35 |
40 |
25 |
30 |
10 |
20 |
15 |
5 |
|
пентан |
15 |
30 |
20 |
15 |
30 |
25 |
45 |
10 |
10 |
50 |
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
Решение задач с долей вещества в смеси, в соединении
Ключевые слова конспекта: массовая доля вещества в смеси или растворе, молярная доля вещества, объемная доля вещества, массовая доля элемента в соединении, масса элемента, массовая доля элемента.
Массовую долю вещества в смеси или растворе вычисляют как отношение массы вещества, входящего в состав смеси, к массе всей смеси. Массовую долю часто выражают в процентах. Для этого отношение массы вещества к массе смеси умножают на 100%:
Аналогично объемную долю вещества вычисляют как отношение объема вещества к объему смеси, а молярную долю вещества — как отношение количества вещества одного из компонентов смеси к сумме количеств веществ всех компонентов смеси:
Массовую долю элемента в соединении вычисляют как отношение массы элемента, входящего в состав данного соединения, к массе всего соединения:
Зная молекулярную формулу соединения, массу элемента, входящего в его состав, вычисляют как произведение молярной массы элемента на число атомов этого элемента в соединении.
В этом случае массовую долю элемента в соединении рассчитывают как отношение этой величины к молярной массе всего соединения:
Цитаты из пособия «Задачи по химии 8-9 кл.» (авт. О.С. Габриелян и др.) использованы в учебных целях. Ссылка на покупку книги указана в конце конспекта.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача № 1.
25 г оксида магния смешали с 35 г оксида алюминия. Определите массовую долю оксида магния в данной смеси.
Ответ. ω(MgO) = 0,417, или 41,7%.
Задача № 2.
Вычислите объемную долю азота в смеси газов, содержащей 32 л азота, 48 л углекислого газа, 36 л гелия и 14 л водорода.
Ответ. φ(N2) = 0,246, или 24,6%.
Задача № 3.
Вычислите молярную и массовую долю (в %) оксида углерода (II) в смеси, содержащей 16,8 л (н. у.) оксида углерода (II) и 13,44 л (н. у.) оксида углерода (IV).
Ответ. χ(СО) = 55,56%, ω(СО) = 44,3%.
Задача № 4.
В воде растворили 15 г хлорида натрия. Вычислите массу полученного раствора, если массовая доля соли в нем равна 5%.
Ответ: m(р-ра) = 300 г.
Задача № 5.
Образец сплава меди с цинком имеет массу 75 г. Массовая доля меди в этом сплаве равна 64%. Определите массу цинка в данном образце.
Ответ. m(Zn) = 27 г.
[highlight]Задача № 6.[/highlight] Объемная доля аммиака в смеси с кислородом равна 40%. Вычислите плотность данной смеси по воздуху.
Посмотреть РЕШЕНИЕ
Ответ. Dвозд(смеси) = 0,896.
Задача № 7.
Найдите массовую долю кислорода в фосфате натрия.
Посмотреть РЕШЕНИЕ
Ответ. ω (O) = 39%.
[highlight]Задача № 8.[/highlight] Определите массовую долю фосфора в смеси, содержащей 55 г фосфата натрия и 70 г дигидрофосфата натрия.
Посмотреть РЕШЕНИЕ
Ответ. ω(Р) = 22,77%
[highlight]Задача № 9.[/highlight] Массовая доля серы в техническом сульфате натрия равна 20,48%. Рассчитайте массовую долю примесей в данном продукте (в %).
Посмотреть РЕШЕНИЕ
Ответ. ω (примесей) = 9,12%.
Задача № 10.
Плотность смеси оксида азота (II) и оксида азота (IV) по водороду равна 17,8. Найдите массовую долю оксида азота (IV) в данной смеси.
Посмотреть РЕШЕНИЕ
Ответ. ω(NO2) = 45,2%.
Решение задач с долей вещества в смеси, в соединении. Выберите дальнейшие действия:
- Перейти к следующей теме: Решение задач на вывод формул соединений
- Вернуться к списку конспектов по Химии.
- Проверить знания по Химии.
- Купить книгу Задачи по химии и способы их решения. 8-9 кл. / О.С. Габриелян и др. — М.: Дрофа.
Компонентный состав раствора может изменяться в достаточно широких пределах. При работе с растворами важно знать количественный состав компонентов, в частности массовую долю растворенных веществ. Эту важную количественную характеристику всегда отмечают на этикетках химических реактивов, пищевых продуктов, лекарственных средств в форме растворов.
Виды количественных характеристик
На практике для описания растворов применяют несколько различных количественных характеристик указывающих на массовый (массовая часть, ww), объемный (объемная часть, фtext{ф}) мольный (мольная часть, χχ) составы.
Наиболее часто в химии используется массовая доля ww.
Массовая доля
Отношение массы одного вещества с массой mm к массе всей смеси mm (смеси), определяемой как
w(X)=m(X)m(X)+m(S),w(X)=frac{m(X)}{m(X)+m(S)},
где w(X)w(X) – собственно массовая доля растворенного компонента XX;
m(Х)m(Х) – масса растворенного компонента XX, г;
m(S)m(S) – масса растворителя SS, г;
mm (раствора) = m(Х)+m(S)m (Х) + m (S), г.
Сумма массовых долей всех компонентов раствора равна 1.
Массовая доля также может быть выражена в процентах по массе с добавлением 100 в знаменателе (такое выражение часто называются процентами по массе).
Другие способы выражения состава смеси в безразмерном размере – мольная доля (χχ в единицах или процентах по молям, мол. %) и объемная доля (фtext{ф} в единицах или процентах по объему, об. %) формульно являются аналогичными.
Объемная доля
ф(X)=V(X)V(X)+V(S),text{ф}(X)=frac{V(X)}{V(X)+V(S)},
где ф(X)text{ф}(X) – собственно объемная доля растворенного вещества XX;
V(Х)V(Х) – объем растворенного компонента –XX, л;
V(S)V(S) – объем растворителя SS, л;
VV(раствора) = V(Х)+V(S)V(Х) + V(S), л.
Кроме литров, также могут использоваться и другие единицы измерения объема.
Следует заметить, что в ряде случаев истинное значение объемной доли может отличатся от расчетного, что связано с возможными химическими и физическими взаимодействиями между растворителем и растворяемым веществом. Кроме того, например в случае смеси этанола и воды, которые смешиваются во всех пропорциях, обозначение растворителя и растворенного вещества является произвольным. А объем такой смеси немного меньше суммы объемов компонентов. Таким образом, согласно вышеприведенному определению, термин «40% спирта по объему» относится к смеси из 40 объемных единиц этанола с достаточным количеством воды, чтобы получить конечный объем 100 единиц, а не смесь 40 единиц этанола с 60 единицами воды.
Мольная доля
χ(X)=n(X)n(X)+n(S)chi(X)=frac{n(X)}{nleft(Xright)+n(S)}
где χ(X)χ(X) – собственно мольная доля компонента XX;
n(Х)n(Х) — количество растворенного XX, моль;
n(S)n(S) — количество растворителя SS, моль;
nn(раствора) = n(Х)+n(S)n(Х) + n(S), моль.
Сумма мольных долей всех компонентов раствора так же равна 1 или 100%.
Для элементарного анализа массовая доля (или массовый процентный состав) также может относиться к отношению массы одного элемента к общей массе соединения. Его можно рассчитать для любого соединения, используя его эмпирическую формулу или ее химическую формулу.
Сумма долей компонентов всегда составляет 1 или 100%.
Молярная концентрация
Кроме безразмерных характеристик расствора, применяют и некоторые размерные характеристики, такие как концентрация.
Молярная концентрация (также называемая молярностью, количественной концентрацией или концентрацией вещества) является показателем соотношения количества вещества на единицу объема раствора. В химии наиболее часто используемой единицей для молярности является количество молей на литр, имеющих единичный знак моль / л. Раствор с концентрацией 1 моль / л считается 1 молярным, обычно обозначаемым как 1 М.
Пример задачи на нахождение массовой доли
Рассмотрим пример задачи на нахождение массовой доли.
Условие.
Определить массовую долю растворимого компонента Х в растворе, при изготовлении которого было взято 40 г данного растворимого компонента и 280 мл воды.
Решение.
Масса воды в растворе равна частному от деления объема воды на ее плотность, которая всегда равна 1000 г/л или 1 г/мл:
V(воды) = 280 мл
m(воды) = 280/1= 280 г
Вычислим массу раствора. Она равна сумме масс растворителя и растворенного вещества:
m(раствора) = m(воды) + m(Х) = 280 г + 40 г = 320 г
Массовая доля ХХ в растворе равна отношению массы растворенного вещества к общей массе раствора:
w(Х)=m(Х)m(раствора)w(Х)=frac{m(Х)}{mtext{(раствора)}}
w(Х)=40/320=0,125w(Х) = 40/320 = 0,125 (или 12,5%)
Ответ.
Массовая доля растворимого компонента в приготовленном растворе составляет 0,125 (или 12,5%).
Следовательно, эти и другие типы расчетов, связанные с изготовлением растворов (разбавление, упаривание, добавление растворителя к веществу, смешивания нескольких растворов), основаны на понимании понятий «целое», «доля от целого», «раствор», «растворитель», «растворенное вещество», «кристаллогидрат» и знании соотношений между соответствующими величинами, и умении ими оперировать.
Умение вычислять массы компонентов раствора необходимы при работе в химических лабораториях и на многих производствах. Понадобятся они и в быту, чтобы изготовить растворы железного или медного купороса, растворы для засолки овощей. Получение столового уксуса разбавления уксусной эссенции также требует упоминавшихся умений.
Тест по теме “Количественная характеристика состава растворов”
Определение массовой доли (ω) вещества
Многие характеристики вещества являются суммой нескольких составляющих, каждая из которых представляет определенную долю от целого.
Математически долю каждой составляющей определяют как частное от деления части на целое (меньшей величины на большую).
Важными характеристиками состава многокомпонентных систем (молекул, смесей веществ, растворов, сополимеровСополимеры – высокомолекулярные соединения, макромолекулы которых содержат два (и более) типа структурных звеньев.) являются массовые, мольные и объёмные доли отдельных компонентов.
Массовая доля компонента (вещества, химического элемента) – содержание компонента в многокомпонентной системе (смеси веществ, растворе, молекуле), определяемое как отношение массы этого компонента к суммарной массе всех компонентов системы.
Таким образом, для нахождения массовой доли вещества в смеси (и решения обратной задачи) служит соотношение:
ω(вещества) = m(вещества) / m(смеси).
Массовую долю элемента в веществе можно определить, используя молярные массы:
ω(элемента) = M(элемента) / M(вещества).
Например, массовая доля водорода ω(H) в этиловом спирте С2Н5ОН вычисляется следующим образом:
Часто долю выражают в процентах. Для этого полученный результат умножают на 100. То есть в данном случае ω(H)=13%. Это означает, что в каждом г (кг, т) С2Н6O содержится 0,13 г (кг, т) водорода или каждые 100 г (кг, т) С2Н6O содержат 13 г (кг, т) водорода.
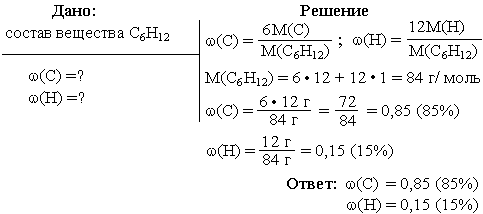
Задача 1. Вычислить массовые доли каждого из элементов, входящих в состав углеводорода, формула которого C6H12.
Задача 2. Из нефти получают бензин (массовая доля его в нефти составляет 25%) и мазут (55%). При дальнейшей переработке мазута получают еще некоторое количество бензина (60% от массы мазута). Рассчитайте массу бензина, который будет получен из нефти массой 200 кг.
Задача 3. Смесь ацетата натрия с избытком гидроксида натрия прокалили. После прокаливания масса сухого остатка оказалась в 1,136 раза меньше массы исходной смеси. Вычислите массовые доли компонентов исходной смеси.
Решение
При сплавлении ацетата натрия CH3COONa с гидроксидом натрия образуется метан CH4 (реакция Дюма).
Уравнение реакции:
Практическая
работа № 10
Тема: Расчёт массовой доли или массы
химического соединения в смеси
Цель: систематизировать
знания о смесях; уметь производить
расчёты массовой доли или массы соединения в смеси
ХОД
РАБОТЫ
I. Теоретическая часть
Это наиболее часто применяемый в химии вид расчётов. С их
помощью определяется состав смеси, или количественные показатели
участников реакции в смеси, состав которой известен.
Выразить состав смеси можно по-разному:
1)
массой каждого ингредиента;
2)
числом молей ингредиентов;
3)
массовыми долями, например, доля ингредиента X в смеси:
ω(X)= __m(X)__ ·100%
m(смеси)
4)
для смеси газов — объёмными долями:
φ(X) = __V(X)__ ·
100%
V(смеси)
Пример. Условие: Сделать расчёт массовых долей Cu и Fe, если
при воздействии на 20 грамм их смеси избытком HCl образовалось 5,6 литров H2 (при н.у.).
Решение: В этом случае соляная кислота реагирует
только с железом. Т.е. по известному объёму выделившегося водорода можно найти
массу железа, а затем и долю его в смеси.
1) рассчитать кол-во
H2:
n =V / Vm = 5,6 / 22,4 = 0,25 моль
2) из уравнения Fe +
2HCl = FeCl2 + H2, кол-во Fe тоже
0,25 моль.
Тогда его масса: mFe = 0,25·56 = 14 г
3) сделать расчёт
массовых долей компонентов смеси:
ωFe = mFe/mсмеси = 14 /
20 ·100% = 70%,
ωCu = 100% — 70% = 30%
Ответ: в смеси 70% Fe и 30% Cu
II. Практическая часть (РЕШИТЕ ЗАДАЧИ)
1. При
нагревании образца карбоната кальция часть вещества разложилась. При этом
выделилось 4,48 л (н. у.) углекислого газа. Масса твёрдого остатка составила
41,2 г. Этот остаток добавили к 465,5 г раствора соляной кислоты, взятой в
избытке. Определите массовую долю соли в полученном растворе. (Ответ: ω(CaCl2) = 11,2%)
2. Навеску основного карбоната меди прокаливали в течение
непродолжительного времени и получили твёрдый остаток массой 98,6 г. При
растворении этого остатка в 800 г раствора серной кислоты, взятой в избытке,
выделилось 6,72 л (н. у.) газа. Найдите массовую долю соли в полученном
растворе. (Ответ: ω(СuSO4) = 18,1%)
3. Навеску технического карбоната кальция
массой 8,00 г растворили в избытке соляной кислоты. К полученному раствору
добавили избыток оксалата аммония, выпавший осадок отфильтровали и прокалили
при температуре 10000С до
постоянной массы. Полученный порошок взвесили, его масса составила 4,03 г.
Определите массовую долю карбоната кальция в техническом образце и объём газа
(н. у.), выделившегося при его растворении в соляной кислоте. Примите, что
технический образец содержит только некарбонатные примеси.
(Ответ: V(CO2) = 1,61 л)
4. Железную
проволоку массой 0,295 г растворили при нагревании в избытке разбавленной
азотной кислоты. К полученному раствору добавили избыток раствора аммиака,
выпавший осадок отфильтровали и прокалили до постоянной массы. Полученный
порошок взвесили, его масса составила 0,400 г. Определите массовую долю железа
в проволоке.
(Ответ: ω(Fe) = 94,9%)
5. Железную
проволоку массой 0,295 г растворили при нагревании в избытке разбавленной
азотной кислоты. К полученному раствору добавили избыток раствора аммиака,
выпавший осадок отфильтровали и прокалили до постоянной массы. Полученный
порошок взвесили, его масса составила 0,400 г. Определите объём оксида
азота(II) (н. у.), выделившегося при растворении железа в азотной кислоте. (Ответ: V(NO) = 0,112 л)
6. Навеску нитрата марганца(II) прокалили,
при этом выделился единственный газ бурого цвета объёмом 2,24 л (н.у.). К
твёрдому остатку добавили избыток воды, после чего нерастворившееся вещество
отделили фильтрованием, высушили и затем полностью растворили в 80 г
концентрированной соляной кислоты. Рассчитайте массовую долю соли марганца в
полученном растворе.
(Ответ: ω(MnCl2) = 7,8%)
7. При прокаливании
навески перманганата калия собрали 1,12 л (н. у.) кислорода. К твёрдому остатку
добавили избыток воды, после чего нерастворившееся вещество отделили
фильтрованием, высушили и затем полностью растворили в 100 г концентрированной
соляной кислоты. Рассчитайте массовую долю соли марганца в полученном растворе.
(Ответ: ω(MnCl2) = 6,25%)
8. Порошок серы
смешали с избытком тонкоизмельчённого порошка алюминия. Навеску смеси массой
10,8 г нагрели. Полученный после бурной реакции остаток охладили и полностью
растворили в соляной кислоте, при этом выделилось 10,08 л (н. у.) газа.
Определите массовую долю серы в исходной смеси. (Ответ: ω(S) = 25,0%)
9. Хлороводород,
полученный при действии избытка серной кислоты на навеску хлорида натрия массой
11,7 г, пропустили через 100 г 14%-го раствора гидроксида калия. Полученный
раствор выпарили. Определите массу твёрдого остатка и его состав (в массовых
долях). (Ответ: ω(KOH) = 15,8%)
10. Хлор, полученный
при действии избытка концентрированной соляной кислоты на навеску оксида
марганца(IV) массой 4,35 г, пропустили через 165 г 10%-го раствора бромида
натрия. Полученный раствор выпарили, твёрдое вещество прокалили. Определите
массу твёрдого остатка и его состав (в массовых долях).
(Ответ: ω(NaBr) = 51,4%)
11. Навеску оксида
железа (III) прокалили с некоторым количеством углерода. Полученный твёрдый
остаток, состоящий из двух веществ общей массой 10 г, полностью растворился в
разбавленной серной кислоте, при этом выделилось 1,12 л (н. у.) газа.
Определите массовую долю железа в твёрдом остатке. (Ответ: ω(Fe) = 28,0%)
12. Навеску оксида
железа (III) прокалили с некоторым количеством углерода. Полученный твёрдый
остаток, состоящий из двух веществ общей массой 10 г, полностью растворился в
разбавленной серной кислоте, при этом выделилось 1,12 л (н. у.) газа.
Определите объём углекислого газа (н. у.), образовавшегося в первом опыте.
(Ответ: V(CO2) = 1,4 л)
13. Навеску оксида
марганца Mn3O4 прокалили с
некоторым количеством углерода. Полученный твёрдый остаток, состоящий из двух
веществ общей массой 18,9 г, полностью растворился в разбавленной серной
кислоте, при этом выделилось 3,36 л (н. у.) газа. Определите массовую долю
оксида
марганца
(II) в твёрдом
остатке.
(Ответ: ω(MnO) = 56,3%)
14. Навеску оксида
марганца Mn3O4 прокалили с
некоторым количеством углерода. Полученный твёрдый остаток, состоящий из двух
веществ общей массой 18,9 г, полностью растворился в разбавленной серной
кислоте, при этом выделилось 3,36 л (н. у.) газа. Определите объём углекислого
газа (в пересчете на н.у.), образовавшегося в первом опыте. (Ответ: V(CO2) = 2,8 л)
15. Цинковую
пластинку опустили в раствор нитрата серебра общей массой 200 г. После
длительного выдерживания в растворе пластинку вынули, высушили и взвесили.
Оказалось, что её масса изменилась по сравнению с первоначальной на
7,55 г. Рассчитайте массовую долю соли в растворе, из которого вынули
пластинку.
(Ответ: ω(Zn(NO3)2) = 4,91%)
16. Медную пластинку
массой 30,0 г опустили в раствор нитрата серебра. После длительного
выдерживания в растворе пластинку вынули, высушили и взвесили. Масса пластинки
оказалась равна 37,6 г, а масса раствора, из которого вынули пластинку,
составила 242,4 г. Рассчитайте массовую долю нитрата серебра в исходном
растворе.
(Ответ:
ω(AgNO3) = 6,8%)
17. Смесь тонко измельчённых
диоксида кремния и магния (взят в небольшом избытке) прокалили. К полученной
смеси добавили избыток соляной кислоты, при этом выделилось 2,24 л (н.у.)
газа, который оказался тяжелее воздуха, а масса нерастворившегося вещества
составила 14 г. Найдите массу оксида кремния (IV) в исходной
смеси.
(Ответ:
m(SiO2) = 36 г)
18. Смесь диоксида
кремния и углерода (взят в некотором избытке) прокалили. Образовались газ легче
воздуха и смесь твёрдых веществ. К смеси добавили избыток концентрированной
щелочи, при этом выделилось 13,44 л (н.у.) газа, а масса нерастворившегося
вещества составила 28 г. Найдите массу углерода в исходной смеси.
(Ответ: m(C) = 32,4 г)
19. Минерал сфалерит
(сульфид цинка) содержит в виде примеси металлическое железо. Образец минерала
массой 10,0 г сожгли в избытке кислорода, а к полученному твёрдому
веществу добавили раствор гидроксида калия. Масса нерастворившегося остатка
составила 1,60 г. Определите массовую долю железа в минерале.
(Ответ: ω(Fe) = 11,2%)
20. Минерал вюрцит (сульфид
цинка) содержит в виде примеси металлическое железо. Образец минерала массой
21,0 г растворили в концентрированной соляной кислоте, а выделившийся газ пропустили
через раствор нитрата свинца. Масса выпавшего осадка составила 47,8 г.
Определите массовую долю железа в минерале.
(Ответ: ω(Fe) = 7,6%)
21. Навеску оксида
меди(II) массой 6,0 г растворили в 100 г 7,3 %-й соляной
кислоты. В полученный раствор опустили железную пластинку, выдержали до
прекращения реакции и удалили из раствора. Найдите массовую долю соли в
полученном растворе. (Ответ: ω(FeCl2) = 11,9%)
22. При нагревании
образца нитрата магния часть вещества разложилась. При этом выделилось
10,08 л (в пересчёте на н.у.) смеси газов. Масса твёрдого остатка
составила 69,36 г. К этому остатку последовательно добавили 100 мл
воды и 240 г 20 %-ого раствора гидроксида натрия. Определите массовую
долю гидроксида натрия в образовавшемся растворе.
(Ответ:
ω(NaOH) = 3,81%)
23. Смесь тонко
измельчённых диоксида кремния и магния (взят в небольшом избытке) прокалили. К
полученной смеси добавили избыток соляной кислоты, при этом выделилось
2,24 л (н.у.) газа, который оказался тяжелее воздуха, а масса
нерастворившегося вещества составила 14 г. Найдите массу магния в исходной
смеси.
(Ответ: m(Mg) = 33,6 г)
24. Смесь диоксида
кремния и углерода (взят в некотором избытке) прокалили. Образовались газ легче
воздуха и смесь твёрдых веществ. К смеси добавили избыток концентрированной
щелочи, при этом выделилось 13,44 л (н.у.) газа, а масса нерастворившегося
вещества составила 28 г. Найдите массу оксида кремния (IV) в исходной смеси.
(Ответ: m(SiO2) = 60 г m(C) = 32,4 г)
25. Навеску оксида
железа (III) прокалили с некоторым количеством углерода. Полученный твёрдый
остаток, состоящий из двух веществ общей массой 10 г, полностью растворился в
разбавленной серной кислоте, при этом выделилось 1,12 л (н. у.) газа.
Определите массовую долю оксида железа (II) в твёрдом остатке.
(Ответ: ω(FeO) = 72,0%)
26. Навеску оксида марганца Mn3O4 прокалили с
некоторым количеством углерода. Полученный твёрдый остаток, состоящий из двух
веществ общей массой 18,9 г, полностью растворился в разбавленной серной
кислоте, при этом выделилось 3,36 л (н. у.) газа. Определите массовую долю
марганца в твёрдом остатке.
(Ответ: ω(Mn) = 43,7%)