ДЛЯ начала нам понадобится таблица Менделеева
1) ФОРМУЛЫ ВЫСШИХ ОКСИДОВ
высший оксид -это оксид с максимальной валентностью
максимальная валентность определяется по номеру группы ( главной подругппы),в которой находится элемент
ПРИМЕР:
алюминий находится в третьей группе ,значит его валентность будет III
III 6 II
Al 2 O3
III -валентность алюминия
II- валентность кислорода (постоянная)
6 — наименьшее общее кратное между II и III
6 делим на валентность алюминия III получаем его индекс 2
6 делим на валентность кислорода II получаем индекс кислорода 3
и получается Al₂O₃
еще пример: фосфор — в пятой группе ,значит максимальная валентность V
P2O5 и т.д.
2) летучее водородное соединение
только элементы IV,V,VI и VII групп образуют ЛЕТУЧИЕ водородные соединения.
валентность элемента в соединении с водородм равна 8-номер группы.
пример
хлор находится в 7 группе, значит его валентность с водородом будет 8-7=1
и формула
I I
H Cl
сера — 6 группа валентность 8-6=2. значит валентность серы будет II
I II
H ₂ S
вот и все тонкости
Удачи
Каждый школьник встречался с понятием «оксид» на уроках химии. От одного этого слова предмет начинал казаться чем-то неописуемо страшным. Но ничего страшного здесь нет. Высшие оксиды – это вещества, в которых содержатся соединения простых веществ с кислородом (в степени окисления -2). Стоит отметить, что они реагируют с:
- O2 (кислородом), в том случае, если элемент стоит не в высшей СО. К примеру, SO2 реагирует с кислородом (т. к. СО равна +4), а SO3 — нет (т. к. стоит в наивысшей степени окисления +6).
- H2 (водород) и C (углерод). Вступают в реакцию только некоторые оксиды.
- Водой в том случае, если получается растворимая щелочь или кислота.
Все оксиды вступают в реакцию с солями и неметаллами (за исключением вышеперечисленных веществ).
Стоит отметить, что некоторые вещества (например, оксид азота, оксид железа и оксид хлора) имеют свои особенности, т. е. их химические особенности могут отличаться от других субстанций.
Классификация оксидов
Они делятся на две ветки: те, кто могут образовывать соль, и те, кто образовывать ее не могут.
Примеры формул высших оксидов, которые не образуют солей: NO (окись азота двух валентная; газ без цвета, образующийся во время гроз), CO (угарный газ), N2O (оксид азота одновалентный), SiO (оксид кремния), S2O (оксид серы), вода.
Эти соединения могут реагировать с основаниями, кислотами и солеобразующими оксидами. Но при реагировании этих веществ никогда не образуется солей. Например:
CO (угарный газ) + NaOH (гидроксид натрия) = HCOONa (формиат натрия)
Солеобразующие оксиды делятся на три вида: кислотные, основания и амфотерные окислы.
Кислотные окиси
Кислотный высший оксид – это солеобразующий оксид, который соответствует кислоте. Например, у оксида серы шестивалентного (SO3) есть соответствующее ему химическое соединения – H2SO4. Эти элементы вступают в реакцию с оксидами основных и амфотерных свойств, основаниями и водой. Образуется соль или кислота.
- Со щелочными оксидами: CO2 (углекислый газ) + MgO (окись магния) = MgCO3 (горькая соль).
- С амфотерными окисями: P2О5 (окисел фосфора)+ Al2О3 (окисел алюминия) = 2AlPO4 (фосфат или ортофосфат алюминия).
- С основаниями (щелочами): CO2 (углекислый газ) + 2NaOH (едкий натр) = Na2CO3 (карбонат натрия или кальцинированная сода) + H2O (вода).
- С водой: CO2 (углекислый газ) + H2O = H2CO3 (угольная кислота, после реакции мгновенно распадается на углекислый газ и воду).
Оксиды кислот не вступают в реакцию друг с другом.
Основные оксиды
Основный высший оксид – это солеобразующий окисел металла, которому соответствует основание. Окислу кальция (CaO) соответствует гидроксид кальция (Ca(OH)2). Эти вещества взаимодействуют с окислами кислотного и амфотерного характера, кислотами (за исключением H2SiO3, так как кремниевая кислота нерастворимая) и водой.
- С кислотными оксидами: CaO (оксид кальция) + CO2 (углекислый газ) = CaCO3 (карбонат кальция или обычный мел).
- С амфотерной окисью: CaO (оксид кальция) + Al2O3 (окись алюминия) = Ca(AlO2)2 (алюминат кальция).
- С кислотами: CaO (окисел кальция) + H2SO4 (серная кислота) = CaSO4 (сульфат кальция или гипс) + H2O .
- С водой: CaO (оксид кальция) + H2O = Ca(OH)2 (гидроксид кальция или реакция гашения извести).
Не взаимодействуют между собой.
Амфотерные окиси
Амфотерный высший оксид – это окисел амфотерного металла. В зависимости от условий, он может проявить основные или кислотные свойства. Например, формулы высших оксидов, которые проявляют амфотерные свойства: ZnO (окисел цинка), Al2O3 (глинозем). Реагируют амфотерные окиси со щелочами, кислотами (так же за исключением кремниевой кислоты), основными и кислотными оксидами.
- С основаниями: ZnO (окисел цинка) + 2NaOH (основание натрия) = Na2ZnO2 (двойная соль цинка и натрия)+ H2O.
- С кислотами: Al2O3 (алюминия оксид) + 6HCl (соляная кислота) = 2AlCl3 (хлорид алюминия или хлористый алюминий) + 3H2O.
- С кислотными оксидами: Al2O3 (окисел алюминия) + 3SO3 (окисел серы шестивалентный) = Al2(SO4)3 (алюминиевые квасцы).
- С окислами основного характера: Al2O3 (окисел алюминия) + Na2O (окись натрия) = 2NaAlO2 (алюминат натрия).
Элементы высших оксидов амфотерного характера не взаимодействуют между собой и с водой.
Классификация оксидов
Материал по химии
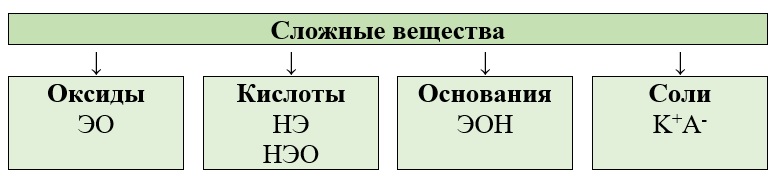
Все сложные неорганические вещества можно разделить на следующие группы:
Классификация оксидов
Классификация веществ
Рассмотрим эти классы по отдельности, начиная с оксидов.
Оксиды – это соединения кислорода в степени окисления «‒2» с другими элементами. Но не все соединения кислорода с элементами будут являться оксидами, степень окисления кислорода очень важна!
Таб. «Соединения кислорода»
* Так как фтор принимает только отрицательную степень окисления (так как может выступать только в качестве окислителя), кислород во фториде кислорода может быть только положительным. Положительные ионы записываются первыми в формуле, поэтому правильнее писать OF2.
** Hадпероксид калия состоит из ионов K+ и O2-1.
Зачем нужно знать классификацию оксидов?
Рассмотрим несколько уравнений:
- K2O + H2O = 2KOH
- CaO + H2O = Ca(OH)2
- FeO + H2O ≠
- CuO + H2O ≠
Почему какие-то оксиды реагируют с водой, а другие – нет? Нужно знать классификацию оксидов на растворимые и нерастворимые.
- CaO + N2O3 = Ca(NO3)2
- CaO + Cs2O ≠
Как определить, какие оксиды реагируют друг с другом, а какие нет? Для ответа на этот вопрос нужно знать, какие оксиды относятся к кислотным, а какие к основным, амфотерным или несолеобразующим.
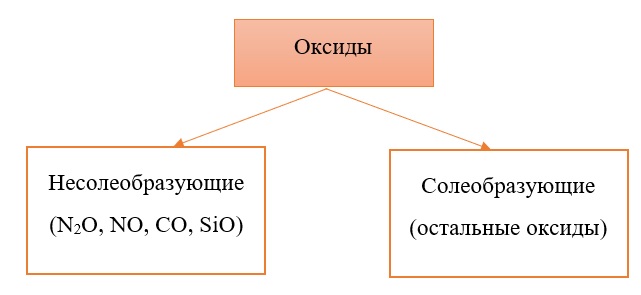
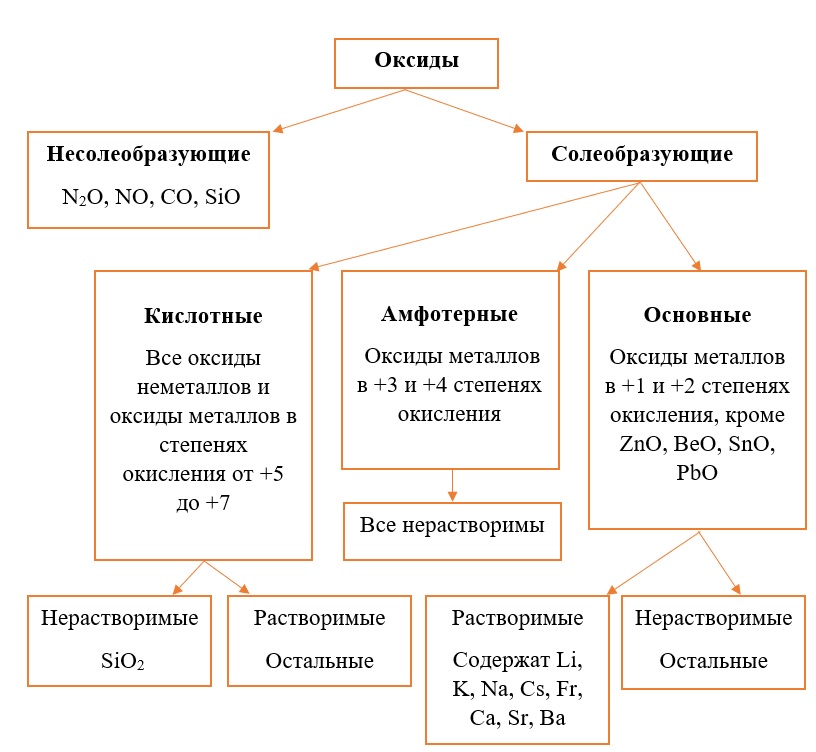
Классификация оксидов на солеобразующие и несолеобразующие
Существует две группы оксидов – те, что при взаимодействии с кислотами/основаниями или друг с другом образуют соли и те, что не вступают в типичные реакции оксидов и не способны образовывать соли (несолеобразующие), их свойства рассматриваются отдельно.
Самыми распространёнными несолеобразующими оксидами являются: N2O, NO, CO, SiO, остальные оксиды считаем солеобразующими (с типичными свойствами).
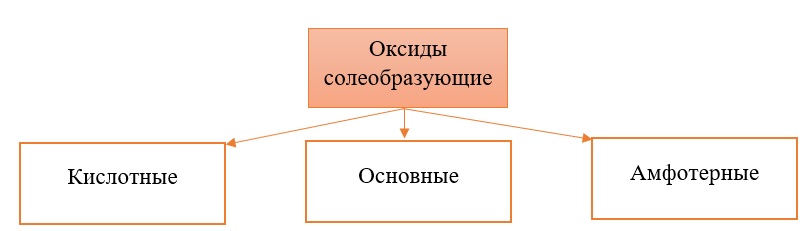
Классификация солеобразующих оксидов
Все солеобразующие оксиды делятся на основные, кислотные и амфотерные.
Кислотные оксиды соответствуют определенным кислотам, они легко взаимодействуют со своими противоположностями – основными веществами.
Основные оксиды соответствуют определенным основаниям, они легко взаимодействуют со своими противоположностями – кислотными веществами.
Амфотерные оксиды, соответствуют определённым гидроксидам, имеют двойственную природу: с кислотными веществами реагируют как основные соединения, а с основными – как кислотные соединения.
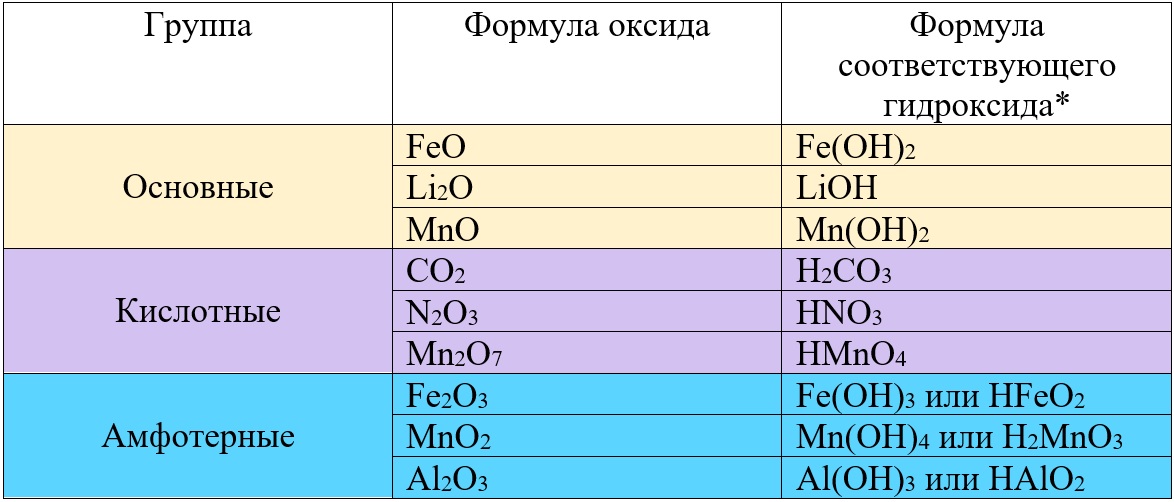
Таб. «Некоторые оксиды и соответствующие им гидроксиды»
* Гидроксид – соединение элемента с гидроксо-группой (OH‒).
Проанализировав таблицу, Вы заметите, что разные оксиды железа могут быть основными или амфотерными, а разные оксиды марганца оказались во всех трех группах. Что бы лучше понимать, от чего зависит принадлежность к тому или иному виду оксидов, необходимо глубже разобраться в классификации этих веществ.
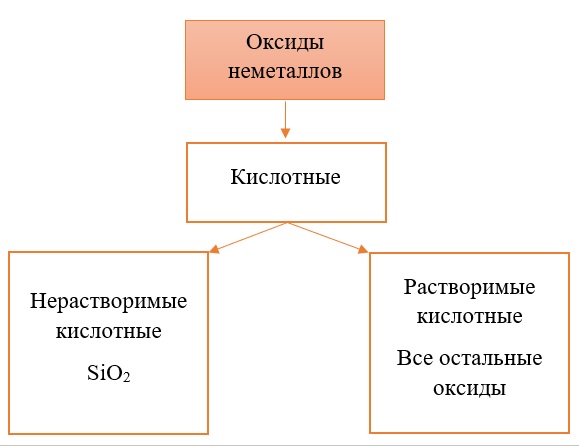
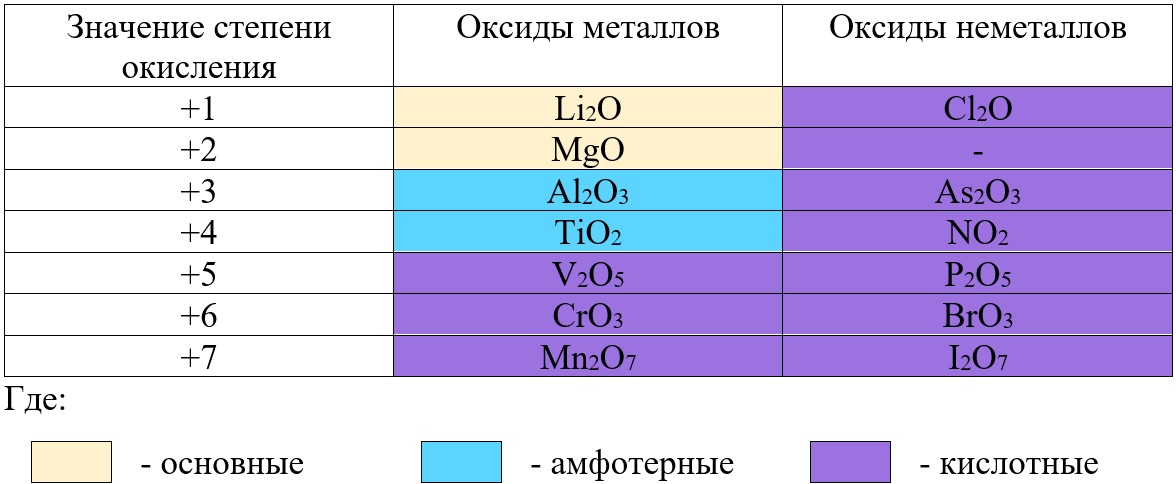
Классификация оксидов неметаллов.
Все солеобразующие оксиды неметаллов относятся к кислотным. Большая часть из них являются растворимыми:
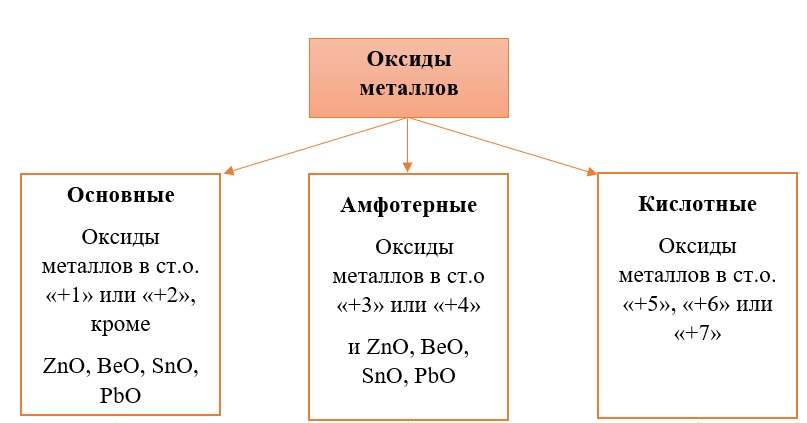
Классификация оксидов металлов.
В отличие от предыдущей группы, в этой не так всё однозначно. Среди оксидов металлов встречаются как основные, так и амфотерные, и даже кислотные. А принадлежность к определённой группе зависит он степени окисления металла, который входит в состав оксида.
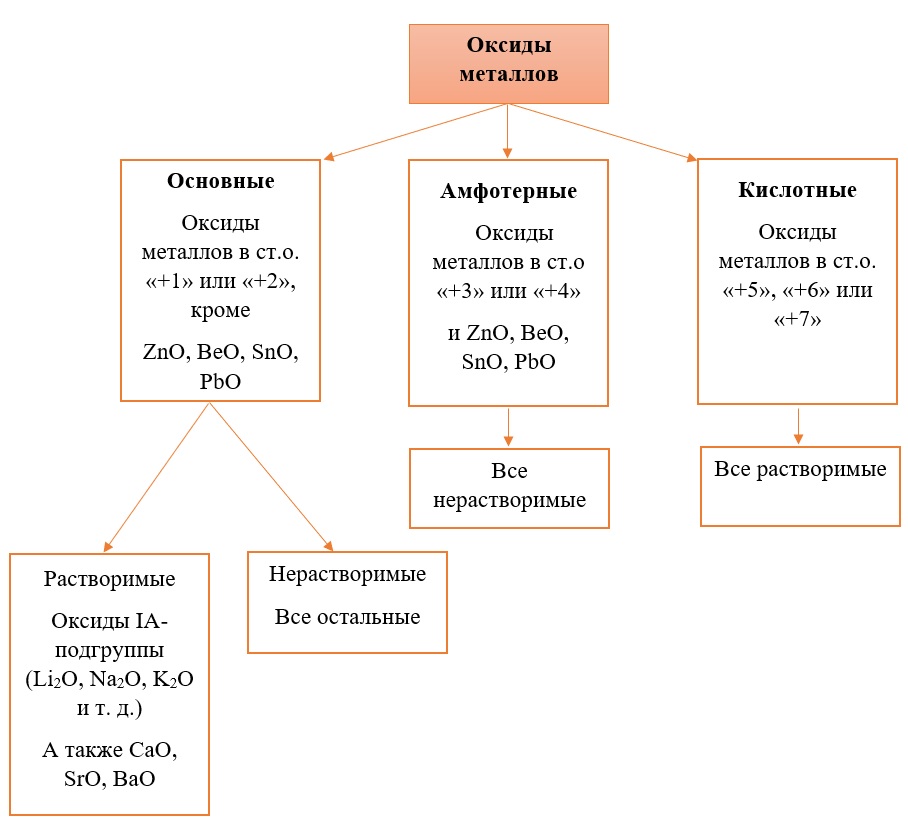
Основные оксиды – это оксиды, в которых металл имеет степень окисления «+1» или «+2» (для элементов с большим диапазоном возможных степеней окисления это будут низшие степени окисления). Есть исключения, например, BeO, ZnO хоть и имеют в своём составе металлы в степени окисления «+2», проявляют амфотерные свойства. Список таких оксидов гораздо шире (SnO, PbO, CuO), но в ЕГЭ остальные примеры исключений игнорируются.
Амфотерные оксиды содержат металлы в степени окисления «+3» и «+4» (промежуточные значения степеней окисления для веществ с большим диапазоном возможных степеней окисления), и два примера оксидов с металлами в ст. о. «+2», написанных выше (BeO, ZnO).
Кислотные оксиды содержат металлы в степени окисления «+5», «+6» и «+7» (для элементов с большим диапазоном возможных степеней окисления это будут высшие степени окисления).
Все кислотные оксиды металлов растворяются в воде и реагируют с ней. Все амфотерные оксиды не растворяются в воде и не реагируют с ней. Среди основных оксидов большинство нерастворимы и только оксиды, образованные кальцием, стронцием, барием, а также всеми металлами IА-подгруппы являются растворимыми.
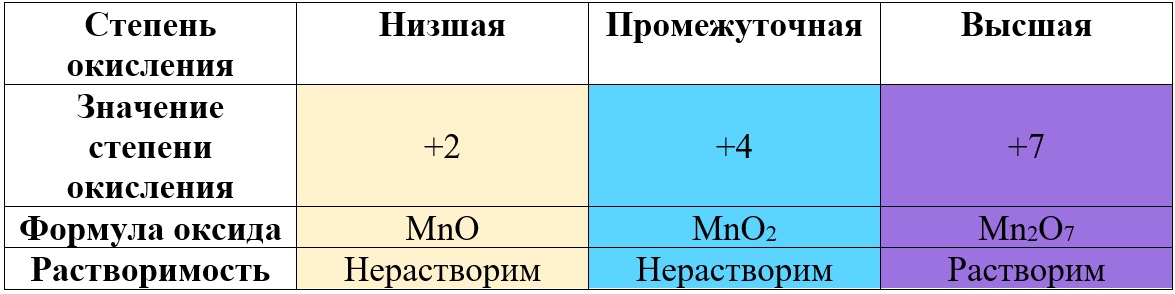
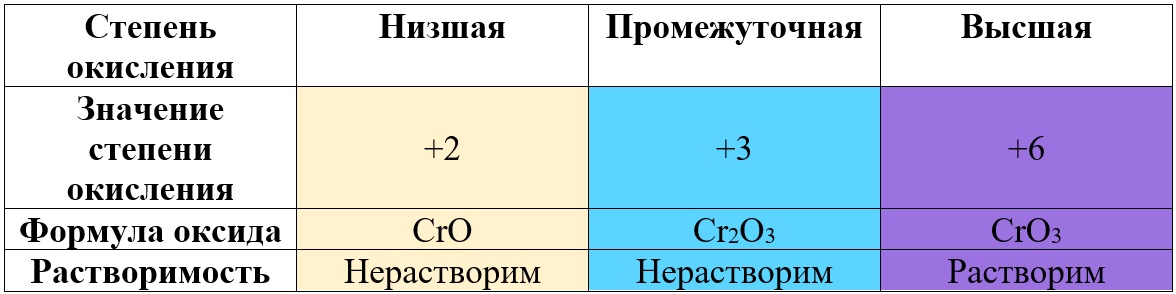
Таким образом металлы, имеющие большой диапазон возможных степеней окисления, могут образовывать совершенно разные по характеру оксиды, например оксиды марганца и хрома:
Таб. «Зависимость характера оксида от степени окисления марганца» (рассмотрены только наиболее распространённые степени)
Таб. «Зависимость характера оксида от степени окисления хрома» (рассмотрены только наиболее степени)
Не следует путать оксиды металлов и неметаллов: у оксидов металлов степень окисления определяет характер оксида, а у оксида неметалла – нет.
Таб. «Зависимость характера оксида от степени окисления элемента»
Обобщим всю классификацию оксидов одной схемой:
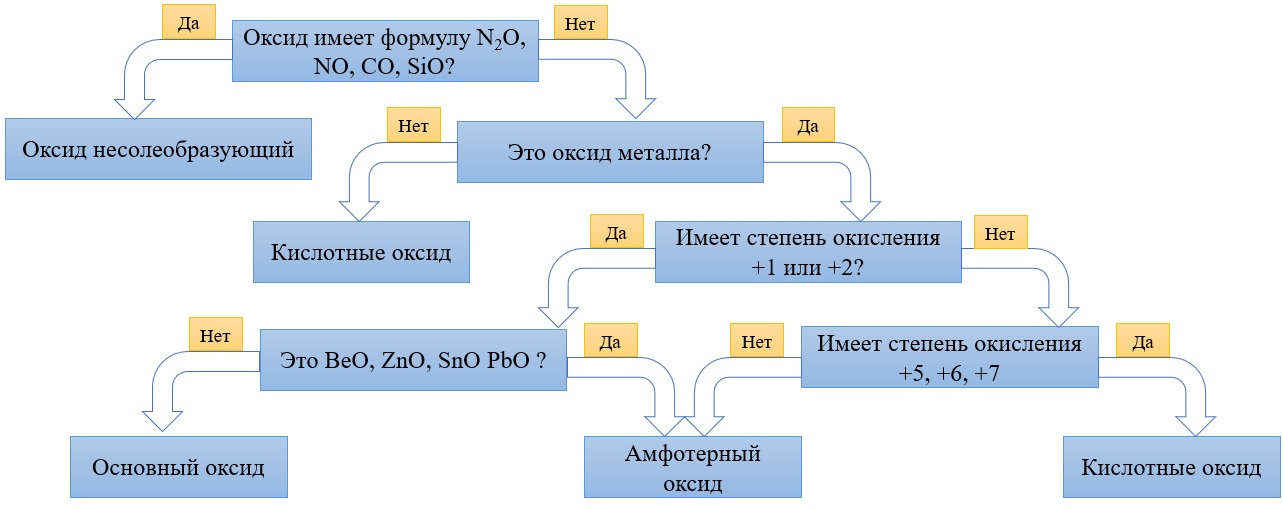
Алгоритм для определения характера оксида:
Простая таблица для определения принадлежности к группе оксидов:
Как составить формулы оксидов
Оксиды – это сложные химические вещества, которые состоят из двух элементов. Одним из них является кислород. Оксиды в большинстве случаев бывают кислотными и основными. Как легко понять из названия, кислотные оксиды реагируют с основаниями, образуя соль, то есть, проявляя свойства кислоты. Как составлять формулы оксидов?

Инструкция
Многие из оксидов способны реагировать с водой, образуя кислоту. Например:
SO3 + H2O = H2SO4 (образуется серная кислота).
SiO2 + 2KOH = K2SiO3 + H2O (нерастворимый в воде оксид кремния вступает в реакцию с гидроксидом калия.
Основные оксиды, напротив, вступают в реакции с кислотами, также образуя соль и воду. Те же из них, которые растворимы в воде, реагируют с ней, образуя основание. Характерные примеры:
ZnO + 2HCl = ZnCl2 + H2O (нерастворимый в воде оксид цинка реагирует с соляной кислотой).
Na2O + H2O = 2NaOH
Следует запомнить, что валентность кислорода в оксиде всегда равняется 2. Исходя из этого, при составлении формулы надо лишь знать валентность второго элемента. Например: щелочные металлы первой группы – одновалентные. Поэтому общая формула оксидов будет выглядеть так: Эл2О. Т.е., Li2O, Na2O, K2O, Rb2O. (Эл – «Элемент»).
Щелочноземельные металлы второй группы – двухвалентные. Общая формула оксидов – ЭлО. И выглядеть она будет: ВеО, MgO, СаО, SrO.
Амфотерные элементы третьей группы, соответственно, трехвалентные. Общая формула оксидов – Эл2О3. Характерный пример – уже упоминавшийся оксид алюминия Al2O3.
Элементы четвертой группы проявляют или больше кислотных свойств (углерод, кремний), или больше основных (германий, олово, свинец). В любом случае, общая формула – ЭлО2 (СО2, SiO2).
Общая формула пятой группы – Эл2О5. Пример – высший оксид азота, N2O5, из которого получают азотную кислоту. Или высший оксид ванадия, V2О5 (хотя ванадий – металл, его высший оксид проявляет кислотные свойства).
Соответственно, формула шестой группы, где находится сам кислород – ЭлО3. Высшие оксиды – SO3, СrO3, WO3. Обратите внимание, что хоть хром и вольфрам – металлы, их высшие оксиды по аналогии с оксидом ванадия также проявляют кислотные свойства.
Следует уточнить, что указывались лишь высшие оксиды элементов. Так, например, помимо оксида хрома CrО3, где хром шестивалентен, есть оксид Cr2O3, где этот элемент имеет валентность, равную 3. Помимо оксида азота N2O5, существуют оксиды N2O, NO, NO2. Подобных примеров очень много. Поэтому, при написании формулы оксида, проверяйте, какую валентность имеет в этом соединении элемент, соединенный с кислородом!
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.