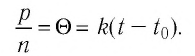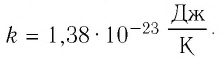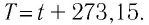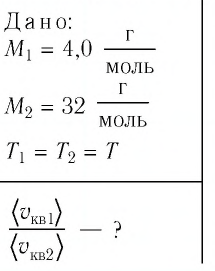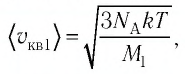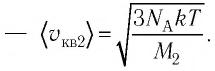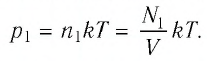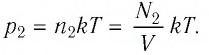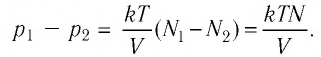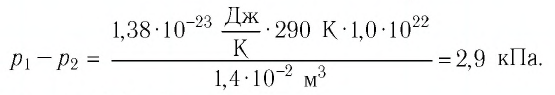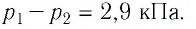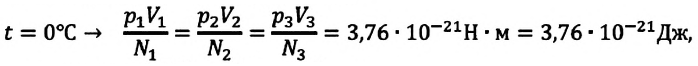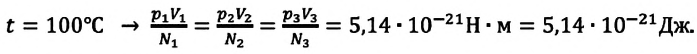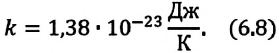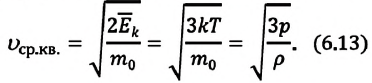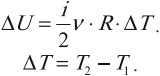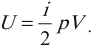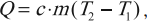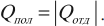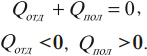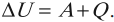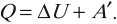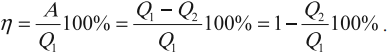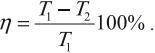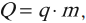Тела, температура которых отличается, могут обмениваться тепловой энергией. То есть, между телами будет происходить теплообмен. Самостоятельно тепловая энергия переходит от более нагретых тел к менее нагретым.
Что такое теплообмен и при каких условиях он происходит
Тела, имеющие различные температуры, будут обмениваться тепловой энергией. Этот процесс называется теплообменом.
Теплообмен – процесс обмена тепловой энергией между телами, имеющими различные температуры.
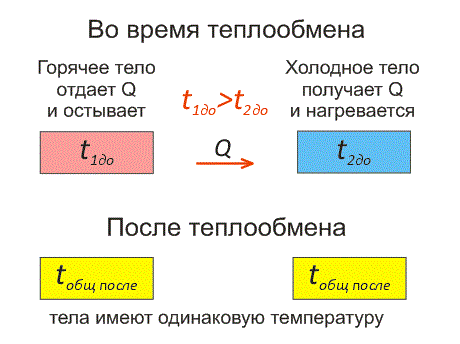
Рассмотрим два тела, имеющие различные температуры (рис. 1).
Тело, имеющее более высокую температуру, будет остывать и отдавать тепловую энергию телу, имеющему низкую температуру. А тело с низкой температурой будет получать количество теплоты и нагреваться.
Рис.1. Два тела во время теплообмена и после
На рисунке, горячее тело имеет розовый оттенок, а холодное изображено голубым цветом.
Когда температуры тел выравниваются, теплообмен прекращается.
Чтобы теплообмен происходил, нужно, чтобы тела имели различные температуры.
Когда температура тел выравняется, теплообмен прекратится.
Тепловое равновесие — это состояние, при котором тела имеют одинаковую температуру.
Уравнение теплового баланса и сохранение тепловой энергии
Когда тело остывает, оно отдает тепловую энергию (теплоту). Утерянное количество теплоты Q имеет знак «минус».
А когда тело нагревается – оно получает тепловую энергию. Приобретенное количество теплоты Q имеет знак «плюс».
Эти факты отражены на рисунке 2.
Рис. 2. Полученное количество теплоты имеет знак «+», а отданное Q – знак «-»
Закон сохранения тепловой энергии: Количество теплоты, отданное горячим телом равно количеству теплоты, полученному холодным телом.
Примечание: Существует и другая формулировка закона сохранения энергии: Энергия не появляется сама собой и не исчезает бесследно. Она переходит из одного вида в другой.
Уравнение теплового баланса
Тот факт, что тепловая энергия сохраняется, можно записать с помощью математики в виде уравнения. Такую запись называют уравнением теплового баланса.
Запишем уравнение теплового баланса для двух тел, обменивающихся тепловой энергией:
[large boxed{ Q_{text{остывания горяч}} + Q_{text{нагревания холод}} = 0 }]
(large Q_{text{остывания горяч}} left( text{Дж} right) ) – это количество теплоты горячее тело теряет.
(large Q_{text{нагревания холод}} left( text{Дж} right) ) – это количество теплоты холодное тело получает.
В левой части уравнения складываем количество теплоты каждого из тел, участвующих в теплообмене.
Записываем ноль в правой части уравнения, когда теплообмен с окружающей средой отсутствует. То есть, теплообмен происходит только между рассматриваемыми телами.
В некоторых учебниках применяют сокращения:
[large Q_{1} + Q_{2} = 0 ]
Примечание: Складывая два числа мы получим ноль, когда эти числа будут:
- равными по модулю и
- имеют различные знаки (одно число — знак «плюс», а второе – знак «минус»).
Если несколько тел участвуют в процессе теплообмена
Иногда в процессе теплообмена участвуют несколько тел. Тогда, для каждого тела нужно записать формулу количества теплоты Q. А потом все количества теплоты подставить в уравнение для теплового баланса:
[large boxed{ Q_{1} + Q_{2} + Q_{3} + ldots + Q_{n} = 0 } ]
При этом:
- Q для каждого нагреваемого тела будет обладать знаком «+»,
- Q для каждого охлаждаемого тела — знаком «-».
Пример расчетов для теплообмена между холодным и горячим телом
К горячей воде, массой 200 грамм, имеющей температуру +80 градусов Цельсия, добавили холодную воду, в количестве 100 грамм при температуре +15 градусов Цельсия. Какую температуру будет иметь смесь после установления теплового равновесия? Считать, что окружающая среда в теплообмене не участвует.
Примечание: Здесь мы рассматриваем упрощенную задачу, для того, чтобы облегчить понимание закона сохранения энергии. Мы не учитываем в этой задаче, что вода содержится в емкости. И часть тепловой энергии будет затрачиваться на то, чтобы изменить температуру емкости.
При решении других задач обязательно учитывайте, что емкость, в которой будет содержаться вещество, имеет массу. И часть тепловой энергии будет затрачиваться на то, чтобы изменить температуру емкости.
Решение:
В условии сказано, что окружающая среда в теплообмене не участвует. Поэтому, будем считать рассматриваемую систему замкнутой. А в замкнутых системах выполняются законы сохранения. Например, закон сохранения энергии.
Иными словами, с сосудом и окружающим воздухом теплообмен не происходит и, все тепловая энергия, отданная горячей водой, будет получена холодной водой.
1). Запишем уравнение теплового баланса, в правой части которого можно записать ноль:
[large Q_{text{остывания горяч}} + Q_{text{нагревания холод}} = 0 ]
2). Теперь запишем формулу для каждого количества теплоты:
[large Q_{text{остывания горяч}} = c_{text{воды}} cdot m_{text{горяч}} cdot (t_{text{общ}} — t_{text{горяч}} ) ]
[large Q_{text{нагревания холодн}} = c_{text{воды}} cdot m_{text{холодн}} cdot (t_{text{общ}} — t_{text{холодн}} ) ]
Примечания:
- (large c_{text{воды}} ) – удельную теплоемкость воды находим в справочнике;
- Массу воды переводим в килограммы;
- Горячая вода остывает и отдает тепловую энергию. Поэтому, разность (large (t_{text{общ}} — t_{text{горяч}} ) ) будет иметь знак «минус», потому, что конечная температура горячей воды меньше ее начальной температуры;
- Холодная вода получает тепловую энергию и нагревается. Из-за этого, разность (large (t_{text{общ}} — t_{text{холодн}} ) ) будет иметь знак «плюс», потому, что конечная температура холодной воды больше ее начальной температуры;
3). Подставим выражения для каждого Q в уравнение баланса:
[large c_{text{воды}} cdot m_{text{горяч}} cdot (t_{text{общ}} — t_{text{горяч}} ) + c_{text{воды}} cdot m_{text{холодн}} cdot (t_{text{общ}} — t_{text{холодн}} ) = 0 ]
4). Для удобства, заменим символы числами:
[large 4200 cdot 0,2 cdot (t_{text{общ}} — 80 ) + 4200 cdot 0,1 cdot (t_{text{общ}} — 15 ) = 0 ]
Проведем упрощение:
[large 840 cdot (t_{text{общ}} — 80 ) + 420 cdot (t_{text{общ}} — 15 ) = 0 ]
Раскрыв скобки и решив это уравнение, получим ответ:
[large t_{text{общ}} = 58,33 ]
Ответ: Температура смеси после прекращения теплообмена будет равна 58,33 градуса Цельсия.
Задача для самостоятельного решения:
В алюминиевом калориметре массой 100 грамм находится керосин массой 250 грамм при температуре +80 градусов Цельсия. В керосин поместили свинцовый шарик, массой 300 грамм. Начальная температура шарика +20 градусов Цельсия. Найдите температуру тел после установления теплового равновесия. Внешняя среда в теплообмене не участвует.
Примечание к решению: В левой части уравнения теплового баланса теперь будут находиться три слагаемых. Потому, что мы учитываем три количества теплоты:
- (large Q_{1} ) – охлаждение алюминия от температуры +80 градусов до конечной температуры;
- (large Q_{2} ) – охлаждение керосина от температуры +80 градусов до конечной температуры;
- (large Q_{3} ) – нагревание свинца от температуры +20 градусов до конечной температуры;
А справа в уравнение теплового баланса запишем ноль. Так как внешняя среда в теплообмене не участвует.
Выводы
- Если тела имеют различную температуру, то между ними возможен обмен тепловой энергией, т. е. теплообмен;
- Когда тела будут иметь равную температуру, теплообмен прекратится;
- Тело с высокой температурой, отдает тепловую энергию (теплоту) и остывает. Отданное количество теплоты Q имеет знак «минус»;
- А тело с низкой температурой получает тепловую энергию и нагревается. Полученное количество теплоты Q имеет знак «плюс»;
- Количество теплоты, отданное горячим телом равно количеству теплоты, полученному холодным телом. Это – закон сохранения тепловой энергии;
- Сохранение тепловой энергии можно записать в виде уравнения теплового баланса;
- В левой части уравнения складываем количества теплоты (всех тел, участвующих в теплообмене);
- В правой части уравнения записываем ноль, когда теплообмен с окружающей средой отсутствует.
Содержание:
Тепловое равновесие:
Температура — мера средней кинетической энергии теплового движения частиц вещества
В повседневной жизни под температурой мы понимаем степень нагретости тела (холодное, тёплое, горячее). Такой подход является довольно субъективным, он зависит не только от состояния рассматриваемого тела, но и от наших ощущений. Чтобы избежать субъективной неопределённости, необходимо установить способ измерения температуры.
Тепловое равновесие
Если привести в соприкосновение два тела, то молекулы этих тел, взаимодействуя между собой, будут обмениваться энергией. При этом молекулы с большей кинетической энергией передают часть энергии молекулам с меньшей кинетической энергией. В результате средняя кинетическая энергия теплового движения молекул одного тела увеличивается, а другого — уменьшается. Отдающее энергию тело называют более нагретым, а тело, к которому энергия переходит, — менее нагретым. Как показывает опыт, такой переход энергии продолжается до тех пор, пока не установится некоторое состояние, в котором тела могут находиться сколь угодно долго. В этом состоянии степень нагретости тел становится и остаётся одинаковой, следовательно, у тел одинаковая температура. Это учитывают при измерении температуры тела. Термометр приводят в соприкосновение с телом, но отсчёт его показаний выполняют не сразу, а через некоторый промежуток времени. Это необходимо для того, чтобы между термометром и телом установилось тепловое равновесие.
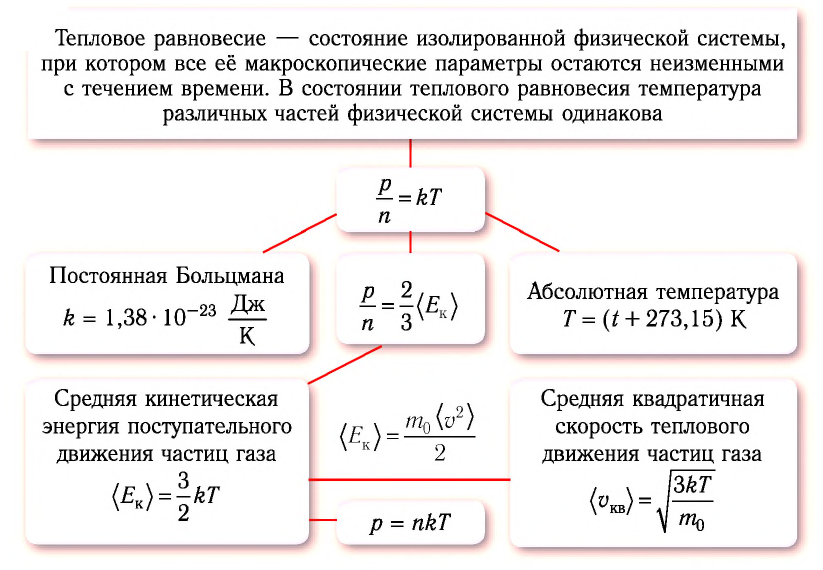
Тепловое равновесие — состояние изолированной физической системы, при котором все её макроскопические параметры остаются неизменными с течением времени.
Под изолированной, или замкнутой, системой понимают систему тел, которая не обменивается энергией с окружающими телами.
Отметим, что у тел, входящих в физическую систему, находящуюся в состоянии теплового равновесия, могут быть различные значения плотности, концентрации, давления и объёма. Однако температура всех тел, входящих в такую систему, всегда одинакова.
Интересно знать:
Понятия «градус» и «температура» появились задолго до изобретения термометра. Знаменитый древнеримский врач Гален (II в.) считал, что все лекарства следует различать по «градусам» (от лат. gradus — ступень) теплоты, холода, сухости и влажности. Гален учил, что одни лекарства оказывают охлаждающее действие, а другие — согревающее. При необходимости следовало смешивать лекарства, чтобы умерить излишнее тепло влажностью, а холод — сухостью. От латинского слова temperature (смешение) возник термин «температура».
Температура и средняя кинетическая энергия поступательного движения молекул газа
Определение температуры должно основываться на такой физической величине, которая характеризует состояние тел и является одинаковой для любых тел, находящихся в состоянии теплового равновесия. Необходимым свойством обладает средняя кинетическая энергия теплового движения частиц вещества. Тепловое движение частиц вещества существенно изменяется при изменении его агрегатного состояния. Максимально простым оно оказывается у одноатомного газа, атомы которого совершают только поступательное движение.
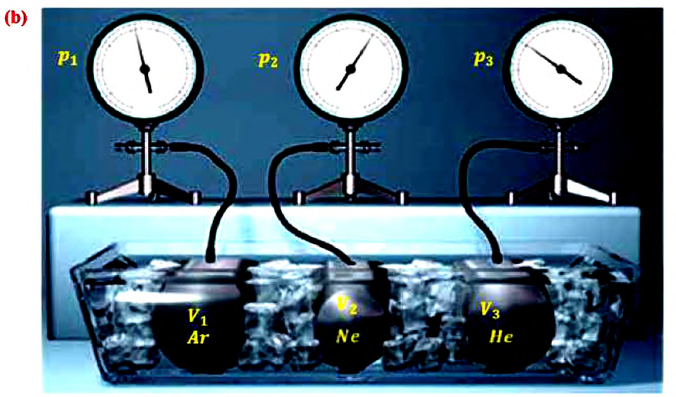
Возьмём несколько сосудов разной вместимости, снабжённых манометрами для измерения давления (рис. 16). Заполнив их различными газами, например аргоном, неоном и гелием, поместим сначала в сосуд с тающим льдом (
Опытным путём установлено, что в состоянии теплового равновесия, несмотря на различные значения давления 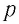
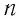
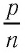
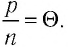
Здесь 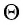
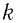
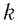
Если для измерения температуры использовать абсолютную температурную шкалу, то при определении числового значения температуры по этой шкале полагают:
Абсолютную (термодинамическую) шкалу температур предложил в 1848 г. выдающийся английский физик Уильям Томсон (1824—1907), удостоенный за работы в области физики в 1892 г. титула лорда Кельвина. Поэтому эту шкалу обычно называют шкалой Кельвина.
Шкала Кельвина совершенно не зависит от физических свойств каких бы то ни было веществ, поэтому её можно считать абсолютной и универсальной.
Нулевая точка по шкале Кельвина соответствует самой низкой теоретически возможной температуре (абсолютный нуль температуры). Температура тающего льда по этой шкале 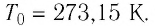
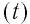
* Единица измерения температуры джоуль неудобна. Например, температура кипения воды, выраженная в джоулях: 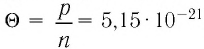
Единица температуры по абсолютной шкале один кельвин (1 К) является основной единицей температуры в СИ и совпадает с одним градусом (1 °С) по шкале Цельсия. Поэтому разность температур по шкале Кельвина и по шкале Цельсия одинакова, т. е. 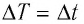
От теории к практике:
Выразите по шкале Кельвина температуру тела здорового человека.
Из основного уравнения молекулярно-кинетической теории идеального газа (3.2) следует: 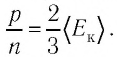
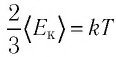
Соотношение (4.2) устанавливает связь между абсолютной температурой Т идеального газа и средней кинетической энергией 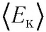
Средняя кинетическая энергия поступательного движения молекул газов, находящихся в состоянии теплового равновесия, одинакова для разных газов и не зависит от массы молекулы газа.
Этот вывод, основанный на экспериментах с разреженными газами, справедлив для жидкостей и твёрдых тел.
Уравнение (4.2) можно записать следующим образом: 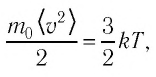
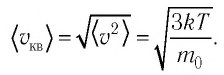
С учётом формулы (4.1) основное уравнение молекулярно-кинетической теории идеального газа может быть записано в виде:
Из уравнения (4.3) следует, что при одинаковых значениях абсолютной температуры Т и концентрации 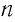
Пример №1
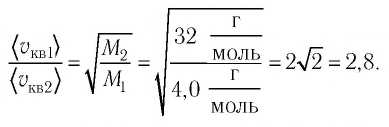
Сравните средние квадратичные скорости атомов гелия и молекул кислорода, если газы находятся в состоянии теплового равновесия.
Решение. Средняя квадратичная скорость теплового движения частиц газа 
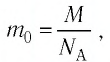
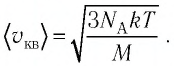
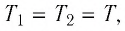
молекул кислорода
Тогда:
Ответ: в состоянии теплового равновесия средняя квадратичная скорость атомов гелия в 2,8 раза больше средней квадратичной скорости молекул кислорода.
Пример №2
В баллоне вместимостью 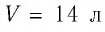
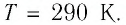
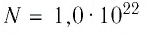
Решение. Начальное давление газа
После того как израсходовали часть газа, а его температура увеличилась до первоначального значения Т, давление газа стало
Тогда убыль давления газа:
Ответ:
Тепловое равновесие, температура
Понятие температуры занимает важное место в повседневной жизни. Так, говоря температура, мы обычно подразумеваем степень нагретости (горячее, теплое, холодное) тела. Такое рассмотрение в достаточной степени субъективно, потому что температура зависит не только от состояния рассматриваемого тела, но и от нашей чувствительности.
Тепловое равновесие:
Известно, что при соприкосновении двух тел с разными температурами между ними происходит теплообмен: тепло переходит от тела с высокой температурой к телу с более низкой температурой. Этот процесс продолжается до тех пор, пока температуры обоих тел не сравняются. Этот факт учитывается при измерении температуры тел — термометр приводится в соприкосновение с телом, но его показания снимаются не сразу, а через определенный промежуток времени, в течение которого между телом и термометром устанавливается тепловое, или так называемое термодинамическое равновесие. При термодинамическом равновесии макроскопические параметры системы остаются постоянными, то есть изменение агрегатного состояния вещества не происходит.
Тепловое или термодинамическое равновесие — это состояние системы, когда ее макроскопические параметры длительное время остаются неизменными.
Состояние теплового равновесия системы характеризуется температурой.
Температура — физическая величина, характеризующая состояние теплового равновесия макроскопической системы: в состоянии теплового равновесия температура всех частей системы одинакова.
Качественное и количественное определение температуры должно основываться на определении физической величины, которая, во-первых, должна характеризовать состояние тела, во-вторых, должна быть одинакова для всех тел, находящихся в тепловом равновесии. Такой величиной является средняя кинетическая энергия поступательного движения молекул вещества. Можно легко определить ее значения для поступательно движущихся молекул одноатомного идеального газа.
С этой целью был поставлен следующий интересный эксперимент: три баллона разного объема, снабженные манометрами (прибор для измерения давления), заполнены различными газами, например, аргоном, неоном и гелием. Баллоны помещаются сначала в тающий лед 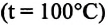
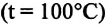
Произведенные вычисления показывают, что в обоих случаях (и при температуре 0°С, и при температуре 100°С) при достижении теплового равновесия, отношение 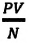
при
при
Если принять во внимание, что 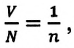
Здесь 
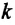
Постоянная Больцмана связывает температуру 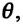
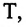
Выражение (6.9) может быть использовано для определения абсолютной температуры в Кельвинах:
Формула (6.10) дает возможность создания новой температурной шкалы. Такая температурная шкала, называемая шкалой абсолютных температур, была предложена в 1848 году английским физиком Уильямом Томсоном (1824-1907). За вклад в области физики в 1892 году он был награжден титулом лорда Кельвина.
Поэтому предложенная им шкала температур называется шкалой Кельвина. Нулевая точка шкалы Кельвина, то есть температура абсолютного нуля, это самая низкая температура, какая возможна теоретически и практически. Согласно этой шкале температура плавления льда равна 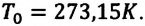
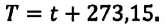
Единица измерения абсолютной температуры, являющейся основной в СИ — Кельвин 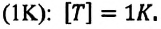
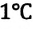
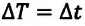
Температура — мера средней кинетической энергии молекул. На самом деле из сравнения выражений (6.4) и (6.9) получаем, что абсолютная температура, являющаяся макроскопическим параметром идеального газа (или разреженного газа), связана со средней кинетической энергией молекул, являющейся ее микроскопическим параметром:
• Средняя кинетическая энергия поступательного движения молекул газа прямо пропорциональна его абсолютной температуре:
Из формулы (6.12) ясно виден физический смысл температуры:
Температура — это мера средней кинетической энергии поступательного движения молекул тела. Это утверждение так же верно для жидкостей и твердых тел. Из формулы видно, что среднее значение кинетической энергии поступательного движения, а значит, и средняя квадратичная скорость молекул при абсолютном нуле равна нулю.
Средняя квадратичная скорость молекул
Из формул (6.1), (6.3) и (6.5) можно вычислить среднюю квадратичную скорость молекул:
- Изопроцессы в физике
- Твердые тела и их свойства в физике
- Строение и свойства жидкостей в физике
- Испарение и конденсация в физике
- Уравнение МКТ идеального газа
- Уравнение состояния идеального газа
- Температура в физике
- Парообразование и конденсация
В этой статье тема «найти тепловое равновесие» будет кратко изложена. В состоянии теплового равновесия передача тепла между двумя веществами, находящимися в контакте, отсутствует.
Из нулевого закона термодинамики мы получаем ясное представление о тепловом равновесии. Тепловое равновесие — это состояние между двумя объектами, при котором тепло не передается и объекты контактируют друг с другом. Температура для двух объектов остается одинаковой для условия теплового равновесия.
Очень интересной концепцией, связанной с температурой, является термин тепловое равновесие. Два вещества находятся в состоянии теплового равновесия, если в замкнутой системе температура объектов повышается или снижается до тех пор, пока они не достигнут состояния равновесия, несмотря на то, что между двумя веществами не происходит передачи энергии. Так же, как и когда вещества не находятся в контакте, они также находятся в состоянии теплового равновесия, если, находясь в контакте, тем не менее обмен энергией между двумя веществами не происходит.
Кредит изображения — Википедия
Примеры теплового равновесия:
Некоторые примеры теплового равновесия обсуждаются ниже.
- Измерение температуры тела человека термометром хороший пример теплового равновесия. При исследовании температуры с помощью термометра температура набирается термометром и через определенное время, когда температура тела и термометра становится одинаковой, теплопередача между телом и термометром прекращается, что означает, что состояние достигает равновесного состояния.
- Внезапно сунуть руку в кубик льда — еще один хороший пример теплового равновесия. Когда рука помещается в кубик льда, в это время температура между кубиком и рукой начинает снижаться. передавать тепло и когда температура между рукой и кубиком льда станет одинаковой, теплопередача будет остановлена, что означает, что состояние достигает состояния равновесия.
- Плавление кубика масла также является примером теплового равновесия. Когда кубик масла помещается в естественную в это время температуру между кубиком и атмосферой, попытайтесь достичь той же температуры, таким образом, начнется передача тепла, и когда температура между атмосферой и кубиком масла станет одинаковой, теплопередача прекратится. , означает, что состояние достигает состояния равновесия.
Как найти тепловое равновесие?
Тепловое равновесие – это состояние, при котором теплообмен двух веществ прекращается, когда их температуры достигают одной и той же точки. Тепловое равновесие определяется по этой формуле
Где,
Q = полная энергия удельной материи тела, выраженная в джоулях.
m = масса конкретного вещества тела, выраженная в граммах.
Ce = Удельная теплоемкость удельной материи тела, которая выражается в джоулях на кельвин на килограмм
Δt = температура конкретного вещества тела, выраженная в градусах Кельвина.
Если заданы значения массы вещества и удельной теплоемкости, температуры, то легко подставляя значения в …уравнение (1), мы можем определить величину теплового равновесия.
Теперь с помощью численной задачи обсуждается тепловое равновесие,
Проблема:
Чтобы 40 граммов воды нагрелись до 45 градусов по Цельсию. Теперь определите значение энергии, при котором вода остается в состоянии теплового равновесия.
Решение:-
В задаче приведены данные,
Масса воды (м) = 40 грамм
Удельная теплоемкость воды Ce = 4.17 Дж на грамм-градус Цельсия
Температура Δt = 45 градусов по Цельсию
Мы знаем, что формула теплового равновесия такова:
Q = м х Сe х Δt
Где,
Q = Полная энергия удельной материи тела
m = масса конкретного вещества тела
Ce= Удельная теплоемкость удельного вещества тела
Δt = температура конкретного вещества тела
Теперь мы помещаем значения в уравнение,
Q = 40 х 4.17 х 45
Q = 7506 Дж.
Чтобы 40 граммов воды нагрелись до 45 градусов по Цельсию. Значение энергии, при котором вода остается на тепловое равновесие состояние 7506 Дж.
Когда найти тепловое равновесие?
Когда два тела соприкасаются, тепло (энергия) передается от одного к другому, пока они не достигнут одинаковой температуры (находятся в тепловом равновесии). Когда объекты имеют одинаковую температуру, теплопередача отсутствует.
Формула для расчета теплового равновесия:
Тепло – это поток энергии от более высокой температуры к более низкой температуре. Когда эти температуры уравновешиваются, тепло перестает течь, тогда говорят, что система (или набор систем) находится в тепловом равновесии.
Формула теплового равновесия:
Q = м х Сe х Δt
Где,
Q = полная энергия удельной материи тела, выраженная в джоулях.
m = масса конкретного вещества тела, выраженная в граммах.
Ce= удельная теплоемкость удельного вещества тела, выраженная в джоулях на кельвин на килограмм.
Δt = температура конкретного вещества тела, выраженная в градусах Кельвина.
Как найти конечную температуру в тепловом равновесии?
С помощью числовых значений конечная температура в тепловом равновесии описана ниже,
Кусок железа массой 220 грамм. Температура куска железа составляет 310 градусов по Цельсию. Предположим, что кусок железа опущен на сосуд, наполненный водой. Вес воды 1.2 кг, температура 22 градуса по Цельсию.
Определить конечную температуру теплового равновесия воды.
Решение:-
Пусть конечная температура в тепловом равновесии для воды = Т градусов по Цельсию.
Теперь изменение температуры,
Δт = Токончательный — Тначальный
Изменение тепла,
Q = м х Сe х Δt
Итак, изменение теплоты куска железа равно
ΔQжелезо = 220/1000 х 450 х (Т – 310) Дж
ΔQжелезо = 99 (Т – 310) Дж
Итак, изменение теплоты воды равно
ΔQводы = 1.20 х 4200 х (Т — 22) Дж
ΔQводы = 5040 (Т – 22) Дж
Используя закон сохранения энергии, мы можем написать,
ΔQжелезо+ ΔQводы = 0
Помещая полученные значения,
99 (Т – 310) + 5040 (Т – 22) = 0
99 Тл – 30690 + 5040Т – 110880 = 0
5138 Т = 141570
Т = 141570/5138
Т = 27.5 градусов по Цельсию.
Кусок железа массой 220 грамм. Температура куска железа составляет 310 градусов по Цельсию. Предположим, что кусок железа опущен на сосуд, наполненный водой. Вес воды 1.2 кг, температура 22 градуса по Цельсию.
Конечная температура в тепловом равновесии для воды составляет 27.5 градусов по Цельсию.
Проблема: 1
Сколько энергии потребуется для повышения температуры 55 граммов воды на 40 градусов по Цельсию?
Решение:-
Данные данные,
Масса воды (м) = 40 грамм
Удельная теплоемкость воды Ce = 4.17 Дж на грамм-градус Цельсия
Температура ΔT = 55 градусов по Цельсию
Мы знаем, что формула теплового равновесия такова:
Q = м х Сe х ΔТ
Где,
Q = Полная энергия удельной материи тела
m = масса конкретного вещества тела
Ce = Удельная теплоемкость удельного вещества тела
Delta; t = Температура конкретного вещества тела
Q = 40 х 4.17 х 55
Q = 9174 Дж.
Для повышения температуры 9174 граммов воды на 55 градусов по Цельсию требуется энергия 40 Дж.
Проблема: 2
Рамеш, друг Ратана, увлекается коллекционированием камней. Пока Рамеш собирает камни, он всегда бросает их в контейнер. Контейнер изготовлен из металлического алюминия. Вес контейнера 15.2 грамма. Естественно, температура контейнера составляет около 36 градусов по Цельсию. Теперь Рамешу в алюминиевую тару наливают холодную воду. Температура воды будет 22 градуса по Цельсию, а вес воды 32 грамма.
Определите точную температуру, при которой температура алюминиевого сосуда и температура холодной воды будут одинаковыми.
Решение: —
Мы знаем, что формула теплового равновесия такова:
Q = м х Сe х ΔТ
Где,
Q = Полная энергия удельной материи тела
m = масса конкретного вещества тела
Ce = Удельная теплоемкость удельного вещества тела
Delta; t = (Конечная температура – Начальная температура) удельного вещества тела
Для алюминия,
QA = мA * СeA * ΔtA ………….. уравнение (1)
Данные данные,
mA = 15.2 грамма
CeA = 0.215 калории на грамм-градус Цельсия
ΔtA = (Тf — ТiA) градус Цельсия = (Tf – 36) градусов по Цельсию
Для воды,
QW = мW * СeW * ΔtW ………….. уравнение (1)
Данные данные,
mW = 32 грамм
CeW = 1 калории на грамм-градус Цельсия
ΔtW = (Тf — ТiW) градус Цельсия = (Tf – 22) градусов по Цельсию
Теперь из ………….. уравнения (1) и ………….. уравнения (2) мы можем написать,
QA = мA * СeA * ΔtA знак равно QW = (-) мW * СeW * ΔtW
Подставляя значение из уравнения (1) и уравнения (2),
15.2 х (0.215) х (Тf – 36) = (-) 32 х 1 х (Тf — 22)
(Поместите значение для CeW = 1 калории на грамм-градус Цельсия
3.268 х (Тf – 36) = -32 (Тf — 22)
3.268 Tf – 117.648 = -32 Тлf + 704
3.268 Tf + 32 тf = 704 + 117.648
Tf = 704 + 117.648/35.268
Tf = 23.2 градуса по Цельсию
Рамеш, друг Ратана, увлекается коллекционированием камней. Пока Рамеш собирает камни, он всегда бросает их в контейнер. Контейнер изготовлен из металлического алюминия. Вес контейнера 15.2 грамма. Естественно, температура контейнера составляет около 36 градусов по Цельсию. Теперь Рамешу в алюминиевую тару наливают холодную воду. Температура воды будет 22 градуса по Цельсию, а вес воды 32 грамма.
Точная температура, при которой температура алюминиевого контейнера и температура холодной воды будут одинаковыми, составляет 23.2 градуса по Цельсию.
Проблема: 3
Неустановленный металл хранится в лаборатории. Вес неуказанного металла 6 грамм. Теперь к неуказанному металлу добавлена энергия 248.2 Дж. Температура неуказанного металла повышается до 116 градусов по Цельсию.
Теперь определите количество удельной теплоемкости для неуказанного металла.
Решение:-
Данные данные,
Масса неуказанного металла (м) = 6 грамм
Нужно рассчитать,
Удельная теплоемкость для неуказанного металла Ce знак равно Джоуль на грамм-градус Цельсия
Температура Delta; t = 116 градуса по Цельсию
Общая энергия неуказанного металла (Q) = 248.2 Дж.
Мы знаем, что формула теплового равновесия такова:
Q = м х Сe х ΔТ
Ce = Q/мDelta; t
Где,
Q = Полная энергия удельной материи тела
m = масса конкретного вещества тела
Ce= Удельная теплоемкость удельного вещества тела
Delta; t = Температура конкретного вещества тела
Ce = 248.2 / 6Delta; t
Ce= 248.2/6 х 116
Ce = 0.356 Дж на грамм-градус Цельсия.
Неустановленный металл хранится в лаборатории. Вес неуказанного металла 6 грамм. Теперь к неуказанному металлу добавлена энергия 248.2 Дж. Температура неуказанного металла повышается до 116 градусов по Цельсию. Количество удельной теплоты для неуказанного металла составляет 0.356 Дж на грамм-градус Цельсия.
Вывод:
Две физические системы находятся в тепловом равновесии, если между ними нет чистого потока тепловой энергии, когда они соединены путем, проницаемым для тепла.
From Wikipedia, the free encyclopedia
Development of a thermal equilibrium in a closed system over time through a heat flow that levels out temperature differences
Two physical systems are in thermal equilibrium if there is no net flow of thermal energy between them when they are connected by a path permeable to heat. Thermal equilibrium obeys the zeroth law of thermodynamics. A system is said to be in thermal equilibrium with itself if the temperature within the system is spatially uniform and temporally constant.
Systems in thermodynamic equilibrium are always in thermal equilibrium, but the converse is not always true. If the connection between the systems allows transfer of energy as ‘change in internal energy’ but does not allow transfer of matter or transfer of energy as work, the two systems may reach thermal equilibrium without reaching thermodynamic equilibrium.
Two varieties of thermal equilibrium[edit]
Relation of thermal equilibrium between two thermally connected bodies[edit]
The relation of thermal equilibrium is an instance of equilibrium between two bodies, which means that it refers to transfer through a selectively permeable partition of matter or work; it is called a diathermal connection. According to Lieb and Yngvason, the essential meaning of the relation of thermal equilibrium includes that it is reflexive and symmetric. It is not included in the essential meaning whether it is or is not transitive. After discussing the semantics of the definition, they postulate a substantial physical axiom, that they call the «zeroth law of thermodynamics», that thermal equilibrium is a transitive relation. They comment that the equivalence classes of systems so established are called isotherms.[1]
Internal thermal equilibrium of an isolated body[edit]
Thermal equilibrium of a body in itself refers to the body when it is isolated. The background is that no heat enters or leaves it, and that it is allowed unlimited time to settle under its own intrinsic characteristics. When it is completely settled, so that macroscopic change is no longer detectable, it is in its own thermal equilibrium. It is not implied that it is necessarily in other kinds of internal equilibrium. For example, it is possible that a body might reach internal thermal equilibrium but not be in internal chemical equilibrium; glass is an example.[2]
One may imagine an isolated system, initially not in its own state of internal thermal equilibrium. It could be subjected to a fictive thermodynamic operation of partition into two subsystems separated by nothing, no wall. One could then consider the possibility of transfers of energy as heat between the two subsystems. A long time after the fictive partition operation, the two subsystems will reach a practically stationary state, and so be in the relation of thermal equilibrium with each other. Such an adventure could be conducted in indefinitely many ways, with different fictive partitions. All of them will result in subsystems that could be shown to be in thermal equilibrium with each other, testing subsystems from different partitions. For this reason, an isolated system, initially not its own state of internal thermal equilibrium, but left for a long time, practically always will reach a final state which may be regarded as one of internal thermal equilibrium. Such a final state is one of spatial uniformity or homogeneity of temperature.[3] The existence of such states is a basic postulate of classical thermodynamics.[4][5] This postulate is sometimes, but not often, called the minus first law of thermodynamics.[6] A notable exception exists for isolated quantum systems which are many-body localized and which never reach internal thermal equilibrium.
Thermal contact[edit]
Heat can flow into or out of a closed system by way of thermal conduction or of thermal radiation to or from a thermal reservoir, and when this process is effecting net transfer of heat, the system is not in thermal equilibrium. While the transfer of energy as heat continues, the system’s temperature can be changing.
Bodies prepared with separately uniform temperatures, then put into purely thermal communication with each other[edit]
If bodies are prepared with separately microscopically stationary states, and are then put into purely thermal connection with each other, by conductive or radiative pathways, they will be in thermal equilibrium with each other just when the connection is followed by no change in either body. But if initially they are not in a relation of thermal equilibrium, heat will flow from the hotter to the colder, by whatever pathway, conductive or radiative, is available, and this flow will continue until thermal equilibrium is reached and then they will have the same temperature.
One form of thermal equilibrium is radiative exchange equilibrium.[7][8] Two bodies, each with its own uniform temperature, in solely radiative connection, no matter how far apart, or what partially obstructive, reflective, or refractive, obstacles lie in their path of radiative exchange, not moving relative to one another, will exchange thermal radiation, in net the hotter transferring energy to the cooler, and will exchange equal and opposite amounts just when they are at the same temperature. In this situation, Kirchhoff’s law of equality of radiative emissivity and absorptivity and the Helmholtz reciprocity principle are in play.
Change of internal state of an isolated system[edit]
If an initially isolated physical system, without internal walls that establish adiabatically isolated subsystems, is left long enough, it will usually reach a state of thermal equilibrium in itself, in which its temperature will be uniform throughout, but not necessarily a state of thermodynamic equilibrium, if there is some structural barrier that can prevent some possible processes in the system from reaching equilibrium; glass is an example. Classical thermodynamics in general considers idealized systems that have reached internal equilibrium, and idealized transfers of matter and energy between them.
An isolated physical system may be inhomogeneous, or may be composed of several subsystems separated from each other by walls. If an initially inhomogeneous physical system, without internal walls, is isolated by a thermodynamic operation, it will in general over time change its internal state. Or if it is composed of several subsystems separated from each other by walls, it may change its state after a thermodynamic operation that changes its walls. Such changes may include change of temperature or spatial distribution of temperature, by changing the state of constituent materials. A rod of iron, initially prepared to be hot at one end and cold at the other, when isolated, will change so that its temperature becomes uniform all along its length; during the process, the rod is not in thermal equilibrium until its temperature is uniform. In a system prepared as a block of ice floating in a bath of hot water, and then isolated, the ice can melt; during the melting, the system is not in thermal equilibrium; but eventually, its temperature will become uniform; the block of ice will not re-form. A system prepared as a mixture of petrol vapour and air can be ignited by a spark and produce carbon dioxide and water; if this happens in an isolated system, it will increase the temperature of the system, and during the increase, the system is not in thermal equilibrium; but eventually, the system will settle to a uniform temperature.
Such changes in isolated systems are irreversible in the sense that while such a change will occur spontaneously whenever the system is prepared in the same way, the reverse change will practically never occur spontaneously within the isolated system; this is a large part of the content of the second law of thermodynamics. Truly perfectly isolated systems do not occur in nature, and always are artificially prepared.
In a gravitational field[edit]
One may consider a system contained in a very tall adiabatically isolating vessel with rigid walls initially containing a thermally heterogeneous distribution of material, left for a long time under the influence of a steady gravitational field, along its tall dimension, due to an outside body such as the earth. It will settle to a state of uniform temperature throughout, though not of uniform pressure or density, and perhaps containing several phases. It is then in internal thermal equilibrium and even in thermodynamic equilibrium. This means that all local parts of the system are in mutual radiative exchange equilibrium. This means that the temperature of the system is spatially uniform.[8] This is so in all cases, including those of non-uniform external force fields. For an externally imposed gravitational field, this may be proved in macroscopic thermodynamic terms, by the calculus of variations, using the method of Langrangian multipliers.[9][10][11][12][13][14] Considerations of kinetic theory or statistical mechanics also support this statement.[15][16][17][18][19][20][21]
Distinctions between thermal and thermodynamic equilibria[edit]
There is an important distinction between thermal and thermodynamic equilibrium. According to Münster (1970), in states of thermodynamic equilibrium, the state variables of a system do not change at a measurable rate. Moreover, «The proviso ‘at a measurable rate’ implies that we can consider an equilibrium only with respect to specified processes and defined experimental conditions.» Also, a state of thermodynamic equilibrium can be described by fewer macroscopic variables than any other state of a given body of matter. A single isolated body can start in a state which is not one of thermodynamic equilibrium, and can change till thermodynamic equilibrium is reached. Thermal equilibrium is a relation between two bodies or closed systems, in which transfers are allowed only of energy and take place through a partition permeable to heat, and in which the transfers have proceeded till the states of the bodies cease to change.[22]
An explicit distinction between ‘thermal equilibrium’ and ‘thermodynamic equilibrium’ is made by C.J. Adkins. He allows that two systems might be allowed to exchange heat but be constrained from exchanging work; they will naturally exchange heat till they have equal temperatures, and reach thermal equilibrium, but in general, will not be in thermodynamic equilibrium. They can reach thermodynamic equilibrium when they are allowed also to exchange work.[23]
Another explicit distinction between ‘thermal equilibrium’ and ‘thermodynamic equilibrium’ is made by B. C. Eu. He considers two systems in thermal contact, one a thermometer, the other a system in which several irreversible processes are occurring. He considers the case in which, over the time scale of interest, it happens that both the thermometer reading and the irreversible processes are steady. Then there is thermal equilibrium without thermodynamic equilibrium. Eu proposes consequently that the zeroth law of thermodynamics can be considered to apply even when thermodynamic equilibrium is not present; also he proposes that if changes are occurring so fast that a steady temperature cannot be defined, then «it is no longer possible to describe the process by means of a thermodynamic formalism. In other words, thermodynamics has no meaning for such a process.»[24]
Thermal equilibrium of planets[edit]
A planet is in thermal equilibrium when the incident energy reaching it (typically the solar irradiance from its parent star) is equal to the infrared energy radiated away to space.
See also[edit]
- Thermodynamic equilibrium
- Radiative equilibrium
- Thermal oscillator
Citations[edit]
- ‘^ Lieb, E.H., Yngvason, J. (1999). The physics and mathematics of the second law of thermodynamics, Physics Reports, 314..a’: 1–96, p. 55–56.
- ^ Adkins, C.J. (1968/1983), pp. 249–251.
- ^ Planck, M., (1897/1903), p. 3.
- ^ Tisza, L. (1966), p. 108.
- ^ Bailyn, M. (1994), p. 20.
- ^ Marsland, Robert; Brown, Harvey R.; Valente, Giovanni (2015). «Time and irreversibility in axiomatic thermodynamics». American Journal of Physics. 83 (7): 628–634. Bibcode:2015AmJPh..83..628M. doi:10.1119/1.4914528. hdl:11311/1043322. S2CID 117173742.
- ^ Prevost, P. (1791). Mémoire sur l’equilibre du feu. Journal de Physique (Paris), vol. 38 pp. 314-322.
- ^ a b Planck, M. (1914), p. 40.
- ^ Gibbs, J.W. (1876/1878), pp. 144-150.
- ^ ter Haar, D., Wergeland, H. (1966), pp. 127–130.
- ^ Münster, A. (1970), pp. 309–310.
- ^ Bailyn, M. (1994), pp. 254-256.
- ^ Verkley, W. T. M.; Gerkema, T. (2004). «On Maximum Entropy Profiles». Journal of the Atmospheric Sciences. 61 (8): 931–936. Bibcode:2004JAtS…61..931V. doi:10.1175/1520-0469(2004)061<0931:OMEP>2.0.CO;2. ISSN 1520-0469.
- ^ Akmaev, R.A. (2008). On the energetics of maximum-entropy temperature profiles, Q. J. R. Meteorol. Soc., 134:187–197.
- ^ Maxwell, J.C. (1867).
- ^ Boltzmann, L. (1896/1964), p. 143.
- ^ Chapman, S., Cowling, T.G. (1939/1970), Section 4.14, pp. 75–78.
- ^ Partington, J.R. (1949), pp. 275–278.
- ^ Coombes, C.A., Laue, H. (1985). A paradox concerning the temperature distribution of a gas in a gravitational field, Am. J. Phys., 53: 272–273.
- ^ Román, F.L., White, J.A., Velasco, S. (1995). Microcanonical single-particle distributions for an ideal gas in a gravitational field, Eur. J. Phys., 16: 83–90.
- ^ Velasco, S., Román, F.L., White, J.A. (1996). On a paradox concerning the temperature distribution of an ideal gas in a gravitational field, Eur. J. Phys., 17: 43–44.
- ^ Münster, A. (1970), pp. 6, 22, 52.
- ^ Adkins, C.J. (1968/1983), pp. 6–7.
- ^ Eu, B.C. (2002). Generalized Thermodynamics. The Thermodynamics of Irreversible Processes and Generalized Hydrodynamics, Kluwer Academic Publishers, Dordrecht, ISBN 1-4020-0788-4, page 13.
Citation references[edit]
- Adkins, C.J. (1968/1983). Equilibrium Thermodynamics, third edition, McGraw-Hill, London, ISBN 0-521-25445-0.
- Bailyn, M. (1994). A Survey of Thermodynamics, American Institute of Physics Press, New York, ISBN 0-88318-797-3.
- Boltzmann, L. (1896/1964). Lectures on Gas Theory, translated by S.G. Brush, University of California Press, Berkeley.
- Chapman, S., Cowling, T.G. (1939/1970). The Mathematical Theory of Non-uniform gases. An Account of the Kinetic Theory of Viscosity, Thermal Conduction and Diffusion in Gases, third edition 1970, Cambridge University Press, London.
- Gibbs, J.W. (1876/1878). On the equilibrium of heterogeneous substances, Trans. Conn. Acad., 3: 108-248, 343-524, reprinted in The Collected Works of J. Willard Gibbs, Ph.D, LL. D., edited by W.R. Longley, R.G. Van Name, Longmans, Green & Co., New York, 1928, volume 1, pp. 55–353.
- Maxwell, J.C. (1867). On the dynamical theory of gases, Phil. Trans. Roy. Soc. London, 157: 49–88.
- Münster, A. (1970). Classical Thermodynamics, translated by E.S. Halberstadt, Wiley–Interscience, London.
- Partington, J.R. (1949). An Advanced Treatise on Physical Chemistry, volume 1, Fundamental Principles. The Properties of Gases, Longmans, Green and Co., London.
- Planck, M., (1897/1903). Treatise on Thermodynamics, translated by A. Ogg, first English edition, Longmans, Green and Co., London.
- Planck, M. (1914). The Theory of Heat Radiation, second edition translated by M. Masius, P. Blakiston’s Son and Co., Philadelphia.
- ter Haar, D., Wergeland, H. (1966). Elements of Thermodynamics, Addison-Wesley Publishing, Reading MA.
- Tisza, L. (1966). Generalized Thermodynamics, M.I.T. Press, Cambridge MA.
Термодинамика
Термодинамика – это раздел физики, изучающий тепловые свойства макроскопических тел и систем тел, находящихся в состоянии теплового равновесия, на основе закона сохранения энергии, без учета внутреннего строения тел, составляющих систему.
Термодинамика не рассматривает микроскопические величины – размеры атомов и молекул, их массы и количество.
Законы термодинамики устанавливают связи между непосредственно наблюдаемыми физическими величинами, характеризующими состояние системы, такими как давление ( p ), объем ( V ), температура ( T ).
Содержание
- Внутренняя энергия
- Тепловое равновесие
- Теплопередача
- Количество теплоты. Удельная теплоемкость вещества
- Работа в термодинамике
- Уравнение теплового баланса
- Первый закон термодинамики
- Второй закон термодинамики
- КПД тепловой машины
- Принципы действия тепловых машин
- Проблемы энергетики и охрана окружающей среды
Внутренняя энергия
Внутренняя энергия – это физическая величина, равная сумме кинетической энергии теплового движения частиц тела и потенциальной энергии их взаимодействия друг с другом.
Обозначение – ( U ), в СИ единица измерения – Джоуль (Дж).
В термодинамике внутренняя энергия зависит от температуры и объема тела.
Внутренняя энергия тел зависит от их температуры, массы и агрегатного состояния. С ростом температуры внутренняя энергия увеличивается. Наибольшая внутренняя энергия у вещества в газообразном состоянии, наименьшая – в твердом.
Внутренняя энергия идеального газа представляет собой только кинетическую энергию теплового движения его частиц; потенциальная энергия взаимодействия частиц равна нулю.
Внутренняя энергия идеального газа прямо пропорциональна его температуре, а от объема не зависит (молекулы идеального газа не взаимодействуют друг с другом):
где ( i ) – коэффициент, равный числу степеней свободы молекулы, ( nu ) – количество вещества, ( R ) – универсальная газовая постоянная, ( T ) – абсолютная температура.
Число степеней свободы равно числу возможных движений частицы.
Важно!
Для одноатомных газов коэффициент ( i ) = 3, для двухатомных газов ( i ) = 5.
На практике часто важно уметь находить изменение внутренней энергии:
При решении задач можно записать формулу для вычисления внутренней энергии, используя уравнение Менделеева–Клапейрона:
где ( p ) – давление, ( V ) – объем газа.
Внутренняя энергия реальных газов зависит как от температуры, так и от объема.
Изменить внутреннюю энергию можно за счет изменения температуры (при теплопередаче) и за счет изменения давления и объема (при совершении работы).
Тепловое равновесие
Тепловое равновесие – это состояние системы, при котором все ее макроскопические параметры остаются неизменными сколь угодно долго.
Величины, характеризующие состояние макроскопических тел без учета их молекулярного строения, называются макроскопическими параметрами. К ним относятся давление и температура, объем, масса, концентрация отдельных компонентов смеси газа и др. В состоянии теплового равновесия отсутствует теплообмен с окружающими телами, отсутствуют переходы вещества из одного агрегатного состояния в другое, не меняются температура, давление, объем.
Любая термодинамическая система переходит самопроизвольно в состояние теплового равновесия. Каждому состоянию теплового равновесия, в которых может находиться термодинамическая система, соответствует определенная температура.
Важно!
В состоянии теплового равновесия объем, давление могут быть различными в разных частях термодинамической системы, и только температура во всех частях термодинамической системы, находящейся в состоянии теплового равновесия, является одинаковой. Микроскопические процессы внутри тела не прекращаются и при тепловом равновесии: меняются положения молекул, их скорости при столкновениях.
Теплопередача
Теплопередача – процесс изменения внутренней энергии тела без совершения работы.
Существуют три вида теплопередачи: теплопроводность, конвекция и излучение (лучистый теплообмен). Теплопередача происходит между телами, имеющими разную температуру. Тепло передается от тела с более высокой температурой к телу с более низкой температурой.
Теплопроводность – это процесс переноса энергии от более нагретых тел (частей тела) к менее нагретым в результате движения и взаимодействия частиц тела. Высокую теплопроводность имеют металлы – так, лучшие проводники тепла – медь, золото, серебро. Теплопроводность жидкостей меньше, а газы являются плохими проводниками тепла. Пористые тела плохо проводят тепло, так как в порах содержится воздух. Вещества с низкой теплопроводностью используют в качестве теплоизоляторов. Теплопроводность невозможна в вакууме. При теплопроводности не происходит переноса вещества.
Явление теплопроводности газов аналогично явлению диффузии. Быстрые молекулы из слоя с более высокой температурой перемещаются в более холодный слой, а молекулы из холодного слоя перемещаются в более нагретый. За счет этого средняя кинетическая энергия молекул более теплого слоя уменьшается, и его температура становится ниже.
В жидкостях и твердых телах при повышении температуры какого-либо участка твердого тела или жидкости его частицы начинают колебаться сильнее. Соударяясь с соседними частицами, где температура ниже, эти частицы передают им часть своей энергии, и температура этого участка возрастает.
Конвекция – перенос энергии потоками жидкости или газа.
Объяснить механизм конвекции можно на основе теплового расширения тел и закона Архимеда. При нагревании объем жидкости увеличивается, а плотность уменьшается. Нагретый слой под действием силы Архимеда поднимается вверх, а холодный опускается вниз. Это естественная конвекция. Она возникает при неравномерном нагревании жидкости или газа снизу в поле тяготения.
При вынужденной конвекции перемещение вещества происходит под действием насосов, лопастей вентилятора. Такая конвекция применяется в состоянии невесомости. Интенсивность конвекции зависит от разности температур слоев среды и агрегатного состояния вещества. Конвекционные потоки поднимаются вверх. При конвекции происходит перенос вещества.
В твердых телах конвекция невозможна, так как частицы не могут из-за сильного взаимодействия покидать свои места. В вакууме конвекция также невозможна.
Примером конвективных потоков в природе являются ветры (бризы дневной и ночной, муссоны).
Излучение (лучистый теплообмен) – перенос энергии электромагнитными волнами. Перенос тепла излучением возможен в вакууме. Источником излучения является любое тело, температура которого отлична от нуля К. При поглощении энергия теплового излучения переходит во внутреннюю энергию. Темные тела быстрее нагреваются излучением, чем тела с блестящей поверхностью, но и остывают быстрее. Мощность излучения зависит от температуры тела. С увеличением температуры тела энергия излучения увеличивается. Чем больше площадь поверхности тела, тем интенсивнее излучение.
Количество теплоты. Удельная теплоемкость вещества
Количество теплоты – это скалярная физическая величина, равная энергии, которую тело получило или отдало при теплопередаче.
Обозначение – ( Q ), в СИ единица измерения – Дж.
Удельная теплоемкость – это скалярная физическая величина, численно равная количеству теплоты, которое тело массой 1 кг получает или отдает при изменении его температуры на 1 К.
Обозначение – ( c ), в СИ единица измерения – Дж/(кг·К).
Удельная теплоемкость определяется не только свойствами вещества, но и тем, в каком процессе осуществляется теплопередача. Поэтому выделяют удельную теплоемкость газа при постоянном давлении – ( c_P ) и удельную теплоемкость газа при постоянном объеме – ( c_V ). Для нагревания газа на 1 К при постоянном давлении требуется большее количество теплоты, чем при постоянном объеме – ( c_P > c_V ).
Формула для вычисления количества теплоты, которое получает тело при нагревании или отдает при охлаждении:
где ( m ) – масса тела, ( c ) – удельная теплоемкость, ( T_2 ) – конечная температура тела, ( T_1 ) – начальная температура тела.
Важно!
При решении задач на расчет количества теплоты при нагревании или охлаждении можно не переводить температуру в кельвины. Так как 1К=1°С, то( Delta T=Delta t ).
Работа в термодинамике
Работа в термодинамике равна изменению внутренней энергии тела.
Обозначение работы газа – ( A’ ), единица измерения в СИ – джоуль (Дж). Обозначение работы внешних сил над газом – ( A ).
Работа газа ( A’ =-A ).
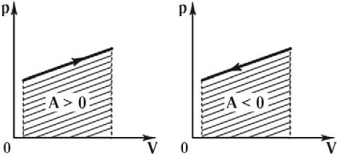
Работой расширения идеального газа называют работу, которую газ совершает против внешнего давления.
Работа газа положительна при расширении и отрицательна при его сжатии. Если объем газа не изменяется (изохорный процесс), то работы газ не совершает.
Графически работа газа может быть вычислена как площадь фигуры под графиком зависимости давления от объема в координатных осях ( (p,V) ), ограниченная графиком, осью ( V ) и перпендикулярами, проведенными из точек начального и конечного значений объема.
Формула для вычисления работы газа:
в изобарном процессе ( A’=pcdotDelta V. )
в изотермическом процессе ( A’=frac{m}{M}RTlnfrac{V_2}{V_1}. )
Уравнение теплового баланса
Если система тел является теплоизолированной, то ее внутренняя энергия не будет изменяться несмотря на изменения, происходящие внутри системы. Если ( A ) = 0, ( Q ) = 0, то и ( Delta U ) = 0 .
При любых процессах, происходящих в теплоизолированной системе, ее внутренняя энергия не изменяется (закон сохранения внутренней энергии).
Рассмотрим теплоизолированную систему из двух тел с разными температурами. При контакте между ними будет проходить теплообмен. Тело с большей температурой будет отдавать некоторое количество теплоты, а тело с меньшей температурой – получать, пока температуры тел не станут равными. Так как суммарная внутренняя энергия не должна изменяться, то, на сколько уменьшится внутренняя энергия более нагретого тела, на столько должна увеличиться внутренняя энергия второго тела. Так как работа не совершается, то изменение внутренней энергии равно количеству теплоты.
Количество теплоты, отданное при теплообмене телом с большей температурой, равно по модулю количеству теплоты, полученному телом с меньшей температурой:
Другая формулировка: если тела образуют замкнутую систему и между ними происходит только теплообмен, то алгебраическая сумма отданных ( Q_{отд} ) и полученных ( Q_{пол} ) количеств теплоты равна нулю:
Первый закон термодинамики
Закон сохранения и превращения энергии, распространенный на тепловые явления, называется первым законом (началом) термодинамики.
Можно дать формулировку этого закона исходя из способов изменения внутренней энергии.
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:
Если рассматривать работу самой системы над внешними телами, то закон может быть сформулирован так:
количество теплоты, переданное системе, идет на изменение ее внутренней энергии и совершение системой работы над внешними телами:
Если система изолирована и над ней не совершается работа и нет теплообмена с внешними телами, то в этом случае внутренняя энергия не изменяется. Если к системе не поступает теплота, то работа системой может совершаться только за счет уменьшения внутренней энергии. Это значит, что невозможно создать вечный двигатель – устройство, способное совершать работу без каких-либо затрат топлива.
Первый закон термодинамики для изопроцессов
Изотермический процесс: ( Q=A’,(T=const, Delta U=0) )
Физический смысл: все переданное газу тепло идет на совершение работы.
Изобарный процесс: ( Q=Delta U+A’ )
Физический смысл: подводимое к газу тепло идет на увеличение его внутренней энергии и на совершение газом работы.
Изохорный процесс: ( Q=Delta U,(V=const, A’=0) )
Физический смысл: внутренняя энергия газа увеличивается за счет подводимого тепла.
Адиабатный процесс: ( Delta U=-A’ ) или ( A=Delta U,mathbf{(Q=0)} )
Физический смысл: внутренняя энергия газа уменьшается за счет совершения газом работы. Температура газа при этом понижается.
Задачи об изменении внутренней энергии тел
Такие задачи можно разделить на группы:
- При взаимодействии тел изменяется их внутренняя энергия без совершения работы над внешней средой.
- Рассматриваются явления, связанные с превращением одного вида энергии в другой при взаимодействии двух тел. В результате происходит изменение внутренней энергии одного тела вследствие совершенной им или над ним работы.
При решении задач первой группы:
- установить, у каких тел внутренняя энергия уменьшается, а у каких – возрастает;
- составить уравнение теплового баланса ( (Delta U=0) ), при записи которого в выражении ( Q =cm(t_2 – t_1) ) для изменения внутренней энергии нужно вычитать из конечной температуры тела начальную и суммировать члены с учетом получающегося знака;
- решить полученное уравнение относительно искомой величины;
- проверить решение.
При решении задач второй группы:
- убедиться, что в процессе взаимодействия тел теплота извне к ним не подводится, т.е. действительно ли ( Q = 0 );
- установить, у какого из двух взаимодействующих тел изменяется внутренняя энергия и что является причиной этого изменения – работа, совершенная самим телом, или работа, совершенная над телом;
- записать уравнение ( Q = Delta U + A ) для тела, у которого изменяется внутренняя энергия, учитывая знак перед работой и КПД рассматриваемого процесса;
- если работа совершается за счет уменьшения внутренней энергии одного из тел, то ( А= -Delta U ), а если внутренняя энергия тела увеличивается за счет работы, совершенной над телом, то ( A=Delta U );
- найти выражения для ( Delta U ) и ( A );
- подставить в исходное уравнение вместо ( Delta U ) и ( A ) выражения для них, получить окончательное соотношение для определения искомой величины;
- решить полученное уравнение относительно искомой величины;
- проверить решение.
Второй закон термодинамики
Все процессы в природе протекают только в одном направлении. В обратном направлении самопроизвольно они протекать не могут. Необратимым называется процесс, обратный которому может протекать только как составляющая более сложного процесса.
Примеры необратимых процессов:
- переход тепла от более нагретого тела к менее нагретому телу;
- переход механической энергии во внутреннюю энергию.
Первый закон термодинамики ничего не говорит о направлении процессов в природе.
Второй закон термодинамики выражает необратимость процессов, происходящих в природе. Существует несколько его формулировок.
Второй закон термодинамики (формулировка Клаузиуса):
невозможно перевести тепло от более холодной системы к более горячей при отсутствии одновременных изменений в обеих системах или окружающих телах.
Второй закон термодинамики (формулировка Кельвина):
невозможно осуществить такой периодический процесс, единственным результатом которого было бы получение работы за счет теплоты, взятой от одного источника.
Эта формулировка говорит также и о том, что невозможно построить вечный двигатель второго рода, то есть двигатель, совершающий работу за счет охлаждения какого-либо одного тела.
Важно!
В формулировке второго закона термодинамики большое значение имеют слова «единственным результатом». Если процессы, о которых идет речь, не являются единственными, то запреты снимаются. Например, в холодильнике происходит передача тепла от более холодного тела к нагретому и при этом осуществляется компенсирующий процесс превращения механической энергии окружающих тел во внутреннюю энергию.
Второй закон термодинамики выполняется для систем с огромным числом частиц. В системах с малым количеством частиц возможны флуктуации – отклонения от равновесия.
КПД тепловой машины
Коэффициентом полезного действия (КПД) тепловой машины (двигателя) называется отношение работы ( A ), совершаемой двигателем за цикл, к количеству теплоты ( Q_1 ), полученному за цикл от нагревателя:
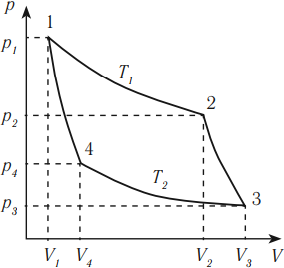
Тепловая машина с максимальным КПД была создана Карно. В машине осуществляется круговой процесс (цикл Карно), при котором после ряда преобразований система возвращается в начальное состояние.
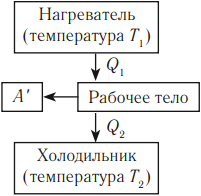
Цикл Карно состоит из четырех стадий:
- Изотермическое расширение (на рисунке — процесс 1–2). В начале процесса рабочее тело имеет температуру ( T_1 ), то есть температуру нагревателя. Затем тело приводится в контакт с нагревателем, который изотермически (при постоянной температуре) передает ему количество теплоты ( Q_1 ). При этом объем рабочего тела увеличивается.
- Адиабатное расширение (на рисунке — процесс 2–3). Рабочее тело отсоединяется от нагревателя и продолжает расширяться без теплообмена с окружающей средой. При этом его температура уменьшается до температуры холодильника ( T_2 ).
- Изотермическое сжатие (на рисунке — процесс 3–4). Рабочее тело, имеющее к тому времени температуру ( T_2 ), приводится в контакт с холодильником и начинает изотермически сжиматься, отдавая холодильнику количество теплоты ( Q_2 ).
- Адиабатное сжатие (на рисунке — процесс 4–1). Рабочее тело отсоединяется от холодильника. При этом его температура увеличивается до температуры нагревателя ( T_1 ).
КПД цикла Карно:
Отсюда видно, что КПД цикла Карно с идеальным газом зависит только от температуры нагревателя ( (T_1) ) и холодильника ( (T_2) ).
Из уравнения следуют выводы:
- для повышения КПД тепловой машины нужно увеличить температуру нагревателя и уменьшить температуру холодильника;
- КПД тепловой машины всегда меньше 1.
Цикл Карно обратим, так как все его составные части являются равновесными процессами.
КПД тепловых двигателей: двигатель внутреннего сгорания — 30%, дизельный двигатель — 40%, паровая турбина — 40%, газовая турбина — 25–30%.
Принципы действия тепловых машин
Тепловым двигателем называют устройство, преобразующее внутреннюю энергию топлива в механическую энергию.
Основные части теплового двигателя:
- Нагреватель – тело с постоянной температурой, преобразующее внутреннюю энергию топлива в энергию газа. В каждом цикле работы двигателя нагреватель передает рабочему телу некоторое количество теплоты.
- Рабочее тело – это газ, совершающий работу при расширении.
- Холодильник – тело с постоянной температурой, которому рабочее тело передает часть тепла.
Любая тепловая машина получает от нагревателя некоторое количество теплоты ( Q_1 ) и передает холодильнику количество теплоты ( Q_2 ). Так как ( Q_1 > Q_2 ), то совершается работа ( A’ = Q_1 – Q_2 ).
Тепловой двигатель должен работать циклически, поэтому расширение рабочего тела должно сменяться его сжатием. Работа расширения газа должна быть больше работы сжатия, совершаемой внешними силами (условие совершения полезной работы). Температура газа при расширении должна быть выше, чем температура при сжатии. Тогда давление газа во всех промежуточных состояниях при сжатии будет меньше, чем при расширении.
В реальных тепловых машинах нагревателем является камера сгорания. В них рабочее тело нагревается за счет тепла, выделяющегося при сгорании топлива. Количество теплоты, выделяющееся при сгорании топлива, вычисляется по формуле:
где ( q ) – удельная теплота сгорания топлива, ( m ) – масса топлива.
Холодильником чаще всего у реальных двигателей служит атмосфера.
Виды тепловых двигателей:
- паровой двигатель;
- турбина (паровая, газовая);
- двигатель внутреннего сгорания (карбюраторный, дизельный);
- реактивный двигатель.
Тепловые двигатели широко используются на всех видах транспорта: на автомобилях – двигатели внутреннего сгорания; на железнодорожном транспорте – дизельные двигатели (на тепловозах); на водном транспорте – турбины; в авиации – турбореактивные и реактивные двигатели. На тепловых и атомных электростанциях тепловые двигатели приводят в движение роторы генераторов переменного тока.
Проблемы энергетики и охрана окружающей среды
Тепловые двигатели широко применяются на транспорте и в энергетике (тепловые и атомные электростанции). Использование тепловых двигателей сильно влияет на состояние биосферы Земли. Можно выделить следующие вредные факторы:
- при сжигании топлива используется кислород из атмосферы, что приводит к снижению содержания кислорода в воздухе;
- при сгорании топлива в атмосферу выделяется углекислый газ. Концентрация углекислого газа в атмосфере повышается. Это изменяет прозрачность атмосферы, так как молекулы углекислого газа поглощают инфракрасное излучение, что ведет к повышению температуры (парниковый эффект);
- при сжигании угля в атмосферу поступают азотные, серные соединения и соединения свинца, вредные для здоровья человека.
Решение проблемы охраны окружающей среды от вредного воздействия предприятий тепловой энергетики требует комплексного подхода. Массовыми загрязнителями при работе тепловых электростанций являются летучая зола, диоксид серы и оксиды азота. Методы сокращения выбросов зависят от свойств топлива и условия его сжижения. Предотвращение загрязнения летучей золой достигается очисткой всего объема продуктов сгорания твердого топлива в высокоэффективных золоуловителях. Сокращение выбросов оксидов азота с продуктами сгорания топлива на тепловых электростанциях, а также в парогазовых и газотурбинных установках обеспечивается, главным образом, технологией сжигания топлива. Уменьшение выброса диоксида серы может быть достигнуто различными методами облагораживания и переработки топлива вне тепловых электростанций либо непосредственно на тепловых электростанциях, а также очисткой дымовых газов.
Контроль за выбросом вредных веществ электростанций осуществляется специальными приборами.
В ряде случаев достаточно эффективным решением вопросов очистки выбросов в атмосферу остается сооружение фильтров-уловителей и дымовых труб. У дымовой трубы два назначения: первое — создавать тягу и тем самым заставлять воздух — обязательный участник процесса горения — в нужном количестве и с должной скоростью входить в топку; второе — отводить продукты горения (вредные газы и имеющиеся в дыме твердые частицы) в верхние слои атмосферы. Благодаря непрерывному турбулентному движению вредные газы и твердые частицы уносятся далеко от источника их возникновения и рассеиваются.
Для рассеивания сернистого ангидрида, содержащегося в дымовых трубах тепловых электростанций, сооружаются дымовые трубы высотой 180, 250 и 320 м. Тепловые электростанции России, работающие на твердом топливе, за год выбрасывают в отвалы около 100 млн т золы и шлаков. Зола и шлаки занимают большие площади земель, неблагоприятно влияют на окружающую среду.
Более половины всех загрязнений создает транспорт. Один из путей решения проблемы защиты окружающей среды заключается в переходе на дизельные двигатели, электродвигатели, повышение КПД.
Алгоритм решения задач раздела «Термодинамика»:
- выделить систему тел и определить ее тип (замкнутая, адиабатически замкнутая, замкнутая в механическом смысле, незамкнутая);
- выяснить, как изменяются параметры состояния ( (p,V,T) ) и внутренняя энергия каждого тела системы при переходе из одного состояния в другое;
- записать уравнения, связывающие параметры двух состояний системы, формулы для расчета изменения внутренней энергии каждого тела системы при переходе из одного состояния в другое;
- определить изменение механической энергии системы и работу внешних сил по изменению ее объема;
- записать формулу первого закона термодинамики или закона сохранения и превращения энергии;
- решить систему уравнений относительно искомой величины;
- проверить решение.
Основные формулы раздела «Термодинамика»
Термодинамика
3 (60.68%) 206 votes