Работа расширения или сжатия газа
Одним
из основных термодинамических процессов,
совершающихся в большинстве тепловых
машин, является процесс расширения газа
с совершением работы. Легко определить
работу, совершаемую при изобарном
расширении газа.
Если
при изобарном расширении газа от объема
V1
до объема V2
происходит перемещение поршня в цилиндре
на расстояние l
(рис. 7.3), то работа A’,
совершенная газом, равна
,
(7.27)
где
p
— давление газа,
—
изменение его объема.
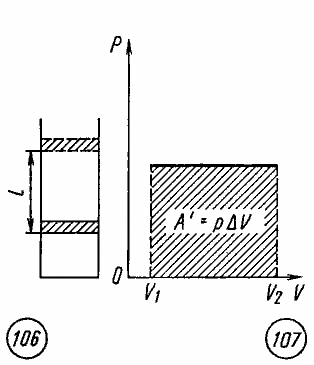
Рис
7.3 Рис 7.4
Как
видно из рисунка 7.4, при изображении
изобарного процесса расширения газа в
координатных осях p
, V
площадь фигуры, ограниченной графиком
процесса, координатами V1
и V2,
осью абсцисс, пропорциональна работе
газа A’.
Работа
при произвольном процессе расширения
газа.
Произвольный процесс расширения газа
от объема V1
до объема V2
можно представить как совокупность
чередующихся изобарных и изохорных
процессов.
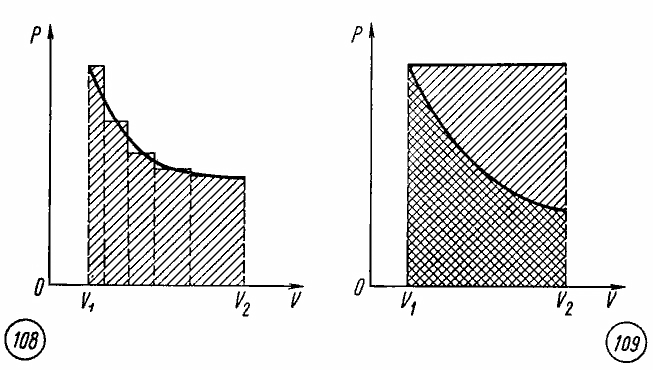
При
изохорных процессах работа равна нулю,
так как поршень в цилиндре не перемещается.
Работа при изобарных процессах
пропорциональна площади фигуры на
диаграмме p,
V
под соответствующим участком изобары
(рис. 7.5).
Рис.
7.5
Рис. 7.6
Следовательно,
работа при произвольном процессе
расширения газа прямо пропорциональна
площади фигуры под соответствующим
участком графика процесса на диаграмме
p,
V.
Работа
при изотермическом расширении газа.
Сравнивая площади фигур под участками
изотермы и изобары (рис. 7.6), можно сделать
вывод, что расширение газа от объема V1
до объема V2
при одинаковом начальном значении
давления газа сопровождается в случае
изобарного расширения совершением
большей работы.
Работа
при сжатии газа.
При расширении газа направление вектора
силы давления газа совпадает с направлением
вектора перемещения, поэтому работа
A’,
совершенная газом, положительна (A’
> 0), а работа А
внешних сил отрицательна: A
= —A’
< 0.
При
сжатии газа направление вектора внешней
силы совпадает с направлением перемещения,
поэтому работа А
внешних сил положительна (A
> 0), а работа A’,
совершенная газом, отрицательна (A’
< 0).
Адиабатный
процесс.
Кроме изобарного, изохорного и
изотермического процессов, в термодинамике
часто рассматриваются адиабатные
процессы.
Адиабатным
процессом
называется процесс, происходящий в
термодинамической системе при отсутствии
теплообмена с окружающими телами, т. е.
при условии Q
= 0.
Отсутствие
теплообмена с окружающей средой может
быть обеспечено хорошей теплоизоляцией
газа. Быстрые процессы расширения или
сжатия газа могут быть близкими к
адиабатному и при отсутствии теплоизоляции,
если время, за которое происходит
изменение объема газа, значительно
меньше времени, необходимого для
установления теплового равновесия газа
с окружающими телами.
Примерами
адиабатных процессов могут служить
процессы сжатия воздуха в цилиндре
воздушного огнива, в цилиндре двигателя
внутреннего сгорания. В соответствии
с первым законом термодинамики, при
адиабатном сжатии изменение внутренней
энергии газа
равно
работе внешних сил А:
(7.28)
Так
как работа внешних сил при сжатии
положительна, внутренняя энергия газа
при адиабатном сжатии увеличивается,
его температура повышается.
При
адиабатном расширении газ совершает
работу A’
за счет уменьшения своей внутренней
энергии:
,
(7.29)
поэтому
температура газа при адиабатном
расширении понижается. Это можно
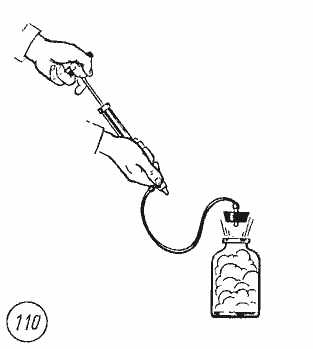
обнаружить в следующем опыте. Если в
бутылку, содержащую насыщенный водяной
пар, накачивать с помощью насоса воздух,
то пробка вылетает (рис. 7.7).
Рис.
7.7
Работа
A’
по выталкиванию пробки совершается
воздухом за счет уменьшения его внутренней
энергии, так как расширение воздуха
происходит за очень короткое время и
теплообмен с окружающей средой не
успевает произойти. Образование капель
тумана доказывает, что при адиабатном
расширении воздуха его температура
понизилась и опустилась ниже точки
росы.
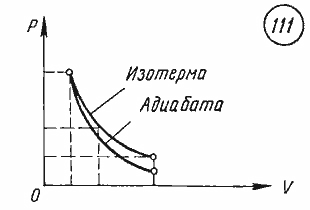
График
адиабатного процесса.
Поскольку при адиабатном сжатии
температура газа повышается, то давление
газа с уменьшением объема растет быстрее,
чем при изотермическом процессе.
Понижение температуры газа при адиабатном
расширении приводит к тому, что давление
газа убывает быстрее, чем при изотермическом
расширении.
График
адиабатного процесса в координатных
осях p,
V
представлен на рисунке 1.8. На том же
рисунке для сравнения приведен график
изотермического процесса.
Рис.
7.8
Вну́тренняя
эне́ргия
тела (обозначается как E
или U) —
полная энергия этого тела за вычетом
кинетической
энергии
тела как целого и потенциальной
энергии
тела во внешнем поле сил. Следовательно,
внутренняя энергия складывается из
кинетической энергии хаотического
движения молекул,
потенциальной энергии взаимодействия
между ними и внутримолекулярной энергии.
Внутренняя
энергия является однозначной функцией
состояния системы. Это означает, что
всякий раз, когда система оказывается
в данном состоянии, её внутренняя энергия
принимает присущее этому состоянию
значение, независимо от предыстории
системы. Следовательно, изменение
внутренней энергии при переходе из
одного состояния в другое будет всегда
равно разности между ее значениями в
конечном и начальном состояниях,
независимо от пути, по которому совершался
переход.
Внутреннюю
энергию тела нельзя измерить напрямую.
Можно определить только изменение
внутренней энергии:
где
—подведённая
к телу теплота,
измеренная в джоулях
—работа,
совершаемая телом против внешних сил,
измеренная в джоулях
Эта
формула является математическим
выражением первого
начала термодинамики
Для
квазистатических
процессов
выполняется следующее соотношение:
где
—температура,
измеренная в кельвинах
—энтропия,
измеренная в джоулях/кельвин
—давление,
измеренное в паскалях
—химический
потенциал
—количество
частиц в системе
Идеальные
газы
Согласно
закону Джоуля, выведенному эмпирически,
внутренняя энергия идеального
газа
не зависит от давления или объёма. Исходя
из этого факта, можно получить выражение
для изменения внутренней энергии
идеального газа. По определению молярной
теплоёмкости
при постоянном объёме,
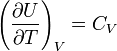
Так как внутренняя энергия идеального
газа является функцией только от
температуры, то

(7.30)
Эта
же формула верна и для вычисления
изменения внутренней энергии любого
тела, но только в процессах при постоянном
объёме (изохорных
процессах);
в общем случае CV
(T,V)
является функцией и температуры, и
объёма.
Если
пренебречь изменением молярной
теплоёмкости при изменении температуры,
получим:
ΔU
= νCVΔT,
(7.31)
где
ν — количеств о вещества, ΔT —
изменение температуры.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Первый закон термодинамики
-
Темы кодификатора ЕГЭ: работа в термодинамике, первый закон термодинамики, адиабатный процесс.
-
Работа газа в изобарном процессе
-
Работа газа в произвольном процессе
-
Работа, совершаемая над газом
-
Применение первого закона термодинамики к изопроцессам
-
Адиабатный процесс
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: работа в термодинамике, первый закон термодинамики, адиабатный процесс.
Начнём с обсуждения работы газа.
Газ, находящийся в сосуде под поршнем, действует на поршень с силой , где
— давление газа,
— площадь поршня. Если при этом поршень перемещается, то газ совершает работу.
При расширении газа эта работа будет положительной (сила давления газа и перемещение поршня направлены в одну сторону). При сжатии работа газа отрицательна (сила давления газа и перемещение поршня направлены в противоположные стороны).
к оглавлению ▴
Работа газа в изобарном процессе
Предположим, что газ расширяется при постоянном давлении . Тогда сила
, с которой газ действует на поршень, также постоянна. Пусть поршень переместился на расстояние
(рис. 1).
Рис. 1.
Работа газа равна:
Но — изменение объёма газа. Поэтому для работы газа при изобарном расширении мы получаем формулу:
(1)
Если и
— начальный и конечный объём газа, то для работы газа имеем:
. Изобразив данный процесс на
-диаграмме, мы видим, что работа газа равна площади прямоугольника под графиком нашего процесса (рис. 2).
Рис. 2. Работа газа как площадь
Пусть теперь газ изобарно сжимается от объёма до объёма
. С помощью аналогичных рассуждений приходим к формуле:
Но , и снова получается формула (1).
Работа газа опять-таки будет равна площади под графиком процесса на -диаграмме, но теперь со знаком минус.
Итак, формула выражает работу газа при постоянном давлении — как в процессе расширения газа, так и в процессе сжатия.
к оглавлению ▴
Работа газа в произвольном процессе
Геометрическая интерпретация работы газа (как площади под графиком процесса на -диаграмме) сохраняется и в общем случае неизобарного процесса.
Действительно, рассмотрим малое изменение объёма газа — настолько малое, что давление
будет оставаться приблизительно постоянным. Газ совершит малую работу
. Тогда работа
газа во всём процессе найдётся суммированием этих малых работ:
Но данный интеграл как раз и является площадью криволинейной трапеции (рис. 3):
Рис. 3. Работа газа как площадь
к оглавлению ▴
Работа, совершаемая над газом
Наряду с работой , которую совершает газ по передвижению поршня, рассматривают также работу
, которую поршень совершает над газом.
Если газ действует на поршень с силой , то по третьему закону Ньютона поршень действует на газ с силой
, равной силе
по модулю и противоположной по направлению:
(рис. 4).
Рис. 4. Внешняя сила , действующая на газ
Следовательно, работа поршня равна по модулю и противоположна по знаку работе газа:
Так, в процессе расширения газ совершает положительную работу ; при этом работа, совершаемая над газом, отрицательна
. Наоборот, при сжатии работа газа отрицательна
, а работа, совершаемая поршнем над газом, положительна
0 right )’ class=’tex’ alt=’left ( {A}’ > 0 right )’ />.
Будьте внимательны: если в задаче просят найти работу, совершённую над газом, то имеется в виду работа .
Как мы знаем, существует лишь два способа изменения внутренней энергии тела: теплопередача и совершение работы.
Опыт показывает, что эти способы независимы — в том смысле, что их результаты складываются. Если телу в процессе теплообмена передано количество теплоты , и если в то же время над телом совершена работа
, то изменение внутренней энергии тела будет равно:
(2)
Нас больше всего интересует случай, когда тело является газом. Тогда (где
, как всегда, есть работа самого газа). Формула (2) принимает вид:
, или
(3)
Соотношение (3) называется первым законом термодинамики. Смысл его прост: количество теплоты, переданное газу, идёт на изменение внутренней энергии газа и на совершение газом работы.
Напомним, что величина может быть и отрицательной: в таком случае тепло отводится от газа. Но первый закон термодинамики остаётся справедливым в любом случае. Он является одним из фундаментальных физических законов и находит подтверждение в многочисленных явлениях и экспериментах.
к оглавлению ▴
Применение первого закона термодинамики к изопроцессам
Напомним, что в изопроцессе остаётся неизменным значение некоторой величины, характеризующей состояние газа — температуры, объёма или давления. Для каждого вида изопроцессов запись первого закона термодинамики упрощается.
1. Изотермический процесс, .
Внутренняя энергия идеального газа зависит только от его температуры. Если температура газа не меняется, то не меняется и внутренняя энергия: . Тогда формула (3) даёт:
Всё подведённое к газу тепло идёт на совершение газом работы.
2. Изохорный процесс, .
Если объём газа остаётся постоянным, то поршень не перемещается, и потому работа газа равна нулю: . Тогда первый закон термодинамики даёт:
Всё тепло, переданное газу, идёт на изменение его внутренней энергии.
3. Изобарный процесс, .
Подведённое к газу тепло идёт как на изменение внутренней энергии, так и на совершение работы (для которой справедлива формула (1)). Имеем:
к оглавлению ▴
Адиабатный процесс
Процесс называется адиабатным, если он идёт без теплообмена с окружающими телами.
Адиабатный процесс совершается газом, находящимся в теплоизолированном сосуде. Такой сосуд препятствует всем видам теплопередачи: теплопроводности, конвекции, излучению. Пример теплоизолированного сосуда — термос.
Приблизительно адиабатным будет всякий процесс, протекающий достаточно быстро: в течение процесса теплообмен просто не успевает произойти.
При адиабатном процессе . Из первого закона термодинамики получаем:
, или
.
В процессе адиабатного расширения газ совершает положительную работу, поэтому (работа совершается за счёт убыли внутренней энергии). Следовательно, газ охлаждается. Если заставить газ совершить достаточно большую работу, охладить его можно весьма сильно. Именно на этом основаны методы сжижения газов.
Наоборот, в процессе адиабатного сжатия будет , поэтому
: газ нагревается. Адиабатное нагревание воздуха используется в дизельных двигателях для воспламенения топлива.
Кривая, изображающая ход адиабатного процесса, называется адиабатой. Интересно сравнить ход адиабаты и изотермы на -диаграмме (рис. 5).
Рис. 5. Сравнительный ход изотермы и адиабаты
В обоих процессах давление убывает с увеличением объёма, но в адиабатном процессе убывание идёт быстрее. Почему?
При изотермическом расширении давление падает потому, что уменьшается концентрация частиц газа, в результате чего удары частиц по стенкам сосуда становятся реже. Однако интенсивность этих ударов остаётся прежней: ведь температура газа не меняется — значит, не меняется и средняя кинетическая энергия его частиц.
А при адиабатном расширении, наряду с уменьшением концентрации частиц, падает также и температура газа. Удары частиц становятся не только более редкими, но и более слабыми. Вот почему адиабата убывает быстрее изотермы.
Благодарим за то, что пользуйтесь нашими статьями.
Информация на странице «Первый закон термодинамики» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать нужные и поступить в высшее учебное заведение или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из данного раздела.
Публикация обновлена:
08.05.2023
При изменении объема газа, газ совершает работу.
При изобарическом процессе работа определяется как A = p∆V, где
A ― работа газа [Дж],
p ― давление газа [Па],
∆V ― изменение объема [м3].
Отсюда видно, что если объём газа не меняется, то есть ∆V = 0, то работа не совершается.
При расширении газа его работа положительна.
При сжатии газа работа отрицательна.
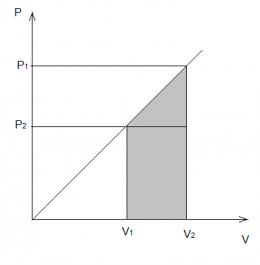
Работа, совершаемая газом, равна площади под графиком на PV диаграмме. На рисунке работа равна площади трапеции:
Внутренняя энергия идеального газа есть сумма кинетических энергий его частиц (энергией взаимодействия частиц пренебрегаем).
Внутренняя энергия идеального газа определяется формулой U = $frac{3}{2}; kT$ , где:
U ― внутренняя энергия [Дж],
T ― температура газа в Кельвинах [К],
k ― постоянная Больцмана, равная 1,38 10–23 [Дж/К].
Первое начало термодинамики представляет собой закон сохранения энергии, в применении к тепловым явлениям. Оно гласит, что тепло, полученное газом, идет на изменение внутренней энергии и совершение работы.
Q = ∆U + A, где
Q ― тепло, полученное газом [Дж],
∆U ― изменение внутренней энергии [Дж],
A ― работа газа [Дж].
Адиабатический процесс — термодинамический процесс, при котором система не обменивается теплотой с окружающим пространством.
В первом начале термодинамики при адиабатическом процессе необходимо положить Q = 0.
Коэффициент полезного действия (КПД) — отношение полезно использованной энергии газа, ко всей полученной энергии:
$eta = frac{Q_{H} — Q_{X}}{Q_H}$где
η ― коэффициент полезного действия, КПД,
QH ― количество теплоты, полученное от нагревателя [Дж],
QX ― количество теплоты, отданное холодильнику [Дж].
Цикл Карно — максимально возможный КПД любой тепловой машины.
КПД цикла Карно определяется температурами нагревателя и холодильника.
$eta = frac{T_H — T_X}{T_H}$ где
η ― коэффициент полезного действия , КПД,
ТН ― температура нагревателя [К],
ТХ ― температура холодильника [К].