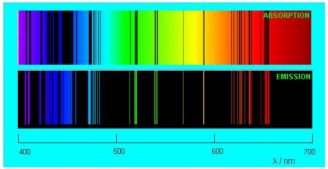
Если пропустить солнечный свет через стеклянную призму или дифракционную решётку, то на экране получится хорошо известный нам спектр. Спектр, который вы видите ниже, называется непрерывным спектром. Он представляет собой сплошную полосу, состоящую из разных цветов, плавно переходящих друг в друга.
Непрерывный (сплошной) спектр — разновидность спектра, в которой присутствуют все длины волн видимого диапазона (от красной границы до фиолетовой).
Излучения, обладающие непрерывным спектром:
- свет, излучаемый Солнцем;
- искусственный свет от лампы дневного освещения;
- любые твердые и жидкие тела, плотные газы, нагретые до высокой температуры.
Пример №1. Будет ли излучать свет в непрерывном спектре спираль работающей электроплиты?
В данном случае да, поскольку спирать — твердое тело, нагретое до высокой температуры.
Линейчатый спектр и его виды
Картина резко меняется, когда мы наблюдаем свечение, излучаемое разреженными газами. Спектр перестает быть непрерывным: в нём появляются разрывы, которые увеличиваются по мере разрежения газа. В предельном случае чрезвычайно разреженного атомарного газа спектр становится линейчатым.
Линейчатый спектр — спектр, который состоит из отдельных достаточно тонких линий.
Линейчатый спектр бывает двух видов:
- спектр испускания;
- спектр поглощения.
Спектр испускания
Предположим, что газ состоит из атомов некоторого химического элемента и разрежен настолько, что атомы почти не взаимодействуют друг с другом. Раскладывая в спектр излучение такого газа (нагретого до очень высокой температуры), мы сможем наблюдать такую картину, как на картинке ниже.
Спектр испускания — линейчатый спектр, который состоит из тонких изолированных разноцветных линий, соответствующих тем длинам волн света, который излучается атомами.
Любой атомарный разреженный газ излучает свет с линейчатым спектром. Но наибольшую важность имеет то, что для любого химического элемента спектр испускания является уникальным. Поэтому по нему можно устанавливать, какой химический элемент находится перед нами. Он является своего рода идентификатором.
Поскольку газ разрежен и атомы мало взаимодействуют друг с другом, мы можем сделать следующий вывод:
Свет излучают атомы сами по себе. Следовательно, каждый атом характеризуется дискретным, строго определённым набором длин волн излучаемого света. У каждого химического элемента этот набор свой.
Спектр поглощения
Атомы излучают свет в процессе перехода из возбуждённого состояния в основное. Но вещество может не только излучать, но и поглощать свет. При поглощении света атом совершает обратный процесс — он переходит из основного состояния в возбуждённое.
Снова рассмотрим разреженный атомарный газ, но теперь в охлажденном состоянии (при довольно низкой температуре). Свечения газа в этом случае мы не увидим. В не нагретом состоянии газ не излучает свечение, так как атомов в возбуждённом состоянии оказывается для этого слишком мало.
Если сквозь охлажденный газ пропустить свет с непрерывным спектром, мы увидим следующую картину (см. рисунок ниже).
Спектр поглощения — темные линии на фоне непрерывного спектра, соответствующие тем длинам волн света, которые поглощаются атомами и излучаются впоследствии при сильном нагревании.
Объясним, откуда берутся темные линии. Под действием падающего света газовые атомы переходят в возбуждённое состояние. При этом оказывается, что для возбуждения атомов нужны не любые длины волн, а лишь некоторые, строго определённые для данного вида газа. Именно эти длины волн газ поглощает из падающего на него света.
Внимание! Газ поглощает те длины волн, которые излучает сам. Поэтому, цветные линии на спектре испускания соответствуют темным линиям на спектре поглощения. Если их сложить, можно получить непрерывный спектр.
На рисунке ниже сопоставлены спектры испускания и поглощения разреженных паров натрия.
Глядя на спектры испускания и поглощения, ученые XIX века пришли к выводу, что атом не является неделимой частицей и обладает некоторой внутренней структурой. Ведь что-то внутри атома должно обеспечивать процессы излучения и поглощения света.
Кроме того, уникальность атомных спектров говорит о том, что этот механизм различен у атомов разных химических элементов. Поэтому атомы разных химических элементов должны отличаться по своему внутреннему устройству.
Спектральный анализ
Использование линейчатых спектров в качестве идентификаторов химических элементов лежит в основе спектрального анализа.
Спектральный анализ — метода исследования химического состава вещества по его спектру.
Идея спектрального анализа заключается в следующем. Спектр излучения исследуемого вещества сопоставляется с эталонными спектрами химических элементов. Затем делается вывод о присутствии или отсутствии различных химических элементов в исследуемом образце. При определённых условиях посредством спектрального анализа можно определить химический состав не только качественно, но и количественно.
В результате наблюдения различных спектров были открыты новые химические элементы. Первыми из таких элементов были цезий и рубидий. Названия эти элементы получили по цвету линий своего спектра. Так, в спектре цезия больше всего выражены две линии небесно-синего цвета, который на латинском языке звучит как caesius. Рубидий же даёт две отчетливые линии рубинового цвета.
В 1868 году в спектре солнечного света были обнаружены линии, не соответствующие ни одному из известных химических элементов. Этот элемент был назван гелием (от греческого гелиос — солнце). Впоследствии гелий был найден в атмосфере нашей планеты. Спектральный анализ излучения Солнца и других звезд показал, что все входящие в их состав входят элементы имеются и на Земле. Таким образом, оказалось, что все объекты Вселенной собраны из одного и того же набора элементов.
Пример №2. Какую картинку можно получить, если провести спектральный анализ вещества, состоящего из двух химических элементов?
Спектры испускания и спектры поглощения будут накладываться друг на друга. В итоге можно будет получить спектр испускания, в котором будут присутствовать все длины волн, соответствующие тем, что испускаются первым и вторым химическим элементом. В спектре поглощения эти же длины волн будут отсутствовать.
Задание EF18348
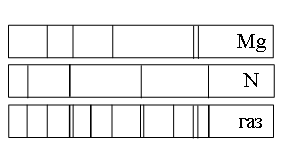
Ответ:
а) азота (N), магния (Mg) и другого неизвестного вещества
б) только азота (N)
в) только магния (Mg)
г) только магния (Mg) и азота (N)
Алгоритм решения
- Определить, при каком условии можно считать, что данный химический элемент входит в состав неизвестного газа.
- Сравнить спектр поглощения неизвестного газа и магния. Сделать вывод о том, присутствует ли магний в газе.
- Сравнить спектр поглощения неизвестного газа и азота. Сделать вывод о том, присутствует ли азот в газе.
- Установить, содержит ли неизвестный газ какие-либо еще элементы.
Решение
Если спектр поглощения неизвестного газа содержит все линии, которые есть на спектре известного элемента, то этот газ содержит этот элемент.
Видно, что спектр поглощения неизвестного газа включает в себя все линии, которые есть в спектре поглощения магния. Следовательно, этот газ содержит магний.
Видно, что спектр поглощения неизвестного газа включает в себя все линии, которые есть в спектре поглощения азота. Следовательно, этот газ также содержит азот.
Но кроме линий, соответствующих азоту и магнию, на спектре поглощения газа наблюдаются другие линии. Следовательно, газ содержит как минимум еще один элемент.
Ответ: а
pазбирался: Алиса Никитина | обсудить разбор
Задание EF18254
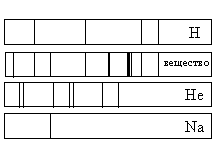
Ответ:
а) только натрий (Na) и водород (Н)
б) только водород (Н) и гелий (Не)
в) водород (Н), гелий (Не) и натрий (Na)
г) натрий (Na), водород (H) и другие элементы, но не гелий (He)
Алгоритм решения
- Определить, при каком условии можно считать, что данный химический элемент входит в состав неизвестного газа.
- Сравнить спектр поглощения неизвестного вещества и водорода. Сделать вывод о том, присутствует ли водород в веществе.
- Сравнить спектр поглощения неизвестного вещества и гелия. Сделать вывод о том, присутствует ли гелий в веществе.
- Сравнить спектр поглощения неизвестного вещества и натрия. Сделать вывод о том, присутствует ли натрий в веществе.
- Установить, содержит ли неизвестный газ какие-либо еще элементы.
Решение
Если спектр поглощения неизвестного газа содержит все линии, которые есть на спектре известного элемента, то этот газ содержит данный элемент.
Видно, что спектр поглощения неизвестного вещества включает в себя все линии, которые есть в спектре поглощения водорода и натрия. Но линий, соответствующих спектру поглощения гелия, в нем нет. Следовательно, это вещество содержит водород, натрий, но не содержит гелий.
Кроме линий, соответствующих водороду и натрию, на спектре поглощения вещества наблюдаются другие линии. Следовательно, оно содержит как минимум еще один элемент.
Ответ: г
pазбирался: Алиса Никитина | обсудить разбор
Задание EF17744

Можно утверждать, что в неизвестном образце
Ответ:
а) не содержится стронция
б) не содержится кальция
в) содержатся кальций и ещё какие-то элементы
г) содержится только кальций
Алгоритм решения
- Определить, при каком условии можно считать, что данный химический элемент входит в состав неизвестного образца.
- Сравнить спектр излучения неизвестного образца и стронция. Сделать вывод о том, присутствует ли стронций в составе образца.
- Сравнить спектр излучения неизвестного образца и кальция. Сделать вывод о том, присутствует ли кальций в составе образца.
- Установить, содержит ли неизвестный газ какие-либо еще элементы.
- Выбрать подходящее утверждение.
Решение
Если спектр излучения неизвестного образца содержит все линии, которые есть на спектре излучения известного элемента, то этот образец содержит данный элемент.
Видно, что спектр излучения неизвестного образца включает в себя все линии, которые есть в спектре излучения стронция. Но линий, соответствующих спектру излучения кальция, в нем нет. Следовательно, этот образец не содержит кальций.
Кроме линий, соответствующих стронцию, на спектре излучения неизвестного образца наблюдаются другие линии. Следовательно, он содержит как минимум еще один элемент.
Из всех перечисленных утверждений верным является только одно — образец не содержит кальция.
Ответ: б
pазбирался: Алиса Никитина | обсудить разбор
Алиса Никитина | Просмотров: 6.6k
Линейчатые спектры
-
Темы кодификатора ЕГЭ: линейчатые спектры.
-
Спектр испускания
-
Спектр поглощения
-
Спектральный анализ
-
Линейчатые спектры
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: линейчатые спектры.
Если пропустить солнечный свет через стеклянную призму или дифракционную решётку, то возникнет хорошо известный вам непрерывный спектр (рис. 1)(Изображения на рис. 1, 2 и 3 взяты с сайта www.nanospectrum.ru):
Рис. 1. Непрерывный спектр
Спектр называется непрерывным потому, что в нём присутствуют все длины волн видимого диапазона — от красной границы до фиолетовой. Мы наблюдаем непрерывный спектр в виде сплошной полосы, состоящей из разных цветов.
Непрерывным спектром обладает не только солнечный свет, но и, например, свет электрической лампочки. Вообще, оказывается, что любые твёрдые и жидкие тела (а также весьма плотные газы), нагретые до высокой температуры, дают излучение с непрерывным спектром.
Ситуация качественно меняется, когда мы наблюдаем свечение разреженных газов. Спектр перестаёт быть непрерывным: в нём появляются разрывы, увеличивающиеся по мере разрежения газа. В предельном случае чрезвычайно разреженного атомарного газа спектр становится линейчатым — состоящим из отдельных достаточно тонких линий.
Мы рассмотрим два типа линейчатых спектров: спектр испускания и спектр поглощения.
к оглавлению ▴
Спектр испускания
Предположим, что газ состоит из атомов некоторого химического элемента и разрежен настолько, что атомы почти не взаимодействуют друг с другом. Раскладывая в спектр излучение такого газа (нагретого до достаточно высокой температуры), мы увидим примерно следующую картину (рис. 2):
Рис. 2. Линейчатый спектр испускания
Этот линейчатый спектр, образованный тонкими изолированными разноцветными линиями, называется спектром испускания.
Любой атомарный разреженный газ излучает свет с линейчатым спектром. Более того, для каждого химического элемента спектр испускания оказывается уникальным, играя роль «удостоверения личности» этого элемента. По набору линий спектра испускания можно однозначно сказать, с каким химическим элементом мы имеем дело.
Поскольку газ разрежен и атомы мало взаимодействуют друг с другом, мы можем заключить, что свет излучают атомы сами по себе. Таким образом, атом характеризуется дискретным, строго определённым набором длин волн излучаемого света. У каждого химического элемента, как мы уже сказали, этот набор свой.
к оглавлению ▴
Спектр поглощения
Атомы излучают свет, переходя из возбуждённого состояния в основное. Но вещество может не только излучать, но и поглощать свет. Атом, поглощая свет, совершает обратный процесс — переходит из основного состояния в возбуждённое.
Снова рассмотрим разреженный атомарный газ, но на сей раз в холодном состоянии (при достаточно низкой температуре). Свечения газа мы не увидим; не будучи нагретым, газ не излучает — атомов в возбуждённом состоянии оказывается для этого слишком мало.
Если сквозь наш холодный газ пропустить свет с непрерывным спектром, то можно увидеть что-то вроде этого (рис. 3):
Рис. 3. Линейчатый спектр поглощения
На фоне непрерывного спектра падающего света появляются тёмные линии, которые образуют так называемый спектр поглощения. Откуда берутся эти линии?
Под действием падающего света атомы газа переходят в возбуждённое состояние. При этом оказывается, что для возбуждения атомов годятся не любые длины волн, а лишь некоторые, строго определённые для данного сорта газа. Вот именно эти длины волн газ и «забирает себе» из проходящего света.
Более того, газ изымает из непрерывного спектра ровно те самые длины волн, которые излучает сам! Тёмные линии в спектре поглощения газа в точности соответствуют ярким линиям его спектра испускания. На рис. 4 сопоставлены спектры испускания и поглощения разреженных паров натрия (изображение с сайта www.nt.ntnu.no):
Рис. 4. Спектры поглощения и испускания для натрия
Впечатляющее совпадение линий, не правда ли?
Глядя на спектры испускания и поглощения, физики XIX века пришли к выводу, что атом не является неделимой частицей и обладает некоторой внутренней структурой. В самом деле, что-то ведь внутри атома должно обеспечивать механизм излучения и поглощения света!
Кроме того, уникальность атомных спектров говорит о том, что этот механизм различен у атомов разных химических элементов; стало быть, атомы разных химических элементов должны отличаться по своему внутреннему устройству.
Строению атома будет посвящён следующий листок.
к оглавлению ▴
Спектральный анализ
Использование линейчатых спектров в качестве уникальных «паспортов» химических элементов лежит в основе спектрального анализа — метода исследования химического состава вещества по его спектру.
Идея спектрального анализа проста: спектр излучения исследуемого вещества сопоставляется с эталонными спектрами химических элементов, после чего делается вывод о присутствии или отсутствии того или иного химического элемента в данном веществе. При определённых условиях методом спектрального анализа можно определить химический состав не только качественно, но и количественно.
В результате наблюдения различных спектров были открыты новые химические элементы.
Первыми из таких элементов были цезий и рубидий; они получили название по цвету линий своего спектра (В спектре цезия наиболее выражены две линии небесно-синего цвета, по-латыни называемого caesius. Рубидий же даёт две характерные линии рубинового цвета).
В 1868 году в спектре Солнца были обнаружены линии, не соответствующие ни одному из известных химических элементов. Новый элемент был назван гелием (от греческого гелиос — солнце). Впоследствии гелий был обнаружен в атмосфере Земли.
Вообще, спектральный анализ излучения Солнца и звёзд показал, что все входящие в их состав входят элементы имеются и на Земле. Таким образом, оказалось, что все объекты Вселенной собраны из одного и того же «набора кирпичиков».
Разберем задачи ЕГЭ по темам: Линейчатые спектры, спектры излучения и поглощения.
к оглавлению ▴
Линейчатые спектры
Задача 1
В 1912 г. английским физиком Альфредом Фаулером при изучении излучения вакуумных трубок, заполненных смесью водорода и гелия, была открыта спектральная серия, которую Фаулер ошибочно приписал водороду. Расчёты показывают, что одна из спектральных линий этой серии соответствует переходу электрона в атоме водорода с энергетического уровня с номером n = 3 на энергетический уровень с номером m =1,5 (хотя энергетического уровня с нецелым номером, конечно же, быть не может). Чему была равна длина волны, соответствовавшая данной спектральной линии? Ответ выразите в нанометрах и округлите до целого числа.
Дано:
n=3
m=1,5
Найти:
Решение.
Уровни энергии в атоме водорода определяются формулой: (эВ), где
и т.д. (1)
При переходе с уровня, соответствующего большему значению энергии (n=3) на уровень с меньшим значением энергии (m=1,5) происходит выделение энергии.
В соответствии с формулой (1), можно рассчитать выделившуюся энергию, которая соответствует указанному переходу
После подстановки численных значений получим:
(эВ).
Чтобы найти длину волны, соответствующую указанному излучению, надо воспользоваться формулой Планка:
С учетом перехода с уровня n на уровень m Отсюда необходимо выразить длину волны
Подстановка численных значений дает значение длины волны, соответствовавшая данной спектральной линии. В расчетах необходимо учесть, что 1эВ Дж.
(м) =
(м) = 273 (нм).
Ответ: 273 нм.
Задача 2
На рисунке показаны спектры поглощения трёх смесей неизвестных газов (1, 2 и 3), а также спектры излучения известных газов A и B. Какая из смесей содержит газ A? В качестве ответа запишите число, обозначающую смесь газов.
Решение.
На рисунке представлены линейчатые спектры смесей газов и отдельных газов. Главное свойство линейчатого спектра состоит в том, линии какого-либо вещества на спектре зависят только от свойств атомов этого вещества, но совершенно не зависят от способа возбуждения свечения атомов. Согласно рисунку, спектральные линии газа А содержатся в смеси газов 3.
Ответ: 3
Задача 3
Какую минимальную скорость должны иметь электроны, чтобы ударом перевести атом водорода из первого энергетического состояния в пятое?
Дано:
n=1
m=5
Найти:
Решение.
Уровни энергии в атоме водорода определяются формулой:
(эВ), где
и т.д.
Для перевода атома водорода из первого энергетического состояния в пятое, ему необходимо сообщить энергию, равную разности этих энергетических состояний.
Рассчитаем значение этой энергии.
(эВ)
В системе «СИ» с учетом того, что 1 эВ Дж.
(Дж).
Электроны, передающие атому водорода эту энергию, должны обладать кинетической энергией не меньшей, чем Дж.
Из последней формулы можно вывести и рассчитать скорость электронов.
масса электрона равна
кг.
(м/с) = 2,14 (Мм/с).
Ответ: 2,14 Мм/с
Благодарим за то, что пользуйтесь нашими материалами.
Информация на странице «Линейчатые спектры» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать необходимые и поступить в ВУЗ или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из разделов нашего сайта.
Публикация обновлена:
08.05.2023
ны. Энергия переходов n→σ* и π→π* меньше, и, следовательно, длина волны света, возбуждающего такой переход, соответственно больше. Практическое значение имеют переходы π→π* и n→π*, поскольку только им соответствуют длины волн, попадающие в рабочий диапазон прибора.
Группировки, вызывающие избирательное поглощение электромагнитного колебания в видимой и ультрафиолетовой части спектра, называются хромофорами.
Основными хромофорами, дающими максимум поглощения в области 200 – 800 нм, являются системы сопряженных двойных связей. Сопряженные двойные связи будут поглощать кванты света с большей длиной волны, чем изолированные двойные связи. Для изолированных кратных связей в используемом для измерений интервале проявляется только переход карбонильной группы C = O (λmax = 270 нм). В ароматических системах переход электрона в возбужденное состояние осуществляется также при меньшей затрате энергии, чем в случае изолированной двойной связи.
Таким образом, основными хромофорами в УФспектроскопии являются сопряженные C=C-связи, карбонильная группа C=O, системы C=C-C=O, ароматическое ядро. Исключение составляют переходы π→π* изолированных двойных
связей C=C и C=N-, а также тройных связей C≡C и C≡N ((λmax = 650-180 нм).
Если плавно изменять длину волны падающего на вещество светового потока, то коэффициент ослабления вещества изменяется по довольно сложной зависимости.
Функция, связывающая коэффициент ослабления с длиной волны, называется спектром поглощения (абсорбции) вещества.
Спектрами называются также и другие оптические характеристики веществ: абсорбция вещества и светопропускание, вычерченные в зависимости от длины волны, частоты или волнового числа (рис. 1.4.).
14
Спектр поглощения удобен для качественного анализа и идентификации, и может претендовать на роль своеобразного паспорта вещества. Практически нет случаев, чтобы различные по химическому строению вещества имели полностью совпадающие спектры.
УФ-спектр органического вещества характеристичен, т.к. поглощение определяется только собственно хромофором и его ближайшим окружением, т.е. один и тот же хромофор проявляется практически одинаково как в исключительно простых, так
исамых сложных молекулах.
Взависимости от непосредственного окружения одной и той же хромофорной группировки положение максимума поглощения в УФ-спектрах различных соединений может несколько меняться. Введение в молекулу различных заместителей или изменение внешних условий, например растворителя, обычно вызывает сдвиг полосы поглощения. Сдвиг максимума в сторону более длинных волн принято называть батохромным сдвигом (обусловлен наличием атома галогена, гидрокси-, ами- но-, алкильных групп), а сдвиг в сторону более коротких волн – гипсохромным (например, образование водородной связи с растворителем).
Рис. 1.4. Некоторые способы изображения спектров поглощения
УФ-спектр в большинстве случаев представляет собой кривую с одним пологим максимумом (рис. 1.5.).
15
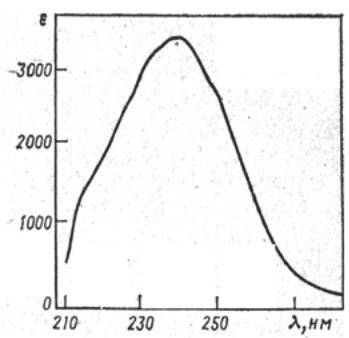
Рис. 1.5. УФ-спектр циклопентадиена
Уширение полос связано с сильным влиянием молекул растворителя на энергетические уровни электронов, ответственных за светопоглощение, и наложением колебательных переходов на электронный переход (помимо основных уровней электронных переходов существуют подуровни, связанные с колебаниями молекулы).
Обычно УФ-спектр характеризуют длиной волны, при которой наблюдается максимум поглощения, и молярным коэффициентом ослабления в этом максимуме. Например, спектр циклопентадиена (рис. 1.5.) достаточно точно может быть пе-
редан записью: λmax (в гексане) 240 нм (ε 3400). УФ-спектр вещества может иметь несколько максимумов поглощения, каж-
дый из которых соответствует различным типам электронных переходов. В этом случае при цифровой записи спектра перечисляются длины волн максимумов поглощения и в скобках приводятся значения “ε”, соответствующие данному максимуму.
Молярный коэффициент ослабления для каждого поглощающего в УФ-области вещества при данной длине волны в одном растворителе имеет строго постоянное значение (издаются атласы спектров поглощения веществ, таблицы).
16
В качестве растворителей в УФ-спектроскопии используются вещества, не имеющие поглощения в исследуемой области спектра и не реагирующие с растворенным веществом (гексан, гептан, циклогексан, спирты, вода, галогенопроизводные, простые эфиры, кислоты и др.).
Интенсивность поглощения в спектре связана с вероятностью данного типа электронного перехода. Наибольшей интенсивностью в спектрах поглощения обладают полосы, обусловленные переносом электрона от одного атома к другому (полосы переноса заряда). Более правильно следует говорить о переносе электрона между молекулярными орбиталями, локализованными у разных атомов. К ним относятся многие π→π*— и n→π*-переходы. Однако не все переходы осуществляются в действительности. Существуют так называемые правила отбора, определяющие разрешенные и запрещенные переходы. Эти правила учитывают в основном симметрию молекулы, а также симметрию основного и возбужденного состояний. Запрещены переходы, при которых происходит изменение спина электрона. Интенсивность поглощения, соответствующего разрешенным переходам, обычно более высока, молярный коэффициент ослабления достигает тысяч, а иногда и сотен тысяч единиц, тогда как для запрещенных переходов значение “ε” составляет десятки, реже – сотни единиц.
1.2.3. Устройство приборов
Приборы для селективного поглощения излучения растворами называются спекрофотометрами. При всем многообразии схем и конструктивных особенностей приборов абсорбционной спектроскопии в каждом из них имеется несколько основных узлов, функции которых примерно одинаковы в разных приборах. Такими узлами являются: источник света, монохроматор света, кювета с исследуемым веществом, приемник света.
В приборах абсорбционной спектроскопии свет от источника освещения проходит через монохроматор и падает на кювету с исследуемым веществом. Интенсивность монохромати-
17
ческого света, прошедшего через кювету, измеряется приемником света.
Ввидимой области источником света являются специальные лампы накаливания с вольфрамовой спиралью с высокой температурой нити, чтобы максимум испускания был смещен как можно дальше в видимую область. Такие лампы называют перекальными.
Вкачестве источника УФ-излучения обычно применяется водородная (дейтериевая) лампа: электрическая дуга в атмосфере водорода при низком давлении, которая дает практически непрерывный спектр излучения в области 200 – 400 нм. Кроме того, используют ртутные лампы. В ртутной лампе разряд происходит в парах ртути. Возбужденные атомы ртути испускают линейчатый спектр, в котором преобладает излучение
сдлиной волны 254, 302, 334 нм.
Монохроматоры и светофильтры предназначены для выделения из полихроматического спектра источника узкого участка, который в условиях опыта можно считать монохроматическим.
Светофильтры – это окрашенные стекла, пропускающие полосу 20 – 50 нм. Светофильтры применяют в колориметрах для выделения спектрального участка, в котором анализируемый раствор имеет наибольшую величину абсорбции (поглощения). Колориметры имеют набор светофильтров, непрерывно перекрывающих весь видимый участок спектра.
Плавное изменение длины волны светового потока возможно с помощью монохроматоров. Наибольшее распространение имеют призменные монохроматоры и монохроматоры с дифракционной решеткой.
Основным элементом призменного монохроматора является диспергирующая призма, которая разлагает полихроматическое излучение в спектр (рис. 1.6).
Излучение источника фокусируется конденсором на входной щели монохроматора. Входная щель установлена в фокусе коллиматорной линзы, направляющей параллельный пучок лучей на грань призмы. Диспергированные лучи фокусируются объективом в фокальной плоскости монохроматора, где нахо-
18
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Спектры поглощения различных веществ могут предоставить нам информацию об их химическом составе, молекулярной структуре и атомном строении. Область спектроскопии занимается их получением и анализом. Полученные таким образом знания можно использовать для разработки и получения новых материалов с интересными свойствами, что позволило нам создать современные самолеты, катализаторы выхлопных газов, фотогальванические элементы или литий-ионные батареи.
Спектроскопия
Изучение атомных спектров полезно не только в материаловедении — спектроскопический анализ также является основополагающим в работе реставраторов произведений искусства. Это, в том числе, позволяет понять, почему работает микроволновая печь.

Слово спектр происходит от латинского слова spectrum, означающего появление, вид или образ, а также дух или фантом. «Спектроскопия», с другой стороны, — это метод получения и изучения спектров, то есть зависимости физических величин от длины волны, частоты или энергии света. Поэтому термин «абсорбционная спектроскопия» будет использоваться для описания методов исследования, целью которых является получение спектра поглощения вещества.
Обратите внимание, что когда мы пишем о спектроскопических методах, мы используем множественное число — не существует единственного метода, называемого «абсорбционная спектроскопия». В зависимости от используемой длины волны света можно говорить о различных разновидностях абсорбционной спектроскопии (и различных спектрах поглощения). Примеры (не все!) этого семейства представлены в таблице 1.
| Тип используемого излучения | Название метода |
| Рентгеновское | Рентгеновская абсорбционная спектроскопия |
| Ультрафиолетовое и видимое | Ультрафиолетовая – видимая спектроскопия (UV-VIS-спектроскопия) |
| Инфракрасное | Инфракрасная абсорбционная спектроскопия |
| Микроволновое | Микроволновая абсорбционная спектроскопия |
| Радиоволновое | Спектроскопия ядерного магнитного резонанса.
Спектроскопия электронного парамагнитного резонанса. |
Прежде чем двигаться дальше, давайте вспомним, что такое спектр поглощения — его получают, освещая вещество определенным излучением и исследуя излучение, которое проходит через вещество. Другими словами, если мы наблюдаем отсутствие определенных длин волн в спектре поглощения по сравнению с падающим излучением, это означает, что эти длины волн были поглощены материалом.
Схема метода поглощения показана на рис. 2, а пример спектра поглощения — на рис. 3. Это спектр поглощения солнечного излучения, полученный, когда солнечное излучение, произведенное глубоко внутри звезды, проходит через слои газа. Видимые черные линии указывают на то, что часть излучения была поглощена.
Различные виды абсорбционной спектроскопии являются мощными инструментами для изучения разнообразных свойств материалов. В таблице 2 мы привели примеры информации, которую можно получить, изучая спектры поглощения в различных спектральных диапазонах.
| Тип используемого излучения | Применение |
| Рентгеновское | Изучение расположения атомов друг относительно друга на очень малых расстояниях, изучение химического состава образца и степени окисления элементов |
| Ультрафиолетовое | Тестирование химического состава образца, тестирование концентрации растворов |
| Видимое | Изучение химического состава звезд и межзвездных облаков, изучение электронной структуры твердых тел, изучение химического состава образца, изучение концентрации растворов |
| Инфракрасное | Изучение химического состава газов, изучение типов связи между атомами, для органических соединений: определение типов функциональных групп, которые присоединяются к углеродной цепи |
| Микроволновое | Определение длин и углов связей между атомами |
| Радиоволновое | Изучение расположения атомов друг относительно друга на очень малых расстояниях, изучение степени окисления элементов в образце |
Применение
В таблице 2 мы представили типичные научные применения абсорбционной спектроскопии. Но давайте попробуем ответить на вопрос — чем могут быть полезны для нас исследованные свойства? Какую пользу мы можем извлечь из знания взаимного расположения атомов в материале или типов химических связей? Другими словами, почему эти методы так важны?
Ответ очень общий — знание перечисленных аспектов позволяет нам, в частности, связывать различные свойства материалов с их атомной структурой. Зная, как связаны свойства и структура материала, мы можем попытаться изменить эту структуру и таким образом улучшить свойства материалов. В результате мы теперь можем производить очень прочные и очень легкие композитные материалы, которые используются, например, при строительстве самолетов, все более совершенные электрические проводники, каталитические нейтрализаторы для разложения выхлопных газов автомобилей, литий-ионные батареи, фотогальванические элементы или датчики выхлопных газов или других токсичных газов.
Изучая свойства различных материалов с помощью методов абсорбционной спектроскопии, мы можем разрабатывать новые материалы с улучшенными свойствами. Например, самолет Boeing 787-8, легче предшественников в своем классе благодаря использованию в его конструкции современных композитных материалов.
Однако применение абсорбционной спектроскопии не ограничивается материаловедением. Возьмем пример из совершенно другой области — искусства! При изучении различных произведений живописи историков интересуют ответы на следующие вопросы: является ли картина, которую мы видим сегодня, той, которую художник написал изначально? Какова была техника рисования? И, наконец, не менее важный вопрос — является ли данная картина оригиналом или очень хорошо созданной копией? Методы абсорбционной спектроскопии могут дать ответы на эти вопросы!
В истории искусства часто случалось так, что художник, например, получал заказ от своего покровителя написать первый вариант той или иной картины. Если меценат не был удовлетворен результатом, художник закрашивал или перерисовывал части картины. Бывает также, что пигменты, используемые в красках, не выдержали испытания временем и в результате химических реакций изменили свой цвет — так, например, темно-зеленая краска может стать коричневой. Наконец, случается, что работа оригинального художника впоследствии «исправляется» другими. Такие изменения коснулись, например, знаменитой «Дамы с горностаем» Леонардо да Винчи, где фон за фигурой был закрашен черным, а сама дама и горностай отретушированы. Текущая версия изображения показана на рисунке 4.
На рис. 5 представлен фрагмент горностая, увиденный в инфракрасном излучении. Темные участки сильно поглощают это излучение, светлые — слабо.
Более высокое поглощение в какой-либо области может означать, что под видимым слоем может находиться более ранняя версия изображения — в данном случае более темная линия вокруг морды животного указывает на то, что в первоначальной версии изображения она была немного больше.

С другой стороны, на рис. 6 показано использование поглощения ультрафиолетового излучения. Изображение поглощает ультрафиолетовое излучение и испускает излучение в видимом свете. Состав этого света зависит от типа используемого пигмента и его элементного состава. В красной краске, которой да Винчи покрасил рукав платья портретируемой Чечилии Галлерани, присутствуют, в частности, свинец, ртуть, железо и кальций. Обратите внимание, как меняется пропорция каждого элемента в более светлых и более темных областях рукава.

Изучение химического состава пигментов также позволяет ответить на вопрос, каким был их первоначальный цвет — не изменился ли цвет, который мы видим сегодня, под воздействием, например, погодных условий. Наконец, это позволяет определить, имела ли место подделка. Если при исследовании картины обнаруживается присутствие красителей, по составу схожих с теми, которые используются сегодня, а не во время создания картины, мы можем быть уверены, что данная картина не является оригиналом.
Давайте теперь сменим тему на несколько иную — от материаловедения и искусства перейдем к изучению… воды. Мы попытаемся объяснить некоторые его свойства, основываясь на спектрах поглощения для различных диапазонов излучения.
Мы знаем, что вода прозрачна в видимом свете, но имеет легкий голубоватый оттенок. Почему? Посмотрите на рис. 7. На нем показана зависимость коэффициента поглощения воды (вертикальная ось) от длины волны падающего излучения (горизонтальная ось). Вертикальная ось показана в логарифмическом масштабе.
Из графика можно сделать два важных вывода: во-первых, коэффициент поглощения не является постоянной величиной, а зависит от длины волны (или частоты) падающего света! Во-вторых, мы видим, что длины волн, создающие впечатление фиолетового и синего цветов, поглощаются более чем в 100 раз меньше, чем те, которые ассоциируются с красным цветом! Это придает воде «голубоватый» оттенок.
Давайте теперь проанализируем другой спектр, на этот раз в области микроволнового излучения. Она представлена на рис. 8. Пунктирными линиями на рисунке показана зависимость так называемых диэлектрических потерь как функция частоты излучения и температуры. Диэлектрические потери связаны с поглощением — чем выше диэлектрические потери, тем выше поглощение излучения.
Поэтому кривые, показанные на рис. 8. можно также назвать спектрами поглощения, просто представленными с помощью других физических величин. «Диэлектрические потери» означают, что энергия падающего излучения будет поглощена материалом. Мы знаем, что поглощенная энергия направлена на увеличение интенсивности колебаний молекул воды. Макроскопически это означает, что вода повышает свою температуру при освещении микроволнами.
Можете ли вы придумать какое-нибудь применение этому явлению? Это, конечно же, микроволновая печь. Типичное устройство такого типа производит микроволны с частотой 2,45 ГГц (что соответствует длине волны около 0,12 м). Из рис. 8 видно, что диэлектрические потери на этой частоте отличны от нуля — поэтому вода, присутствующая в пище, поглощает микроволновое излучение и повышает свою температуру, что приводит к нагреванию всей пищи.
Анализируя рис. 9, можно также задать вопрос — почему мы не используем в микроволновых печах частоты, где диэлектрические потери еще выше — например, около 10 ГГц? Ведь тогда поглощение излучения происходило бы еще эффективнее, и пища нагревалась бы быстрее! Ответ связан с другим свойством излучения — чем выше коэффициент поглощения (или диэлектрические потери), тем меньше излучение проникает в материал.
Высокие диэлектрические потери означают, что большая часть излучения поглощается очень близко к поверхности. Поэтому, если бы микроволновые печи вырабатывали микроволны более высокой частоты, то нагреваемая пища была бы очень горячей в тонком слое у поверхности и становилась бы холодной в глубине. При более низких частотах микроволн поглощенная энергия более равномерно распределяется по пище.
Наконец, проанализируем зависимость коэффициента поглощения воды для широкого диапазона частот. На рисунке 9 показан диапазон видимого света, который мы обсуждали ранее. Анализируя спектр в широком диапазоне, можно увидеть, что поглощение воды в видимом диапазоне очень слабое — вода гораздо лучше поглощает волны из инфракрасного и микроволнового диапазона (что вызывает ее нагрев) и из ультрафиолетового диапазона.
Для сравнения — поглощение в ультрафиолете примерно в миллиард раз сильнее, чем в видимой области! Сильное поглощение в этой области уже связано с фотоионизацией воды — излучение поглощается молекулами воды и вызывает выбивание из них электронов.
Своим присутствием на Земле мы обязаны тому факту, что вода лишь слабо поглощает излучение видимого диапазона. Если бы вода сильно поглощала это видимое излучение, все водоемы были бы темными и мутными. Это предотвратило бы развитие водных растений, а затем и водных животных.
Список использованной литературы
- Ельяшевич М. А. Спектры оптические // Физическая энциклопедия / Гл. ред. А. М. Прохоров. — М.: Большая Российская энциклопедия, 1994. — Т. 4. Пойнтинга—Робертсона эффект — Стримеры. — С. 628—629. — 704 с. — 40 000 экз. — ISBN 5-85270-087-8.
- Физика. 11 класс: учеб. для общеобразоват. учреждений: базовый и профил. уровни/ Г. Я. Мякишев, Б. Б. Буховцев, В. М. Чаругин; под ред. В. И. Николаева, Н. А. Парфентьевой. — 19-е изд. — М. : Просвещение, 2010. — 399 с.
- Малышев, В. И. Введение в экспериментальную спектроскопию. — М.: Наука, 1979. — 479 с.
- John M. Chalmers; Peter Griffiths, eds. (2006). Handbook of Vibrational Spectroscopy. New York: Wiley. doi:10.1002/0470027320. ISBN 978-0-471-98847-2.