Наибольшие трудности при изучении физики
учащиеся испытывают при решении задач, т.е. когда
требуется применить знания. Эти трудности
представляются ребятам настолько большими, что
многие из них отказываются даже от попыток
решать задачи. Отказ от решения задач еще как-то
«проходил» во времена устных экзаменов по
физике. Но теперь – как при прохождении
Государственной итоговой аттестации, выполнении
заданий Единого государственного экзамена или
тестирования при поступлении – проверяют именно
умение применять полученные знания, а не
декларировать их.
Понимание смысла физических законов – главная
цель школьного курса физики, но понимание этих
законов может родиться только в осознанной
деятельности по применению этих законов.
Школьникам же часто предлагают алгоритмы
решения задач, которые провоцируют бездумное,
автоматическое применение физических формул.
Преодолеть эту принципиальную трудность можно,
только неоднократно применяя законы физики в
тщательно отобранных простейших ситуациях,
когда смысл этих законов кристально ясен.
В школьном курсе физики тысячи задач. Однако,
если посмотреть на все множество этих задач «с
высоты птичьего полета», то нетрудно заметить,
что подавляющее их большинство группируются
вокруг нескольких десятков типичных учебных
ситуаций. Эти ситуации можно назвать ключевыми.
А овладение ключевыми ситуациями «даст ключи» к
решению задач.
Ключевые ситуации – важнейшая связь между
«теорией» и «задачами». Без этой связи теория
мертва для школьника, а задачи представляются
ему случайной россыпью неинтересных загадок.
Однако пока еще некоторые учителя «дают» своим
ученикам «теорию» отдельно, а «задачи» отдельно.
После такого разрезания по живому от живой
физики остаются только мертвые формулы-шаблоны
для примитивных задач на подстановку.
Изучение ключевых ситуаций – это живой мост
между «теорией» и «задачами», причем мост с
двухсторонним движением. С одной стороны, задачи
рождаются при изучении ключевых ситуаций, в
которых наглядно проявляется действие
физических законов, с другой стороны, благодаря
решению задач на основе ключевой ситуации теория
осознается, т.е. становится действенной силой, а
не пассивным набором фактов и формул.
И еще одна очень важная роль ключевых ситуаций.
Дело в том, что результатом изучения школьного
курса физики должен быть не набор решенных задач
(это быстро забывается), а понимание физических
законов и физическая интуиция, которая может
развиваться именно при рассмотрении ключевых
ситуаций.
Приложение 1.
Фрагмент урока с выделением ключевой ситуации по
теме «Плотность».
Приложение 2. Фрагмент
урока с выделением ключевой ситуации по теме
«Полые тела».
Приложение 3.
Дополнительный материал по теме «Сплавы».
Приведем фрагмент урока с выделение ключевой
ситуации по теме «Сплавы».
Фрагмент урока по теме «СПЛАВЫ»
Учитель. Тема урока зашифрована
ребусом. Кто первый раскроет секрет?
Ученики. …
Учитель. Тема урока «Сплавы».
Сплав — макроскопически однородная смесь двух
или большего числа химических элементов с
преобладанием металлических компонентов.
Основной или единственной фазой сплава, как
правило, является твёрдый раствор легирующих
элементов в металле, являющемся основой сплава.
Сплавы имеют металлические свойства, например:
металлический блеск, высокие электропроводность
и теплопроводность. Иногда компонентами сплава
могут быть не только химические элементы, но и
химические соединения, обладающие
металлическими свойствами. Например, основными
компонентами твёрдых сплавов являются карбиды
вольфрама или титана. Макроскопические свойства
сплавов всегда отличаются от свойств их
компонентов, а макроскопическая однородность
многофазных (гетерогенных) сплавов достигается
за счёт равномерного распределения примесных
фаз в металлической матрице.
Сплавы обычно получают с помощью смешивания
компонентов в расплавленном состоянии с
последующим охлаждением. При высоких
температурах плавления компонентов, сплавы
производятся смешиванием порошков металлов с
последующим спеканием (так получаются, например,
многие вольфрамовые сплавы).
Сплавы являются одним из основных
конструкционных материалов. Среди них
наибольшее значение имеют сплавы на основе
железа и алюминия. В состав многих сплавов могут
вводиться и неметаллы, такие как углерод,
кремний, бор и др. В технике применяется более 5
тыс. сплавов.
Цель нашего урока –
научиться решать задачи для определения
плотности, массы или объема сплавов или веществ
входящих в их состав.
Рассматривая сплавы, обычно предполагают, что
объем сплава равен сумме объемов
составляющих его веществ. В таком случае
плотность сплава ,
где индексы 1 и 2 относятся к двум компонентам
сплава.
Если заданы или требуется найти массы
компонентов известной плотности ρ1 и ρ2, то объемы
компонентов надо выразить через их массы и
плотности, в результате чего формула для
плотности сплава примет вид 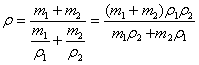
Часто в задаче дано или требуется найти
соотношение масс компонентов сплава. Обозначим . Тогда
. Эта формула связывает
плотность сплава ρ и массовое отношение
компонент . Из
нее при следует:
. Приведенные
формулы позволяют по заданному значению одной из
величин ( или ρ)
найти значение другой.
Запишите в тетрадях:
Примечание.
1. Задача первого уровня предназначена для
применения основной формулы: .
2. Задачи второго уровня похожи, поэтому
целесообразно применить разные способы решения.
3. Задачи третьего уровня предусмотрены для
закрепления способов решения задач предложенных
ранее с добавлением дополнительных вычислений
(объема и процентного отношения).
РЕШЕНИЕ ЗАДАЧ
Задачи по теме «СПЛАВЫ»:
УРОВЕНЬ 1
Найдите плотность бронзы, для изготовления
которой взяли 100 г меди и 30 г олова, считая, что
объем сплава равен сумме объемов входящих в него
металлов.
УРОВЕНЬ 2
1. Кусок сплава из свинца и олова массой 664 г
имеет плотность 8,3 г/см3. Определите массу
свинца в сплаве. Принять объем сплава равным
сумме объемов его составных частей.
2. В куске кварца содержится небольшой
самородок золота. Масса куска 100 г, а его
плотность 8 г/см3. Определите массу
золота, содержащегося в кварце. Принять, что
плотность кварца и золота соответственно равны
2,65 и 19,36 г/см3.
УРОВЕНЬ 3
1. Сплав золота и серебра массой 400 г имеет
плотность 14·103 кг/м3. Полагая объем сплава
равным сумме объемов его составных частей,
определите массу, объем золота и процентное
содержание его в сплаве.
2. В чистой воде растворена кислота. Масса
раствора 240 г, а его плотность 1,2 г/см3.
Определите объем кислоты в растворе и его
процентное содержание, если плотность кислоты 1,8
г/см3. Принять объем раствора равным сумме
объемов его составных частей.
Выходной контроль:
Установите соответствие:
Ответы: 1-Д, 2-Ж, 3-А, 4-Б, 5-В. 6-Г, 7-Е.
Домашнее задание:
Дополнительный материал.
Сплавы различаются по своему предназначению.
Конструкционные сплавы: стали, чугуны,
дюралюминий.
Конструкционные со специальными свойствами
(например, искробезопасность, антифрикционные
свойства): бронзы, латуни.
Для заливки подшипников: баббит.
Для измерительной и электронагревательной
аппаратуры: манганин, нихром.
Для изготовления режущих инструментов:
победит.
Подготовьте сообщение о каком-нибудь сплаве.
Расскажите о веществах, которые в него входят, о
их процентном вхождении в сплав и т.д.
Задачи:
1. Найдите плотность стали (сталь —
деформируемый (ковкий) сплав железа с углеродом),
для изготовления которой взяли 100 г железа и 2 г
углерода (углекислого газа), считая, что объем
сплава равен сумме объемов входящих в него
веществ.
2. Чтобы получить латунь, сплавили куски меди
массой 178 кг и цинка массой 355 кг. Какой плотности
была получена латунь? Объем сплава равен сумме
объемов его составных частей.
3. Сплав золота и серебра массой 500 г имеет
плотность 11 г/см3. Полагая объем сплава равным
сумме объемов его составных частей, определите
массу, объем золота и процентное содержание его в
сплаве.
Ответы: 1. 0,098 г/см3, 2. 8540 кг/м3, 3. 50 г, 2,59
см3, 10%.
Подведение итогов урока. Рефлексия
На полях рабочей тетради изобрази схематически
один из рисунков, который соответствует степени
усвоения материала на уроке. Солнце – мне все
понятно, туча – материал интересный, но надо еще
поработать, луна – я все проспал.
Литература
- Материалы курса «Как научить решать задачи по
физике (основная школа). Подготовка к ГИА: лекции
1-4. – М.: Педагогический университет «Первое
сентября», 2010. -80с. - Сборник задач по физике: Учеб. Пособие для
учащихся 7-8 классов средней школы. – 6-е изд.,
перераб. – М.: Просвещение, 1994. – 191 с.: ил. - Физическая олимпиада в 6-7 классах средней школы:
Пособие для учащихся. – 2-е изд, перераб. И доп. –
М.: Просвещение, 1987. – 192 с: ил.
Содержание:
- Металлы и сплавы
- Общая характеристика металлов
- Химические свойства металлов
- Взаимодействие с неметаллами
- Взаимодействие с водой
- Взаимодействие с растворами солей
- Взаимодействие с кислотами
- Получение металлов
- Способы получения
- Сплавы металлов
- Решение задач на вычисление массы вещества по уравнению реакции, если известна масса другого вещества, содержащего определенную массовую долю примесей
- Свойства металлов и сплавов
- Физические и химические свойства металлов. Электронное строение металлов, изоляторов и полупроводников
- Кристаллическое строение металлов
- Добывание металлов из руд
- Получение металлов высокой чистоты
- Перегонка в вакууме
- Термическое разложение летучих соединений металла. Карбонильный процесс
- Сплавы
- Диаграмма состояния для сплавов, образующих механические смеси индивидуальных компонентов
- Диаграмма состояния для сплавов с неограниченной растворимостью в твердом состоянии
- Диаграмма состояния для сплавов с ограниченной взаимной растворимостью в твердом состоянии
- Диаграмма состояния для сплавов, образующих химические соединения
- Коррозия металлов
Сплав — макроскопически однородный металлический материал, состоящий из смеси двух или большего числа химических элементов с преобладанием металлических компонентов. Сплавы состоят из основы (одного или нескольких металлов), малых добавок специально вводимых в сплав легирующих и модифицирующих элементов, а также из неудалённых примесей (природных, технологических и случайных).
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Металлы и сплавы
Сплавы металлов — твердые соединения двух или более металлов (и неметаллов), полученные целенаправленно в процессе металлургического производства
Общая характеристика металлов
Металлы и их сплавы были известны человечеству с давних пор (рис. 27).
Все химические элементы, как уже известно, подразделяются на металлы и неметаллы. Большинство химических элементов (более 90) относятся к металлам.
Металлами называют вещества» обладающие высокой электро- и теплопроводностью» ковкостью» пластичностью и металлическим блеском.
В Периодической системе химических элементов металлы расположены левее и ниже условной разделительной линии, направленной от бора к астату.
Из таблицы видно, что к металлам принадлежат все элементы побочных подгрупп, включая лантаноиды и актиноиды, элементы главных подгрупп I (за исключением водорода), II и Ш (кроме бора) и некоторые элементы главных подгрупп групп IV—VI (германий, олово, свинец, сурьма, висмут и полоний).
У атомов металлов на внешнем энергетическом уровне обычно находится от одного до трех электронов. Например, один у натрия, два у магния и три у алюминия.
Вступая в химические реакции, атомы металлов отдают свои валентные электроны. Легкость отдачи электронов возрастает с уменьшением числа электронов на внешнем энергетическом уровне и с удалением внешнего энергетического уровня от атомного ядра.
Следовательно, с ростом атомного номера элемента способность отдавать электроны и металличность в периодах уменьшаются, а в подгруппах увеличиваются.
Наиболее типичные металлы расположены в начале периодов (элементы 
В химических соединениях металлы проявляют только положительные степени окисления и обладают восстановительными свойствами.
В отличие от атомов неметаллов, атомы металлов обладают большим радиусом и легко отдают валентные электроны. При этом атомы металлов превращаются в положительно заряженные ионы. Оторвавшиеся от атомов электроны относительно свободно перемещаются между положительно заряженными ионами металлов. Между этими заряженными частицами образуется особый тип химической связи — металлическая (рис. 28). Эта связь обусловливает образование металлической кристаллической решетки простых веществ металлов. В узлах этих кристаллических решеток находятся положительно заряженные ионы металлов, а между ними
передвигаются свободные электроны. Так как электроны находятся в непрерывном движении, то при их столкновении с ионами металлов последние превращаются в нейтральные атомы, а затем вновь в ионы.
Кристаллические решетки, в узлах которых находятся положительно заряженные ионы и некоторое число нейтральных атомов, между которыми передвигаются относительно свободные электроны, называют металлическими.
Связь, которую осуществляют эти относительно свободные электроны между ионами металлов, образующими кристаллическую решетку, называют металлической связью.
Особое строение кристаллических решеток металлов определяют их общие свойства.
Физические свойства. Для всех металлов характерен металлический блеск. Это свойство обусловлено тем, что металлы хорошо отражают от своей поверхности световые лучи.
Электрическая проводимость и теплопроводность. Металлы являются хорошими проводниками электричества и теплоты. Это вызвано наличием электронов, свободно перемещающихся по всему объему кристаллической решетки металла. Помимо того, что электроны могут быть участниками направленного движения (электрического тока), они также могут переносить и тепловую энергию. Электрическая проводимость и теплопроводность металлов увеличиваются от 

Из наиболее доступных металлов хорошей электропроводностью обладают медь и алюминий, благодаря чему их используют в качестве проводников электрического тока.
Ковкость и пластичность. Благодаря особенности металлической связи многие металлы пластичны и обладают хорошей ковкостью. При механическом воздействии на металл происходит смещение слоев атомов, однако в связи с перемещением электронов по всему кристаллу, связь не разрывается. Пластичность уменьшается в ряду:
Золото — самый пластичный металл, его можно прокатывать в листы толщиной не более 0,003 мм, которые используются для позолоты различных предметов.
На основании физических характеристик металлов условно классифицируют:
а) по плотности: легкие 
Самый легкий металл — литий (в 2 раза легче воды), а самый тяжелый осмий
5) по температуре плавления: легкоплавкие
и тугоплавкие 

в) по твердости: мягкие (щелочные металлы, олово, свинец) и твердые (хром и молибден). Щелочные металлы можно резать ножом.
Таким образом, общими физическими свойствами металлов являются: металлический блеск, твердость, ковкость, пластичность, хорошая проводимость теплоты и электричества (рис. 29).
Химические свойства металлов
Общим химическим свойством металлов является сравнительная легкость отдачи валентных электронов с образованием положительно заряженных ионов, т. е. в свободном состоянии металлы являются восстановителями:
Восстановительные свойства металлов проявляются по-разному. Эти свойства зависят от энергии, которая расходуется на разрушение кристаллической решетки, отрыв электронов от атомов, а также от энергии, которая выделяется при гидратации ионов. В связи с этим металлы можно расположить в ряд по убыванию восстановительной способности:
Этот ряд характеризует химическую активность металлов только в окислительно-восстановительных реакциях, протекающих в водной среде.
Взаимодействие с неметаллами
Практически все металлы непосредственно взаимодействуют с кислородом и галогенами. Эти реакции протекают при различных температурах с разными скоростями. Так, щелочные металлы легко окисляются кислородом воздуха, а их взаимодействие с гало генами может протекать со взрывом. Медь и железо вступают в эти реакции при нагревании, а золото и платиновые металлы вообще не окисляются:
Активные металлы способны присоединять водород, образуя гидриды. Эти реакции обычно протекают при нагревании до температуры
Многие металлы могут взаимодействовать с серой с образованием сульфидов:
Некоторые металлы при нагревании взаимодействуют с азотом и фосфором, образуя нитриды и фосфиды:
Взаимодействие с водой
Щелочные, щелочноземельные металлы взаимодействуют с водой с образованием гидроксидов и выделением водорода:
Многие металлы при повышенной температуре взаимодействуют с водой с образованием оксидов металлов и водорода:
Металлы, стоящие в электрохимическом ряду напряжений металлов после водорода, не вытесняют его из воды.
Взаимодействие с растворами солей
Металлы, находящиеся в электрохимическом ряду напряжений металлов левее, восстанавливают металлы, находящиеся в этом ряду правее данного металла:
Для подобных реакций нельзя применять такие металлы, как натрий, калий, кальции, барий.
Взаимодействие с кислотами
Металлы, стоящие в электрохимическом ряду напряжений металлов левее водорода, вытесняют его из разбавленных растворов кислот (за исключением азотной кислоты):
Таким образом, металлы могут вступать в реакции соединения и замещения. Закономерности изменений химических свойств металлов представлены в таблице 16.
Металлами называют вещества, обладающие, высокой электро- и теплопроводностью, ковкостью, пластичностью и металлическим блеском. В Периодической системе химических элементов металлы расположены левее и ниже условной разделительной линии, направленной от бора к астату. Наиболее типичные металлы расположены в начале периодов (элементы 
Получение металлов
Нахождение металлов в природе. Металлы в природе редко встречаются в свободном состоянии, главным образом они находятся в виде химических соединении (рис. 30). В виде самородков, т. е. в свободном состоянии, встречаются такие металлы, как золото и платина. Малоактивные металлы — серебро, медь, ртуть, олово встречаются как в виде самородков, так и в виде соединений. Более активные металлы можно найти только в виде соединений (схема 5).
Различна распространенность металлов в земной коре. Наиболее распространен алюминий, затем железо и далее кальций, натрий, калий, магний и титан. Содержание остальных металлов незначительно.
В недрах казахстанской земли найдены почти все металлы, имеющиеся в Периодической системе химических элементов Д. И. Менделеева. По запасам урана, вольфрама, пинка и бария наша страна занимает одно из первых мест в мире. Крупнейшие месторождения металлов (свинца, хрома, алюминия, золота, серебра,
меди и др.) сосредоточены в основном на востоке, западе и в Центральной части Казахстана. Изучением месторождений полезных ископаемых страны занималась группа ученых под руководством академика К. И. Сатпаева.
Металлы содержатся в живых организмах и участвуют в важнейших жизненных процессах. В организме взрослого человека массовая доля неорганических веществ равна 6%, а эти вещества содержат металлы 
Способы получения
Минералы и горные породы, содержащие металлы или их соединения, пригодные для промышленного получения металлов, называются рудами. Важнейшими рудами металлов являются их оксиды и соли (сульфиды, карбонаты и др.). Если руды содержат соединения двух или нескольких металлов, то они называются полиметаллическими. Например: медно-цинковые, свинцово-серебряные руды и др.
Получение металлов из руд — задача металлургии.
Металлургия — это наука о промышленных способах получения металлов из природного сырья. Металлургией также называют металлургическую промышленность.
Различают черную и цветную металлургию. К черной металлургии относится производство железа и его сплавов, а к цветной — производство всех остальных металлов и их сплавов.
Современная металлургия получает более 75 металлов и многочисленные сплавы на их основе. В зависимости от способов получения металлов различают пирометаллургию, гидрометаллургию, электрометаллургию.
Пирометаллургия занимает ведущее место в металлургии и объединяет группу методом получения металлов с помощью высоко-температурных реакций восстановления. В качестве восстановителей применяют водород, активные металлы, углерод и оксид углерода (II).
Металлы восстанавливают из их соединений водородом (водородотермия). Водородотермия используется для получения не очень активных металлов (медь, вольфрам, молибден):
Восстановление металлов из их соединений другими металлами, химически более активными, называется металлотермией (рис. 31, а). Эти процессы протекают также при высоких температурах. В качестве восстановителя применяют: алюминий, магний, калий, натрий и др. Если восстановителем является алюминий, то процесс называется соответственно алюмотермией, если магний — магний-термией. Методом алюмотермии получают хром, кальций, марганец, а методом кальциетермии — цезий:
Сильными восстановительными свойствами, особенно при высокой температуре, обладают углерод (в виде кокса, сажи) и оксид углерода (II) (карботермия):
Гидрометаллургия охватывает способы получения металлов из водных растворов их солей. При этом металл из руды сначала переводят в раствор, а затем из этого раствора его извлекают (рис. 32).
Так, например, получают медь:
Электрометаллургия — получение металлов с помощью электролиза (электрического тока). Так получают многие металлы, в первую очередь — щелочные, щелочноземельные и алюминий. Электролиз проводят с расплавами галогенидов (рис. 33):
Как видим, в основе всех способов получения металлов из их соединений лежат окислитель но-восстановительные процессы.
Минералы и горные породы, содержащие металлы или их соединения, пригодные для промышленного получения металлов, называются рудами. Важнейшими рудами металлов являются их оксиды и соли (сульфиды, карбонаты и др.). В зависимости от способов получения металлов различают: пирометаллургию, гидрометаллургию, электрометаллургию. В основе всех способов получения металлов из их соединений лежат окислительно-восстановительные процессы.
Сплавы металлов
К характерным свойствам металлов относится взаимодействие их между собой и некоторыми неметаллами с образованием сплавов. Сплавы — это системы, состоящие из двух или более металлов, а также металлов и неметаллов.
Сплавы существенно отличаются от исходных металлов по физическим свойствам; комбинируя их состав, можно получить сплавы с нужными свойствами: легкоплавкие, жаростойкие, кислотостойкие и т. д. Например, высокой твердостью отличается сплав золота и серебра, в то время как сами металлы в индивидуальном состоянии сравнительно мягкие. В технике широко используется легкоплавкий 






Изготовление сплавов основано на способности металлов в расплавленном состоянии взаимно растворяться и смешиваться с последующим затвердеванием при охлаждении.
В некоторых случаях расплавленные металлы реагируют друг с другом, образуя химические соединения, называемые и итерметаллидами.
Приведем данные о составе и применении некоторых важнейших сплавов (табл. 17).
Решение задач на вычисление массы вещества по уравнению реакции, если известна масса другого вещества, содержащего определенную массовую долю примесей
Абсолютно чистых веществ в природе не встречается, каждое вещество, наряду с основным компонентом включает то или иное количество примесей. Примесь (примеси) по сравнению со основным компонентом имеет иной состав, поэтому реагирует по другому или вообще не вступает в химическую реакцию. Образец вещества, содержащий примеси, принято называть техническим (технически чистым). Его массу обозначают 



Сумма массовых долей примесей и основного вещества равна:
Если известна масса технического образца и массовая доля примесей, то массу основного компонента находят по формуле:
Отсюда следует выражение для определения массы технического образца
Задача 1. При разложении 50,0 г технического известняка получили 10 л (н.у.) углекислого газа. Найдите массовую долю (%) примесей в известняке.
Решение. Основным компонентом известняка является карбонат кальция, при техническом разложении которого и получается углекислый газ:
По объему 

Ответ: 10,8%.
Задача 2. Какой объем сернистого газа (н.у.) можно получить при обжиге 240 г технического пирита, в котором массовая доля примесей равна 10%?
Решение. Находим 
Записываем уравнение реакции:
Далее решаем задачу обычным способом, например:
Ответ: 80,64 л.
Задача 3. Какая масса фосфорита, в котором массовая доля примесей равна 15%, потребуется для получения 31 г фосфора?
Решение. Составляем стехиометрическую схему процесса получения фосфора из фосфата кальция, который является основной составной частью фосфорита: 


Мы нашли массу чистого компонента, а массу технического образца находим по формуле:
Получаем: 
и метод логических рассуждений. Поскольку по условию задачи массовая доля 
155 г составляет 85% ;

Отсюда
Ответ: 182 г.
- 1. Известняк массой 11 г обработали избытком соляной кислоты. В результате реакции выделился газ объемом 2,24 л (н.у.). Определите массовую долю карбоната кальция в известняке.
Ответ: 91%.
- 2. Какую массу кремния можно получить при взаимодействии 60 г кремнезема с 20 г кокса, содержащего 90% углерода, если выход продукта равен 90%?
Ответ: 18,9 г.
- 3. Образец массой 15,6 г, состоящий из оксида и карбоната кальция, прокалили. В результате реакции выделился газ объемом 2,24 л (н.у.). Определите массовую долю оксида кальция в образце.
Ответ: 35,9%.
- 4. На растворение смеси цинка и оксида цинка израсходовано 132,8 мл 20%-ного раствора соляной кислоты (р = 1,1г/ мл). Выделившийся после сжигания газ образует 3,6 г воды. Определите массовую долю металла в смеси.
Ответ: 44,5% .
- 5. Углекислый газ, образовавшийся при сжигании 15 г угля, содержащего 20% негорючих примесей, пропущен через 480 г 10%-ного раствора гидроксида натрия. Рассчитайте массы и массовые доли образовавшихся в растворе солей.
Ответ: 67,2 г и 12,82%
- 6. При обработке образца фосфорита массой 50 г избытком концентрированной серной кислоты образовался твердый остаток массой 52,64 г. Рассчитайте, сколько массовых долей (в %) примесей содержится в данном образце фосфорита.
Ответ: 0,8.
- 7. Для растворения образца технического карбоната кальция массой 200 г потребовалась 70% -ная азотная кислота объемом 202,7 мл (плотность 1,421 г/мл). Определите, сколько массовых долей примесей содержалось в образце карбоната.
Ответ: 19,8%
- 8. Массовая доля азота в удобрении составляет 14%. Весь азот входит в удобрение в составе мочевины
Вычислите массовую долю мочевины в этом удобрении.
Ответ: 30% .
- 9. Вычислите массу углерода, необходимого для полного восстановления 50 кг оксида железа
массовая доля примесей в котором 15%.
Ответ: 7,08 кг.
- 10. В образце технического пирита массой 950 кг массовая доля примесей составляет 5,2% . Найдите массу примесей и массу пирита в техническом образце.
Ответ: 900,6 кг 
Свойства металлов и сплавов
В предыдущих главах мы рассмотрели свойства неметаллов и лишь нескольких элементов, относящихся к металлам. Прежде чем рассматривать остальные металлы по группам периодической системы, остановимся на их общих свойствах и методах получения из природных соединений.
Физические и химические свойства металлов. Электронное строение металлов, изоляторов и полупроводников
Металлы обладают рядом общих свойств. К общим физическим свойствам металлов относятся их высокая электрическая проводимость и теплопроводность, пластичность, т. е. способность подвергаться деформации при обычных и при повышенных температурах, не разрушаясь. Пластичность металлов имеет очень большое практическое значение. Благодаря этому свойству металлы поддаются ковке, прокатке, вытягиванию в проволоку (волочению), штамповке. Металлам присущи также металлический блеск, обусловленный их способностью хорошо отражать свет, и непрозрачность.
В табл. 29 приведены значения удельного электрического сопротивления и теплопроводности некоторых металлов. Для сравнения в ней даны сведения для двух неметаллов.
Таблица 29. Удельное электрическое сопротивление 

В химическом отношении все металлы характеризуются сравнительной легкостью отдачи валентных электронов и, как следствие этого, способностью образовывать положительно заряженные ноны и проявлять в своих соединениях только положительную окислен-ность. Многие металлы, например железо, хром, марганец, имеют в различных соединениях разную степень окисленности, но она всегда положительна. В связи с этим металлы в свободном состоянии являются восстановителями. Восстановительная способность разных металлов неодинакова. Для реакций в водных растворах она определяется положением металла в ряду напряжений и концентрацией (активностью) его ионов в растворе.
Причина общности как физических, так и химических свойств металлов лежит в общности строения их атомов и природы кристаллических решеток металлов.
Общей особенностью атомов металлов являются их большие в сравнении с атомами неметаллов размеры (см. § 33). Внешние электроны в атомах металлов находятся на значительном удалении от ядра и связаны с ним сравнительно слабо — атомы металлов характеризуются низкими потенциалами ионизации (см. § 34, табл. 4 и 5) и близким к нулю пли отрицательным сродством к электрону. Именно поэтому металлы легко отдают валентные электроны, выступая в качестве восстановителей, и, как правило, не способны присоединять электроны — проявлять окислительные свойства.
Рассмотрим особенности строения металлов в кристаллическом состоянии. Как отмечалось, металлы обладают высокой электрической проводимостью, причем переносчиками тока в металлах служат электроны. Это говорит о том, что в металлах имеются «свободные» электроны, способ-ные перемещаться по кристаллу под действием даже слабых электрических полей. В то же время неметаллы в кристаллическом состоянии обычно представляют собою изоляторы и, следовательно, не содержат свободных злектронов. Причины этих различии можно объяснить на основе метода молекулярных орбиталей (метод МО).
В § 45 было показано, что при взаимодействии двух одинаковых атомов вместо двух энергетически равноценных исходных атомных орбиталей образуются две молекулярные орбитали, отвечающие различным уровням энергии (рис. 45). Если взаимодействуют три атома, причем их валентные орбитали заметно перекрываются, то возникают не две, а три молекулярные орбитали, в равной степени принадлежащие всем трем атомам (делокализованные орбитали) и характеризующиеся тремя различными значениями энергии. При последовательном увеличении числа взаимодействующих атомов добавление каждого из них приводит к образованию еще одного энергетического уровня и к дальнейшей делокализации молекулярных орбиталей (т. е. к распространению их на большее число атомов); общее число энергетических уровней будет при этом равно числу взаимодействующих атомов. Схема подобного процесса представлена на рис. 135.
Как показывает эта схема, с ростом числа атомов возрастает число разрешенных энергетических состояний, а расстояния между соседними энергетическими уровнями уменьшаются. При небольшом числе взаимодействующих атомов для перевода электрона с какого-либо энергетического уровня на ближайший более высокий уровень необходима затрата сравнительно большой энергии. Но при большом числе атомов N (в макроскопическом кристалле N имеет порядок числа Авогадро) соседние уровни настолько мало различаются, что образуется практически непрерывная энергетическая зона, и переход электрона на ближайший более высокий уровень может осуществиться при затрате ничтожно малой энергии. Если такой ближайший уровень не занят электронами, то находящийся на предшествующем уровне электрон ведет себя как «свободный»; вследствие делокализованности орбиталей он может перемещаться по кристаллу при сколь угодно малых энергетических воздействиях.
Заполнение электронами МО, составляющих энергетическую зону, происходит в порядке последовательного возрастания энергии. При этом, в соответствии с принципом Паули, на каждой МО может размещаться по два электрона.
В кристалле какого-нибудь щелочного металла, например калия, атомные орбитали внутренних электронных слоев практически не перекрываются. Можно считать, что в этом случае непрерывная энергетическая зона создается только за счет орбиталей внешнего электронного слоя и заполняется электронами этого слоя. В кристалле, содержащем N атомов, из исходных атомных s-орбиталей внешнего слоя образуется энергетическая зона, состоящая из N уровней. В этой зоне размещаются N внешних s-электронов атомов щелочного металла, которые занимают N/2 энергетических уровней (по два электрона на каждом уровне). Совокупность этих занятых валентными электронами уровнен называется валентной зоной. В рассматриваемом случае валентная зона занимает лишь половину имеющихся энергетических уровней. Остальные уровни остаются незаполненными, образуя зону проводимости (рис. 136). Здесь в непосредственной близости от верхних занятых уровней имеются свободные уровни, на которые могут переходить электроны под действием электрического поля. Это и создает возможность переноса тока электронами — обеспечивает электрическую проводимость металла.
В кристалле металла главной подгруппы второй группы (например, кальция) из исходных атомных s-орбиталей наружного слоя также образуется зона, состоящая из N уровней. Но, поскольку здесь каждый атом обладает двумя внешними s-электро-нами, то в этой зоне должно разместиться 2N электронов, так что все ее уровни окажутся полностью занятыми. Однако при взаимодействии атомов металла перекрываются не только внешние s-op-битали, но и внешние р-орбитали. В результате также образуется непрерывная энергетическая зона, не заполненная электронами. При этом зоны, образованные s- и р-орбиталями, перекрываются (рис. 137), так что и в этом случае зона проводимости, содержащая свободные энергетические уровни, непосредственно примыкает к валентной зоне. Таким образом, рассматриваемый кристалл также должен обладать высокой электрической проводимостью.
На рис. 136 и 137 изображена резкая граница между валентной зоной и зоной проводимости. В действительности эта граница размыта; вследствие теплового движения электроны могут переходить с верхних уровней валентной зоны на нижние уровни зоны проводимости. Способность этих электронов свободно передвигаться по кристаллу и переносить энергию из одной его части (нагретой) в другую (более холодную) служит причиной высокой теплопроводности металлов. Таким образом, и электрическая проводимость и теплопроводность металлов обусловлены возможностью свободного передвижения электронов зоны проводимости. Именно поэтому для большинства металлов наблюдается параллелизм между этими величинами. Например, лучшие проводники электричества — серебро и медь — обладают и наиболее высокой теплопроводностью (см. табл. 29).
При нагревании колебания атомов металла около их равновесных положений в кристаллической решетке становятся более интенсивными, 470 затрудняет движение электронов. Поэтому с повышением температуры электрическое сопротивление металлов возрастает.
Рассмотренная картина электронного строения твердых металлов показывает, что валентные электроны, осуществляющие химическую связь, принадлежат не двум или нескольким определенным атомам, а всему кристаллу металла. При этом валентные электроны способны свободно перемещаться в объеме кристалла. Образованную подобным образом химическую связь называют металлической связью, а совокупность «свободных» электронов в металле — электронным газом. Металлическая связь характерна для металлов, их сплавов и интерметаллических соединений (см. стр. 534).
Пластичность металлов также объясняется специфическими свойствами металлической связи. При механическом воздействии на твердое тело отдельные слои его кристаллической решетки смещаются относительно друг друга. В кристаллах с атомной структурой это приводит к разрыву ковалентных связей между атомами, принадлежащими различным слоям, и кристалл разрушается. В кристаллах с ионной структурой при взаимном смещении слоев неизбежно создается такое положение, при котором рядом оказываются одноименно заряженные ионы; при этом возникают силы электростатического отталкивания и кристалл также разрушается. В случае же металла при смещении отдельных слоев его кристаллической решетки происходит лишь некоторое перераспределение электронного газа, связывающего друг с другом атомы металла, но разрыва химических связей не происходит — металл деформируется, не разрушаясь.
В отличие от металлов кристаллы простых пеществ, образованных неметаллами, обычно не обладают заметкой электронной проводимостью (см. табл. 29); они представляют собою изоляторы (диэлектрики). Хотя в этом случае тоже возможно образование непрерывных энергетических зон, но здесь зона проводимости отделена от валентной зоны запрещенной зоной, т.е. значительным энегретическим промежутком 
Особыми свойствами, отличающими их как от металлов, так и от изоляторов, обладают полупроводники. При низких температурах их электрическое сопротивление весьма велико и в этих условиях они проявляют свойства изоляторов. Однако при нагревании или при освещении электрическая проводимость полупроводников резко возрастает и может достигать величин, сравнимых с проводимостью металлов.
Зависимость электрических свойств полупроводников от температуры и освещенности объясняется электронным строением их кристаллов. Здесь, как и у изоляторов, валентная зона отделена от зоны проводимости запрещенной зоной (рис. 138, полупроводник). Однако ширина запрещенной зоны 
При переходе электронов в зону проводимости в валентной зоне возникают не полностью занятые электронам» энергетические уровни — электронные вакансии, или «дырки». В электрическом поле такие дырки ведут себя как положительные электрические заряды. Поэтому перенос тока в полупроводниках может осуществляться как электронами зоны проводимости (п-проводимость, от латинского «negative» — отрицательный), так и дырками валентной зоны (р-проводимость, от латинского «positive» — положительный).
Кристаллическое строение металлов
Кристаллическое строение металлов изучается различными методами. Их можно разделить на две группы. К первой принадлежат методы изучения внутреннего строения кристаллов, ко второй — методы изучения их внешних форм.
Внутреннее строение кристаллов изучается глазным образом с помощью рентгеиоструктурного анализа (см. § 50). По его данным для всех металлов установлены типы и параметры кристаллических решеток.
Кристаллические решетки металлов могут быть различных типов. Однако для большинства металлов характерны три типа решеток: объемноцентрированная кубическая (Li, Na, К, V, Cr, Fe, Pb, W и др.), гранецентрированная кубическая (Аl, Са, Fe, Ni, Сu, Ag, Аu п др.), гексагональная (Be, Mg, Cd, Ti, Co, Zn и др.). На рис. 139 показаны элементарные ячейки (см. § 50) решеток этих типов.
Размеры, форму и взаимное расположение кристаллов в металлах изучают металлографическими методами. Наиболее полную оценку структуры металла в этом отношении дает микроскопический анализ его шлифа. Из испытуемого металла вырезают образец и его плоскость шлифуют, полируют и протравливают специальным раствором (травителем). В результате травления выявляется структура образца, которую рассматривают или фотографируют с помощью металлографического микроскопа.
Кристаллы металлов обычно имеют небольшие размеры. Поэтому любое металлическое изделие состоит из большого числа кристаллов. Такая структура называется поликристаллической. При кристаллизации металла из расплавленного состояния растущие кристаллы мешают друг другу принять правильную форму. Поэтому кристаллы поликристаллического тела имеют неправильную форму и в отличие от правильно ограненных кристаллов называются кристаллитами или зернами. Зерна различаются между собой пространственной ориентацией их кристаллических решеток (рис. 140).
При травлении шлифа границы зерен разъедаются сильнее; они становятся углубленными. Свет, падая на них, рассеивается, и в поле зрения микроскопа границы зерен представляются темными, а сами зерна — светлыми (рис. 141).
Специальными способами получают куски металлов, представляющие собой один кристалл — монокристаллы. Монокристаллы металлов, а также неметаллов изготовляют для научных исследований и для специальных отраслей техники (полупроводники, лазеры и др.).
Внутренняя структура зерна металла не является строго правильной. Металлам, как и всем реальным кристаллам (см. § 51), присущи дефекты структуры. При этом многие свойства металлов сильно зависят от характера и от числа имеющихся в металле дефектов. Так, в процессах диффузии важную роль играют вакансии. Эти процессы протекают, например, при насыщении в горячем состоянии поверхностного слоя металлического изделия другими элементами для защиты от коррозии или для придания поверхности изделия твердости. Проникновение атомов постороннего элемента в глубь металла происходит в основном по местам вакансий. С повышением температуры число вакансий возрастает, что служит одной из причин ускорения процесса диффузии.
Некоторые механические свойства металлов зависят от количества дислокаций и от их способности к перемещению по металлу. Так, высокая пластичность металлов объясняется перемещением дислокаций.
Схема пластического сдвига в кристалле металла изображена на рис. 142. Внешняя сила Р первоначально вызывает небольшое смещение атомов вертикальных рядов 1, 2, 3 (рис. 142, а). С увеличением силы Р это смещение возрастает и ряд атомов 1 (выше плоскости скольжения АА) проскакивает нейтральное положение между 1′ и 2′. При этом ряд 2 превращается в лишнюю плоскость и образует дислокацию (рис. 142, б), знакомую нам по рис. 62 (стр. 156). В результате образования дислокации решетка искажается по обе стороны плоскости скольжения. Поэтому далее уже при небольшой силе Р вертикальные ряды атомов над плоскостью скольжения будут смещаться — дислокация подобно эстафете будет последовательно передаваться рядам 3, 4 и далее.
В какой-то момент будет иметь место положение, представленное на рис. 142, в. В итоге же дислокация выйдет на поверхность и исчезнет, как показано на рнс. 142, г.
Таким образом, пластический сдвиг в реальном металле происходит не путем одновременного сдвига всей атомной плоскости, что потребовало бы затраты гораздо большей энергии, а путем перемещения дислокаций вдоль плоскости скольжения.
Металлические кристаллы, лишенные дислокаций, обладают весьма высокой прочностью. Такими кристаллами являются выращиваемые в особых условиях нитевидные кристаллы или «усы». Их прочность во много раз превышает прочность обычных образцов соответствующего металла и близка к теоретической величине, вычисленной для кристаллической решетки металла, не имеющей дефектов структуры.
С другой стороны, появление в металле очень большого числа различно ориентированных дислокаций также приводит к повышению прочности, так как при этом кристаллическая структура металла сильно искажается и перемещение дислокаций затрудняется. В этом состоит объяснение явления наклепа — упрочнения металла под действием пластической деформации. При нагревании сильно деформированного металла искажения его структуры, вызванные сдвигами, постепенно снимаются — металл возвращается в структурно более устойчивое состояние; его пластичность возрастает, а твердость и прочность снижаются.
Добывание металлов из руд
Огромное большинство металлов находится в природе в виде соединений с другими элементами. Только немногие металлы встречаются в свободном состоянии, и тогда они называются самородными. Золото и платина встречаются почти исключительно в самородном виде, а серебро и медь — отчасти; иногда попадаются также самородные ртуть и некоторые другие металлы.
Добывание золота и платины производится или посредством механического отделения их от той породы, в которой они заключены, например промывкой водой, или путем извлечения их из породы различными реагентами с последующим выделением из раствора. Все же остальные металлы добываются химической переработкой их природных соединений.
Минералы и горные породы, содержащие соединения металлов и пригодные для получения этих металлов заводским путем, носят название руд. Главнейшие руды содержат оксиды, сульфиды и карбонаты металлов. Получение металлов из руд составляет задачу металлургии — одной из наиболее древних отраслей химической промышленности. Металлургические процессы, протекающие при высоких температурах, называются пирометаллургическими. Пирометаллургическим путем получают, например, чугун и сталь.
Важнейший способ получения металлов из руд основан на восстановлении их оксидов углем или СО. Если, например, смешать красную медную руду Cu2О с углем и накалить, то уголь, восстанавливая медь, превращается в оксид углерода (II), а медь выделяется в расплавленном состоянии:
Выплавка чугуна производится восстановлением железных руд оксидом углерода.
При переработке сульфидных руд сперва переводят сульфиды в оксиды путем обжига в специальных печах, а затем уже восстанавливают полученные оксиды углем. Например:
Кроме пирометаллургических методов, при добывании металлов применяются гидрометаллургические методы. Они представляют собою извлечение металлов из руд в виде их соединений водными растворами различных реагентов с последующим выделением металла из раствора. Гидрометаллургическим путем получают, например, золото (см. § 202).
Обычно руды представляют собой совокупность минералов. Минералы, содержащие извлекаемый металл, называются рудными минералам и, все остальные — пустой породой. Последняя чаще всего состоит из песка, глины, известняка, которые трудно плавятся. Чтобы облегчить выплавку металла, к руде примешивают специальные вещества — флюсы. Флюсы образуют с веществами пустой породы легкоплавкие соединения — шлаки, которые обычно собираются на поверхности расплавленного металла и удаляются. Если пустая порода состоит из известняка, то в качестве флюса применяется песок. Для руд, содержащих большие количества песка, флюсом служит известняк. В обоих случаях в качестве шлака образуется силикат кальция, поскольку песок состоит в основном из диоксида кремния.
Во многих рудах количество пустой породы столь велико, что непосредственная выплавка металла из таких руд экономически невыгодна. Такие руды предварительно обогащают — отделяют от них часть пустой породы. В остающемся концентрате содержание рудного минерала повышается. Существуют различные способы обогащения руд. Чаще других применяются флотационный, гравитационный и магнитный способы.
Флотационный метод основан на различной смачиваемости поверхности минералов водою. Тонкоизмельченную руду обрабатывают водой, к которой добавлено небольшое количество флотационного реагента, усиливающего различие в смачиваемости частиц рудного минерала и пустой породы. Через образующуюся смесь энергично продувают воздух; при этом его пузырьки прилипают к зернам тех минералов, которые хуже смачиваются. Эти минералы выкосятся вместе с пузырьками воздуха на поверхность и таким образом отделяются от пустой породы.
Гравитационное обогащение основано на различии плотности и вследствие этого скорости падения зерен минералов в жидкости.
Магнитный способ основан на разделении минералов по их магнитным свойствам.
Не все металлы можно получить восстановлением их оксидов углем или 
Воспользовавшись табл. 7 (стр. 194), находим 





Для металлов, не восстанавливаемых ни углем, ни оксидом углерода (II), применяются более сильные восстановители: водород, магний, алюминий, кремний. Восстановление металла из его оксида с помощью другого металла называется металлотермией. Если, в частности, в качестве восстановителя применяется алюминий, то процесс носит название алюминотермии. Такие металлы, как хром, марганец, получают главным образом алюминотермией, а также восстановлением кремнием. Если мы подсчитаем 
то получим отрицательную величину (—523 кДж). Это говорит о том, что восстановление хрома алюминием может протекать самопроизвольно.
Наконец, металлы, оксиды которых наиболее прочны (алюминий, магний и другие), получают электролизом (см. § 103),
Получение металлов высокой чистоты
На протяжении последних десятилетии в связи с развитием новых отраслей техники потребовались металлы, обладающие очень высокой чистотой. Например, для надежном работы ядерного реактора необходимо, чтобы в расщепляющихся материалах такие «опасные» примеси, как бор, кадмий и другие, содержались в количествах, не превышающих миллионных долен процента. Чистый цирконий — один из лучших конструкционных материалов для атомных реакторов — становится совершенно непригодным для этой цели, если в нем содержится даже незначительная примесь гафния. В используемом в качестве полупроводника германии допускается содержание не более одного атома фосфора, мышьяка или сурьмы па десять миллионов атомов металла. В жаропрочных сплавах, широко применяемых, например, в ракетостроении, совершенно недопустима даже ничтожная примесь свинца или серы.
В связи с потребностями промышленности разработаны новые методы очистки веществ. Рассмотрим наиболее важные из них.
Перегонка в вакууме
Этот метод основан на различии летучестей очищаемого металла и имеющихся в нем примесей. Исходный металл загружается в специальный сосуд, соединенный с вакуум-насосом, после чего нижняя часть сосуда нагревается. В ходе перегонки на холодных частях сосуда осаждаются либо примеси* (если они более летучи, чем основной металл), либо очищенный металл (если примеси менее летучи). Процесс ведется при непрерывной откачке воздуха, так как присутствие даже небольших количеств кислорода приводило бы к окислению поверхности расплавленного металла и тем самым к торможению процесса испарения.
* Точнее говоря, в этом случае осаждается основной металл, сильно обогащенный примесями.
Зонная плавка заключается в медленном протягивании бруска очищаемого металла через кольцевую печь. Тот участок (зона) бруска, который находится в данный момент в печи, плавится. По мере продвижения бруска жидкая зона перемещается от начала бруска к его концу.
Зонной плавке подвергают металл, прошедший предварительную очистку. Содержание примесей в нем уже невелико, так что основной металл и примеси образуют гомогенный твердый раствор. При движении бруска через кольцевую печь происходит плавление металла у передней границы зоны и кристаллизация его у задней границы. При этом состав образующихся кристаллов, находящихся в равновесии с расплавом, отличается от состава расплава (см. стр. 530). Примеси одних металлов концентрируются в расплавленной зоне и перемещаются вместе с ней к концу бруска; примеси других металлов концентрируются в образующихся кристаллах, остаются за движущейся зоной и при неоднократном повторении процесса перемещаются к началу бруска. В результате средняя часть бруска получается наиболее чистой; ее вырезают и используют.
Зонную плавку применяют для очистки не только металлов, но и других веществ.
Термическое разложение летучих соединений металла. Карбонильный процесс
Этот метод применяется для получения высокочистых никеля и железа. Подлежащий очистке никель нагревают в атмосфере оксида углерода (II), находящегося под давлением около 20 МПа. При этом никель взаимодействует с 


При очистке железа аналогичным образом осуществляется процесс синтеза и последующего разложения пентакарбонила железа 
Иодидный способ дает возможность получать титан, цирконий и некоторые другие металлы значительной чистоты. Рассмотрим этот процесс на примере титана. Исходный металл в виде порошка нагревается до 100—200 °С с небольшим количеством иода в герметическом аппарате. В аппарате натянуты титановые нити, нагреваемые электрическим током до 1300—1500 °С. Титан (но не примеси) образует с иодом летучий иодид 
Процесс можно представить схемой:
Сплавы
Для изготовления оборудования в различных отраслях современной промышленности используются самые разнообразные материалы, как природные, так и созданные руками человека. Однако основа современной техники — машины и механизмы — изготовляются в основном из металлических материалов — металлов, сплавов металлов друг с другом и с некоторыми неметаллами, прежде всего с углеродом. Это связано с тем, что из всех видов материалов металлические материалы обладают наиболее ценными механическими свойствами. Кроме того, металлические материалы очень многочисленны и разнообразны по своим свойствам.
В жидком состоянии большинство металлов растворяются друг в друге и образуют однородный жидкий сплав. При кристаллизации из расплавленного состояния различные металлы ведут себя по-разному. Основными случаями являются при этом следующие три.
1. В твердом состоянии сплавляемые металлы не растворяются и химически не взаимодействуют друг с другом. При этих условиях сплав представляет собою механическую смесь и состоит из кристаллитов одного и другого компонентов *, отчетливо выявляемых па микрошлкфе (рис. 143).
* По-видимому, нет металлов, абсолютно нерастворимых друг в друге в твердом состоянии. Но в тех случаях, когда взаимная растворимость металлов не превышает сотых долей процента, принято считать, что они нерастворимы друг в друге.
2. Сплавляемые металлы взаимодействуют друг с другом, образуя химическое соединение.
3. При кристаллизации из расплава растворимость металлов друг в друге сохраняется. Образуются однородные кристаллы. В этом случае твердая фаза носит название твердого раствора (рис. 144). При этом для одних металлов их взаимная растворимость в твердом состоянии неограниченна, другие же растворимы друг в друге лишь до определенных концентраций.
195. Диаграммы состояния металлических систем. При изучении свойств сплавов очень большое значение имеют диаграммы состояния, характеризующие состояние сплавов различного состава при разных температурах. Такие диаграммы показывают термодинамически устойчивые состояния, т. е. состояния, отвечающие минимуму энергии Гиббса системы. Их называют также фазовыми диаграммами, так как они показывают, какие фазы могут сосуществовать при данных условиях.
Диаграммы состояния получают экспериментально. Обычно для этого строят кривые охлаждения и по остановкам и перегибам на них, вызванным тепловыми эффектами превращений, определяют температуры этих превращений. Для получения кривых охлаждения приготовляют из двух металлов изучаемой системы ряд смесей различного состава. Каждую из приготовленных смесей расплавляют. Получающиеся жидкие сплавы (расплавы) медленно охлаждают, отмечая через определенные промежутки времени температуру остывающего сплава. По данным наблюдений строят кривые охлаждения, откладывая на оси абсцисс время, а на оси ординат — температуру (рис. 145).
На рис. 145 слева показано, какой вид имеет кривая охлаждения чистого расплавленного металла. Сначала понижение температуры плавно идет по кривой 


Иногда остановки в падении температуры наблюдаются и на кривой охлаждения твердого металла, указывая па связанные с выделением теплоты процессы, происходящие уже в твердом веществе, например переход из одной кристаллической формы в другую.
Несколько иной вид имеет кривая охлаждения сплава двух металлов. Такая кривая изображена на рис. 145 справа. Точка 



Рис. 147. Диаграмма состоянии системы 
Имея достаточный набор сплавов, различающихся содержанием компонентов и определив в каждом сплаве температуры превращений, можно построить диаграмму состояния. На диаграммах состояния по вертикальной оси откладывают температуру, а по горизонтальной — состав сплава (содержание одного из компонентов). Для сплавов, состоящих из двух компонентов, обозначаемых буквами 




Рассмотрим четыре простых случая — четыре типа диаграмм, соответствующие упомянутым выше типам сплавов: механической смеси, твердому раствору с неограниченной и с ограниченной растворимостью и химическому соединению.
Диаграмма состояния для сплавов, образующих механические смеси индивидуальных компонентов
В качестве примера диаграммы этого типа на рис. 147 приведена диаграмма состояния системы 









Рассмотрим подробнее процесс кристаллизации расплава. Пусть это будет расплав, содержащий 40 % 





Если исходить из расплава, содержащего небольшое количество сурьмы (меньше эвтектического), то весь процесс будет происходить аналогично рассмотренному, с тон разницей, что вначале будут выпадать кристаллы не сурьмы, а свинца. Полученный сплав будет иметь структуру, представляющую собой смесь эвтектики с кристаллами свинца. Наконец, если исходить из расплава эвтектического состава, то весь сплав закристаллизуется при 246 °С и будет представлять собой эвтектику. На рис. 148 показана структура сплавов системы 
Если верхние кривые диаграммы на рис. 147 (


При плавлении твердых сплавов горизонталь, проходящая через точку 


Из сказанного ясно, что области I на диаграмме рис. 147 отвечает расплав, областям II и III соответствует сосуществование расплава с кристаллами избыточного компонента, областям IV и V отвечает смесь эвтектики с зернами свинца (область IV) или сурьмы (область V).
Как уже говорилось, по горизонтальной оси диаграмм состояния откладывается состав взятого сплава. Однако для областей, отвечающих равновесию двух фаз, по этой оси можно также устанавливать составы этих фаз. Пусть, например, сплав 5 % 







Диаграмма состояния для сплавов с неограниченной растворимостью в твердом состоянии
На рис. 150 приведена диаграмма состояния системы 


Рассмотрим, как происходит кристаллизация расплавов в этом случае. Пусть исходный жидкий сплав соответствует точке 





Таким образом, области I на диаграмме состояния рассматриваемой системы (рис. 150) отвечает расплав, области II — сосуществование расплава и кристаллов твердого раствора, области III — твердый раствор. При равновесии точки обеих кривых на диаграмме связаны между собой: каждой температуре отвечает расплав определенного состава и кристаллы тоже определенного состава, но другого, чем состав расплава (например, точке 

В ходе процесса кристаллизации температура системы понижается и равновесие между расплавом и кристаллами, образовавшимися ранее, т.е. при более высокой температуре, нарушается. Поэтому кристаллизация сопровождается диффузией, в результате чего при медленном проведении процесса зерна всего сплава получаются однородными и имеют одинаковый состав. При быстром охлаждении процессы диффузии не успевают происходить и сплав получается неоднородным.
Как и в предыдущем случае, но горизонтальной оси диаграммы можно устанавливать составы равновесных фаз, в данном случае — расплава и находящегося в равновесии с ним твердого раствора. Например, система, которой отвечает точка s, состоит из расплава, состав которого отвечает точке е, и кристаллов состава, соответствующего точке р.
Диаграмма состояния для сплавов с ограниченной взаимной растворимостью в твердом состоянии
В сплавах этого типа, образуемых компонентами 






Для того чтобы понять, существованию каких фаз отвечают другие области па диаграмме и кривые па пси, рассмотрим, как протекает в системе данного типа кристаллизация расплавов.
Сначала будем исходить из жидкого сплава, богатого свинцом (точка 








Кривая 






Теперь рассмотрим охлаждение жидкого сплава, не столь богатого свинцом (точка 









В области температур ниже 183,3 °С растворимость свинца в олове и олова в свинце с понижением температуры уменьшается. Поэтому при дальнейшем охлаждении сплава образовавшиеся кристаллы изменяют свой состав. Состав кристаллов твердого раствора олова в свинце изменяется по кривой 

Аналогично протекает кристаллизация расплавов, богатых оловом. В этом случае кристаллизация начинается с выделения кристаллов твердого раствора на основе олова.
На основании сказанного можно заключить, что областям IV и V на диаграмме отвечает сосуществование жидкого расплава и кристаллов твердого раствора на основе свинца (область IV) или на основе олова (область V), а областям VI и VII — смеси кристаллов эвтектики с кристаллами твердого раствора на основе свинца (область VI) или твердого раствора на основе олова (область VII).
Рис. 152. Диаграмма состояния системы 
Диаграмма состояния для сплавов, образующих химические соединения
Металлы образуют друг с другом многочисленные соединения, называемые интерметаллическими. Энтальпии образования подобных соединении обычно невелики; лишь в некоторых случаях (например, при взаимодействии алюминия с расплавленной медью) их образование сопровождается значительным экзотермическим эффектом. Многие металлы образуют по несколько соединении друг с другом, например, 
На рис. 152 приведена диаграмма состояния системы 

От рассмотренных ранее диаграмм эта диаграмма отличается наличием максимума на кривой начала кристаллизации. Этот максимум (точка 









Таким образом, диаграмма системы с химическим соединением как бы составлена из двух диаграмм первого типа. Если компоненты системы образуют между собой два или более химических соединения, то диаграмма как бы составлена из трех, четырех и более отдельных диаграмм первого типа.
Кристаллизация сплавов в этом и в подобных случаях происходит аналогично кристаллизации сплавов, образующих диаграммы первого типа. Отличие состоит в том, что, кроме выделения кристаллов индивидуальных компонентов, происходит еще образование кристаллов соединения. По линии 





При охлаждении жидкого сплава, содержащего 75 % 



Нетрудно понять, что области I на рис. 152 отвечает жидкий сплав, областям II—V—равновесия жидкого сплава и соответствующих кристаллов (в области II — кристаллы 



Мы рассмотрели наиболее простые, но в то же время важнейшие типы диаграмм состояния. Для многих систем диаграммы состояния носят значительно более сложный характер. Так, ряд металлов и сплавов испытывают превращения в твердом состоянии, переходя из одной модификации в другую. На диаграмме состояния появляются при этом кривые, разграничивающие области устойчивости этих модификаций.
Существуют методы построения диаграмм состояния тройных систем — систем, состоящих из трех компонентов.
Для технически важных систем диаграммы состояния изучены и приводятся в специальной литературе. Они имеют широкое применение в различных областях науки и техники, служат научной основой при подборе сплавов, обладающих заданными свойствами, при изыскании методов термической обработки сплавов, при разработке и создании новых сплавов. Примером системы, имеющей очень большое практическое значение, может служить система 
Кроме диаграмм состояния, большое значение имеют диаграммы состав — свойство. На этих диаграммах по оси абсцисс откладывают, как и на диаграммах состояния, состав системы, а по оси ординат — величины, характеризующие различные свойства системы, например, плотность, электрическую проводимость, коррозионную стойкость и др.
В верхней части рис. 153 схематически изображены диаграммы состояния четырех основных типов сплавов, а в нижней его части — отвечающие им типичные диаграммы — «состав — свойство». Видно, что при образовании механической смеси (рис. 153, а) свойства сплавов изменяются линейно и их значения находятся в интервале между значениями этих свойств для индивидуальных компонентов. При образовании твердых растворов (рис. 153, б и в) наблюдается нелинейная зависимость. При этом некоторые свойства могут значительно отличаться от свойств металлов, составляющих сплав. Наконец, при образовании химического соединения на диаграммах «состав — свойство» появляется максимум или минимум, отвечающий соединению (рис. 153,г).
Метод построения диаграмм «состав — свойство» был положен И. С. Курнаковым * в основу разработанного им метода исследования систем — физико-химического анализа. В настоящее время физико-химический анализ служит одним из основных способов изучения сплавов и вообще систем, состоящих из нескольких компонентов: солей, оксидов и других.
* Николай Семенович Курнаков (1860—1941)—русский ученый, академик, лауреат Государственной премии, автор работ по теории растворов и сплавов, химии комплексных соединений, основоположник физико-химического анализа. Н. С. Курнаков уделял много внимания изучению природных соляных растворов; его работы в этой области способствовали эффективному использованию отечественных соляных ресурсов и привели к открытию месторождений калийных солей вблизи Соликамска.
Коррозия металлов
Металлические материалы — металлы и сплавы на основе металлов,— приходя в соприкосновение с окружающей их средой (газообразной или жидкой), подвергаются с той или иной скоростью разрушению. Причина этого разрушения лежит в химическом взаимодействии: металлы вступают в окислительно-восстановительные реакции с веществами, находящимися в окружающей среде, и окисляются.
Самопроизвольное разрушение металлических материалов, происходящее под химическим воздействием окружающей среды, называется коррозией (от латинского «corrodere» — разъедать).
Общая масса металлических материалов, используемых в виде различных изделий в мировом хозяйстве, очень велика. Поэтому, несмотря на то, что обычно скорость коррозии мала, ежегодно из-за коррозии безвозвратно теряются огромные количества металла. По ориентировочным подсчетам мировая потеря металла от коррозии выражается величиной 20 миллионов тонн в год. Но еще больший вред связан не с потерей металла, а с порчей изделий, вызываемой коррозией. Затраты на ремонт или на замену деталей судов, автомобилей, аппаратуры химических производств, приборов во много раз превышают стоимость металла, из которого они изготовлены. Наконец, существенными бывают косвенные потери, вызванные коррозией. К ним можно отнести, например, утечку нефти или газа из подвергшихся коррозии трубопроводов, порчу продуктов питания, потерю здоровья, а иногда и жизни людей в тех случаях, когда это вызвано коррозией. Таким образом, борьба с коррозией представляет собой важную народнохозяйственную проблему. Поэтому на защиту от коррозии тратятся большие средства.
К важнейшим случаям коррозии относятся коррозия в газах (газовая коррозия) и коррозия в растворах электролитов (электрохимическая коррозия). Коррозия в газах происходит при повышенных температурах, когда конденсация влаги на поверхности металла невозможна. Газовой коррозии подвергаются арматура печей, детали двигателей внутреннего сгорания, лопатки газовых турбин и т. п. Газовую коррозию претерпевает также металл, подвергаемый термической обработке. В результате газовой коррозии на поверхности металла образуются соответствующие соединения: оксиды, сульфиды и др.
Для изготовления аппаратуры, подвергающейся действию коррозионноактивных газов, применяют жаростойкие сплавы. Для придания жаростойкости стали и чугуну в их состав вводят хром, кремний, алюминий; применяются также сплавы на основе никеля или кобальта. Защита от газовой коррозии осуществляется, кроме того, насыщением в горячем состоянии поверхности изделия некоторыми металлами, обладающими защитным действием. К таким металлам принадлежат алюминий и хром. Защитное действие этих металлов обусловлено образованием на их поверхности весьма тонкой, но прочной оксидной пленки, препятствующей взаимодействию металла с окружающей средой. В случае алюминия этот метод носит название алитирования, в случае хрома — термохромирования.
К электрохимической коррозии относятся все случаи коррозии в водных растворах. Электрохимической коррозии подвергаются, например, подводные части судов, паровые котлы, проложенные в земле трубопроводы. Коррозия металла, находящегося во влажной атмосфере, также представляет собой электрохимическую коррозию. В результате электрохимической коррозии окисление металла может приводить как к образованию нерастворимых продуктов (например, ржавчины), так и к переходу металла в раствор в виде ионов.
В воде обычно содержится растворенный кислород, способный к восстановлению:
Кроме того, в воде присутствуют ноны водорода, также способные к восстановлению:
Растворенный кислород и ионы водорода — важнейшие окислители, вызывающие электрохимическую коррозию металлов.
Рассмотрим, какие металлы могут быть окислены растворенным в воде кислородом, и какие — ионами водорода. Потенциал, отвечающий электродному процессу
равен (см. табл. 18 на стр. 277):
В нейтральных средах (
Следовательно, растворенный в воде или в нейтральном водном растворе кислород может окислить те металлы, потенциал которых меньше, чем 0,8 В; они расположены в ряду напряжений от его начала до серебра.
Потенциал, отвечающий электродному процессу
в нейтральной среде, равен приблизительно —0,41 В (см. стр. 282). Следовательно, ионы водорода, находящиеся в воде и в нейтральных водных средах, могут окислить только те металлы, потенциал которых меньше, чем —0,41 В, — это металлы от начала ряда напряжений до кадмия. При этом кадмий и металлы, близкие к нему в ряду напряжений, имеют на своей поверхности защитную оксидною пленку, препятствующую взаимодействию этих металлов с водой. Поэтому число металлов, которые могут быть окислены ионами водорода в нейтральных средах, еще меньше.
Таким образом, вода, содержащая растворенный кислород, значительно опаснее в коррозионном отношении, чем вода, не содержащая его и способная окислять металлы только ионами водорода.
При использовании металлических материалов очень важным является вопрос о скорости их коррозии. Кроме природы металла и окислителя и содержания последнего, на скорость коррозии могут влиять различные примеси, содержащиеся как в самом металле, так и в коррозионной среде — в атмосфере или в растворе.
При коррозии металла, содержащего включения другого металла, могут наблюдаться, в зависимости от размеров включений, два различных случая.
Включения инородного металла очень малы. Такие включения практически не изменяют величину потенциала основного металла в данном растворе. В этом случае ускорение коррозии может наблюдаться, если перенапряжение окислительной полуреакшш на металле включения меньше, чем на основном металле.
В качестве примера можно указать на коррозию цинка, содержащего небольшие примеси железа или меди, в соляной или в разбавленной серной кислотах. При содержании в цинке сотых долей процента какого-либо из этих металлов скорость взаимодействия его с указанными кислотами в сотни раз выше, чем в случае цинка, подвергшегося специальной очистке. Это объясняется тем, что перенапряжение выделения водорода на меди и на железе ниже, чем на цинке, а лимитирующей стадией (см. § 61) реакции
является именно процесс восстановления ионов водорода.
Включения инородного металла не столь малы. Потенциал таких включении отличен от потенциала основного металла. В этом случае, помимо величины перенапряжения окислительной полуреакции на металле включения, на скорость коррозии может повлиять поляризующее действие (см. § 104) металла включения на основной металл. Если металл включения имеет больший потенциал, чем основной металл, то последний поляризуется анодно и скорость его коррозии возрастает. Например, алюминий, содержащий включения железа или меди, корродирует значительно быстрее, чем алюминий высокой чистоты.
Скорость коррозии металла повышается также при включении в него неметаллических примесей, потенциал которых выше потенциала основного металла. Так, включения оксидов или шлаков в стали сильно снижают ее коррозионную стойкость.
Примеси, находящиеся в окружающей среде, могут адсорбироваться на поверхности металла и также каталитически влиять на коррозию, ускоряя или замедляя ее. Например, большинство сплавов железа корродирует в морской воде гораздо быстрее, чем в воде с такой же концентрацией кислорода, не содержащей хлоридов. Это обусловлено тем, что хлорид-ионы, адсорбируясь на поверхности железа, препятствуют образованию на ней защитных слоев.
Как уже говорилось (см. § 100), некоторые металлы в определенных условиях переходят в пассивное состояние — на их поверхности образуются слои или пленки, состоящие из адсорбированного кислорода, из оксида данного металла, или из его соли. Присутствие таких слоев и их структура сильно влияют на скорость коррозии металла; в ряде случаев эти слои обладают защитным действием, вследствие чего металл корродирует лишь ничтожно медленно. В условиях атмосферного воздуха пассивирующие пленки образуются на хроме, никеле, алюминии, цинке.
К важным случаям электрохимической коррозии относятся коррозия в природных водах, в растворах, атмосферная коррозия, коррозия в грунте, коррозия при неравномерной аэрации, контактная коррозия.
Атмосферная коррозия — коррозия во влажном воздухе при обычных температурах. Поверхность металла, находящегося во влажном воздухе, бывает покрыта пленкой воды, содержащей различные газы, и в первую очередь — кислород. Скорость атмосферной коррозии зависит от условий. В частности, на нее влияет влажность воздуха и содержание в нем газов, образующих с водою кислоты 
Коррозия в грунте* приводит к разрушению проложенных под землей трубопроводов, оболочек кабелей, деталей строительных сооружений. Металл в этих условиях соприкасается с влагой грунта, содержащей растворенный воздух. В зависимости от состава грунтовых вод, а также от структуры и минералогического состава грунта, скорость этого вида коррозии может быть весьма различной.
* Этот вид коррозии часто неточно называют почвенной коррозией.
Коррозия при неравномерной аэрации** — наблюдается в тех случаях, когда деталь или конструкция находится в растворе, но доступ растворенного кислорода к различным ее частям неодинаков. При этом те части металла, доступ кислорода к которым минимален, корродируют значительно сильнее тех частей, доступ кислорода к которым больше. Такое неравномерное распределение коррозии объясняется следующим образом. При восстановлении кислорода
расходуются ионы водорода и раствор, следовательно, несколько подщелачивается. Металлы, и в частности железо, при подщелачивании раствора легче переходят в пассивное состояние. Поэтому аэрируемые участки металла переходят в пассивное состояние и скорость коррозии на них снижается. На неаэрируемых участках не происходит пассивирования — здесь протекает процесс окисления металла, приводящий к переходу его ионов в раствор:
** Аэрация — омывание воздухом, кислородом.
Таким образом, при неравномерной аэрации металла осуществляется пространственное разделение окислительно-восстановительной реакции: восстановление кислорода протекает на более аэрируемых участках, а окисление металла — на менее аэрируемых участках поверхности. Локализация процесса окисления приводит к местной коррозии — интенсивному разрушению металла на отдельных участках. Местная коррозия приводит к появлению на поверхности металла углублений («язв»), которые со временем могут превращаться в сквозные отверстия. Иногда развитие язв трудно обнаружить, например, из-за остатков окалины на поверхности металла. Этот вид коррозии особенно опасен для обшивки судов, для промышленной химической аппаратуры и в ряде других случаев.
Контактная коррозия может протекать, когда два металла с различными потенциалами соприкасаются друг с другом либо в водной среде, либо при наличии влаги, конденсирующейся из воздуха. Так же, как и в рассмотренном выше случае значительных включений, металлы оказывают друг на друга поляризующее действие; металл с меньшим потенциалом поляризуется акод-но, и скорость его коррозии вблизи места контакта резко возрастает.
Контактная коррозия наблюдается, например, в теплофикационных установках, когда медные нагревательные змеевики соединены с железными кипятильниками или трубами. Интенсивная коррозия железа протекает около мест соединения. Однако соотношение между потенциалами контактирующих металлов зависит не только от природы металлов, но также от природы растворенных в воде веществ, от температуры и от других условий и не всегда соответствует взаимному положению металлов в ряду напряжений. Так, в случае контакта железо — цинк последний интенсивно корродирует при комнатной температуре, но в горячей воде полярность металлов изменяется и растворяться начинает железо.
Для предупреждения коррозии и защиты от нее применяются разнообразные методы. К важнейшим из них относятся следующие:
1) применение химически стойких сплавов;
2) защита поверхности металла покрытиями;
3) обработка коррозионной среды;
4) электрохимические методы.
Из химически стойких сплавов наиболее широкое применение имеют нержавеющие стали, в состав которых входит до 18 % хрома и до 10 % никеля.
Покрытия, применяемые для защиты металлов, подразделяются на металлические, неметаллические и образованные в результате химической или электрохимической обработки поверхности металла.
В качестве металлов для покрытия обычно применяют металлы, образующие на своей поверхности защитные пленки. Как уже говорилось, к таким металлам относятся хром, никель, цинк, кадмий, алюминий, олово и некоторые другие. Значительно реже применяются металлы, имеющие высокий электродный потенциал— серебро, золото. Существуют различные способы нанесения металлических покрытий; наибольшие преимущества имеют методы гальванотехники (см. § 103).
К неметаллическим относятся покрытия лаками, красками, эмалями, фенолоформальдегидными и другими смолами. Для длительной защиты от атмосферной коррозии металлических сооружений, деталей, машин, приборов чаще всего применяются лакокрасочные покрытия.
Покрытия, создаваемые химической или электрохимической обработкой металла, представляют собой в основном защитные оксидные или солевые пленки. Примерами могут служить оксидирование алюминия (создание на его поверхности стойких оксидных пленок), фосфатнрование стальных изделий (создание защитных пленок, состоящих из фосфатов).
Метод обработки внешней среды пригоден для случаев, когда защищаемое изделие эксплуатируется в ограниченном объеме жидкости. Метод состоит в удалении из раствора, в котором эксплуатируется защищаемая деталь, растворенного кислорода (деаэрация) или в добавлении к этому раствору веществ, замедляющих коррозию, — ингибиторов. В зависимости от природы металла и раствора применяются различные ингибиторы: нитрит натрия, хромат и дихромат калия, фосфаты натрия, некоторые высокомолекулярные органические соединения и другие. Защитное действие этих веществ обусловлено тем, что их молекулы или ноны адсорбируются на поверхности металла н каталитически снижают скорость коррозии, а некоторые из них (например, хроматы и дихроматы) переводят металл в пассивное состояние.
К электрохимическим методам защиты металлов относятся катодная защита и метод протекторов. При катодной защите защищаемая конструкция или деталь присоединяется к отрицательному полюсу источника электрической энергии и становится катодом. В качестве анодов используются куски железа. При надлежащей силе тока в цепи на защищаемом изделии происходит восстановление окислителя, процесс же окисления претерпевает вещество анода.
Метод протекторов осуществляется присоединением к защищаемому металлу большого листа, изготовленного из другого, более активного металла — протектора. В качестве протектора при защите стальных изделий обычно применяют цинк или сплавы на основе магния. При хорошем контакте между металлами защищаемый металл (железо) и металл протектора (например, цинк) оказывают друг на друга поляризующее действие. Согласно взаимному положению этих металлов в ряду напряжений, железо поляризуется катодно, а цинк — анодно. В результате этого на железе идет процесс восстановления того окислителя, который присутствует в воде (обычно растворенный кислород), а цинк окисляется.
И протекторы, и катодная защита применимы в средах, хорошо проводящих электрический ток, например в морской воде. В частности, протекторы широко применяются для защиты подводных частей морских судов. Ясно, что убытки, вызванные коррозией корпуса морского судна и связанные с его простоем и ремонтом, очень велики и во много раз превышают стоимость протекторов.
Услуги по химии:
- Заказать химию
- Заказать контрольную работу по химии
- Помощь по химии
Лекции по химии:
- Основные понятия и законы химии
- Атомно-молекулярное учение
- Периодический закон Д. И. Менделеева
- Химическая связь
- Скорость химических реакций
- Растворы
- Окислительно-восстановительные реакции
- Дисперсные системы
- Атомно-молекулярная теория
- Строение атома в химии
- Простые вещества
- Химические соединения
- Электролитическая диссоциация
- Химия и электрический ток
- Чистые вещества и смеси
- Изменения состояния вещества
- Атомы. Молекулы. Вещества
- Воздух
- Химические реакции
- Закономерности химических реакций
- Периодическая таблица химических элементов
- Относительная атомная масса химических элементов
- Химические формулы
- Движение электронов в атомах
- Формулы веществ и уравнения химических реакций
- Химическая активность металлов
- Количество вещества
- Стехиометрические расчёты
- Энергия в химических реакциях
- Вода
- Необратимые реакции
- Кинетика
- Химическое равновесие
- Разработка новых веществ и материалов
- Зеленая химия
- Термохимия
- Правило фаз Гиббса
- Диаграммы растворимости
- Законы Рауля
- Растворы электролитов
- Гидролиз солей и нейтрализация
- Растворимость электролитов
- Электрохимические процессы
- Электрохимия
- Кинетика химических реакций
- Катализ
- Строение вещества в химии
- Строение твердого тела и жидкости
- Протекание химических реакций
- Комплексные соединения
Лекции по неорганической химии:
- Важнейшие классы неорганических соединений
- Водород и галогены
- Подгруппа кислорода
- Подгруппа азота
- Подгруппа углерода
- Общие свойства металлов
- Металлы главных подгрупп
- Металлы побочных подгрупп
- Свойства элементов первых трёх периодов периодической системы
- Классификация неорганических веществ
- Углерод
- Качественный анализ неорганических соединений
- Металлы и неметаллы
- Производство металлов
- Переходные металлы
- Элементы 1 (1А), 2 IIA и 13 IIIA групп и соединения
- Элементы 17(VIIA), 16(VIA) 15(VA), 14(IVA) групп и их соединения
- Важнейшие S -элементы и их соединения
- Важнейшие d элементы и их соединения
- Важнейшие р-элементы и их соединения
- Производство неорганических соединений и сплавов
- Главная подгруппа шестой группы
- Главная подгруппа пятой группы
- Главная подгруппа четвертой группы
- Первая группа периодической системы
- Вторая группа периодической системы
- Третья группа периодической системы
- Побочные подгруппы четвертой, пятой, шестой и седьмой групп
- Восьмая группа периодической системы
- Водород
- Кислород
- Озон
- Водород
- Галогены
- Естественные семейства химических элементов и их свойства
- Химические элементы и соединения в организме человека
- Геологические химические соединения
Лекции по органической химии:
- Органическая химия
- Углеводороды
- Кислородсодержащие органические соединения
- Азотсодержащие органические соединения
- Теория А. М. Бутлерова
- Соединения ароматического ряда
- Циклические соединения
- Карбонильные соединения
- Амины и аминокислоты
- Химия живого вещества
- Синтетические полимеры
- Органический синтез
- Элементы 14(IVA) группы
- Азот и сера
- Растворы кислот и оснований
Решение
задач на нахождение плотности смесей и сплавов,
средней
плотности неоднородных тел (7 класс)
Ларионов Вадим Сергеевич,
учитель физики МБОУ Лицея №
15 г.Сарова, larionvadim@yandex.ru
Ларионова Наталья Валентиновна,
к.п.н., учитель физики МБОУ Лицея № 15
г.Сарова, nvlarionova@yandex.ru
В статье сформулированы методические рекомендации по
организации факультативного занятия по решению задач на нахождение плотности
смесей, сплавов и неоднородных тел. Представлены учебные материалы по теме,
структурированные по уровню сложности.
Задачи на
нахождение плотности смеси или сплава, средней плотности неоднородного
(«составного») тела являются базовыми при изучении темы «Плотность» и
достаточно часто встречаются в олимпиадах по физике в 7-8-х классах. Именно
поэтому целесообразно данному типу задач посвятить отдельное факультативное занятие,
структура которого соответствует принципу «от простого к сложному» и содержит последовательные
блоки задач: ключевые, олимпиадные и задачи для самостоятельного решения (см.
приложение).
Средняя плотность
неоднородного («составного») тела, плотность смеси или сплава рассчитывается по
формуле
где m1, m2, m3… -массы отдельных частей тела
(компонентов смеси или сплава), а V1, V2, V3 … — их объёмы.
Для решения задач
по данной теме, необходимо составить систему уравнений, в основе которой лежат
следующие положения:
1. Определительная формула
плотности
2. Свойство аддитивности массы
(масса смеси или сплава равна сумме масс его составных частей)
m=m1+ m2+ m3+…
3. Как правило, в таких задачах
полагают, что объём сплава (смеси) равен сумме объёмов его составных частей
V=V1+V2+V3 …
В задачах, предложенных ниже,
исключением является задача № 6 из блока олимпиадных задач (задача о смешивании
спирта и воды).
Ключевые задачи,
представленные в занятии, в зависимости от подготовки учащихся могут быть
решены непосредственно на уроке при изучении темы «Плотность». В этом случае на
факультативном занятии рассматриваются олимпиадные задачи. Далее ученикам
предлагаются задачи для самостоятельного решения, которые, как правило,
составляют домашнее задание. В этом случае удобно дифференцировать домашнее
задание учеников, предложив не более трёх обязательных задач в зависимости от
уровня подготовленности учеников. Учитель может дополнить списки олимпиадных
задач и задач для самостоятельного решения, используя материалы последних
олимпиад.
Приложение
Плотность смесей, сплавов, «составных» тел
Цель: Научиться решать задачи
на нахождение плотности смесей и сплавов, а также средней плотности
неоднородных тел («составных») тел.
Ключевые задачи
1. Какова плотность сплава из
300г олова и 100г свинца? (8г/см3)
2.
Сплав
изготовлен из меди объёмом 0,4 м3 и цинка массой 710 кг. Какова
плотность сплава? (8540 кг/м3)
3. Для приготовления вишнёвого
сиропа в кастрюлю вылили 1 л вишнёвого варенья и 2 л воды и хорошо перемешали.
Какова плотность сиропа, если плотность варенья 1300 кг/м3? (1100
кг/м3)
4. Какова плотность смеси из
глицерина и спирта, если объём спирта составляет половину объёма смеси? Как
изменится ответ, если масса спирта составляет половину массы смеси? (1030 кг/м3, 980 кг/м3)
Олимпиадные задачи
1. Масса первого изделия в 2
раза больше массы второго изделия, а их объёмы находятся в отношении V1:V2=1:3. Плотность первого изделия ρ1=4г/см3.
Какова будет средняя плотность «составного» тела, если два изделия склеить?
Массой и объёмом клея пренебречь. (1,5 г/см3)
2. Изделие, склеенное из трёх
различных частей, имеет объём V=600см3.
Объёмы частей находятся в соотношении V1:V2:V3=2:3:5, а их плотности – в соотношении ρ1:ρ2:ρ3=4:3:1.
Чему равна масса изделия, если плотность первой части ρ1=2000кг/м3?
(660 г)
3. Ученик измерил плотность
деревянного бруска, покрытого краской, и она оказалась равной ρ=600 кг/м3. Но на
самом деле брусок состоит из двух частей, равных по массе, плотность одной из
которых в два раза больше плотности другой. Найдите плотности обеих частей
бруска. Массой краски можно пренебречь. (450 кг/м3, 900 кг/м3)
4. В дистиллированную воду
аккуратно вливают серную кислоту. Получившийся раствор имеет плотность ρр=1200
кг/м3 и массу m=120г. Объём раствора равен
сумме объёмов воды и кислоты. Плотность воды ρв=1000 кг/м3,
плотность кислоты ρк=1800 кг/м3. Какова масса кислоты,
влитой в воду? (45 г)
5. 
a и плотностью ρ поместили внутрь куска глины с плотностью 4ρ, которому придали
форму куба со стороной 2a. Получившийся куб облепили пластилином плотностью 2ρ,
в результате чего получился куб со стороной 3a (см. рисунок). Определите
среднюю плотность получившейся системы. (67ρ/27≈2,5ρ)
6. Плотностью вещества называют
отношение массы тела из этого вещества к его объёму. Например, масса 1 см3
воды составляет 1 г, поэтому плотность воды 1 г/см3. Представим, что
смешали 100 литров воды и 100 литров спирта плотностью 0,8 г/см3, и
при смешении оказалось, что суммарный объём уменьшился на 5 процентов. Какова
плотность полученного раствора? (ρ=18/19 г/cм3≈0,95г/cм3)
Задачи
для самостоятельного решения
1. Какую плотность имеет сплав
из 270г алюминия и 445г меди? (≈4,77
г/cм3)
2. Сплав золота и серебра массой
400 г имеет плотность 1,4·104 кг/м3. Полагая объём сплава
равным сумме объёмов его составных частей, определите массу золота в сплаве? (220
г)
3. Масса первого изделия в 3
раза меньше массы второго изделия, а их объёмы находятся в соотношении V1:V2=2:1. Плотность первого тела ρ1=1,8 г/см3.
Какова будет средняя плотность «составного» тела, если два изделия склеить? Массой
и объёмом клея пренебречь. (4,8 г/см3)
4. Изделие, склеенное из трёх
различных частей, имеет объём V=900см3.
Объёмы частей находятся в соотношении V1:V2:V3=5:3:1, а их плотности – в соотношении ρ1:ρ2:ρ3=1:2:5.
Чему равна масса изделия, если плотность первой части ρ1=500кг/м3?
(800 г)
5. Кубик с ребром a=20см сделан из материала с
плотностью ρ=3000кг/м3. Однако внутри кубика имеется воздушная
полость, поэтому его средняя плотность ρср=1200кг/м3.
Определите объём этой воздушной полости. Во сколько раз изменится средняя
плотность кубика, если полость целиком заполнить водой? Массой воздуха внутри
полости можно пренебречь. (4800 см3, 1,5)
Литература к занятию
1. Генденштейн Л.Э., Кирик Л.А.,
Гельгафт И.М. Задачи по физике с примерами решений. 7-9 классы. Под ред. В.А.Орлова.
– М.: Илекса, 2009. – 416 с.
2. Бажанский И.И., Гой В.А.,
Чубов Ю.Б. Приморские олимпиады школьников по физике (2003-2007 гг). Учебное
пособие. – Владивосток: Изд-во Дальневост. ун-та, 2008. – 200с.
3. Олимпиады 2008-2009. Физика.
Задачи Московских олимпиад школьников. Под ред. М.В.Семёнова, А.А.Якуты. – М.:
МЦНМО, 2009. – 70 с.
4. 400 физических этюдов.
Избранные задачи физических олимпиад Санкт-Петербурга. – СПб, 2006. –284 с.
5.
Борисов
С.Н. Учебное пособие по физике для учащихся 7-го класса. – М.: МИФИ, 2009. –
100 с.
В
литейном производстве составы сплавов
принято выражать в процентах по массе
(% масс.). Это наиболее удобный для практики
способ, поскольку масса легко определяется
простым взвешиванием. В научных
исследованиях важным является содержание
компонентов сплава в молярных процентах
(% мол.). Можно принять, что в сплавах,
находящихся как в твердом, так и в жидком
состояниях, структурными единицами
являются отдельные атомы. В этом случае
число молей каждого компонента (ni)
в 100 г сплава оказывается равным частному
от деления (% масс.), данного компонента
на его молярную массу (атомный вес).
Общее число молей равно сумме этих
величин ni.
Содержание любого компонента в молярных
процентах равно:
%
мол. = (ni/
n)
100.
В
последнее время составы сплавов,
получаемых в аморфном состоянии,
принято выражать в виде формул АxВyСz,
где х, у, z показывают содержание в
молярных процентах, поэтому х + у + z =
100.
Давление
пара сплавов выражается законом Рауля,
при этом коэффициент активности
принят равным 1.
Теплофизические
свойства металлов определяют затраты
энергии на плавку. Теплоемкость металлов
при расчетах считается не зависящей
от температуры. Общая масса сплава m.
В состав сплава входят компоненты А,
В, С
с массой соответственно mA,
mB,
mC
и примеси Х,
У, Z
массой mX,
mY,
mZ.
Таким образом m
= mA,B,C
+
mX,
mY,
mZ.
Состав сплава в массовых процентах
компонентов и примесей:
%
маcс. (А,
В,
С)
= (mА,В,С/m)
100;
%
масс. (Х,
Y,
Z)
= (mX,Y,Z/m)
100;
%
масс. (А,
В,
С)
+ %
масc. (Х,
Y,
Z)
= 100 %.
Ввиду
малости величины %
масс. (Х,
Y,
Z)
ею обычно пренебрегают.
Состав
сплава в молярных процентах (без учета
примесей): % мол. (А,В,С)
= [(mА,В,С/МА,В,С)/(mА,В,С/МА,В,С)]
100, где МА,В,С
—
мольные массы компонентов А, В ,С. Если
в вышеприведенных выражениях отбросить
множитель 100, получаем выражение состава
сплава в молярных долях компонентов А,
В, С.
Состав
сплава, состоящего из компонентов А,
В, С
(без учета содержания примесей, можно
выразить формулой, где индексами у букв
А,
В, С
являются цифры, отражающие содержание
данного компонента в мольных процентах.
Например, марке сплава Бр010Ц2 соответствует
формула Cu88Sn10Zn2.
Масса
1 моль сплава: Мспл
=
[МA,B,C
(% мол. А,
В, С)]/100.
При таком расчете принимается, что
структурными единицами в сплаве
являются атомы компонентов. Единицы
ppm (parts per million) используют для выражения
содержания малых количеств примесей в
сплавах.
1
ррm = 1 часть на 1 миллион частей.
Поскольку
1 % = 1 часть на 100 частей, получаем, что 1
% + 104
или 1 ррm = 1
104
%.
Единицы
cм3/100
г используют для выражения содержания
газа в металлах и сплавах. В этом случае
считают, что весь газ, обнаруженный в
металле анализами, независимо от формы
его присутствия (раствор, соединения)
выделен в свободном виде (Н2,
N2,
О2
и т.п.) и находится в нормальных условиях
(Т
= 293 К, р
= 101000 Па). Например, установлено, что в
металле содержится 3
10-4
масс. водорода и 0,01 % масс. азота.
Следовательно, в 100 г сплава имеется 3
10-4
г водорода и 0,01 г азота. С учетом молярных
масс этих газов (из прил. 4 Мh2
=
2 г/моль, Мn2
=
28 г/моль) получаем, что число молей
каждого газа равно соответственно:
n
=3
10-4/2
= 1,5
10-4
моль;
n
=
0,01/28 = 36
10-5
моль.
Поскольку
при нормальных условиях 1 моль газа
занимает объем 22400 см3,
получаем следующие количества
водорода и азота:
Водород
– 22400
1,5
10-4
= 3,36 см3/100г;
Азот
– 22400
36
10-5
=
8 см3/100г.
В
технических расчетах можно принять,
что при сплавлении металлов не происходит
изменение объема. На этом основании
удельный объем сплава (Vспл)
является аддитивной величиной,
определяемой удельными объемами
компонентов (VA,
VВ,
VС)
и их содержанием в сплаве, выраженным
в % масс. (XА,
XВ,
XС).
Удельный объем сплава вычисляется по
формуле:
Vспл
=
( ХА
VА
+
XВ
VВ
+
XС
VС)/100.
Плотность
— величина, обратная удельному объему:
= 1/V.
Плотность сплава спл
может быть выражена через плотности
компонентов А,
В,
С
и их содержание в массовых процентах
XA,
XB,
XC
по формуле:
спл
= 100 /( XА/А
+XВ/В
+XС/С).
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Расчет состава нового сплава
Начну с легенды. «Старые мастера делали серебряный припой так: брали серебряный полтинник и медный пятак…» А вот интересно, что за сплав получится, если сплавить полтинник и пятак?
Другой случай. Ты по ошибке сплавил в один кусок два изделия разной пробы. Что делать? Опять это страшное слово «аффинаж»? Конечно, нет. Нужно просто вычислить состав полученного «неправильного» сплава и использовать его дальше: или для его исправления, или в качестве добавки к другим сплавам.
В общем, бывают случаи, когда нужно узнать состав сплава, полученного при смешивании нескольких других. Для этого, конечно, необходимо знать состав и количество (массу) исходных сплавов.
Для простоты рассмотрим случай, когда исходных сплавов только два (как чаще всего и бывает).
Дано:




Найти:

Решение:
Алгоритм простой: вычисляем массу каждого компонента и делим на общую массу.
Суммарная масса компонента: 
Суммарная масса сплава: 
Состав результирующего сплава: 
Пример расчета
Теперь проверим, что получится, если сплавить полтинник и пятак. Возьмем 10 г серебра 900 пробы (полтинник) и 16 г меди (пятак), подставим в формулу (1) и получим:
доля серебра — (0,9*10 + 0*16) / (10 + 16) = 0,346;
доля меди — (0,1*10 + 1*16) / (10 + 16) = 0,654.
То есть, это серебро 346 пробы, которое никак ювелирным сплавом считаться не может. Не всем легендам стоит доверять.
Кстати
Программа Alloy теперь умеет решать и эту задачу. Число исходных сплавов — до четырех.
Здесь находится описание программы, а здесь можно ее заказать.





















































 Вычислите массовую долю мочевины в этом удобрении.
Вычислите массовую долю мочевины в этом удобрении.  массовая доля примесей в котором 15%.
массовая доля примесей в котором 15%. 



































