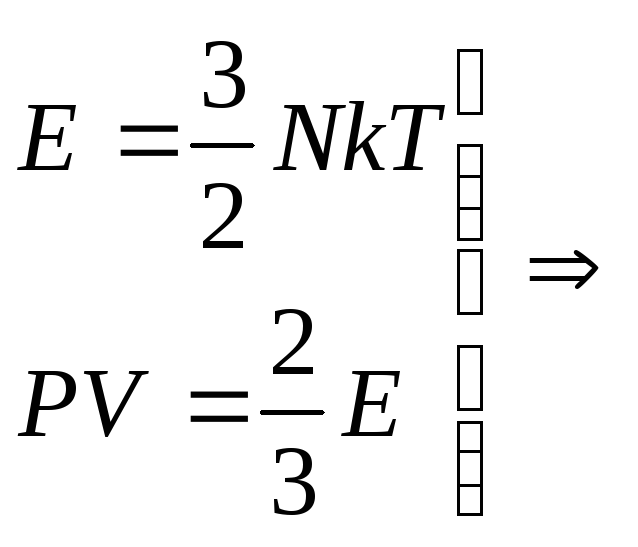Gas atoms or molecules act almost independently of each other in comparison to liquids or solids, particles of which have greater correlation. This is because a gas may occupy thousands of times more volume than the corresponding liquid. The root-mean-square velocity of gas particles varies directly with temperature, according to the “Maxwell Speed Distribution.” That equation enables the calculation of velocity from temperature.
Derivation of Maxwell Speed Distribution Equation
Learn the derivation and application of the Maxwell Speed Distribution equation. That equation is based on and derived from the Ideal Gas Law equation:
PV = nRT
where P is pressure, V is volume (not velocity), n is the number of moles of gas particles, R is the ideal gas constant and T is the temperature.
Study how this gas law is combined with the formula for kinetic energy:
KE = 1/2 m v^2 = 3/2 k T.
Appreciate the fact that the velocity for a single gas particle cannot be derived from the temperature of the composite gas. In essence, each particle has a different velocity and so has a different temperature. This fact has been taken advantage of to derive the technique of laser cooling. As a whole or unified system, however, the gas has a temperature that can be measured.
Calculate the root-mean-square velocity of gas molecules from the temperature of gas using the following equation:
Vrms = (3RT/M)^(1/2)
Make sure to use units consistently. For example, if the molecular weight is taken to be in grams per mole and the value of the ideal gas constant is in joules per mole per degree Kelvin, and the temperature is in degrees Kelvin, then the ideal gas constant is in joules per mole-degree Kelvin, and the velocity is in meters per second.
Practice with this example: if the gas is helium, the atomic weight is 4.002 grams/mole. At a temperature of 293 degrees Kelvin (about 68 degrees Fahrenheit) and with the ideal gas constant being 8.314 joules per mole-degree Kelvin, the root-mean-square velocity of the helium atoms is:
(3 x 8.314 x 293/4.002)^(1/2) = 42.7 meters per second.
Use this example to calculate velocity from temperature.
Перейти к контенту
Условие задачи:
Определить среднюю квадратичную скорость молекул азота при температуре 27° C?
Задача №4.1.26 из «Сборника задач для подготовки к вступительным экзаменам по физике УГНТУ»
Дано:
(t=27^circ) C, (upsilon_{кв}-?)
Решение задачи:
Среднюю квадратичную скорость молекул идеального газа (upsilon_{кв}) определяют по такой формуле:
[{upsilon _{кв}} = sqrt {frac{{3RT}}{M}} ]
В этой формуле (R) – универсальная газовая постоянная, равная 8,31 Дж/(моль·К), (M) – молярная масса газа, равная у азота 0,028 кг/моль.
Переведем данную в условии температуру из шкалы Цельсия в шкалу Кельвина:
[27^circ;C = 300;К]
Посчитаем ответ:
[{upsilon _{кв}} = sqrt {frac{{3 cdot 8,31 cdot 300}}{{0,028}}} = 516,8;м/с approx 0,5;км/с]
Ответ: 0,5 км/с.
Если Вы не поняли решение и у Вас есть какой-то вопрос или Вы нашли ошибку, то смело оставляйте ниже комментарий.
Смотрите также задачи:
4.1.25 Какова плотность сжатого воздуха при 0 C в камере шины автомобиля “Волга”? Давление
4.1.27 Определить плотность воздуха при нормальных условиях. Молярную массу принять
4.1.28 Каково давление азота, если его плотность равна 1,35 кг/м^3, а средняя квадратичная
( 16 оценок, среднее 3 из 5 )
Атомы или молекулы газа действуют практически независимо друг от друга по сравнению с жидкостями или твердыми веществами, частицы которых имеют большую корреляцию. Это связано с тем, что газ может занимать в тысячи раз больший объем, чем соответствующая жидкость. Среднеквадратичная скорость частиц газа изменяется непосредственно в зависимости от температуры, в соответствии с «распределением скорости Максвелла». Это уравнение позволяет рассчитывать скорость по температуре.
Вывод уравнения распределения скоростей Максвелла
Изучите вывод и применение уравнения распределения Максвелла. Это уравнение основано на уравнении закона идеального газа и получено из него:
PV = nRT
где P — давление, V — объем (не скорость), n — число молей частиц газа, R — постоянная идеального газа, а T — температура.
Изучите, как этот закон газа сочетается с формулой кинетической энергии:
KE = 1/2 mv ^ 2 = 3/2 k T.
Примите во внимание тот факт, что скорость для одной частицы газа не может быть получена из температуры составного газа. По сути, каждая частица имеет разную скорость и поэтому имеет разную температуру. Этот факт был использован для того, чтобы вывести технику лазерного охлаждения. Однако в целом или в единой системе газ имеет температуру, которую можно измерить.
Рассчитайте среднеквадратичную скорость молекул газа по температуре газа, используя следующее уравнение:
Vrms = (3RT / M) ^ (1/2)
Убедитесь, что вы используете единицы последовательно. Например, если молекулярная масса принята в граммах на моль, а значение постоянной идеального газа в джоулях на моль на градус Кельвина, а температура в градусах Кельвина, то постоянная идеального газа в джоулях на моль градусов Кельвина, а скорость в метрах в секунду.
Практикуйтесь с этим примером: если газ представляет собой гелий, атомный вес составляет 4, 002 г / моль. При температуре 293 градуса Кельвина (около 68 градусов по Фаренгейту) и постоянной идеального газа, равной 8, 314 Дж на моль градуса Кельвина, среднеквадратичная скорость атомов гелия равна:
(3 x 8, 314 x 293 / 4, 002) ^ (1/2) = 42, 7 метра в секунду.
Используйте этот пример для расчета скорости по температуре.
Молекулярно-кинетическая теория позволяет, анализируя микроскопическое поведение системы и используя методы статистической механики, получить важные макроскопические характеристики термодинамической системы. Одной из микроскопических характеристик, которая связана с температурой системы, является средняя квадратичная скорость молекул газа. Формулу для нее приведем и рассмотрим в статье.
Газ идеальный
Сразу отметим, что формула квадратичной средней скорости молекул газа будет приведена именно для газа идеального. Под ним в физике полагают такую многочастичную систему, в которой частицы (атомы, молекулы) не взаимодействуют друг с другом (их кинетическая энергия на несколько порядков превышает потенциальную энергию взаимодействия) и не имеют размеров, то есть являются точками с конечной массой (расстояние между частицами на несколько порядков превышает их размеры линейные).
Любой газ, который состоит из химически нейтральных молекул или атомов, и что находится под небольшим давлением и имеет высокую температуру, может считаться идеальным. Например, воздух — это идеальный газ, а водяной пар таковым уже не является (между молекулами воды действуют сильные водородные связи).
Теория молекулярно-кинетическая (МКТ)

Изучая идеальный газ в рамках МКТ, следует обратить внимание на два важных процесса:
Несмотря на то, что индивидуальные скорости газовых частиц сильно отличаются друг от друга, среднее значение этой величины сохраняется постоянным во времени, если отсутствуют внешние воздействия на систему. Формулу средней квадратичной скорости молекул газа можно получить, если рассмотреть связь между кинетической энергией и температурой. Займемся этим вопросом в следующем пункте статьи.
Вывод формулы квадратичной средней скорости молекул газа идеального
Каждый школьник знает из общего курса физики, что кинетическая энергия поступательного движения тела массой m рассчитывается так:
Ek = m*v2/2
Где v — линейная скорость. С другой стороны, кинетическую энергию частицы также можно определить через абсолютную температуру T, используя переводной множитель kB (постоянная Больцмана). Поскольку наше пространство является трехмерным, то Ek рассчитывается так:
Ek = 3/2*kB*T.
Приравнивая оба равенства и выражая из них v, получим формулу средней скорости квадратичной газа идеального:
m*v2/2 = 3/2*kB*T =>
v = √(3*kB*T/m).
В этой формуле m — является массой газовой частицы. Ее значение неудобно использовать в практических расчетах, поскольку оно невелико (≈ 10-27 кг). Чтобы избежать этого неудобство вспомним об универсальной газовой постоянной R и молярной массе M. Постоянная R с kB связана равенством:
kB = R/NA.
Величина M определяется так:
M = m*NA.
Принимая во внимание оба равенства, получаем следующее выражение для средней квадратичной скорости молекул:
v = √(3*R*T/M).
Таким образом, средняя квадратичная скорость газовых частиц оказывается прямо пропорциональной квадратному корню из абсолютной температуры и обратно пропорциональна корню квадратному из молярной массы.
Пример решения задачи
Каждый знает, что воздух, которым мы дышим, на 99% состоит из азота и кислорода. Необходимо определить разницы в средних скоростях молекул N2 и O2 при температуре 15 oC.

Эту задачу будет решать последовательно. Сначала переведем температуру в абсолютные единицы, имеем:
T = 273,15 + 15 = 288,15 К.
Теперь выпишем молярные массы для каждой рассматриваемой молекулы:
MN2 = 0,028 кг/моль;
MO2 = 0,032 кг/моль.
Поскольку значения молярных масс отличаются между собой незначительно, то средние их скорости при одинаковой температуре тоже должны быть близки. Пользуясь формулой для v, получаем следующие значения для молекул азота и кислорода:
v (N2) = √(3*8,314*288,15/0,028) = 506,6 м/с;
v (O2) = √(3*8,314*288,15/0,032) = 473,9 м/с.
Поскольку молекулы азота немного легче, чем молекулы кислорода, то движутся они быстрее. Разница средних скоростей составляет:
v (N2) — v (O2) = 506,6 — 473,9 = 32,7 м/с.
Полученное значение составляет всего 6,5 % от средней скорости молекул азота. Обращаем внимание на большие значения скоростей молекул в газах даже при невысоких температурах.
Автор:
16-01-2019 19:51
Жду ваши вопросы и мнения в комментариях
Так как
,
то, следовательно,
…(11.12)
где
–
кинетическая энергия всех молекул газа.
Массу газа можно
выразить как
,
тогда (12.12) запишется как
;
для одного моля газа, то есть m
= M, а V = V
,
отсюда
Так как молярную
массу можно выразить через массу одной
молекулы m0
и число Авогадро —
,
то квадратичную скорость можно представить
как
где
— постоянная Больцмана.
При комнатной
температуре молекулы кислорода, например,
имеют среднеквадратическую скорость
480м/с, водорода – 1900м/с.
6. Средняя кинетическая энергия поступательного движения молекул газа.
Средняя кинетическая
энергия поступательного движения одной
молекулы идеального газа
– она пропорциональна термодина-мической
температуре и зависит только от нее, то
есть
температура тела есть количественная
мера энергии движения молекул, из которых
состоит это тело. Кроме
того, связи между абсолютной температурой
и средней кинетической энергией
показывает, что при
одинаковой температуре средние
кинетические энергии молекул всех газов
одинаковы, несмотря на различие масс
молекул разных газов.
Кинетическая
энергия газа состоящего из
молекул, равна
,
то есть
,
отсюда
,
где
— концентрация молекул, тогда
– получили уравнение состояния идеального
газа. Из этих выражений видно, что если
то <E0>
= 0, то есть прекращается поступательное
движение молекул идеального газа, а, ,
его давление равно нулю.
Не следует думать,
что при абсолютном нуле температуры,
прекращается всякое движение частиц
вещества. Даже если все молекулы газа
остановятся, то внутри них будут двигаться
электроны, будут участвовать в движении
протоны и нейтроны ядер.
Абсолютный ноль
температур означает для реальной системы
не отсутствие движения, но такое состояние
тела, при котором дальнейшее уменьшение
интенсивности этого движения за счет
отдачи его энергии окружающим телам
невозможно. Следовательно, при абсолютном
нуле система находится в состоянии с
наименьшей возможной энергией.
Характер этого состояния зависит от
конкретных свойств составляющих систему
частиц.
7. Любая
молекулярная система состоит из большого
числа составных частиц (идеальный газ).
Эти частицы беспорядочно движутся.
Скорости каждой частицы в произвольный
момент времени неизвестны. Но, оказываются
разные
скорости различных частиц встречаются
с разными вероятностями.
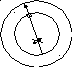
В этом можно убедится на опыте Штерна
(1888 – 1970):
|
|
Раскаленная |
|
испаряясь, |
|
|
стороны. |
|
|
те |
поверхности
внешнего цилиндра, они создают изображение
щели, которое можно увидеть, если через
некоторое время развернуть внутреннюю
поверхность большого цилиндра. Если
прибор привести во вращение вокруг
общей оси, то атомы серебра, прошедшие
сквозь щель, будут оседать не прямо
напротив него, а с некоторым смещением.
Если бы всех молекул серебра была
одинакова, то и это смещение было бы
одинаковым, но опыт показал распределение
по скоростям.
|
|
Существует |
|
около |
|
|
ны |
|
|
интервалы, |
|
|
наиболее |
|
|
стью |
|
|
ет |
Чем больше скорость
частиц отличается от Uв,
тем меньше число таких частиц. С
увеличением
возрастает наиболее вероятная скорость,
больше появится быстрых частиц, вся
кривая сместится вправо. Однако площадь
под кривой остается постоянной (так как
постоянно число частиц), кривая
растягивается. Сама кривая называется:
распределение
Максвелла молекул по скоростям.
Применив методы
теории вероятностей, Максвелл нашел
функцию распределения по скоростям
f
(1)
Значение наиболее
вероятной скорости можно найти,
продифференцировав (1):
(2)
Средняя скорость
молекул определяется по формуле:
(3)
Таким образом,
состояние газа характеризуется следующими
скоростями:
1) наиболее вероятная
2) средняя
3) Средняя квадратичная
Исходя из
распределения молекул по скоростям
можно определить функцию
распределения молекул по энергиям
теплового движения
(4)
Тогда средняя
кинетическая энергия :
7
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #