Содержание
- Термин: Зависимость электрического сопротивления от температуры (ТКС)
- Электрическое сопротивление
- Электрическое сопротивление проводника в общем случае зависит от материала проводника
- Определение и формула температурного коэффициента сопротивления
- Единицы
- Примеры решения задач
- Расчет сопротивления электрического проводника
- Расчет длины электрического проводника
- Расчет сечения электрического проводника
- Температурный коэффициент объемного расширения
- Температурный коэффициент линейного расширения
- Зависимость сопротивлений от температуры
- Как рассчитать температурный коэффициент реакции?
- Температурный коэффициент электрического сопротивления металлов α
Термин: Зависимость электрического сопротивления от температуры (ТКС)
Зависимость электрического сопротивления провода от температуры приходится учитывать в различных схемах измерений, поскольку эта зависимость может оказывать существенное влияние на дополнительную погрешность измерения.
Зависимость сопротивления R(t) провода от температуры t задаётся температурным коэффициентом сопротивления (ТКС) провода α и описывается формулой:
R(t) = R20 (1 + α (t — 20) ),
где температура t задаётся в градусах Цельсия; R20 – это сопротивление провода при 20°С, а ТКС α – это константа с размерностью 1/°С, зависящая от материала провода. Приблизительные ТКС некоторых проводников приводим в таблице ниже.
Проводник α (ТКС), 1/°С
| Алюминий | 4,2*10-3 |
| Вольфрам | 5*10-3 |
| Железо | 6*10-3 |
| Золото | 4*10-3 |
| Латунь | (0,1 — 0,4)*10-3 |
| Магний | 3,9*10-3 |
| Медь | 4,3*10-3 |
| Никель | 6,5*10-3 |
| Нихром | 0,1*10-3 |
| Олово | 4,4*10-3 |
| Платина | 3,9*10-3 |
| Серебро | 4,1*10-3 |
| Сталь | (1 — 4)*10-3 |
Абсолютное изменение сопротивления проводника ∆R при изменении температуры ∆t и начальном сопротивлении R рассчитывается по формуле:
∆R = R*α*∆t.
Относительное изменение сопротивления проводника ∆R/R при изменении температуры ∆t рассчитывается по формуле: ∆R/R = α*∆t.
К схемам измерений, в которых существенное влияние отказывает ТКС проводов, относят: полномостовые четырёхпроводные балансные схемы и полумостовые трёхпроводные схемы. Эти схемы применяют в тензометрии, и здесь существенное влияние на шкалу (масштаб) измерения оказывают ТКС проводов питания.
Существуют также балансные мостовые схемы, в которых существенное влияние отказывает не собственный ТКС проводов, а различия ТКС проводов, которыми подключен мост. К такому случаю относят трёхпроводную четверьмостовую схему. В то же время, существуют схемы измерений, в которых ТКС проводов не оказывает никакого влияния на измерения, например, в случае питания тензомоста от источника стабильного тока.
Термин ТКС (англ: TCR temperature coefficient of resistance) широко применяют также к резисторам (и к элементам, проявляющим резистивные свойства) для описания их температурной зависимости с размерностью 10-6/°С или ppm/°С. При этом, ТКС реальных резистивных элементов может быть как положительным, так и отрицательным, но, кроме того, в зависимости от технологии этих элементов, их ТКС может быть разным при разной температуре.
Большое абсолютное значение ТКС в сочетанием фактором самонагрева резистивного элемента из-за протекающего тока может рассматриваться как проявление нелинейного сопротивления на интервалах времени значительно больших, чем время самонагрева.
На интервалах времени значительно меньших, чем время самонагрева резистивного элемента, большое абсолютное значение ТКС будет восприниматься как дрейф (нестабильность) сопротивления по причине самонагрева.
Электрическое сопротивление
Электрическое сопротивление — это физическая величина , характеризующая противодействие проводника или электрической цепи электрическому току . Физика 7,8,9,10,11 класс, ЕГЭ, ГИА Копировать ссылку Распечатать
Электрическое сопротивление — это физическая величина, характеризующая противодействие проводника или электрической цепи электрическому току.
Электрическое сопротивление определяется как коэффициент пропорциональности R между напряжением U и Iсилой постоянного тока в законе Ома для участка цепи.
Единица сопротивления называется омом (Ом) в честь немецкого ученого Г. Ома, который ввел это понятие в физику. Один ом (1 Ом) — это сопротивление такого проводника, в котором при напряжении 1В сила тока равна 1А.
Электрическое сопротивление проводника в общем случае зависит от материала проводника
от его длины и от поперечного сечения, или более кратко — от удельного сопротивления и от геометрических размеров проводника. Данная зависимость общеизвестна и выражается формулой:
Известен каждому и закон Ома для однородного участка электрической цепи, из которого видно, что ток тем меньше, чем сопротивление выше. Таким образом, если сопротивление проводника постоянно, то с ростом приложенного напряжения ток должен бы линейно расти. Но в реальности это не так. Сопротивление проводников не постоянно.
За примерами далеко ходить не надо. Если к регулируемому блоку питания (с вольтметром и амперметром) подключить лампочку, и постепенно повышать напряжение на ней, доводя до номинала, то легко заметить, что ток растет не линейно: с приближением напряжения к номиналу лампы, ток через ее спираль растет все медленнее, причем лампочка светится все ярче.
Нет такого, что с увеличением вдвое приложенного к спирали напряжения, вдвое возрос и ток. Закон Ома как-будто не выполняется. На самом деле закон Ома выполняется, и точно, просто сопротивление нити накала лампы непостоянно, оно зависит температуры.
Вспомним, с чем связана высокая электрическая проводимость металлов. Она связана с наличием в металлах большого количества носителей заряда — составных частей тока — электронов проводимости. Это электроны, образующиеся из валентных электронов атомов металла, которые для всего проводника являются общими, они не принадлежат каждый отдельному атому.
Под действием приложенного к проводнику электрического поля, свободные электроны проводимости переходят из хаотичного в более-менее упорядоченное движение — образуется электрический ток. Но электроны на своем пути встречают препятствия, неоднородности ионной решетки, такие как дефекты решетки, неоднородная структура, вызванные ее тепловыми колебаниями.
Электроны взаимодействуют с ионами, теряют импульс, их энергия передается ионам решетки, переходит в колебания ионов решетки, и хаос теплового движения самих электронов усиливается, от того проводник и нагревается при прохождении по нему тока.
В диэлектриках, полупроводниках, электролитах, газах, неполярных жидкостях — причина сопротивления может быть иной, однако закон Ома, очевидно, не остается постоянно линейным.
Таким образом, для металлов, рост температуры приводит к еще большему возрастанию тепловых колебаний кристаллической решетки, и сопротивление движению электронов проводимости возрастает. Это видно по эксперименту с лампой: яркость свечения увеличилась, но ток возрос слабее. То есть изменение температуры повлияло на сопротивление нити накаливания лампы.
В итоге становится ясно, что сопротивление металлических проводников зависит почти линейно от температуры. А если принять во внимание, что при нагревании геометрические размеры проводника меняются слабо, то и удельное электрическое сопротивление почти линейно зависит от температуры. Зависимости эти можно выразить формулами:
Обратим внимание на коэффициенты. Пусть при 0°C сопротивление проводника равно R0, тогда при температуре t°C оно примет значение R(t), и относительное изменение сопротивления будет равно α*t°C. Вот этот коэффициент пропорциональности α и называется температурным коэффициентом сопротивления. Он характеризует зависимость электрического сопротивления вещества от его текущей температуры.
Данный коэффициент численно равен относительному изменению электрического сопротивления проводника при изменении его температуры на 1К (на один градус Кельвина, что равноценно изменению температуры на один градус Цельсия).
Для металлов ТКС (температурный коэффициент сопротивления α) хоть и относительно мал, но всегда больше нуля, ведь при прохождении тока электроны тем чаще сталкиваются с ионами кристаллической решетки, чем выше температура, то есть чем выше тепловое хаотичное их движение и чем выше их скорость. Сталкиваясь в хаотичном движении с ионами решетки, электроны металла теряют энергию, что мы и видим в результате — сопротивление при нагревании проводника возрастает. Данное явление используется технически в термометрах сопротивления.
Итак, температурный коэффициент сопротивления α характеризует зависимость электрического сопротивления вещества от температуры и измеряется в 1/К — кельвин в степени -1. Величину с обратным знаком называют температурным коэффициентом проводимости.
Что касается чистых полупроводников, то для них ТКС отрицателен, то есть сопротивление снижается с ростом температуры, это связано с тем, что с ростом температуры все больше электронов переходят в зону проводимости, растет при этом и концентрация дырок. Этот же механизм свойственен для жидких неполярных и твердых диэлектриков.
Полярные жидкости свое сопротивление резко уменьшают с ростом температуры из-за снижения вязкости и роста диссоциации. Это свойство применяется для защиты электронных ламп от разрушительного действия больших пусковых токов.
У сплавов, легированных полупроводников, газов и электролитов тепловая зависимость сопротивления более сложна чем у чистых металлов. Сплавы с очень малым ТКС, такие как манганин и константан, применяют в электроизмерительных приборах.
Определение и формула температурного коэффициента сопротивления
Сопротивление проводника (R) (удельное сопротивление) ()
зависит от температуры. Эту зависимость при незначительных изменениях температуры
представляют в виде функции:
где
— удельное сопротивление проводника при температуре равной 0oC;
— температурный коэффициент сопротивления.
ОПРЕДЕЛЕНИЕ Температурным коэффициентом электрического сопротивления () называют физическую величину, равную относительному приращению (R) участка цепи (или удельного сопротивления среды (
), которое происходит при нагревании проводника на 1oС. Математически определение температурного коэффициента сопротивления можно представить как:
Величина
служит характеристикой связи электросопротивления с температурой.
При температурах, принадлежащих диапазону
у большинства металлов рассматриваемый коэффициент
остается постоянным. Для чистых металлов температурный коэффициент сопротивления часто принимают равным
Иногда говорят о среднем температурном коэффициенте сопротивления, определяя его как:
где
— средняя величина температурного коэффициента в заданном интервале температур
Основной единицей измерения температурного коэффициента сопротивления в системе СИ является:
Единицы
Тепловой коэффициент электрическая цепь части иногда указываются как промилле/°C, или же промилле/K. Он определяет долю (выраженную в миллионных долях), на которую его электрические характеристики будут отклоняться при достижении температуры выше или ниже Рабочая Температура.
Примеры решения задач
ПРИМЕР 1
| Задание | Лампа накаливания, имеющая спираль из вольфрама включена в сеть с напряжением B, по ней идет ток А. Какой будет температура спирали, если при температуре oС она имеет сопротивление Ом? Температурный коэффициент сопротивления вольфрама . |
| Решение | В качестве основы для решения задачи используем формулу зависимости сопротивления от температуры вида:
где По закону Ома для участка цепи имеем: Вычислим Запишем уравнение связывающее сопротивление Проведем вычисления: |
| Ответ | K |
ПРИМЕР 2
| Задание | При температуре сопротивление реостата равно , сопротивление амперметра равно и он показывает силу тока Реостат, сделан из железной проволоки, он последовательно соединен с амперметром (рис.1). Каким будет сила тока течь через амперметр, если реостат нагреть до температуры ? Считать температурный коэффициент сопротивления железа равным .  Рис. 1 Рис. 1 |
| Решение | Закон Ома для участка цепи при температуре 0oC можно записать как:
После нагревания сопротивление реостата стало равно R, тогда через амперметр течет ток равный: Сопротивление зависит от температуры: Подставим выражения (2.3) и (2.1) в уравнение (2.2), получим: |
| Ответ |
Расчет сопротивления электрического проводника
Сопротивление электрического проводника рассчитываем по формуле:
R = ρ * L / S
- R — сопротивление электрического проводника
- ρ — удельное сопротивление проводника
вычисляется по формуле (1): ρ = ρ20[1 + α(t — 20)]- ρ20 — удельное сопротивление проводника при температуре t = 20°C (Таблица 1)
- t — температура проводника
- α — температурный коэффициент электрического сопротивления (Таблица 1)
- L — длина электрического проводника
- S — сечение электрического проводника
Расчет длины электрического проводника
Длину электрического проводника рассчитываем по формуле:
L = R * S / ρ
- L — длина электрического проводника
- R — сопротивление электрического проводника
- S — сечение электрического проводника
- ρ — удельное сопротивление проводника
вычисляется по формуле (1): ρ = ρ20[1 + α(t — 20)]- ρ20 — удельное сопротивление проводника при температуре t = 20°C (Таблица 1)
- t — температура проводника
- α — температурный коэффициент электрического сопротивления (Таблица 1)
Расчет сечения электрического проводника
Минимальное сечение электрического проводника при допустимых потерях напряжения рассчитываем по формуле:
S = I * ρ * L / ΔU
- S — сечение электрического проводника
- I — сила тока в электрической цепи
- L — длина электрического проводника
при двухпроводной линии, длина проводника (значение L) удваивается - ΔU — допустимые потери напряжения
- ρ — удельное сопротивление проводника
вычисляется по формуле (1): ρ = ρ20[1 + α(t — 20)]- ρ20 — удельное сопротивление проводника при температуре t = 20°C (Таблица 1)
- t — температура проводника
- α — температурный коэффициент электрического сопротивления (Таблица 1)
Температурный коэффициент объемного расширения
Температурным коэффициентом объемного расширения тела является физическая величина, которая характеризует относительное изменение объема тела
которое происходит при нагревании тела на 1 K и неизменном давлении:
Температурный коэффициент линейного расширения
ОПРЕДЕЛЕНИЕ Температурный коэффициент линейного расширения
— это физическая величина, которая характеризует изменение линейных размеров твердого тела с ростом или уменьшением его температуры.
где
— начальная длина тела,
— увеличение длины тела (удлинение) при росте температуры тела на
Зависимость сопротивлений от температуры
С повышением температуры сопротивление металлов возрастает. Однако существуют сплавы, сопротивление которых почти не меняется при повышении температуры (например, константан, манганин и др.). Сопротивление же электролитов с повышением температуры уменьшается.
Температурным коэффициентом сопротивления проводника называется отношение величины изменения сопротивления проводника при нагревании на 1 °С к величине его сопротивления при 0 ºС:
Зависимость удельного сопротивления проводников от температуры выражается формулой:
В общем случае α зависит от температуры, но если интервал температур невелик, то температурный коэффициент можно считать постоянным. Для чистых металлов α = (1/273)К-1. Для растворов электролитов α < 0. Например, для 10% раствора поваренной соли α = -0,02 К-1. Для константана (сплава меди с никелем) α = 10-5 К-1.
Зависимость сопротивления проводника от температуры используется в термометрах сопротивления.
Как рассчитать температурный коэффициент реакции?
Что такое температурный коэффициент?
Во-первых, при повышении температуры скорость реакции возрастает. Всё логично
Значит, температурный коэффициент- это число, которое показывает, во сколько раз увеличилась скорость реакции, когда мы повысим температуру на 10 градусов
Вот такая страшная формула( но только на первый взгляд)
γ-это и есть наш температурный коэффициент
Следовательно, чтобы его расчитать, нужно знать
2 скорости (до и после повышения температуры на 10 градусов)
2 константы (у каждой реакции они свои. Обычно их пишут в условии задачи)
Температурный коэффициент электрического сопротивления металлов α
- В разумных температурных пределах вокруг некоторой точки зависимость удельного сопротивления металлов от температуры описывается как:
- ΔR = α*R*ΔT, где α — температурный коэффициент электрического сопротивления.
- Ниже приведена таблица значений α для ряда металлов в диапазоне температур от 0 до 100 ° C.
Зависимость сопротивления металлов от температуры. Температурный коэффициент электрического сопротивления металлов α .
| Проводник | Удельное сопротивление ρ, Ом*мм2/м |
α, 10 -3*C-1(или K -1) |
| Алюминий | 0,028 | 4,2 |
| Бронза | 0,095 — 0,1 | — |
| Висмут | 1,2 | — |
| Вольфрам | 0,05 | 5 |
| Железо | 0,1 | 6 |
| Золото | 0,023 | 4 |
| Иридий | 0,0474 | — |
| Константан ( сплав Ni-Cu + Mn) | 0,5 | 0,05! |
| Латунь | 0,025 — 0,108 | 0,1-0,4 |
| Магний | 0,045 | 3,9 |
| Манганин (сплав меди марганца и никеля — приборный) | 0,43 — 0,51 | 0,01!! |
| Медь | 0,0175 | 4,3 |
| Молибден | 0,059 | — |
| Нейзильбер (сплав меди цинка и никеля) | 0,2 | 0,25 |
| Натрий | 0,047 | — |
| Никелин ( сплав меди и никеля) | 0,42 | 0,1 |
| Никель | 0,087 | 6,5 |
| Нихром ( сплав никеля хрома железы и марганца) | 1,05 — 1,4 | 0,1 |
| Олово | 0,12 | 4,4 |
| Платина | 0.107 | 3,9 |
| Ртуть | 0,94 | 1,0 |
| Свинец | 0,22 | 3,7 |
| Серебро | 0,015 | 4,1 |
| Сталь | 0,103 — 0,137 | 1-4 |
| Титан | 0,6 | — |
| Фехраль (Cr (12—15 %); Al (3,5—5,5 %); Si (1 %); Mn (0,7 %); + Fe) | 1,15 — 1,35 | 0,1 |
| Хромаль | 1,3 — 1,5 | — |
| Цинк | 0,054 | 4,2 |
| Чугун | 0,5-1,0 | 1,0 |
Источники
- https://www.lcard.ru/lexicon/wire_tcr
- https://www.calc.ru/Elektricheskoye-Soprotivleniye.html
- http://ElectricalSchool.info/main/osnovy/1873-temperaturnyjj-kojefficient.html
- http://ru.solverbook.com/spravochnik/koefficienty/temperaturnyj-koefficient-soprotivleniya/
- https://wikiaro.ru/wiki/Temperature_coefficient
- https://www.axwap.com/kipia/docs/elektrika/provodnik.htm
- http://ru.solverbook.com/spravochnik/koefficienty/temperaturnyj-koefficient/
- https://yandex.ru/q/question/kak_rasschitat_temperaturnyi_koeffitsient_26938630/
- https://dpva.ru/Guide/GuidePhysics/ElectricityAndMagnethism/ElectricalResistanceAndConductivity/MetalsElResHeatCoef/
Помогла ли вам статья?
Что такое температурный коэффициент сопротивления
На основании закона Ома и измерения удельного электрического сопротивления ряда материалов, в частности сопротивления металлов, было выявлено, что данный параметр не постоянен и меняется при изменении температуры. Как правило, при нагреве их проводимость ухудшается.
Убедиться на практике в наличии данного явления можно, включив лампочку накаливания. В момент включения уже горящие лампочки на короткое время уменьшают яркость своего свечения. Это свидетельствует о том, что холодная лампочка (спираль которой выполнена из металла вольфрама) потребляет больший ток от сети, чем разогретая, и «просаживает» напряжение. Следовательно, холодная лампочка проводит электрический ток значительно лучше разогретой.
Как определяется температурный коэффициент сопротивления
Количественной мерой изменения электрического сопротивления проводника служит температурный коэффициент удельного сопротивления (ТКС). Ввиду малости значений ТКС выражается в особых единицах — миллионных долях на один Кельвин или градус Цельсия и обозначается ppm/°C или К-1.
Чтобы рассчитать температурный коэффициент сопротивления меди или любого другого материала, применяют метод, основанный на измерении электрического сопротивления при различных температурных показателях. Затем используется формула:
Температурный коэффициент сопротивлений обозначают буквой α. Его можно выразить через удельное сопротивление:
Исходя из этого, для расчета сопротивления резистора R или любого другого проводника применяется следующее выражение:
Знак ТКС
Чтобы определить температурный коэффициент сопротивления вольфрама или температурный коэффициент сопротивления алюминия, никеля, серебра и пр. материалов и сплавов, нужно знать проводимость исследуемого материала. Она измеряется при разной температуре. TКС характеризует средний наклон графика сопротивления проводника в исследуемом температурном интервале. Если наклон линии зависимости сопротивления от температуры постоянен, зависимость называется линейной. Но для многих материалов, например, для нихромовой проволоки свойственна нелинейная форма температурной зависимости сопротивления. Поэтому важно указывать, какая температура соответствует определенному значению ТКС. Например, температурный коэффициент сопротивления платины равен 3900 при температуре 20 градусов.
ТКС материала может быть положительным или отрицательным по знаку. Плюсовое значение показывает, что с увеличением нагрева сопротивление также увеличивается. Отрицательный коэффициент означает, что с ростом температуры сопротивление уменьшается. Следует также знать, что в разных температурных интервалах знак может отличаться.
ТКС чистых металлов обычно имеет положительное значение, например, температурный коэффициент сопротивления никеля никогда не бывает отрицательным. Материалы с большим (по модулю) параметром используются для измерения температуры в составе датчиков температуры. Резисторы для подобных применений называют терморезисторами или термисторами.
У электролитов ТКС отрицательный. Это связано с тем, что при нагреве в растворе увеличивается количество обеспечивающих электрическая проводимость свободных ионов. Таким образом, электролиты при нагревании начинают проводить лучше, но характер этой зависимости резко нелинейный.
Отрицателен этот параметр и у чистых (беспримесных) полупроводников. Связано это с тем, что при нагреве в зону проводимости переходит большее количество электронов, тем самым увеличивая концентрацию дырок в полупроводнике.
Материалами для изготовления эталонных (образцовых) сопротивлений (резисторов) служат сплавы с равным или очень близким к нулю ТКС. Одним из таких сплавов является проволока из манганина (сплава на основе меди с добавкой марганца и никеля).
ТКС можно узнать из справочной литературы. Например, таблица, представленная ниже, позволяет определить температурный коэффициент сопротивления железа или сопротивления нихрома, а также серебра, меди, алюминия и прочих материалов.
Термин ТКС был введен с целью обозначения термической стабильности резисторов, поскольку удельное сопротивление их резистивного слоя под воздействием температуры может меняться. Температурную зависимость сопротивления используют в устройствах, называемых термометрами сопротивления. Основным их элементом является проволока из меди или платины, намотанная на жесткий каркас из диэлектрика. Платиновый термометр обычно используется для измерения температуры от +263 до 1064, а медный — 180…–50 градусов.
Если при создании электроизмерительных приборов требуются проводники с сопротивлением, мало зависящим от температурных показателей, используют специальные сплавы, такие как манганин или константан. Например, ТКС последнего в 820 раз меньше, чем температурный коэффициент сопротивления серебра.
Видео по теме
Температурный коэффициент скорости реакции
Возрастание
скорости реакции с ростом температуры
принято характеризовать температурным
коэффициентом скорости реакции , числом,
показывающим, во сколько раз возрастает
скорость данной реакции при повышении
температуры системы на 10°С. Температурный
коэффициент различных реакций различен.
При обычных температурах его значение
для большинства реакций находится в
пределах от 2… 4.
Температурный
коэффициент определяют в соответствии
с так называемым «правилом Вант-Гоффа»,
которое математически выражается
уравнением
v2/v1
=
(T2
–
T1)/10,
где
v1
и v2
–
скорости реакции при температурах Т1
и Т2;
температурный коэффициент реакции.
Так,
например, если
= 2, то при Т2
–
Т1
= 50°С v2/v1
= 25
= 32, т.е. реакция ускорилась в 32 раза,
причем это ускорение никак не зависит
от абсолютных величин Т1
и Т2,
а только от их разности.
Энергия
активации,
разность между значениями средней
энергии частиц (молекул, радикалов,
ионов и др.), вступающих в элементарный
акт химической реакции, и средней энергии
всех частиц, находящихся в реагирующей
системе. Для различных химических
реакций Э. а. изменяется в широких
пределах — от нескольких до ~ 10 дж./
моль. Для
одной и той же химической реакции
значение Э. а. зависит от вида функций
распределения молекул по энергиям их
поступательного движения и внутренним
степеням свободы (электронным,
колебательным, вращательным). Как
статистическую величину Э. а. следует
отличать от пороговой энергии, или
энергетического барьера, — минимальной
энергии, которой должна обладать одна
пара сталкивающихся частиц для протекания
данной элементарной реакции.
Аррениуса
уравнение,
температурная зависимость константы
скорости
к элементарной
хим. реакции:
где
A-предэкспоненциальныи множитель
(размерность совпадает с размерностью
к), Еа
-энергия
активации, обычно принимающая положит.
значения, Т-абс. температура, k-постоянная
Больцмана. Принято приводить Еа
в расчете не
на одну молекулу.
а на число частиц NA
= 6,02*1023
(постоянная Авогадро) и выражать в
кДж/моль; в этих случаях в уравнении
Аррениуса величину k
заменяют
газовой
постоянной
R. График
зависимости 1nк от 1/kT
(аррениусов
график) – прямая линия, отрицательный
наклон которой определяется энергией
активации
Еа
и
характеризует положит. температурную
зависимость к.
22
Скорость
химической реакции —
изменение количества одного из реагирующих
веществ за единицу времени в единице
реакционного пространства. Является
ключевым понятием химической
кинетики.
Скорость химической реакции —
величина всегда положительная, поэтому,
если она определяется по исходному
веществу (концентрация
которого убывает в процессе реакции),
то полученное значение домножается на
−1.
Например
для реакции:
выражение
для скорости будет выглядеть так:
.
Скорость
химической реакции в каждый момент
времени пропорциональна концентрациям
реагентов, возведенным в некоторые
степени.
Для
элементарных
реакций
показатель степени при значении
концентрации каждого вещества часто
равен его стехиометрическому коэффициенту,
для сложных реакций это правило не
соблюдается. Кроме концентрации на
скорость химической реакции оказывают
влияние следующие факторы:
-
природа
реагирующих веществ, -
наличие
катализатора, -
температура
(правило
Вант-Гоффа), -
давление,
-
площадь
поверхности реагирующих веществ.
Если
мы рассмотрим самую простую химическую
реакцию A + B → C, то мы заметим, что
мгновенная
скорость химической реакции величина
непостоянная.
Катализа́тор —
химическое
вещество,
ускоряющее
реакцию,
но не входящее в состав продуктов
реакции[1].
Количество катализатора, в отличие от
других реагентов, после реакции не
изменяется. Важно понимать, что катализатор
участвует в реакции. Обеспечивая более
быстрый путь для реакции, катализатор
реагирует с исходным веществом,
получившееся промежуточное соединение
подвергается превращениям и в конце
расщепляется на продукт и катализатор.
Затем катализатор снова реагирует с
исходным веществом, и этот каталитический
цикл многократно (до миллиона
раз)[источник?]
повторяется.
Катализаторы
подразделяются на гомогенные
и гетерогенные.
Гомогенный катализатор находится в
одной фазе
с реагирующими веществами, гетерогенный —
образует самостоятельную фазу, отделённую
границей раздела от фазы, в которой
находятся реагирующие вещества [1].
Типичными гомогенными катализаторами
являются кислоты и основания. В качестве
гетерогенных катализаторов применяются
металлы, их оксиды и сульфиды.
Реакции
одного и того же типа могут протекать
как с гомогенными, так и с гетерогенными
катализаторами. Так, наряду с растворами
кислот применяются имеющие кислотные
свойства твёрдые Al2O3,
TiO2,
ThO2,
алюмосиликаты, цеолиты. Гетерогенные
катализаторы с основными свойствами:
CaO, BaO, MgO [1].
Гетерогенные
катализаторы имеют, как правило, сильно
развитую поверхность, для чего их
распределяют на инертном носителе
(силикагель,
оксид
алюминия,
активированный
уголь
и др.).
Для
каждого типа реакций эффективны только
определённые катализаторы. Кроме уже
упомянутых кислотно-основных,
существуют катализаторы
окисления-восстановления;
для них характерно присутствие переходного
металла
или его соединения (Со+3,
V2O5+MoO3).
В этом случае катализ осуществляется
путём изменения степени окисления
переходного металла.
Много
реакций осуществлено при помощи
катализаторов, которые действуют через
координацию
реагентов у атома или иона переходного
металла (Ti,
Rh,
Ni).
Такой катализ называется координационным.
Если
катализатор обладает хиральными
свойствами, то из оптически неактивного
субстрата получается оптически активный
продукт.
В
современной науке и технике часто
применяют системы
из нескольких катализаторов,
каждый из которых ускоряет разные стадии
реакции [2][3].
Катализатор также может увеличивать
скорость одной из стадий каталитического
цикла, осуществляемого другим
катализатором. Здесь имеет место «катализ
катализа», или катализ
второго уровня
(Имянитов).
В
биохимических реакциях роль катализаторов
играют ферменты.
Катализаторы
следует отличать от инициаторов.
Например, перекиси
распадаются на свободные
радикалы,
которые могут инициировать радикальные
цепные
реакции.
Инициаторы расходуются в процессе
реакции, поэтому их нельзя считать
катализаторами.
Ингибиторы
иногда ошибочно считают отрицательными
катализаторами. Но ингибиторы, например,
цепных радикальных реакций, реагируют
со свободными радикалами и, в отличие
от катализаторов, не сохраняются. Другие
ингибиторы (каталитические яды)
связываются с катализатором и его
дезактивируют, здесь имеет место
подавление катализа, а не отрицательный
катализ. Отрицательный катализ в принципе
невозможен: он обеспечивал бы для реакции
более медленный путь, но реакция,
естественно, пойдёт по более быстрому,
в данном случае, не катализированному,
пути.
23
Диспе́рсная
систе́ма —
это образования
из двух или более числа
фаз (тел),
которые совершенно или практически не
смешиваются и не реагируют друг с другом
химически. Первое из веществ (дисперсная
фаза)
мелко распределено во втором (дисперсионная
среда).
Если фаз несколько, их можно отделить
друг от друга физическим способом
(центрифугировать, сепарировать и т. д.).
Обычно
дисперсные системы — это коллоидные
растворы,
золи.
К дисперсным системам относят также
случай твёрдой дисперсной среды, в
которой находится дисперсная фаза.
Наиболее
общая классификация дисперсных систем
основана на различии в агрегатном
состоянии дисперсионной
среды и дисперсной фазы. Сочетания трех
видов агрегатного состояния позволяют
выделить девять видов дисперсных систем.
Для краткости записи их принято обозначать
дробью, числитель которой указывает на
дисперсную фазу, а знаменатель на
дисперсионную среду, например для
системы «газ в жидкости» принято
обозначение Г/Ж.
-
Дисперсная
фазаДисперсионная
средаНазвание
и примерГазообразная
Газообразная
Дисперсная
система не образуетсяЖидкая
Газообразная
Аэрозоли:
туманы,
облакаТвёрдая
Газообразная
Аэрозоли
(пыли, дымы), порошкиГазообразная
Жидкая
Газовые
эмульсии и пеныЖидкая
Жидкая
Эмульсии:
нефть,
крем,
молокоТвёрдая
Жидкая
Суспензии
и золи: пульпа, ил,
взвесь,
пастаГазообразная
Твёрдая
Пористые
телаЖидкая
Твёрдая
Капиллярные
системы: жидкость в пористых телах,
грунт,
почваТвёрдая
Твёрдая
Твёрдые
гетерогенные системы: сплавы,
бетон,
ситаллы,
композиционные
материалы
Коллоидные
растворы. Коллоидное состояние характерно
для многих веществ, если их частицы
имеют размер от 1 до 500 нм. Легко показать,
что суммарная поверхность этих частиц
огромна. Если предположить, что частицы
имеют форму шара с диаметром 10 нм, то
при общем объеме этих частиц
1
см3
они будут иметь
площадь
поверхности порядка 10 м2. Как указывалось
ранее поверхностный слой характеризуется
поверхностной энергией и способностью
адсорбировать те или иные частицы, в
том числе ионы
из
раствора. Характерной особенностью
коллоидных частиц является наличие на
их поверхности заряда, обусловленного
избирательной адсорбцией ионов.
Коллоидная частица имеет сложное
строение. Она включает в себя ядро,
адсорбированные ионы, противоины и
растворитель. Существуют лиофильные
(гид.
роф
ильные) коллоиды, в которых растворитель
взаимодейстиует с ядрами частиц,
илнофобные (гидрофобные) коллоиды, в
которых растворитель не взаимодействует
с ядрами
частиц.
Растворитель входит в состав гидрофобных
частиц лишь как сольватная оболочка
адсорбированных ионов или при наличии
стабилизаторов (ПАВ), имеющих лиофобную
и лиофильные части.
Приведем
несколько примеров коллоидных частиц:
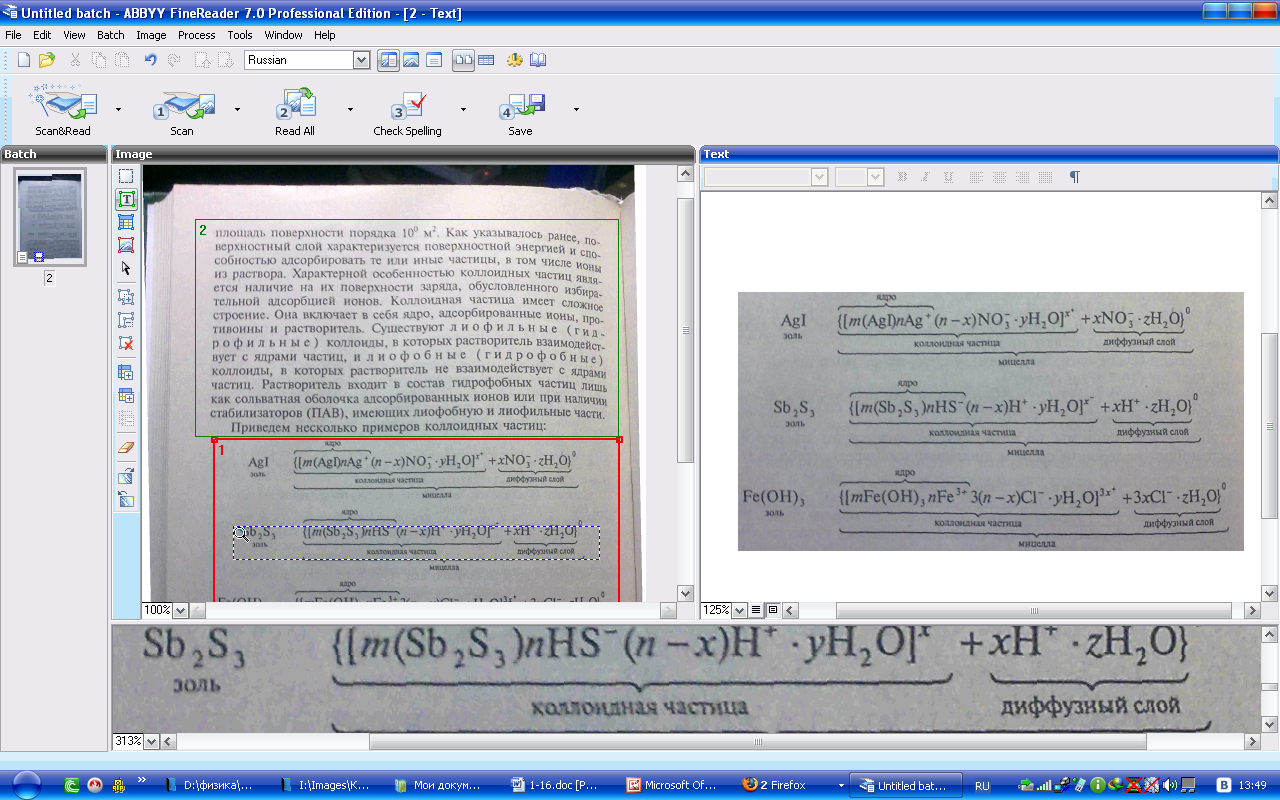
Как.
видно, ядро состоит из электронейтрального
агрегата частиц с адсорбированными
ионами элементов, входящих в состав
ядра (в данных примерах ионами Аg+,
НS-,
Fе3+).
Коллоидная час-шца кроме ядра имеет
противоионы и молекулы растворителя.
Адсорбированные ионы и противоионы
с растворителем образуют адсорбированный
слой. Суммарно заряд частицы равен
разности зарядов адсороированных
ионов и противоионов. Вокруг частиц
находится д и ф ф у з н ы й с л о и и о
н о в, заряд которых равен иряду коллоидной
частицы. Коллоидная частица и диффузный
слои образуют электронейтральную
мицеллу
Мицеллы (уменьшительное
от лат. mica —
частица, крупинка) — частицы в
коллоидных
системах,
состоят из нерастворимого в данной
среде ядра очень малого размера,
окруженного стабилизирующей оболочкой
адсорбированных
ионов
и молекул
растворителя.
Например, мицелла сульфида
мышьяка
имеет строение:
{(As2S3)m•nHS−•(n-x)H+}x-•хН+
Средний
размер мицелл от 10−5
до 10−7см.
Коагуляция
— разделение коллоидного раствора на
две фазы – растворитель и студнеобразную
массу, или загустевание раствора в
результате укрупнения частиц растворенного
вещества
Пептизация
— процесс перехода коллоидного осадка
или геля в коллоидный раствор под
действием жидкости или добавленных к
ней веществ, хорошо адсорбирующихся
осадком или гелем, называемых в этом
случае пептизаторами (например, пептизация
жиров под действием желчи).
Пептизация
— разъединение агрегатов частиц гелей
(студней) или рыхлых осадков под влиянием
определенных веществ — пептизаторов
после коагуляции коллоидных растворов.
В результате пептизации осадок (или
гель) переходит во взвешенное состояние.
24
РАСТВОРЫ,
однофазные
системы, состоящие из двух или более
компонентов. По своему агрегатному
состоянию растворы могут быть твердыми,
жидкими или газообразными.
Растворимость,
способность вещества образовывать с
другим веществом (или веществами)
гомогенные смеси с дисперсным
распределением компонентов (см. Растворы).
Обычно растворителем
считают вещество, которое в чистом виде
существует в том же агрегатном состоянии,
что и образовавшийся раствор. Если до
растворения
оба вещества находились в одном и том
же агрегатном состоянии, растворителем
считается вещество, присутствующее в
смеси в существенно большем кол-ве.
Растворимость
определяется физическим и химическим
сродством молекул
растворителя и растворяемого вещества,
соотношением энергий взаимодействием
однородных и разнородных компонентов
раствора. Как правило, хорошо растворимы
друг в друге подобные по физ. и хим.
свойствам вещества (эмпирич. правило
«подобное растворяется в подобном»).
В частности, вещества, состоящие из
полярных
молекул,
и вещества с ионным типом связи хорошо
раств. в полярных растворителях (воде,
этаноле,
жидком аммиаке), а неполярные вещества
хорошо раств. в неполярных растворителях
(бензоле, сероуглероде).
Согласно
теории, предложенной Дж. Гильдебрандом
(1935), взаимная растворимость неэлектролитов
возрастает с уменьшением разности их
параметров растворимости
d=(Е/V)1/2,
где Е-теплота испарения,
V-полярный объем. Параметр растворимости
— одно из осн. понятий, определяющих
когезионные свойства веществ в конденсир.
состояниях; важная технол. характеристика
полимеров
и растворителей, лакокрасочных
материалов
и т.п. (см. Когезия). Р. мн. электролитов
возрастает пропорционально кубу
диэлектрич. проницаемости растворителя.
Обычно более растворимы электролиты
с большей склонностью к сольватации
растворителем; образование кристаллогидратов
обычно увеличивает растворимость солей.
Растворимость
данного вещества зависит от температуры
и давления
соответствует общему принципу смещения
равновесий (см. Ле Шателье-Брауна
принцип). Концентрация
насыщенного раствора при данных условиях
численно определяет Р. вещества в данном
растворителе и также наз. растворимостью.
Пересыщенные растворы содержат большее
кол-во растворенного вещества, чем это
соответствует его растворимости,
существование пересыщенных растворов
обусловлено кинетич. затруднениями
кристаллизации
(см. Зарождение новой фазы). Для
характеристики растворимости
малорастворимых веществ используют
произведение
активностей
ПА (для растворов, близких по своим
свойствам к идеальному — произведение
растворимости ПР).
Способы
выражения концентрации растворов.
1)
Массовая доля раствора ω (х). Выражается
отношением массы растворенного вещества
m(х) к массе раствора.
Является
величиной безразмерной или выражается
в процентах:
Например,
15%-ный раствор: массовая доля ω (х) = 0,15
2)
Молярная концентрация раствора С(х).
Выражается отношением количества
растворенного вещества n(x) к объему
раствора, выраженному в литрах.
Т.к.
количество вещества n(x) выражается
отношением массы вещества m(x) к его
молярной массе M(x), то молярную концентрацию
раствора удобно выразить как
25
РАСТВОРЫ,
однофазные
системы, состоящие из двух или более
компонентов. По своему агрегатному
состоянию растворы могут быть твердыми,
жидкими или газообразными.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
01.05.2015354.02 Кб230725259_F7873_baranenko_a_v_holodilnye_mashiny.pdf
- #
- #
- #
- #
01.05.20156.82 Mб301.doc
- #
- #
- #
Скорость химической реакции
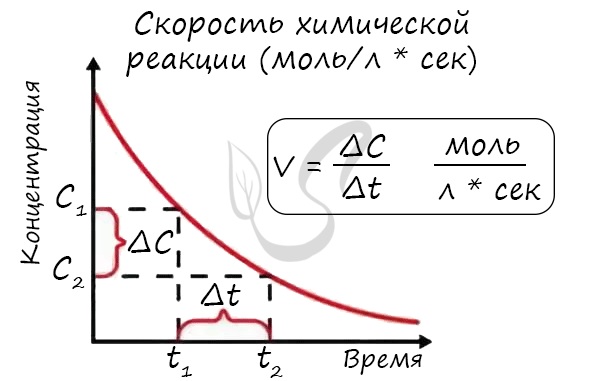
Скорость химической реакции — основное понятие химической кинетики, выражающее отношения количества прореагировавшего вещества (в молях) к отрезку времени, за которое произошло взаимодействие.
Скорость реакции отражает изменение концентраций реагирующих веществ за единицу времени. Единицы измерения для гомогенной реакции: моль/л * сек. Физический смысл в том, что каждую секунду какое-то количество одного вещества превращается в другое в единице объема.
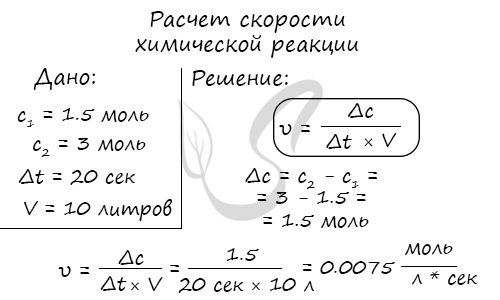
Мне встречались задачи, где была дана молярная концентрация вещества до реакции и после, время и объем. Требовалось посчитать скорость реакции. Давайте решим подобное несложное задание для примера:
Молярная концентрация вещества до реакции составляла 1.5 моль/л по итогу реакции — 3 моль/л. Объем смеси 10 литров, реакция заняла 20 секунд. Рассчитайте скорость реакции.
Влияние природы реагирующих веществ
При изучении агрегатных состояний веществ возникает вопрос: где же быстрее всего идут реакции: между газами, растворами или твердыми веществами?
Запомните, что самая высокая скорость реакции между растворами, в жидкостях. В газах она несколько ниже.
Если реакция гетерогенная: жидкость + твердое вещество, газ + твердое вещество, жидкость + газ, то большую роль играет площадь соприкосновения реагирующих веществ.
Очевидно, что большой кусок железа, положенный в соляную кислоту, будет гораздо дольше реагировать с ней, нежели чем измельченное железо — железная стружка.
Химическая активность также играет важную роль. Например, отвечая на вопрос «какой из металлов Fe или Ca быстрее прореагирует с серой?» мы отдадим предпочтение кальцию, так как в ряду активности металлов он стоит левее железа, а значит кальций активнее железа.
Иного подхода требуют реакции металлов с водой, где нужно учитывать радиус атома. Например, отвечая на вопрос «какой из металлов Li или K быстрее прореагирует с водой?» мы отдадим предпочтение калию, так как калий имеет больший радиус атома. Калий будет быстрее взаимодействовать с водой, чем литий.
Иногда для верного ответа на вопрос о скорости реакции требуется знание активности кислот. Мы подробнее обсудим эту тему в гидролизе, однако сейчас я замечу: чем сильнее (активнее) кислота, тем быстрее идет реакция.
Например, реакцию магния с серной кислотой протекает гораздо быстрее реакции магния с уксусной кислотой. Причиной этому служит то, что серная кислота относится к сильным (активным) кислотам, а активность уксусной кислоты меньше, она является слабой кислотой.
Как я уже упомянул, слабые и сильные кислоты и основания изучаются в теме гидролиз.
Влияние изменения концентрации
Влияние концентрации «прямо пропорционально» скорости реакции: при увлечении концентрации реагирующего вещества скорость реакции повышается, при уменьшении — понижается.
Замечу деталь, которая может оказаться важной, если в реакции участвуют газы: при увеличении давления концентрация вещества на единицу объема возрастает (представьте, как газ сжимается). Поэтому увеличение давление, если среди исходных веществ есть газ, увеличивает скорость реакции.
Закон действующих масс устанавливает соотношение между концентрациями реагирующих веществ и их продуктами. Скорость простой реакции aA + bB → cC определяют по уравнению:
Физический смысл константы скорости — k — в том, что она численно равна скорости реакции при том условии, что концентрации реагирующих веществ равны 1. Обратите внимание, что стехиометрические коэффициенты уравнения переносятся в степени — a и b.
Записанное выше следствие закона действующих масс нужно не только «зазубрить», но и понять. Поэтому мы решим пару задач, где потребуется написать подобную формулу.
Окисление диоксида серы протекает по уравнению: 2SO2(г) + O2 = 2SO3(г). Как изменится скорость этой реакции, если объемы системы уменьшить в три раза?
По итогу решения становится ясно, что скорость реакции в таком случае возрастет в 27 раз.
Решим еще одну задачу. Дана реакция синтеза аммиака: N2 + ЗН2 = 2NH3. Как изменится скорость прямой реакции образования аммиака, если уменьшить концентрацию водорода в два раза?
В результате решения мы видим, что при уменьшении концентрации водорода в два раза скорость реакции замедлится в 8 раз.
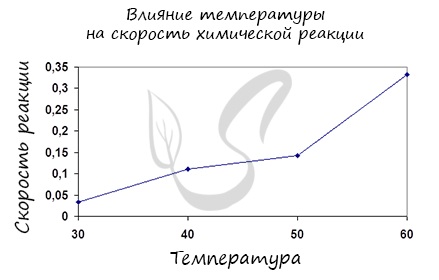
Влияние изменения температуры на скорость реакции
Постулат, который рекомендую временно взять на вооружение: «Увеличение температуры увеличивает скорость абсолютно любой химической реакции: как экзотермической, так и эндотермической. Исключений нет!»
Очень часто в заданиях следующей темы — химическом равновесии, вас будут пытаться запутать и ввести в заблуждение, но вы не поддавайтесь и помните про постулат!
Итак, влияние температуры на скорость реакции «прямо пропорционально»: чем выше температура, тем выше скорость реакции — чем ниже температура, тем меньше и скорость реакции. Однако, как и в случае с концентрацией, это больше чем простая «пропорция».
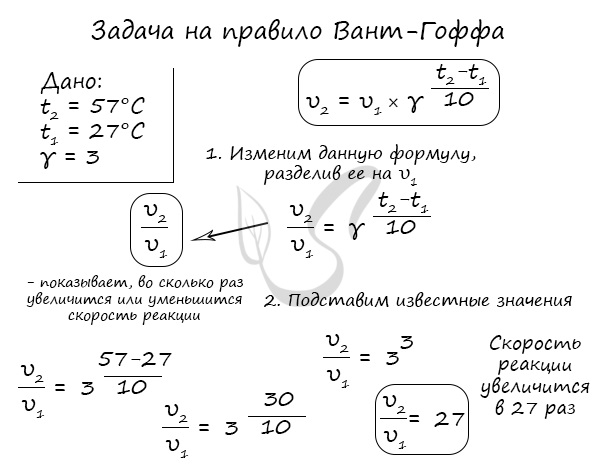
Правило Вант-Гоффа, голландского химика, позволяет точно оценить влияние температуры на скорость химической реакции. Оно звучит так: «При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза»
В формуле, написанной выше, используются следующие обозначение:
- υ1 — скорость реакции при температуре t1
- υ2 — скорость реакции при температуре t2
- γ — температурный коэффициент, который может быть равен 2-4
Если по итогам решения задач у вас получится температурный коэффициент меньше 2 или больше 4, то, скорее всего, где-то вы допустили ошибку. Используйте этот факт для самопроверки.
Для тренировки решим пару задач, в которых потребуется использование правило Вант-Гоффа.
Как изменится скорость гомогенной реакции при повышении температуры от 27°C до 57°C при температурном коэффициенте, равном трем?
Иногда в задачах требуется рассчитать температурный коэффициент, как, например, здесь: «Рассчитайте, чему равен температурный коэффициент скорости, если известно, что при понижении температуры от 250°C до 220°C скорость реакции уменьшилась в 8 раз».
Катализаторы и ингибиторы
Катализатор (греч. katalysis — разрушение) — вещество, ускоряющее химическую реакцию, но не участвующее в ней. Катализатор не расходуется в химической реакции.
Многие химические реакции в нашем организме протекают с участием катализаторов — белковых молекул, ферментов. Без катализаторов подобные реакции шли бы сотни лет, а с катализаторами идут одну долю секунды.
Катализом называют явление ускорения химической реакции под действием катализатора, а химические реакции, идущие с участием катализатора — каталитическими.
Ингибитор (лат. inhibere — задерживать) — вещество, замедляющее или предотвращающее протекание какой-либо химической реакции.
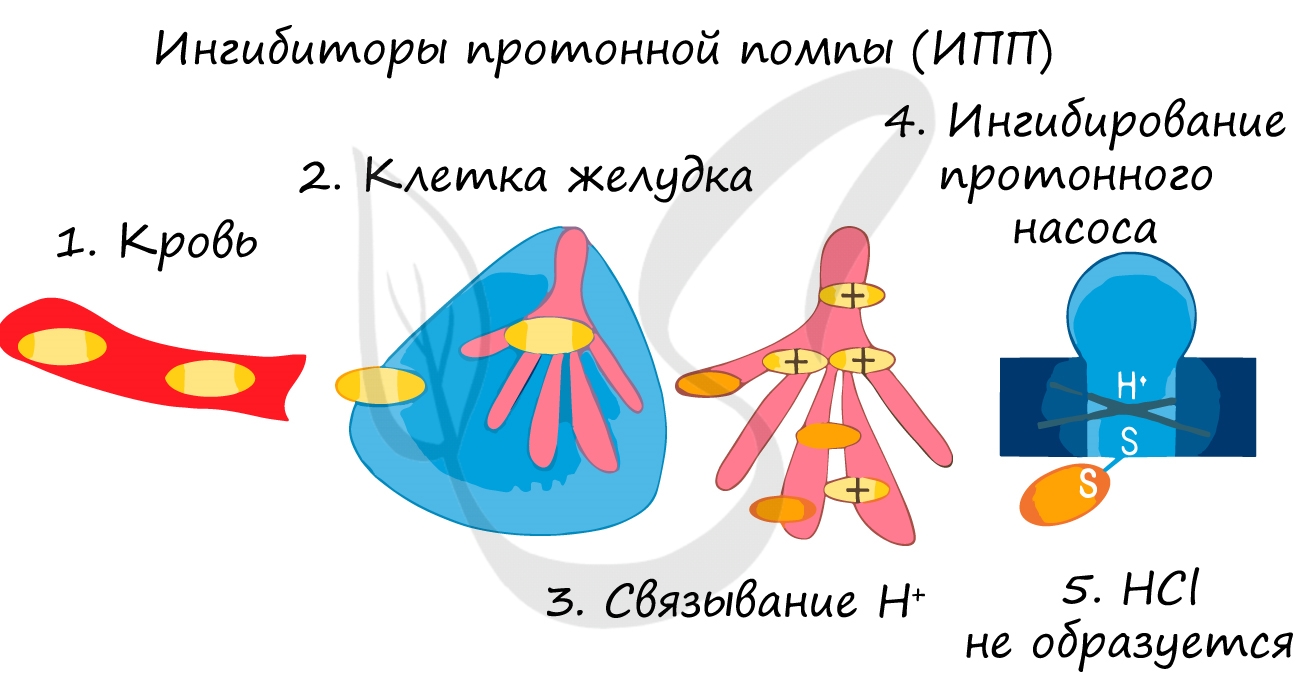
Ингибиторы применяют для замедления коррозии металла, окисления топлива, старения полимеров. Многие лекарственные вещества являются ингибиторами.
Так при лечении гастрита — воспаления желудка (греч. gaster — желудок) или язв часто назначаются ингибиторы протонной помпы — химические вещества, которые блокирует выработку HCl слизистой желудке. В результате этого соляная кислота прекращает воздействие на поврежденную стенку желудка, воспаление стихает.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Скорость химической реакции
Расчеты изменения скорости реакции
Задача 331.
Реакция между веществами А и В выражается уравнением: А + 2В → С. Начальные концентрации составляют: [А]0 = 0,03 моль/л, [В]0 = 0,05 моль/л. Константа скорости реакции равна 0,4. Найти начальную скорость реакции и скорость реакции по истечении некоторого времени, когда концентрация вещества А уменьшится на 0,01 моль/л.
Решение:
До изменения концентрации скорость реакции можно выразить уравнением:
v — скорость реакции, k — константа скорости реакции, [А] и [В] – концентрации исходных веществ.
Для нахождения скорости реакции по истечении некоторого времени учтём, что на образование 1 моля вещества С затрачивается 1 моль вещества А и 2 моля вещества В, поэтому при уменьшении концентрации вещества А на 0,01 моль/л, концентрация вещества В уменьшится соответственно на 0,02 моль/л (2 . 0.01 = 0,02). Тогда оставшиеся концентрации веществ будут равны [A]ост. = 0.03 – 0,01 = 0,02 моль/л, [B]ост. = 0,05 – 0,02 = 0,03моль/л. Тогда скорость реакции по истечении некоторого времени будет составлять:
Ответ: v1 = 3 . 10 -5 ; v2 = 7,2 . 10 -6 .
Задача 332.
Как изменится скорость реакции 2NO (г.) + O2 (г.) → 2NO2 (г.), если: а) увеличить давление в системе в 3 раза; б) уменьшить объем системы в 3 раза; в) повысить концентрацию в 3 раза?
Решение:
До изменения объёма, давления и концентрации скорость реакции можно выразить уравнением:
а) Вследствие увеличения давления в системе в 3 раза, соответственно концентрация каждого из реагирующих веществ возрастёт в 3 раза. Следовательно, теперь скорость реакции будет равна:
Тогда, сравнивая выражения v и vа) , находим, что скорость реакции возрастает в 27 раз
б) при уменьшении объёма в 3 раза в системе концентрация каждого из реагирующих веществ возрастёт в 3 раза. Следовательно, теперь скорость реакции будет равна:
Тогда, сравнивая выражения v и vб), находим, что скорость реакции возрастает в 27 раз
в) При увеличении концентрации NO в 3 раза скорость реакции будет равна:
Cравнивая выражения v и vв), находим, что скорость реакции возрастает в 9 раз
Ответ: а) возрастёт в 27 раз; б) возрастёт в 27 раз; в) возрастёт в 9 раз.
Задача 333.
Две реакции протекают при 25 °С с одинаковой скоростью. Температурный коэффициент скорости первой реакции равен 2,0, а второй 2,5. Найти отношение скоростей этих реакций при 95°С.
Решение:
Зависимость скорости реакции (или константы скорости реакции) от температуры может быть выражена уравнением:
Здесь vt и kt — скорость и константа скорости реакции при температуре t °С; v(t + 10) и k(t + 10) те же величины при температуре (t + 10 °С); — температурный коэффициент скорости реакции, значение которого для большинства реакций лежит в пределах 2 — 4 (правило Вант-Гоффа). В общем случае, если температура изменилась на 95 °С, последнее уравнение преобразуется к виду:
Поскольку t = 70 °С (95 – 25 = 75), то, скорость реакции равна:
Скорость второй реакции равна:
Найдём отношение этих скоростей:
Ответ:
Задача 334.
Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 30 градусов скорость реакции возрастает в 15,6 раза?
Решение:
Согласно правилу Вант Гоффа зависимость скорости реакции от температуры выражается уравнением:
vt и kt — скорость и константа скорости реакции при температуре t °С; v(t + 10) и k(t + 10) те же величины при температуре (t + 10 °С); — температурный коэффициент скорости реакции, значение которого для большинства реакций лежит в пределах 2 – 4. Поскольку t = 30 °С, то, подставив в уравнение Вант-Гоффа значения по условию задачи, рассчитаем температурный коэффициент скорости реакции:
Ответ: 2,5.
Задача 335.
Температурный коэффициент скорости некоторой реакции равен 2,3. Во сколько раз увеличится скорость этой реакции, если повысить температуру на 25 градусов?
Решение:
Согласно правилу Вант Гоффа зависимость скорости реакции от температуры выражается уравнением:
vt и kt — скорость и константа скорости реакции при температуре t °С; v(t + 10) и k(t + 10) те же величины при температуре (t + 10 °С); — температурный коэффициент скорости реакции, значение которого для большинства реакций лежит в пределах 2 – 4. Поскольку t = 25 °С, то, обозначив скорость начальной реакции и скорость реакции при повышении температуры системы на 25 градусов соответственно через v и v’, можем записать:
Задачи с использованием закона Вант-Гоффа
Пример 1
Как изменится скорость гомогенной реакции при повышении температуры от 67 0 до 97 0 при температурном коэффициенте, равном четырём?
Решение
Запишем формулу закона Вант-Гоффа:
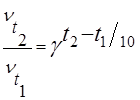
Подставим известные данные: 
Пример 2
Рассчитайте, чему равен температурный коэффициент скорости, если известно, что при понижении температуры от 150 0 до 120 0 скорость реакции уменьшилась в 27 раз.
Решение
Запишем формулу закона Вант-Гоффа
и выразим из неё 



где t2=120, t1=150 (температура понижается ), а 
______
СОВЕТ: помните, что значение 
1.2.3 Задачи с использованием закона объёмных отношений
Формулировка закона: если в реакцию вступают газообразные вещества и такие же вещества образуются в результате реакции, то их обёмы относятся друг к другу как небольшие целые числа, равные стехиометрическим коэффициентам в уравнении реакции перед формулами этих веществ. Например, для гомогенной реакции aA + bB = cC + dDформула будет выглядеть следующим образом:
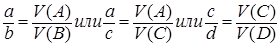
Этот закон относится к основным законам химии и может быть использован в химической кинетике применительно к концентрации.
Пример 1
Реакция идет по уравнению 2Н2(г)+O2(г)=2Н2O(г). Концентрации исходных веществ до начала реакции были [Н2]=0,06 моль/л, [O2]=0,02 моль/л. вычислите концентрации этих веществ в момент, когда [Н2O]=0,01 моль/л.
Решение
В этой реакции Н2(г) и O2(г) относятся к исходным веществам, концентрация которых с течением времени уменьшается по мере того, как эти вещества расходуются, а Н2O(г) – к продуктам реакции, концентрация которых с течением времени увеличивается по мере того, как эти вещества образуются. Из закона объёмных отношений следует, что один объём О2 взаимодействует с двумя объёмами Н2и при этом образуется два объёма Н2O, т. е. если получается 0,01 моль/л Н2O, то расходуется столько же Н2 и в два раза меньше О2. В виде формулы это можно записать следующим образом:

где обр-образованное и изр-израсходованное;

Таким образом концентрации этих веществ в момент, когда [Н2O]=0,01 моль/л будет равна: [H2]=[H2]нач-[H2]изр=0,06-0,01=0,05моль/л и [O2]=[O2]нач-[O2]изр=0,02-0,005=0,015 моль/л (где нач- начальная концентрация веществ).
Пример 2
До начала реакции концентрации исходных веществ в гомогенной системе K+2L=3M+Fбыли равны: [K]=0,5 моль/л, [L]=0,12 моль/л. Найдите концентрации всех веществ на тот момент времени, когда концентрация Lуменьшилась в три раза.
Решение
При уменьшении концентрации Lв три раза, на данный момент времени она будет равна [L] = [L]нач / 3 = 0,12 / 3 =0,4 моль/л. Следовательно, в ходе реакции израсходовалось некоторое количество вещества L:[L]изр = [L]нач-[L] = 0,12 – 0,4 = 0,8 моль/л. В случае определения концентрации вещества К следует помнить, что вещество Lне расходуется само по себе, а вступает в реакцию с К в соотношении 2 к 1,т. е. 
Значит, на данный момент времени концентрация вещества Кбудет равна [К] = [К]нач — [К]изр = 0,5 – 0,4.= 0,1 моль/л. Также по закону объёмных отношений можно найти и концентрации образованных веществ MиF:
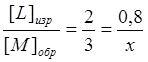
Концентрацию вещества F можно найти таким же образом по концентрации K или L, а можно и полученной концентрации М:

Поскольку не были даны исходные концентрации этих веществ, то мы можем считать, что начальная концентрация продуктов реакции равна нулю. Следовательно, на тот момент времени, когда концентрация Lуменьшилась в три раза, концентрации других веществ будут равны: [К] = 0,1 моль/л;[M] = 0,12 моль/л; [F] =0,4 моль/л.
______
СОВЕТ: в формулу закона необходимо подставлять не начальные или конечные концентрации для исходных веществ, а именно израсходованные, прореагировавшие.
2 Химическое равновесие
В химических реакциях исходные вещества не всегда полностью превращаются в продукты реакции. Это происходит потому, что по мере накопления продуктов реакции могут создаваться условия для протекания обратимой реакции в противоположном направлении. Например, если смешать пары иода с водородом при температуре 200°С, то произойдет реакция:
Однако известно, что йодистый водород уже при нагревании до 180 °С начинает разлагаться на иод и водород:

Понятно, что в этих условиях не произойдет ни полного разложения НI, так как продукты реакции способны вновь реагировать между собой, ни полного образования йодистого водорода.
Основные понятия и законы
Обратимаяхимическая реакция – это реакция, в ходе которой происходят превращения как в прямом, так и в обратном направлениях, Первым, кто четко сформулировал представление об обратимости химических реакций, был К.Бертолле (1799). Участвуя в Египетской экспедиции Бонапарта, он обратил внимание на образование карбоната натрия в соляных озерах и пришел к заключению, что карбонат натрия образуется в результате взаимодействия между насыщенным раствором хлорида натрия и растворенным карбонатом кальция. Этот процесс обратен проводимой в лаборатории реакции между карбонатом натрия и растворенным хлоридом кальция с образованием карбоната кальция.
При написании уравнений обратимых реакций вместо знака равенства ставят две противоположно направленные стрелки. Уравнение рассмотренной выше обратимой реакции запишется следующим образом:
Реакцию, протекающую слева направо, называют прямой (константа скорости прямой реакции k1), справа налево — обратной (константа скорости обратной реакции k2).
В обратимых реакциях скорость прямой реакции вначале имеет максимальное значение, а затем уменьшается вследствие уменьшения концентрации исходных веществ, расходуемых на образование продуктов реакции. И наоборот, обратная реакция в начальный момент имеет минимальную скорость, которая увеличивается по мере увеличения концентрации продуктов реакции. Следовательно, скорость прямой реакции уменьшается, а обратной — увеличивается. Наконец, наступает такой момент, когда скорости прямой и обратной реакций становятся равными.
Рисунок 4 — График изменения скоростей прямой и обратной реакций во времени 1


Рисунок 5 — График изменения скоростей прямой и обратной реакций во времени 2
Химическое равновесие — состояние системы, в котором скорость прямой реакции (V1) равна скорости обратной реакции (V2). При химическом равновесии концентрации веществ остаются неизменными. Химическое равновесие имеет динамический характер: прямая и обратная реакции при равновесии не прекращаются. Положение равновесия можно определить, зная скорости прямой и обратной реакций. Уравнение обратимой реакции имеет вид
согласно закону действующих масс, скорости прямой реакции u1 и обратной u2 соответственно запишутся следующим образом:
В равновесии скорости прямой и обратной реакций равны:
Состояние химического равновесия количественно характеризуется константой равновесия, представляющей собой отношение констант прямой (K1) и обратной (K2) реакций. Преобразуем эту формулу и получим:
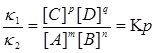
Константа равновесия зависит от температуры и природы реагирующих веществ. Чем больше константа равновесия, тем больше равновесие сдвинуто в сторону образования продуктов прямой реакции, т. е. численное значение константы равновесия характеризует тенденцию к осуществлению реакции или, другими словами, характеризует выход данной реакции. Так, при К >> 1 выход реакции велик (равновесие смещено в сторону прямой реакции ), так как при этом
http://buzani.ru/zadachi/khimiya-glinka/1138-izmenenie-skorosti-reaktsii-zadachi-373
http://lektsii.org/5-34914.html
From Wikipedia, the free encyclopedia
A temperature coefficient describes the relative change of a physical property that is associated with a given change in temperature. For a property R that changes when the temperature changes by dT, the temperature coefficient α is defined by the following equation:
Here α has the dimension of an inverse temperature and can be expressed e.g. in 1/K or K−1.
If the temperature coefficient itself does not vary too much with temperature and 
where ΔT is the difference between T and T0.
For strongly temperature-dependent α, this approximation is only useful for small temperature differences ΔT.
Temperature coefficients are specified for various applications, including electric and magnetic properties of materials as well as reactivity. The temperature coefficient of most of the reactions lies between −2 and 3.
Negative temperature coefficient[edit]
Most ceramics exhibit negative temperature dependence of resistance behaviour. This effect is governed by an Arrhenius equation over a wide range of temperatures:
where R is resistance, A and B are constants, and T is absolute temperature (K).
The constant B is related to the energies required to form and move the charge carriers responsible for electrical conduction – hence, as the value of B increases, the material becomes insulating. Practical and commercial NTC resistors aim to combine modest resistance with a value of B that provides good sensitivity to temperature. Such is the importance of the B constant value, that it is possible to characterize NTC thermistors using the B parameter equation:
where 

Therefore, many materials that produce acceptable values of 
Materials with a negative temperature coefficient have been used in floor heating since 1971. The negative temperature coefficient avoids excessive local heating beneath carpets, bean bag chairs, mattresses, etc., which can damage wooden floors, and may infrequently cause fires.
Reversible temperature coefficient[edit]
Residual magnetic flux density or Br changes with temperature and it is one of the important characteristics of magnet performance. Some applications, such as inertial gyroscopes and traveling-wave tubes (TWTs), need to have constant field over a wide temperature range. The reversible temperature coefficient (RTC) of Br is defined as:
To address these requirements, temperature compensated magnets were developed in the late 1970s.[1] For conventional SmCo magnets, Br decreases as temperature increases. Conversely, for GdCo magnets, Br increases as temperature increases within certain temperature ranges. By combining samarium and gadolinium in the alloy, the temperature coefficient can be reduced to nearly zero.
Electrical resistance[edit]
The temperature dependence of electrical resistance and thus of electronic devices (wires, resistors) has to be taken into account when constructing devices and circuits. The temperature dependence of conductors is to a great degree linear and can be described by the approximation below.
where

That of a semiconductor is however exponential:
where 


For both, 
This property is used in devices such as thermistors.
Positive temperature coefficient of resistance[edit]
A positive temperature coefficient (PTC) refers to materials that experience an increase in electrical resistance when their temperature is raised. Materials which have useful engineering applications usually show a relatively rapid increase with temperature, i.e. a higher coefficient. The higher the coefficient, the greater an increase in electrical resistance for a given temperature increase. A PTC material can be designed to reach a maximum temperature for a given input voltage, since at some point any further increase in temperature would be met with greater electrical resistance. Unlike linear resistance heating or NTC materials, PTC materials are inherently self-limiting. On the other hand, NTC material may also be inherently self-limiting if constant current power source is used.
Some materials even have exponentially increasing temperature coefficient. Example of such a material is PTC rubber.
Negative temperature coefficient of resistance[edit]
A negative temperature coefficient (NTC) refers to materials that experience a decrease in electrical resistance when their temperature is raised. Materials which have useful engineering applications usually show a relatively rapid decrease with temperature, i.e. a lower coefficient. The lower the coefficient, the greater a decrease in electrical resistance for a given temperature increase. NTC materials are used to create inrush current limiters (because they present higher initial resistance until the current limiter reaches quiescent temperature), temperature sensors and thermistors.
Negative temperature coefficient of resistance of a semiconductor[edit]
An increase in the temperature of a semiconducting material results in an increase in charge-carrier concentration. This results in a higher number of charge carriers available for recombination, increasing the conductivity of the semiconductor. The increasing conductivity causes the resistivity of the semiconductor material to decrease with the rise in temperature, resulting in a negative temperature coefficient of resistance.
Temperature coefficient of elasticity[edit]
The elastic modulus of elastic materials varies with temperature, typically decreasing with higher temperature.
Temperature coefficient of reactivity[edit]
In nuclear engineering, the temperature coefficient of reactivity is a measure of the change in reactivity (resulting in a change in power), brought about by a change in temperature of the reactor components or the reactor coolant. This may be defined as
Where 



In water moderated nuclear reactors, the bulk of reactivity changes with respect to temperature are brought about by changes in the temperature of the water. However each element of the core has a specific temperature coefficient of reactivity (e.g. the fuel or cladding). The mechanisms which drive fuel temperature coefficients of reactivity are different from water temperature coefficients. While water expands as temperature increases, causing longer neutron travel times during moderation, fuel material will not expand appreciably. Changes in reactivity in fuel due to temperature stem from a phenomenon known as doppler broadening, where resonance absorption of fast neutrons in fuel filler material prevents those neutrons from thermalizing (slowing down).[5]
Mathematical derivation of temperature coefficient approximation[edit]
In its more general form, the temperature coefficient differential law is:
Where is defined:
And 

Integrating the temperature coefficient differential law:
Applying the Taylor series approximation at the first order, in the proximity of 
Units[edit]
The thermal coefficient of electrical circuit parts is sometimes specified as ppm/°C, or ppm/K. This specifies the fraction (expressed in parts per million) that its electrical characteristics will deviate when taken to a temperature above or below the operating temperature.
See also[edit]
- Microbolometer (used to measure TCRs)
References[edit]
- ^ «About Us». Electron Energy Corporation. Archived from the original on October 29, 2009.
- ^ Kasap, S. O. (2006). Principles of Electronic Materials and Devices (Third ed.). Mc-Graw Hill. p. 126.
- ^ Alenitsyn, Alexander G.; Butikov, Eugene I.; Kondraryez, Alexander S. (1997). Concise Handbook of Mathematics and Physics. CRC Press. pp. 331–332. ISBN 0-8493-7745-5.
- ^ Duderstadt & Hamilton 1976, pp. 259–261
- ^ Duderstadt & Hamilton 1976, pp. 556–559
Bibliography[edit]
- Duderstadt, Jame J.; Hamilton, Louis J. (1976). Nuclear Reactor Analysis. Wiley. ISBN 0-471-22363-8.









































![{displaystyle operatorname {rho } (T)=rho _{0}left[1+alpha _{0}left(T-T_{0}right)right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e6592d9ec18d3c1c33ee3448336a1565d9e83754)
![{displaystyle alpha _{0}={frac {1}{rho _{0}}}left[{frac {delta rho }{delta T}}right]_{T=T_{0}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/83381dbf76253a0bb27a4650c45381c6d49ef947)





