Решение.
Т = (273 + 27) К = 300 К.
Температура газа связана с средней кинетической энергией движения молекулы соотношением:
[ {{E}_{K}}=frac{i}{2}cdot kcdot T (1). ]
Где: к – постоянная Больцмана, к = 1,38∙10-23 Дж/К, i – количество степеней свободы.
Определим среднее значение кинетической энергии вращательного движения всех молекул водорода (вращательному движению для двухатомной молекулы водорода соответствует количество степеней свободы i = 2)
[ begin{align}
& {{E}_{K}}({{H}_{2}})=Ncdot frac{2}{2}cdot kcdot T(2),N=frac{m}{M}cdot {{N}_{A}}(3),{{E}_{K}}({{H}_{2}})=frac{m}{M}cdot {{N}_{A}}cdot kcdot T(4). \
& {{E}_{K}}({{H}_{2}})=frac{0,2cdot {{10}^{-3}}}{2cdot {{10}^{-3}}}cdot 6,02cdot {{10}^{23}}cdot 1,38cdot {{10}^{-23}}cdot 300=249,228. \
end{align} ]
Где: N – количество всех молекул, M – молярная масса молекулы водорода, М(Н2) = 2∙10-3 кг/моль, NА число Авогадро, NА = 6,02∙1023 моль-1.
Ответ: 249,228 Дж.
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,662 -
гуманитарные
33,654 -
юридические
17,917 -
школьный раздел
611,985 -
разное
16,906
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
где
k
— постоянная
Больцмана.
Средняя кинетическая
энергия молекулы с жесткими связями,
включающая кинетическую энергию
поступательного и вращательного
движения, выражается
где
i
— число степеней
свободы молекулы (поступательных и
вращательных).
.
Зависимость
давления газа p
от высоты
h в гравитационном
поле (барометрическое распределение)
где
po
— давление
газа на высоте, условно принятой за
начало отсчета (h=0),
mo
— масса
молекулы газа,
— молярная
масса, T
– температура газа.
где
то
—
масса одной молекулы.
.
и
.
.
.
.
где
Q—теплота,
сообщенная системе (газу);
U
—
изменение внутренней
энергии системы; А
— работа, совершенная
системой против внешних сил.
где
=Ср/СV—показатель
адиабаты.
Уравнения Пуассона,
связывающие параметры идеального газа
при адиабатическом процессе:
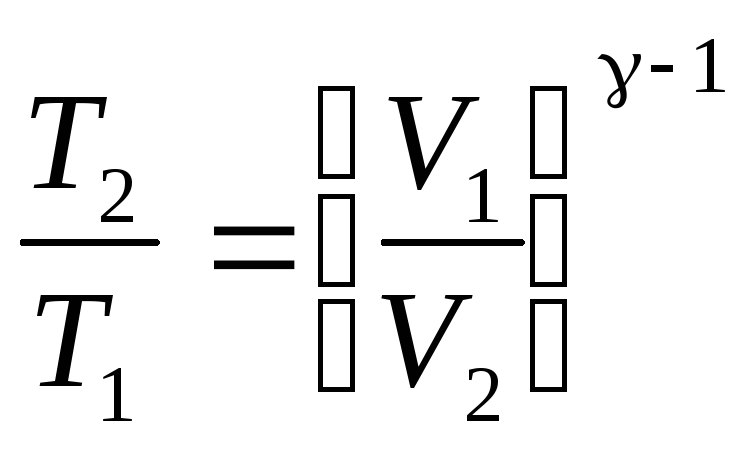
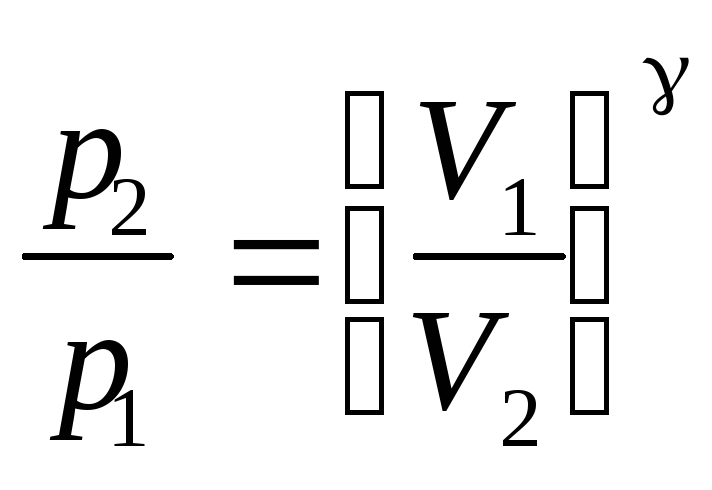

где
Q1
— теплота, полученная
рабочим телом от теплоотдатчика
(нагревателя);
Q2
— теплота, переданная
рабочим телом теплоприемнику
(холодильнику),
T1
и T2—термодинамические
температуры теплоотдатчика и
теплоприемника.
Изменение энтропии
при переходе системы из состояния 1 в
состояние 2 определяется формулой
где
dQ
—
элементарное количество теплоты,
полученное или переданное системе в
каком-либо процессе, T
— температура
системы при
этом процессе.
где
<v>
—
средняя арифметическая
скорость молекул,
<z>
—
среднее число столкновений молекулы в
единицу времени, d
—
эффективный диаметр
молекулы, n
—
число молекул в единице объема
(концентрация молекул).
где
F —
сила поверхностного натяжения, действующая
на контур l,
ограничивающий поверхность жидкости;
E
— изменение свободной
энергии поверхностной пленки жидкости,
связанное с изменением площади S
поверхности этой пленки.
Формула
Лапласа, выражающая давление р,
создаваемое сферической поверхностью
жидкости,
где
R
— радиус сферической
поверхности.
где
— краевой угол
(=0
при полном смачивании стенок трубки
жидкостью;
=
при полном несмачивании),
R—радиус
канала трубки;
— плотность жидкости,
g
— ускорение
свободного падения.
Высота подъема
жидкости между двумя близкими и
параллельными друг другу плоскостями
где
d
— расстояние
между плоскостями.
Определить
количество вещества
v
и число N
молекул кислорода
массой т=0,5
кг.
Сколько
атомов содержится в ртути:
1) количеством
вещества
v=0,2
моль; 2)
массой т=1
г?
Вода
при температуре t=4°С
занимает объем V=1
см3.
Определить количество вещества
v
и число N
молекул воды.
Найти
молярную массу
и массу тo
одной молекулы поваренной соли.
Определить
массу тo
одной молекулы углекислого газа.
Определить
концентрацию п
молекул кислорода, находящегося в
сосуде вместимостью V=2
л.
Количество вещества
v
кислорода равно
0,2 моль.
Определить
количество вещества
v
водорода,
заполняющего сосуд
объемом V=3
л, если концентрация молекул газа в
сосуде n
=21018
м3.
В
баллоне вместимостью V=3
л содержится кислород
массой т=10
г. Определить концентрацию n
молекул газа.
Плотность
газа
при давлении p=96
кПа и температуре
t=0°C
равна 1,35
г/л. Найти молярную массу
газа.
Определить
количество вещества
v
и число N
молекул азота массой m=0,2
кг.
В
цилиндр длиной
l=1,6
м, заполненный
воздухом при нормальном атмосферном
давлении ро
начали медленно вдвигать поршень
площадью основания
S=200
см3.
Определить силу
F,
действующую на поршень, если его
остановить на расстоянии l1=10
см от дна цилиндра.
В
баллоне находится газ при температуре
Т1=400
К. До какой температуры Т2
надо нагреть газ, чтобы его давление
увеличилось в
1,5 раза?
Баллон
вместимостью V=20
л
заполнен азотом
при температуре T=400
К. Когда часть газа
израсходовали, давление в баллоне
понизилось на р=200
кПа. Определить
массу m
израсходованного газа. Процесс считать
изотермическим.
В
баллоне вместимостью V=15
л находится аргон
под давлением p1=600
кПа и при температуре
Т1=300
К. Когда из баллона было взято некоторое
количество газа, давление в баллоне
понизилось до p2=400
кПа, а температура
установилась Т2=260
К. Определить массу
m
аргона, взятого из баллона.
Два
сосуда одинакового объема содержат
кислород. В одном сосуде давление р1=2
МПа
и температура T1=800
K, в другом р2=2,5
МПа,
T2=200
К. Сосуды соединили трубкой и охладили
находящийся в них кислород до температуры
T=200
К. Определить
установившееся в сосудах давление р.
Вычислить
плотность
азота, находящегося в баллоне под
давлением р=2
МПа и имеющего
температуру Т=400
К.
Определить
относительную молекулярную массу
Mr
газа, если при температуре Т=154
К и давлении р=2,8
МПа он имеет плотность =6,1
кг/м3.
Найти
плотность
азота при температуре Т=400
К и давлении р=2
МПа.
В
сосуде вместимостью
V=40
л находится кислород
при температуре Т=300
К. Когда часть газа израсходовали,
давление в баллоне понизилось на р=100
кПа. Определить массу
m
израсходованного кислорода. Процесс
считать изотермическим.
Определить
плотность
водяного пара, находящегося под давлением
р=2,5
кПа и имеющего температуру Т=250
К.
Определить
внутреннюю энергию
U
водорода, а также среднюю кинетическую
энергию
молекулы этого газа при температуре
Т=300
К, если количество вещества
v
этого газа равно
0,5 моль.
Определить
суммарную кинетическую энергию Ek
поступательного движения всех молекул
газа, находящегося в сосуде вместимостью
V=3
л под давлением
р=540
кПа.
Количество
вещества гелия
v=l,5
моль, температура
Т=120
К. Определить суммарную кинетическую
энергию Ek
поступательного движения всех молекул
этого газа.
Молярная
внутренняя энергия
Um
некоторого двухатомного газа равна
6,02 кДж/моль. Определить
среднюю кинетическую энергию вр
вращательного движения одной молекулы
этого газа. Газ считать идеальным.
Определить
среднюю кинетическую энергию
одной молекулы
водяного пара при температуре
Т=500
К.
Определить
среднюю квадратичную скорость vкв
молекулы газа,
заключенного в сосуд вместимостью V=2
л под давлением р=200
кПа. Масса газа m=0,3
г.
Водород
находится при температуре Т=300
К. Найти среднюю
кинетическую энергию вр
вращательного движения одной молекулы,
а также суммарную кинетическую энергию
Ek
всех молекул этого газа; количество
водорода
v=0,5
моль.
При
какой температуре средняя кинетическая
энергия п
поступательного движения молекулы
газа равна
4,1410-21
Дж?
В
азоте взвешены мельчайшие пылинки,
которые движутся так, как если бы они
были очень крупными молекулами. Масса
каждой пылинки равна
610-10
г. Газ находится при температуре Т=400
К. Определить средние квадратичные
скорости vкв,
а также средние кинетические энергии
п
поступательного движения молекулы
азота и пылинки.
Определить
среднюю кинетическую энергию п
поступательного движения и вр
вращательного движения молекулы азота
при температуре Т=1
К.
Определить также полную кинетическую
энергию Ek
молекулы при тех же условиях.
Определить
молярную массу
двухатомного газа
и его удельные теплоемкости cp
и cV,
если известно, что разность
удельных теплоемкостей этого газа
cp—cV
равна 260
Дж/(кгК).
Найти
удельные cV
и cp,
а также молярные СV
и Сp
теплоемкости углекислого газа.
Определить
показатель адиабаты
идеального газа, который при температуре
Т=350
К и
давлении р=0,4
МПа занимает объем V=300
л и имеет теплоемкость СV=857
Дж/К.
В
сосуде вместимостью V=6
л находится при
нормальных условиях двухатомный газ.
Определить теплоемкость СV
этого газа при постоянном объеме.
Определить
относительную молекулярную массу Mr
и молярную массу
газа, если разность его удельных
теплоемкостей cp—cV=2,08
кДж/(кгК).
Определить
молярные теплоемкости газа, если его
удельные теплоемкости cV=10,4
кДж/(кгК)
и cp=14,6
кДж/(кгК).
Найти
удельные cV
и cp
и молярные CV
и Cp
теплоемкости азота
и гелия.
Вычислить
удельные теплоемкости газа, зная, что
его молярная масса
=410-3
кг/моль и отношение молярных теплоемкостей
Ср/СV=1,67.
Трехатомный
газ под давлением р=240
кПа
и температуре t=20°С
занимает объем V=10
л. Определить теплоемкость Ср
этого газа при постоянном давлении.
Одноатомный
газ при нормальных условиях занимает
объем V=5
л. Вычислить теплоемкость СV
этого газа при
постоянном объеме.
Найти
среднее число z
столкновений за время t=1
с и
длину свободного пробега
l
молекулы гелия, если газ находится под
давлением р=2
кПа при температуре
Т=200
К.
Определить
среднюю длину свободного пробега l
молекулы азота в
сосуде вместимостью V=5
л.
Масса газа т=0,5
г.
Водород
находится под давлением р=20
мкПа и имеет
температуру Т=300
К. Определить среднюю длину свободного
пробега l
молекулы такого газа.
При
нормальных условиях длина свободного
пробега l
молекулы водорода равна
0,160 мкм. Определить
диаметр d
молекулы водорода.
Какова
средняя арифметическая скорость молекул
кислорода при нормальных условиях,
если известно, что средняя длина
свободного пробега
l
молекулы кислорода при этих условиях
равна 100
нм?
Кислород
находится под давлением р=133
нПа при температуре
Т=200 К. Вычислить
среднее число z
столкновений молекулы кислорода при
этих условиях за время t=1
с.
При
каком давлении р
средняя длина свободного пробега
l
молекул азота равна
1 м, если температура
газа t=10°С?
В
сосуде вместимостью V=5
л находится водород
массой m=0,5
г. Определить среднюю длину свободного
пробега l
молекулы водорода
в этом сосуде.
Средняя
длина свободного пробега
l
молекулы водорода при некоторых условиях
равна 2
мм. Найти плотность
водорода при этих
условиях.
В
сферической колбе вместимостью V=3
л, содержащей азот,
создан вакуум с давлением р=80
мкПа. Температура газа Т=250
К. Можно ли считать вакуум в колбе
высоким? Вакуум считается высоким, если
длина свободного пробега молекул в нем
много больше линейных размеров сосуда.
Определить
количество теплоты
Q, которое надо
сообщить кислороду объемом
V=50
л и массой 1 моль при его изохорическом
нагревании, чтобы давление газа
повысилось на
p=0,5
Мпа
При
изотермическом расширении азота при
температуре Т=280
К объем его увеличился
в два раза. Определить:
1) совершенную при
расширении газа работу А,
2) изменение
U
внутренней энергии;
3) количество теплоты
Q, полученное газом.
Масса азота m=0,2
кг.
При
адиабатическом сжатии давление воздуха
было увеличено от р1=50
кПа до р2=0,5
МПа. Затем при
неизменном объеме температура воздуха
была понижена до первоначальной.
Определить давление р3
газа в конце процесса.
Кислород
массой m=200
г занимает объем
V1=100
л и находится под
давлением р1=200
кПа. При нагревании
газ расширился при постоянном давлении
до объема V2=300
л, а затем его
давление возросло до р2=500
кПа при неизменном
объеме. Найти изменение внутренней
энергии U
газа, совершенную газом работу А
и теплоту Q,
переданную газу. Построить график
процесса.
Объем
водорода при изотермическом расширении
при температуре Т=300
К
увеличился в п=3
раза. Определить работу А,
совершенную газом, и теплоту
Q,
полученную при
этом. Масса т
водорода равна
200 г.
Азот
массой m=0,1
кг был изобарически нагрет от температуры
Т1=200
К до температуры Т2=400
К. Определить работу А,
совершенную газом, полученную газом
теплоту Q
и изменение
U
внутренней энергии азота.
Во
сколько раз увеличится объем водорода,
содержащий количество вещества
v=0,4
моль при изотермическом расширении,
если при этом газ получит количество
теплоты Q=800
Дж? Температура водорода Т=300
К.
Какая
работа А
совершается при изотермическом
расширении водорода массой m=5
г, взятого при
температуре Т=290
К, если объем газа
увеличивается в три раза?
Какая
доля w1
количества теплоты
Q,
подводимого к идеальному двухатомному
газу при изобарическом процессе,
расходуется на увеличение
U
внутренней энергии газа и какая доля
w2
— на работу А
расширения? Рассмотреть три случая,
если газ: 1)
одноатомный; 2)
двухатомный;
3) трехатомный.
Определить
работу А,
которую совершит азот, если ему при
постоянном давлении сообщить количество
теплоты Q=21
кДж. Найти также изменение
U
внутренней энергии газа.
Идеальный
газ совершает цикл Карно при температурах
теплоприемника Т2=290
К и теплоотдатчика Т1=400
К. Во сколько раз увеличится коэффициент
полезного действия
цикла, если температура теплоотдатчика
возрастет до T1,1=600
К?
Идеальный
газ совершает цикл Карно. Температура
Т1
теплоотдатчика
в четыре раза (n=4)
больше температуры теплоприемника.
Какую долю w
количества теплоты, полученного за
один цикл от теплоотдатчика, газ отдаст
теплоприемнику?
Определить
работу A2
изотермического сжатия газа, совершающего
цикл Карно, КПД которого =0,4,
если работа
изотермического расширения равна A1=8
Дж.
Найти
изменение энтропии 1 кг льда находящегося
при температуре 0оС.
Найти
изменение энтропии при изобарическом
расширении 8 г
гелия от объема
V1=10
л до V2=25
л.
Найти
изменение энтропии при изотермическом
расширении 6 г
водорода
от 105
Па до 0,5105
Па.
Во
сколько раз увеличится коэффициент
полезного действия
цикла Карно при
повышении температуры теплоотдатчика
от Т1=380
К до Т1,1=560
К? Температура теплоприемника Т2=280
К.
Идеальная
тепловая машина работает по циклу
Карно. Температура теплоотдатчика
Т1=500
К, температура теплоприемника Т2=250
К. Определить термический КПД
цикла, а также работу A1
рабочего вещества при изотермическом
расширении, если при изотермическом
сжатии совершена работа A2=70
Дж.
Газ,
совершающий цикл Карно, получает теплоту
Q1=84
кДж.
Определить работу
А
газа, если температура
Т1
теплоотдатчика в три раза выше температуры
Т2
теплоприемника.
В
цикле Карно газ получил от теплоотдатчика
теплоту Q1=500
Дж
и совершил работу
А=100
Дж. Температура теплоотдатчика
Т1=400
К. Определить температуру Т2
теплоприемника.
Найти
массу m
воды, вошедшей в стеклянную трубку с
диаметром канала d=0,8
мм, опущенную в воду
на малую глубину. Считать смачивание
полным.
Какую
работу А
надо совершить при выдувании мыльного
пузыря, чтобы увеличить его объем от
V1=8
см-3
до V2=16
см-3?
Считать процесс изотермическим.
Какая
энергия Е
выделится при слиянии двух капель ртути
диаметром d1=0,8
мм и
d2=1,2
мм в одну каплю?
Определить
давление р
внутри воздушного пузырька диаметром
d=4
мм, находящегося в воде у самой ее
поверхности. Считать атмосферное
давление нормальным.
Пространство
между двумя стеклянными параллельными
пластинками с площадью поверхности
S=100
см2
каждая, расположенными
на расстоянии l=20
мкм друг от друга, заполнено водой.
Определить силу
F,
прижимающую пластинки друг к другу.
Считать мениск вогнутым с диаметром
d,
равным расстоянию между пластинками.
Глицерин
поднялся в капиллярной трубке диаметром
канала d=1
мм на высоту
h=20
мм. Определить поверхностное натяжение
глицерина. Считать смачивание полным.
В воду
опущена на очень малую глубину стеклянная
трубка с диаметром канала
d=1
мм. Определить массу т
воды, вошедшей в трубку.
На
сколько давление р
воздуха внутри мыльного пузыря больше
нормального атмосферного давления ро,
если диаметр пузыря
d=5
мм?
Воздушный
пузырек диаметром
d=2,2
мкм находится в воде у самой ее
поверхности. Определить плотность
воздуха в пузырьке, если воздух над
поверхностью воды находится при
нормальных условиях.
Две
капли ртути радиусом r=1,2
мм каждая слились
в одну большую каплю. Определить энергию
Е, которая
выделится при этом слиянии. Считать
процесс изотермическим.
Определить
давления р1
и р2
газа, содержащего N=109
молекул и имеющего объем
V=1
см-3,
при температурах T1=З
К и T2=1000
К.
При
температуре t=35°С
и давлении р=708
кПа плотность некоторого газа =12,2
кг/м3.
Определить относительную молекулярную
массу Mr
газа.
Какой
объем V
занимает смесь азота массой т1=1
кг и гелия массой т2=1
кг при нормальных условиях?
В
баллоне вместимостью V=15
л находится смесь,
содержащая
m1=10
г водорода, m2=54
г водяного пара и
m3=60
г оксида углерода. Температура смеси
t=27°С.
Определить
давление.
Найти
полную кинетическую энергию, а также
кинетическую энергию вращательного
движения одной молекулы аммиака NH3
при температуре
t=27°C.
Определить
удельные теплоемкости cV
и cp
газообразного оксида углерода СО.
Смесь
газа состоит из кислорода
О2
с массовой долей
w1=85%
и озона О3
с массовой долей
w2=15%.
Определить
удельные теплоемкости cV
и cp
этой газовой смеси.
Газовая
смесь состоит из азота массой
т1=3
кг и водяного пара
массой т2=1
кг. Принимая эти газы за идеальные,
определить удельные теплоемкости cV
и cp
газовой смеси.
Молекула
газа состоит из двух атомов; разность
удельных теплоемкостей газа при
постоянном давлении и постоянном объеме
равна 260
Дж/(кгК).
Найти молярную массу газа и его удельные
теплоемкости cV
и cp.
Найти
среднюю длину
<l>
свободного пробега молекулы водорода
при р=133
мПа и t=-173°С.
Один
киломоль двухатомного идеального газа
совершает замкнутый цикл, график
которого в координатах p,V
представляет собой
прямоугольник Координаты вершин данного
прямоугольника равны: p1=1,2
МПа, V1=2
м3
;
p2=1,6
МПа, V2=2
м3
;
p3=1,6
МПа, V3=3
м3
;
p4=1,2
МПа, V4=3
м3
.
Изобразить процесс на рисунке. Определить:
1) теплоту
Q1,
полученную от теплоотдатчика;
2) теплоту
Q2,
переданную теплоприемнику;
3) работу А,
совершаемую газом за один цикл;
4) термический КПД
цикла.
Водород
занимает объем V=10
м3
при давлении р1=0,1
МПа. Его нагрели при постоянном объеме
до давления р2=0,З
МПа. Определить изменение
U
внутренней энергии газа, работу А,
совершенную газом, и теплоту
Q, сообщенную газу.
Кислород
при неизменном давлении р=80
кПа нагревается.
Его объем увеличивается от
V1=1
м3
до V2=3
м3.
Определить изменение U
внутренней энергии кислорода, работу
А,
совершенную им при расширении, а также
теплоту Q,
сообщенную газу.
В
цилиндре под поршнем находится азот,
имеющий массу
m=0,6
кг и занимающий объем
V1=1,2
м3,
при температуре
T1=560
К. В результате нагревания газ расширился
и занял объем
V2=4,2
м3,
причем температура осталась неизменной.
Найти изменение
U
внутренней энергии газа, совершенную
им работу А
и теплоту Q,
сообщенную газу.
В
бензиновом автомобильном двигателе
степень сжатия горючей смеси равна
6,2. Смесь засасывается
в цилиндр при температуре t1=15°С.
Найти температуру t2
горючей смеси в конце такта сжатия.
Горючую смесь рассматривать как
двухатомный идеальный газ, процесс
считать адиабатическим.
Найти
изменение энтропии при превращении 10
г льда находящегося при температуре
-20оС
в пар при 100оС.
Какую
энергию надо затратить, чтобы выдуть
мыльный пузырь
диаметром
d=12
см? Каково будет добавочное давление
внутри этого пузыря?
На
нижнем конце трубки диаметром d=0,2
см повисла шарообразная
капля воды. Найти диаметр этой капли.
В
сосуд с ртутью частично погружены две
вертикально расположенные и параллельные
друг другу стеклянные пластинки.
Расстояние между пластинками d=1
мм. Определить разность h
уровней ртути в сосуде и между пластинками,
краевой угол принять равным 138°.
Определите среднюю кинетическую энергию и скорость одной молекулы водорода, масса которой 3, 4 * 10 в минус 27 степени кг при температуре 227 градусов С.
Вы перешли к вопросу Определите среднюю кинетическую энергию и скорость одной молекулы водорода, масса которой 3, 4 * 10 в минус 27 степени кг при температуре 227 градусов С?. Он относится к категории Физика,
для 10 — 11 классов. Здесь размещен ответ по заданным параметрам. Если этот
вариант ответа не полностью вас удовлетворяет, то с помощью автоматического
умного поиска можно найти другие вопросы по этой же теме, в категории
Физика. В случае если ответы на похожие вопросы не раскрывают в полном
объеме необходимую информацию, то воспользуйтесь кнопкой в верхней части
сайта и сформулируйте свой вопрос иначе. Также на этой странице вы сможете
ознакомиться с вариантами ответов пользователей.
Идеальный газ — газ, удовлетворяющий трем условиям:
- Молекулы — материальные точки.
- Потенциальная энергия взаимодействия молекул пренебрежительно мала.
- Столкновения между молекулами являются абсолютно упругими.
Реальный газ с малой плотностью можно считать идеальным газом.
Измерение температуры
Температуру можно измерять по шкале Цельсия и шкале Кельвина. По шкале Цельсия за нуль принимается температура, при которой происходит плавление льда. По шкале Кельвина за нуль принимается абсолютный нуль — температура, при котором давление идеального газа равно нулю, и его объем тоже равен нулю.
Обозначение температуры
- По шкале Цельсия — t. Единица измерения — 1 градус Цельсия (1 oC).
- По шкале Кельвина — T. Единица измерения — 1 Кельвин (1 К).
Цена деления обеих шкал составляет 1 градус. Поэтому изменение температуры в градусах Цельсия равно изменению температуры в Кельвинах:
∆t = ∆T
При решении задач в МКТ используют значения температуры по шкале Кельвина. Если в условиях задачи температура задается в градусах Цельсия, нужно их перевести в Кельвины. Это можно сделать по формуле:
T = t + 273
Если особо важна точность, следует использовать более точную формулу:
T = t + 273,15
Пример №1. Температура воды равна oC. Определить температуру воды в Кельвинах.
T = t + 273 = 2 + 273 = 275 (К)
Основное уравнение МКТ идеального газа
Давление идеального газа обусловлено беспорядочным движением молекул, которые сталкиваются друг с другом и со стенками сосуда. Основное уравнение МКТ идеального газа связывает давление и другие макропараметры (объем, температуру и массу) с микропараметрами (массой молекул, скоростью молекул и кинетической энергией).
Основное уравнение МКТ
Давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы.
p=23n−Ek
p — давление идеального газа, n — концентрация молекул газа, −Ek — средняя кинетическая энергия поступательного движения молекул.
Выражая физические величины друг через друга, можно получить следующие способы записи основного уравнения МКТ идеального газа:
|
p=13m0n−v2 |
m0— масса одной молекулы газа; n — концентрация молекул газа; −v2 — среднее значение квадрата скорости молекул газа. Среднее значение квадрата скорости не следует путать со среднеквадратичной скоростью v, которая равна корню из среднего значения квадрата скорости: v=√−v2 |
|
p=13ρ−v2 |
ρ — плотность газа |
|
p=nkT |
k — постоянная Больцмана (k = 1,38∙10–3 Дж/кг) T — температура газа по шкале Кельвина |
Пример №2. Во сколько раз уменьшится давление идеального одноатомного газа, если среднюю кинетическую энергию теплового движения молекул и концентрацию уменьшить в 2 раза?
Согласно основному уравнению МКТ идеального газа, давление прямо пропорционально произведению средней кинетической энергии теплового движения молекул и концентрации его молекул. Следовательно, если каждая из этих величин уменьшится в 2 раза, то давление уменьшится в 4 раза:
Следствия из основного уравнения МКТ идеального газа
Через основное уравнение МКТ идеального газа можно выразить скорость движения молекул (частиц газа):
v=√3kTm0=√3RTM
R — универсальная газовая постоянная, равная произведения постоянной Авогадро на постоянную Больцмана:
R=NAk=8,31 Дж/К·моль
Температура — мера кинетической энергии молекул идеального газа:
−Ek=32kT
T=2−Ek3k
Полная энергия поступательного движения молекул газа определяется формулой:
E=N−Ek
Пример №3. При уменьшении абсолютной температуры на 600 К средняя кинетическая энергия теплового движения молекул неона уменьшилась в 4 раза. Какова начальная температура газа?
Запишем формулу, связывающую температуру со средней кинетической энергией теплового движения молекул, для обоих случаев, с учетом что:
Следовательно:
Составим систему уравнений:
Отсюда:
Задание EF19012

Алгоритм решения
1.Указать, в каких координатах построен график.
2.На основании основного уравнения МКТ идеального газа и уравнения Менделеева — Клапейрона выяснить, как меняются указанные физические величины во время процессов 1–2 и 2–3.
Решение
График построен в координатах (V;Ek). Процесс 1–2 представляет собой прямую линию, исходящую из начала координат. Это значит, что при увеличении объема растет средняя кинетическая энергия молекул. Но из основного уравнения МКТ идеального газа следует, что мерой кинетической энергии молекул является температура:
T=2−Ek3
Следовательно, когда кинетическая энергия молекул растет, температура тоже растет.
Запишем уравнение Менделеева — Клапейрона:
pV=νRT
Так как количество вещества одинаковое для обоих состояния 1 и 2, запишем:
νR=p1V1T1=p2V2T2
Мы уже выяснили, что объем и температура увеличиваются пропорционально. Следовательно, давление в состояниях 1 и 2 равны. Поэтому процесс 1–2 является изобарным, давление во время него не меняется.
Процесс 2–3 имеет график в виде прямой линии, перпендикулярной кинетической энергии. Так как температуры прямо пропорциональна кинетической энергии, она остается постоянной вместе с этой энергией. Следовательно, процесс 2–3 является изотермическим, температура во время него не меняется. Мы видим, что объем при этом процессе уменьшается. Но так как объем и давление — обратно пропорциональные величины, то давление на участке 2–3 увеличивается.
Ответ:
• Участок 1–2 — изобарный процесс. Температура увеличивается, давление постоянно.
• Участок 2–3 — изотермический процесс. Температура постоянно, давление увеличивается.
pазбирался: Алиса Никитина | обсудить разбор
Задание EF17560
Первоначальное давление газа в сосуде равнялось р1. Увеличив объём сосуда, концентрацию молекул газа уменьшили в 3 раза, и одновременно в 2 раза увеличили среднюю энергию хаотичного движения молекул газа. В результате этого давление р2 газа в сосуде стало равным
Ответ:
а) 13p1
б) 2p1
в) 23p1
г) 43p1
Алгоритм решения
1.Записать исходные данные.
2.Записать основное уравнение МКТ идеального газа.
3.Составить уравнения для состояний 1 и 2.
4.Выразить искомую величину.
Решение
Исходные данные:
• Начальное давление: p0.
• Начальная концентрация молекул: n1 = 3n.
• Конечная концентрация молекул: n2 = n.
• Начальная средняя энергия хаотичного движения молекул: Ek1 = Ek.
• Конечная средняя энергия хаотичного движения молекул: Ek2 = 2Ek.
Основное уравнение МКТ:
p=23n−Ek
Составим уравнения для начального и конечного состояний:
p1=23n1−Ek1=233n−Ek=2n−Ek
p2=23n2−Ek2=23n2−Ek=43n−Ek
Отсюда:
n−Ek=p12=3p24
p2=4p16=23p1
Ответ: в
pазбирался: Алиса Никитина | обсудить разбор
Задание EF18416
Цилиндрический сосуд разделён неподвижной теплоизолирующей перегородкой. В одной части сосуда находится кислород, в другой – водород, концентрации газов одинаковы. Давление кислорода в 2 раза больше давления водорода. Чему равно отношение средней кинетической энергии молекул кислорода к средней кинетической энергии молекул водорода?
Алгоритм решения
1.Записать исходные данные.
2.Записать основное уравнение МКТ идеального газа.
3.Составить уравнения для обоих газов.
4.Найти отношение средней кинетической энергии молекул кислорода к средней кинетической энергии молекул водорода.
Решение
Анализируя условия задачи, можно выделить следующие данные:
• Концентрации кислорода и водорода в сосуде равны. Следовательно, n1 = n2 = n.
• Давление кислорода вдвое выше давления водорода. Следовательно, p1 = 2p, а p2 = p.
Запишем основное уравнение идеального газа:
p=23n−Ek
Применим его для обоих газов и получим:
p1=23n1−Ek1 или 2p=23n−Ek1
p2=23n2−Ek2 или p=23n−Ek2
Выразим среднюю кинетическую энергию молекул газа из каждого уравнения:
−Ek1=3pn
−Ek2=3p2n
Поделим уравнения друг на друга и получим:
−Ek1−Ek2=3pn·2n3p=2
Ответ: 2
pазбирался: Алиса Никитина | обсудить разбор
Задание EF18824
В одном сосуде находится аргон, а в другом – неон. Средние кинетические энергии теплового движения молекул газов одинаковы. Давление аргона в 2 раза больше давления неона. Чему равно отношение концентрации молекул аргона к концентрации молекул неона?
Алгоритм решения
1.Записать исходные данные.
2.Записать основное уравнение МКТ идеального газа.
3.Составить уравнения для обоих газов.
4.Найти отношение концентрации молекул аргона к концентрации молекул неона.
Решение
Анализируя условия задачи, можно выделить следующие данные:
• Средние кинетические энергии теплового движения молекул газов одинаковы. Следовательно, −Ek1=−Ek2=−Ek.
• Давление аргона в 2 раза больше давления неона. Следовательно, p1 = 2p, а p2 = p.
Запишем основное уравнение идеального газа:
p=23n−Ek
Применим его для обоих газов и получим:
p1=23n1−Ek1 или 2p=23n1−Ek
p2=23n2−Ek2 или p=23n2−Ek
Выразим концентрации молекул газа из каждого уравнения:
n1=3p−Ek
n2=3p2−Ek
Поделим уравнения друг на друга и получим:
n1n2=3p−Ek·2−Ek3p=2
Ответ: 2
pазбирался: Алиса Никитина | обсудить разбор
Алиса Никитина | Просмотров: 10.9k





