Физика, 10 класс
Урок 18. Основное уравнение МКТ
Перечень вопросов, рассматриваемых на уроке:
1) средняя кинетическая энергия молекулы;
2) давление газа;
3) основное уравнение МКТ;
Глоссарий по теме:
Давление идеального газа пропорционально произведению концентрации молекул и средней кинетической энергии поступательного движения молекул.
Средняя кинетическая энергия молекул – усреднённая величина, равная половине произведения массы молекулы на среднюю величину квадрата её скорости.
Концентрация – число молекул в единице объёма.
Масса молекулы (или атома) – чрезвычайно маленькая величина в макроскопических масштабах (граммах и килограммах), вычисляется через отношение массы вещества к количеству содержащихся в ней молекул (или атомов).
Изменение импульса тела – произведение силы на время действия силы. Импульс силы всегда показывает, как изменяется импульс тела за данное время.
Основная и дополнительная литература по теме урока:
- Мякишев Г.Я., Буховцев Б.Б., Сотский Н.Н. Физика.10 класс. Учебник для общеобразовательных организаций М.: Просвещение, 2017. С. 188 – 192.
- Кирик Л.А., Генденштейн Л.Э., Гельфгат И.М.. Задачи по физике. 10-11 классы для профильной школы. – М.: Илекса, 2010. С. 111.
- Рымкевич А.П. Физика. Задачник. 10-11 классы. – М.: Дрофа, 2013. С. 65 – 67.
Открытые электронные ресурсы по теме урока:
- http://kvant.mccme.ru/1991/09/idealnyj_gaz_-_universalnaya_f.htm
- http://kvant.mccme.ru/1983/10/davlenie_idealnogo_gaza.htm
- http://kvant.mccme.ru/1987/09/davlenie_gaza_v_sosude.htm
Теоретический материал для самостоятельного изучения
Основная задача молекулярно-кинетической теории газа заключается в том, чтобы установить соотношение между давлением газа и его микроскопическими параметрами — массой молекул, их средней скоростью и концентрацией. Это соотношение называется основным уравнением молекулярно-кинетической теории газа.
Давление газа на стенку сосуда обусловлено ударами молекул, давление газа пропорционально концентрации молекул: чем больше молекул в единице объема, тем больше ударов молекул о стенку за единицу времени. Каждая молекула при ударе о стенку передает ей импульс, пропорциональный импульсу молекулы m0v.
Давление пропорционально второй степени скорости, так как, чем больше скорость молекулы, тем чаще она бьется о стенку сосуда. Расчеты показывают, что основное уравнение молекулярно-кинетической теории идеального газа имеет вид:

n— концентрация молекул,

Коэффициент 
Средняя кинетическая энергия поступательного движения
тогда уравнение примет вид:

Давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы.
Примеры и разбор решения заданий.
1. К каждой позиции первого столбца подберите соответствующую позицию второго:
|
ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ |
ФОРМУЛЫ |
|
1) импульс тела |
А) |
|
2) средняя кинетическая энергия молекул |
Б) |
|
3) давление газа на стенку сосуда |
В) |
|
4) концентрация молекул |
Г) |
Правильный ответ: вспомнив формулы величин, устанавливаем соответствие:
|
ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ |
ФОРМУЛЫ |
|
1) импульс тела |
В) |
|
2) средняя кинетическая энергия молекул |
А) |
|
3) давление газа на стенку сосуда |
Г) |
|
4) концентрация молекул |
Б) |
2. Кислород находится при нормальных условиях. Средняя квадратичная скорость молекул кислорода в этом случае равна ___ м/с.
Решение:

Ответ: 460 м/с.
Основное уравнение мкт
,
где k является постоянной
Больцмана (отношение универсальной
газовой постоянной R к числу
Авогадро NA), i
— число степеней свободы молекул (i
= 3 в большинстве задач про идеальные
газы, где молекулы предполагаются
сферами малого радиуса, физическим
аналогом которых могут служить инертные
газы), а T — абсолютная температура.
Основное
уравнение МКТ связывает макроскопические
параметры (давление,
объём,
температура)
газовой системы с микроскопическими
(масса молекул, средняя скорость их
движения).
Вывод основного уравнения мкт
Пусть
имеется кубический сосуд с ребром длиной
l и одна частица массой m в нём.
Обозначим
скорость движения vx, тогда
перед столкновением со стенкой сосуда
импульс
частицы равен mvx, а после —
− mvx, поэтому стенке
передается импульс p = 2mvx.
Время, через которое частица сталкивается
с одной и той же стенкой, равно
.
Отсюда
следует:
Так
как давление
,
следовательно сила F = p * S
Подставив,
получим:
Преобразовав:
Так
как рассматривается кубический сосуд,
то V = Sl
Отсюда:
.
Соответственно,
и
.
Таким
образом, для большого числа частиц верно
следующее:
,
аналогично для осей y и z.
Поскольку
,
то
.
Это следует из того, что все направления
движения молекул
в хаотичной среде равновероятны.
Отсюда
или
.
Пусть
—
среднее значение кинетической энергии
всех молекул, тогда:
,
откуда
.
Для
одного моля выражение примет вид
Уравнение среднеквадратичной скорости молекулы
Уравнение
среднеквадратичной скорости молекулы
легко выводится из основного уравнения
МКТ для одного моля газа.
,
для 1 моля N = Na, где Na —
постоянная
Авогадро
Nam
= Mr, где Mr —
молярная
масса газа
Отсюда
окончательно
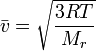
43
Асчёт скорости движения молекул. Введение. Температура, как мера средней кинетической энергии молекул
Попробуем
получить нетривиальные результаты,
используя уравнение Клайперона-Менделеева
и основное уравнение МКТ.
Введем
понятие средней кинетической энергии
молекул:
(1)
Преобразуем
основное уравнение МКТ с учетом формулы
(1):
т.е.
основное уравнение МКТ запишем так
(2)
Воспользуемся
уравнением К.-М. в таком виде:
(3)
Сравним
уравнения (2) и (3) и получим, что
или
(4)
Как
понимать формулу (4)?
Мы
выяснили, что от температуры зависит
величина средней кинетической энергии
молекул. Поэтому говорят, что температура
— мера средней кинетической энергии
молекул. Это утверждение мы доказали
на для идеального газа, но оказывается
оно справедливо и для других агрегатных
сосятояний вещества.
Среднеквадратичная скорость движения молекул.
Интересен
вопрос о скорости движения молекул
газа. В газен царит полный хаос, молекулы
движутся по всем направлениям с самыми
разными скоростями.
Оказывается,
что
-
в газе есть молекулы с очень маленькими
скоростями и с очень большими, но их
сравнительно мало. -
Средняя
проекция скорости на любое направление
для всего газа равна 0 (иначе, в газе
существовали бы потоки). -
Оказывается
у молекул есть средняя скорость (по
модулю), которая зависит от температуры,
и основная часть молекул имеет модуль
скорости близкий к ней. Эту скорость
мы не можем вычислить, но можем легко
посчитать среднеквадратичную скорость
движения молекул газа, которая отличается
от средней скорости коэффициентом
порядка 1.
Определение.
Среднеквадратичная скорость молекул
равна квадратному корню из среднего
квадрата скорости молекул:
(5)
Вычислим
среднеквадратичную скорость из средней
кинетической энергии молекул, которую
мы легко можем сосчитать:
(6)
С
учетом уравнения (4) получим:
(7)
Посчитаем,
например, среднюю скорость молекул газа
в классной комнате:
T=300K,
mo=M/Na, М=0,029 г/моль. С учетом
этого имеем:

44
Распределение энергии по степеням
свободы молекулы
Молекулы
можно рассматривать как системы
материальных точек (атомов) совершающих
как поступательное, так и вращательное
движения. При исследовании движения
тела необходимо знать его положение
относительно выбранной системы координат.
Для этого вводится понятие о степенях
свободы тела. Число независимых
координат, которые полностью определяют
положение тела в пространстве, называется
числом степеней свободы тела.
При
движении точки по прямой линии для
оценки ее положения необходимо знать
одну координату, т.е. точка имеет одну
степень свободы. Если точка движения
по плоскости, ее положение характеризуется
двумя координатами; при этом точка
обладает двумя степенями свободы.
Положение точки в пространстве
определяется 3 координатами. Число
степеней свободы обычно обозначают
буквой i. Молекулы, которые состоят из
обычного атома, считаются материальными
точками и имеют три степени свободы
(аргон, гелий).

Двухатомные
жесткие молекулы, например молекулы
водорода, азота и др., обладают пятью
степенями свободы: они имеют 3 степени
свободы поступательного движения и 2
степени свободы вращения вокруг осей
ОХ и OZ. Вращением вокруг оси OY можно
пренебречь, т.к. момент инерции ее
относительно этой оси пренебрежимо
мал. Поэтому вклад энергии вращательного
движения вокруг оси OY в суммарную энергию
двухатомной молекулы можно не учитывать.
Молекулы,
состоящие из трех и более жестко связанных
атомов, не лежащих на одной прямой, имеют
число степеней свободы i = 6: три степени
свободы поступательного движения и 3
степени свободы вращения вокруг осей
ОХ, OY и OZ.
В
этом случае, если расстояние между
атомами может изменяться (нежесткие
молекулы), появляются дополнительные
степени свободы .
Согласно
молекулярно-кинетической теории газов
движение молекул носит беспорядочный
характер; эта беспорядочность относится
ко всем видам движения молекулы. Ни один
из видов движения не имеет преимущества
перед другим. При статистическом
равновесии движений энергия в среднем
распределяется равномерно между всеми
видами движения. Закон равномерного
распределения энергии по степеням
свободы молекул можно сформулировать
следующим образом: статистически в
среднем на каждую степень свободы
молекул приходится одинаковая энергия.
Поступательное движение молекул
характеризуется средней кинетической
энергией, равной
.
Так как поступательному движению
соответствует 3 степени свободы, то в
среднем на одну степень свободы движения
молекул приходится энергия
В
однородном газе, молекулы которого
имеют любое число степеней свободы i,
каждая молекула в среднем обладает
энергией движения, равной
|
|
(10.11) |
45
Если
в результате теплообмена телу передается
некоторое количество теплоты, то
внутренняя энергия тела и его температура
изменяются. Количество теплоты Q,
необходимое для нагревания 1 кг
вещества на 1 К называют удельной
теплоемкостью вещества
c.
|
Во
многих случаях удобно использовать
молярную
теплоемкость
C:
|
где
M – молярная масса вещества.
Определенная таким образом теплоемкость
не
является однозначной
характеристикой вещества. Согласно
первому закону термодинамики изменение
внутренней энергии тела зависит не
только от полученного количества
теплоты, но и от работы, совершенной
телом.
В
зависимости от условий, при которых
осуществлялся процесс теплопередачи,
тело могло совершать различную работу.
Поэтому одинаковое количество теплоты,
переданное телу, могло вызвать различные
изменения его внутренней энергии и,
следовательно, температуры. Такая
неоднозначность определения теплоемкости
характерна только для газообразного
вещества.
При
нагревании жидких и твердых тел их объем
практически не изменяется, и работа
расширения оказывается равной нулю.
Поэтому все количество теплоты, полученное
телом, идет на изменение его внутренней
энергии. В отличие от жидкостей и твердых
тел, газ в процессе теплопередачи может
сильно изменять свой объем и совершать
работу. Поэтому теплоемкость газообразного
вещества зависит от характера
термодинамического процесса. Обычно
рассматриваются два значения теплоемкости
газов: CV – молярная
теплоемкость в изохорном процессе
(V = const)
и Cp – молярная
теплоемкость в изобарном процессе
(p = const). В процессе при постоянном
объеме газ работы не совершает: A = 0.
Из первого закона термодинамики для
1 моля газа следует
|
Изменение
ΔU внутренней энергии газа прямо
пропорционально изменению ΔT его
температуры. Для процесса при постоянном
давлении первый закон термодинамики
дает:
|
где
ΔV – изменение объема 1 моля идеального
газа при изменении его температуры на
ΔT. Отсюда следует:
|
|
Отношение
ΔV / ΔT может быть найдено из уравнения
состояния идеального газа, записанного
для 1 моля:
|
pV = RT, |
где
R – универсальная газовая постоянная.
При p = const
|
|
Таким
образом, соотношение, выражающее связь
между молярными теплоемкостями Cp и CV,
имеет вид (формула
Майера):
|
Cp = CV + R. |
Молярная
теплоемкость Cp газа в процессе с
постоянным давлением всегда больше
молярной теплоемкости CV в процессе с
постоянным объемом (рис. 3.10.1).
|
|
|
Рисунок |
Отношение
теплоемкостей в процессах с постоянным
давлением и постоянным объемом играет
важную роль в термодинамике. Оно
обозначается греческой буквой γ.
|
В
частности, это отношение входит в формулу
для адиабатического процесса (см. §3.9).
Между двумя изотермами с температурами
T1 и T2 на диаграмме (p, V) возможны
различные пути перехода. Поскольку для
всех таких переходов изменение температуры
ΔT = T2 – T1 одинаково,
следовательно, одинаково изменение ΔU
внутренней энергии. Однако, совершенные
при этом работы A и полученные в результате
теплообмена количества теплоты Q окажутся
различными для разных путей перехода.
Отсюда
следует, что у газа имеется бесчисленное
количество теплоемкостей. Теплоемкости
Cp и CV – это лишь частные (и очень важные
для теории газов) значения теплоемкостей.
Термодинамические процессы, в которых
теплоемкость газа остается неизменной,
называются политропическими.
Все
изопроцессы являются политропическими.
В случае изотермического процесса
ΔT = 0, поэтому CT = ∞. В
адиабатическом процессе ΔQ = 0,
следовательно, Cад = 0. Следует
отметить, что «теплоемкость», как и
«количество теплоты» – крайне неудачные
термины.
Они
достались современной науке в наследство
от теории теплорода,
господствовавшей в XVIII веке. Эта
теория рассматривала теплоту как особое
невесомое вещество, содержащееся в
телах. Оно не может быть ни создано, ни
уничтожено. Нагревание тел объяснялось
увеличением, а охлаждение – уменьшением
содержащегося внутри них теплорода.
Теория теплорода несостоятельна.
Она
не может объяснить, почему одно и то же
изменение внутренней энергии тела можно
получить, передавая ему разное количество
теплоты в зависимости от работы, которую
совершает тело. Поэтому лишено физического
смысла утверждение, что «в данном теле
содержится такой-то запас теплоты». В
молекулярно-кинетической теории
устанавливается следующее соотношение
между средней кинетической энергией
поступательного
движения
молекул и абсолютной температурой T:
|
|
Внутренняя
энергия 1 моля идеального газа равна
произведению
на
число Авогадро NА:
|
|
При
изменении температуры на ΔT внутренняя
энергия изменяется на величину
|
Коэффициент
пропорциональности между ΔU и ΔT равен
теплоемкости CV при постоянном давлении:
|
Это
соотношение хорошо подтверждается в
экспериментах с газами, состоящими из
одноатомных молекул (гелий, неон, аргон).
Однако, для двухатомных (водород, азот)
и многоатомных (углекислый газ) газов
это соотношение не согласуется с
экспериментальными данными. Причина
такого расхождения состоит в том, что
для двух- и многоатомных молекул средняя
кинетическая энергия должна включать
не только энергию поступательного
движения, но и энергию вращательного
движения молекул.
На
рис. 3.10.2 изображена модель двухатомной
молекулы. Молекула может совершать пять
независимых движений: три поступательных
движения вдоль осей X, Y, Z и два вращения
относительно осей X и Y. Опыт показывает,
что вращение относительно оси Z, на
которой лежат центры обоих атомов, может
быть возбуждено только при очень высоких
температурах. При обычных температурах
вращение около оси Z не происходит, так
же как не вращается одноатомная молекула.
Каждое
независимое движение называется степенью
свободы. Таким образом, одноатомная
молекула имеет 3 поступательные степени
свободы, «жесткая» двухатомная молекула
имеет 5 степеней (3 поступательные и 2
вращательные), а многоатомная молекула
– 6 степеней свободы (3 поступательные
и 3 вращательные). В классической
статистической физике доказывается
так называемая теорема
о равномерном распределении энергии
по степеням свободы:
Если
система молекул находится в тепловом
равновесии при температуре T, то средняя
кинетическая энергия равномерно
распределена между всеми степенями
свободы и для каждой степени свободы
молекулы она равна
Из
этой теоремы следует, что молярные
теплоемкости газа Cp и CV и их отношение
γ могут быть записаны в виде
|
где
i – число степеней свободы газа. Для
газа, состоящего из одноатомных
молекул
(i = 3)
|
Для
газа, состоящего из двухатомных
молекул
(i = 5)
|
Для
газа, состоящего из многоатомных
молекул
(i = 6)
|
Экспериментально
измеренные теплоемкости многих газов
при обычных условиях достаточно хорошо
согласуются с приведенными выражениями.
Однако, в целом классическая теория
теплоемкости газов не может считаться
вполне удовлетворительной. Существует
много примеров значительных расхождений
между теорией и экспериментом. Это
объясняется тем, что классическая теория
не в состоянии полностью учесть энергию,
связанную с внутренними движениями в
молекуле. Теорему о равномерном
распределении энергии по степеням
свободы можно применить и к тепловому
движению частиц в твердом теле.
Атомы,
входящие в состав кристаллической
решетки, совершают колебания около
положений равновесия. Энергия этих
колебаний и представляет собой внутреннюю
энергию твердого тела. Каждый атом в
кристаллической решетке может колебаться
в трех взаимно перпендикулярных
направлениях. Следовательно, каждый
атом имеет 3 колебательные степени.
При
гармонических колебаниях средняя
кинетическая энергия равна средней
потенциальной энергии. Поэтому в
соответствии с теоремой о равномерном
распределении на каждую колебательную
степень свободы приходится средняя
энергия kT, а на один атом – 3kT. Внутренняя
энергия 1 моля
твердого вещества равна:
|
U = 3NAkT = 3RT. |
Поэтому
молярная теплоемкость вещества в твердом
состоянии равна:
|
Это
соотношение называется законом
Дюлонга–Пти.
Для твердых тел практически не существует
различия между Cp и CV из-за ничтожно малой
работы при расширении или сжатии. Опыт
показывает, что у многих твердых тел
(химических элементов) молярная
теплоемкость при обычных температурах
действительно близка к 3R. Однако, при
низких температурах наблюдаются
значительные расхождения между теорией
и экспериментом. Это показывает, что
гипотеза о равномерном распределении
энергии по степеням свободы является
приближением. Наблюдаемая на опыте
зависимость теплоемкости от температуры
может быть объяснена только на основе
квантовых представлений.
46
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Формулы молекулярной физики
Формула концентрации молекул
Здесь n — концентрация 

Формула плотности
Здесь 


Формула относительной молекулярной массы
Здесь 


Формула количества вещества (количества молей)
Здесь v — количество вещества (количество молей) (моль), m — масса вещества (кг), М — молярная масса (кг/моль).
Формулы массы одной молекулы
Здесь 




Формулы количества молекул
Здесь A — количество молекул (безразмерное), п — концентрация молекул 




Формулы средней квадратичной скорости молекул
Здесь 


Основное уравнение кинетической теории идеального газа
Здесь р — давление газа (Па), 



Формула средней кинетической энергии молекул
Здесь 


Связь шкал Цельсия и Кельвина
Здесь Т — абсолютная температура (К), t — температура по шкале Цельсия.
Связь средней кинетической энергии молекул идеального газа с абсолютной температурой
Здесь 
У равнение состояния идеального газа — уравнение Клапейрона — Менделеева
Здесь р — давление газа (Па), V — объем 


Объединенный газовый закон — уравнение Клапейрона
при
Здесь 



Закон Бойля — Мариотта (изотермический процесс)
при
Здесь Т — абсолютная температура газа (К), m — масса газа (кг), 



Закон Гей-Люссака (изобарный процесс)
при
Здесь р — давление газа (Па), m — масса газа (кг), 




Закон Шарля
при
Здесь V — объем газа 


Связь давления идеального газа с концентрацией его молекул и температурой
Здесь р — давление газа (Па), к — постоянная Больцмана (Дж/К), п — концентрация молекул газа 
Формулы относительной влажности
Здесь 



Работа при изобарном изменении объема газа
Здесь А — работа (Дж), р — давление газа (Па), 


Внутренняя энергия идеального одноатомного газа
Здесь U — внутренняя энергия газа (Дж), m — масса газа (кг), М — молярная масса газа (кг/моль), R — молярная газовая постоянная (Дж/(моль • К), Т — абсолютная температура (К), v — количество вещества или число молей (моль), 

Первый закон термодинамики
Здесь Q — количество теплоты, переданное термодинамической системе (Дж), 
Применение первого закона термодинамики к термодинамическим процессам
к изотермическому: при
к изохорному: при V = const
к изобарному: при р = const
к адиабатному: при Q = 0
Здесь Т — абсолютная температура (К), 

Формулы количества теплоты при нагревании или охлаждении тел
Здесь Q — количество теплоты, переданное телу при нагревании или отданное им при охлаждении (Дж), с — удельная теплоемкость вещества (Дж/(кг • К), т — масса тела (кг), 





Формула количества теплоты при плавлении или кристаллизации
Здесь Q — количество теплоты (Дж), т — масса тела (кг), 
Формула количества теплоты при парообразовании или конденсации
Здесь Q — количество теплоты (Дж), m — масса тела (кг), r — удельная теплота парообразования (Дж/кг).
Формула количества теплоты при сгорании топлива
Здесь Q — количество выделившейся теплоты, m — масса топлива (кг), q — удельная теплота сгорания (Дж/кг).
Коэффициент полезного действия теплового двигателя
Здесь 



Коэффициент полезного действия идеального теплового двигателя
Здесь 


Эта теория со страницы подробного решения задач по физике, там расположена теория и подробное решения задач по всем темам физики:
Задачи по физике с решением
Возможно вам будут полезны эти страницы:
Уравнение состояния идеального газа
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: модель идеального газа, связь между давлением и средней кинетической энергией теплового движения молекул идеального газа, связь температуры газа со средней кинетической энергией его частиц, уравнение  , уравнение Менделеева—Клапейрона.
, уравнение Менделеева—Клапейрона.
Из трёх агрегатных состояний вещества наиболее простым для изучения является газообразное. В достаточно разреженных газах расстояния между молекулами намного больше размеров самих молекул (тогда как в жидкостях и твёрдых телах молекулы «упакованы» весьма плотно).Поэтому силы взаимодействия между молекулами таких газов очень малы.
Для описания разреженных газов в физике используется модель идеального газа. В рамках этой модели делаются следующие допущения.
1. Пренебрегаем размерами молекул. Иными словами, молекулы газа считаются материальными точками.
2. Пренебрегаем взаимодействием молекул на расстоянии.
3. Соударения молекул друг с другом и со стенками сосуда считаем абсолютно упругими.
Таким образом, идеальный газ — это газ, частицы которого являются не взаимодействующими на расстоянии материальными точками и испытывают абсолютно упругие соударения друг с другом и со стенками сосуда.
Средняя кинетическая энергия частиц газа
Оказывается, что ключевую роль в описании идеального газа играет средняя кинетическая энергия его частиц.
Частицы газа двигаются с разными скоростями. Пусть в газе содержится частиц, скорости которых равны
. Масса каждой частицы равна
. Кинетические энергии частиц:
Средняя кинетическая энергия частиц газа это среднее арифметическое их кинетических энергий:
Последний множитель — это средний квадрат скорости, обозначаемый просто :
Тогда формула для средней кинетической энергии приобретает привычный вид:
(1)
Корень из среднего квадрата скорости называется средней квадратической скоростью:
Основное уравнение МКТ идеального газа
Cвязь между давлением газа и средней кинетической энергией его частиц называется основным уравнением молекулярно-кинетической теории идеального газа. Эта связь выводится из законов механики и имеет вид:
(2)
где — концентрация газа (число частиц в единице объёма). С учётом (1) имеем также:
(3)
Что такое ? Произведение массы частицы на число частиц в единице объёма даёт массу единицы объёма, то есть плотность:
. Получаем третью разновидность основного уравнения:
(4)
Энергия частиц и температура газа
Можно показать, что при установлении теплового равновесия между двумя газами выравниваются средние кинетические энергии их частиц. Но мы знаем, что при этом становятся равны и температуры газов. Следовательно, температура газа — это мера средней кинетической энергии его частиц.
Собственно, ничто не мешает попросту отождествить эти величины и сказать, что температура газа — это средняя кинетическая энергия его молекул. В продвинутых курсах теоретической физики так и поступают. Определённая таким образом температура измеряется в энергетических единицах — джоулях.
Но для практических задач удобнее иметь дело с привычными кельвинами. Связь средней кинетической энергии частиц и абсолютной температуры газа даётся формулой:
(5)
где Дж/К — постоянная Больцмана.
Благодарим за то, что пользуйтесь нашими публикациями.
Информация на странице «Уравнение состояния идеального газа» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать нужные и поступить в высшее учебное заведение или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из данного раздела.
Публикация обновлена:
08.05.2023
Молекулярно-кинетическая теория позволяет, анализируя микроскопическое поведение системы и используя методы статистической механики, получить важные макроскопические характеристики термодинамической системы. Одной из микроскопических характеристик, которая связана с температурой системы, является средняя квадратичная скорость молекул газа. Формулу для нее приведем и рассмотрим в статье.
Газ идеальный
Сразу отметим, что формула квадратичной средней скорости молекул газа будет приведена именно для газа идеального. Под ним в физике полагают такую многочастичную систему, в которой частицы (атомы, молекулы) не взаимодействуют друг с другом (их кинетическая энергия на несколько порядков превышает потенциальную энергию взаимодействия) и не имеют размеров, то есть являются точками с конечной массой (расстояние между частицами на несколько порядков превышает их размеры линейные).
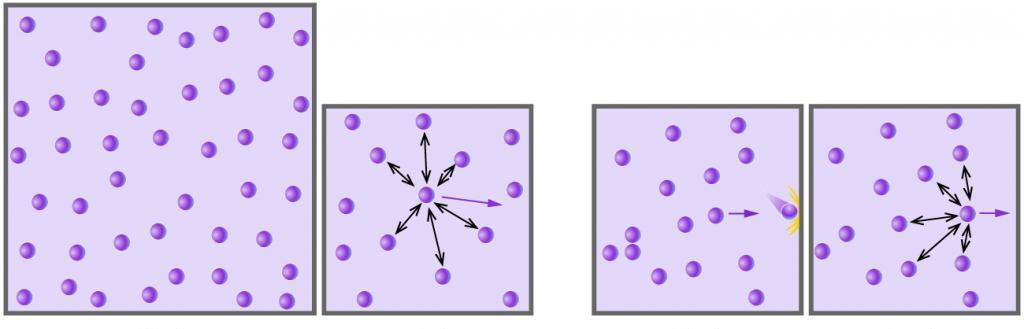
Любой газ, который состоит из химически нейтральных молекул или атомов, и что находится под небольшим давлением и имеет высокую температуру, может считаться идеальным. Например, воздух — это идеальный газ, а водяной пар таковым уже не является (между молекулами воды действуют сильные водородные связи).
Теория молекулярно-кинетическая (МКТ)

Изучая идеальный газ в рамках МКТ, следует обратить внимание на два важных процесса:
Несмотря на то, что индивидуальные скорости газовых частиц сильно отличаются друг от друга, среднее значение этой величины сохраняется постоянным во времени, если отсутствуют внешние воздействия на систему. Формулу средней квадратичной скорости молекул газа можно получить, если рассмотреть связь между кинетической энергией и температурой. Займемся этим вопросом в следующем пункте статьи.
Вывод формулы квадратичной средней скорости молекул газа идеального
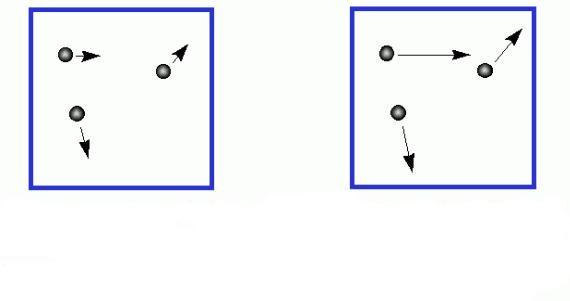
Каждый школьник знает из общего курса физики, что кинетическая энергия поступательного движения тела массой m рассчитывается так:
Ek = m*v2/2
Где v — линейная скорость. С другой стороны, кинетическую энергию частицы также можно определить через абсолютную температуру T, используя переводной множитель kB (постоянная Больцмана). Поскольку наше пространство является трехмерным, то Ek рассчитывается так:
Ek = 3/2*kB*T.
Приравнивая оба равенства и выражая из них v, получим формулу средней скорости квадратичной газа идеального:
m*v2/2 = 3/2*kB*T =>
v = √(3*kB*T/m).
В этой формуле m — является массой газовой частицы. Ее значение неудобно использовать в практических расчетах, поскольку оно невелико (≈ 10-27 кг). Чтобы избежать этого неудобство вспомним об универсальной газовой постоянной R и молярной массе M. Постоянная R с kB связана равенством:
kB = R/NA.
Величина M определяется так:
M = m*NA.
Принимая во внимание оба равенства, получаем следующее выражение для средней квадратичной скорости молекул:
v = √(3*R*T/M).
Таким образом, средняя квадратичная скорость газовых частиц оказывается прямо пропорциональной квадратному корню из абсолютной температуры и обратно пропорциональна корню квадратному из молярной массы.
Пример решения задачи
Каждый знает, что воздух, которым мы дышим, на 99% состоит из азота и кислорода. Необходимо определить разницы в средних скоростях молекул N2 и O2 при температуре 15 oC.

Эту задачу будет решать последовательно. Сначала переведем температуру в абсолютные единицы, имеем:
T = 273,15 + 15 = 288,15 К.
Теперь выпишем молярные массы для каждой рассматриваемой молекулы:
MN2 = 0,028 кг/моль;
MO2 = 0,032 кг/моль.
Поскольку значения молярных масс отличаются между собой незначительно, то средние их скорости при одинаковой температуре тоже должны быть близки. Пользуясь формулой для v, получаем следующие значения для молекул азота и кислорода:
v (N2) = √(3*8,314*288,15/0,028) = 506,6 м/с;
v (O2) = √(3*8,314*288,15/0,032) = 473,9 м/с.
Поскольку молекулы азота немного легче, чем молекулы кислорода, то движутся они быстрее. Разница средних скоростей составляет:
v (N2) — v (O2) = 506,6 — 473,9 = 32,7 м/с.
Полученное значение составляет всего 6,5 % от средней скорости молекул азота. Обращаем внимание на большие значения скоростей молекул в газах даже при невысоких температурах.
Автор:
16-01-2019 19:51
Жду ваши вопросы и мнения в комментариях




















































