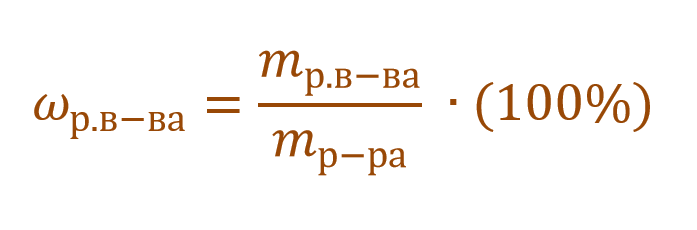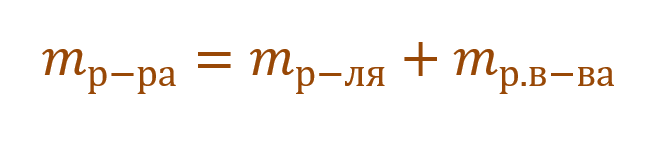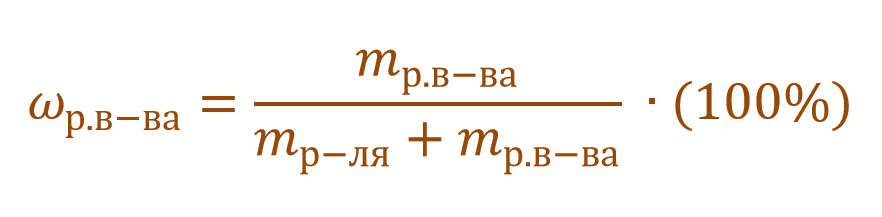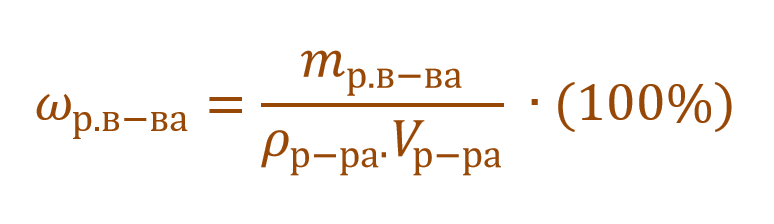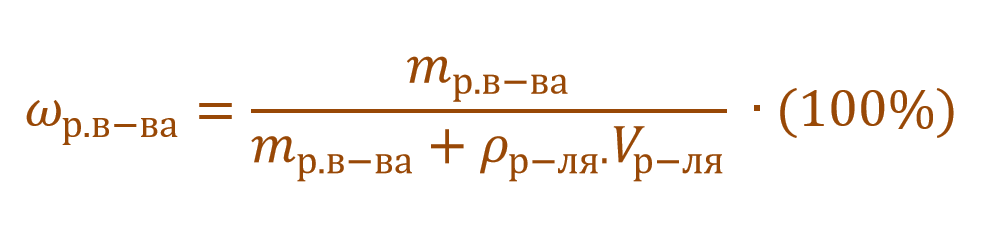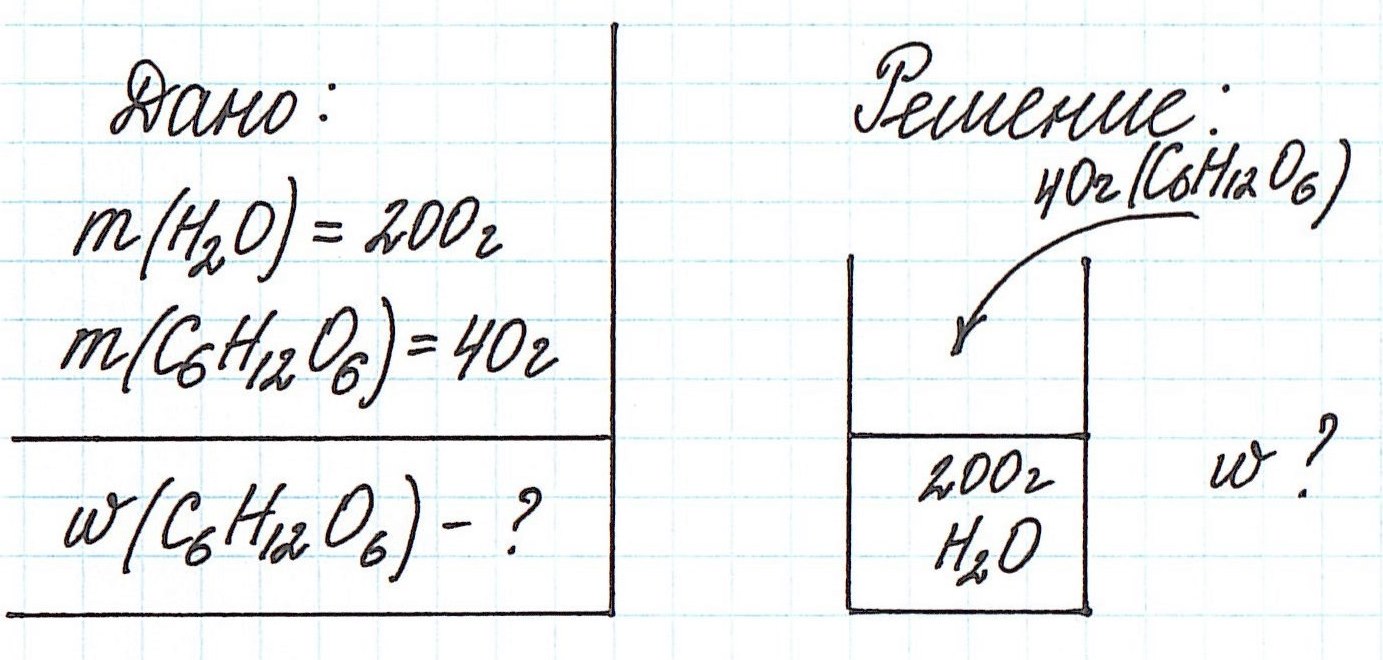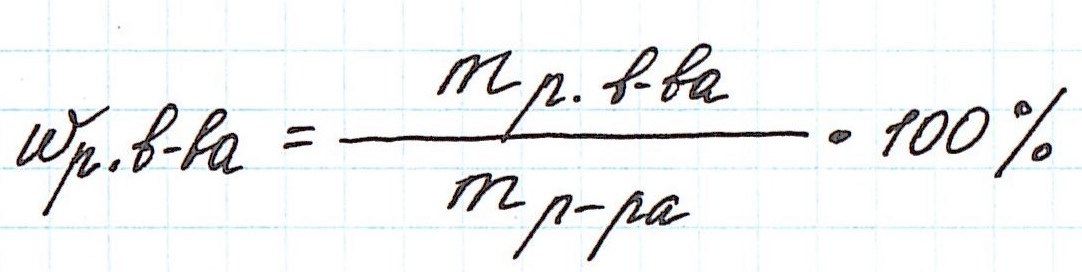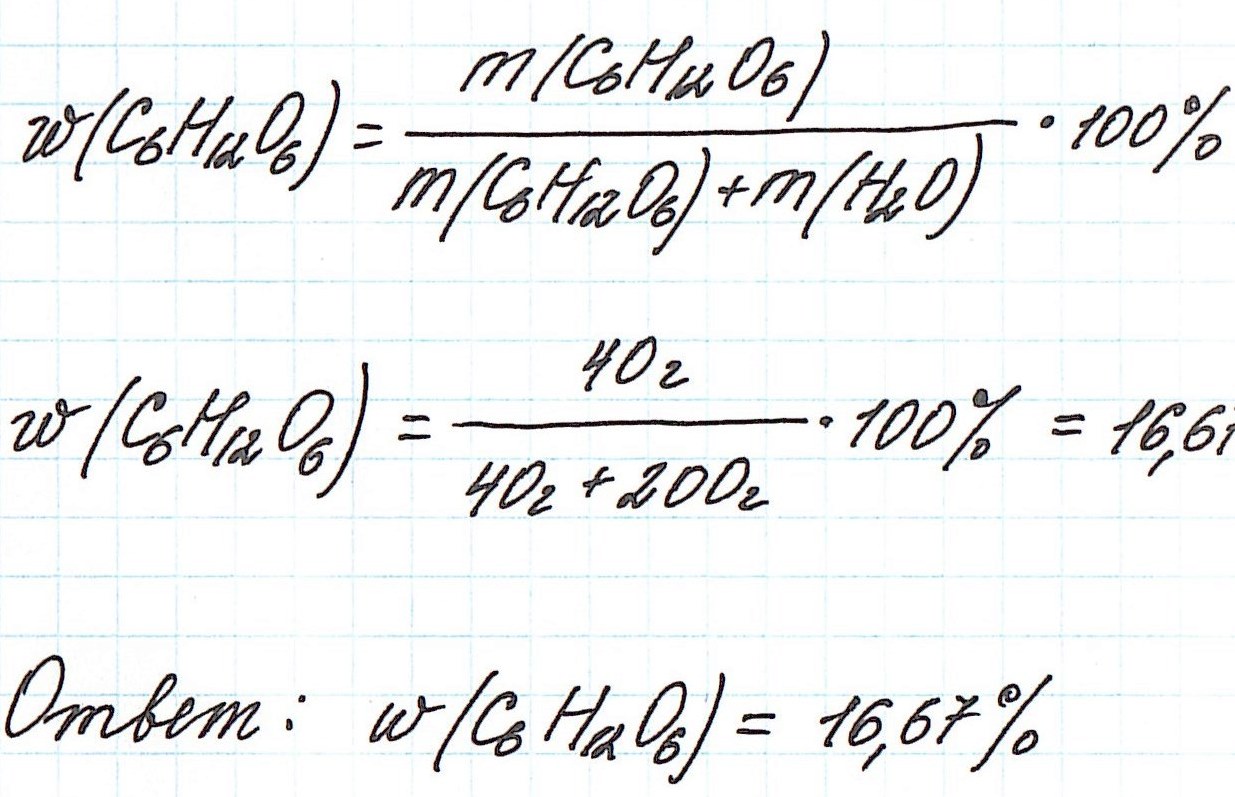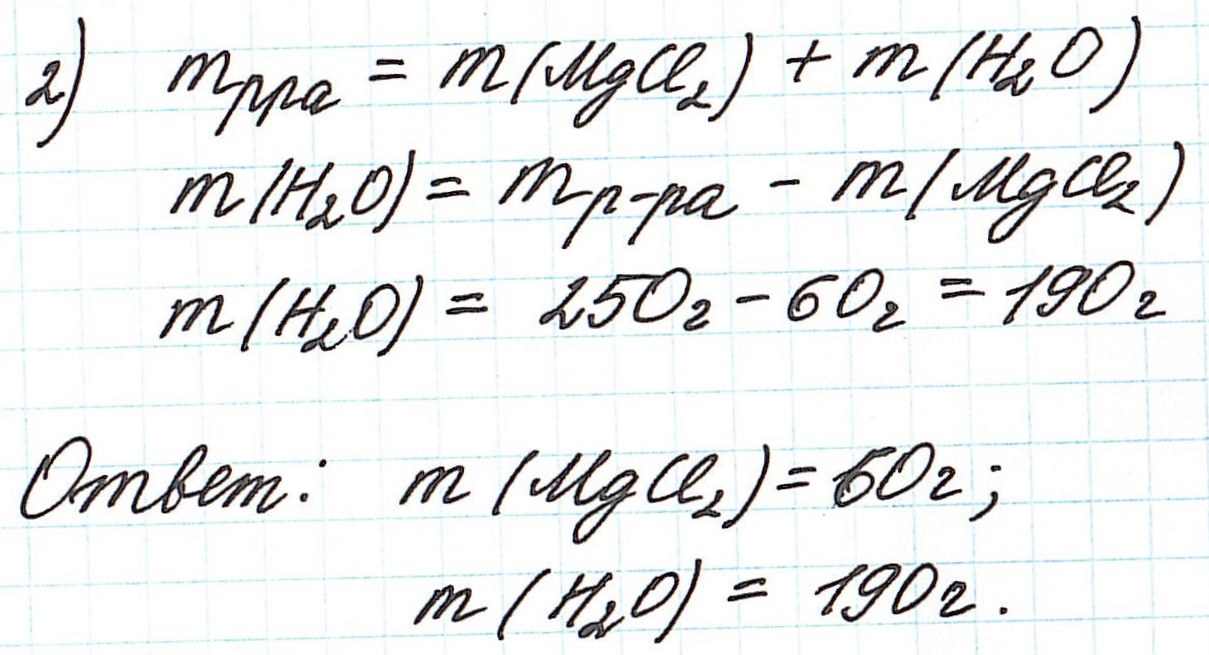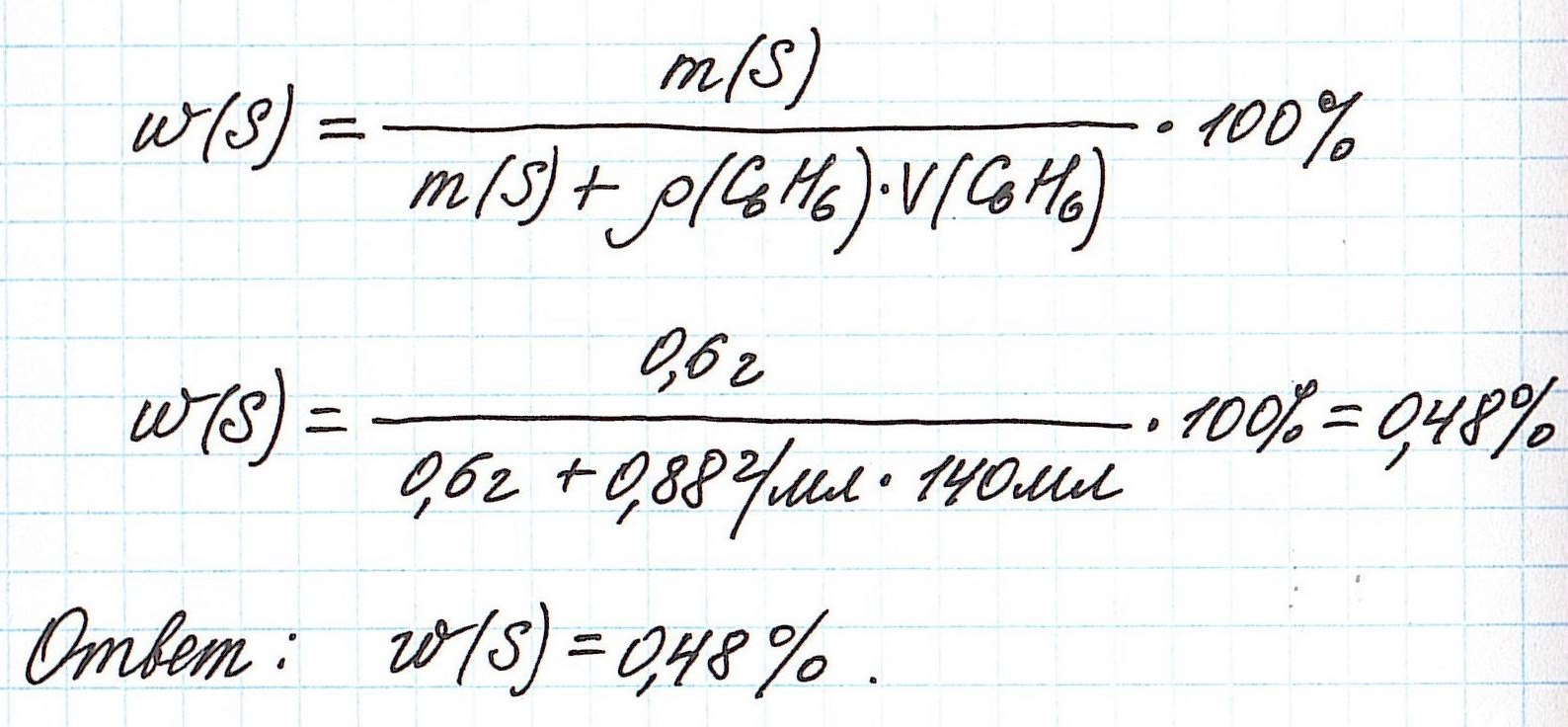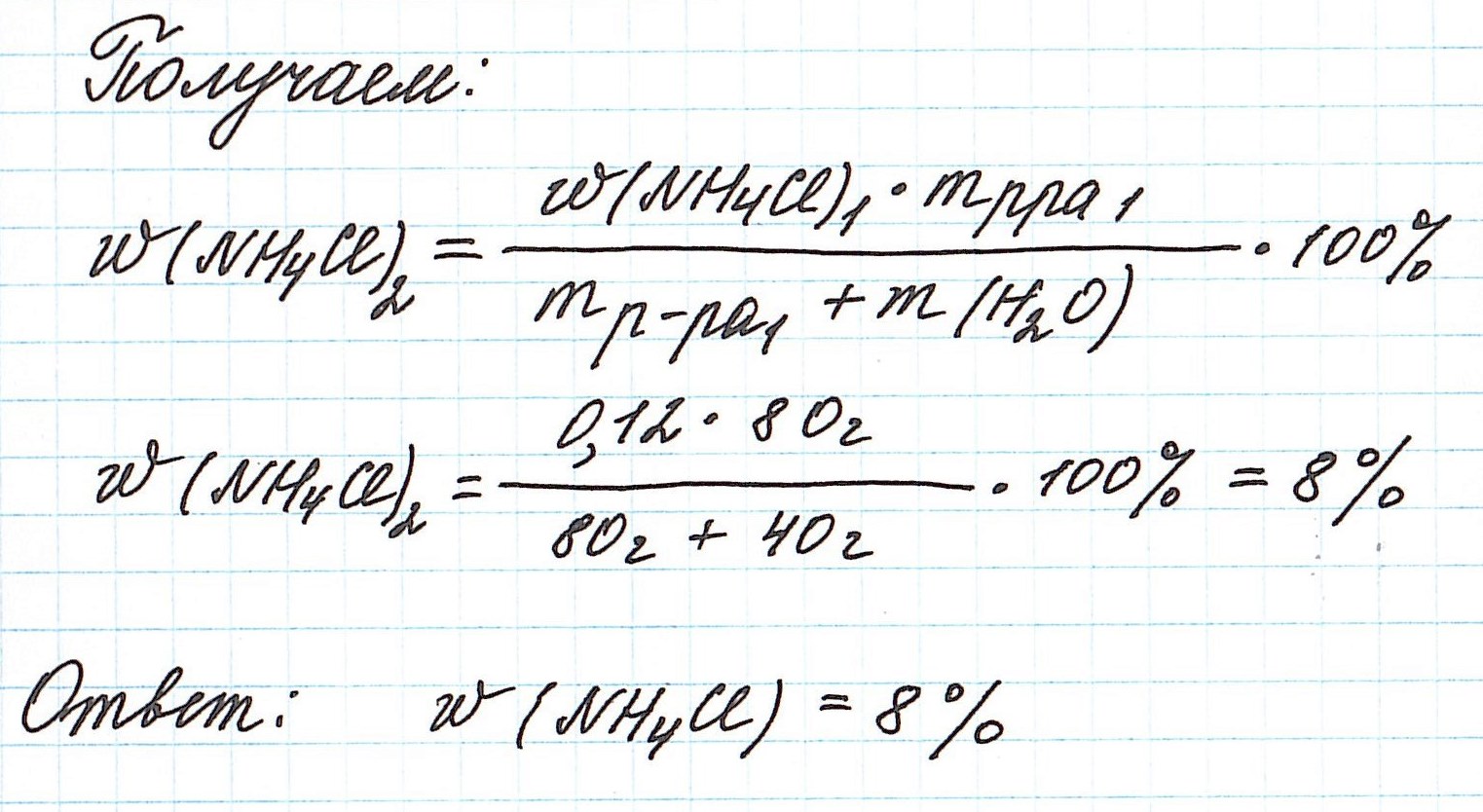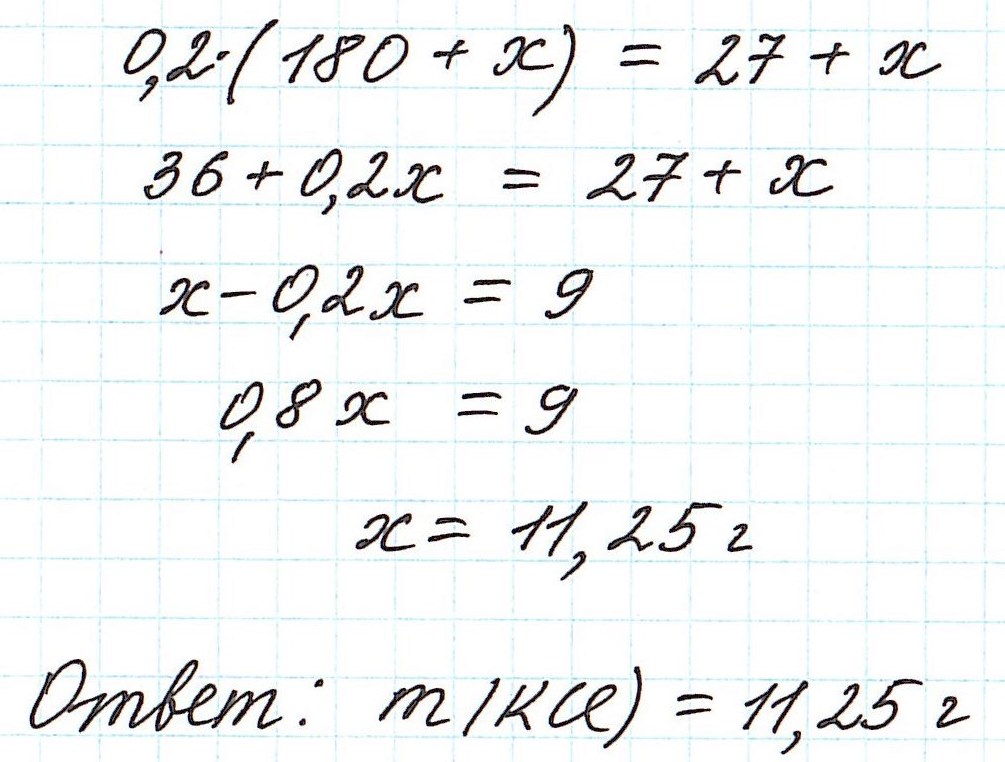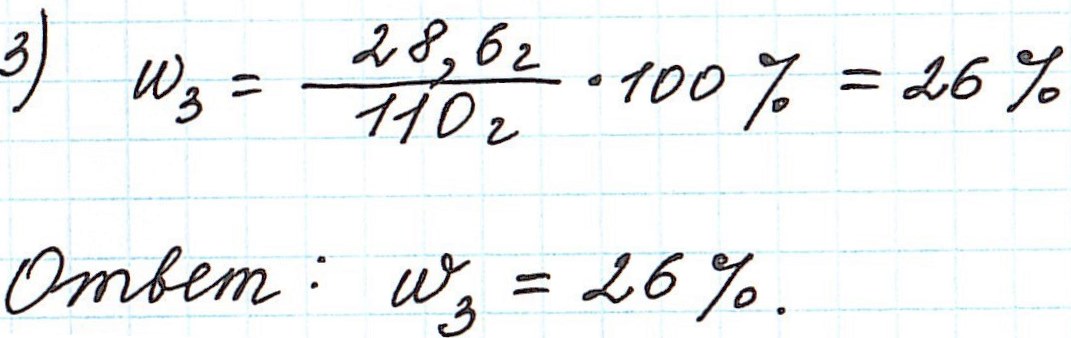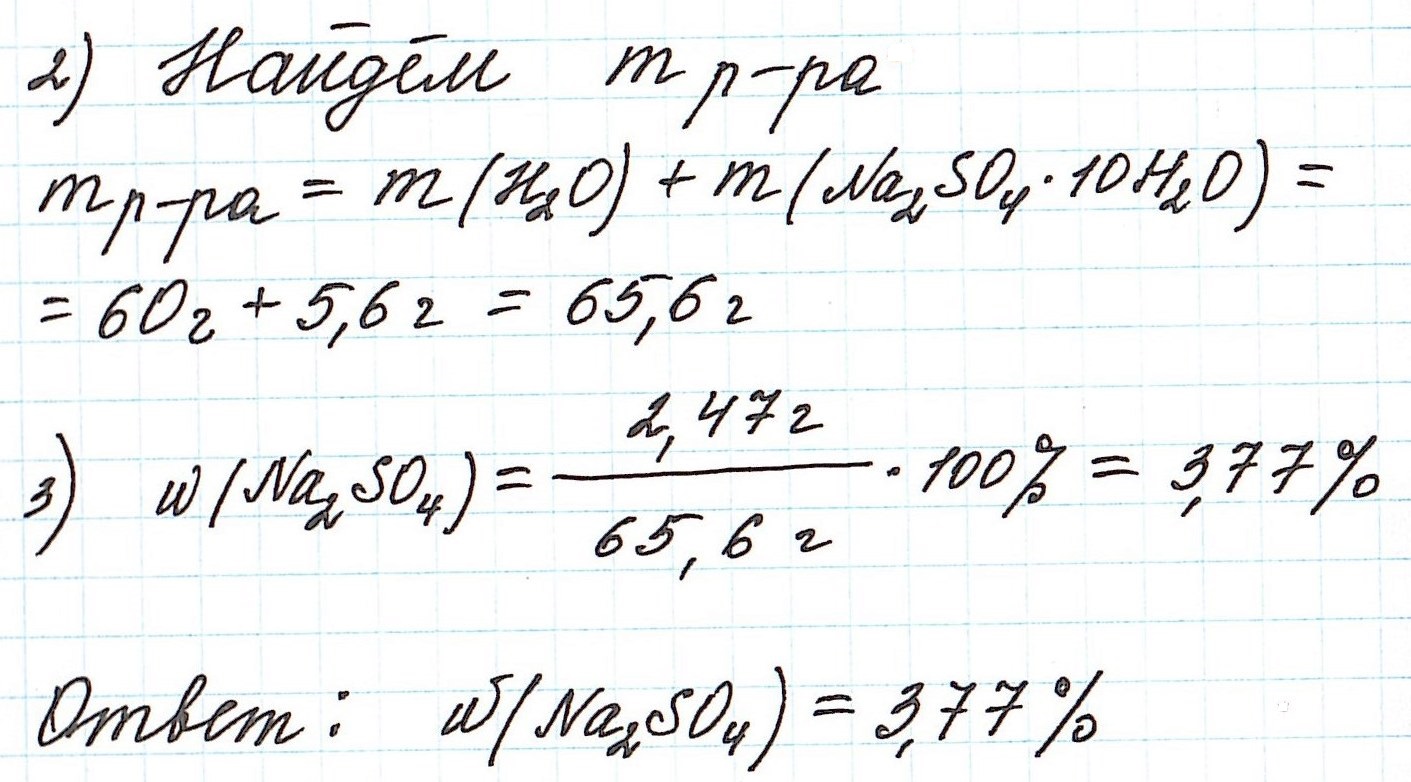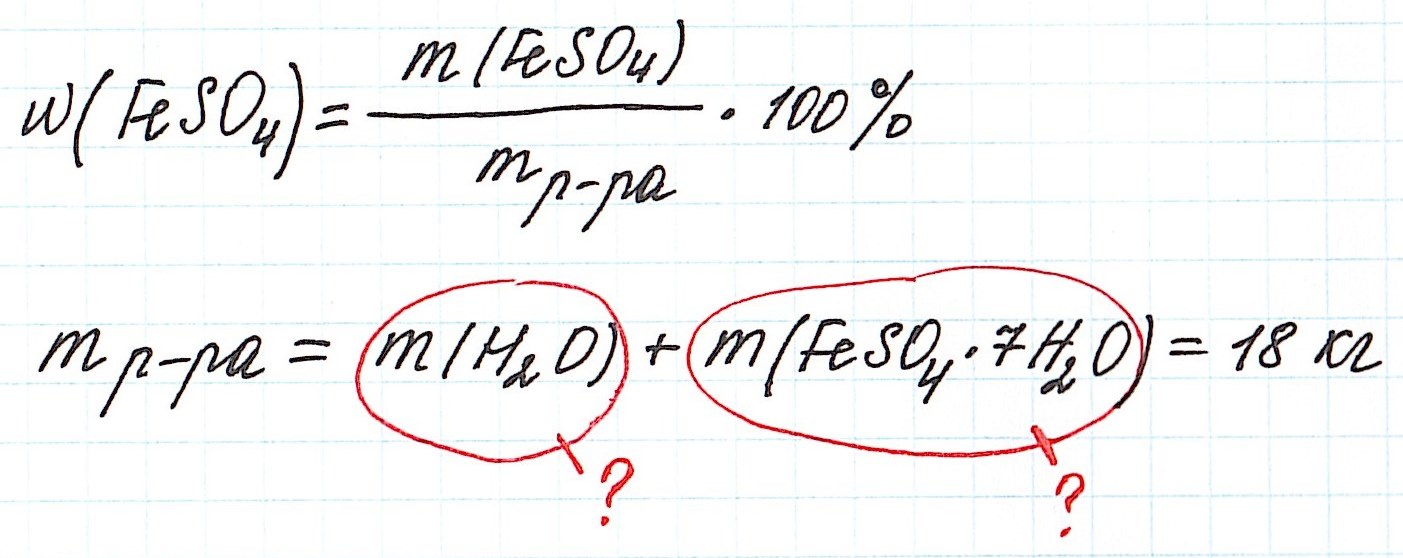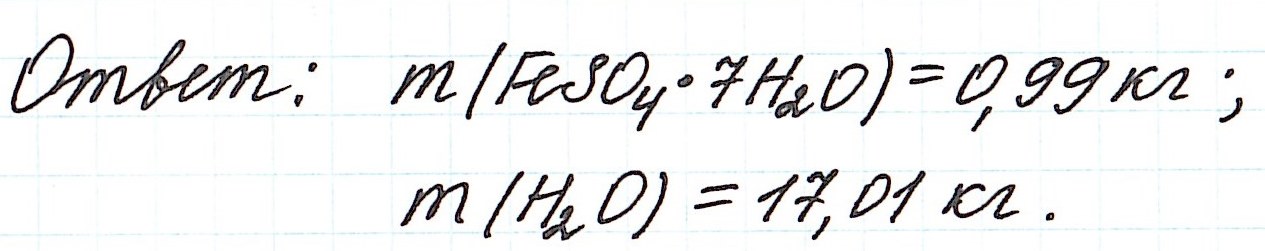Формула концентрации раствора. Их множество. И каждая соответствует тому или иному способу выражения концентрации. А в химии их применяются достаточно: массовая доля растворенного вещества, молярная, нормальная, моляльная, титр и др.
Зачем так много? Ответ на этот вопрос очень прост. Каждый вид концентрации удобен в том или ином случае, когда применение другого вида концентрации неуместно.
Например, при исследовании содержания массы вещества в очень небольшом объеме раствора удобно пользоваться титром. А в каких-то технологиях вообще концентрация заменяется другими количественными характеристиками раствора. Так, в технологии посола рыбы для расчета необходимой концентрации тузлука (раствора поваренной соли) используют не его процентную концентрацию, а плотность.
Содержание:
1. Концентрация – что это такое
2. Формула концентрации раствора: основные виды
3. Массовая доля растворенного вещества и примеры ее вычисления
- разбавление раствора водой
- концентрирование раствора путем упаривания
- концентрирование раствора путем добавления растворенного вещества
- смешивание двух растворов
- применение кристаллогидратов для приготовления раствора (задачи на кристаллогидраты)
4. Правило «креста» в химии растворов как метод решения задач на процентную концентрацию растворов
Концентрация – что это такое
Любой раствор имеет различные характеристики: качественные и количественные. Одной из важнейших количественных характеристик является концентрация раствора.
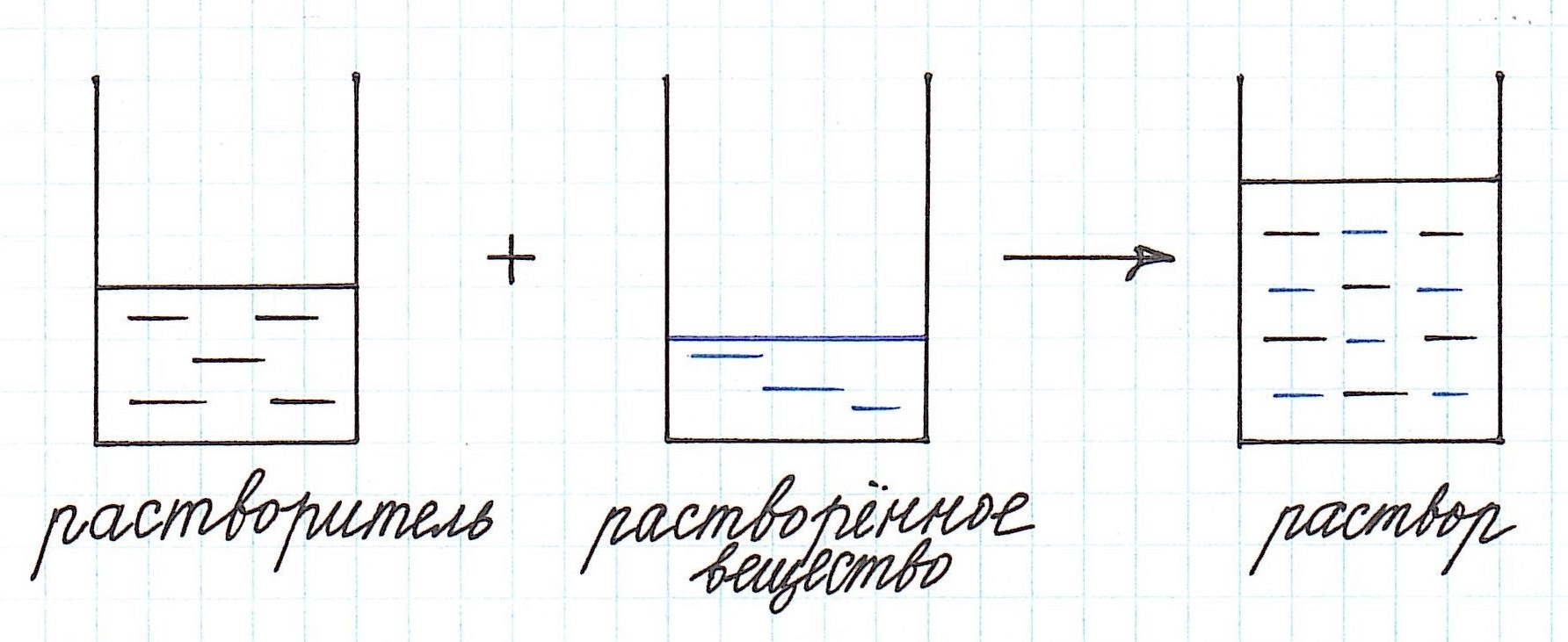
Концентрация раствора – это количество растворенного вещества, содержащееся в определенном количестве раствора.
Как видно из приведенного определения, основными компонентами раствора являются:
— растворитель;
— растворенное вещество.
Растворенного вещества в растворе всегда меньше, а растворителя больше.
И вот именно с вычислением количественного содержания растворенного вещества чаще всего и связаны все расчеты, основанные на применении формулы концентрации раствора.
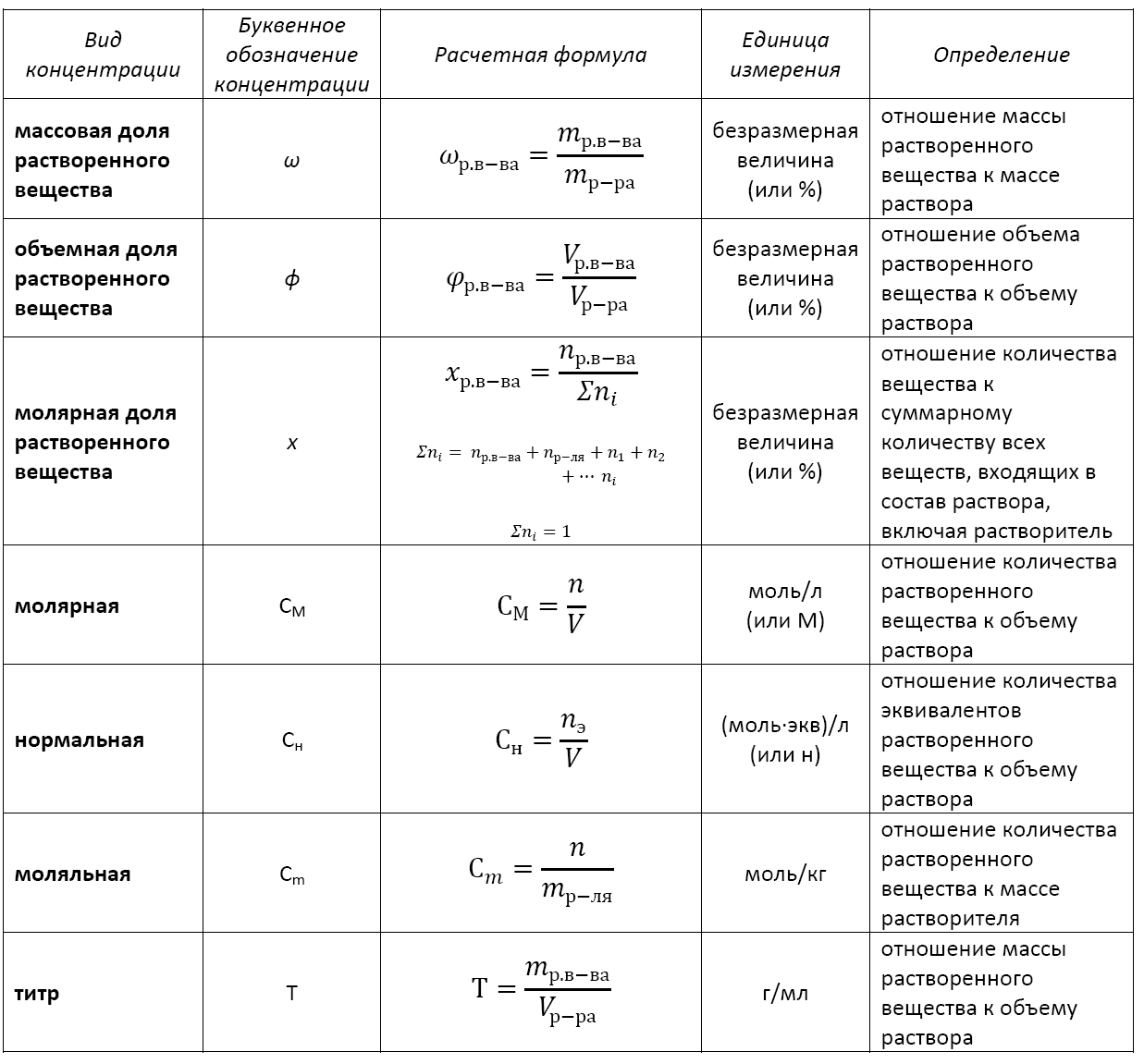
Существует несколько видов концентрации раствора:
— массовая доля растворенного вещества;
— объемная доля растворенного вещества;
— молярная доля растворенного вещества;
— молярная (или молярность);
— моляльная (или моляльность);
— нормальная (или эквивалентная);
— титр.
Формула концентрации раствора: основные виды
Применение того или иного вида концентрации уместно в каждом конкретном случае. Не существует какой-то универсальной концентрации или универсальной формулы концентрации раствора.
Кстати, с помощью математических преобразований можно перейти от одной концентрации к другой или найти взаимосвязь между разными их видами.
Основные расчетные формулы концентрации раствора приведены в таблице:
Массовая доля растворенного вещества и примеры ее вычисления
Массовая доля растворенного вещества – это отношение массы растворенного вещества к массе раствора.
Ее расчетная формула выглядит так:
где ωр.в-ва – массовая доля растворенного вещества, mр.в-ва – масса растворенного вещества, mр-ра – масса раствора.
ωр.в-ва представляет собой долю или от единицы или от 100%. Так, например, имеется двухпроцентный раствор NaCl. Его концентрация будет записана в первом случае ω(NaCl) = 0,02, а во втором – ω(NaCl) = 2%. Форма записи основной сути не меняет. Можно записывать и так, и так.
Что же означает выражение ω(NaCl) = 0,02 или ω(NaCl) = 2%? Буквально следующее: в 100 г водного раствора поваренной соли содержится 2 г этой соли и 98 г воды.
Необходимо помнить, что раствор состоит из растворителя и растворенного вещества. Поэтому масса раствора будет состоять из массы растворителя и массы растворенного вещества:
Тогда основную расчетную формулу для массовой доли растворенного вещества можно преобразовать:
Очень часто в расчетах с процентной концентрацией используются плотность и объем раствора:
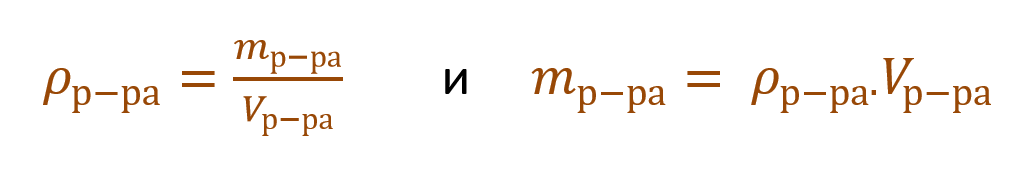
В других ситуациях могут использоваться объем и плотность не раствора, а растворителя. Тогда основная формула для расчета концентрации будет выглядеть так:
На практике бывает необходимо не только приготовить раствор с какой-либо определенной концентрацией, но и увеличить, либо уменьшить ее значение. Это достигается различными приемами:
— упариванием раствора;
— добавлением растворенного вещества;
— добавлением к раствору растворителя (например, воды).
Кроме того, приходится часто смешивать друг с другом растворы разных концентраций.
Разберем все возможные случаи.
Мы рекомендуем задачи, в которых речь идет о растворах, решать с использованием схематических рисунков. Это очень наглядно, особенно, когда речь идет о смешивании растворов.
Начнем с самого простого: вычислим концентрацию раствора.
Пример 1. В 200 г воды растворили 40 г глюкозы. Вычислите массовую долю глюкозы в полученном растворе.
Обратите внимание, что речи о каком-либо химическом взаимодействии не идет! Поэтому записывать уравнения реакций не требуется!
Запишем общую формулу для расчета массовой доли растворенного вещества:
В данной задаче глюкоза (C6H12O6) – растворенное вещество, а вода (H2O) – растворитель. Масса раствора будет складываться из массы глюкозы и массы воды:
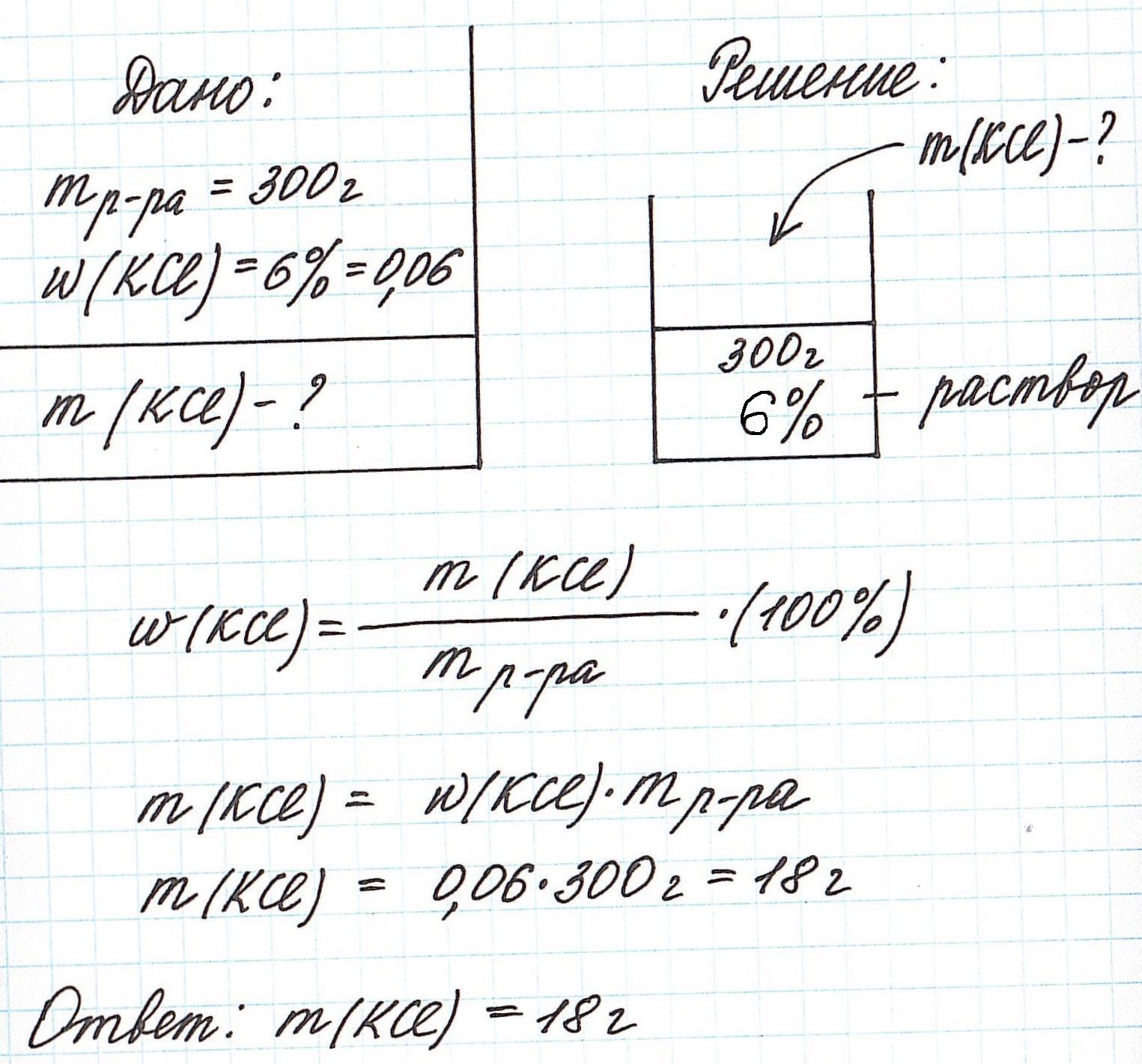
Пример 2. Рассчитайте, сколько потребуется хлорида калия, чтобы приготовить 300 г раствора с массовой долей соли 6%.
Обратите внимание, для того, чтобы расчеты были менее громоздкими, будем использовать выражение концентрации не в %, а в долях от единицы.
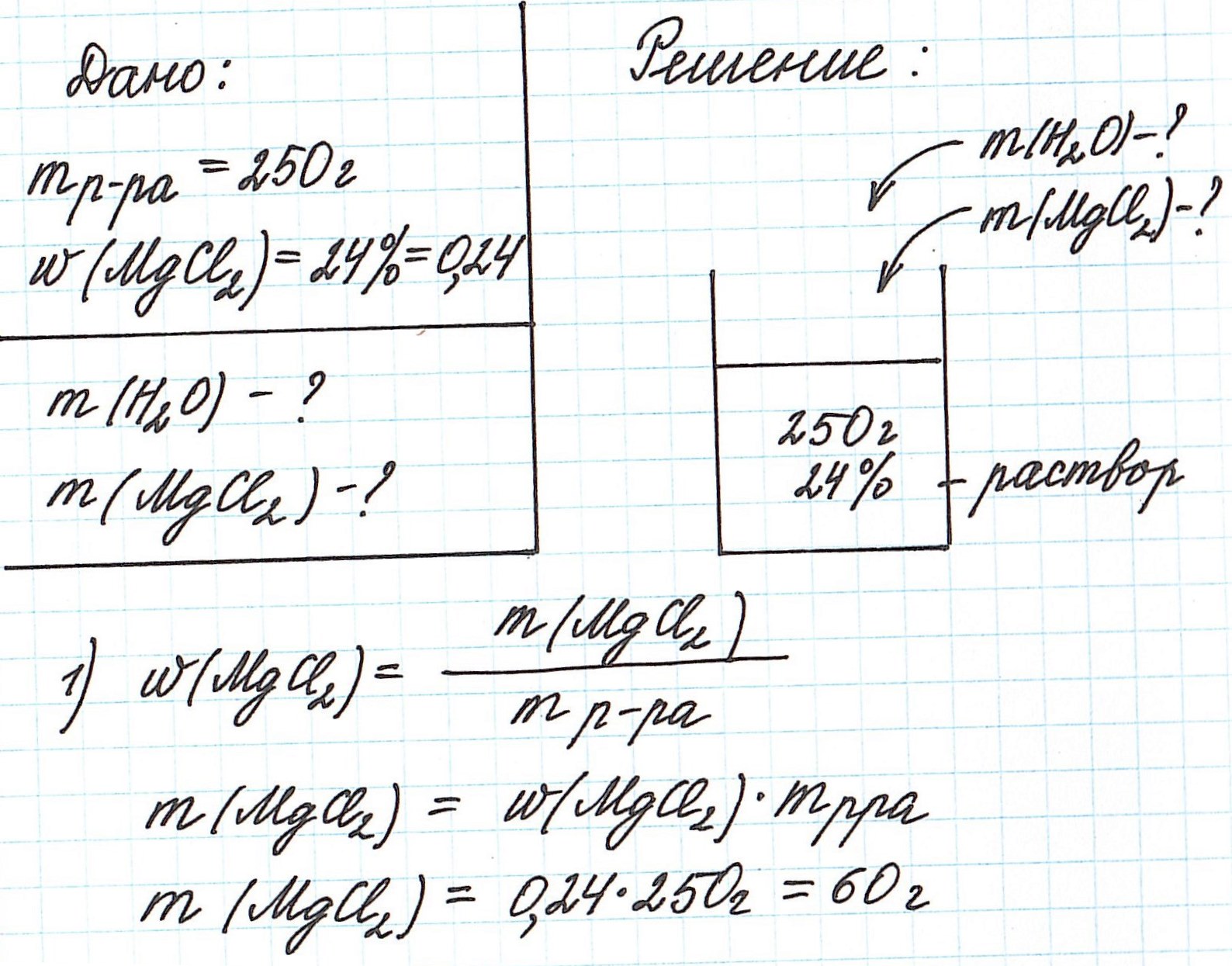
Пример 3. Необходимо приготовить 250 г раствора с массовой долей хлорида магния 24%. Рассчитайте массу требуемых воды и соли.
Так как раствор готовится из хлорида магния и воды, то и масса раствора равна сумме масс хлорида магния и воды:
Рассмотрим задачу, в которой в качестве растворителя выступает не вода, а другое вещество.
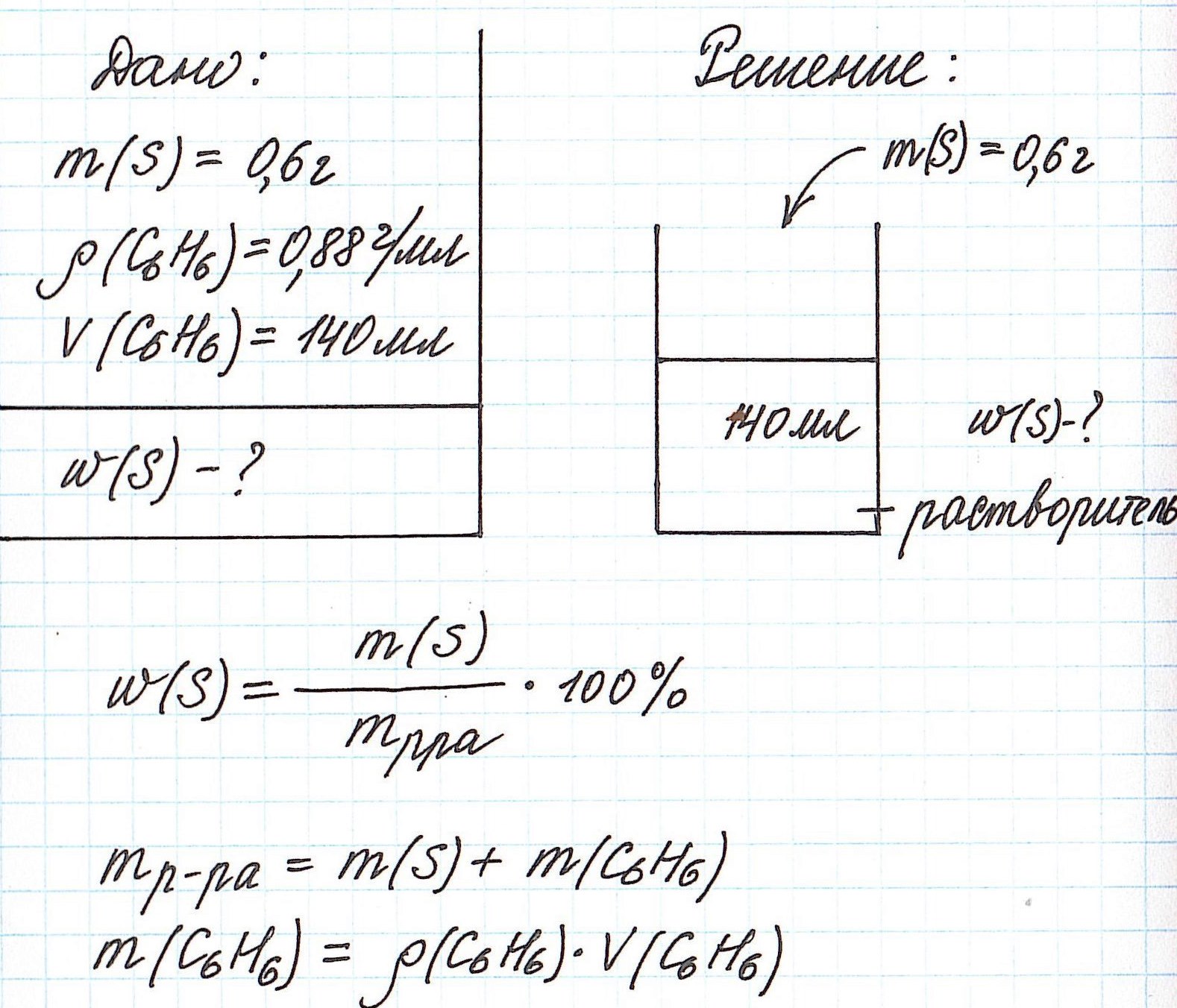
Пример 4. В органическом растворителе бензоле объемом 140 мл растворили серу массой 0,6 г. Вычислите массовую долю серы в полученном растворе, если плотность бензола составляет 0,88 г/мл.
Обратите внимание, что здесь:
— масса раствора не известна;
— масса растворителя (бензола) не известна;
— известны объем и плотность растворителя (бензола), что позволяет нам найти его массу;
— масса раствора состоит из массы растворителя (бензол) и массы растворенного вещества (сера).
Объединим все расчетные формулы в одну и подставим в нее имеющиеся численные значения:
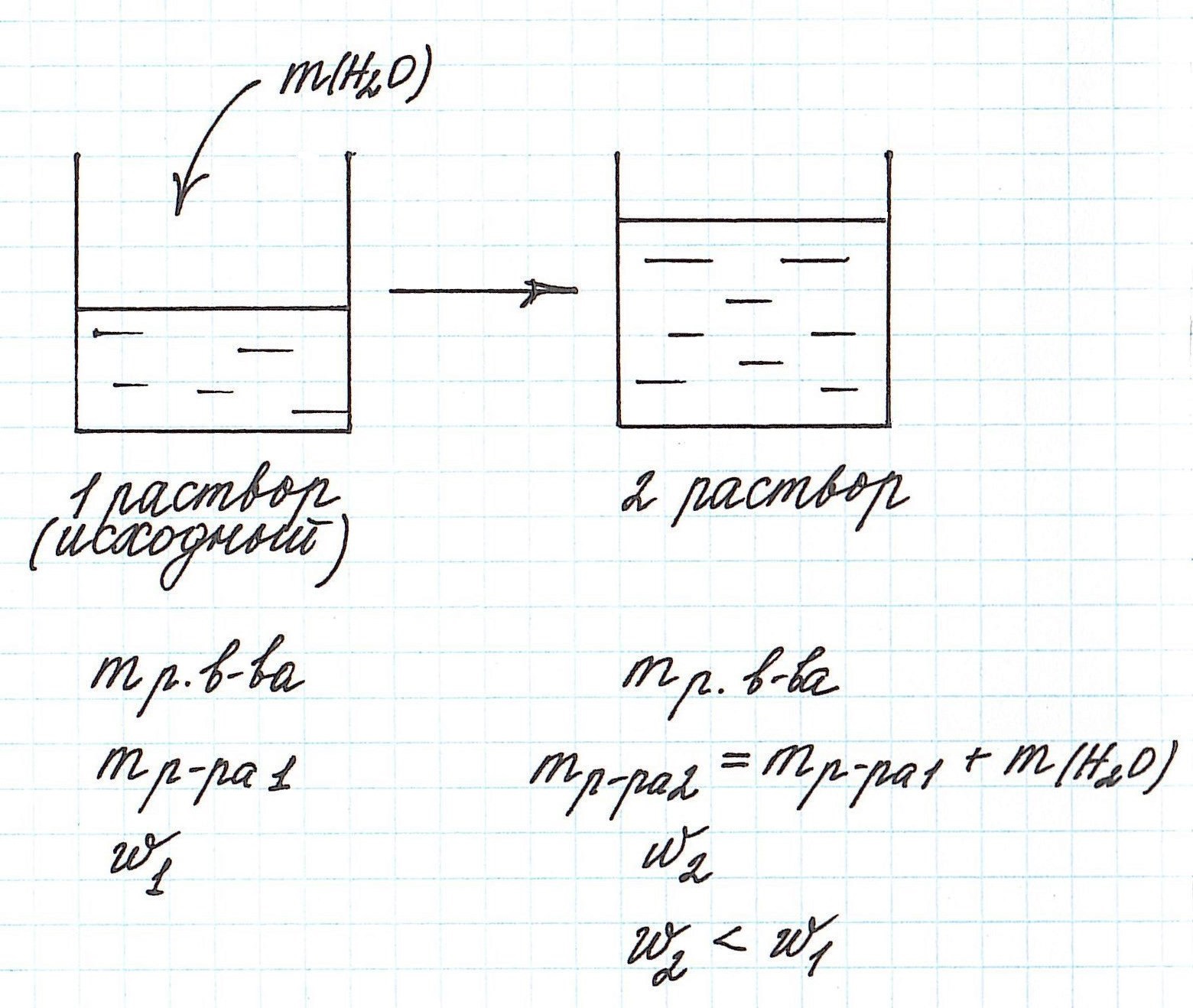
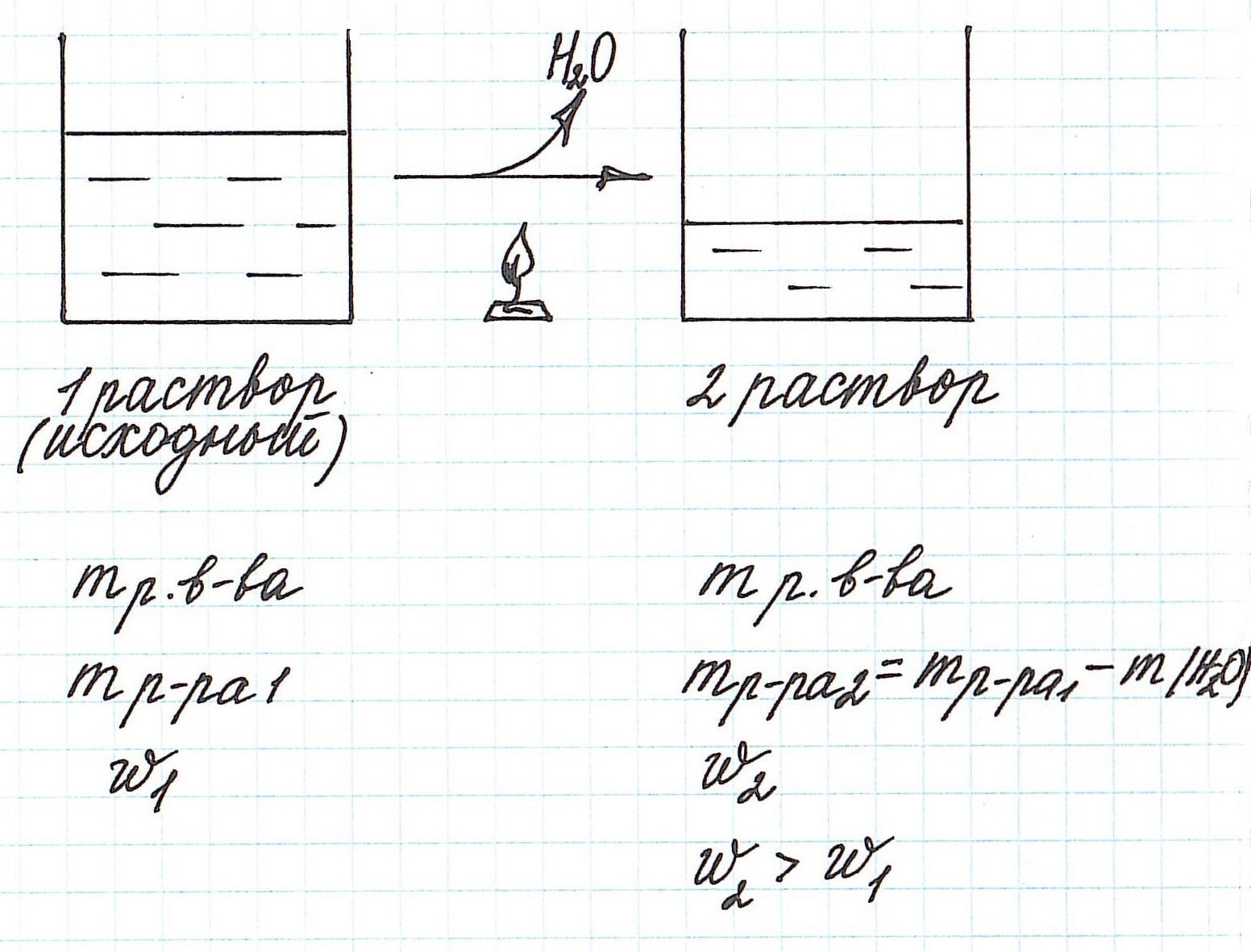
Вычисление массовой доли растворенного вещества при разбавлении раствора водой
Разбавление раствора водой приводит к уменьшению его концентрации.
Запомним, что в таких случаях:
— увеличивается масса раствора;
— увеличивается масса растворителя;
— масса растворенного вещества остается постоянной.
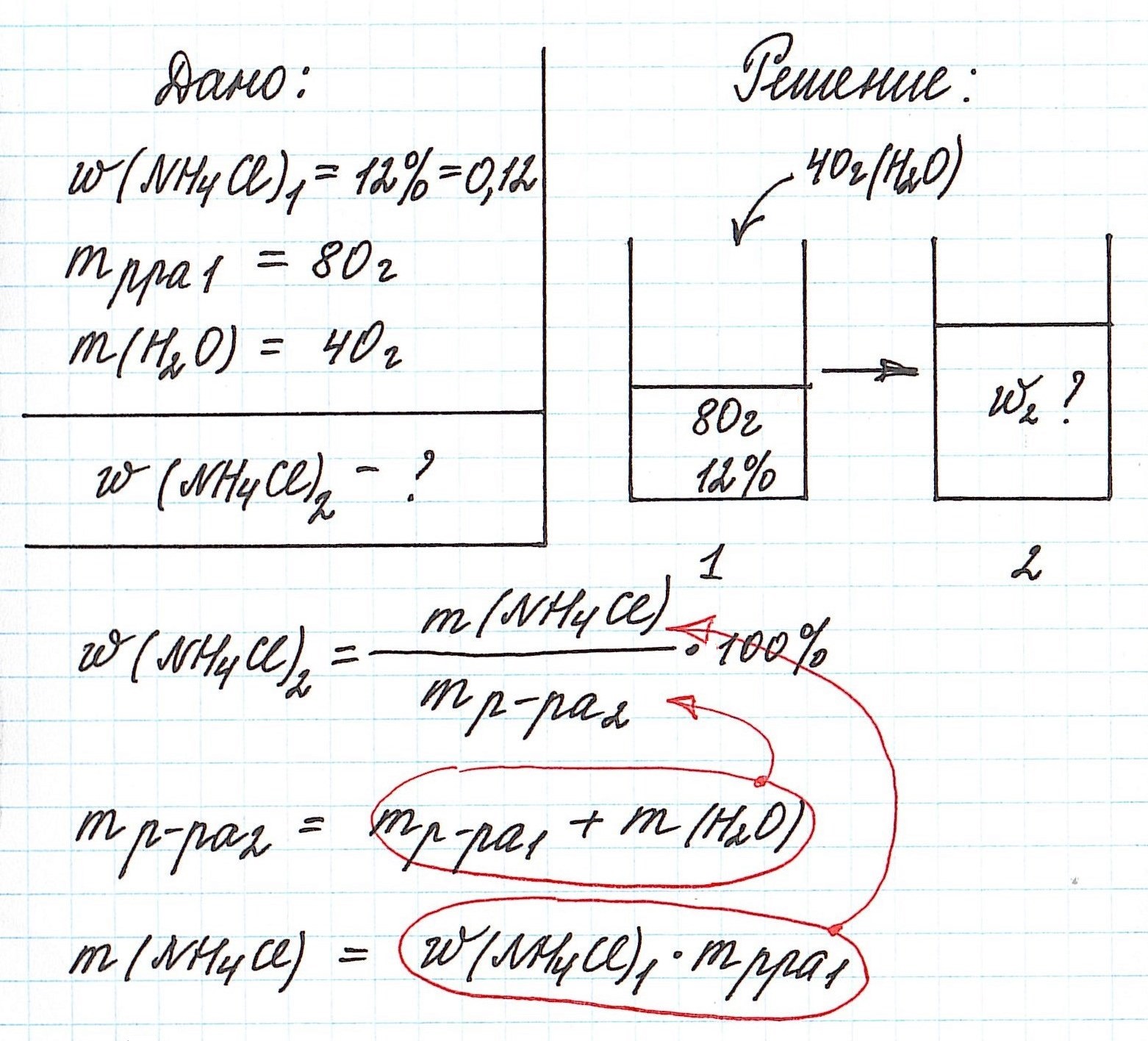
Пример 5. К 80 г раствора с массовой долей NH4Cl 12% добавили 40 г воды. Вычислите массовую долю хлорида аммония в полученном растворе.
Объединим все полученные формулы в одну и подставим имеющиеся данные:
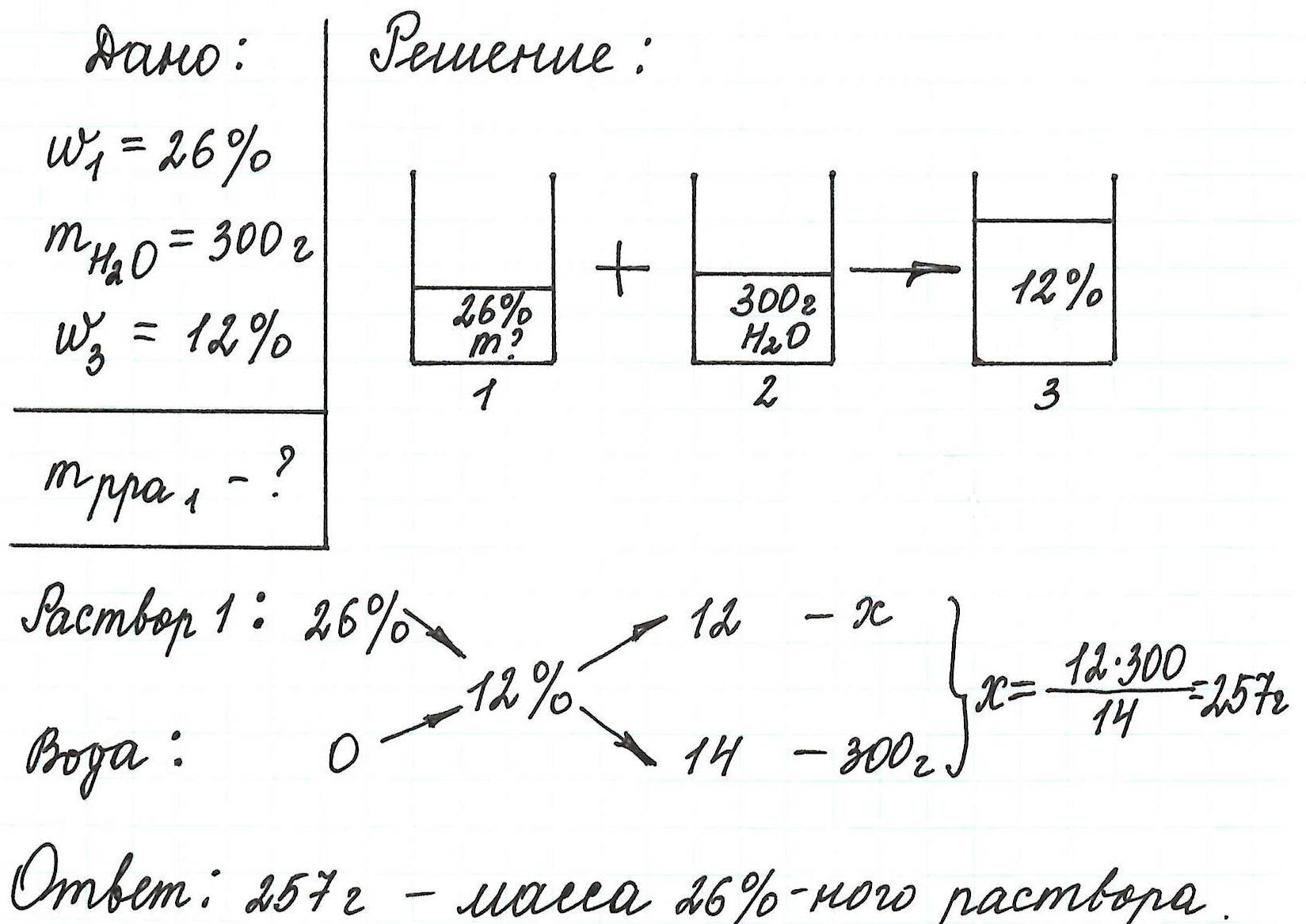
Пример 6. Рассчитайте объем раствора фосфорной кислоты (массовая доля кислоты 12%, плотность 1,065 г/мл), который потребуется для приготовления раствора с массовой долей H3РO4 4% объемом 250 мл (плотность 1,02 г/мл).
В данной задаче речь напрямую о разбавлении раствора не идет. Но судя по тому, что исходный раствор имел концентрацию 12%, а конечный – 4%, становится ясно: последний раствор можно получить путем разбавления первого водой.
Вычисление массовой доли растворенного вещества при концентрировании раствора путем упаривания
Упаривание раствора, т.е. его нагревание, при котором происходит испарение воды, приводит к увеличению концентрации.
Учтите, что при этом:
— уменьшается масса раствора;
— уменьшается масса растворителя;
— масса растворенного вещества остается постоянной (при условии, что растворенное вещество не разлагается при данной температуре).
Пример 7. Из 200 г 27%-ного раствора глюкозы выпарили 20 г воды. Определите массовую долю глюкозы в полученном растворе.
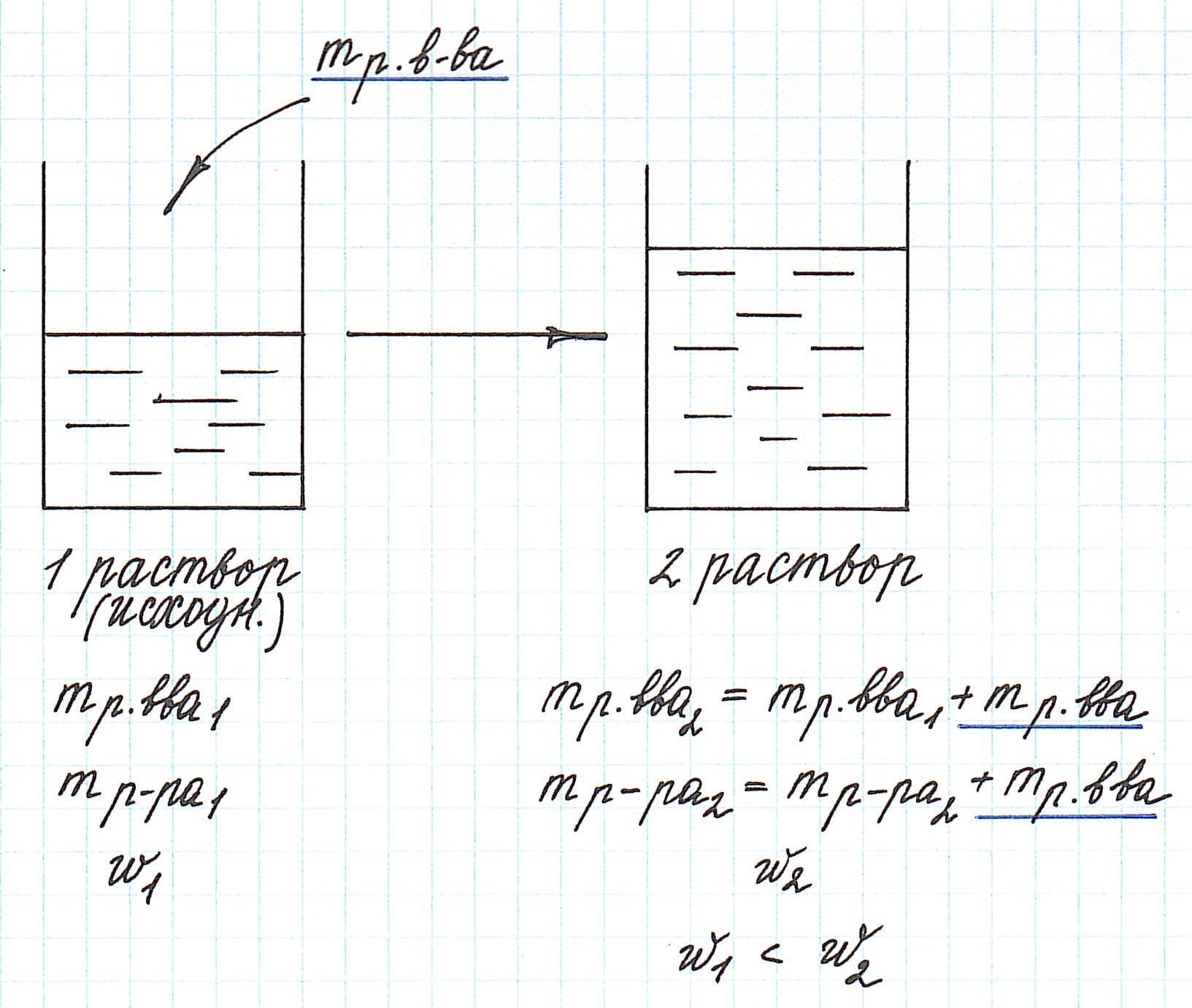
Вычисление массовой доли растворенного вещества при концентрировании раствора путем добавления растворенного вещества
Добавление к уже существующему раствору новой порции растворенного вещества приводит к увеличению концентрации раствора.
Помните, что в таких случаях:
— увеличивается масса раствора;
— увеличивается масса растворенного вещества.
Пример 8. Определите массу хлорида калия, который надо добавить к 180 г 15%-ного раствора этой соли, чтобы получить 20%-ный раствор.
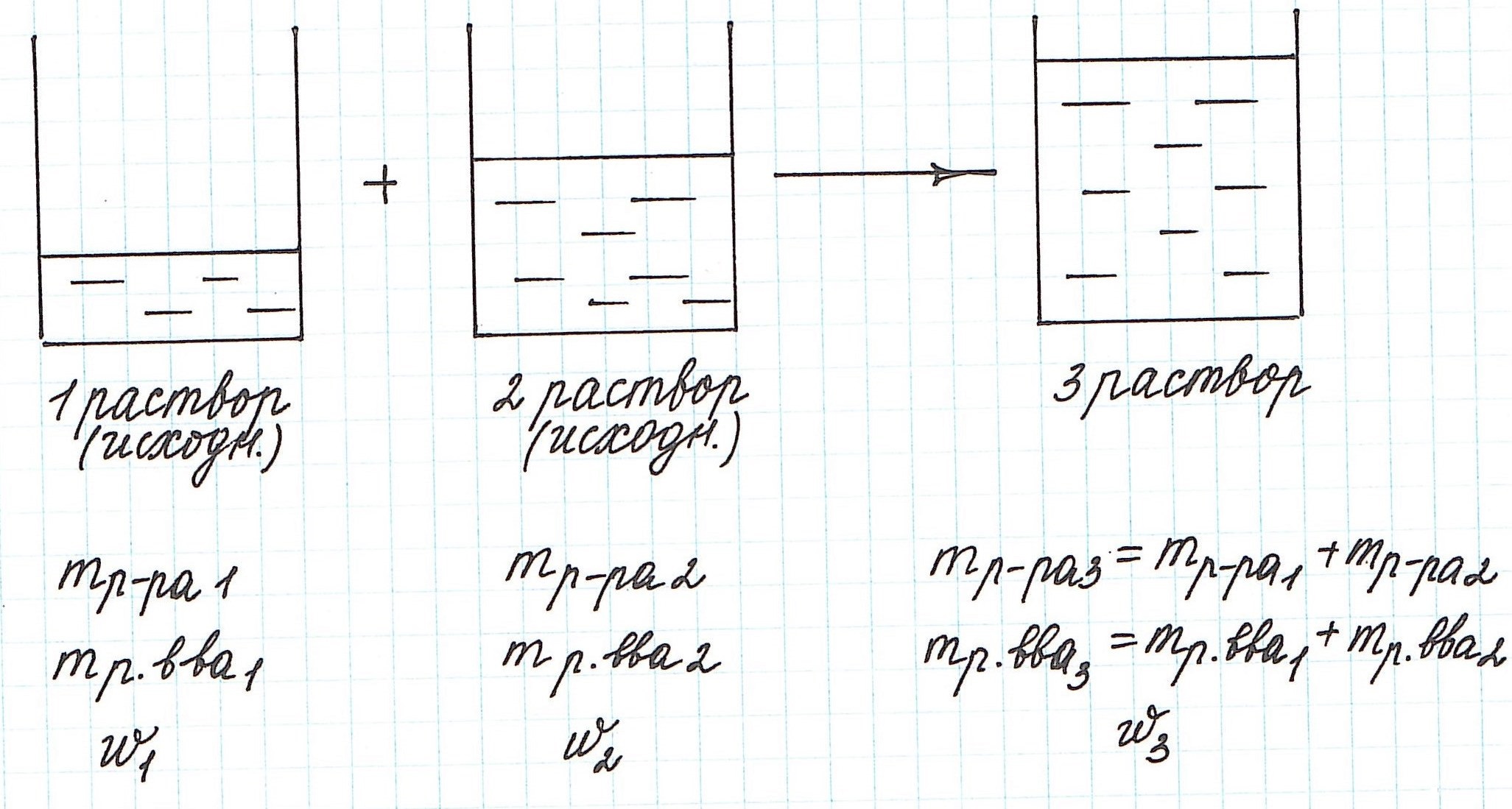
Вычисление массовой доли растворенного вещества при смешивании двух растворов
При смешивании двух растворов (речь о растворах одного и того же вещества конечно же) изменяются все количественные характеристики:
— увеличивается масса раствора;
— увеличивается масса растворенного вещества;
— изменяется массовая доля растворенного вещества.
Пример 9. Смешали 80 г 32%-ного раствора и 30 г 10%-ного раствора нитрата меди (II). Какова концентрация соли в полученном растворе?
Вычисление массовой доли растворенного вещества с применением кристаллогидратов для приготовления раствора
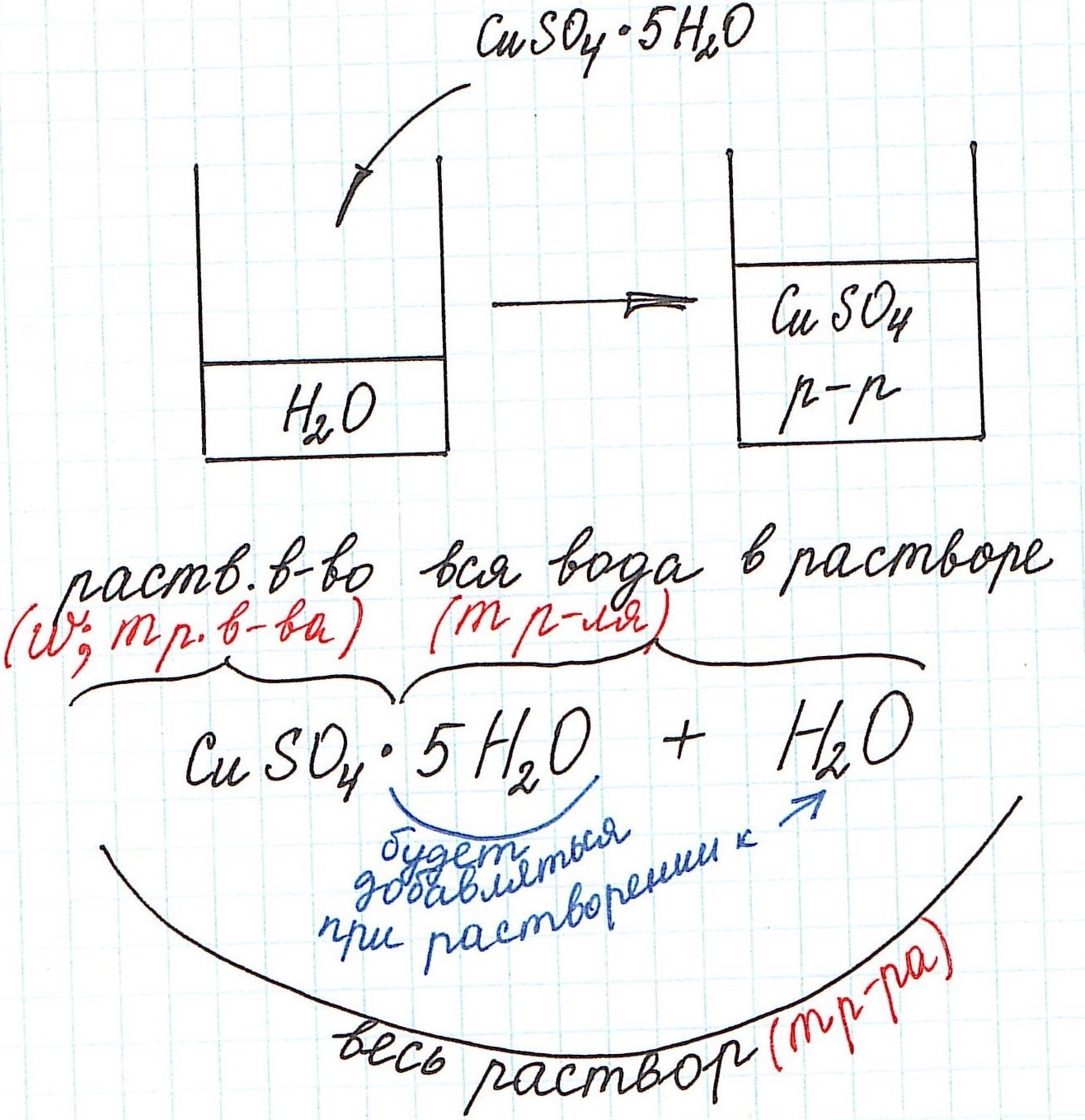
Кристаллогидраты используются для приготовления растворов довольно часто. Кристаллогидраты представляют собой вещества, в состав которых помимо основного вещества входят молекулы воды. Например:
CuSO4·5H2O – кристаллогидрат сульфата меди (II) (или медный купорос);
Na2SO4·10H2O – кристаллогидрат сульфата натрия (или глауберова соль).
Больше примеров здесь.
Вода, входящая в состав кристаллогидрата, называется кристаллизационной.
Кристаллогидраты различаются прочностью связи между основным веществом и кристаллизационной водой. Одни из них теряют воду при комнатной температуре с течением времени и перестают быть кристаллогидратами (например, Na2СO3·10H2O). Другие – обезвоживаются только при сильном нагревании (например, CuSO4·5H2O).
При расчете концентрации с использованием кристаллогидратов для получения растворов часто приходится учитывать и кристаллизационную воду.
Но сначала поясним некоторые нюансы на конкретном примере:
1) Формула CuSO4·5H2O означает, что 1 моль CuSO4·5H2O содержит 1 моль CuSO4 и 5 моль H2O. Это можно было бы записать так:
n(CuSO4) = n(CuSO4·5H2O); n(H2O) = 5n(CuSO4·5H2O)
2) Относительная молекулярная (и численно молярная) масса будет складываться из относительной молекулярной массы вещества и относительной молекулярной массы воды. Например:
Mr(CuSO4·5H2O) = Mr(CuSO4) + 5·Mr(H2O) = 160 + 5·18 = 250 и, соответственно,
M(CuSO4·5H2O) = M(CuSO4) + 5·M(H2O) = 160 + 5·18 = 250 г/моль.
3) Еще одну особенность поясним с помощью рисунка:
Итак, разберем несколько типичных задач.
Пример 10. В 60 г воды растворили глауберову соль Na2SO4·10H2O массой 5,6 г. Какова массовая доля сульфата натрия в полученном растворе?
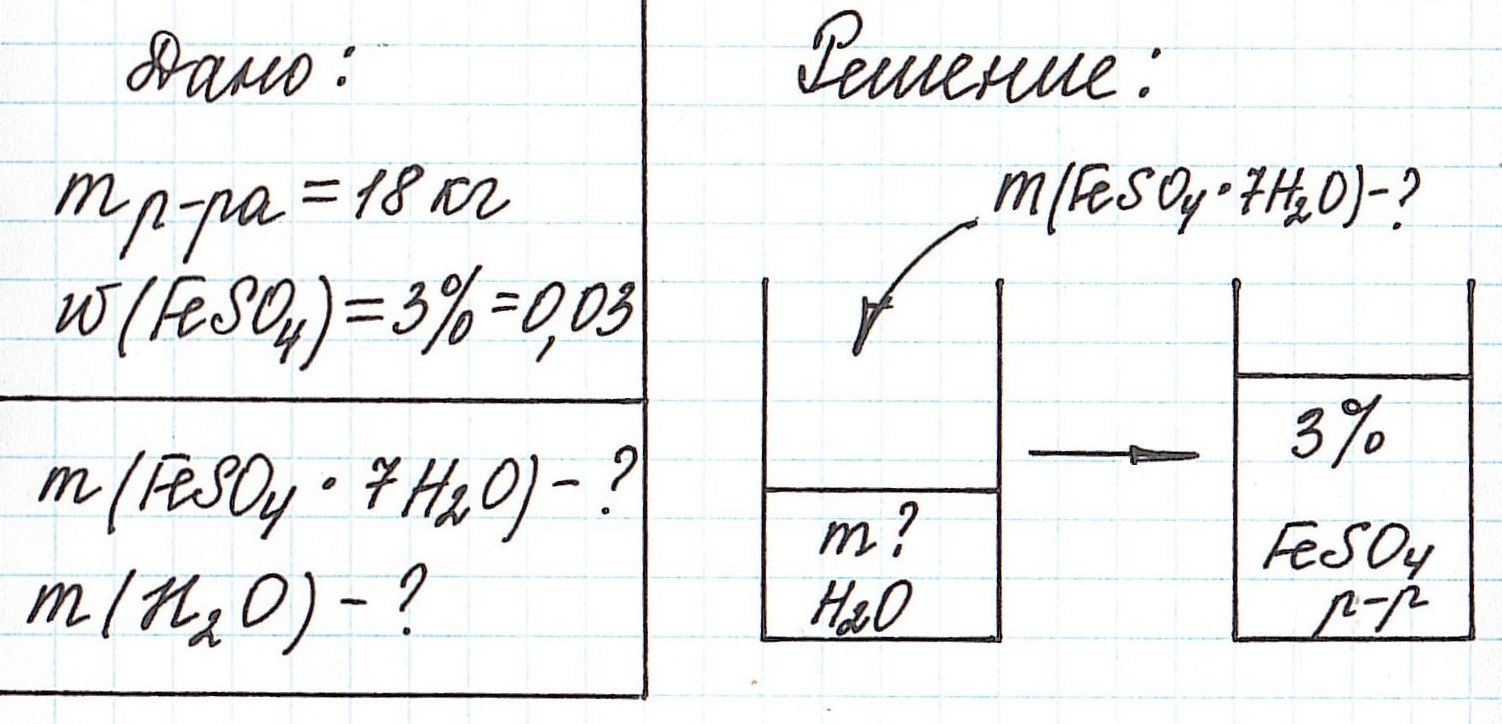
Пример 11. Какая масса железного купороса FeSO4·7H2O и воды потребуется для приготовления 18 кг раствора сульфата железа (II) с массовой долей FeSO4 3%?
Обратите внимание, что масса раствора дана не в граммах (г), а в килограммах (кг). Для того, чтобы привести в ходе расчетов все единицы измерения к единой системе, можно перевести килограммы в граммы и вычислять как обычно.
Но есть более простой способ. Можно считать количество вещества не в моль, а в киломоль (кмоль). Молярную массу вычислять не в г/моль, а в кг/кмоль. В этом случае ответ в задаче мы сразу получим в килограммах.
Пример 12. Вычислите массу кристаллогидрата сульфата никеля NiSO4·7H2O, который надо добавить к 180 г раствора с массовой долей сульфата никеля 1,5%, чтобы получить раствор с массовой долей соли 6%?
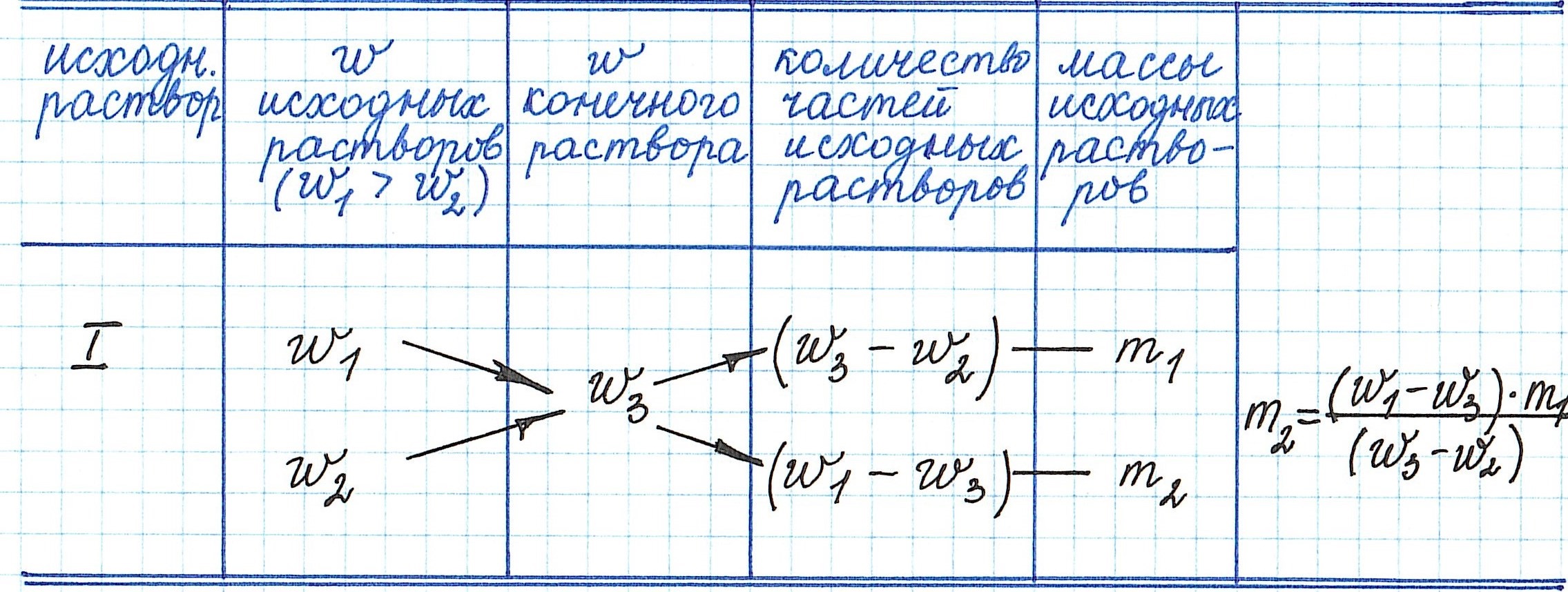
Правило «креста» в химии растворов как метод решения задач на процентную концентрацию растворов
Правилом «креста» (или «квадратом Пирсона») очень удобно пользоваться в расчетах, связанных с разбавлением или смешиванием растворов.
Общая схема вычислений выглядит так:
Пример 13. Какую массу 5%-ного раствора глюкозы надо добавить к 70 г 21%-ного раствора этого же вещества, чтобы получить 12%-ный раствор?
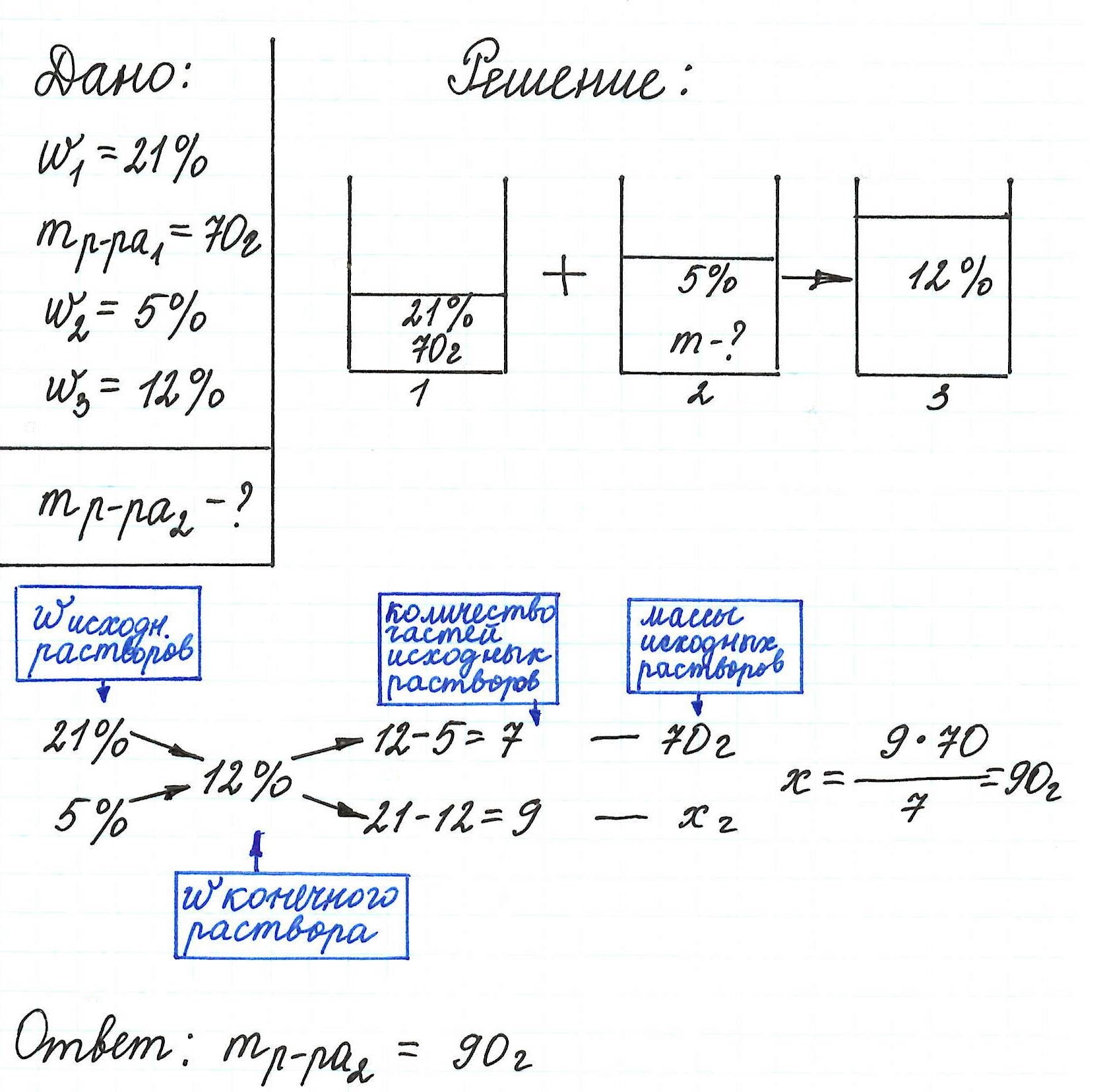
Еще примеры с применением правила «креста» можно посмотреть здесь.
Мы рассмотрели достаточно примеров расчетов, где используется формула такой концентрации раствора как массовая доля растворенного вещества. Как видим, ситуаций, в которых требуется ее применение, множество. Однако, есть достаточно случаев, когда более приемлемыми являются формулы других концентраций (молярной, нормальной, титра и т.д.). Об этом читайте в других статьях.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
или на Одноклассниках
Пожалуйста, оцените публикацию. Большая просьба, если вы оцениваете публикацию от 1 до 3 звезд, обязательно оставьте свой комментарий с указанием того, что не так с этой публикацией. Мы постараемся устранить недостатки.
Ваше мнение для нас важно!
Как найти концентрацию вещества 🚩 как записать рациональное выражение концентрации раствора 🚩 Естественные науки
Массовая доля – это отношение массы вещества к массе раствора или смеси: w = m(в)/m(р-ра), где w – массовая доля, m(в) – масса вещества, m(р-ра) – масса раствора, или w = m(в)/m(см), где m(см) – масса смеси. Выражается в долях единицы или процентах.
Дополнительные формулы, которые могут понадобиться для решения задач на массовую долю вещества:
1)m = V*p, где m – масса, V – объем, p – плотность.
2)m = n*M, где m – масса, n – количество вещества, M – молярная масса.
Мольная доля – это отношение числа молей вещества к числу молей всех веществ: q = n(в)/n(общ), где q – мольная доля, n(в) – количество определенного вещества, n(общ) – общее количество веществ.
Дополнительные формулы:
1)n = V/Vm, где n – количество вещества, V – объем, Vm – молярный объем(при нормальных условиях равен 22,4 л/моль).
2)n = N/Na, где n –количество вещества, N – число молекул, Na – постоянная Авогадро(является константой и равна 6,02*10 в 23 степени 1/моль).
Объемная доля – это отношение объема вещества к объему смеси: q = V(в)/V(см), где q – объемная доля, V(в) – объем вещества, V(см) – объем смеси.
Молярная концентрация – отношение количества данного вещества к объему смеси: Cm = n(в)/V(см), где Cm – молярная концентрация(моль/л), n – количество вещества(моль), V(см) – объем смеси(л). Решим задачу на молярную концентрацию. Определите молярную концентрацию раствора, полученного при растворении сульфата натрия массой 42,6 г в воде массой 300 г, если плотность полученного раствора равна 1,12 г/мл. Пишем формулу для вычисления молярной концентрации: Cm = n(Na2SO4)/V(см). Видим, что необходимо найти количество вещества натрия и объем раствора.
Рассчитываем: n(Na2SO4) = m(Na2SO4)/M(Na2SO4).
M(Na2SO4) = 23*2+32+16*4 = 142 г/моль.
n(Na2SO4) = 42,6/142 = 0,3 моль.
Ищем объем раствора: V = m/p
m = m(Na2SO4) + m(h3O) = 42,6 + 300 = 342,6 г.
V = 342,6/1,12 = 306 мл = 0,306 л.
Подставляем в общую формулу: Cm = 0,3/0,306 = 0,98 моль/л. Задача решена.
www.kakprosto.ru
Как правильно вычислить концентрацию — 27 Ноября 2012 — Примеры решений задач
Способы выражения концентрации растворов
Концентрацию веществ в растворах можно выразить
разными способами. На этой страничке вы с ними познакомитесь. Наиболее
часто используют массовую долю растворённого вещества, молярную и
нормальную концентрацию.
Массовая доля растворённого вещества w(B) — это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора m :
w(B)= m(B) / m
Массовую долю растворённого вещества
w(B) обычно выражают в долях единицы или в процентах. Например,
массовая доля растворённого вещества – CaCl2 в воде равна 0,06 или 6%.
Это означает,что в растворе хлорида кальция массой 100 г содержится
хлорид кальция массой 6 г и вода массой 94 г.
Пример
Сколько грамм сульфата натрия и воды нужно для приготовления 300 г 5% раствора?
Решение
m(Na2
SO4) = w(Na2SO4)*m / 100 = (5 · 300) / 100 = 15 г
где w(Na2SO4)) – массовая доля в %,
m — масса раствора в г
m(H2O) = 300 г — 15 г = 285 г.
Таким образом, для приготовления 300 г 5% раствора сульфата натрия надо взять 15 г Na2SO4) и 285 г воды.
Молярная концентрация C(B) показывает, сколько моль растворённого вещества содержится в 1 литре раствора.
C(B) = n(B) / V = m(B) / (M(B) · V),
где М(B) — молярная масса растворенного вещества г/моль.
Молярная концентрация измеряется в моль/л и
обозначается «M». Например, 2 M NaOH — двухмолярный раствор гидроксида
натрия. Один литр такого раствора содержит 2 моль вещества или 80 г
(M(NaOH) = 40 г/моль).
Пример
Какую массу хромата калия K2CrO4 нужно взять для приготовления 1,2 л 0,1 М раствора?
Решение
m(K2CrO4) = C(K2CrO4) · V · M(K2CrO4) = 0,1 моль/л · 1,2 л · 194 г/моль » 23,3 г.
Таким образом, для приготовления 1,2 л 0,1 М раствора нужно взять 23,3 г K2CrO4 и растворить в воде, а объём довести до 1,2 литра.
Концентрацию раствора можно выразить количеством
молей растворённого вещества в 1000 г растворителя. Такое выражение
концентрации называют моляльностью раствора.
Нормальность раствора
обозначает число грамм-эквивалентов данного вещества в одном литре
раствора или число миллиграмм-эквивалентов в одном миллилитре раствора.
Грамм — эквивалентом вещества называется
количество граммов вещества, численно равное его эквиваленту. Для
сложных веществ — это количество вещества, соответствующее прямо или
косвенно при химических превращениях 1 грамму водорода или 8 граммам
кислорода.
Эоснования = М
основания / число замещаемых в реакции гидроксильных групп
Экислоты = Мкислоты / число замещаемых в реакции атомов водорода
Эсоли = Мсоли / произведение числа катионов на его заряд
Пример
Вычислите значение грамм-эквивалента (г-экв.) серной кислоты, гидроксида кальция и сульфата алюминия.
Э H2SO4 = М H2SO4 / 2 = 98 / 2 = 49 г
Э Ca(OH)2 = М Ca(OH)2 / 2 = 74 / 2 = 37 г
Э Al2(SO4)3 = М Al2(SO4)3 / (2· 3) = 342 / 2= 57 г
Величины нормальности обозначают буквой «Н». Например, децинормальный раствор серной кислоты обозначают «0,1 Н раствор H2SO4«.
Так как нормальность может быть определена только для данной реакции,
то в разных реакциях величина нормальности одного и того же раствора
может оказаться неодинаковой. Так, одномолярный раствор H
2SO4 будет однонормальным, когда он предназначается для реакции со щёлочью с образованием гидросульфата NaHSO4, и двухнормальным в реакции с образованием Na2SO4.
Пример
Рассчитайте молярность и нормальность 70%-ного раствора H2SO4 (r = 1,615 г/мл).
Решение
Для вычисления молярности и нормальности надо знать число граммов H2SO4в 1 л раствора. 70% -ный раствор h3SO4 содержит 70 г h3SO4 в 100 г раствора. Это весовое количество раствора занимает объём
V = 100 / 1,615 = 61,92 мл
Следовательно, в 1 л раствора содержится 70 · 1000 / 61,92 = 1130,49 г H2SO4
Отсюда молярность данного раствора равна: 1130,49 / М (H2SO4) =1130,49 / 98 =11,53 M
Нормальность этого раствора (считая, что кислота
используется в реакции в качестве двухосновной) равна 1130,49 / 49
=23,06 H
Онлайн сервис решения химических задач
www.reshim.su
Как Рассчитать Концентрацию Раствора
В химии раствором называют однородную смесь двух компонентов – растворенного вещества и растворителя, в котором оно растворено. Концентрация является мерой того, насколько растворенное вещество растворено в растворителе. Существует много причин, по которым рассчитывают концентрацию растворов, но применяемая техника измерения является схожей как для измерения уровня хлорина в горячей воде из крана, так и для проведения жизненно важного анализа крови. Эта статья научит вас базовым методам химии растворов, а также разберет один из наиболее распространенных практических методов на примере ухода за аквариумом.
Ваши действия
Способ 1 из 3: Изучаем основы концентрации
-
Учимся записывать концентрацию. Концентрация растворенного вещества – это, попросту говоря, количество растворенного вещества, разделенное на количество растворителя, в котором оно растворено. Но в связи с тем, что существует несколько способов записи «количества» данного раствора, существует и несколько вариантов записи концентрации. Вот несколько наиболее распространенных вариантов:
- Граммы на литр (грл.) Просто вес растворяемого вещества в граммах, растворенного на данное количество раствора (которое не всегда такое же, как количество растворителя). Как правило, используется для растворов, полученных из сухого растворяемого вещества и жидкого растворителя.
- Молярность(моль.) Число моль растворенного вещества деленное на количество раствора. Обычно используется в химии.
- Части на миллион(ppm.) Соотношение частей (обычно грамм) растворенного вещества на миллионную часть раствора, умноженную на 106. Обычно используется для очень разбавленного водного раствора (массу воды очень легко вычислить: 1 л воды = 1000 гр.)
- Процентный состав. Соотношение частей (как правило, грамм) растворенного вещества к 100 частям раствора, записывается в процентах.
-
Узнайте всю информацию для определения концентрации. Обычно все, кроме молярности, варианты записей растворов требуют от вас знания количества растворяемого вещества и количество или массу получившегося раствора. Многие химические задачи по нахождению концентрации раствора, которые вам придется решать, не дают такую информацию. Если нет, то вам придется выяснить самому эти данные, используя данные вам величины.
-
Пример: скажем нам нужно найти концентрацию (грамм на литр) раствора 12 чайной ложки столовой соли в 2 литрах воды. Также нам известно, что в одной чайной ложке, приблизительно 6 грамм соли. В этом случае вычисления не сложны – 12 часть чайной ложки (6 грамм 1 чайная ложка)= 12 ложки получится, 3 грамма соли. 3 грамма соли делим на 2 литра воды =
1.5 грл
-
Пример: скажем нам нужно найти концентрацию (грамм на литр) раствора 12 чайной ложки столовой соли в 2 литрах воды. Также нам известно, что в одной чайной ложке, приблизительно 6 грамм соли. В этом случае вычисления не сложны – 12 часть чайной ложки (6 грамм 1 чайная ложка)= 12 ложки получится, 3 грамма соли. 3 грамма соли делим на 2 литра воды =
-
Учимся узнавать молярность. Нахождение молярности требует знания моль вашего растворяемого вещества, а это легко вычислить, если вы знаете массу и химическую формулу вашего растворяемого вещества. Каждый химический элемент имеет молярную массу (ММ)- специфическую массу одного моль данного элемента. Молярная масса показана в периодической таблице элементов (обычно под символом и именем химического элемента). Просто сложите молярные массы компонентов растворяемого вещества и узнаете его молярную массу. Затем умножьте известную массу растворяемого вещества на (1 ММ вашего растворяемого вещества) и узнаете количество моль вашего растворяемого вещества.
-
Пример: Давайте найдем молярность нашего соляного раствора. Вспомним, у нас есть 3 грамма соли(NaCl), растворенных в 2 литрах воды. Начнем с нахождения молярной массы Na и Cl, согласно периодической таблице.Na = приб. 23 гр моль, а Cl = приб. 35.5 гр моль. Итак, ММ NaCl =23 + 35.5 = 58.5 гр моль. 3 гр NaCl умножаем на (1 моль Na Cl 58/5 гр.NaCl) =0.051 моль NaCl. 0.051 моль NaCl 2литра воды =
0.026 М NaCl
-
Пример: Давайте найдем молярность нашего соляного раствора. Вспомним, у нас есть 3 грамма соли(NaCl), растворенных в 2 литрах воды. Начнем с нахождения молярной массы Na и Cl, согласно периодической таблице.Na = приб. 23 гр моль, а Cl = приб. 35.5 гр моль. Итак, ММ NaCl =23 + 35.5 = 58.5 гр моль. 3 гр NaCl умножаем на (1 моль Na Cl 58/5 гр.NaCl) =0.051 моль NaCl. 0.051 моль NaCl 2литра воды =
-
Практикуемся на простейших задачах по концентрации. Предоставленные знания — это все, что вам потребуется для вычисления концентрации в самых простых случаях. Если вам известна масса или объем раствора и количество растворяемого вещества в начале реакции, или вы можете вычислить эти величины из данных задачи, вы сможете с легкостью вычислять концентрацию раствора. Практикуйтесь на задачах по концентрации для укрепления знаний. Ниже представлены примеры задач:
- Какова молярность NaCl в 400 мл раствора, полученного путем добавления 0.001 гр. NaCl в воду?
- Какова концентрация (ppm) раствора, полученного при добавлении 0.001гр Свинца (Pb) в 150 л. воды? Помните, что 1л. воды это 1000гр. В этом случае количество раствора изменится незначительно после добавления растворяемого вещества, поэтому вы можете использовать количество растворителя как количество раствора.
- Найдите концентрацию в граммах на 1 литр раствора, полученного при добавлении 12 моль KCl в воду. В этой задаче вам потребуется работать от противного, используя молярную массу KCl для вычисления массы в граммах растворяемого вещества KCl.
Способ 2 из 3: Совершаем титрование
-
Узнаем, в каких случаях возможно титрование. Титрование — это техника, используемая химиками для вычисления количества растворяемого вещества присутствующего в растворе. Для того чтобы совершить титрование, вы должны совершить химическую реакцию между растворяющимся веществом и другим реагентом (обычно также растворенным в жидком растворе). В связи с тем, что вы знаете точное количество второго реагента, а также знаете химическое уравнение, при котором реагент и растворимое вещество вступает в реакцию, вы можете вычислить количество растворенного вещества, основываясь на количестве реагента которое вам необходимо добавить и при котором произойдет реакция.
- Поэтому титрование очень полезно для вычисления концентрации в растворе, где вам неизвестно количество изначально добавленного растворяемого вещества.
- Если вам уже известно, сколько вещества в растворе, вам нет необходимости титровать – просто измерьте количество раствора и высчитайте концентрацию так, как то описано в первой части.
-
Приготовьте оборудование для титрования. Точное титрование требует чистого, точного, профессионального химического оборудования. Оборудуйте зону титрования конической колбой или стаканом, установите его под калиброванной бюреткой, выставленной на держатель для бюретки, конец бюретки должен быть установлен в горлышко колбы или стакана, не касаясь стенок.
- Убедитесь, что все оборудование было тщательно вымыто деионизированной водой и тщательно высушено.
-
Заполните колбу и бюретку. Точно отмерьте небольшое количество раствора неизвестной концентрации для пробы. Когда ваше растворимое вещество растворится в растворе, его концентрация будет одинакова во всем небольшом пробном количестве раствора и одинаково в его исходном оригинале. Заполните вашу бюретку раствором известной концентрации, которая вступит в реакцию с вашим раствором. Запишите точное количество раствора в бюретке – вы будете вычитать количество полученного раствора для того чтобы узнать общее количество раствора используемого в реакции.
- Обратите внимание: если реакция между раствором неизвестной концентрации и бюреткой не показывает никаких визуальных изменений, вам понадобится ввести индикатор в колбу. В химии, индикаторы — это химические препараты, которые показывают визуально, когда реакция достигает конца или точки эквивалентности. Индикаторы обычно используют для кислотно-щелочных и окислительно-восстановительных реакций титрования, но существуют и много других индикаторов. Проконсультируйтесь с учебником по химии или посмотрите в интернете, чтобы знать какой именно индикатор вам подходит для вашей реакции.
-
Начните титрование. Равномерно добавляйте раствор из бюретки (назовем его «титрант») в колбу. Используйте магнитный перемешиватель или стеклянную палочку для аккуратного смешивания растворов, пока они еще реагируют. Если реакция ваших растворов визуально различима, вы ее увидите – изменение цвета, пузырьки, образование осадков, и т.д. Если вы используете индикатор, вы сможете наблюдать изменения цвета во время того, как каждая капля попадает в колбу из бюретки.
- Если ваша реакция приведет к изменению pH или потенциалов, вы можете ввести pH измеритель или потенциометры в колбу — для слежения за процессом реакции.
- Для более точного титрования, следите за кислотностью pH или потенциалами так, как то указано выше, каждый раз записывая результаты, когда добавляете небольшое количество титранта. Составьте график pH и потенциальности вашего раствора относительно количества введенного титранта. Вы получите острый скачок линии в точке эквивалентности вашей реакции.
-
Your ads will be inserted here by
Easy Plugin for AdSense.
Please go to the plugin admin page to
Paste your ad code OR
Suppress this ad slot.Замедлите вашу реакцию титрования. Когда ваша реакция титрования будет подходить к концу, замедляйте титрование капля по капле. Если вы используете индикатор, вы заметите, что вспышки цвета, который он дает, остаются все дольше. Продолжайте как можно медленнее, до тех пор, пока вы не дойдете до той капли, которая заставит вашу реакцию остановиться. Для индикатора вы, в основном, будете искать наиболее раннее постоянное изменение цвета в вашей реакции.
- Запишите окончательное количество в вашей бюретке. Вычитая это количество от первоначального количества в бюретке, вы узнаете точное количество титранта, которое вы использовали.
-
Подсчитаем количество растворяемого вещества в растворе. Используйте химическую формулу для реагента между вашим тетрантом и раствором для нахождения количества моль растворяемого вещества в пробирке. Как только вы узнаете моль растворяемого вещества, вы сможете просто разделить его на количество раствора в колбе для нахождения молярности раствора, или перевести молярность в граммы и разделить на количество раствора для вычисления концентрации в гр л. Это потребует базового понимания стехиометрии.
- Например, скажем, мы использовали 25 мл. 0.5 М Na OH для титрования раствора HCl и воды до его точки эквивалентности. Раствор HCl имел объем 60 мл до титрования. Как много моль HCl в нашем растворе?
- Для начала давайте рассмотрим химическую реакцию NaOH и HCl : NaOH + HCl > H2O + NaCl
- В нашем случае одна молекула NaOH вступает в реакцию с одной молекулой HCl (получаем продукт вода и NaCl). Итак, так как вы добавили количество NaOH, достаточное для нейтрализации всех молекул HCl, число моль NaOH потраченных в реакции будет равно числу моль HCl в пробирке.
- Итак, давайте найдем число NaOH в моль. 25 мл NaOH = 0.025 л. NaOH x (.5 моль NaOH/1 л.) = 0.0125 моль NaOH.
- Так как мы выяснили по уравнению реакции, что количество потраченных моль NaOH = количеству моль HCl в растворе, то мы знаем, что имеем 0.0125 моль HCl в растворе.
-
Рассчитываем концентрацию раствора. Теперь, когда вам известно количество растворяемого вещества в растворе, будет легко найти концентрацию в размере молярности. Просто разделите моль растворяемого вещества в растворе на объем раствора, который вы взяли для пробы ( не на объем раствора, от которого вы взяли пробу). В результате получаем молярность вашего раствора!
- Для нахождения молярности из примера сверху, просто разделите моль HCl на объем в колбе 0.0125 моль HCl x (1/0.060 л) = 0.208 M HCl.
- Для того чтобы перевести молярность в грл, ppm или процентное соотношение, вам нужно перевести моль вашего растворяемого вещества в массу (используя молярную массу вашего компонента). В случае ppm и процентного соотношения вам также придется перевести ваш объем раствора в массу (используя коэффициент преобразований, такой как плотность, а то и просто взвесив их), а потом умножьте полученный результат соответственно на 106 или 102.
Способ 3 из 3: Найдем соленость аквариумной воды
-
Возьмите пробу воды из вашего аквариума. Внимательно запишите ее объем. Если возможно, запишите ее объем в международных единицах измерения (МЕ), таких как миллилитры — их будет легче конвертировать в литры. Если вы не можете – если у вас, например, имеется только кухонная мерка – коэффициенты конвертации МЕ есть в интернете.
- В этом примере мы протестируем аквариумную воду на соленость . Соленость — это всего лишь красивое слово для обозначения количества соли (NaCl) в воде. Для наших целей мы возьмем небольшое количество воды из нашего аквариума, скажем 3 мл , и окончательный результат запишем в грл.
-
Титрируйте вашу пробу воды. Подберите титрант, который произведет видимую реакцию с вашим растворяемым веществом. В этом случае мы будем использовать раствор 0.25 M AgNO3 (нитрат серебра), смесь, которая произведет нерастворимый хлорид соли во время реакции с NaCl в следующей химической реакции: AgNO3 + NaCl > NaNO3 + AgCl. Соль (AgCl) выделится как видимый мутно-белый плавающий осадок, который можно отфильтровать из раствора.
- Титрируйте нитрат серебра из бюретки или маленького шприца в пробу из аквариума, остановитесь пробовать тогда, когда раствор прекратит становиться мутным. С учетом такой маленькой пробы крайне важно точно определить, какое количество нитрата серебра вы добавили – следите за каждой каплей пристально.
-
Продолжайте до окончания реакции. Когда нитрат серебра перестанет делать раствор мутным, вы можете записать, какое количество мл. вы добавили. Титрируйте AgNO3очень медленно, следите за раствором тщательно, особенно перед окончанием реакции.
- Например, предположим, что у нас ушло 3 мл. нашего 0.25М AgNO3, медленно титрованного в 3 мл. воды, перед тем как мы прекратили получать мутный осадок.
-
Определим моль использованного титранта. Это очень простой шаг – просто умножьте объем титранта, который вы добавили, на его молярность. Это дает вам молярное число титранта, которое вы использовали.
- 3 мл x .25 M = .003 л x (.25 моль AgNO3/1 л) = .000075 моль AgNO3.
-
Определим моль вашего растворенного вещества. Используем уравнение реакции для преобразования моль AgNO3 в моль NaCl. Наше уравнение реакции выглядит таким образом: AgNO3 + NaCl > NaNO3 + AgCl. Так, 1 моль AgNO3 вступает в реакцию с 1 моль NaCl, а мы знаем, что моль NaCl в растворе = моль AgNO3 добавленному: .000075 моль.
- В нашем случае, 1 моль AgNO3 вступает в реакцию с 1 моль NaCl. Но если 1 моль нашего титранта вступает в реакцию с 2 моль растворенного вещества, то мы умножим моль нашего титранта на 2 для получения количества моль растворенного вещества.
- Соответственно, если 2 моль титранта вступают в реакцию с 1 моль растворенного вещества, мы поделим моль титранта на два.
- Эти правила также действуют на 3 моль титранта относительно 1 моль растворенного вещества, 4 моль титранта относительно 1 моль растворенного вещества, и т. д. также как и для 1 моль титранта относительно 3 моль растворенного вещества, 1 моль титранта к 4 моль растворенного вещества и т. д.
-
Переведем ваш моль растворенного вещества в граммы. Чтобы это сделать, вам нужно рассчитать молярную массу растворенного вещества и умножить ее на моль растворенного вещества. Чтобы найти молярную массу NaCl, используйте периодическую таблицу элементов, найдите и сложите атомные массы натрия (Na) и хлора (Cl).
- MM Na = 22.990. MM Cl = 35.453.
- 22.990 + 35.453 = 58.443 гр моль
- .000075 моль NaCl x 58.442 гр моль = .00438 моль NaCl.
- Запомните: если было больше, чем один атом одного типа атомов молекулы, вы должны добавить молярную массу этого атома многократно. Например, если вы хотите найти молярную массу AgNO3, вы должны добавить массу кислорода три раза, ведь в этой молекуле три атома кислорода.
-
Рассчитайте конечную концентрацию. Мы имеем массу нашего растворенного вещества в граммах, и мы знаем объем пробного забора воды. Все, что осталось сделать, это разделить: .00438 g NaCl/.003 L = 1.46 гр NaCl/л
- Соленость морской воды приблизительно составляет 35 гр NaClл. Иначе говоря, наш аквариум и близко не подошел к солености, достаточной для морских рыб.
Рекомендации
- Ag + 2 HNO3 > AgNO3 + NO2 + h3O
- Хотя растворенное вещество и растворитель могут быть в разном агрегатном состоянии (твердое, жидкое, газообразное), пока они отделены, раствор, образуемый во время растворения в растворителе растворяемого вещества, имеет такое же агрегатное состояние, как и растворенное вещество.
- Вот видео-инструкция:
- Используйте только прозрачный пластик или стеклянную посуду.
Предостережения
- Храните раствор AgNO3 в запечатанной темной бутылке, так как он светочувствительный.
- Будьте осторожны, когда работаете с сильными кислотами. Работайте под вытяжкой или на свежем воздухе.
- Надевайте защитные очки и перчатки.
- Если вы хотите вернуть ваше серебро, тогда: Cu(s) + 2 AgNO3 (aq) > Cu(NO3)2 + 2 Ag (s) Где (s) значит «твердый».
Похожие публикации
wikisurv.ru
Как найти процентную концентрацию 🚩 процентная концентрация 🚩 Естественные науки
27 декабря 2018
Автор КакПросто!
Концентрация – это величина, которая характеризует качественный состав раствора. Концентрацией принято называть количество растворенного вещества либо его массы к общему объему либо массе жидкости. Таким образом, важнейшими характеристиками являются массовая и объемная доли.
Статьи по теме:
Вам понадобится
- — масса растворенного вещества;
- — масса раствора.
Инструкция
Массовая доля, она же процентная концентрация – это безразмерная величина, которая равна отношению массы растворенного вещества к общей массе жидкости. Чаще всего ее выражают в процентах, для чего вам необходимо перемножить полученное отношение на сто. В виде формулы процентную концентрацию можно записать следующим способом: ω = m в-ва/m р-ра*100%. Первое значение является массой самого вещества, а второе – массой раствора в целом. Зачастую в условии задач дана процентная концентрация вещества, исходя из которой, требуется найти массу вещества или массу раствора. Сделать это очень просто, нужно лишь преобразовать исходную формулу. Для нахождения массы вещества она будет следующей: m в-ва = m р-ра* ω/100. Массу раствора можно узнать следующим образом: разделите массу вещества на процентную концентрацию и умножьте результат на сто. Единица измерения массы вещества и массы раствора – граммы.
Для нахождения процентной концентрации в случае, если раствор был получен с применением кристаллогидрата, следует пользоваться другим алгоритмом решения. Кристаллогидрат имеет структуру Mе(x)К-та(y)*nh3O. В условии задачи, где фигурирует кристаллогидрат, должна содержаться информация о массе самого кристаллогидрата и массе сухого вещества металл-икс-кислота-игрек. В данном случае процентная концентрация будет равняться массе раствора, умноженной на молярную массу кристаллогидрата, поделенной на массу кристаллогидрата, перемноженной с сухим коэффициентом вещества и с молярной массой безводного вещества.
Видео по теме
Полезный совет
Подсчитывая массу раствора, обратите внимание, что она состоит из двух величин: массы растворителя и массы вещества, растворенного в нем. В упущении этого факта заключается большое количество ошибок во время решения подобных задач.
Совет полезен?
Распечатать
Как найти процентную концентрацию
Статьи по теме:
Не получили ответ на свой вопрос?
Спросите нашего эксперта:
www.kakprosto.ru
Как найти концентрацию раствора?
Концентраций раствора бывает несколько видов.
Наиболее распространена так называемая массовая доля.
Массовую долю наиболее часто обозначают греческой буквой «омега». Я буду обозначать её буквой w. Это допустимое обозначение, мы его изредка применяли в колледже.
Итак, массовая доля находится по следующей формуле:
w = [m(в-ва)/m(р-ра)] * 100%
m(в-ва) — масса растворённого вещества
m(р-ра) — масса раствора.
В свою очередь масса раствора равна сумме масс растворённого вещества и растворителя:
m(р-ра) = m(в-ва) + m(р-ля)
Соответственно, мы можем записать формулу так:
w = {m(в-ва)/[m(в-ва) + m(р-ля)]} * 100%
Пример задачи.
«Какова концентрация (массовая доля) раствора, для приготовления которого взяли 5 г хлорида натрия и 45 мл воды?»
Ключи к решению:
1) Во-первых, нам облегчает решение то, что неважно, о каком веществе идёт речь. По условию дан NaCl, но вместо него может быть любое другое растворимое вещество: иодид калия, нитрат серебра, сахароза и мн. др.
2) Во-вторых, радует то, что никаких уравнений химических реакций в задачах такого вида составлять не надо.
Решим задачу по действиям.
1) Находим массу растворителя, то есть воды.
m (h3O) = V (h3O) * po (h3O) = 45 мл * 1 г/мл = 45 г.
2) Находим массу раствора:
m(р-ра) = m(в-ва) + m(р-ля) = 5 г + 45 г = 50 г.
3) Находим массовую долю:
w = [m(в-ва)/m(р-ра)] * 100% = (5 г/50 г) * 100% = 0,1 * 100% = 10%.
Ответ: концентрация раствора (массовая доля NaCl) равна 10%.
Кроме массовой доли, существует ещё множество иных видов концентраций раствора.
1) Молярная концентрация (Cm). Равна отношению количества растворённого вещества к объёму раствора.
Cm = v(в-ва)/V(р-ра)
2) Нормальная концентрация (Cn). Равна отношению количества эквивалента растворённого вещества к объёму раствора.
Cn = v(в-ва)/[(1/f) * V(р-ра)]
Cn = z * v(в-ва)/ V(р-ра)
3) Моляльная концентрация (обозначим её K). Равна отношению количества растворённого вещества к массе растворителя.
K = v(в-ва)/m(р-ля)
4) Титр вещества (T). Равен отношению массы растворённого вещества к объёму раствора.
T = m(в-ва)/V(р-ра).
5) Мольная доля (обозначим её как X). Равна отношению количества вещества некоторого компонента к сумме количеств веществ всех компонентов раствора.
X = v/S(vi)
где S(vi) — сумма количеств веществ всех компонентов раствора.
www.bolshoyvopros.ru
Как определить концентрацию кислоты 🚩 два сосуда с раствором щелочи разных концентраций 🚩 Естественные науки
Вам понадобится
- -раствор щелочи точной коцентрации
- -бюретка
- -конические колбы
- -мерные пипетки
- -индикатор
- -набор ареометров
Инструкция
Одним из наиболее простых способов определения концентрации кислоты является прямое титрование (процесс постепенного добавления раствора с известной концентрацией(титранта) к раствору определяемого вещества с целью зафиксировать точку эквивалентности (конец реакции)). В данном случае удобно использовать нейтрализацию щелочью. Завершение ее можно легко определить с помощью добавления индикатора (к примеру, в кислоте фенолфталеин прозрачен, а при добавлении щелочи становится малиновым; метиловый оранжевый в кислой среде — розовый, а в щелочной — оранжевый). Возьмите бюретку (объемом 15-20 мл), установите ее в штативе с помощью лапки. Она должна быть четко зафиксирована, иначе с раскачивающего кончика могут упасть несколько лишних капель, которые испортят вам весь процесс. Порой одна капелька меняет цвет индикатора. Этот момент необходимо засечь.
Запаситесь посудой и реактивами: коническими колбами для титрования (4-5 штук небольшого объема), несколькими пипетками (как Мора — без делений, так и размерными), мерной колбой на 1 л, фиксаналом щелочи, индикатором, дистиллированной водой.
Приготовьте раствор щелочи точной концентрации (к примеру, NaOH). Для этого лучше используйте фиксанал (ампула с запаянным в нее веществом, при разведении которого в 1л воды получается 0,1 нормальный раствор). Конечно, можно пустить в ход точную навеску. Но первый вариант точнее и надежнее.
Далее заполните бюретку раствором щелочи. В коническую колбу поместите 15 мл кислоты неизвестной концентрации (возможно, HCl), в нее же добавьте 2-3 капли индикатора. И приступайте непосредственно к титрованию. Как только индикатор изменит цвет и примерно 30 с будет таким оставаться, прекращайте процесс. Запишите, сколько ушло щелочи (к примеру, 2,5 мл).
Затем выполните данный ход работы еще 2-3 раза. Это делается для получения белее точного результата. После подсчитайте средний объем щелочи. Vср = (V1+V2+V3)/3, V1 — результат первого титрования, мл, V2 — результат второго, мл, V3 — объем третьего, мл, 3 — количество проделанных реакций. Например, Vср = (2,5+2,7+2,4)/3 = 2,53 мл.
После проведения эксперимента, можно приступить к основным подсчетам. В данной ситуации справедливо соотношение: C1*V1 = C2*V2, где C1 — концентрация раствора щелочи, нормальная (н), V1 — средний объем израсходованной на реакцию щелочи, мл, С2 — концентрация раствора кислоты, н, V2 — объем кислоты, участвующей в реакции, мл. С2 — величина неизвестная. Значит, ее необходимо выразить через известные данные. С2 = (C1*V1)/V2, т.е. С2 = (0,1 * 2,53)/ 15 = 0,02 н. Вывод: при титровании HCl раствором 0,1 н NaOH, была выяснена концентрация кислоты — 0,02 н.
Еще одним распространненым способом выяснить концентрацию кислоты — это, для начала, узнать ее плотность. Для этого приобретите набор ареометров (в специализированном химическом или магазине, также можно заказать по интернету или посетить точки торговли принадлежностей для автомобилистов).
Налейте кислоту в химический стакан и помещайте в него ареометры до тех пор, пока они не престанут тонуть или выталкиваться на поверхность. Когда же прибор станет, как поплавок, отметьте числовое значение на нем. Данная цифра и есть плотность кислоты. Далее, используя соответствующую литературу (можно справочник Лурье), не составит труда определить по таблице нужную концентрацию.
В независимости от того, какой способ вы выберите, не забывайте про соблюдение техники безопасности.
www.kakprosto.ru
Как вычислить молярную и нормальную концентрацию
Под термином «насыщенность» понимают величину, характеризующую долю вещества, находящегося в каком-нибудь определенном объеме либо массе раствора. Чем огромнее эта доля, тем выше насыщенность. Ее дозволено выразить через разные показатели: массовую долю, молярность, моляльность, нормальность, титр. Молярная насыщенность – величина, показывающая, сколько молей данного вещества находится в одном литре раствора.
Инструкция
1. Возможен, вам вестимо, что в 500 миллилитрах раствора серной кислоты содержится 49 граммов этого вещества. Вопрос: какова молярная насыщенность этого раствора? Запишите точную формулу вещества – Н2SO4, позже чего посчитайте его молекулярную массу. Она складывается из ядерных масс элементов, с учетом их индексов. 1*2 + 32 + 4*16 = 98 ядерных единиц массы.
2. Молярная масса всякого вещества численно равна его молекулярной массе, только выражается в граммах/моль. Следственно, один моль серной кислоты весит 98 граммов. Сколько же молей составляет первоначальное число кислоты, равное 49 граммам? Поделите: 49/98 = 0,5.
3. Следственно, 0,5 молей серной кислоты содержится в 500 миллилитрах раствора. Сколько же молей было бы в 1 литре? Разумеется, один. Значит, у вас одномолярный раствор серной кислоты. Либо, как принято записывать, 1М раствор.
4. А что такое типичная насыщенность? Это величина, показывающая, сколько эквивалентов вещества (то есть такое число его молей, которое вступает в реакцию с одним молем водорода) содержится в одном литре раствора. Размерность типичной концентрации – моль-экв/л либо г-экв/л. Она обозначается буквами «н» либо «N».
5. Разглядите пример с той же серной кислотой. Вы теснее вычислили, что ее раствор одномолярный. А какова будет ее типичная насыщенность? Для результата на данный вопрос вам нужно учесть, что согласно закону эквивалентов, все вещества реагируют друг с ином в равнозначных соотношениях. Таким образом, величина нормальности раствора серной кислоты зависит от того, в какую реакцию с каким веществом она вступит.
6. Скажем, Н2SO4 + NaOH = NaHSO4 + h3O. В этой реакции на всякую молекулу резкого натра доводится также одна молекула серной кислоты (либо на один эквивалент щелочи – один эквивалент кислоты). Следственно, в данном случае раствор кислоты однонормальный (1N либо примитивно N).
7. Но если щелочь взята в избытке, то реакция протечет так: Н2SO4 + 2NaOH = Na2SO4 + 2h3O. И тогда, от того что на всякую молекулу кислоты доводится теснее две молекулы щелочи, то раствор кислоты будет двухнормальным (2N).
jprosto.ru
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Растворы. Способы выражения концентрации растворов
Способы выражения концентрации растворов
Существуют различные способы выражения концентрации растворов.
Массовая доля ω компонента раствора определяется как отношение массы данного компонента Х, содержащегося в данной массе раствора к массе всего раствора m. Массовая доля – безразмерная величина, её выражают в долях от единицы:
ωр.в. = mр.в./mр-ра (0 < ωр.в. < 1) (1)
Массовый процент представляет собой массовую долю, умноженную на 100:
ω(Х) = m(Х)/m · 100% (0% < ω(Х) < 100%) (2)
где ω(X) – массовая доля компонента раствора X; m(X) – масса компонента раствора X; m – общая масса раствора.
Мольная доля χ компонента раствора равна отношению количества вещества данного компонента X к суммарному количеству вещества всех компонентов в растворе.
Для бинарного раствора, состоящего из растворённого вещества Х и растворителя (например, Н2О), мольная доля растворённого вещества равна:
χ(X) = n(X)/(n(X) + n(H2O)) (3)
Мольный процент представляет мольную долю, умноженную на 100:
χ(X), % = (χ(X)·100)% (4)
Объёмная доля φ компонента раствора определяется как отношение объёма данного компонента Х к общему объёму раствора V. Объёмная доля – безразмерная величина, её выражают в долях от единицы:
φ(Х) = V(Х)/V (0 < φ(Х) < 1) (5)
Объёмный процент представляет собой объёмную долю, умноженную на 100.
φ(X), % = (φ(X)·100)%
Молярность (молярная концентрация) C или Cм определяется как отношение количества растворённого вещества X, моль к объёму раствора V, л:
Cм(Х) = n(Х)/V (6)
Основной единицей молярности является моль/л или М. Пример записи молярной концентрации: Cм(H2SO4) = 0,8 моль/л или 0,8М.
Нормальность Сн определяется как отношение количества эквивалентов растворённого вещества X к объёму раствора V:
Cн(Х) = nэкв.(Х)/V (7)
Основной единицей нормальности является моль-экв/л. Пример записи нормальной концентрации: Сн(H2SO4) = 0,8 моль-экв/л или 0,8н.
Титр Т показывает, сколько граммов растворённого вещества X содержится в 1 мл или в 1 см3 раствора:
T(Х) = m(Х)/V (8)
где m(X) – масса растворённого вещества X, V – объём раствора в мл.
Моляльность раствора μ показывает количество растворённого вещества X в 1 кг растворителя:
μ(Х) = n(Х)/mр-ля (9)
где n(X) – число моль растворённого вещества X, mр-ля – масса растворителя в кг.
Мольное (массовое и объёмное) отношение – это отношение количеств (масс и объёмов соответственно) компонентов в растворе.
Необходимо иметь ввиду, что нормальность Сн всегда больше или равна молярности См. Связь между ними описывается выражением:
См = Сн · f(Х) (10)
Для получения навыков пересчёта молярности в нормальность и наоборот рассмотрим табл. 1. В этой таблице приведены значения молярности См, которые необходимо пересчитать в нормальность Сн и величины нормальности Сн, которые следует пересчитать в молярность См.
Пересчёт осуществляем по уравнению (10). При этом нормальность раствора находим по уравнению:
Сн = См/f(Х) (11)
Результаты расчётов приведены в табл. 2.
Таблица 1. К определению молярности и нормальности растворов
| Тип химического превращения | См | Сн | Сн | См |
| Реакции обмена | 0,2 M Na2SO4 | ? | 6 н FeCl3 | ? |
| 1,5 M Fe2(SO4)3 | ? | 0,1 н Ва(ОН)2 | ? | |
| Реакции окисления-восстановления | 0,05 М KMnO4
в кислой среде |
? | 0,03 М KMnO4
в нейтральной среде |
? |
Таблица 2
Значения молярности и нормальности растворов
| Тип химического превращения | См | Сн | Сн | См |
| Реакции обмена | 0,2M Ma2SO4 | 0,4н | 6н FeCl3 | 2М |
| 1,5M Fe2(SO4)3 | 9н | 0,1н Ва(ОН)2 | 0,05М | |
| Реакции окисления-восстановления | 0,05М KMnO4 в кислой среде | 0,25н | 0,03М KMnO4
в нейтральной среде |
0,01М |
Между объёмами V и нормальностями Сн реагирующих веществ существует соотношение:
V1 Сн,1 =V2 Сн,2 (12)
Примеры решения задач
Задача 1. Рассчитайте молярность, нормальность, моляльность, титр, мольную долю и мольное отношение для 40 мас.% раствора серной кислоты, если плотность этого раствора равна 1,303 г/см3.
Решение.
Масса 1 литра раствора равна М = 1000·1,303 = 1303,0 г.
Масса серной кислоты в этом растворе: m = 1303·0,4 = 521,2 г.
Молярность раствора См = 521,2/98 = 5,32 М.
Нормальность раствора Сн = 5,32/(1/2) = 10,64 н.
Титр раствора Т = 521,2/1000 = 0,5212 г/см3.
Моляльность μ = 5,32/(1,303 – 0,5212) = 6,8 моль/кг воды.
Обратите внимание на то, что в концентрированных растворах моляльность (μ) всегда больше молярности (См). В разбавленных растворах наоборот.
Масса воды в растворе: m = 1303,0 – 521,2 = 781,8 г.
Количество вещества воды: n = 781,8/18 = 43,43 моль.
Мольная доля серной кислоты: χ = 5,32/(5,32+43,43) = 0,109. Мольная доля воды равна 1– 0,109 = 0,891.
Мольное отношение равно 5,32/43,43 = 0,1225.
Задача 2. Определите объём 70 мас.% раствора серной кислоты (r = 1,611 г/см3), который потребуется для приготовления 2 л 0,1 н раствора этой кислоты.
Решение.
2 л 0,1н раствора серной кислоты содержат 0,2 моль-экв, т.е. 0,1 моль или 9,8 г.
Масса 70%-го раствора кислоты m = 9,8/0,7 = 14 г.
Объём раствора кислоты V = 14/1,611 = 8,69 мл.
Задача 3. В 5 л воды растворили 100 л аммиака (н.у.). Рассчитать массовую долю и молярную концентрацию NH3 в полученном растворе, если его плотность равна 0,992 г/см3.
Решение.
Масса 100 л аммиака (н.у.) m = 17·100/22,4 = 75,9 г.
Масса раствора m = 5000 + 75,9 = 5075,9 г.
Массовая доля NH3 равна 75,9/5075,9 = 0,0149 или 1,49 %.
Количество вещества NH3 равно 100/22,4 = 4,46 моль.
Объём раствора V = 5,0759/0,992 = 5,12 л.
Молярность раствора См = 4,46/5,1168 = 0,872 моль/л.
Задача 4. Сколько мл 0,1М раствора ортофосфорной кислоты потребуется для нейтрализации 10 мл 0,3М раствора гидроксида бария?
Решение.
Переводим молярность в нормальность:
0,1 М Н3РО4 0,3 н; 0,3 М Ва(ОН)2 0,6 н.
Используя выражение (12), получаем: V(H3P04)=10·0,6/0,3 = 20 мл.
Задача 5. Какой объем, мл 2 и 14 мас.% растворов NaCl потребуется для приготовления 150 мл 6,2 мас.% раствора хлорида натрия?
Плотности растворов NaCl:
| С, мас.% | 2 | 6 | 7 | 14 |
| ρ, г/см3 | 2,012 | 1,041 | 1,049 | 1,101 |
Решение.
Методом интерполяции рассчитываем плотность 6,2 мас.% раствора NaCl:
6,2% =6% + 0,2(7% —6% )/(7 – 6) = 1,0410 + 0,0016 = 1,0426 г/см3.
Определяем массу раствора: m = 150·1,0426 = 156,39 г.
Находим массу NaCl в этом растворе: m = 156,39·0,062 = 9,70 г.
Для расчёта объёмов 2 мас.% раствора (V1) и 14 мас.% раствора (V2) составляем два уравнения с двумя неизвестными (баланс по массе раствора и по массе хлорида натрия):
156,39 = V1 1,012 + V2 1,101 ,
9,70 = V1·1,012·0,02 + V2·1,101·0,14 .
Решение системы этих двух уравнений дает V1 =100,45 мл и V2 = 49,71 мл.
Задачи для самостоятельного решения
3.1. Рассчитайте нормальность 2 М раствора сульфата железа (III), взаимодействующего со щёлочью в водном растворе.
12 н.
3.2. Определите молярность 0,2 н раствора сульфата магния, взаимодействующего с ортофосфатом натрия в водном растворе.
0,1 M.
3.3. Рассчитайте нормальность 0,02 М раствора KMnO4, взаимодействующего с восстановителем в нейтральной среде.
0,06 н.
3.4. Определите молярность 0,1 н раствора KMnO4, взаимодействующего с восстановителем в кислой среде.
0,02 M.
3.5. Рассчитать нормальность 0,2 М раствора K2Cr2O7, взаимодействующего с восстановителем в кислой среде.
1,2 M.
3.6. 15 г CuSO4·5H2O растворили в 200 г 6 мас.% раствора CuSO4. Чему равна массовая доля сульфата меди, а также молярность, моляльность и титр полученного раствора, если его плотность составляет 1,107 г/мл?
0,1; 0,695М; 0,698 моль/кг; 0,111 г/мл.
3.7. При выпаривании 400 мл 12 мас.% раствора KNO3 (плотность раствора 1,076 г/мл) получили 2М раствор нитрата калия. Определить объём полученного раствора, его нормальную концентрацию и титр.
255 мл; 2 н; 0,203 г/мл.
3.8. В 3 л воды растворили 67,2 л хлороводорода, измеренного при нормальных условиях. Плотность полученного раствора равна 1,016 г/мл. Вычислить массовую, мольную долю растворённого вещества и мольное отношение растворённого вещества и воды в приготовленном растворе.
0,035; 0,0177; 1:55,6.
3.9. Сколько граммов NaCl надо добавить к 250 г 6 мас.% раствору NaCl, чтобы приготовить 500 мл раствора хлорида натрия, содержащего 16 мас.% NaCl? Плотность полученного раствора составляет 1,116 г/мл. Определить молярную концентрацию и титр полученного раствора.
74,28 г; 3,05 М; 0,179 г/мл.
3.10. Определить массу воды, в которой следует растворить 26 г ВaCl2·2H2O для получения 0,55М раствора ВaCl2 (плотность раствора 1,092 г/мл). Вычислить титр и моляльность полученного раствора.
192,4 г; 0,111 г/мл; 0,56 моль/кг.
Государственное образовательное учреждение высшего профессионального образования Астраханская государственная медицинская академия
м.в. ПЛОСКОНОС
РАСЧЁТ КОНЦЕНТРАЦИЙ РАСТВОРОВ (учебно-методическое пособие для студентов)
Астрахань 2009
УДК 541.8 ББК24.1 Л 39
Плосконос М.В. Расчёт концентраций растворов: Учеб но-методическое пособие. — Астрахань: ГОУ ВПО АГМА, 2009.-42 с.
Основная цель данного пособия — сформировать общие представления о том, что такое растворы, из каких компонентов они состоят и как их класси фицируют, обеспечить понимание значения растворов в медицинской практи ке, сформировать умения по расчёту количества вещества для приготовления растворов различной концентрации и расчётные умения по определению кон центрации растворов. В пособии приведены примеры с детальным разбором решения типовых задач, а также задачи для самостоятельного решения, кото рые снабжены ответами. В приложении приведены таблицы, содержащие дан ные, необходимые для решения задач.
Пособие предназначено для студентов лечебного, педиатрического, стома тологического, медико-профилактическою и фармацевтического факультетов медицинских вузов. Типы и содержание задач соответствуют действующим в настоящее время программам по общей химии для медицинских вузов. Данное пособие может помочь в процессе подготовки к экзамену по общей химии. Пособие может быть использовано также студентами и преподавателями био логических специальностей немедицинских вузов, а также медучилищ и кол леджей.
Рецензенты;
Зав. кафедрой аналитической и физической химии Астраханского гос. университета,
доктор химических наук, проф. Н.М.Алыков Зав. кафедрой фармацевтической химии
Астраханской государственной медицинской академии кандидат химических наук, доцент О.Л.Титова
Печатается по решению редакционно-издательского совета ГОУ ВПО Астраханской государственной медицинской академии.
©М.В. Плосконос
©ГОУ ВПО Астраханская государственная медицинская академия
ОБЩИЕ ПРЕДСТАВЛЕНИЯ О РАСТВОРАХ
Растворы — гомогенные равновесные системы, состоящие из растворителя, растворённого вещества и продуктов их взаимодействия.
Вещества, составляющие раствор, называются ком понентами раствора. Обычно растворителем считают тот компонент, который после растворения не меняет своего агрегатного состояния (например, сахар в воде) или тот которого больше (спирт и вода). В растворах электролитов вне зависимости от соотношения компонентов электроли ты рассматриваются как растворённые вещества (напри мер, 96%-ный р-р H2SO4 в воде).
К лассификация растворов
По агрегатному состоянию растворы делятся:
|
газообразные |
жидкие |
твёрдые |
|
(воздух) |
(водные р-ры) |
(ставы) |
Для медиков наибольший интерес представляют жидкие водные растворы.
3
( 1 0 0 0
По содержанию вещества:
.Растворы,
1
|
ненасыщенные |
насыщенные |
пересыщенные |
|
содержание в-ва |
содержание в-ва |
содержание в-ва |
|
меньше его |
равно его |
больше его |
|
растворимости |
растворимости |
растворимости |
|
при данной t° |
при данной t° |
при данной t° |
|
Также растворы делятся: |
||
|
„Растворы, |
|
нмс |
ВМС |
||
|
низкомолелулярных |
высокомолекулярных |
||
|
соединений |
|||
|
соединений |
|||
|
(М меньше 5000 г/моль) |
|||
|
(М больше 5000 г/моль) |
|||
|
I |
I |
1 |
|
|
электролиты |
неэлектролиты |
||
|
полиэлектролиты |
|||
|
р-ры солей, |
р-ры сахарозы, |
||
|
гепарин, |
|||
|
кислот, |
глюкозы, |
||
|
полилизин, |
|||
|
оснований, |
мочевины, |
||
|
белки, |
|||
|
амфолитов. |
|||
|
нуклеиновые к-ты. |
|||
|
Ч ____ ______ |
J |
||
Истинные р-ры
гомогенного состава, отсутствует поверхность раздела между веществом и растворителем, размер растворённых частиц меньше 1 0 ‘9 м.
При увеличении размеров частиц система становится гетерогенной, состоящей из двух или более фаз с сильно развитой поверхностью раздела. Такме системы называют ся дисперсными. Они делятся на взвеси (суспензии,
“6
эмульсии), у которых размер растворённых частиц 10* м нм) и более, и коллоидные растворы, размер час-
тиц которых от 10-9 м до 5 10-7 м (от 1 до 500 нм).
Идеальный — раствор, в котором не происходят хи мические реакции между компонентами, а силы межмолекулярного взаимодействия между компонентами одинако вы. К идеальным растворам по своим свойствам прибли жаются лишь очень разбавленные растворы, т.е. р-ры с очень низкой концентрацией растворённого вещества.
ЗНАЧЕНИЕ РАСТВОРОВ В ЖИЗНЕДЕЯТЕЛЬНОСТИ ОРГАНИЗМОВ И В МЕДИЦИНСКОЙ ПРАКТИКЕ
По современным представлениям жизнь возникла в океане, который представлял собой водный раствор неор ганических и органических веществ. В ходе эволюции жи вые организмы развивались и изменялись. Многие из них покинули океан и перешли на сушу и в воздух, но сохра нили в своих организмах водные растворы, содержащие различные неорганические ионы и органические вещества.
Учение о растворах представляет для медиков осо бый интерес потому, что важнейшие биологические жид кости — кровь, спинномозговая и внутриклеточная жид кость, лимфа, моча, слюна, пот — представляют собой вод-
ные растворы низкомолекулярных соединений — солей NaCl, КС1 и др., высокомолекулярных соединений — бел ков, углеводов, липидов и нуклеиновых кислот. Усвоение пищи связано с переходом питательных веществ в раство рённое состояние. Биохимические реакции в живых орга низмах протекают в растворах.
Лекарственные вещества эффективны лишь в раство рённом состоянии или должны перейти в растворённое со стояние в организме.
Биологические жидкости участвуют в транспорте пи тательных веществ (жиров, аминокислот, кислорода), ле карственных препаратов к органам и тканям, а также в вы ведении из организма метаболитов (мочевины, билируби на, углекислого газа и т.д.). Плазма крови является средой для клеток — эритроцитов, лейкоцитов, тромбоцитов.
Буферные растворы играют большую роль в жизне деятельности, а именно в поддержании кислотно основного равновесия организмов. Внутриклеточные и внеклеточные жидкости всех живых организмов характе ризуются постоянным значением pH, которое поддержива ется с помощью буферных систем.
В жидких средах организма поддерживается посто янство кислотности, концентрации солей и органических веществ. Такое постоянство называется концентрацион
ным гомеостазом.
Растворы имеют большое значение и широко исполь зуются в медицине. Так, например, при больших потерях крови (например, после тяжёлых операций, травм) боль ным вводят по несколько литров изотонического раствора
(0,9% водный р-р NaCl (0,15 моль/л)) для возмещения по тери жидкости с кровью. Однако в крови кроме ионов Na+ и СГ имеются и другие ионы, а также ВМС и форменные элементы. Поэтому в медицинских целях более правильно использовать растворы, содержащие те же компоненты и в том же количестве, что и входящие в состав крови. Эти растворы применяют в качестве кровезаменителей в хи рургии. В хирургии также применяют гипертонические повязки (марлю, смоченную в гипертоническом 1 0 % рас творе NaCl), которые вводят в гнойные раны.
Гипертонические растворы глауберовой соли Na2S0 4 *1 0 H20 и горькой соли MgSOWHhO применяются как слабительные средства.
Гипертонические растворы в небольших количествах вводятся иногда внутривенно при глаукоме, чтобы умень шить избыточное количество влаги в передней камере гла за.
СПОСОБЫ ВЫРАЖЕНИЯ КОЛИЧЕСТВЕННОГО
СОСТАВА РАСТВОРОВ
Для описания раствора используются понятия «каче
ственный и количественный состав». Качественные
характеристики включают наименование растворителя и растворённого вещества. Количественные характеристи ки определяют соотношение компонентов в системе.
Количественный состав растворов выражается че
рез понятие концентрация.
7
6
Концентрация — это величина, измеряемая ко
личеством вещества, содержащегося в определённой
массе или объёме растворителя или раствора.
Основные способы выражения концентрации
^Массовая доля (процентная концентрация)
Показывает сколько вещества в граммах содержится в 100 г раствора. Выражают в долях от единицы или в %.
ш (в—ва)
<0(в-ва)% = — ———— * 100% m (р-ра)
где:
т(в-ва) — масса растворённого вещества, г; ш(р-ра) — масса раствора, г.
Из приведённой формулы следует:
ш(в-ва) = со(в-ва) * т(р-ра)! 1 0 0 % т(р-ра) = ю(в-ва) • 1 0 0 % / т(р-ра)
Для проведения количественных расчётов необходи мо пользоваться следующими формулами:
т(р-ра) = т(в-ва) + т(растворителя)
если растворителем является вода, то
Часто от массовых единиц приходится переходить к
объёмным:
m(p-pa) = V(p-pa) • р (р-ра)
где:
ш(р-ра) — масса раствора, г; V(p-pa) — объём раствора, мл;
р (р-ра) — плотность раствора, г/мл.
Так как плотность воды равна 1 г/мл, то m(H20 )=V(H20).
2. Молярная концентрация (молярность) С«(в-ва)
Показывает какое количество вещества в молях содер жится в 1 л раствора. Единицы измерения [моль/л] или
[моль/дм3].
|
_ |
v ( B — B a ) _______т(в -в а) |
|
м |
V(p~pa) М(в-ва) • V(p-pa) |
где:
у(в-ва) — количество растворённого вещества, моль;
ш(в-ва) — масса растворённого вещества, г; М(в-ва) — молярная масса растворённого вещества, г/моль;
V(p-pa) — объём раствора, л.
При одинаковой молярной концентрации равные объёмы растворов различных веществ содержат одинако вые количества вещества (моль).
9
т(р-ра) = т(в-ва) + т(НгО)
3..Нормальная концентрация (нормальность) С..(п-тй
или молярная концентрация эквивалента С __(к-иа)
Показывает какое количество молей эквивалентов веще ства содержится в 1 л раствора. Единицы измерения
[моль/л] или [моль/дм3].
|
2*8, V(p-pa) |
Мэкв(в-ва) • V(p-pa) |
где:
Уэкв(в-ва) —количество эквивалента растворённого веще ства, моль;
т(в-ва) — масса растворённого вещества, г;
Мэкв(в-ва) — молярная масса эквивалента растворённого вещества, г/моль;
V(p-pa) — объём раствора, л.
Эквивалент — частица вещества, которая в ки слотно-основной реакции высвобождает один ион водо рода или соединяется с ним, а в окислительно
восстановительной реакции может присоединять или высвобождать один электрон.
Молярная масса эквивалента Мэкв — масса моля эк вивалентов вещества.
Мэкв(в-ва) = М(в-ва) • f3KB
Гэкв ~ фактор эквивалентности, безразмерная величина.
Фактор эквивалентности f3KB — это число,
обозначающее, какая доля реальной или условной час тицы вещества эквивалентна одному иону водорода в данной кислотно-основной реакции или одному элек трону в данной окислительно-восстановительной ре акции.
Расчёт Фактора эквивалентности веществ
I. Для веществ не вступающих в реакцию:
|
f3KB кислоты = |
1 |
|
~ |
|
|
основность к-ты |
Основность к-ты определяется по числу атомов водорода, входящих в её состав.
Например: f3KBHCI = 1; f3KBH2S0 4 = 1/2; f3KBH3P0 4 = 1/3.
1
f,KB основания = — кислотность
Кислотность основания определяется по числу гидроксогрупп, входящих в его состав.
HanpHMep:f3KBNaOH=l; f3KBMg(OH)2= 1/2; f3KBА1(ОН)з~1/3.
|
1 |
|
|
^ |
— — ——— |
|
экв соли |
валентность Me • число атомов Me |
Например: f3KBN aCl-l; f3KBNa2S0 4 =l/2 ; f3KBAl2(S0 4 )3~ l/6 .
|
4* |
1 |
|
— |
|
|
экв оксида |
валентность эл-та • число атомов эл-та |
Например: f3KBAI2O3 — 1/6; f^ B ^ O s^ 1/10.
И
10
II. Для веществ вступающих в реакцию:
Фактор эквивалентности может быть рассчитан, если известна стехиометрия реакции.
1 . Кислотно-основные реакции:
Составим уравнение реакции:
Н3РО4 + NaOH -> NaH2P 0 4 + Н20
Точка эквивалентности будет достигнута, когда каждая частица Н3Р04 прореагирует с каждой частицей NaOH (1 :1), т.е. в процессе реакции замещается один ион водоро да.
f3KBH3P0 4 = 1, f3KBNaOH=l.
Если реакция протекает по уравнению
Н3РО4+ 2NaOH Na2HP04 + 2НаО,
то в точке эквивалентности каждая реагирующая частица Н3РО4 будет эквивалентна двум частям NaOH (1 :2 ), т.е. ко личества реагирующих веществ будут эквивалентны, когда v(NaOH) = v(l/2 Н3РО4). В данной реакции замещается два иона водорода.
f3KBH3P04= 1/2, f3KBNaOH=l.
Если же реакция протекает по уравнению
Н3РО4 + 3NaOH -* Na3P 0 4 + 3H20,
то в точке эквивалентности каждая реагирующая частица Н3Р04 будет эквивалентна трём частям NaOH (1 :3), т.е. ко личества реагирующих веществ будут эквивалентны, когда
v(NaOH) = v(l/3 Н3РО4). В данной реакции замещается три
иона водорода.
f3KBН3РО4 = 1/3, f3KBNaOH=l.
2. Окислительно-восстановительные реакции:
Рассмотрим окислительно-восстановительные пре вращения перманганат — иона в кислой, нейтральной и ще лочной средах.
Если реакция протекает в кислой среде:
2КМп04 + 5K2S03 + 3H2S04 = 2MnS04 + 6K2S04 + 3H20 Mn+7 + 5ё -► Mn+2
S+4 — 2e -> S+6
TO f3KB KMn04 = 1/5, т.к. в данной окислительно восстановительной реакции Мп+7 переходит в Мп+2, при нимая 5ё. Соответственно f3KBK2SO3 = 1/2.
Если реакция протекает в нейтральной среде:
2KMn04 + 3K2S03 + Н20 = 2MnOz + 3K2S04 + 2К0Н Мп+7 + 3ё —> Мп+4
S+4 — 2ё -> S+6 f3KBKMn04 = 1/3, f3KBK2SO3 = 1/2.
Если реакция протекает в щелочной среде:
2КМп04 + K2S03 + 2К0Н = 2K2M n04 + K2S04 + Н20 Мп+7 + ё -» Мп+6
S+4 — 25 -»• S+6 f3KBKMn04 = 1, f3KBK2S03 = 1/2.
Ниже приведена таблица значений f3KBдля некоторых ве ществ.
13
12
Титриметрические реакции и соответствующие
Реагирующие
вещества
1
НС1, NaOH
h 2 s o 4, КОН
н 3р о 4, КОН
НС1, Ва(ОН) 2
НС1, Na2€ 0 3
A gN 03, NaCl
КМ11О4, FeS04
KMn04> H2C20 4
K2Cr2 0 7, FeCl2
K2Cr2 0 7, KJ
H2 S, h
J2, Na2 S2 0 3
значения эквивалентов
Аналитическая
реакция
2
HCl + NaOH = NaCl + H20
H2 S 0 4 + 2KOH =K2 S 0 4 +
2HzO
H3PO4 +KOH = KH2 P04 +
H 2O
Н3РО4 + 2KOH = K2 HP04 +
2H20
H3P 04 + 3KOH = K3PO4
+зн2о
2HC1 + Ba(OH) 2 = BaCl2 +
2H-.0
2HC1 + Na2C 03 = 2NaCl +
co2 + H20
HCl+ NajCOj= NaCl+
NaHC03
AgN03 + NaCl = NaN03 +
• AgCl 2KMn04 + lOFeSO* +
8H2 S 0 4 = K2S 0 4 + 8H20 + 2MnS04 + 5Fe2 (S04) 3
2KMn04 + 5H2C2 0 4 + 3H2 S 0 4 = K2 S 0 4 + 2MnSO, + 10C02 + 8H20
K2 Cr2 0 7 + 6 FeCl2 + 14HC1 = 2KC1 + 2CrCl3 + 6 FeCl3 +
7H20
K2Cr20 7 + 6 KJ + 7H2 S 0 4 = 4K2 S 0 4 + Cr2(S 0 4) 3 + 3J2 +
7H20
H2S + J2 — S + 2HJ
2Na2 S2 0 3 + h = Na2 S40 6 +
2NaJ
Фактор эквива лентности, f 3
f(HCl) = 1; f(NaOH) = 1
f(H2 S 0 4) = 1 /2 ; f(KOH) = 1 f(H3P 0 4)= 1; f(KOH) = 1 f(H3P 04) = 1/2; f(KOH) = 1 f(H3P 0 4) = 1/3; f(KOH) = 1 f(HC!) = 1; f(Ba(OH)2)= 1/2 f(HCl)= 1; f(Na2 C 03) = 1/2 f(HCl)= 1; f(Na2C 03)= 1 f(AgN03)= 1; f(NaCl) = 1
f(KMn04) =1/5; f(FeS04) = 1
f(KMn04) = 1/5; f(H2C2 0 4) = 1 / 2
f(K2 Cr20 7) — 1 /6 ; f(FeCb)= 1
f(K2 Cr20 7) = 1/6; f(KJ) = 1
f(H2 S) = 1/2; f(J2) = 1/2
f(Na2 S?0 3) = 1/2; f(J2) = 1/2
4. Т и т р Т(в-ва)
Показывает сколько вещества в граммах содержится в 1 мл раствора. Единицы измерения [г/мл] или [г/см3].
т = т (в~ ва) V(p-pa)
где:
т(в-ва) — масса растворённого вещества, г; V(p-pa) — объём раствора, мл.
Формулы для перевода концентраций друг в друга
1 0 • со% • р
с „ =
М • f3KB
Сн • Мэкв Т = ————-
1000
15
14
РАСЧЁТЫ, НЕОБХОДИМЫЕ ДЛЯ
ПРИГОТОВЛЕНИЯ РАСТВОРОВ РАЗЛИЧНОЙ
КОНЦЕНТРАЦИИ
Часто на практике, чтобы приготовить раствор за данной концентрации, необходимо найти массу вещества и массу растворителя (воды, спирта и др.) или наоборот, бы вает необходимо вычислить концентрацию какого-либо раствора.
Вычисление массы (объёма) растворённого вещества и массы (объёма) растворителя
Пример 1. Вычислите массы соли и воды, необходимые для приготовления 800 г раствора с массовой долей хлори да бария 0,04 (или 4%).
Решение:
1) Определим массу соли, необходимую для приготовле ния данного раствора:
т(соли) — ео(соли) • т(р-ра); т(ВаС12) = 0,04 • 800 г = 32 г
2) Находим массу воды:
ш(Н20) — т(р-ра) — т(соли); т(Н 20 ) = 800 г — 32 г = 768 г
Ответ: для приготовления раствора потребуется 32 г ВаСЬ и 768 г Н20.
Пример 2. Сколько граммов гидроксида калия КОН нужно добавить к 2 0 0 мл 15%-ного его раствора (плотность 1 ,1 2 г/мл), чтобы приготовить 2 0 %-ный раствор?
Решение:
1) Определим массу 200 мл исходного раствора: mj(p-pa) = Vt(p-pa) • pi(p-pa);
mi(р-ра) = 200 мл • 1,12 г/мл = 224 г
2) Найдём массу КОН, содержащегося в 224 г 15%-ного
|
_ |
m (в—ва) |
|
раствора, используя формулу: й>(в-ва) ~ |
т «(р-ра) ’ из К0Т0~ |
рой Ш](в-ва) = 0)1 (в-ва) • mi (р-ра);
mi(KOH) = 0,15 • 224 г = 33,6 г
3) Обозначим массу добавляемого твёрдого КОН через х г. Тогда масса полученного раствора равна (224 + х) г, а мас са растворённого в нём КОН равна (33,6 + х) г.
_ ш (в-ва)
Массу КОН можно найти но формуле: Ю(в-ва) ~
|
33,6 + х |
откуда х = 14 г. |
|
О? = ———; |
|
|
2 2 4 + х |
J |
Ответ: для приготовления раствора необходимо 14 г гид
роксида калия КОН. I
Пример 3. Какую массу раствора с массовой долей карбо ната калия 40% надо прибавить к воде массой 500 г для получения раствора с массовой долей К2СОз 15%?
17
16
Решение:
1)Обозначим массу раствора с со(К2СОз) = 0,4 (40%) через
х.Тогда масса растворённого вещества:
т(КгСОз) = ю^КгСОз) • mi(p-pa) = 0,4 • х
2) Находим массу раствора т 2(р-ра), полученного после прибавления воды массой 500 г к исходному раствору:
то (р-ра) = пц(р-ра) + т(Н 2 0 ) = х + 500 Таким образом, в растворе массой Ш2(р-ра) = х + 500 со держится К2СОз массой 0,4 • х. Получаем
|
„г |
ч |
ш(КгСОз) |
|
|
со2(К2С 03) —————учитывая, что ©2(К2СОз) = 0.15 или |
|||
|
m 2(р-ра) |
|||
|
(15%), имеем: |
|||
|
0 Д5 = |
откуда х = 300 г. |
||
|
х + 500 |
J |
Ответ: необходимо прибавить 300 г раствора карбоната калия.
Пример 4. В лаборатории имеются растворы с массовой долей хлорида натрия 10% и 30%. Какую массу каждого раствора нужно взять для приготовления 2 0 0 г раствора, содержащего 15% хлорида натрия.
Решение:
При решении задач на смешение (или разведение) растворов часто пользуются диагональной схемой. Такой
способ решения называют ещё вычислением по «правилу креста» (квадрата Пирсона). Поясним это на данном при
мере.
Записываем друг под другом массовые доли исход ных растворов, а правее между ними — массовую долю раствора, который необходимо приготовить:
Из большей массовой доли вычитаем заданную (0,3 — 0,15 = 0,15) и записываем результат справа вверху. Далее из за данной массовой доли вычитаем меньшую (0,15 — 0,1 = 0,05) и записываем результат справа внизу:
|
0,1 |
/ ^ ° ’15 |
|
|
Х |
’15^ |
‘*■<1,05 |
|
0 , 3 / |
Числа 0,15 и 0,05 показывают, в каком массовом от ношении надо взять растворы с ©i(NaCl) = 0,1 (10%) и <B2(NaCl) = 0,3 (30%) соответственно.
19
18
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Загрузить PDF
Загрузить PDF
В химии концентрация раствора показывает, как много растворенного вещества содержится в растворителе. Согласно стандартной формуле C = m/V, где C — концентрация, m — масса растворенного вещества и V — общий объем раствора. При малых концентрациях удобнее вычислять концентрацию в миллионных долях (ppm). Во время лабораторной работы вас могут попросить также вычислить молярность, или молярную концентрацию раствора.
-
1
Найдите массу растворенного вещества. Это вещество добавляют в растворитель, чтобы получить раствор. Если в условии дана масса растворенного вещества, запишите ее и укажите соответствующие единицы измерения. Если эту массу необходимо найти, взвесьте то вещество, которое вы собираетесь растворить, на лабораторных весах и запишите результат измерений.[1]
- Если растворенное вещество имеет жидкую форму, можно вычислить массу с помощью формулы для плотности D = m/V, где m — масса жидкости и V — ее объем. Чтобы найти массу, умножьте плотность жидкости на объем.
Совет: если необходимо использовать весы, вычтите из общей массы массу емкости, в которой находится взвешиваемая жидкость, чтобы получить правильный результат.
-
2
Запишите общий объем раствора. Этот объем равен сумме объема растворителя и растворенного вещества. Если необходимо измерить объем в лаборатории, приготовьте раствор в мерной пробирке или мензурке и определите объем. Чтобы получить более точный результат, определите объем по верхнему краю поверхности раствора (мениска). Запишите найденную величину.[2]
- Если вы не измеряете объем раствора самостоятельно, возможно, потребуется вычислить его по массе и плотности.
- Например, если следует найти концентрацию 3,45 грамма соли, растворенной в 2 литрах воды, можно определить объем по формуле для плотности. Найдите плотность соли в справочнике или интернете и решите уравнение относительно массы m. В данном случае плотность соли составляет 2,16 г/мл (грамма на миллилитр). Получаем 2,16 г/мл = (3,45 г)/V. Умножим обе части равенства на V и получим V(2,16 г/мл) = 3,45 г. После этого поделим каждую часть на 2,16 и найдем объем: V = (3,45 г)/(2,16 г/мл) = 1,60 мл.
- Прибавьте к объему растворенного вещества объем растворителя. В нашем примере имеем 2 л + 1,6 мл = 2000 мл + 1,6 мл = 2001,6 мл. Можно оставить найденный объем в миллилитрах или перевести его в литры: 2,002 л.
-
3
Поделите массу растворенного вещества на общий объем раствора. Запишите уравнение C = m/V, где m — масса растворенного вещества и V — общий объем раствора. Подставьте величины массы и объема и выполните деление, чтобы определить концентрацию раствора. Не забудьте записать в ответе правильные единицы измерения.[3]
- В нашем примере для концентрации 3,45 грамма соли в 2 литрах воды имеем C = (3,45 г)/(2,002 л) = 1,723 г/л.
- В некоторых задачах требуется найти концентрацию в определенных величинах. Не забудьте перевести значения в соответствующие единицы измерения, прежде чем подставлять их в конечную формулу.
Реклама
-
1
Найдите массу растворенного вещества в граммах. Измерьте массу того вещества, которое вы собираетесь добавить в раствор. Не забудьте вычесть массу емкости, если вы используете ее при взвешивании, чтобы получить правильный результат.[4]
- Если растворяемое вещество находится в жидкой форме, можно вычислить его массу с помощью формулы D = m/V, где D — плотность жидкости, m — ее масса и V — объем. Найдите плотность жидкости в справочнике или интернете и решите уравнение относительно массы.
-
2
Определите общую массу раствора в граммах. Общая масса равна сумме масс растворенного вещества и растворителя. Измерьте эти массы с помощью лабораторных весов или переведите объем растворителя в массу с помощью формулы для плотности D = m/V. Сложите массы растворенного вещества и растворителя, чтобы найти общую массу.[5]
- Например, если вы хотите найти концентрацию 10 граммов порошка какао в 1,2 литра воды, определите массу воды по формуле для плотности. Плотность воды составляет 1000 г/л, поэтому получаем 1000 г/л = m/(1,2 л). Умножим обе стороны равенства на 1,2 литра и найдем массу в граммах: m = 1,2 л×1000 г/л = 1200 г. Прибавим массу порошка какао и получим 1210 г.
-
3
Поделите массу растворенного вещества на общую массу раствора. Определим концентрацию как C = масса растворенного вещества/общая масса раствора. Подставьте в это уравнение значения, чтобы найти концентрацию раствора.[6]
- В нашем примере C = (10 г)/(1210 г) = 0,00826.
-
4
Умножьте ответ на 100, если хотите найти концентрацию в процентах. Если требуется определить концентрацию в процентах, умножьте найденный ответ на 100. Запишите полученный результат со знаком процентов.[7]
- В нашем примере концентрация в процентах составляет 0,00826×100 = 0,826 %.
-
5
Умножьте концентрацию на 1000000, чтобы найти миллионные доли. Возьмите найденное значение концентрации и умножьте его на 1000000, или 106. В результате вы найдете, сколько миллионных долей растворенного вещества содержится в растворе. Укажите в ответе единицы измерения в ppm.[8]
- В нашем примере количество миллионных долей ppm = 0,00826×1000000 = 8260 ppm.
Совет: миллионные доли обычно используют для очень малых концентраций, когда легче записать и понять ответ в них, а не в процентах.
Реклама
-
1
Сложите атомные массы растворенного вещества, чтобы найти молярную массу. Посмотрите, из каких химических элементов состоит данное растворенное вещество. Выпишите атомную массу каждого элемента, поскольку атомная и молярная массы равны. Сложите все атомные массы элементов растворенного вещества, чтобы найти общую молярную массу. Укажите в полученном результате, что это г/моль (количество граммов на моль).[9]
- Например, если в качестве растворенного вещества дан гидроксид калия, найдите атомные массы калия, кислорода и водорода и сложите их. В результате получится молярная масса = 39 +16 + 1 = 56 г/моль.
- Молярность используется в химии в основном тогда, когда известен химический состав растворенного вещества.
-
2
Поделите массу растворенного вещества на его молярную массу, чтобы определить количество молей. При необходимости измерьте массу растворенного вещества с помощью лабораторных весов. Не забудьте вычесть массу емкости, чтобы получить правильный результат. Поделите найденную массу на молярную массу, в результате вы узнаете количество молей. Укажите возле ответа «моль».[10]
- К примеру, если вы хотите найти, сколько молей содержится в 25 граммах гидроксида калия (KOH), уравнение будет выглядеть следующим образом: число молей = (25 г)/(56 г/моль) = 0,45 моль.
- Переведите массу растворенного вещества в граммы, если она указана в других единицах измерения.
- Моли показывают количество молекул в растворе.
-
3
Переведите объем раствора в литры. Определите объем растворителя, прежде чем приготовить раствор. Если объем не дан в условии задачи, используйте мерную пробирку или мензурку. Если вы получите результат в миллилитрах, поделите его на 1000, чтобы перевести в литры.[11]
- В рассматриваемом примере если вы используете 400 миллилитров воды, поделите эту величину на 1000, и у вас получится 0,4 литра.
- Если объем растворителя уже указан в литрах, данный шаг можно пропустить.
Совет: обычно нет необходимости учитывать объем растворенного вещества, так как он, как правило, не сильно влияет на общий объем. Однако если объем заметно изменится после того, как вы добавите растворимое вещество, используйте общий объем раствора.
-
4
Поделите количество молей растворенного вещества на объем раствора в литрах. Запишите молярность следующим образом: M = mol/V, где mol — количество молей растворенного вещества и V — объем растворителя. Найдите ответ и поставьте возле него букву «M».[12]
- В нашем примере M = (0,45 моль)/(0,4 л) = 1,125 M.
Реклама
Советы
- Если вы находитесь в лаборатории и не знаете, сколько растворенного вещества было добавлено, можно титровать раствор другими реактивами. При этом необходимо знать, как записывать химические уравнения в стехиометрическом виде.
Реклама
Об этой статье
Эту страницу просматривали 227 722 раза.