Условие задачи:
Найти среднюю квадратичную скорость молекул газа, имеющего плотность 1,8 кг/м3 при давлении 152 кПа.
Задача №4.1.44 из «Сборника задач для подготовки к вступительным экзаменам по физике УГНТУ»
Дано:
(rho=1,8) кг/м3, (p=152) кПа, (upsilon_{кв}-?)
Решение задачи:
Запишем для начала основное уравнение молекулярно-кинетической теории (МКТ) идеального газа:
[p = frac{1}{3}n{m_0}upsilon _{кв}^2]
Распишем в этой формуле концентрацию молекул (n) как отношение числа молекул (N) к объему газа (V):
[p = frac{1}{3}frac{{{m_0}N}}{V}upsilon _{кв}^2]
Произведение массы одной молекулы (m_0) на число молекул (N) равна массе газа (m), поэтому:
[p = frac{1}{3}frac{m}{V}upsilon _{кв}^2]
Отношение массы газа (m) к его объему (V) есть плотность газа (rho), значит:
[p = frac{1}{3}rho upsilon _{кв}^2]
Выразим отсюда искомую среднюю квадратичную скорость молекул (upsilon_{кв}):
[{upsilon _{кв}} = sqrt {frac{{3p}}{rho }} ]
Численное значение этой скорости равно:
[{upsilon _{кв}} = sqrt {frac{{3 cdot 152 cdot {{10}^3}}}{{1,8}}} = 503,3;м/с = 1812;км/ч]
Ответ: 1812 км/ч.
Если Вы не поняли решение и у Вас есть какой-то вопрос или Вы нашли ошибку, то смело оставляйте ниже комментарий.
Смотрите также задачи:
4.1.43 Найдите отношение средних скоростей молекул O2 и H2 при одинаковой температуре
4.1.45 В баллоне находится кислород при давлении 4 МПа и температуре 42 C. Определить
4.1.46 В баллоне объемом 0,01 м3 находится газ, кинетическая энергия поступательного движения
-
Основное уравнение молекулярно-кинетической теории:
,
где
– давление
газа,
– концентрация
молекул,
–
масса одной молекулы,
–
средняя квадратичная скорость одной
молекулы,
—
плотность газа,
–абсолютная
температура,
–
постоянная
Больцмана.
-
Средняя
кинетическая энергия поступательного
движения одной молекулы:
.
-
Изопроцессы
(газовые законы) –
для
:
1)
— изотермический:
;
2)
—
изобарный:;
3)
—
изохорный:
.
-
Уравнение
Менделеева-Клапейрона:
,
где
–
объём газа,
– масса газа,
– молярная масса;
)
– универсальная
газовая постоянная.
-
Количество
вещества:
,
где
– общее число молекул;
– постоянная Авогадро.
-
Скорости
молекул:
—
средняя квадратичная,
—
средняя арифметическая,
—
наиболее вероятная.
-
Нормальные
условия:
—
объём
одного моля газа.
Примеры решения задач
Задача
1.
Смесь кислорода и азота при температуре
t=270С
находится под давлением Р=2,3·102
Па.
Масса кислорода составляет 75% от общей
массы смеси. Определите концентрацию
молекул каждого из газов.
|
Дано: Т=300 Р=2,3·102 m1=0,75 М1=0,032 М2=0,028 |
Решение:
Смесь где (2) концентрация смеси газов; азота; |
|
n1 |
Из
выражений (1) и (2) имеем:
.
(3)
Выразим
концентрацию n1
через концентрацию n2.
По
условию задачи масса кислорода:
m1
= 0,75 m
,
(4)
где
m
– масса смеси.
Массу
кислорода можно выразить также через
концентрацию n1
и объем газа:
m1
=
,
(5)
где
М1
–
молярная масса кислорода;
NA
– число Авогадро;
V
– объем газа.
Приравняв
правые части выражений (4) и (5), получим:
.
(6)
Масса
азота m2=0,25m,
или иначе
.
Приравняв значенияm2
из последних двух формул, найдем:
.
(7)
Из
выражений (6) и (7) имеем:
.
(8)
Подставив
в формулу (3) значение n2
из
последнего выражения, получим n1
=.
После подстановки значений и вычисленияn1
=
0,40·1023
1/м3,
n2
=
0,15·1023
(1/м3).
Ответ:
n1
=
0,40·1023
1/м3,
n2
=
0,15·1023
(1/м3).
Задача
2.
В
закрытом сосуде объемом V=1
м3
находится
m1=1кг
азота и m2=1,5
кг воды. Определите давление в сосуде
при температуре t=6000С,
зная, что при этой температуре вся вода
превратится в пар.
|
Дано: V=1 m1=1 m2=1,5 Т=873 M1=0,028 M2=0,018 |
Решение:
По
Р=Р1+Р2 где
где
где |
|
Р |
Из
уравнений (2) и (3) имеем:
,
.
После подстановки давленийР1
и
Р2
в
выражение
(1)
имеем
Используя числовые значения, получим:
Р
=
8,62·105
Па.
Ответ:
Р =
8,62·105
Па.
Задача
3.
Определите
число молекул воздуха в аудитории
объемом V=180
м3
при температуре t=220С
и давлении Р=0,98·105
Па. Какова концентрация молекул воздуха
при этих условиях?
|
Дано: V=180 Т=295 Р=0,98· |
Решение:
Число
где
Из N |
|
N |
Число
молей воздуха в аудитории можно выразить,
используя уравнение Клапейрона-Менделеева
откуда
После
подстановки
из последней формулы в выражение (2)
получим:
.
(3)
Используя
числовые значения, определим N
=
0,43·1028.
Проверим единицы измерения правой части
выражения (3)
. Концентрацию (число молекул в единице
объема) определим по формуле:
.
После
подстановки:
n=0,24·1026.
Ответ:
N =
0,43·1028,
n=0,24·1026.
Задача
4.
Определите
среднюю квадратичную скорость молекул
некоторого газа, плотность которого
при давлении Р=1,1·105
Па
равна ρ=0,024.
Какова масса одного моля этого газа,
если значениеплотности
дано для температуры 270
С?
|
Дано:
|
Решение: Для
где Так |
|
|
в
таком виде:
,
откуда,после
подстановки числовых значений и
вычисления получим:
.
Для
определения массы одного моля газа
используем уравнение Клапейрона-Менделеева
—
откуда
.
Так как,
то,
или.
После подстановки числовых значений и
вычисления:
.
Ответ:
,
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Агата Ильина
15 сентября, 10:52
0
Данные задачи: ρ (плотность газа) = 1,8 кг/м³; P (давление газа) = 152 кПа (152 * 10³ Па).
Среднюю квадратичную скорость молекул газа можно вычислить из формулы: Р = 1/3 * ρ * Vср², откуда Vср = √ (3 Р / ρ).
Выполним расчет: Vср = √ (3 * 152 * 10³ / 1,8) = 503,3 м/с.
Ответ: Средняя квадратичная скорость молекул газа составляет 503,3 м/с.
- Комментировать
- Жалоба
- Ссылка
Газ находится под давлением 2 атм и имеет плотность 1,2 кг/м3 Определить среднюю квадратичную скорость молекул газа.
Оцените сложность задачи:
0 голосов, средняя сложность: 0.0000
Решения задачи
Данные задачи: газ находится под давлением
| Давление газа | P | 2 | атм |
|---|---|---|---|
| Плотность | 1,2 | $frac{кг}{м^{3}}$ | |
| Средняя квадратичная скорость молекул газа | $υ$ | ? |
Средняя квадратичная скорость
$ υ = sqrt{frac{3RT}{μ}} $
Уравнение Менделеева-Клайпейрона
$ PV = frac{m}{μ}RT $
Или
$ P =ρfrac{RT}{μ} $
Откуда находим
$ frac{P}{ρ} = frac{RT}{μ} $
и тогда
$ υ = sqrt{3frac{RT}{μ}}=sqrt{3frac{P}{ρ}}=sqrt{3frac{2×1,01×10^{5}}{1,2}}=711 frac{м}{с} $
Ответ:
$ Средняя квадратичная скорость молекул газа 711 frac{м}{с} $
Чтобы предложить решение пожалуйста войдите или зарегистрируйтесь
Средняя квадратичная скорость молекул — среднее квадратическое значение модулей скоростей всех молекул рассматриваемого количества газа
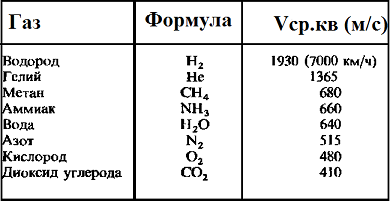
Таблица значений средней квадратичной скорости молекул некоторых газов
Для того чтоб понять, откуда же у нас получается эта формула, мы выведем среднюю квадратичную скорость молекул. Вывод формулы начинается с основного уравнения молекулярно кинетический теории (МКТ):
Где у нас количество вещества, для более легкого доказательства, возьмем на рассмотрение 1 моль вещества, тогда у нас получается:
Если посмотреть, то PV это две третьих средней кинетической энергии всех молекул (а у нас взят 1 моль молекул):
Тогда, если приравнять правые части, у нас получается, что для 1 моля газа средняя кинетическая энергия будет равняться:
Но средняя кинетическая энергия, так же находится, как :
А вот теперь, если мы приравняем правые части и выразим из них скорость и возьмем квадрат,Число Авогадро на массу молекулы , получается Молярная масса то у нас и получится формула для средней квадратичной скорости молекулы газа:
А если расписать универсальную газовую постоянную, как , и за одно молярную массу
, то у нас получится?
В Формуле мы использовали :
— Средняя квадратичная скорость молекул
— Постоянная Больцмана
— Температура
— Масса одной молекулы
— Универсальная газовая постоянная
— Молярная масса
— Количество вещества
— Средняя кинетическая энергия молекул
— Число Авогадро