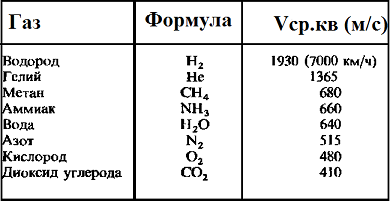
Средняя квадратичная скорость молекул — среднее квадратическое значение модулей скоростей всех молекул рассматриваемого количества газа
Таблица значений средней квадратичной скорости молекул некоторых газов
Для того чтоб понять, откуда же у нас получается эта формула, мы выведем среднюю квадратичную скорость молекул. Вывод формулы начинается с основного уравнения молекулярно кинетический теории (МКТ):
Где у нас количество вещества, для более легкого доказательства, возьмем на рассмотрение 1 моль вещества, тогда у нас получается:
Если посмотреть, то PV это две третьих средней кинетической энергии всех молекул (а у нас взят 1 моль молекул):
Тогда, если приравнять правые части, у нас получается, что для 1 моля газа средняя кинетическая энергия будет равняться:
Но средняя кинетическая энергия, так же находится, как :
А вот теперь, если мы приравняем правые части и выразим из них скорость и возьмем квадрат,Число Авогадро на массу молекулы , получается Молярная масса то у нас и получится формула для средней квадратичной скорости молекулы газа:
А если расписать универсальную газовую постоянную, как , и за одно молярную массу
, то у нас получится?
В Формуле мы использовали :
— Средняя квадратичная скорость молекул
— Постоянная Больцмана
— Температура
— Масса одной молекулы
— Универсальная газовая постоянная
— Молярная масса
— Количество вещества
— Средняя кинетическая энергия молекул
— Число Авогадро
Для характеристики движения молекул в физике используют две скорости: среднюю и среднюю квадратичную скорость молекул.
Важно. Следует обязательно понимать, что в реальных условиях мы не можем точно знать ни конкретное число молекул в системе, ни тем более скорость каждой из них в конкретный момент времени. Это обусловлено неимоверно гигантским числом частиц в реальных и даже сколько-нибудь приближенных к ним системах. Например, в 1 см3 при давлении 200 мм. рт. ст. содержится 4,18*1018 молекул водорода. Говоря более понятными категориями, это более чем 4 миллиарда миллиардов. Заметим, что указанное давление меньше атмосферного почти в 4 раза. Последнее в среднем равняется 760 мм. рт. ст. Разрежённый водород по своим свойствам наиболее близок к идеальному газу. В данном случае физика вынуждена иметь дело с распределениями скоростей и энергий частиц.
Что такое средняя скорость движения молекул
Среднюю скорость движения молекул часто именуют скоростью их теплового движения.
Определение 1
Вид формулы средней относительной скорости молекул в физике можно представить выражением:
[text { Vотн }=sqrt{2} sqrt{frac{8 R T}{pi m_{0}}}]
Выражение под корнем – средняя скорость молекул идеального газа.
Как определить среднюю квадратичную скорость движения молекул
Определение 2
Средней квадратичной скоростью молекул идеального газа называют величину равную квадратному корню из среднего арифметического величины квадратов скоростей каждой из молекул.
Средняя скорость молекул равна:
[leftlanglemathrm{V}_{mathrm{KB}}rightrangle=sqrt{frac{1}{N} sum_{i=1}^{N} v_{i}^{2}}]
Если обе её части возвести в квадрат и проинтегрировать, то получим выражение:
[langlemathrm{VKB}rangle^{2}=int_{0}^{infty} v^{2} F(v) d v]
Ещё одно выражение для среднеквадратичной скорости:
[leftlangle V_{K B}rightrangle=sqrt{frac{3 k T}{m_{0}}}=sqrt{frac{3 R T}{mu}}]
Именно она присутствует в уравнении, именуемом основным уравнением молекулярно-кинетической теории
P = (1/3)nm*<Vкв>
Где n – концентрация молекул, которая вычисляется делением их общего числа на объём.
Пример. 1.
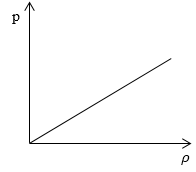
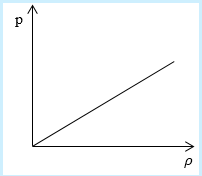
Рассмотрим простейший случай, чтобы использование интегрирования не затруднило понимание сути явления и помогло лучше понять материал. Вычислим как меняется средняя скорость движения молекул в идеальном газе при линейном увеличении его давления. График следующий:
Напомним, что средняя скорость частиц:
[mathrm{Vcp}=sqrt{frac{8 R T}{pi m_{0}}}]
Если присмотреться к представленному графику, то можно заметить, что P приблизительно равно ρ. Эти две величины можно связать соотношением
P=C*ρ
Где С – некоторая постоянная величина, константа.
Далее считаем m0= ρ/n, p = n*k*T = C* ρ. Отсюда следует, что k*T = (C*ρ)/n.
Нужно лишь подставить эти значения в формулу для средней скорости:
[V c p=sqrt{8 mathrm{kT} / pi mathrm{m}}=sqrt{(8 mathrm{C} rho / pi mathrm{n})(mathrm{n} / rho)}=sqrt{8 mathrm{C} / pi}]
В полученном выражении нет ни одной переменной величины, т. е. при увеличении давления, вопреки ожиданиям, скорость оказалась неизменной.
Ответ: В процессе, который был дан нам на графике, при увеличении давления средняя скорость молекул никак не меняется.
Нет времени решать самому?
Наши эксперты помогут!
Пример. 2.
Определим среднюю квадратичную скорость молекул газа при условии, что нам известны его давление (P), молярная масса (M) и концентрация частиц (n).
Воспользуемся формулой:
[leftlanglemathrm{V}_{kappa в}rightrangle=sqrt{frac{3 k T}{m_{0}}}=sqrt{frac{3 R T}{mu}}]
Также нам потребуется уравнение Менделеева-Клайперона
Здесь мы воспользовались тем, что:
m/μ = N/Na
PV = (m/μ)*RT = (N/Na)*RT
Если обе части этого уравнения поделить на V и принять во внимание, что
(N/V) = n, то можно получить
P = (n/Na)*RT. Отсюда находим, что RT = (p*N)/n
Если мы это подставим в выражение для среднеквадратичной скорости [leftlangle V_{K B}rightrangle=sqrt{3 mathrm{kT} / mathrm{m}_{0}}=sqrt{3 mathrm{RT} / mu}], получим, что средняя квадратичная скорость движения молекул газа: [leftlangle V_{K B}rightrangle=sqrt{left(3 rho N_{a}right) /(mu mathrm{n})}]
Ответ: Формула средней квадратичной скорости молекул исходя из данный нам условий следующая:
[leftlangle V_{K B}rightrangle=sqrt{left(3 rho N_{a}right) /(mu mathrm{n})}]
Екатерина Владимировна Мосина
Эксперт по предмету «Физика»
Задать вопрос автору статьи
Различают следующие скорости, характеризующие движение молекул.
Средняя скорость движения молекул
средняя скорость движения молекул $leftlangle vrightrangle $, которая определяется как:
где N — число молекул. Или, среднюю скорость можно найти как:
где $Fleft(vright)=4pi {left(frac{m_0}{2pi kT}right)}^{frac{3}{2}}expleft(-frac{m_0v^2}{2kT}right)v^2$ — функция распределения молекул по модулю скорости, указывающая долю молекул со скоростями, находящимися в единичном интервале $dv$ около величины скорости $v$, $m_0$- масса молекулы, $k$- постоянная Болцмана, T — термодинамическая температура. Для того, чтобы определить, как средняя скорость молекулы связана с макропараметрами газа, как системы частиц, найдем значение интеграла (2).
Произведем замену:
Следовательно:
Подставим (4) и (5) в (3), получим:
Сдай на права пока
учишься в ВУЗе
Вся теория в удобном приложении. Выбери инструктора и начни заниматься!
Получить скидку 3 000 ₽
Проведем интегрирование по частям, получим:
где R — универсальная газовая постоянная, $mu $- молярная масса газа.
Среднюю скорость движения молекул называют также скоростью теплового движения молекул.
Средняя относительная скорость молекул:
[leftlangle v_{otn}rightrangle =sqrt{2}sqrt{frac{8kT}{pi m_0}}=sqrt{2}leftlangle vrightrangle left(7right).]
Средняя квадратичная скорость
Средней квадратичной скоростью движения молекул газа называют величину:
[leftlangle v_{kv}rightrangle =sqrt{frac{1}{N}sumlimits^N_{i=1}{{v_i}^2}}left(8right).]
Или
[{leftlangle v_{kv}rightrangle }^2=intnolimits^{infty }_0{v^2Fleft(vright)dv left(9right).}]
Проводя интегрирование, которое аналогично интегрированию при получении связи средней скорости с температурой газа, получим:
[leftlangle v_{kv}rightrangle =sqrt{frac{3kT}{m_0}}=sqrt{frac{3RT}{mu }}left(10right).]
Именно средняя квадратичная скорость поступательного движения молекул газа входит в основное уравнение молекулярно-кинетической теории:
[p=frac{1}{3}nm_0{leftlangle v_{kv}rightrangle }^2left(11right),]
где $n=frac{N}{V}$ — концентрация частиц вещества, $N$- число частиц вещества, V- объем.
«Средняя скорость молекул» 👇
Пример 1
Задание: Определите, как изменяется средняя скорость движения молекул идеального газа при увеличении давления в процессе, представленном на графике (рис.1).
Рис. 1
Решение:
Запишем выражение для средней скорости движения молекул газа в виде:
[leftlangle vrightrangle =sqrt{frac{8kT}{pi m_0}} left(1.1right)]
По графику видим, что $psim rho или p=Crho , $ где C- некоторая константа.
[m_0=frac{rho }{n}, p=nkT=Crho to kT=frac{Crho }{n} left(1.2right).]
Подставим (1.2) в (1.1), получим:
[leftlangle vrightrangle =sqrt{frac{8kT}{pi m_0}}=sqrt{frac{8Crho }{pi n}frac{n}{rho }}=sqrt{frac{8C}{pi }}left(1.3right)]
Ответ: В процессе, изображенном на графике, с ростом давления средняя скорость движения молекул не изменяется.
Пример 2
Задание: Можно ли вычислить среднюю квадратичную скорость молекулы идеального газа, если известны: давление газа (p), молярная масса газа ($mu $) и концентрация молекул газа (n)?
Решение:
Используем выражение для $leftlangle v_{kv}rightrangle :$
[leftlangle v_{kv}rightrangle =sqrt{frac{3RT}{mu }}left(2.1right).]
Кроме того, из уравнения Менделеева — Клайперона и зная, что $frac{m}{mu }=frac{N}{N_A}$:
[pV=frac{m}{mu }RT=frac{N}{N_A}RTleft(2.2right).]
Разделим правую и левую части (2.2) на V, зная, что $frac{N}{V}=n$ получим:
[p=frac{n}{N_A}RTto RT=frac{pN_A}{n} left(2.3right).]
Подставим (2.3) в выражение для среднеквадратичной скорости (2.1), имеем:
[leftlangle v_{kv}rightrangle =sqrt{frac{3pN_A}{mu n}} left(2.4right).]
Ответ: По заданным в условии задачи параметрам среднеквадратичную скорость движения молекул газа вычислить можно с помощью формулы $leftlangle v_{kv}rightrangle =sqrt{frac{3pN_A}{mu n}}.$
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме
Дж. Максвелл вывел закон распределения молекул газа по скоростям (F(v)), график которого представлен на рисунке (1). Функция (F(v) = frac{Delta N}{NDelta v}) показывает относительное число молекул газа (frac{Delta N}{N}), скорости которых лежат в интервале от (v) до (v + Delta v) ((N) — число частиц в газе). Согласно данному закону средняя квадратичная скорость (bar{v}_{кв}) молекул газа в состоянии термодинамического равновесия ((T = const)) является постоянной величиной, значение которой вычисляется по формуле: (boxed{bar{v}_{кв} = sqrt{frac{3kT}{m_0}}}), ((1))
где (m_0) — масса молекулы газа, (k = frac{R}{N_A} = 1,38 · 10^{-23}) Дж/К — постоянная Больцмана.
Экспериментальное доказательство данного распределения было получено О. Штерном.
Средняя квадратичная скорость молекул

4.5
Средняя оценка: 4.5
Всего получено оценок: 286.
Обновлено 30 Июля, 2021
4.5
Средняя оценка: 4.5
Всего получено оценок: 286.
Обновлено 30 Июля, 2021
Температура — это уровень внутренней энергии, заключённой в хаотическом движении молекул вещества. Скорость конкретной молекулы может иметь весьма широкий диапазон, однако скорость большинства молекул лежит в достаточно узких пределах, поэтому в молекулярной физике используется среднее значение этой скорости. Как же оно определяется?
Среднее значение физической величины
Большинство физических величин, характеризующих конкретный объект, имеет вполне определённое значение. Однако, если рассматривается несколько объектов, измеренная величина может быть различна для каждого объекта. И для моделирования поведения системы этих объектов требуется учитывать все значения.
С возрастанием числа объектов измерять параметры для каждого объекта становится всё сложнее. Но при этом зачастую оказывается, что все измеряемые значения лежат в некоторых пределах, причём систему можно достаточно точно моделировать, пренебрегая мелкими отличиями параметров каждого объекта.
Когда число объектов очень велико (например, число молекул в теле), этот метод является единственно возможным. Более того, значение, полученное для одного конкретного объекта, практически не играет роли.
В таких случаях используется специальное значение, при котором суммарная ошибка параметра для всех объектов будет наименьшей. Это значение называется средним значением физической величины. Среднее значение может рассчитываться несколькими способами.
Скорость молекул газа
Газ — это хороший пример системы, которая состоит из большого числа движущихся объектов (молекул), при этом скорость каждой отдельной молекулы не имеет значения, и единственный способ оценки молекулярных движений — использование средней скорости.
Простейший способ нахождения среднего значения — это суммирование всех значений и деление суммы на количество значений. Такое среднее называется средним арифметическим.
Для скорости молекул такое среднее не подходит. Скорости молекул имеют самые разные направления, и, какое бы направление мы не взяли, всегда окажется, что по этому направлению и против него движется одинаковое число молекул. Простая сумма скоростей будет равна нулю. Поэтому здесь используется среднее значение квадрата скорости молекул.
$$overline{v^2} = {v^2_1+v^2_1+…+v^2_N over N}$$
Особенности среднеквадратичного значения
Квадрат любого ненулевого числа положителен, поэтому значение в приведённой формуле также всегда будет положительным.
Ещё одно преимущество использования средней квадратичной скорости молекул состоит в том, что кинетическая энергия материальной точки находится по формуле:
$$E={mv^2 over 2}$$
Получается, что средняя квадратичная скорость молекул газа удобна для нахождения средней энергии молекулы, а она, в свою очередь, связана с макроскопическими параметрами — с температурой и давлением. Поэтому именно среднеквадратичная скорость используется в большинстве формул молекулярно-кинетической теории.
Что мы узнали?
Средняя квадратичная скорость молекул газа — удобный показатель, широко использующийся в молекулярно-кинетической теории для определения макроскопических параметров — температуры и давления.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
Пока никого нет. Будьте первым!
Оценка доклада
4.5
Средняя оценка: 4.5
Всего получено оценок: 286.
А какая ваша оценка?