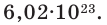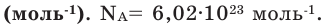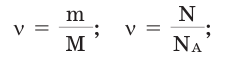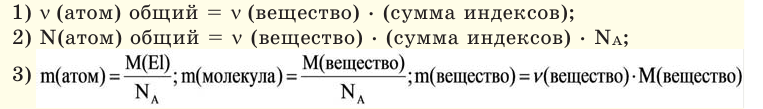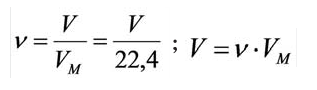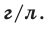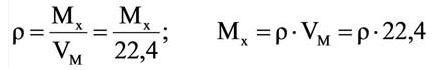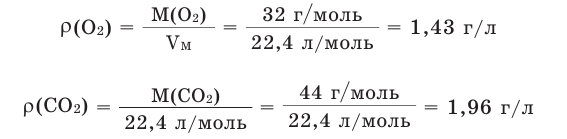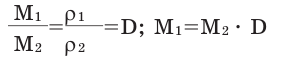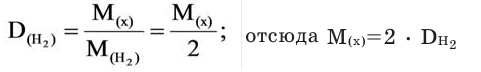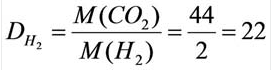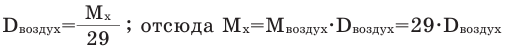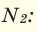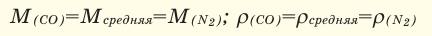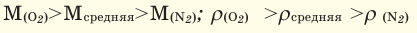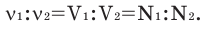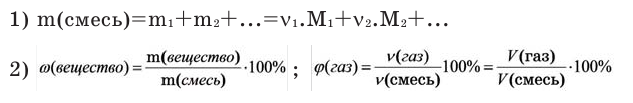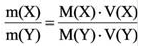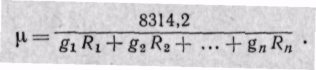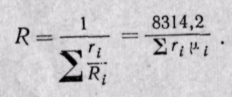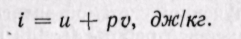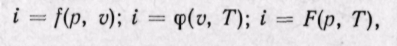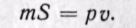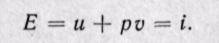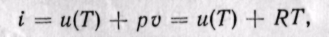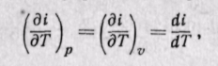Одним из основных
показателей, определяющих тип пластового
флюида, является его молекулярная масса,
она напрямую связана с его физическими
свойствами, и по ней можно охарактеризовать
состав природного газа, чем она больше,
тем выше в нем концентрация углеводородов
с большими молекулярными массами.
Молекулярная масса газовой смеси
состоящей в основном из метана (на 98
об.%), в пластовых условиях и на поверхности
приблизительно одинакова.
Кроме выше
перечисленной классификации углеводородов
(природный газ, газоконденсат и нефть),
существуют также классификации
подразделяющие их на сухой газ, жирный
газ, газоконденсат сухого газа,
газоконденсат жирного газа, летучая
нефть, нефть с высокой степенью усадки,
нелетучая нефть и тяжелая нефть.
Молекулярная масса жирного газа,
газоконденсата, в пластовых условиях
обычно больше, чем при нормальных
поверхностных условиях, что связано с
выпадением конденсирующихся, более
высокомолекулярных углеводородов в
пласте. В таблице 2.2 приведены диапазоны
молекулярных масс классифицирующих
углеводородные пластовые флюиды как
газы, газоконденсаты или нефти. Данные
интервалы являются приблизительными,
так как существуют некоторые исключения.
Таблица 2.2 –
Углеводородные пластовые флюиды
|
показатели |
Жирный и сухой газ |
Газокон-денсаты Сухого Газа |
Конденса-ты жирного газа |
Летучие нефти |
Нефть с высокой степенью усадки |
Нелетучая нефть |
Тяжелая Нефть и гудроны |
|
Молекуляр-ная масса |
не более 20 |
20-25 |
25-40 |
30-60 |
50-90 |
75-150 |
более 150 |
|
Цвет |
бесцвет-ный |
от жел-товатого до проз-рачного |
от оран-жевого до |
от зеле- новато- го до жевого |
от корич- неватого до зеленого |
от корич- невого темно-зе- леновато- го |
черный |
|
Доля С7+ |
0-1 |
1-6 |
6-12 |
10-30 |
25-35 |
30-50 |
Более 50 |
В таблице 2.3
приведены значения молекулярной массы
смеси углеводородов и составы пластовых
флюидов некоторых чисто газовых,
газоконденсатных и нефтяных месторождений.
Таблица 2.3 –
Состав пластовых флюидов чисто газовых,
газоконденсатных и нефтяных месторождений
|
Месторождение |
тип |
тип |
Молекул- лярная |
Состав газа, % |
||||||
|
CH4 |
С2Н6 |
C3H8 |
С4Н10 |
С5H12+ высшие |
СО2 |
N2 |
||||
|
Медвежье (Россия) |
газовое |
сухой газ |
16,27 |
98,56 |
0,17 |
0,01 |
0,02 |
0,02 |
0,22 |
1,0 |
|
Новопортовское (Россия) |
газовое |
жирный газ |
18,60 |
88,1 |
6,6 |
2,2 |
0,94 |
0,52 |
0,4 |
1,5 |
|
Юбилейное (Россия) |
газоконден-сатное |
конденсат сухого газа кСухого |
21,91 |
79,47 |
9,06 |
4,43 |
1,64 |
4,38 |
0,54 |
0,48 |
|
Надымское (Россия) |
газоконден-сатное |
конденсат жирного |
26,32 |
68,45 |
10,99 |
5,66 |
1,65 |
10,72 |
0,88 |
1,66 |
|
Ромашкинское (Россия) |
нефтяное |
летучая нефть |
32,27 |
38,8 |
19,1 |
17,8 |
8 |
6,8 |
1,5 |
8 |
|
Рэли (США) |
нефтяное |
нефть с высокой |
76,0 |
45,21 |
7,09 |
4,61 |
4,5 |
35,16 |
1,19 |
0,51 |
|
Месторождение Западного |
нефтяное |
тяжелая нефть |
108,9 |
15,93 |
10,47 |
10,69 |
9,41 |
53,69 |
0,01 |
0,13 |
|
Каннерли |
нефтяное |
битуминозная нефть |
268,6 |
22,62 |
1,69 |
0,81 |
0,89 |
73,99 |
0 |
0 |
В таблице 2.4
представлены молекулярные массы алканов,
которые также могут быть определены по
формуле:
(2.1)
где а
– число
атомов углевода; b
– число атомов водорода.
Таблица 2.4 –
Молекулярные массы алканов
|
Метан |
Этан |
Пропан |
Бутан |
Пентан |
Гексан |
Гептан |
|
|
Химическая формула |
СН4 |
С2Н6 |
С3Н8 |
С4Н10 |
С5Н12 |
С6Н14 |
С7Н16 |
|
Молекулярная масса |
16,043 |
30,070 |
44,097 |
58,124 |
72,151 |
86,178 |
100,20 |
|
Молекулярный объем 1 кмоля, м3 |
22,36 |
22,19 |
21,941 |
21,455 |
20,576 |
19,944 |
19,029 |
Таблица 2.5 –
Молекулярные массы неуглеводородных
компонентов
|
Углекис-лый газ |
Азот |
Сероводород |
Водяной пар |
|
|
Химическая формула |
СО2 |
N2 |
H2S |
H2O |
|
Молекулярная масса |
44,010 |
28,013 |
34,082 |
18,015 |
|
Молекулярный объем 1 кмоля, м3 |
22,264 |
22,403 |
22,190 |
20,845 |
Если известен
молярный состав смеси в процентах, то
среднюю молекулярную массу можно
определить по формуле:
(2.2)
где у1,
y2,
…, уn
– молярные (объемные) доли компонентов,
%; М1,
М2,
…, Мn
– молекулярные массы компонентов.
Упражнение 2.1.
Определить молекулярную массу смеси
газовых месторождений, представленных
в таблице 2.6.
Таблица 2.6 –
Компонентный состав природных газов
месторождений Тюменской области
|
Месторождение |
Продуктивный горизонт |
Состав газа, «% объемные |
|||||||
|
СН4 |
С2Н6 |
С3Н8 |
С4Н10 |
С5Н12+ |
СО2 |
N2 |
|||
|
1 |
Березовское |
П(юрский) |
94,61 |
0,95 |
0,16 |
0,03 |
— |
1,04 |
3,20 |
|
2 |
Бованенковское |
Сеноманский |
96,44 |
1,44 |
0,17 |
0,14 |
0,06 |
0,18 |
1,61 |
|
3 |
Нурминское |
ТП21-26 |
92,40 |
1,72 |
0,62 |
0,11 |
0,07 |
0,99 |
4,09 |
|
4 |
Губкинское |
Сеноманский |
96,95 |
0,47 |
0,07 |
— |
— |
0,53 |
1,98 |
|
5 |
Заполярное |
Сеноманский |
98,80 |
0,07 |
0,01 |
0,004 |
0,01 |
0,13 |
0,976 |
|
6 |
Комсомольское |
Сеноманский |
96,37 |
0,22 |
0,03 |
0,01 |
— |
0,49 |
2,88 |
|
7 |
Ямсовейское |
Сеноманский |
95,0 |
0,08 |
0,006 |
0,01 |
— |
0,3 |
4,6 |
|
8 |
Тазовское |
Сеноманский |
98,68 |
0,06 |
0,003 |
0,01 |
— |
0,39 |
0,86 |
|
9 |
Ямбургское |
Сеноманский |
98,2 |
0,04 |
0,006 |
0,001 |
0,1 |
0,3 |
1,353 |
|
10 |
Уренгойское |
Сеноманский |
99,05 |
0,06 |
0,01 |
– |
– |
0,08 |
0,80 |
Пример расчета.
Определить
молекулярную массу смеси на Медвежьем
месторождении. Объемные составы в
процентах и молекулярные массы компонентов
представлены в таблицах (2.4), (2.5) и (2.7).
Таблица 2.7 –
Компонентный состав газовой смеси
Сеноманского продуктивного горизонта
Медвежьего месторождения
|
Месторождение |
Продуктивный горизонт |
Состав газа, % объемные |
||||||
|
СН4 |
С2Н6 |
С3Н8 |
С4Н10 |
С5Н12+ |
СО2 |
N2 |
||
|
Медвежье |
Сеноманский |
98,56 |
0,17 |
0,01 |
0,02 |
0,02 |
0,22 |
1 |
Решение. Для
определения молекулярной массы смеси
используем формулу (2.2):

Определение
молекулярной массы смеси по компонентному
составу возможно, когда известны объемные
доли в процентах по каждому входящему
в состав смеси компоненту. Ввиду того,
что компоненты выше пентана объединяют
с ним в остаток С5Н12+,
а на газоконденсатных и нефтяных
месторождениях этот остаток обычно
более 2 %, использование формулы (2.2) будет
приводить к погрешности, размер которой
тем больше чем больше объемная доля
остатка С5Н12+.
В данном случае необходимо проводить
более расширенный хромотографический
анализ. В настоящее время существуют
приборы позволяющие определять состав
углеводородных компонентов до С40
и даже более.
Газовые смеси
можно охарактеризовать не только
молярными, но и массовыми концентрациями
компонентов. Молярный и объемный составы
газовых смесей примерно совпадают друг
с другом, так как объемы 1 кмоля идеальных
газов при одинаковых нормальных
физических условиях (P=0,1013
МПа и Т=273 К) по закону Авогадро составляют
22,41 м3.
Более точные значения молярных объемов
алканов и неуглеводородных компонентов
входящих в состав природных газов
представлены в таблицах 2.4 и 2.5. Пересчет
молярных (объемных) концентраций
компонентов газовой смеси в массовые
и наоборот производится при помощи
следующих формул:
— в массовых долях;
(2.3)
— в массовых
процентах;
(2.4)
— в молярных долях;
(2.5)
— в молярных
процентах,
(2.6)
где gi
– массовая доля i-го
компонента; Мi
– молярная
масса i-го
компонента.
Упражнение 2.2.
Пересчитать
объемные проценты в массовые проценты
по месторождениям представленным в
таблице 2.6.
Пример расчета.
Пересчитать объемные процентные в
массовые проценты на Медвежьем
месторождении. Исходные данные
представлены в примере 2.1.
Решение.
Для определения массовой доли метана
используем формулу (2.3):
EMBED Equation.3

Таким образом,
рассчитываются массовые доли всех
входящих компонентов, значения которых
представлены в таблице.
|
С1 |
С2 |
С3 |
С4 |
С5+ |
СО2 |
N2 |
|
|
Молярная доля, |
98,56 |
0,17 |
0,01 |
0,02 |
0,02 |
0,22 |
1 |
|
Массовая доля, |
97,18 |
0,31 |
0,02 |
0,07 |
0,08 |
0,59 |
1,72 |
Если известен
массовый состав смеси, то ее среднюю
молекулярную массу можно определить
по формуле:
(2.7)
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Содержание:
Количество вещества:
В чём разница между понятиями «масса» и «количество»
Если мы будем производить подобные расчеты, соответствующие этому заданию, для простых веществ, образованных различными элементами, то всякий раз получим одно и то же число —
Например, в 1 моле водородного газа содержится 


Количество частиц, содержащихся в 1 моле химических веществ ( 
Количество вещества можно вычислить по следующей формуле:
Здесь 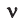
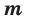
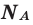
Молярная масса
Молярной массой называют массу 1 моля вещества, выраженного в граммах. Молярная масса обозначается
буквой М, единицей измерения является г/моль.
При выражении молярной массы вещества в граммах, она численно бывает равна его относительной молекулярной массе (если состоит из молекул). Для сравнения запишем (таблица 1):
Как видно из сравнений, молярная масса веществ по своей единице отличается от относительной молекулярной массы. То есть молярная масса — измеряемая величина.
Как видно из вышесказанного, понятие молярная масса применяется как к химическим элементам, так и к простым и сложным веществам с молекулярным и немолекулярным строением.
На основе количества вещества (моль) можно производить следующие вычисления. Если известно мольное количество вещества:
Закон Авогадро и молярный объём газов
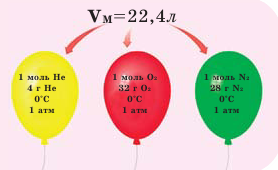
Обратите внимание на рисунки. Почему, несмотря на разные массы газов, они занимают одинаковый объём?
В начале XIX века итальянский ученый Авогадро, проведя наблюдения над свойствами газов в различных условиях и проанализировав открытые прежде законы о газах (Бойля-Мариотта, Гей-Люссака и др.) в 1811 году сформулировал новый закон о газах. Закон Авогадро звучит следующим образом: в равных объемах различных газов при одинаковых условиях (одинаковых температуре и давлении) содержится одинаковое число молекул.
Итальянский ученый. В 1811 году им был открыт закон о газах, который впоследствии был назван его именем.
Мы уже знаем, что 1 моль любого вещества содержит 
Было вычислено, что при нормальных условиях объем 1 моля любого газа или смеси газов составляет примерно 22,4 л. Объем 1 моля газа при нормальных условиях (н.у.) называют молярным объемом данного газа, выраженным знаком 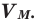
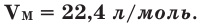
Здесь 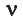
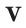
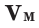
На основе закона Авогадро и молярного объёма газов можно вычислить плотность газов при нормальных условиях и относительную плотность одного газа по отношению к другому газу. Плотность обозначается буквой 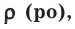
измерения —
Нормальные условия означают: температура 0°С, 1 атм давления 1атм — 101,3 кПа
Для вычисления плотности какого-либо газа X в нормальных условиях (н.у.), следует его молярную массу разделить на молярный объем:
Например, вычислим плотности кислорода и углекислого газа при нормальных условиях:
Плотность твёрдых и жидких веществ при н.у. вычисляется по формуле 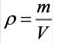
Для того, чтобы определить, масса какого из газов с одинаковыми объемами и при одинаковых условиях бывает тяжелее, пользуются понятием относительной плотности. Отношение плотностей различных газов при одинаковых условиях равно отношению их молярных масс. Относительная плотность обозначается буквой D и не имеет единицы измерения. Формула относительной плотности следующая:
Относительную плотность газов в большинстве случаев вычисляют по самому легкому газу — водороду и воздуху:
В таком случае, относительная плотность углекислого газа по водороду вычисляется следующим образом:
Так как средняя молярная масса воздуха, состоящего из смеси газов, примерно равна 29 г/моль, то формула его относительной плотности следующая:
Способы вычисления средней молярной массы газовой смеси
Здесь: 
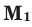
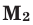

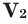
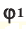
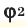
Среднюю молярную массу 1 моля смеси из двух различных газов можно вычислить по следующей формуле: 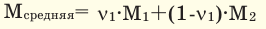
При смешивании газов с одинаковыми молярными массами, которые при одинаковом давлении не вступают друг с другом в реакцию, плотность газовой смеси (при н.у.), а также их средняя молярная масса остаются неизменными. Например, при смешивании 
При смешивании газов с различными молярными массами, при одинаковом давлении, средняя молярная масса (при н.у.) и плотность полученной газовой смеси приобретают значение между молярными массами и плотностями смешиваемых газов. Например, при смешивании 
При добавлении газа с большей молярной массой в тот или иной газ при постоянном давлении плотность газовой смеси увеличивается, а при добавлении газа с меньшей молярной массой — уменьшается.
Закон объемных отношений
В химических реакциях соотношение объемов, вступающих в реакцию, и полученных газов равно соотношению их коэффициентов. Например:
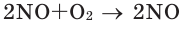
Численное соотношение объемов, молей и молекул газов равно друг другу.
Можно производить следующие вычисления по смесям:
3) Массовое соотношение двух газов:
- Физические и химические явления
- Растворы в химии
- Периодический закон Д. И. Менделеева
- Химические связи
- Состав и строение веществ в химии
- Простые и сложные вещества в химии
- Химическая формула
- Относительная атомная и относительная молекулярная масса
2.1. Основные понятия и формулы
Количество вещества — число структурных элементов (молекул, атомов, ионов и т. п.), содержащихся в теле или системе. Количество вещества выражается в молях. Моль равен количеству вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в 0,012 кг изотопа углерода 12 C. Количество вещества тела (системы)
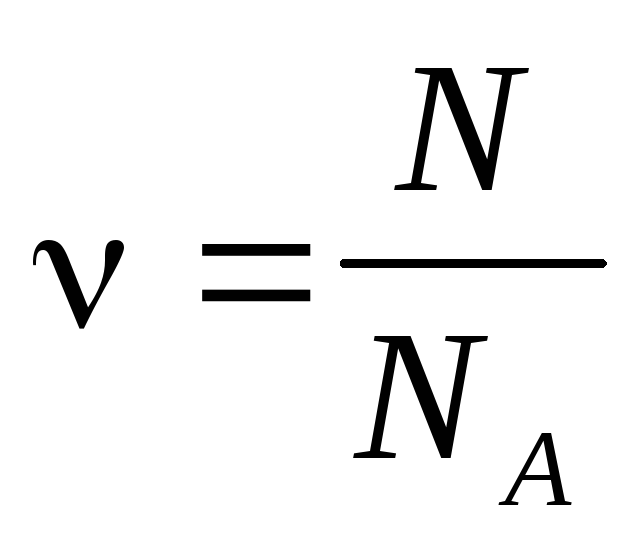
где N — число структурных элементов (молекул, атомов, ионов и т.п.), составляющих тело (систему). Постоянная Авогадро NА=6,0210 23 моль -1 .
Молярная масса вещества ,
где m—масса однородного тела (системы); —количество вещества (число молей) этого тела (системы). Выражается в единицах г/моль (или кг/моль).
Единица массы, равная 1/12 массы атома углерода 12 C, называется атомной единицей массы (а.е.м.). Массы атомов или молекул выраженные в атомных единицах массы называют соответственно относительной атомной или относительной молекулярной массой вещества. Относительная молекулярная масса вещества состоит из относительных атомных масс химических элементов, составляющих молекулу вещества. Относительные атомные массы химических элементов приводятся в таблице Д. И. Менделеева (см. также таблицу 8 приложения данного пособия).
Молярная масса вещества численно равна относительной атомной или молекулярной массе данного вещества, если размерность а.е.м. заменить на размерность г/моль.
Количество вещества смеси n газов
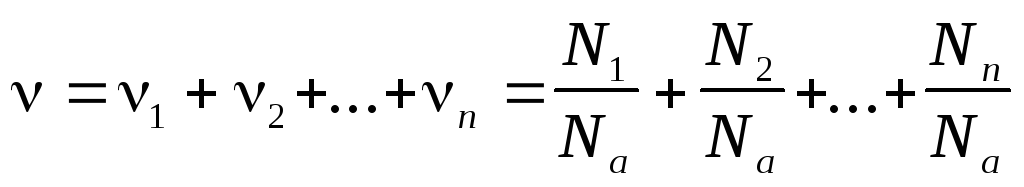
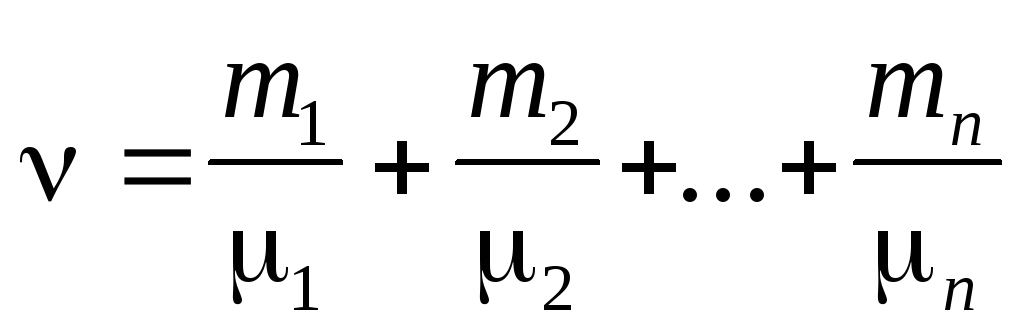
Уравнение Менделеева — Клапейрона (уравнение состояния идеального газа)

где т — масса газа, — молярная масса газа, R — универсальная газовая постоянная, ν — количество вещества, Т — термодинамическая температура.
Опытные газовые законы, являющиеся частными случаями уравнения Менделеева — Клапейрона для изопроцессов:
а) закон Бойля—Мариотта (изотермический процесс: T=const, m=const)
или для двух состояний газа, обозначенных цифрами 1 и 2,
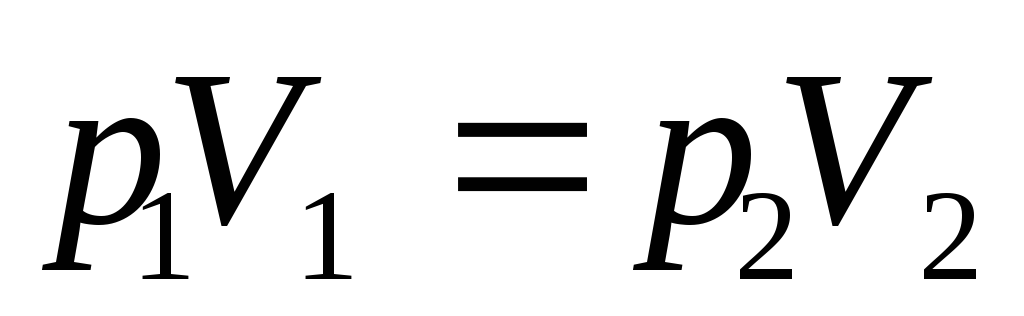
б) закон Гей-Люссака (изобарический процесс: р=const, m=const)
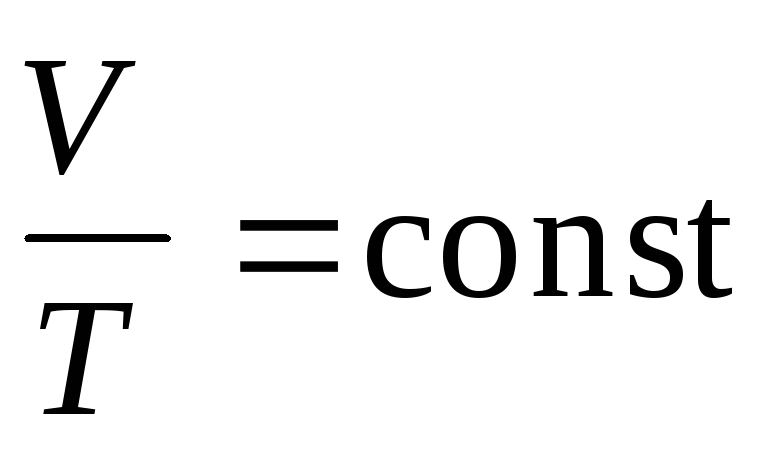
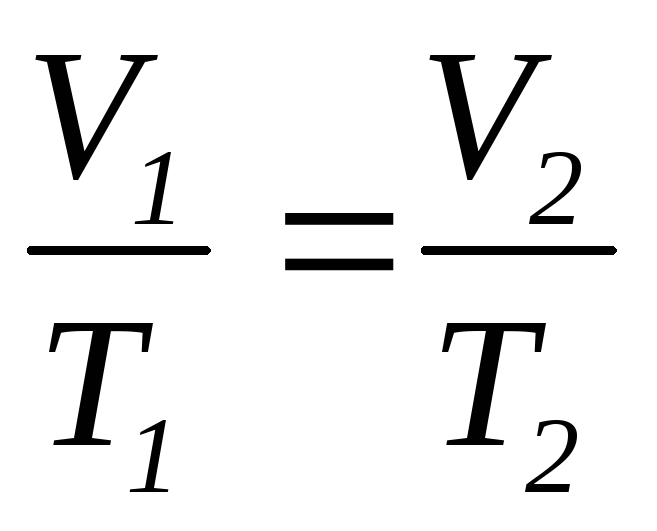
в) закон Шарля (изохорический процесс: V=const, m=const)
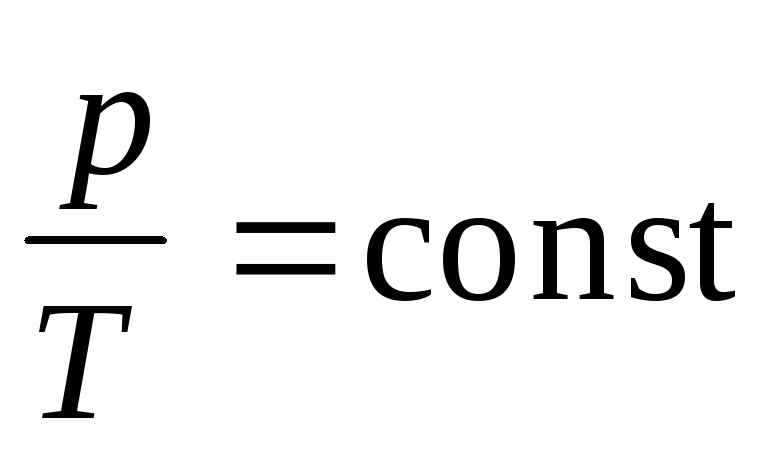
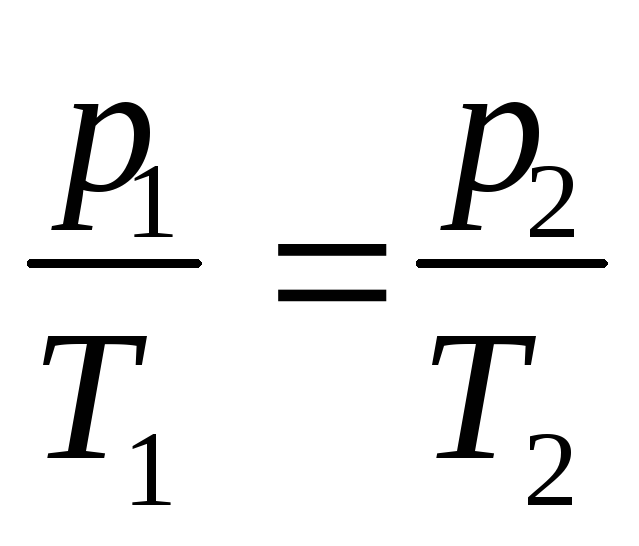
г) объединенный газовый закон (m=const)

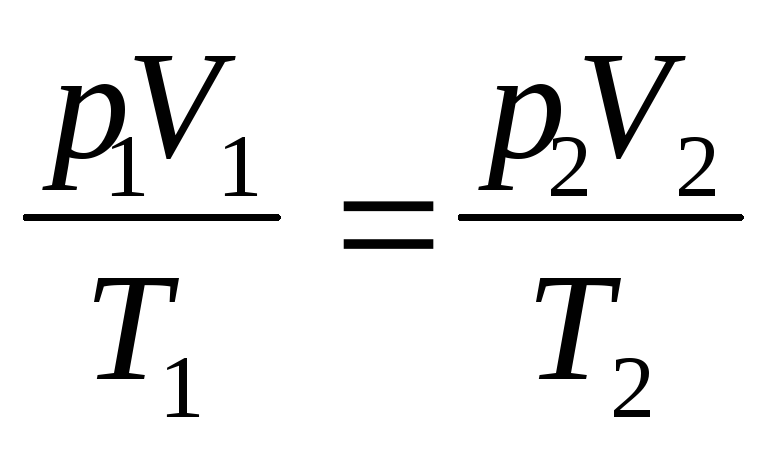
Под нормальными условиями понимают давление po=1 атм (1,01310 5 Па), температуру 0 о С (T=273 K).
Закон Дальтона, определяющий давление смеси n газов.
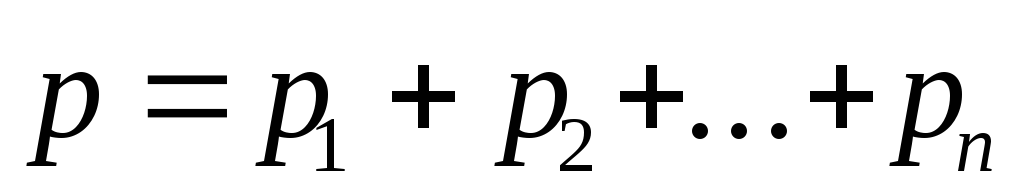
где pi — парциальные давления компонентов смеси (i=1,2,…,n). Парциальным давлением называется давление газа, которое производил бы этот газ, если бы только он один находился в сосуде, занятом смесью.
Молярная масса смеси n газов
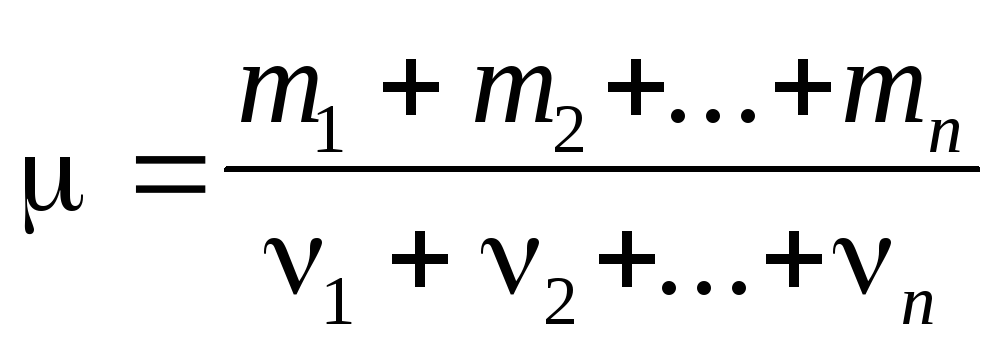
Массовая доля i-го компонента смеси газа (в долях единицы или процентах)
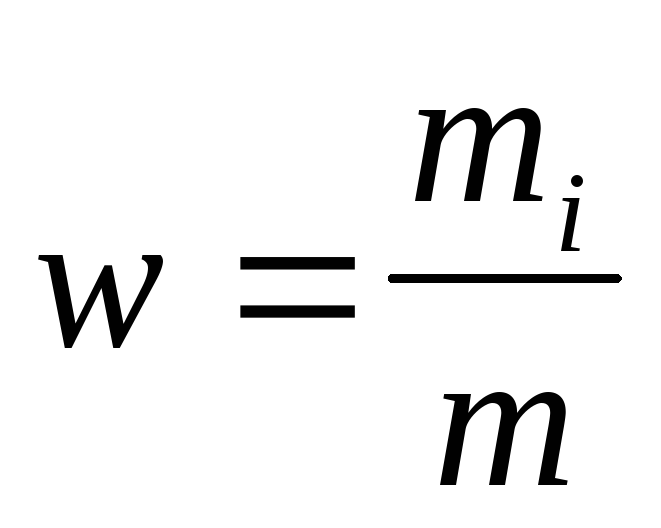
Концентрация молекул
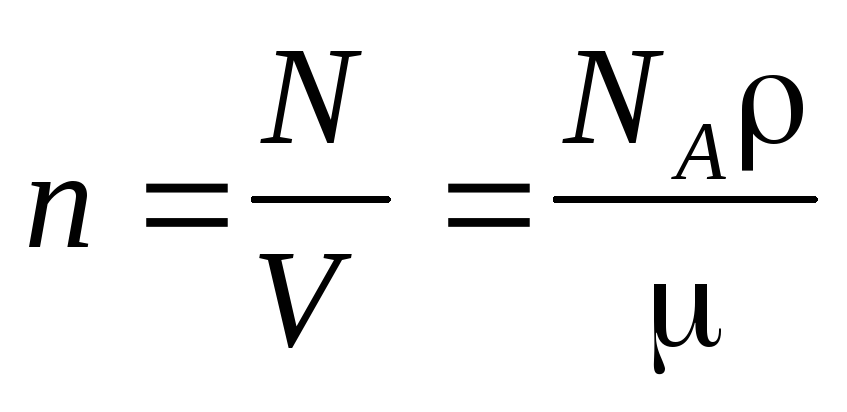
где N — число молекул, содержащихся в данной системе; — плотность вещества в системе; V — объем системы. Формула справедлива не только для газов, но и для любого агрегатного состояния вещества.
Уравнение Ван-дер-Ваальса для реального газа
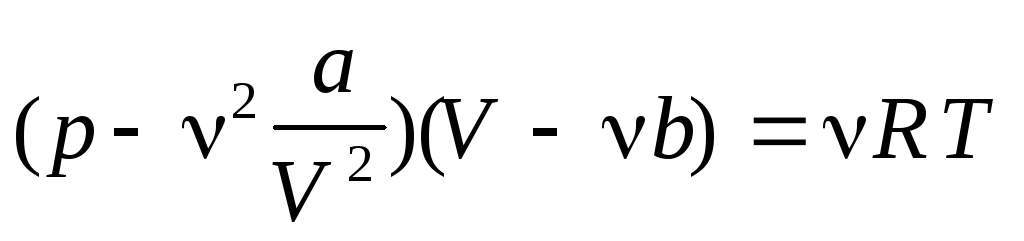
где a и b — коэффициенты Ван-дер-Ваальса
Для идеального газа уравнение Ван-дер-Ваальса переходит в уравнение Менделеева — Клапейрона.
Основное уравнение молекулярно — кинетической теории газов
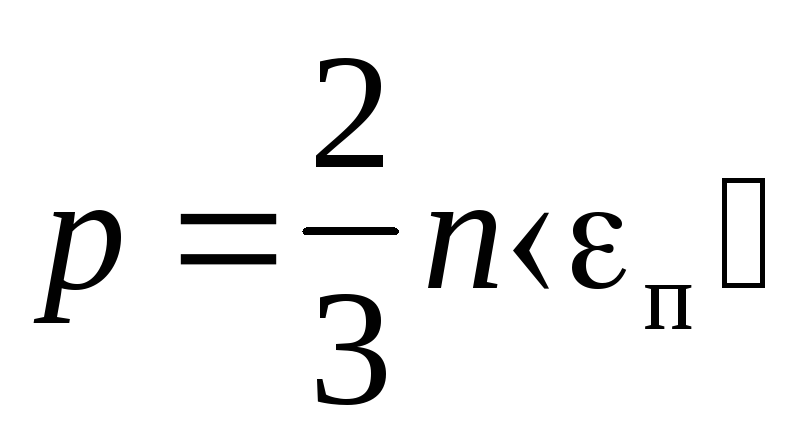
где п — средняя кинетическая энергия поступательного движения молекулы.
Средняя молекулярная масса представляет собой условную величину и относится к такому однородному газу, у которого число молекул и общая масса равны числу молекул и массе смеси газов.
Если известна величина газовой постоянной смеси, то
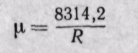
Заменяя газовые постоянные R1, R2, . Rn их значениями из уравнения Клапейрона, получаем выражение для средней молекулярной массы, если смесь задана массовыми долями:
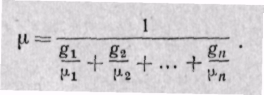
Если смесь задана объемными долями, то, как следует из уравнения (3-6),
Поскольку 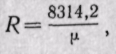
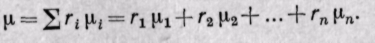
Средняя молекулярная масса смеси газов равна сумме произведений объемных долей на молекулярные массы отдельных газов, составляющих смесь.
Парциальные давления
Парциальное давление газа может быть определено через массовые доли из уравнения Клапейрона, если известны основные параметры газа:
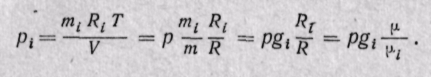
Для нахождения парциального давления каждого газа при задании смеси объемными долями можно воспользоваться законом Бойля — Мариотта, из которого следует, что при постоянной температуре
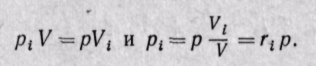
Парциальное давление каждого газа равно произведению общего давления смеси газов на его объемную долю.
Уравнением (3-11) обычно пользуются при технических расчетах и при испытаниях тепловых установок. Объемные доли газов определяют специальными аппаратами — газоанализаторами.
Удельная энтальпия, т. е. энтальпия, отнесенная к 1 кг, обозначается буквой i и представляет собой по определению сложную функцию вида
Дифференциал энтальпии di есть элементарное количество теплоты, участвующее в процессе при постоянном давлении. Вся теплота в процессе при постоянном давлении расходуется на изменение энтальпии:
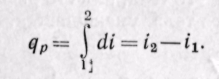
Из уравнения (5-12) следует, что
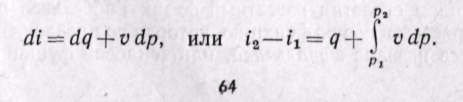
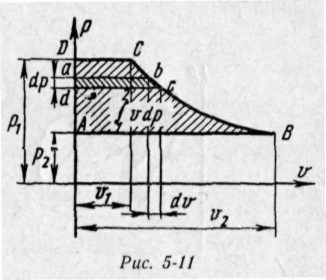
Энтальпия больше внешней теплоты на величину работы vdp, которая на рv-диаграмме изображается элементарной площадкой abed (рис. 5-11). Очевидно, вся пл. ABCD определяется выражением
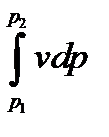
Изменение энтальпии полностью определяется начальным и конечным состоянием рабочего тела и не зависит от промежуточных состояний. Изменение энтальпии газа в циклах равно нулю, т. е.
Поскольку энтальпия является функцией основных параметров состояния, то di есть полный дифференциал этой функции при любых независимых переменных, характеризующих состояние 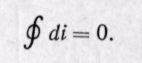
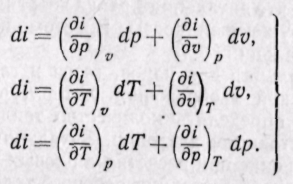
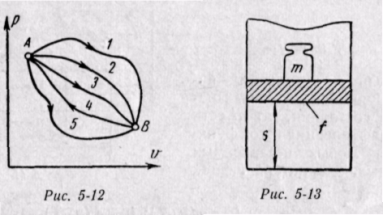
Изменение энтальпии во всех процессах, протекающих между двумя точками А и В, будет одинаковым (рис. 5-12).
Физический смысл энтальпии будет понятен из рассмотрения следующего примера. На перемещающийся поршень в цилиндре с 1 кг газа помещена гиря массой т кг (рис. 5-13). Площадь поршня /; внутренняя энергия рабочего тела и. Потенциальная энергия гири равна произведению массы гири т на высоту S. Так как давление газа р уравновешивается массой гири, то потенциальную энергию ее можно 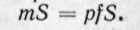
Произведение /S есть удельный объем газа. Отсюда
Произведение давления на объем есть работа, которую надо затратить, чтобы ввести газ объемом v во внешнюю среду с давлением р. Таким образом, работа pv есть потенциальная энергия газа, зависящая от сил, действующих на поршень. Чем больше эти внешние силы, тем больше давление р и тем больше потенциальная энергия давления pv.
Если рассматривать газ, находящийся в цилиндре и поршень с грузом как одну систему, которую будем называть расширенной системой, то полная энергия Е этой системы складывается из внутренней энергии газа и и потенциальной энергии поршня с грузом, равной pv:
Значения энтальпий для паров, газов и газовых смесей приводятся в технической и справочной литературе. Пользуясь этими данными, можно определять количество теплоты, участвующее в процессе при постоянном давлении. Энтальпия получила большое значение и применение при расчетах тепловых и холодильных установок и, как параметр состояния рабочего тела, значительно упрощает тепловые расчеты. Она позволяет [применять графические методы при исследовании всевозможных термодинамических процессов и циклов.
Энтальпией особенно целесообразно пользоваться тогда, когда в качестве основных параметров принимают р и Т. Это наглядно можно видеть, если энтальпию i сравнить с внутренней энергией и. При v = const уравнение первого закона термодинамики dq = = du + pdv превращается в dqv = du, или qv — u2—u1 а при р = const qp = i3 — i1.
Энтальпия идеального газа,’ так же как и внутренняя энергия, является функцией температуры и не зависит от других параметров. Действительно, для идеального газа
следовательно (поскольку оба слагаемых зависят только от температуры), i = f(T).
Тогда по аналогии с внутренней энергией будем иметь
т. е. в любом процессе изменения состояния идеального газа производная от изменения энтальпии по температуре будет полной производной.
Численные значения энтальпий идеальных газов приведены в приложении, табл. XIII.
Дата добавления: 2018-02-15 ; просмотров: 1423 ; ЗАКАЗАТЬ РАБОТУ
Электронное учебное пособие
Москва 2013
2. Ocновные понятия и законы химии. Атомно-молекулярное учение
2.10. Примеры решения задач
2.10.1. Расчет относительных и абсолютных масс атомов и молекул
Относительные массы атомов и молекул определяются с использованием приведенных в таблице Д.И. Менделеева величин атомных масс. При этом, при проведении расчетов для учебных целей значения атомных масс элементов обычно округляются до целых чисел (за исключением хлора, атомная масса которого принимается равной 35,5).
Пример 1. Относительная атомная масса кальция Аr(Са)=40; относительная атомная масса платины Аr(Pt)=195.
Относительная масса молекулы рассчитывается как сумма относительных атомных масс составляющих данную молекулу атомов с учетом количества их вещества.
Пример 2. Относительная молярная масса серной кислоты:
Величины абсолютных масс атомов и молекул находятся делением массы 1 моль вещества на число Авогадро.
Пример 3. Определите массу одного атома кальция.
Решение. Атомная масса кальция составляет Аr(Са)=40 г/моль. Масса одного атома кальция окажется равной:
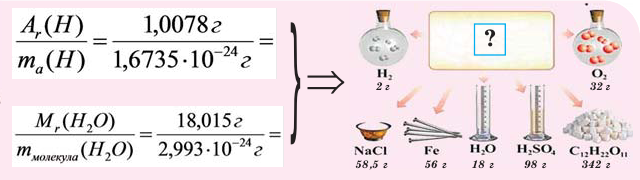
m(Ca)= Аr(Ca) : NA =40 : 6,02·10 23 = 6,64·10 -23 г.
Пример 4. Определите массу одной молекулы серной кислоты.
Решение. Молярная масса серной кислоты равна Мr(H2SO4) = 98. Масса одной молекулы m(H2SO4) равна:
2.10.2. Расчет количества вещества и вычисление числа атомных и молекулярных частиц по известным значениям массы и объема
Количество вещества определяется путем деления его массы, выраженной в граммах, на его атомную (молярную) массу. Количество вещества, находящегося в газообразном состоянии при н.у., находится делением его объема на объем 1 моль газа (22,4 л).
Пример 5. Определите количество вещества натрия n(Na), находящегося в 57,5 г металлического натрия.
Решение. Относительная атомная масса натрия равна Аr(Na)=23. Количество вещества находим делением массы металлического натрия на его атомную массу:
Пример 6 . Определите количество вещества азота, если его объем при н.у. составляет 5,6 л.
Решение. Количество вещества азота n(N 2) находим делением его объема на объем 1 моль газа (22,4 л):
Число атомов и молекул в веществе определяется умножением количества вещества атомов и молекул на число Авогадро.
Пример 7. Определите число молекул, содержащихся в 1 кг воды.
Решение. Количество вещества воды находим делением ее массы (1000 г) на молярную массу (18 г/моль):
Число молекул в 1000 г воды составит:
N(Н2О) = 55,5·6,02·10 23 = 3,34·10 24 .
Пример 8. Определите число атомов, содержащихся в 1 л (н.у.) кислорода.
Решение. Количество вещества кислорода, объем которого при нормальных условиях составляет 1 л равно:
n(О2) = 1 : 22,4 = 4,46·10 -2 моль.
Число молекул кислорода в 1 л (н.у.) составит:
N(О2) = 4,46·10 -2 · 6,02·10 23 = 2,69·10 22 .
Следует отметить, что 26,9·10 22 молекул будет содержаться в 1 л любого газа при н.у. Поскольку молекула кислорода двухатомна, число атомов кислорода в 1 л будет в 2 раза больше, т.е. 5,38·10 22 .
2.10.3. Расчет средней молярной массы газовой смеси и объемной доли
содержащихся в ней газов
Средняя молярная масса газовой смеси рассчитывается на основе молярных масс составляющих эту смесь газов и их объемных долей.
Пример 9. Полагая, что содержание (в объемных процентах) азота, кислорода и аргона в воздухе соответственно составляет 78, 21 и 1, рассчитайте среднюю молярную массу воздуха.
Решение.
Мвозд = 0,78·Мr(N2)+0,21·Мr (O2)+0,01·Мr(Ar)= 0,78·28+0,21·32+0,01·40 = 21,84+6,72+0,40=28,96
или приблизительно 29 г/моль.
Пример 10. Газовая смесь содержит 12 л NH3, 5 л N2 и 3 л Н2, измеренных при н.у. Рассчитать объемные доли газов в этой смеси и ее среднюю молярную массу.
Решение. Общий объем смеси газов равен V=12+5+3=20 л. Объемные доли j газов окажутся равными:
Средняя молярная масса рассчитывается на основе объемных долей составляющих эту смесь газов и их молекулярных масс:
М=0,6·М(NH3)+0,25·M(N2)+0,15·M(H2) = 0,6·17+0,25·28+0,15·2 = 17,5.
2.10.4. Расчет массовой доли химического элемента в химическом соединении
Массовая доля ω химического элемента определяется как отношение массы атома данного элемента Х, содержащегося в данной массе вещества к массе этого вещества m. Массовая доля – безразмерная величина. Ее выражают в долях от единицы:
ω(X) = m(X)/m (0 Пример 11. Рассчитайте массовую долю марганца в оксиде марганца (VII).
Решение. Молярные массы веществ равны: М(Mn) = 55 г/моль, М(О) = 16 г/моль, M(Mn2O7)=2М(Mn)+7М(О)= 222 г/моль. Следовательно, масса Mn2O7 количеством вещества 1 моль составляет:
Из формулы Mn2O7следует, что количество вещества атомов марганца в два раза больше количества вещества оксида марганца (VII). Значит,
m(Mn)= n(Mn)·M(Mn) = 2·55 = 110 г.
Таким образом, массовая доля марганца в оксиде марганца(VII) равна:
2.10.5. Установление формулы химического соединения по его элементному составу
Простейшая химическая формула вещества определяется на основании известных величин массовых долей входящих в состав этого вещества элементов.
Допустим имеется образец вещества NaxPyOz массой mo г. Рассмотрим как определяется его химическая формула, если известны количества вещества атомов элементов, их массы или массовые доли в известной массе вещества. Формула вещества определяется отношением:
x : y : z = N(Na) : N(P) : N(O).
Это отношение не изменится, если каждый его член разделить на число Авогадро:
Таким образом, для нахождения формулы вещества необходимо знать соотношение между количествами веществ атомов в одной и той же массе вещества:
Если разделить каждый член последнего уравнения на массу образца mo, то получим выражение, позволяющее определить состав вещества:
Пример 12. Вещество содержит 85,71 масс. % углерода и 14,29 масс. % водорода. Молярная его масса равна 28 г/моль. Определите простейшую и истинную химические формулы этого вещества.
Решение. Соотношение между количеством атомов в молекуле СхНу определяется делением массовых долей каждого элемента на его атомную массу:
х : у = 85,71/12 : 14,29/1 = 7,14:14,29 = 1 : 2.
Таким образом простейшая формула вещества — СН2. Простейшая формула вещества не всегда совпадает с его истинной формулой. В данном случае формула СН2 не соответствует валентности атома водорода. Для нахождения истинной химической формулы необходимо знать молярную массу данного вещества. В данном примере молярная масса вещества равна 28 г/моль. Разделив 28 на 14 (сумму атомных масс, отвечающих формульной единице СН2), получаем истинное соотношение между числом атомов в молекуле:
Получаем истинную формулу вещества: С2Н4— этилен.
Вместо молярной массы для газообразных веществ и паров в условии задачи может быть указана плотность по какому-либо газу или по воздуху.
В рассматриваемом случае плотность газа по воздуху составляет 0,9655. На основании этой величины может быть найдена молярная масса газа:
М = Мвозд·Dвозд = 29·0,9655 = 28.
В этом выражении М – молярная масса газа СхНу, Мвозд – средняя молярная масса воздуха, Dвозд — плотность газа СхНу по воздуху. Полученная величина молярной массы используется для определения истинной формулы вещества.
В условии задачи может не указываться массовая доля одного из элементов. Она находится вычитанием из единицы (100%) массовых долей всех остальных элементов.
Пример 13. Органическое соединение содержит 38,71 масс. % углерода, 51,61 масс. % кислорода и 9,68 масс. % водорода. Определить истинную формулу этого вещества, если плотность его паров по кислороду составляет 1,9375.
Решение. Рассчитываем соотношение между количеством атомов в молекуле СхНyОz:
х : у : z = 38,71/12 : 9,68/1 : 51,61/16 = 3,226 : 9,68 : 3,226= 1:3:1.
Молярная масса М вещества равна:
М = М(O2)·D(O2) = 32·1,9375 = 62.
Простейшая формула вещества СН3О. Сумма атомных масс для этой формульной единицы составит 12+3+16=31. Делим 62 на 31 и получаем истинное соотношение между количеством атомов в молекуле:
х : у : z = 2 : 6 : 2.
Таким образом, истинная формула вещества С2Н6О2. Эта формула отвечает составу двухатомного спирта – этиленгликоля: СН2(ОН)-СН2(ОН).
2.10.6. Определение молярной массы вещества
Молярная масса вещества может быть определена на основе величины плотности его паров по газу с известной величиной молярной массы.
Пример 14 . Плотность паров некоторого органического соединения по кислороду равна 1,8125. Определите молярную массу этого соединения.
Решение. Молярная масса неизвестного вещества Мx равна произведению относительной плотности этого вещества D на молярную массу вещества M, по которому определено значение относительной плотности:
Мx = D·M = 1,8125·32 = 58,0.
Веществами с найденным значением молярной массы могут быть ацетон, пропионовый альдегид и аллиловый спирт.
Молярная масса газа может быть рассчитана с использованием величины молярного его объема при н.у.
Пример 15. Масса 5,6 л газа при н.у. составляет 5,046 г. Рассчитайте молярную массу этого газа.
Решение. Молярный объем газа при н.у равен 22,4 л. Следовательно, молярная масса искомого газа равна
М = 5,046·22,4/5,6 = 20,18.
Искомый газ – неон Ne.
Уравнение Клапейрона–Менделеева используется для расчета молярной массы газа, объем которого задан при условиях, отличающихся от нормальных.
Пример 16. При температуре 40 о С и давлении 200 кПа масса 3,0 л газа составляет 6,0 г. Определите молярную массу этого газа.
Решение. Подставляя известные величины в уравнение Клапейрона–Менделеева получаем:
М = mRT/PV = 6,0·8,31·313/(200·3,0)= 26,0.
Рассматриваемый газ – ацетилен С2Н2.
Пример 17. При сгорании 5,6 л (н.у.) углеводорода получено 44,0 г углекислого газа и 22,5 г воды. Относительная плотность углеводорода по кислороду равна 1,8125. Определите истинную химическую формулу углеводорода.
Решение. Уравнение реакции сгорания углеводорода можно представить следующим образом:
Количество углеводорода составляет 5,6:22,4=0,25 моль. В результате реакции образуется 1 моль углекислого газа и 1,25 моль воды, которая содержит 2,5 моль атомов водорода. При сжигании углеводорода количеством вещества 1 моль получается 4 моль углекислого газа и 5 моль воды. Таким образом, 1 моль углеводорода содержит 4 моль атомов углерода и 10 моль атомов водорода, т.е. химическая формула углеводорода С4Н10. Молярная масса этого углеводорода равна М=4·12+10=58. Его относительная плотность по кислороду D=58:32=1,8125 соответствует величине, приведенной в условии задачи, что подтверждает правильность найденной химической формулы.



© Факультет естественных наук РХТУ им. Д.И. Менделеева. 2013 г.
- Как найти среднюю молярную массу смеси газов
-
ВВЕДЕНИЕ В ОБЩУЮ ХИМИЮ
- 2. Ocновные понятия и законы химии. Атомно-молекулярное учение
- 1.5. Смеси газов
Как найти среднюю молярную массу смеси газов
РАЗДЕЛ И. ОБЩАЯ ХИМИЯ
Примеры решения типовых задач
V. Определение средней молярной массы смеси газов
Формулы и понятия, которые используются:
где М(смеси) – средняя молярная масса смеси газов,
М(А), М(Б), М(В) – молярные массы компонентов смеси А, Б и В,
χ(А), χ(B), χ(В) – мольные доли компонентов смеси А, Б и В,
φ(А), φ(B), φ(В) – объемные доли компонентов смеси А, Б и В,
М(пов.) – молярная масса воздуха, г/моль,
М r (пов.) – относительная молекулярная масса воздуха.
Задача 23. Вычислите молярну массу смеси, в которой объемные доли метана и бутана соответственно составляют 85 и 15%.
Молярная масса смеси – это масса всех ее составляющих, взятых в суммарном количестве вещества смеси 1 моль (М(СН 4 ) = 16 г/моль, М(С4Н10) = 58 г/моль). Вычислить среднюю молярну массу смеси можно по формуле:
Ответ: М(смеси) = 22 , 3 г/моль.
Задача 24. Определите плотность газовой смеси с азотом, в которой объемные доли карбон(И V ) оксида, сульфур(И V ) оксида и карбон(II) оксида соответственно составляют 35,25 и 40 %.
1. Вычислим молярну массу смеси (М(С O 2 ) = 44 г/моль, M ( SO 2 ) = 64 г/моль, М(СО) = 28 г/моль):
2. Вычислим относительную плотность смеси с азотом:
Ответ: DN2 (смеси) = 1,52.
Задача 25. Плотность смеси ацетилена и бутену за гелием равна 11. Определите объемную долю ацетилена в смеси.
1. По формуле определим молярну массу смеси (М(Не) = 4 г/моль):
2. Предположим, что мы имеем 1 моль смеси. В ней содержится х моль С2Н2, тогда в соответствии
3. Запишем выражение для вычисления средней молярной массы газовой смеси:
Подставим все известные данные: М(С2Н2) = 26 г/моль, М(С4Н8) = 56 г/моль:
4. Следовательно, 1 моль смеси содержит 0,4 моль С2Н2. Вычислим мольну долю χ(С2Н2):
Для газов φ(Х) = χ(Х). Следовательно, φ(С2Н4) = 40 %.
Как найти среднюю молярную массу смеси газов
Определения средней молярной массы смеси газов – Примеры решения типовых задач – Основные химические понятия. Вещество – ОБЩАЯ ХИМИЯ – ХИМИЯ – Комплексная подготовка к внешнему независимому тестированию По действующей программе ВНО – предназначен для подготовки к внешнему независимому оцениванию. Он содержит теоретический материал, представленный в соответствии с действующей программой по химии для общеобразовательных школ и программы ВНО; примеры решения типовых задач; тематические тестовые задания.
Источник: na-uroke.in.ua
ВВЕДЕНИЕ В ОБЩУЮ ХИМИЮ
Электронное учебное пособие
Москва 2013
2. Ocновные понятия и законы химии. Атомно-молекулярное учение
2.10. Примеры решения задач
2.10.1. Расчет относительных и абсолютных масс атомов и молекул
Относительные массы атомов и молекул определяются с использованием приведенных в таблице Д.И. Менделеева величин атомных масс. При этом, при проведении расчетов для учебных целей значения атомных масс элементов обычно округляются до целых чисел (за исключением хлора, атомная масса которого принимается равной 35,5).
Пример 1. Относительная атомная масса кальция Аr(Са)=40; относительная атомная масса платины Аr(Pt)=195.
Относительная масса молекулы рассчитывается как сумма относительных атомных масс составляющих данную молекулу атомов с учетом количества их вещества.
Пример 2. Относительная молярная масса серной кислоты:
Величины абсолютных масс атомов и молекул находятся делением массы 1 моль вещества на число Авогадро.
Пример 3. Определите массу одного атома кальция.
Решение. Атомная масса кальция составляет Аr(Са)=40 г/моль. Масса одного атома кальция окажется равной:
m(Ca)= Аr(Ca) : NA =40 : 6,02·10 23 = 6,64·10 -23 г.
Пример 4. Определите массу одной молекулы серной кислоты.
Решение. Молярная масса серной кислоты равна Мr(H2SO4) = 98. Масса одной молекулы m(H2SO4) равна:
2.10.2. Расчет количества вещества и вычисление числа атомных и молекулярных частиц по известным значениям массы и объема
Количество вещества определяется путем деления его массы, выраженной в граммах, на его атомную (молярную) массу. Количество вещества, находящегося в газообразном состоянии при н.у., находится делением его объема на объем 1 моль газа (22,4 л).
Пример 5. Определите количество вещества натрия n(Na), находящегося в 57,5 г металлического натрия.
Решение. Относительная атомная масса натрия равна Аr(Na)=23. Количество вещества находим делением массы металлического натрия на его атомную массу:
Пример 6 . Определите количество вещества азота, если его объем при н.у. составляет 5,6 л.
Решение. Количество вещества азота n(N 2) находим делением его объема на объем 1 моль газа (22,4 л):
Число атомов и молекул в веществе определяется умножением количества вещества атомов и молекул на число Авогадро.
Пример 7. Определите число молекул, содержащихся в 1 кг воды.
Решение. Количество вещества воды находим делением ее массы (1000 г) на молярную массу (18 г/моль):
Число молекул в 1000 г воды составит:
N(Н2О) = 55,5·6,02·10 23 = 3,34·10 24 .
Пример 8. Определите число атомов, содержащихся в 1 л (н.у.) кислорода.
Решение. Количество вещества кислорода, объем которого при нормальных условиях составляет 1 л равно:
n(О2) = 1 : 22,4 = 4,46·10 -2 моль.
Число молекул кислорода в 1 л (н.у.) составит:
N(О2) = 4,46·10 -2 · 6,02·10 23 = 2,69·10 22 .
Следует отметить, что 26,9·10 22 молекул будет содержаться в 1 л любого газа при н.у. Поскольку молекула кислорода двухатомна, число атомов кислорода в 1 л будет в 2 раза больше, т.е. 5,38·10 22 .
2.10.3. Расчет средней молярной массы газовой смеси и объемной доли
содержащихся в ней газов
Средняя молярная масса газовой смеси рассчитывается на основе молярных масс составляющих эту смесь газов и их объемных долей.
Пример 9. Полагая, что содержание (в объемных процентах) азота, кислорода и аргона в воздухе соответственно составляет 78, 21 и 1, рассчитайте среднюю молярную массу воздуха.
Решение.
Мвозд = 0,78·Мr(N2)+0,21·Мr (O2)+0,01·Мr(Ar)= 0,78·28+0,21·32+0,01·40 = 21,84+6,72+0,40=28,96
или приблизительно 29 г/моль.
Пример 10. Газовая смесь содержит 12 л NH3, 5 л N2 и 3 л Н2, измеренных при н.у. Рассчитать объемные доли газов в этой смеси и ее среднюю молярную массу.
Решение. Общий объем смеси газов равен V=12+5+3=20 л. Объемные доли j газов окажутся равными:
Средняя молярная масса рассчитывается на основе объемных долей составляющих эту смесь газов и их молекулярных масс:
М=0,6·М(NH3)+0,25·M(N2)+0,15·M(H2) = 0,6·17+0,25·28+0,15·2 = 17,5.
2.10.4. Расчет массовой доли химического элемента в химическом соединении
Массовая доля ω химического элемента определяется как отношение массы атома данного элемента Х, содержащегося в данной массе вещества к массе этого вещества m. Массовая доля – безразмерная величина. Ее выражают в долях от единицы:
ω(X) = m(X)/m (0 о С и давлении 200 кПа масса 3,0 л газа составляет 6,0 г. Определите молярную массу этого газа.
Решение. Подставляя известные величины в уравнение Клапейрона–Менделеева получаем:
М = mRT/PV = 6,0·8,31·313/(200·3,0)= 26,0.
Рассматриваемый газ – ацетилен С2Н2.
Пример 17. При сгорании 5,6 л (н.у.) углеводорода получено 44,0 г углекислого газа и 22,5 г воды. Относительная плотность углеводорода по кислороду равна 1,8125. Определите истинную химическую формулу углеводорода.
Решение. Уравнение реакции сгорания углеводорода можно представить следующим образом:
Количество углеводорода составляет 5,6:22,4=0,25 моль. В результате реакции образуется 1 моль углекислого газа и 1,25 моль воды, которая содержит 2,5 моль атомов водорода. При сжигании углеводорода количеством вещества 1 моль получается 4 моль углекислого газа и 5 моль воды. Таким образом, 1 моль углеводорода содержит 4 моль атомов углерода и 10 моль атомов водорода, т.е. химическая формула углеводорода С4Н10. Молярная масса этого углеводорода равна М=4·12+10=58. Его относительная плотность по кислороду D=58:32=1,8125 соответствует величине, приведенной в условии задачи, что подтверждает правильность найденной химической формулы.
ВВЕДЕНИЕ В ОБЩУЮ ХИМИЮ
ВВЕДЕНИЕ В ОБЩУЮ ХИМИЮ Электронное учебное пособие Москва 2013 2. Ocновные понятия и законы химии. Атомно-молекулярное учение 2.10. Примеры решения задач 2.10.1. Расчет относительных
Источник: onx.distant.ru
Если идеальные газы находятся в сообщающихся баллонах, разделенных краном, то при открытии крана газы в баллонах смешиваются между собой и каждый из них заполняет объем обоих баллонов.
Для идеального газа (или двух разных газов), находящегося в сообщающихся баллонах , при открытии крана некоторые параметры становятся одинаковыми:
- давление газа (или смеси газов) после открытия крана уравнивается:
- газ (или смесь газов) после открытия крана занимает весь предоставленный ему объем, т.е. объем обоих сосудов:
где V 1 — объем первого баллона; V 2 — объем второго баллона;
- температура газа (или смеси газов) после открытия крана уравнивается:
- плотность газа ρ и его концентрация n в обоих баллонах становятся одинаковыми:
ρ = const, n = const,
Если баллоны имеют одинаковый объем , то массы газа (или смеси газов) в каждом баллоне после открытия крана становятся одинаковыми :
m ′ 1 = m ′ 2 = m ′ = m 1 + m 2 2 ,
где m ′ 1 — масса газа (или смеси газов) в первом баллоне после открытия крана; m ′ 2 — масса газа (или смеси газов) во втором баллоне после открытия крана; m ′ — масса газа (или смеси газов) в каждом баллоне после открытия крана; m 1 — масса газа в первом баллоне до открытия крана; m 2 — масса газа во втором баллоне до открытия крана.
Масса газа, перешедшего из одного сосуда в другой в результате открытия крана, определяется следующими выражениями:
- изменение массы газа в первом баллоне
Δ m 1 = | m ′ 1 − m 1 | = | m 1 + m 2 2 − m 1 | = | m 2 − m 1 | 2 ;
- изменение массы газа во втором баллоне
Δ m 2 = | m ′ 2 − m 2 | = | m 1 + m 2 2 − m 2 | = | m 1 − m 2 | 2 .
Изменения массы газа (или смеси газов) в обоих баллонах одинаковы :
Δ m 1 = Δ m 2 = Δ m = | m 2 − m 1 | 2 ,
т.е. сколько газа ушло из баллона с большей массой газа — столько же газа пришло в баллон с меньшей массой.
Если баллоны имеют одинаковый объем , то количества газа (или смеси газов) в каждом баллоне после открытия крана становятся одинаковыми :
ν ′ 1 = ν ′ 2 = ν ′ = ν 1 + ν 2 2 ,
где ν ′ 1 — количество газа (или смеси газов) в первом баллоне после открытия крана; ν ′ 2 — количество газа (или смеси газов) во втором баллоне после открытия крана; ν′ — количество газа (или смеси газов) в каждом баллоне после открытия крана; ν1 — количество газа в первом баллоне до открытия крана; ν2 — количество газа во втором баллоне до открытия крана.
Количество газа, перешедшего из одного сосуда в другой в результате открытия крана, определяется следующими выражениями:
- изменение количества газа в первом баллоне
Δ ν 1 = | ν ′ 1 − ν 1 | = | ν 1 + ν 2 2 − ν 1 | = | ν 2 − ν 1 | 2 ;
- изменение количества газа во втором баллоне
Δ ν 2 = | ν ′ 2 − ν 2 | = | ν 1 + ν 2 2 − ν 2 | = | ν 1 − ν 2 | 2 .
Изменения количества газа (или смеси газов) в обоих баллонах одинаковы :
Δ ν 1 = Δ ν 2 = Δ ν = | ν 2 − ν 1 | 2 ,
т.е. сколько газа ушло из баллона с большим количеством газа — столько же газа пришло в баллон с меньшим количеством.
Для идеального газа (или двух разных газов), находящегося в сообщающихся баллонах, при открытии крана давление становится одинаковым:
и определяется по закону Дальтона (для смеси газов) —
где p 1, p 2 — парциальные давления компонентов смеси.
Парциальные давления компонентов смеси могут быть рассчитаны следующим образом:
- с помощью уравнения Менделеева — Клапейрона; тогда давление определяется формулой
p = ( ν 1 + ν 2 ) R T V 1 + V 2 ,
где ν1 — количество вещества первого компонента смеси; ν2 — количество вещества второго компонента смеси; R — универсальная газовая постоянная, R ≈ 8,31 Дж/(моль ⋅ К); T — температура смеси; V 1 — объем первого баллона; V 2 — объем второго баллона;
- с помощью основного уравнения молекулярно-кинетической теории; тогда давление определяется формулой
p = ( N 1 + N 2 ) k T V 1 + V 2 ,
где N 1 — количество молекул первого компонента смеси; N 2 — количество молекул второго компонента смеси; k — постоянная Больцмана, k = 1,38 ⋅ 10 −23 Дж/К.
Пример 26. Определить среднюю молярную массу смеси газов, состоящей из 3,0 кг водорода, 1,0 кг гелия и 8,0 кг кислорода. Молярные массы водорода, гелия и кислорода равны 2,0, 4,0 и 32 г/моль соответственно.
Решение . Средняя молярная масса смеси определяется формулой
где m — масса смеси; ν — количество вещества в смеси.
Массу смеси найдем как сумму масс —
где m 1 — масса водорода; m 2 — масса гелия; m 3 — масса кислорода.
Аналогично найдем количество вещества —
где ν1 — количество водорода в смеси, ν1 = m 1/ M 1; M 1 — молярная масса водорода; ν2 — количество гелия в смеси, ν2 = m 2/ M 2; M 2 — молярная масса гелия; ν3 — количество кислорода в смеси, ν3 = m 3/ M 3; M 3 — молярная масса кислорода.
Подстановка выражений для массы и количества вещества в исходную формулу дает
〈 M 〉 = m 1 + m 2 + m 3 ν 1 + ν 2 + ν 3 = m 1 + m 2 + m 3 m 1 M 1 + m 2 M 2 + m 3 M 3 .
〈 M 〉 = 3,0 + 1,0 + 8,0 3,0 2,0 ⋅ 10 − 3 + 1,0 4,0 ⋅ 10 − 3 + 8,0 32 ⋅ 10 − 3 =
= 6,0 ⋅ 10 − 3 кг/моль = 6,0 г/моль .
Пример 27. Плотность смеси газов, состоящей из гелия и водорода, при давлении 3,50 МПа и температуре 300 К, равна 4,50 кг/м 3 . Определить массу гелия в 4,00 м 3 смеси. Молярные массы водорода и гелия равны 0,002 и 0,004 кг/моль соответственно.
Решение . Чтобы найти массу гелия m 2 в указанном объеме, необходимо определить плотность гелия в смеси:
где ρ 2 — плотность гелия; V — объем смеси газов.
Плотность смеси определяется как сумма плотностей водорода и гелия:
где ρ1 — плотность водорода.
Однако записанная формула содержит две неизвестные величины — плотности водорода и гелия. Для определения указанных величин требуется еще одно уравнение, в которое входят плотности водорода и гелия.
Запишем закон Дальтона для давления смеси газов:
где p 1 — давление водорода; p 2 — давление гелия.
Для определения давлений газов запишем уравнение состояния в следующей форме:
p 1 = ρ 1 R T M 1 ,
p 2 = ρ 2 R T M 2 ,
где R — универсальная газовая постоянная, R ≈ 8,31 Дж/(моль ⋅ К); T — температура смеси; M 1 — молярная масса водорода; M 2 — молярная масса гелия.
Подстановка выражений для давлений водорода и гелия в закон Дальтона дает
p = ρ 1 R T M 1 + ρ 2 R T M 2 .
Получено еще одно уравнение с двумя неизвестными величинами — плотностью водорода и плотностью гелия.
Формулы для расчета плотности и давления смеси образуют систему уравнений:
ρ = ρ 1 + ρ 2 , p = ρ 1 R T M 1 + ρ 2 R T M 2 , >
которую требуется решить относительно плотности гелия.
Для этого выразим плотности водорода из первого и второго уравнений
ρ 1 = ρ − ρ 2 , ρ 1 = M 1 R T ( p − ρ 2 R T M 2 ) >
и приравняем их правые части:
ρ − ρ 2 = M 1 R T ( p − ρ 2 R T M 2 ) .
ρ 2 = M 2 M 2 − M 1 ( ρ − p M 1 R T ) .
Подставим полученное выражение в формулу для вычисления массы гелия
m 2 = M 2 V M 2 − M 1 ( ρ − p M 1 R T )
и произведем расчет:
m 2 = 0,004 ⋅ 4,00 0,004 − 0,002 ( 4,50 − 3,50 ⋅ 10 6 0,002 8,31 ⋅ 300 ) ≈ 13,6 кг.
Масса гелия в указанном объеме смеси составляет 13,6 кг.
Как найти среднюю молярную массу смеси газов
Если идеальные газы находятся в сообщающихся баллонах, разделенных краном, то при открытии крана газы в баллонах смешиваются между собой и каждый из них заполняет объем обоих баллонов. Для
Источник: vedy.by
- Главная   /  ТеплотехникаТехническая термодинамика
- Расчет смеси газов
Задача 229
Условие: Произвести расчет термодинамических параметров газовой смеси, совершающей изобарное расширение до объема V2 , если известны начальная температура t1=50ºC, начальное давление р1=3 МПа и масса Мсм=4 кг. Определить газовую постоянную и кажущуюся молекулярную массу, начальный объем V1 , основные параметры в конечном состоянии, изменение внутренней энергии, энтальпии, энтропии, теплоту и работу расширения в процессе 1-2. При определении молярной массы и газовой постоянной обратить внимание на способ задания смеси. Теплоемкость компонентов смеси рассчитать с использованием закона Майера. Для расчета параметров состояния использовать уравнения состояния идеальных газов. — Правильность вычисления энергетических параметров контролировать по выполнению 1 закона термодинамики. Состав газовой смеси по объему: Cp=96, 06%; C2p=2, 0%; C3H8=0, 3%; C4h20=0, 01%; C5h22=0, 1%; N2=1, 0%; CO2=0, 1%; h3O = 0, 43%; ρ=V2/V1=3, 5.
Условие: По заданному составу газовой смеси расчитать: кажущуюся (среднюю) молекулярную массу смеси, газовую постоянную, плотность, среднюю массовую теплоемкость смеси при постоянном давлении в пределах температур от t1=100ºC до t2=835ºC ,колличество тепла,полученное газовой смесью при её нагревании от t1=100ºC до t2=835ºC. Массовая доля азота — 0,6; воды — 0,2; углекислого газа — 0,2. Обьем смеси V =300 м3, давление — р1=3 бар.
Задача 111
Условие: Произвести расчет термодинамических параметров газовой смеси, совершающей изобарное расширение до объема V2 , если известны начальная температура t1=70ºC, начальное давление р1=5 МПа и масса Мсм=2 кг. Определить газовую постоянную и кажущуюся молекулярную массу, начальный объем V1 , основные параметры в конечном состоянии, изменение внутренней энергии, энтальпии, энтропии, теплоту и работу расширения в процессе 1-2.- При определении молярной массы и газовой постоянной обратить внимание на способ задания смеси. — Теплоемкость компонентов смеси рассчитать с использованием закона Майера.- Для расчета параметров состояния использовать уравнения состояния идеальных газов.- Правильность вычисления энергетических параметров контролировать по выполнению 1 закона термодинамики. Состав газовой смеси по объему: Cp=94, 2%; C2p=3, 0%; C3H8=0, 9%; C4h20=0, 17%;
C5h22=0, 22%; N2=0, 9%; CO2=0, 3%; h3O = 0, 31%; ρ=V2/V1=3, 5.
Как найти среднюю молярную массу смеси газов
Главная   /  ТеплотехникаТехническая термодинамика Расчет смеси газов Задача 229 Условие: Произвести расчет термодинамических параметров газовой смеси,
Источник: x-term.ru
1.5. Смеси газов
Возникает естественный вопрос: какими уравнениями описываются смеси идеальных газов? Ведь с чистыми газами нам редко приходится встречаться в природе. Например, наша естественная среда обитания — воздух — состоит из азота N2 (78,08 %), кислорода O2 (20,95 %), инертных газов (0,94 %), углекислого газа СO2 (0,03 %).
Пусть в некотором объеме V при некоторой температуре Т содержится смесь газов (которые мы будем нумеровать
индексом i ). Роль каждого компонента смеси будем характеризовать массовой долей:
где mi — масса i-го компонента. Наша задача — написать уравнение, подобное уравнению Клапейрона — Менделеева, и разобраться с эффективным числом степеней свободы смеси, где могут содержаться и одноатомные, и многоатомные молекулы.
Прежде всего, заметим, что мы рассматриваем идеальные газы. Молекулы не взаимодействуют друг с другом, и потому каждый компонент не мешает любому другому «жить» в том же общем сосуде. Различные газы в сосуде, в силу их предполагаемой идеальности, просто «не замечают» друг друга. Поэтому для каждого из компонентов справедливо одно и то же уравнение Клапейрона — Менделеева:
где ni — число молей вещества в i -м компоненте. Полное число n молей в смеси равно сумме числа молей ni в каждом из компонентов:
Аналогично, полная масса смеси равна сумме масс каждого из компонентов
и естественно определить молярную массу смеси m как массу одного моля смеси:
Введем величину, называемую парциальным давлением.
Парциальное давление pi — это давление, оказываемое i-м компонентом газовой смеси.
Имеет место закон Дальтона для газовой смеси:
Полное давление газовой смеси равно сумме всех парциальных давлений
Как найти среднюю молярную массу смеси газов
1.5. Смеси газов Возникает естественный вопрос: какими уравнениями описываются смеси идеальных газов? Ведь с чистыми газами нам редко приходится встречаться в природе. Например, наша естественная
Источник: online.mephi.ru