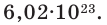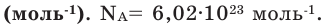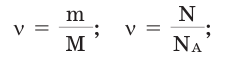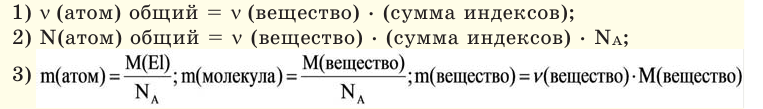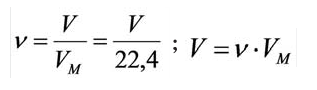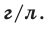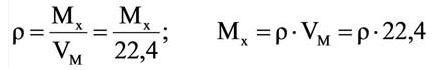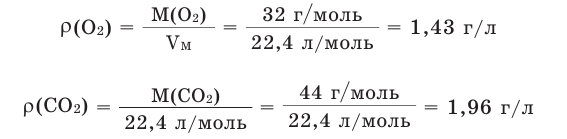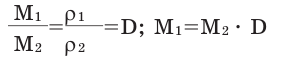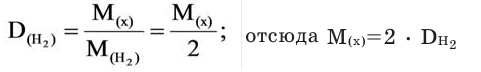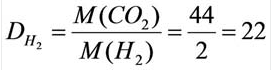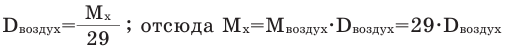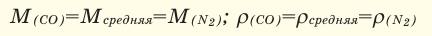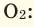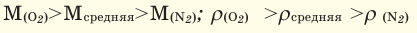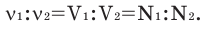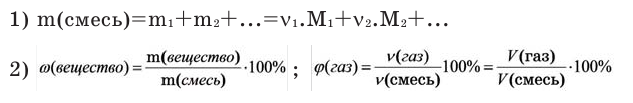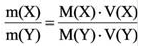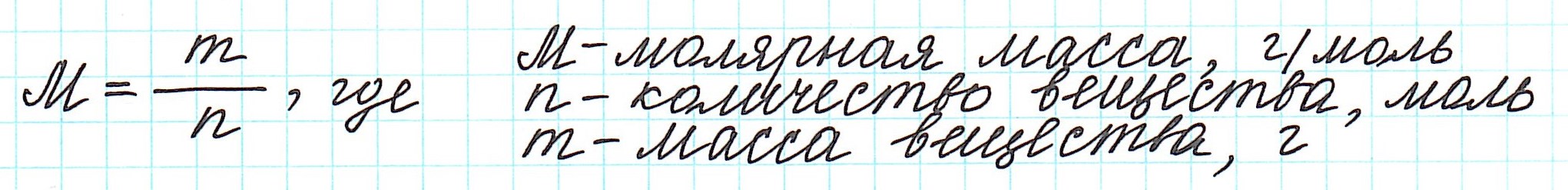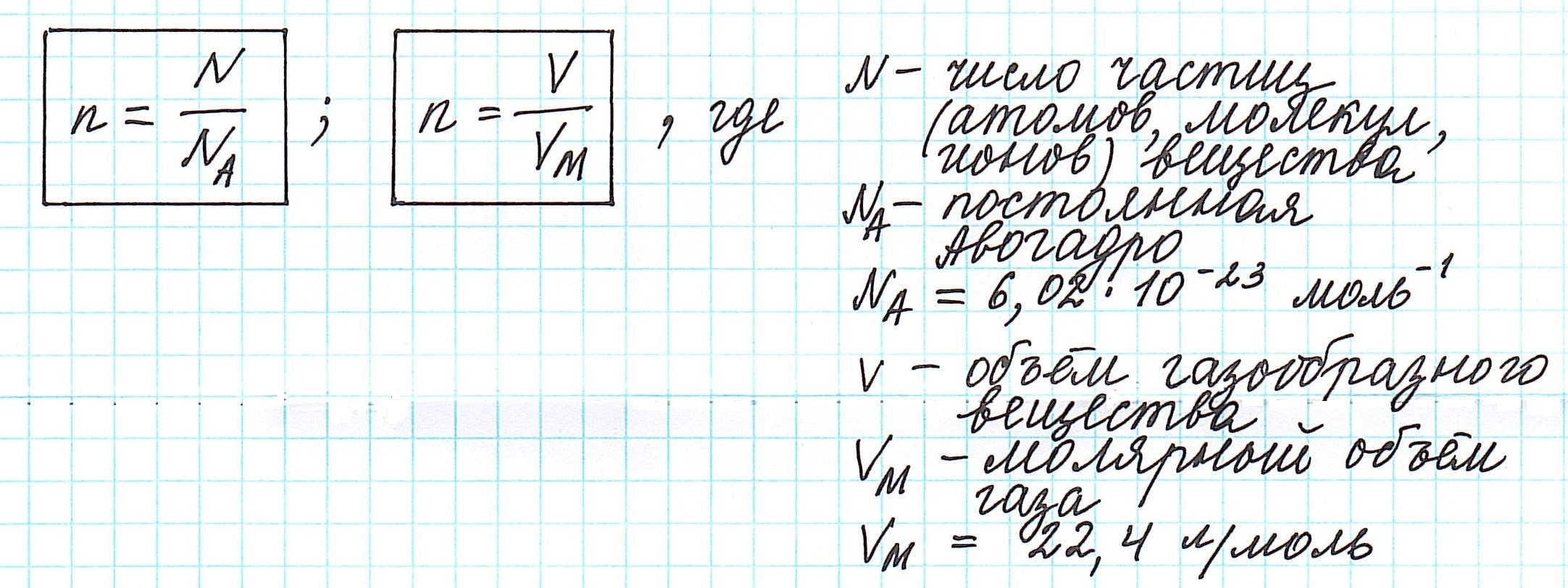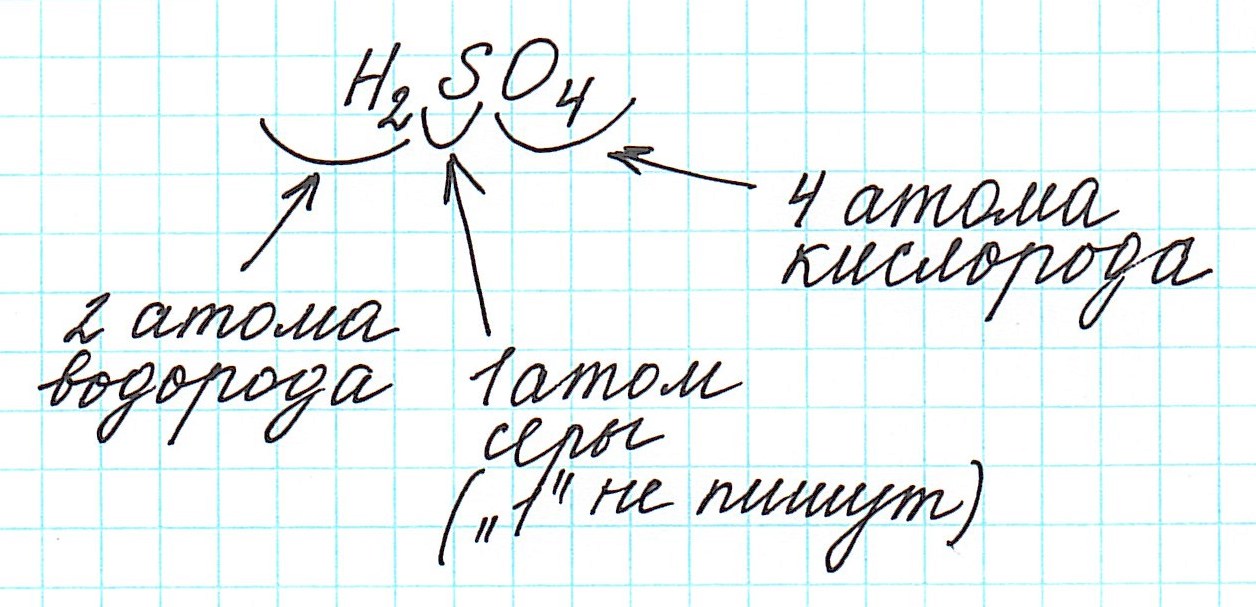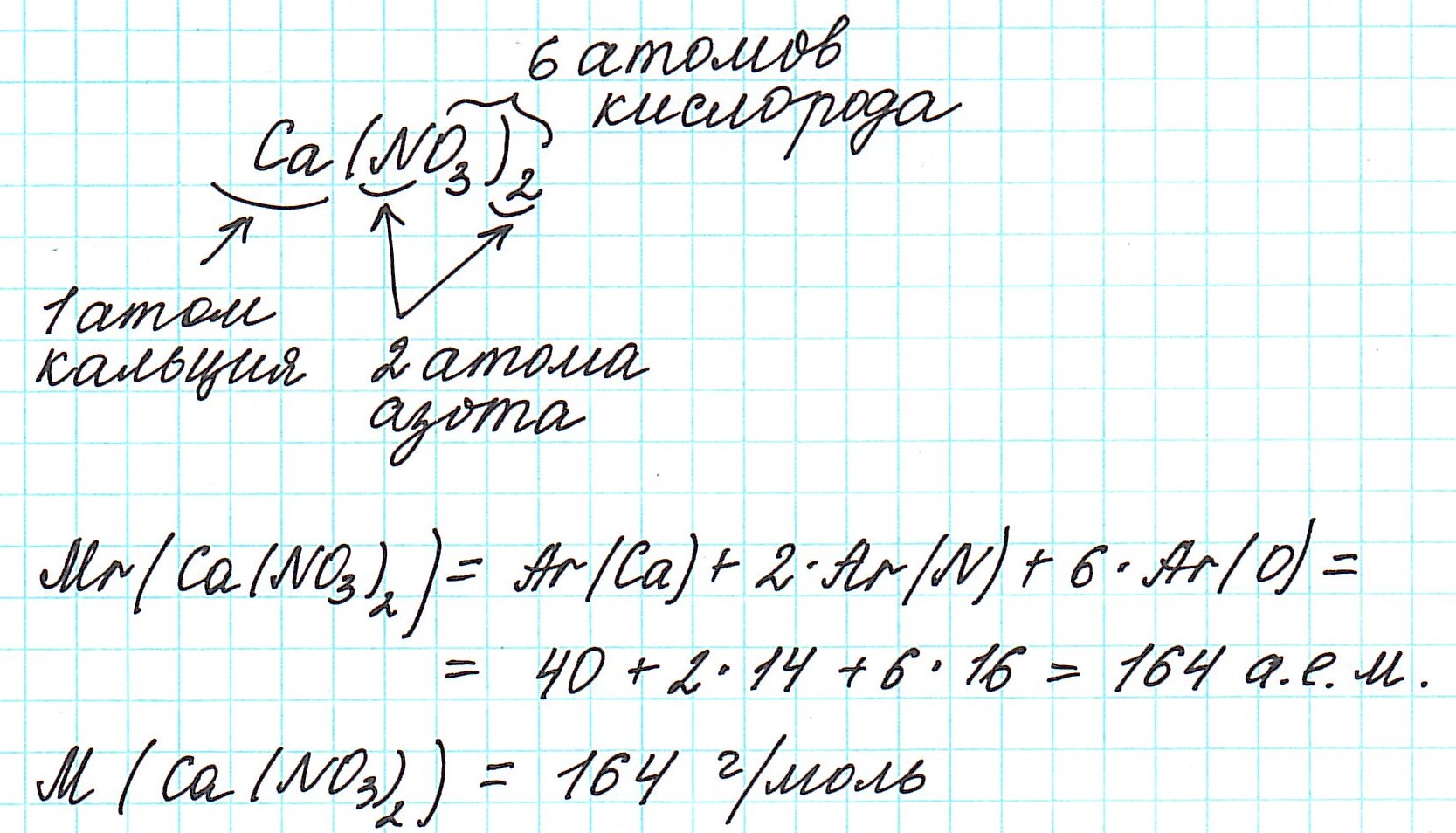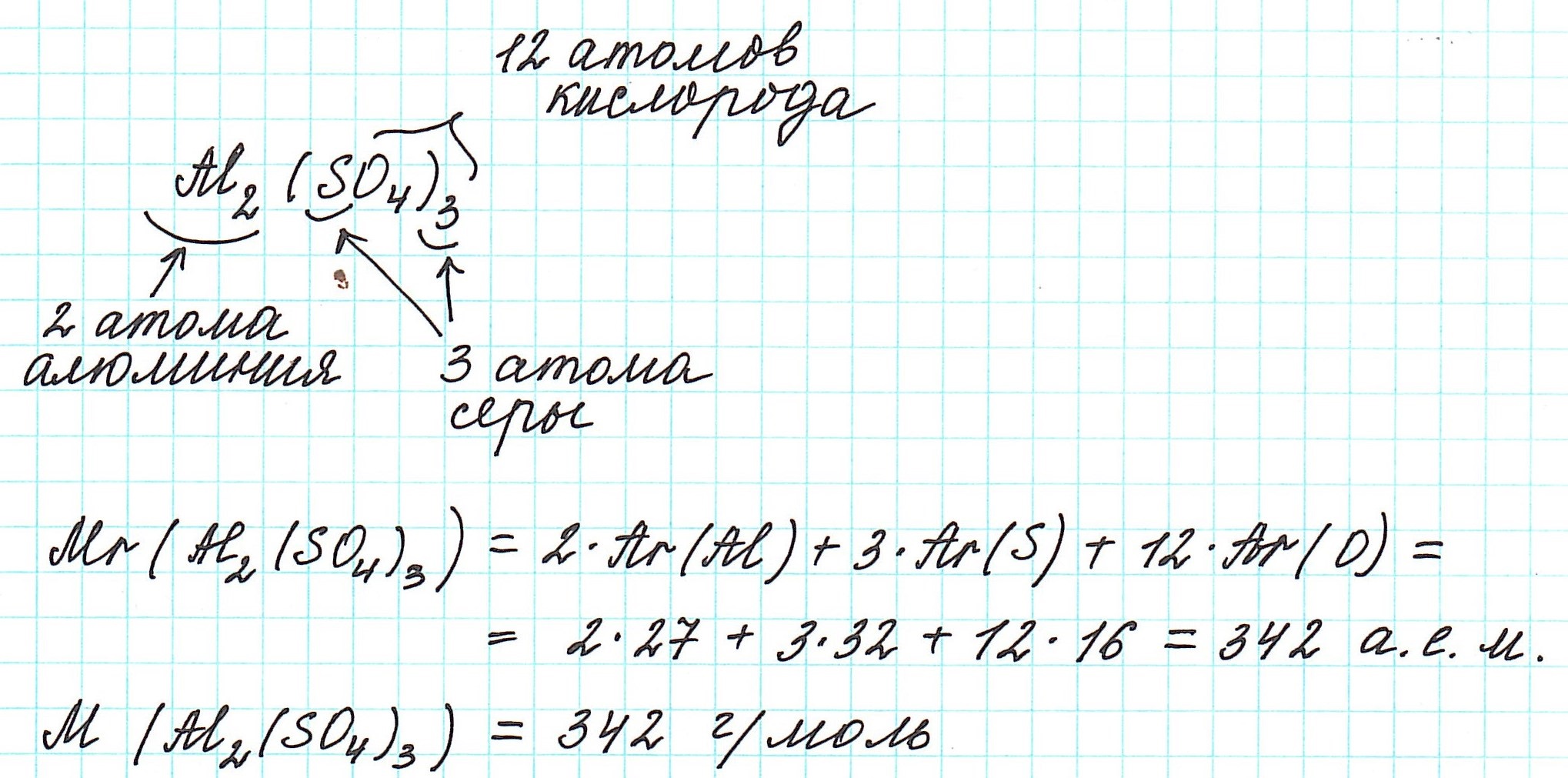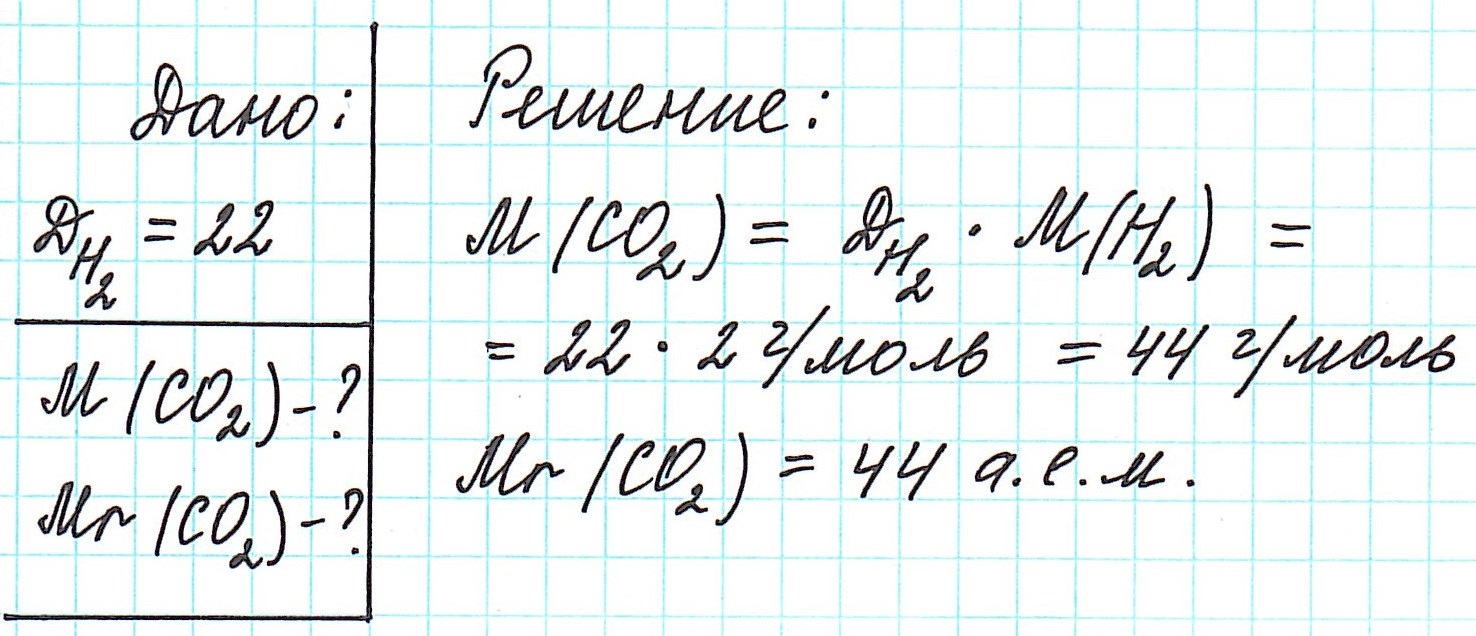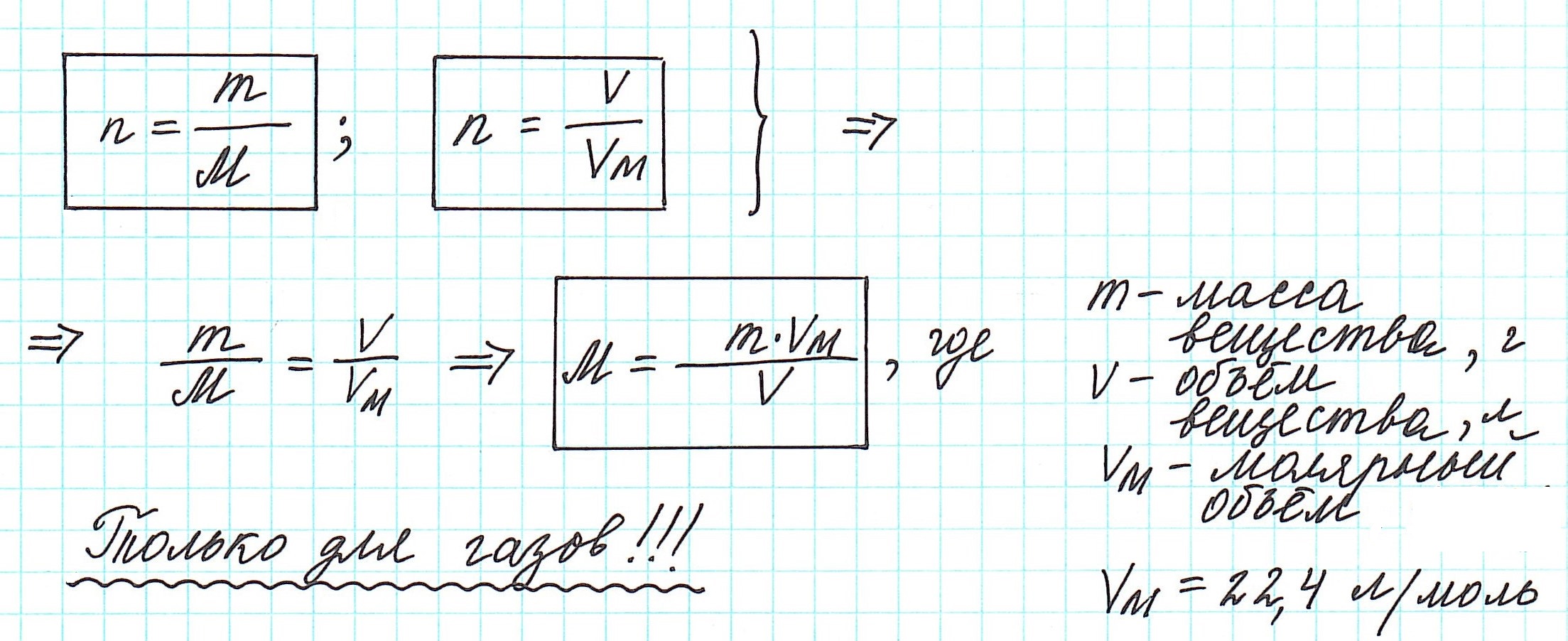Условие:
Рассчитайте среднюю молярную массу воздуха, имеющего следующий состав (в % по объему): 21% О2, 78% N2,, 0,5% Аг и 0,5% СО2,
Решение. Поскольку объемы газов пропорциональны их количествам (закон Авогадро), то среднюю молярную массу смеси можно выражать как через объемы, так и через количества веществ:
Мср = (М1·V1 + М2·V2 + M3·V3 + )/(V1 + V2 + V3+…) (1)
Мср =(М1·ν1 + М2·ν2 + M3·ν3 + )/(ν1 + ν2 + ν3+…) (2)
Возьмем 1 моль воздуха, тогда v(O2) = 0,21 моль, v(N2) = 0,78 моль, v(Ar) = 0,005 моль и v(CO2) = 0,005 моль. Подставляя эти значения в формулу (2), получаем
Мср (возд) = (0,21·32 + 0,78 ·28 + 0,005 ·40 + 0,005 ·44)/(0,21 + 0,78 + 0,005 + 0,005) = 29 г/моль.
Именно поэтому в многочисленных расчетных задачах, связанных с относительной плотностью газов по воздуху Dвозд, всегда подразумевается средняя молярная масса воздуха, равная 29 г/моль.
Ответ. Мср(возд) = 29 г/моль.
Содержание:
Количество вещества:
В чём разница между понятиями «масса» и «количество»
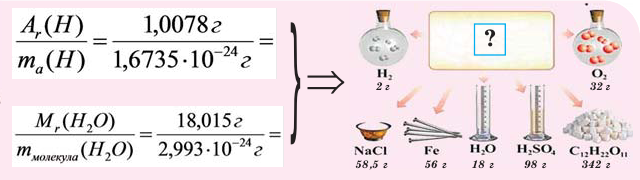
Если мы будем производить подобные расчеты, соответствующие этому заданию, для простых веществ, образованных различными элементами, то всякий раз получим одно и то же число —
Например, в 1 моле водородного газа содержится 


Количество частиц, содержащихся в 1 моле химических веществ ( 
Количество вещества можно вычислить по следующей формуле:
Здесь 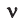
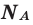
Молярная масса
Молярной массой называют массу 1 моля вещества, выраженного в граммах. Молярная масса обозначается
буквой М, единицей измерения является г/моль.
При выражении молярной массы вещества в граммах, она численно бывает равна его относительной молекулярной массе (если состоит из молекул). Для сравнения запишем (таблица 1):
Как видно из сравнений, молярная масса веществ по своей единице отличается от относительной молекулярной массы. То есть молярная масса — измеряемая величина.
Как видно из вышесказанного, понятие молярная масса применяется как к химическим элементам, так и к простым и сложным веществам с молекулярным и немолекулярным строением.
На основе количества вещества (моль) можно производить следующие вычисления. Если известно мольное количество вещества:
Закон Авогадро и молярный объём газов
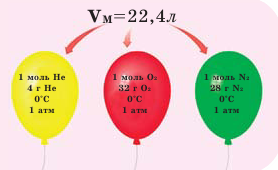
Обратите внимание на рисунки. Почему, несмотря на разные массы газов, они занимают одинаковый объём?
В начале XIX века итальянский ученый Авогадро, проведя наблюдения над свойствами газов в различных условиях и проанализировав открытые прежде законы о газах (Бойля-Мариотта, Гей-Люссака и др.) в 1811 году сформулировал новый закон о газах. Закон Авогадро звучит следующим образом: в равных объемах различных газов при одинаковых условиях (одинаковых температуре и давлении) содержится одинаковое число молекул.
Итальянский ученый. В 1811 году им был открыт закон о газах, который впоследствии был назван его именем.
Мы уже знаем, что 1 моль любого вещества содержит 
Было вычислено, что при нормальных условиях объем 1 моля любого газа или смеси газов составляет примерно 22,4 л. Объем 1 моля газа при нормальных условиях (н.у.) называют молярным объемом данного газа, выраженным знаком 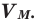
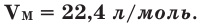
Здесь 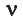
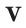
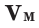
На основе закона Авогадро и молярного объёма газов можно вычислить плотность газов при нормальных условиях и относительную плотность одного газа по отношению к другому газу. Плотность обозначается буквой 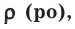
измерения —
Нормальные условия означают: температура 0°С, 1 атм давления 1атм — 101,3 кПа
Для вычисления плотности какого-либо газа X в нормальных условиях (н.у.), следует его молярную массу разделить на молярный объем:
Например, вычислим плотности кислорода и углекислого газа при нормальных условиях:
Плотность твёрдых и жидких веществ при н.у. вычисляется по формуле 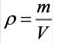
Для того, чтобы определить, масса какого из газов с одинаковыми объемами и при одинаковых условиях бывает тяжелее, пользуются понятием относительной плотности. Отношение плотностей различных газов при одинаковых условиях равно отношению их молярных масс. Относительная плотность обозначается буквой D и не имеет единицы измерения. Формула относительной плотности следующая:
Относительную плотность газов в большинстве случаев вычисляют по самому легкому газу — водороду и воздуху:
В таком случае, относительная плотность углекислого газа по водороду вычисляется следующим образом:
Так как средняя молярная масса воздуха, состоящего из смеси газов, примерно равна 29 г/моль, то формула его относительной плотности следующая:
Способы вычисления средней молярной массы газовой смеси
Здесь: 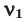
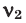
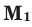
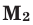

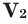
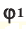
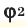
Среднюю молярную массу 1 моля смеси из двух различных газов можно вычислить по следующей формуле: 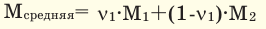
При смешивании газов с одинаковыми молярными массами, которые при одинаковом давлении не вступают друг с другом в реакцию, плотность газовой смеси (при н.у.), а также их средняя молярная масса остаются неизменными. Например, при смешивании 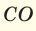
При смешивании газов с различными молярными массами, при одинаковом давлении, средняя молярная масса (при н.у.) и плотность полученной газовой смеси приобретают значение между молярными массами и плотностями смешиваемых газов. Например, при смешивании 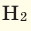
При добавлении газа с большей молярной массой в тот или иной газ при постоянном давлении плотность газовой смеси увеличивается, а при добавлении газа с меньшей молярной массой — уменьшается.
Закон объемных отношений
В химических реакциях соотношение объемов, вступающих в реакцию, и полученных газов равно соотношению их коэффициентов. Например:
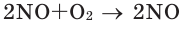
Численное соотношение объемов, молей и молекул газов равно друг другу.
Можно производить следующие вычисления по смесям:
3) Массовое соотношение двух газов:
- Физические и химические явления
- Растворы в химии
- Периодический закон Д. И. Менделеева
- Химические связи
- Состав и строение веществ в химии
- Простые и сложные вещества в химии
- Химическая формула
- Относительная атомная и относительная молекулярная масса
Что такое молярная масса?
Молярная масса вещества — это отношение его массы к количеству молей. Для воздуха тоже действует это отношение. Поэтому при проведении вычислений в результате получается масса одного моля. Но не все вещества можно рассчитать подобным образом. Для того, чтобы узнать, чему равна молярная масса воздуха в физике используют специальные формулы. Выражается результат в граммах на моль.
Воздух является смесью различных газов. Из этого следует, что молярная масса воздуха включает в себя молярные массы газов, входящих в его состав. Именно поэтому результаты таких вычислений будут различаться в зависимости от состава воздуха и количества различных газов и примесей в его составе. Существует и усредненный показатель, и средняя молярная масса воздуха равняется 29 г/моль.
Если же при расчетах было выявлено сильное отклонение от нормального показателя без объективных причин, то следует задуматься. Нарушение баланса газов – это очень серьезная проблема, которая очень часто встречается в больших городах. Именно там ежедневно в воздух выбрасывается огромное количество разнообразных веществ, которые меняют состав воздуха. Вредные примеси и их скопления очень плохо влияют на состояние организма человека. Также и увеличение или уменьшение содержания азота, кислорода, углекислого газа и других веществ влечет за собой тоже большие проблемы. Недостаток кислорода губителен для живых организмов и для человека может быть даже смертельно опасным.
Тщательное исследование воздуха может выявить отклонения от нормы и предотвратить их негативное влияние на организм человека. В нашей независимой лаборатории можно заказать комплексное обследование, которое представляет собой проведение исследований на различные показатели и выявление нарушений.

Как же определяется молярная масса воздуха?
Все вещества различаются по массе, и этот показатель является очень индивидуальным. Для сложных веществ учитывается число атомов, находящемся в нем. Так чему равна молярная масса воздуха? Это сумма всех массовых долей элементов, которые входят в данное вещество. В данном случае это молярные массы азота, кислорода, аргона, углекислого газа, водорода и других веществ. Из них азот составляет 78% от общего объема, кислород 21%, а остальные же вещества содержатся в гораздо меньшем количестве.
Существует несколько методов проведения измерения:
- Откачка воздуха из колбы позволяет при помощи уравнения состояния газа позволяет также вычислить этот показатель.
- При помощи классического химического уравнения, в котором находятся все молярные массы газов, входящих в состав воздуха.
- Также существуют уже готовые таблицы, со средними значениями.
Если производить расчеты, следуя определению, что объемы газов являются пропорциональными их количествам, то мы можем выражать среднюю массу как через объем, так и через количество. Поэтому молярная масса воздуха в химии рассчитывается по формуле, включающей в себя отношение массы вещества к его количеству. В сложных веществах надо найти отдельно массы каждого вещества, которое входит в состав.
Но этот способ расчетов по большей части затрагивает ситуации, когда воздух находится в своем обычном состоянии. Также можно вычислить и массу в других ситуациях.
Формула, по которой рассчитывается молярная масса влажного воздуха является формулой для смеси газов. При расчетах учитываются доли сухого воздуха и водяного пара, а также соответствующее для них давление и молярные массы. Получается формула выглядит как сумма объема с молярной массой водяного пара и объема с молярной массой сухого воздуха.

Известно, что молярная масса воздуха при нормальных условиях — 29 г/моль. Именно такой показатель принят за средний. Но он может колебаться в зависимости от состава воздуха. Поэтому сильные изменения свидетельствуют о нарушениях баланса газов в воздухе. Так если в воздухе будет содержаться 92% азота, то это будет смертельно опасно для человека. Именно поэтому состав воздуха так важен и необходимо его постоянно контролировать. Сейчас, в результате деятельности человека, наблюдается неблагоприятная экологическая картина и во многом она связана с загрязнением воздуха. Именно выбросы в воздух различных веществ нарушают его естественный состав, что приводит к ухудшению условий жизни. Многие экологические проблемы тоже являются уже следствием загрязнения воздуха. Смог, кислотные дожди и изменение состава всей атмосферы.
Закажите бесплатно консультацию эколога
Сколько азота в воздухе?
Если говорить о воздухе, то нельзя не затронуть тему содержания в нем азота. Он представляет собой бесцветный газ, у которого нет запаха и вкуса. Если разбирать химическую формулу, то молекула азота представляет собой два атома азота, которые скрещены между собой. Именно он составляет большую часть и составляет около 78% от всего объема воздуха. И молярная масса сжатого воздуха, высчитываемая по формуле, будет содержать в себе и молярную массу азота. Азот содержится практически везде и человек уже давно начал его использовать в своих нуждах. Даже в белке, который является основным строительным материалом всех живых организмов, тоже есть азот. Так аммиак, который применяется в сельском хозяйстве, получается при извлечении азота. И сам человек примерно на 2% состоит из азота.
Но азот может быть и опасным, если превышать его концентрацию. Безопасный азот обычно смешан с водородом в необходимых пропорциях. Азот необходим для разбавления кислорода, ведь чистый кислород тоже может быть губительным для живых организмов. Но если азот будет повышен, то это приведет к гипоксии, то есть понижению уровня кислорода в организме и внутренних органах. Вдыхаемый человеком азот не усваивается в организме, а выдыхается, так как служит только для защиты легких от кислорода.

Человек ежедневно сталкивается с тем, что было создано не без помощи азота. Азот нашел свое применение в различных областях и сейчас мы можем видеть его как в упаковках на прилавках магазинов, так и в медицине. К примеру, жидкую форму азота уже давно используют для транспортировки донорских органов.
Растения тоже не могут обойтись без азота и получают его из почвы в виде нитратов. В почве находится большое количество азота. Так потом он попадает в организмы животных, которые едят растения. Главным поставщиком азота являются бактерии, благодаря которым образовывается более ста тонн этого вещества.
Теплопроводность углекислого газа
Углекислым газом называют химическое соединение углерода и кислорода. В отличие от чистого углерода или кислорода, содержание углекислого газа в воздухе намного меньше. В нормальных условиях содержание будет равно 0,003% от общего объема воздуха. В молекулы газа входит один атом углерода и два атома кислорода. Для человека повышенный уровень углекислого газа может быть смертельно опасен, ведь он мешает поступлению кислорода в организм.
Углекислый газ также участвует в круговороте веществ и без него невозможны многие процессы. Так живые существа выделяют его в процессе дыхания, а растения, наоборот, при фотосинтезе поглощают этот газ. Он выделяется при горении углеродсодержащих предметов. Поэтому при пожарах нарушается естественный состав воздуха и увеличивается содержание в нем углекислого газа.
Теплопроводность представляет собой процесс равномерного перераспределения энергии. Эта способность является индивидуальной для каждых веществ, их состояний, а также зависит и от внешних факторов. Процесс непосредственно зависит от температуры и давления. Поэтому были разработаны таблицы, в которых показана зависимость этих показателей друг от друга.
В специальных таблицах уже рассчитаны показатели теплопроводности углекислого газа в различных его состояниях и условиях.
На основе этих таблиц можно сделать вывод, что теплопроводность углекислого газа уменьшается при повышении температуры и наоборот увеличивается если повысить давление.
Также состояние газа тоже влияет на эту зависимость. В газообразном состоянии он более теплопроводен как при увеличении давления, так и при повышении температуры, в отличие от конденсированного состояния.
На основе именно этого свойства газа работают приборы, которые измеряют содержание углекислого газа.

Зачем нужно проводить химический анализ воздуха?
Воздух является важным условием для жизни на земле. Все живые организмы зависят от воздуха и содержащегося в нем кислорода. Поэтому важно, чтобы в нем не содержалось вредных примесей и все показатели были в норме. Нарушение баланса может вызывать многие проблемы и в том числе, и со здоровьем.
Состав воздуха может изменяться не только в результате загрязнения различными предприятиями или автомобилями. Даже мебель или отделочные материалы в вашей квартиры на самом деле могут быть источниками выброса в воздух различных вредных веществ. Сейчас очень часто производители могут нарушать всевозможные нормы и изготовлять мебель из некачественных дешевых материалов. В процессе эксплуатации изделия начинают менять свои свойства и выделять иногда даже ядовитые вещества.
Для того, чтобы обезопасить себя и своих близких вы можете обратиться в нашу лабораторию «ЭкоТестЭкспресс» и заказать химический анализ воздуха.
Химический анализ представляет собой комплекс различных исследований, который позволяет определить точный состав воздуха, количество содержащихся в нем веществ и примесей. Таким образом можно выявить как нарушения в балансе, так и вредные вещества, которые загрязняют воздух и вызывают различные заболевания.
Наши эксперты-экологи проведут все необходимые измерения и выдадут вам официальные результаты исследования. Также после получения результатов вы можете получить консультацию и понять, какие именно источники вызвали нарушение норм. Своевременное устранение проблемы может сберечь ваше здоровье и комфорт.
Документы, которые выдает наша лаборатория, являются не только официальными, но и имеют юридическую силу. В случае выявления нарушений такие документы могут быть предъявлены в суд в качестве доказательства.
Сколько весит воздух? На первый взгляд, это совершенно бессмысленный вопрос, ведь воздух нельзя потрогать, он, как мы привыкли думать, не давит на нас, он совсем невидим, не ощущается, и вообще, разве может воздух что-то весить? Даже говорят иногда про худеньких и костлявых людей: «Да он (или она) легче воздуха!». Сколько весит воздух, кажется, вопрос совсем абсурдный. И тем не менее, откуда-то он берется.
Вопрос о том, сколько весит воздух, далеко не так абсурден, как кажется на первый взгляд. Он вовсе не лишен смысла, когда речь идет о весе воздуха в контексте химических реакций и расчетов. Обычно химики оперируют молярной массой воздуха.

Что же это такое и каким образом ученым удалось взвесить воздух? Они пользовались какими-то особыми весами? И чему масса воздуха равна? В чем ее измерять? И что делать, если нужно рассчитать вес очень большого объема воздуха?

Что такое молярная масса?
Молярная масса — это отношение (знак деления) массы вещества к количеству молей этого вещества. Иными словами, молярной массой вещества называется масса одного моля этого вещества.

Общепринятая форма записи молярной массы в химических формулах — заглавная буква «М». То есть, если вам нужно записать формулой фразу «молярная масса вещества равна», она будет выглядеть следующим образом: «М = …»
Обычно нижним индексом указывают, молярная масса какого вещества имеется в виду. Для сложного вещества, такого, как воздух, не имеющего определенной краткой формы записи, можно указывать также в скобках. Тогда молярную массу воздуха можно обозначать как Мвоздуха или как М (воздуха). Более предпочтителен все же вариант записи нижним индексом.
В чем измеряется молярная масса?
Единицей измерения молярной массы в Международной системе единиц (СИ) является килограмм на моль. В сокращенном виде в русскоязычном варианте это будет выглядеть как «кг/моль», а принятое международное сокращение записывается как kg/mol. Исторически, однако, сложилось так, что молярная масса измеряется в граммах на моль, так как речь, как правило, ведется об очень малых величинах и количествах вещества, а значит, килограммы здесь только утяжелили бы расчеты, не выполняя никакой иной функции.
Что такое моль?
Как уже было сказано выше, молярная масса выражает вес одного моля вещества. Но что же такое этот моль? Как его посчитать? Кто и когда решил считать массу в молях?
Моль, согласно Резолюции XIV Генеральной конференции по мерам и весам, принятой в 1971 году, и Положению о единицах величин, допускаемых к применению в Российской Федерации, определяется как количество вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде-12 массой 0,012 кг. В качестве структурных элементов могут выступать атомы, молекулы, ионы, электроны или другие частицы и специфицированные группы частиц.
Название этой величины происходит от латинского moles, означающего «количество, масса, счетное множество».
Какова молярная масса воздуха?
Так сколько же все-таки весит воздух? Химики могут дать точный ответ на этот вопрос. Средняя молярная масса воздуха составляет 28,98 граммов на моль. Для простоты расчетов в учебных целях это число обычно округляют до 29 граммов на моль. Записывается это при решении химических уравнений как 28,98 г/моль или как 29 г/моль. Молярная масса воздуха для типовых расчетов, которые не требуют высокой точности, является неизменной.
Как удалось взвесить моль воздуха?
Воздух — это смесь различных газов. В основном в его состав входят азот и кислород. Вместе их доля в воздухе составляет более 98 процентов. Помимо них, в воздухе содержатся водород, углекислый газ, аргон и совсем крошечные примеси других газов, которые образуют атмосферу Земли, а также мельчайшие частицы водяного пара.
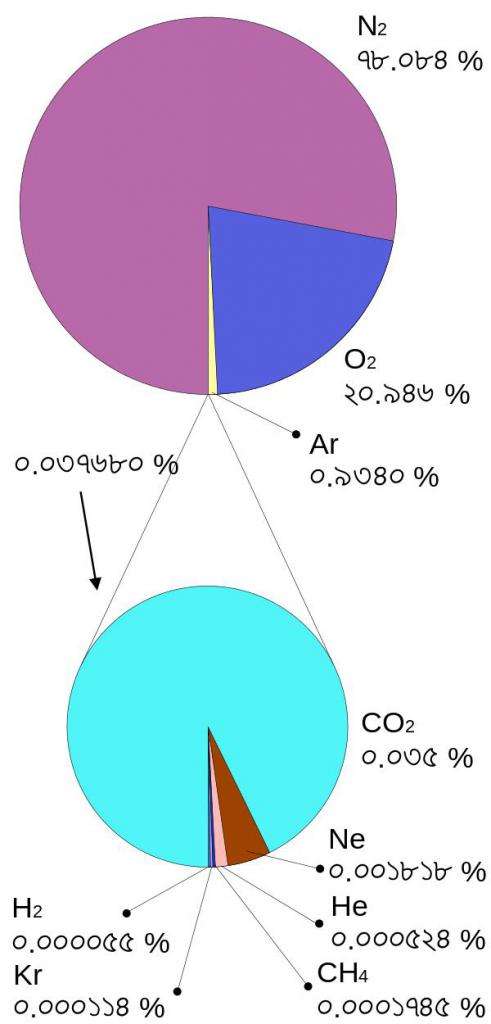
Молярная масса воздуха высчитывается как молярная масса смеси нескольких веществ, входящих в его состав. То есть для нахождения ее необходимо найти среднее арифметическое взвешенное молярной массы массовых долей, которые входят в состав индивидуальных веществ, образующих воздух.
Для удобства подсчетов химиками берутся некоторые идеальные значения молярных масс газов, входящих в состав воздуха, а также некоторые абсолютные доли этих газов в воздухе. Число 28,98 граммов на моль получается в результате нахождения среднего арифметического взвешенного с использованием этих данных.
Всегда ли моль воздуха будет весить ровно столько?
Поскольку воздух представляет собой смесь газов, он представляет собой неустойчивое соединение, в котором точные доли веществ могут изменяться в зависимости от различных условий.
Так, например, содержание в воздухе углекислого газа выше в крупных городах, чем в сельской местности, или тем более в лесах, где он потребляется деревьями, напротив, привносящими в его состав больший процент кислорода. Вообще, состав воздуха в городской среде очень сильно изменен еще и за счет выхлопных газов, работы заводов и предприятий, неравномерной концентрации зеленых и закатанных в бетон и цемент участков, а также промышленных и рекреационных зон.

Другое проявление различий в составе воздуха в разных местах хорошо знакомо альпинистам. Связано оно с тем, что молекулы кислорода имеют большую массу, а потому с высотой его концентрация в воздухе уменьшается. Следовательно, в высокогорных районах кислорода в воздухе содержится намного меньше, чем на равнине или в низине. Концентрация азота в воздухе при этом становится с высотой выше за счет уменьшения концентрации кислорода, так как этот газ имеет меньшую молярную массу, чем молярная масса кислорода. Именно поэтому покорителям горных вершин приходится таскать на себе кислородные баллоны, а у впервые попавшего в горную местность человека может закружиться голова.
Также оказывает влияние на концентрацию газов в воздухе водяной пар. Доля его содержания в воздухе зависит от влажности, температуры, климата, времени года и некоторых других условий. Доля его обычно не слишком значительна, однако может достигать в отдельных местностях нескольких процентов.
Каким образом можно найти массу большего количества воздуха?

Зная молярную массу воздуха, можно рассчитать, сколько весит больший объем воздуха. Для этого необходимо знать количество воздуха.
Масса воздуха рассчитывается путем умножения количества воздуха на его молярную массу. Если записать это утверждение в виде формулы, схема расчетов будет выглядеть следующим образом: m = V × M. В этой формуле m обозначает массу воздуха, V — количество воздуха в молях, а M — молярную массу воздуха.
Как вычислить молярную массу вещества? В каких единицах она измеряется?
А еще есть относительная молекулярная масса. Почему она относительная и численно равна молярной массе? Может быть это одно и то же?
Вот сколько вопросов возникает сразу в отношении такого простого на первый взгляд понятия, как молярная масса.
Разберемся по порядку и научимся ее определять.
Содержание:
1.Относительная атомная масса
2.Почему атомная масса дробная?
3.Относительная молекулярная масса
4.Количество вещества и молярная масса
5.Как вычислить молярную массу вещества
Относительная атомная масса
Огромнейший вклад в развитие и обоснование понятия относительная атомная масса внесли в разное время французский ученый Гей-Люссак, итальянский ученый А.Авогадро и шведский ученый Й.Я. Берцелиус.
Не углубляясь в историю вопроса, вспомним, что любой химический элемент представляет собой определенную разновидность атомов. Сегодня мы знаем, что атомы химических элементов имеют свои особые характеристики.
И самая главная из них, определяющая практически все остальные, это заряд ядра. А так как заряд ядра обусловлен присутствием в нем протонов, а заряд одного протона равен +1, то и количество протонов, соответственно, также является важнейшей характеристикой атомов химических элементов.
Основную массу атома составляет ядро, которое кроме протонов содержит еще и нейтроны. Масса последних сопоставима с массой первых. Оболочку атома составляют электроны.
По числу частиц в атоме, а точнее, по их суммарной массе, атомы химических элементов можно условно разделить на тяжелые и легкие. Например, легким элементом является водород, так как его атомы имеют самую маленькую массу. А свинец — это уже тяжелый элемент. Масса его атома в 302 раза тяжелее массы атома водорода.
Но тем не менее, как бы мы не делили все атомы на тяжелые или легкие, абсолютная масса (mA) каждого из них ничтожно мала, как мала и масса составляющих их частиц. Например,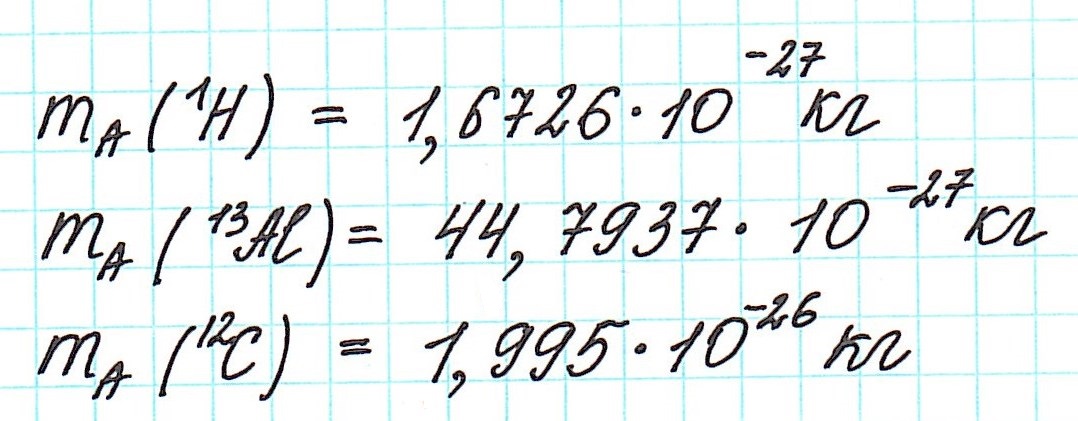
Величина, с которой сравнивают массу атома
Первоначально еще Дальтон сравнивал массы атомов с массой атома водорода, как самого легкого. Позднее появилась так называемая кислородная единица, равная 1/16 части массы атома кислорода. К ней перешли потому, что большинство атомов химических элементов образуют соединения с кислородом.
Однако, с развитием атомной физики и эта единица стала крайне неудобной. Все потому, что кислород в природе имеет несколько изотопов (а именно 3 устойчивых, всего же их 16). А изотопы, как известно, отличаются своей атомной массой. Из-за большого разнообразия изотопов и их различной устойчивости кислородная единица утратила свою актуальность.
В настоящее время (с 1961 года) общепринятой является углеродная единица, так называемая атомная единица массы (сокращенно а.е.м.). Она равна 1/12 части массы атома углерода (изотопа 12С).
Почему именно углерод? Да потому, что:
— у углерода всего 2 изотопа: 12С и 13С; причем первого 98,9%;
— количество органических веществ (их основу составляет, как известно, именно углерод) в сотни раз больше, чем неорганических;
— при переходе от кислородной единицы к углеродной уже посчитанные относительные атомные массы всех элементов изменились не существенно, что оказалось очень удобным.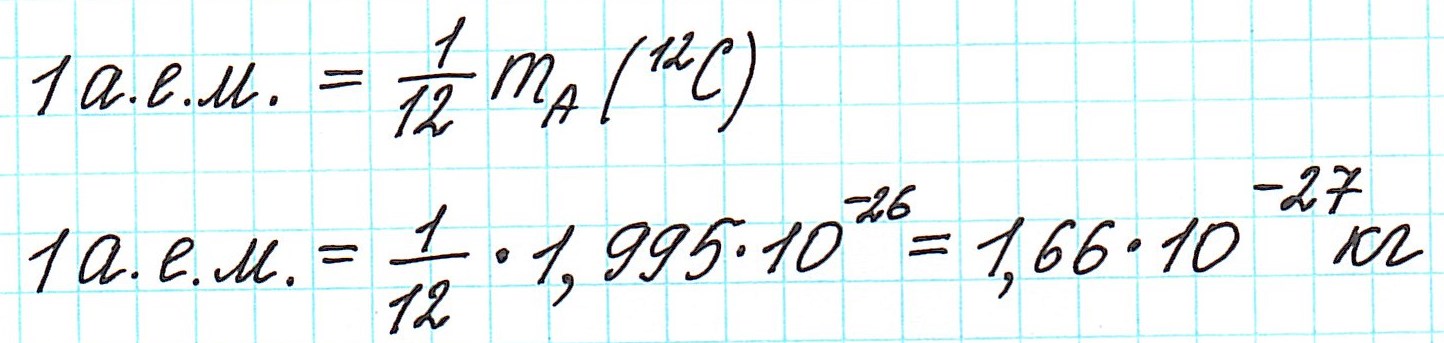
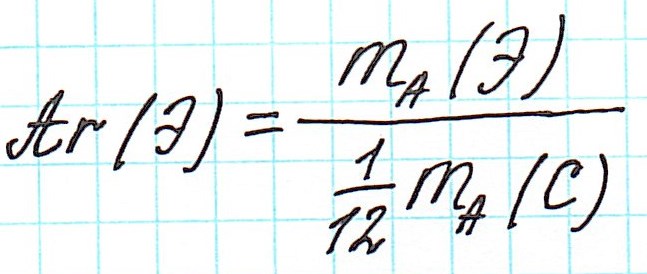
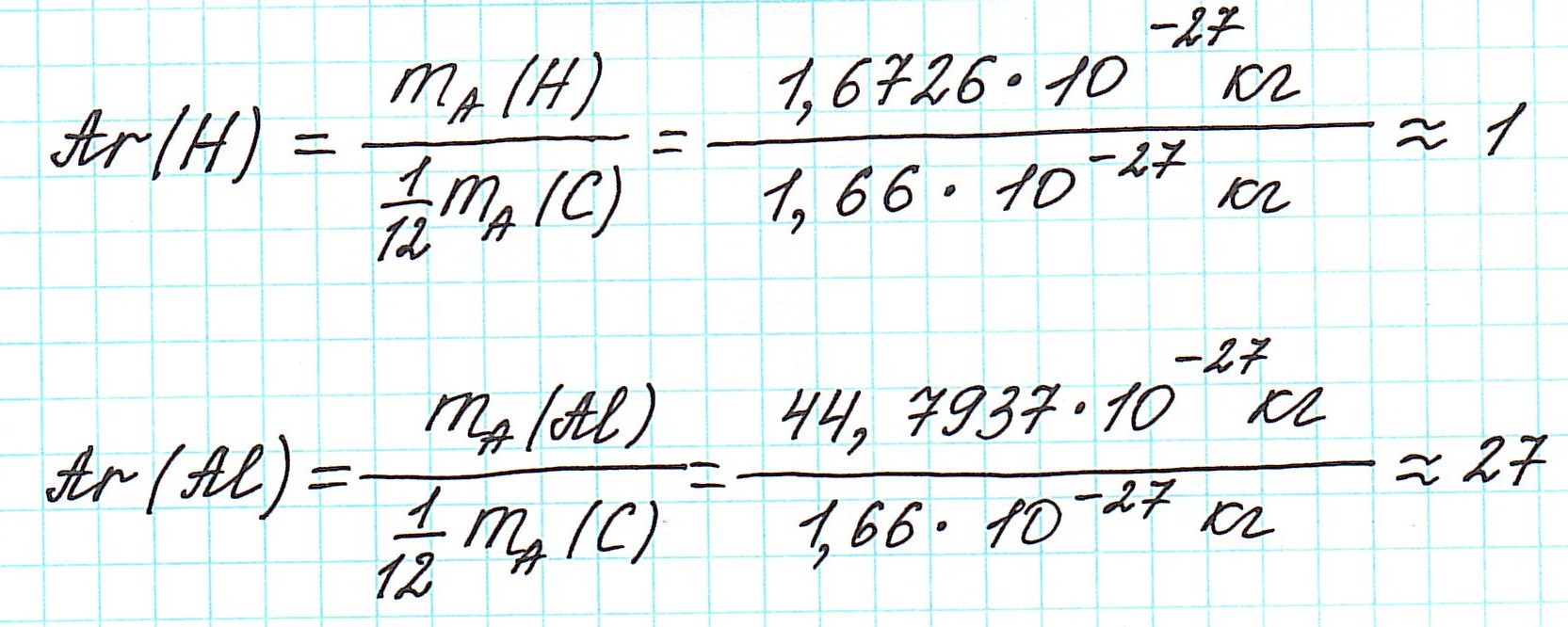
Почему атомная масса дробная?
Вернемся к строению атома.
Масса атома складывается из массы всех составляющих его частиц.
Массы протона и нейтрона приняты равными 1. А вот массой электрона обычно пренебрегают (по крайней мере в химии), так как даже относительная она безнадежно мала (0,0005485799090659(16) а.е.м.). То есть можно сказать, что масса атома определяется массой его ядра.
В составе ядра целое количество частиц. Например, в атоме одного из изотопов кислорода 8 протонов и 8 нейтронов. Значит, его Ar должна быть равна 16. Так почему же Ar представлена в периодической системе химических элементов в виде десятичной дроби? Для кислорода это Ar(О)=15,9994.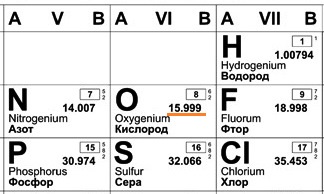
Например, химический элемент кислород в природе состоит на 99,76% из изотопа 16О, на 0,04% из изотопа 17О и на 0,20% из изотопа 18О. Таким образом, Ar для кислорода является средним значением, учитывающим относительное содержание его изотопов.
Относительная молекулярная масса
А как же найти относительную молекулярную массу?
Здесь не все так просто. Понятие «относительная молекулярная масса» не всегда применяется корректно. Правильнее было бы говорить о «формульной массе».
Дело в том, что молекулы характерны для веществ с ковалентными связями: вода H2O, серная кислота H2SO4, глюкоза C6H12O6 и т.д. И к ним в полной мере можно применить термин «относительная молекулярная масса».
Так как молекулы состоят из атомов, то относительная молекулярная масса (Mr) будет складываться из их относительных атомных масс. Например: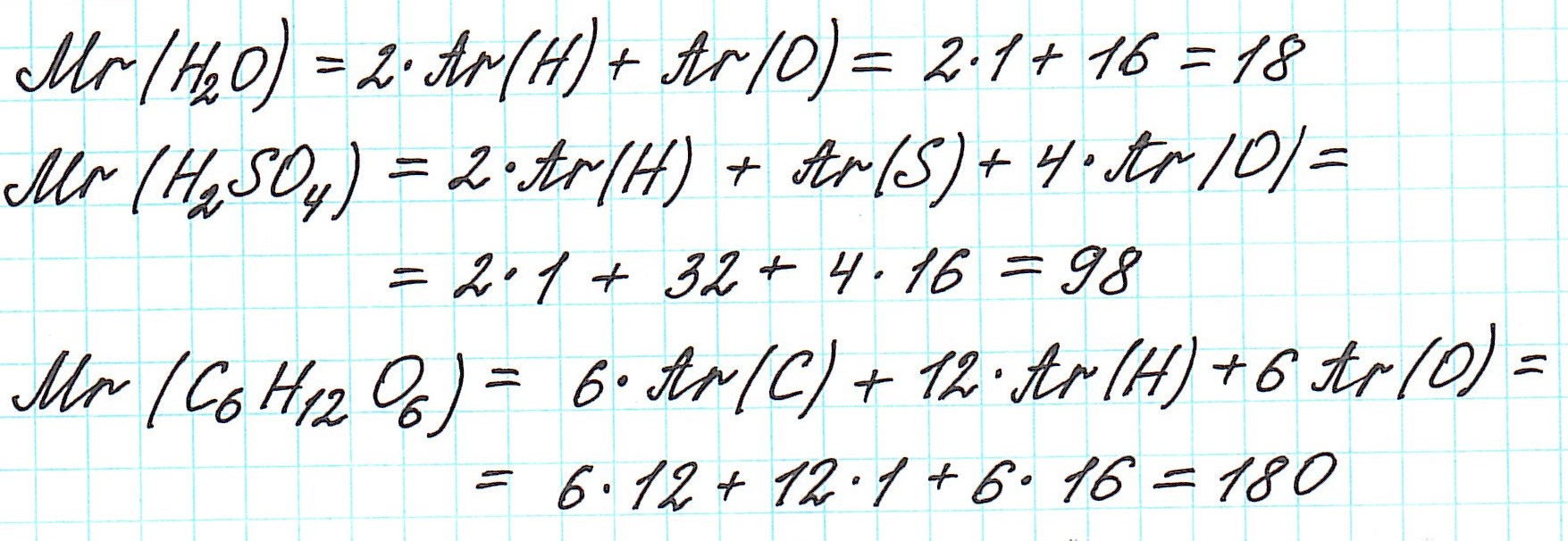
Например, формула NaCl показывает, что в кристалле хлорида натрия на один ион натрия Na+ приходится один ион хлора Cl—. На самом деле формула хлорида натрия должна выглядеть так: Na∞Cl∞. Поэтому запомним, что к ионным соединениям термины «молекула» и «молекулярная масса» не применимы.
В связи с этим для подобных веществ вычисляется формульная масса. А вычисляется она все по тому же принципу, что и молекулярная масса. Обозначается так же — Mr. Например, для хлорида натрия:
Точно так же, как относительную атомную массу (Ar), относительную молекулярную массу (Mr) будем сопоставлять с 1/12 частью атома изотопа углерода 12С.
В последующем говорим о Mr.
Количество вещества и молярная масса
В практических расчетах все-таки требуется вычислять массы, взятые в граммах, килограммах ато и в тоннах (если речь идет о каком-то производстве, например).
Как же поступают тогда?
Введена новая и тоже относительная величина – моль.
Точно было посчитано, что определенное количество атомов изотопа углерода 12С, а именно 6,02·1023, имеют массу ровно 12 г. Обратите внимание, что относительная молекулярная масса для этого же изотопа равна 12, но не грамм!
Количество вещества, которое содержит столько же частиц (атомов, ионов, молекул – в зависимости от строения), что и 12 г изотопа углерода 12С, назвали молем.
Один моль вещества (любого!) всегда содержит 6,02·1023 его частиц (постоянная Авогадро).
Ну, а так как атомы элементов отличаются по своей массе, то и 1 моль вещества тоже будет отличаться по массе.
Массу одного моля вещества называют молярной массой (М) и вычисляют в г/моль.
Таким образом, молярная масса и количество вещества связаны соотношением:
Можно также определить и такие отношения, связанные с количеством вещества:
Почему же относительная молекулярная и молярная массы равны?
Итак, относительная молекулярная и молярная массы, как следует из их определений – это не одно и то же.
Докажем, каким образом обе массы численно могут быть равны:
Как вычислить молярную массу вещества
Мы уже знаем, что относительная молекулярная масса складывается из относительных атомных масс.
При нахождении относительной молекулярной массы (Mr), а значит и молярной (М), выполняем следующие действия:
1) правильно записываем формулу вещества;
2) анализируем качественный состав (атомы каких элементов составляют вещество) и количественный состав (в каких количествах находятся эти атомы – смотрим по индексам, которые стоят справа внизу от знака химического элемента);
3) в периодической системе химических элементов находим элементы, атомы которых составляют вещество, и округляем относительную атомную массу, стоящую рядом со знаком элемента, до целого числа (! у хлора – до 35,5);
4) складываем относительные атомные массы всех элементов с учетом количества атомов.
Рассмотрим еще примеры:
Как вычислить молярную массу вещества, находящегося в газообразном состоянии
Определить молекулярную (а значит и молярную) массу газообразного вещества можно, используя закон Авогадро. Он гласит, что в равных объемах газов, взятых при одинаковой температуре, а также одинаковом давлении, содержится равное число молекул.
Это означает, что в данных условиях отношение масс газов друг к другу является отношением их молярных масс:


Запомните, что средняя молярная масса воздуха равна 29 г/моль.
Вычислить молярную массу вещества (а, значит, и относительную молекулярную), находящегося в газообразном состоянии, можно, используя молярный объем газа (VM):
Итак, подведем итог:
- Относительная молекулярная масса (Mr) показывает отношение массы молекулы к 1/12 части массы атома изотопа углерода 12С.
- Молярная масса (М) – масса одного моля вещества, равная отношению массы вещества к его количеству и выраженная в г/моль.
- Относительная молекулярная и молярная массы численно равны.
- Вычислить молярную массу вещества (и относительную молекулярную также) можно, используя значения относительных атомных масс, записанных в периодической системе.
Без вычисления молярной массы не обходится решение практически ни одной задачи. Если вы поняли, что такое молярная и относительная молекулярная массы и как их вычислять, но еще не умеете решать задачи с их применением, то самое время научиться.
Разбор простых типовых задач по химии в книге, которую вы можете совершенно БЕСПЛАТНО скачать здесь.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.