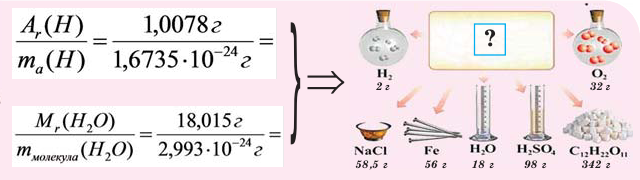
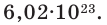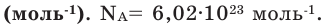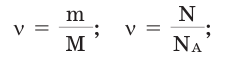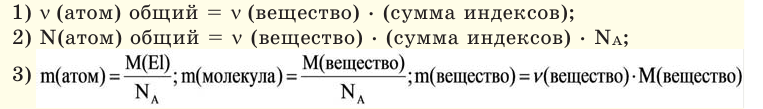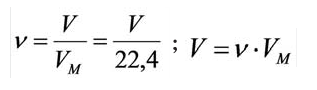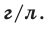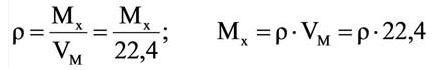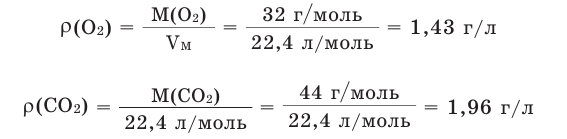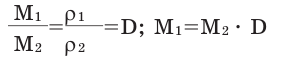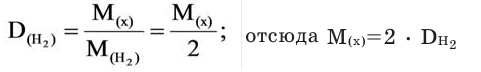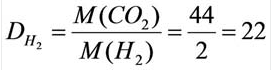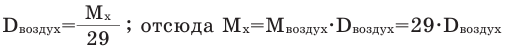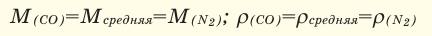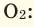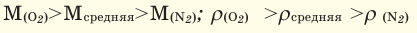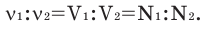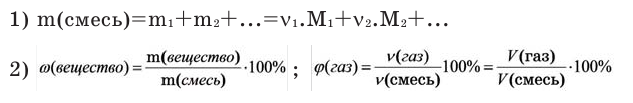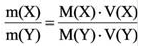Содержание:
Количество вещества:
В чём разница между понятиями «масса» и «количество»
Если мы будем производить подобные расчеты, соответствующие этому заданию, для простых веществ, образованных различными элементами, то всякий раз получим одно и то же число —
Например, в 1 моле водородного газа содержится 

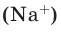

Количество частиц, содержащихся в 1 моле химических веществ ( 
Количество вещества можно вычислить по следующей формуле:
Здесь 
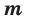
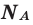
Молярная масса
Молярной массой называют массу 1 моля вещества, выраженного в граммах. Молярная масса обозначается
буквой М, единицей измерения является г/моль.
При выражении молярной массы вещества в граммах, она численно бывает равна его относительной молекулярной массе (если состоит из молекул). Для сравнения запишем (таблица 1):
Как видно из сравнений, молярная масса веществ по своей единице отличается от относительной молекулярной массы. То есть молярная масса — измеряемая величина.
Как видно из вышесказанного, понятие молярная масса применяется как к химическим элементам, так и к простым и сложным веществам с молекулярным и немолекулярным строением.
На основе количества вещества (моль) можно производить следующие вычисления. Если известно мольное количество вещества:
Закон Авогадро и молярный объём газов
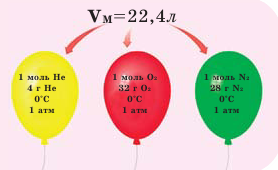
Обратите внимание на рисунки. Почему, несмотря на разные массы газов, они занимают одинаковый объём?
В начале XIX века итальянский ученый Авогадро, проведя наблюдения над свойствами газов в различных условиях и проанализировав открытые прежде законы о газах (Бойля-Мариотта, Гей-Люссака и др.) в 1811 году сформулировал новый закон о газах. Закон Авогадро звучит следующим образом: в равных объемах различных газов при одинаковых условиях (одинаковых температуре и давлении) содержится одинаковое число молекул.
Итальянский ученый. В 1811 году им был открыт закон о газах, который впоследствии был назван его именем.
Мы уже знаем, что 1 моль любого вещества содержит 
Было вычислено, что при нормальных условиях объем 1 моля любого газа или смеси газов составляет примерно 22,4 л. Объем 1 моля газа при нормальных условиях (н.у.) называют молярным объемом данного газа, выраженным знаком 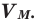
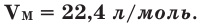
Здесь 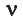
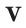
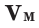
На основе закона Авогадро и молярного объёма газов можно вычислить плотность газов при нормальных условиях и относительную плотность одного газа по отношению к другому газу. Плотность обозначается буквой 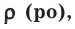
измерения —
Нормальные условия означают: температура 0°С, 1 атм давления 1атм — 101,3 кПа
Для вычисления плотности какого-либо газа X в нормальных условиях (н.у.), следует его молярную массу разделить на молярный объем:
Например, вычислим плотности кислорода и углекислого газа при нормальных условиях:
Плотность твёрдых и жидких веществ при н.у. вычисляется по формуле 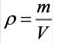
Для того, чтобы определить, масса какого из газов с одинаковыми объемами и при одинаковых условиях бывает тяжелее, пользуются понятием относительной плотности. Отношение плотностей различных газов при одинаковых условиях равно отношению их молярных масс. Относительная плотность обозначается буквой D и не имеет единицы измерения. Формула относительной плотности следующая:
Относительную плотность газов в большинстве случаев вычисляют по самому легкому газу — водороду и воздуху:
В таком случае, относительная плотность углекислого газа по водороду вычисляется следующим образом:
Так как средняя молярная масса воздуха, состоящего из смеси газов, примерно равна 29 г/моль, то формула его относительной плотности следующая:
Способы вычисления средней молярной массы газовой смеси
Здесь: 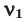
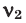
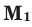
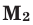

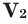
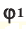
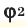
Среднюю молярную массу 1 моля смеси из двух различных газов можно вычислить по следующей формуле: 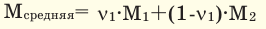
При смешивании газов с одинаковыми молярными массами, которые при одинаковом давлении не вступают друг с другом в реакцию, плотность газовой смеси (при н.у.), а также их средняя молярная масса остаются неизменными. Например, при смешивании 
При смешивании газов с различными молярными массами, при одинаковом давлении, средняя молярная масса (при н.у.) и плотность полученной газовой смеси приобретают значение между молярными массами и плотностями смешиваемых газов. Например, при смешивании 
При добавлении газа с большей молярной массой в тот или иной газ при постоянном давлении плотность газовой смеси увеличивается, а при добавлении газа с меньшей молярной массой — уменьшается.
Закон объемных отношений
В химических реакциях соотношение объемов, вступающих в реакцию, и полученных газов равно соотношению их коэффициентов. Например:
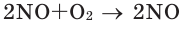
Численное соотношение объемов, молей и молекул газов равно друг другу.
Можно производить следующие вычисления по смесям:
3) Массовое соотношение двух газов:
- Физические и химические явления
- Растворы в химии
- Периодический закон Д. И. Менделеева
- Химические связи
- Состав и строение веществ в химии
- Простые и сложные вещества в химии
- Химическая формула
- Относительная атомная и относительная молекулярная масса

Уравнение Клапейрона-Менделеева
m
р · V = ¾¾ R · T.
М
Закон Авогадро
В равных объемах любых газов при одинаковых условиях (температура и давление) содержится одинаковое число молекул.
Следствия из закона Авогадро
1. Один моль любого газа при данных условиях занимает один и тот же объем – молярный объем (Vм). Он равен отношению объема газа
(V) к его количеству вещества n: V
Vm = ¾¾¾ . n
2. При нормальных условиях (н.у.) 1 моль различных газов занимает объем 22,4 л, т.е. Vм = 22,4 л/моль.
Относительная плотность одного газа по другому Молярную массу газа (Мгаза) можно определить по его плотности
r (отношение массы газа к его объему): Мгаза = 22,4·r.
Плотности газов при одинаковых условиях относятся как их молярные массы:
|
m1 |
r1 |
М1 |
|
¾¾¾ = ¾¾ = ¾¾¾ = D. |
||
|
m 2 |
r2 |
М2 |
D — относительная плотность одного газа по другому.
Средняя молярная масса смеси газов
Средняя молярная масса смеси газов равна сумме произведений их объемных долей (j) на их молярные массы (М):
Мср = j1 · М1 + j2 · М2 + … + jn · Mn,
V1 Vn
где j1 = ¾¾¾; jn = ¾¾¾ .
Vобщ Vобщ
Закон парциальных давлений газов (закон Дальтона)
Общее давление смеси газов, химически не взаимодействующих друг с другом, равно сумме парциальных давлений газов, составляющих смесь:
рСМ · j
РСМ = Р1 + Р2 + … + Рn ; Рn = ¾¾¾
100%
где Р1, Р2, …, Рn – парциальные давления газов; РСМ – общее давление смеси газов
9
- Как найти среднюю молярную массу смеси газов
-
ВВЕДЕНИЕ В ОБЩУЮ ХИМИЮ
- 2. Ocновные понятия и законы химии. Атомно-молекулярное учение
- 1.5. Смеси газов
Как найти среднюю молярную массу смеси газов
РАЗДЕЛ И. ОБЩАЯ ХИМИЯ
Примеры решения типовых задач
V. Определение средней молярной массы смеси газов
Формулы и понятия, которые используются:
где М(смеси) – средняя молярная масса смеси газов,
М(А), М(Б), М(В) – молярные массы компонентов смеси А, Б и В,
χ(А), χ(B), χ(В) – мольные доли компонентов смеси А, Б и В,
φ(А), φ(B), φ(В) – объемные доли компонентов смеси А, Б и В,
М(пов.) – молярная масса воздуха, г/моль,
М r (пов.) – относительная молекулярная масса воздуха.
Задача 23. Вычислите молярну массу смеси, в которой объемные доли метана и бутана соответственно составляют 85 и 15%.
Молярная масса смеси – это масса всех ее составляющих, взятых в суммарном количестве вещества смеси 1 моль (М(СН 4 ) = 16 г/моль, М(С4Н10) = 58 г/моль). Вычислить среднюю молярну массу смеси можно по формуле:
Ответ: М(смеси) = 22 , 3 г/моль.
Задача 24. Определите плотность газовой смеси с азотом, в которой объемные доли карбон(И V ) оксида, сульфур(И V ) оксида и карбон(II) оксида соответственно составляют 35,25 и 40 %.
1. Вычислим молярну массу смеси (М(С O 2 ) = 44 г/моль, M ( SO 2 ) = 64 г/моль, М(СО) = 28 г/моль):
2. Вычислим относительную плотность смеси с азотом:
Ответ: DN2 (смеси) = 1,52.
Задача 25. Плотность смеси ацетилена и бутену за гелием равна 11. Определите объемную долю ацетилена в смеси.
1. По формуле определим молярну массу смеси (М(Не) = 4 г/моль):
2. Предположим, что мы имеем 1 моль смеси. В ней содержится х моль С2Н2, тогда в соответствии
3. Запишем выражение для вычисления средней молярной массы газовой смеси:
Подставим все известные данные: М(С2Н2) = 26 г/моль, М(С4Н8) = 56 г/моль:
4. Следовательно, 1 моль смеси содержит 0,4 моль С2Н2. Вычислим мольну долю χ(С2Н2):
Для газов φ(Х) = χ(Х). Следовательно, φ(С2Н4) = 40 %.
Как найти среднюю молярную массу смеси газов
Определения средней молярной массы смеси газов – Примеры решения типовых задач – Основные химические понятия. Вещество – ОБЩАЯ ХИМИЯ – ХИМИЯ – Комплексная подготовка к внешнему независимому тестированию По действующей программе ВНО – предназначен для подготовки к внешнему независимому оцениванию. Он содержит теоретический материал, представленный в соответствии с действующей программой по химии для общеобразовательных школ и программы ВНО; примеры решения типовых задач; тематические тестовые задания.
Источник: na-uroke.in.ua
ВВЕДЕНИЕ В ОБЩУЮ ХИМИЮ
Электронное учебное пособие
Москва 2013
2. Ocновные понятия и законы химии. Атомно-молекулярное учение
2.10. Примеры решения задач
2.10.1. Расчет относительных и абсолютных масс атомов и молекул
Относительные массы атомов и молекул определяются с использованием приведенных в таблице Д.И. Менделеева величин атомных масс. При этом, при проведении расчетов для учебных целей значения атомных масс элементов обычно округляются до целых чисел (за исключением хлора, атомная масса которого принимается равной 35,5).
Пример 1. Относительная атомная масса кальция Аr(Са)=40; относительная атомная масса платины Аr(Pt)=195.
Относительная масса молекулы рассчитывается как сумма относительных атомных масс составляющих данную молекулу атомов с учетом количества их вещества.
Пример 2. Относительная молярная масса серной кислоты:
Величины абсолютных масс атомов и молекул находятся делением массы 1 моль вещества на число Авогадро.
Пример 3. Определите массу одного атома кальция.
Решение. Атомная масса кальция составляет Аr(Са)=40 г/моль. Масса одного атома кальция окажется равной:
m(Ca)= Аr(Ca) : NA =40 : 6,02·10 23 = 6,64·10 -23 г.
Пример 4. Определите массу одной молекулы серной кислоты.
Решение. Молярная масса серной кислоты равна Мr(H2SO4) = 98. Масса одной молекулы m(H2SO4) равна:
2.10.2. Расчет количества вещества и вычисление числа атомных и молекулярных частиц по известным значениям массы и объема
Количество вещества определяется путем деления его массы, выраженной в граммах, на его атомную (молярную) массу. Количество вещества, находящегося в газообразном состоянии при н.у., находится делением его объема на объем 1 моль газа (22,4 л).
Пример 5. Определите количество вещества натрия n(Na), находящегося в 57,5 г металлического натрия.
Решение. Относительная атомная масса натрия равна Аr(Na)=23. Количество вещества находим делением массы металлического натрия на его атомную массу:
Пример 6 . Определите количество вещества азота, если его объем при н.у. составляет 5,6 л.
Решение. Количество вещества азота n(N 2) находим делением его объема на объем 1 моль газа (22,4 л):
Число атомов и молекул в веществе определяется умножением количества вещества атомов и молекул на число Авогадро.
Пример 7. Определите число молекул, содержащихся в 1 кг воды.
Решение. Количество вещества воды находим делением ее массы (1000 г) на молярную массу (18 г/моль):
Число молекул в 1000 г воды составит:
N(Н2О) = 55,5·6,02·10 23 = 3,34·10 24 .
Пример 8. Определите число атомов, содержащихся в 1 л (н.у.) кислорода.
Решение. Количество вещества кислорода, объем которого при нормальных условиях составляет 1 л равно:
n(О2) = 1 : 22,4 = 4,46·10 -2 моль.
Число молекул кислорода в 1 л (н.у.) составит:
N(О2) = 4,46·10 -2 · 6,02·10 23 = 2,69·10 22 .
Следует отметить, что 26,9·10 22 молекул будет содержаться в 1 л любого газа при н.у. Поскольку молекула кислорода двухатомна, число атомов кислорода в 1 л будет в 2 раза больше, т.е. 5,38·10 22 .
2.10.3. Расчет средней молярной массы газовой смеси и объемной доли
содержащихся в ней газов
Средняя молярная масса газовой смеси рассчитывается на основе молярных масс составляющих эту смесь газов и их объемных долей.
Пример 9. Полагая, что содержание (в объемных процентах) азота, кислорода и аргона в воздухе соответственно составляет 78, 21 и 1, рассчитайте среднюю молярную массу воздуха.
Решение.
Мвозд = 0,78·Мr(N2)+0,21·Мr (O2)+0,01·Мr(Ar)= 0,78·28+0,21·32+0,01·40 = 21,84+6,72+0,40=28,96
или приблизительно 29 г/моль.
Пример 10. Газовая смесь содержит 12 л NH3, 5 л N2 и 3 л Н2, измеренных при н.у. Рассчитать объемные доли газов в этой смеси и ее среднюю молярную массу.
Решение. Общий объем смеси газов равен V=12+5+3=20 л. Объемные доли j газов окажутся равными:
Средняя молярная масса рассчитывается на основе объемных долей составляющих эту смесь газов и их молекулярных масс:
М=0,6·М(NH3)+0,25·M(N2)+0,15·M(H2) = 0,6·17+0,25·28+0,15·2 = 17,5.
2.10.4. Расчет массовой доли химического элемента в химическом соединении
Массовая доля ω химического элемента определяется как отношение массы атома данного элемента Х, содержащегося в данной массе вещества к массе этого вещества m. Массовая доля – безразмерная величина. Ее выражают в долях от единицы:
ω(X) = m(X)/m (0 о С и давлении 200 кПа масса 3,0 л газа составляет 6,0 г. Определите молярную массу этого газа.
Решение. Подставляя известные величины в уравнение Клапейрона–Менделеева получаем:
М = mRT/PV = 6,0·8,31·313/(200·3,0)= 26,0.
Рассматриваемый газ – ацетилен С2Н2.
Пример 17. При сгорании 5,6 л (н.у.) углеводорода получено 44,0 г углекислого газа и 22,5 г воды. Относительная плотность углеводорода по кислороду равна 1,8125. Определите истинную химическую формулу углеводорода.
Решение. Уравнение реакции сгорания углеводорода можно представить следующим образом:
Количество углеводорода составляет 5,6:22,4=0,25 моль. В результате реакции образуется 1 моль углекислого газа и 1,25 моль воды, которая содержит 2,5 моль атомов водорода. При сжигании углеводорода количеством вещества 1 моль получается 4 моль углекислого газа и 5 моль воды. Таким образом, 1 моль углеводорода содержит 4 моль атомов углерода и 10 моль атомов водорода, т.е. химическая формула углеводорода С4Н10. Молярная масса этого углеводорода равна М=4·12+10=58. Его относительная плотность по кислороду D=58:32=1,8125 соответствует величине, приведенной в условии задачи, что подтверждает правильность найденной химической формулы.
ВВЕДЕНИЕ В ОБЩУЮ ХИМИЮ
ВВЕДЕНИЕ В ОБЩУЮ ХИМИЮ Электронное учебное пособие Москва 2013 2. Ocновные понятия и законы химии. Атомно-молекулярное учение 2.10. Примеры решения задач 2.10.1. Расчет относительных
Источник: onx.distant.ru
Если идеальные газы находятся в сообщающихся баллонах, разделенных краном, то при открытии крана газы в баллонах смешиваются между собой и каждый из них заполняет объем обоих баллонов.
Для идеального газа (или двух разных газов), находящегося в сообщающихся баллонах , при открытии крана некоторые параметры становятся одинаковыми:
- давление газа (или смеси газов) после открытия крана уравнивается:
- газ (или смесь газов) после открытия крана занимает весь предоставленный ему объем, т.е. объем обоих сосудов:
где V 1 — объем первого баллона; V 2 — объем второго баллона;
- температура газа (или смеси газов) после открытия крана уравнивается:
- плотность газа ρ и его концентрация n в обоих баллонах становятся одинаковыми:
ρ = const, n = const,
Если баллоны имеют одинаковый объем , то массы газа (или смеси газов) в каждом баллоне после открытия крана становятся одинаковыми :
m ′ 1 = m ′ 2 = m ′ = m 1 + m 2 2 ,
где m ′ 1 — масса газа (или смеси газов) в первом баллоне после открытия крана; m ′ 2 — масса газа (или смеси газов) во втором баллоне после открытия крана; m ′ — масса газа (или смеси газов) в каждом баллоне после открытия крана; m 1 — масса газа в первом баллоне до открытия крана; m 2 — масса газа во втором баллоне до открытия крана.
Масса газа, перешедшего из одного сосуда в другой в результате открытия крана, определяется следующими выражениями:
- изменение массы газа в первом баллоне
Δ m 1 = | m ′ 1 − m 1 | = | m 1 + m 2 2 − m 1 | = | m 2 − m 1 | 2 ;
- изменение массы газа во втором баллоне
Δ m 2 = | m ′ 2 − m 2 | = | m 1 + m 2 2 − m 2 | = | m 1 − m 2 | 2 .
Изменения массы газа (или смеси газов) в обоих баллонах одинаковы :
Δ m 1 = Δ m 2 = Δ m = | m 2 − m 1 | 2 ,
т.е. сколько газа ушло из баллона с большей массой газа — столько же газа пришло в баллон с меньшей массой.
Если баллоны имеют одинаковый объем , то количества газа (или смеси газов) в каждом баллоне после открытия крана становятся одинаковыми :
ν ′ 1 = ν ′ 2 = ν ′ = ν 1 + ν 2 2 ,
где ν ′ 1 — количество газа (или смеси газов) в первом баллоне после открытия крана; ν ′ 2 — количество газа (или смеси газов) во втором баллоне после открытия крана; ν′ — количество газа (или смеси газов) в каждом баллоне после открытия крана; ν1 — количество газа в первом баллоне до открытия крана; ν2 — количество газа во втором баллоне до открытия крана.
Количество газа, перешедшего из одного сосуда в другой в результате открытия крана, определяется следующими выражениями:
- изменение количества газа в первом баллоне
Δ ν 1 = | ν ′ 1 − ν 1 | = | ν 1 + ν 2 2 − ν 1 | = | ν 2 − ν 1 | 2 ;
- изменение количества газа во втором баллоне
Δ ν 2 = | ν ′ 2 − ν 2 | = | ν 1 + ν 2 2 − ν 2 | = | ν 1 − ν 2 | 2 .
Изменения количества газа (или смеси газов) в обоих баллонах одинаковы :
Δ ν 1 = Δ ν 2 = Δ ν = | ν 2 − ν 1 | 2 ,
т.е. сколько газа ушло из баллона с большим количеством газа — столько же газа пришло в баллон с меньшим количеством.
Для идеального газа (или двух разных газов), находящегося в сообщающихся баллонах, при открытии крана давление становится одинаковым:
и определяется по закону Дальтона (для смеси газов) —
где p 1, p 2 — парциальные давления компонентов смеси.
Парциальные давления компонентов смеси могут быть рассчитаны следующим образом:
- с помощью уравнения Менделеева — Клапейрона; тогда давление определяется формулой
p = ( ν 1 + ν 2 ) R T V 1 + V 2 ,
где ν1 — количество вещества первого компонента смеси; ν2 — количество вещества второго компонента смеси; R — универсальная газовая постоянная, R ≈ 8,31 Дж/(моль ⋅ К); T — температура смеси; V 1 — объем первого баллона; V 2 — объем второго баллона;
- с помощью основного уравнения молекулярно-кинетической теории; тогда давление определяется формулой
p = ( N 1 + N 2 ) k T V 1 + V 2 ,
где N 1 — количество молекул первого компонента смеси; N 2 — количество молекул второго компонента смеси; k — постоянная Больцмана, k = 1,38 ⋅ 10 −23 Дж/К.
Пример 26. Определить среднюю молярную массу смеси газов, состоящей из 3,0 кг водорода, 1,0 кг гелия и 8,0 кг кислорода. Молярные массы водорода, гелия и кислорода равны 2,0, 4,0 и 32 г/моль соответственно.
Решение . Средняя молярная масса смеси определяется формулой
где m — масса смеси; ν — количество вещества в смеси.
Массу смеси найдем как сумму масс —
где m 1 — масса водорода; m 2 — масса гелия; m 3 — масса кислорода.
Аналогично найдем количество вещества —
где ν1 — количество водорода в смеси, ν1 = m 1/ M 1; M 1 — молярная масса водорода; ν2 — количество гелия в смеси, ν2 = m 2/ M 2; M 2 — молярная масса гелия; ν3 — количество кислорода в смеси, ν3 = m 3/ M 3; M 3 — молярная масса кислорода.
Подстановка выражений для массы и количества вещества в исходную формулу дает
〈 M 〉 = m 1 + m 2 + m 3 ν 1 + ν 2 + ν 3 = m 1 + m 2 + m 3 m 1 M 1 + m 2 M 2 + m 3 M 3 .
〈 M 〉 = 3,0 + 1,0 + 8,0 3,0 2,0 ⋅ 10 − 3 + 1,0 4,0 ⋅ 10 − 3 + 8,0 32 ⋅ 10 − 3 =
= 6,0 ⋅ 10 − 3 кг/моль = 6,0 г/моль .
Пример 27. Плотность смеси газов, состоящей из гелия и водорода, при давлении 3,50 МПа и температуре 300 К, равна 4,50 кг/м 3 . Определить массу гелия в 4,00 м 3 смеси. Молярные массы водорода и гелия равны 0,002 и 0,004 кг/моль соответственно.
Решение . Чтобы найти массу гелия m 2 в указанном объеме, необходимо определить плотность гелия в смеси:
где ρ 2 — плотность гелия; V — объем смеси газов.
Плотность смеси определяется как сумма плотностей водорода и гелия:
где ρ1 — плотность водорода.
Однако записанная формула содержит две неизвестные величины — плотности водорода и гелия. Для определения указанных величин требуется еще одно уравнение, в которое входят плотности водорода и гелия.
Запишем закон Дальтона для давления смеси газов:
где p 1 — давление водорода; p 2 — давление гелия.
Для определения давлений газов запишем уравнение состояния в следующей форме:
p 1 = ρ 1 R T M 1 ,
p 2 = ρ 2 R T M 2 ,
где R — универсальная газовая постоянная, R ≈ 8,31 Дж/(моль ⋅ К); T — температура смеси; M 1 — молярная масса водорода; M 2 — молярная масса гелия.
Подстановка выражений для давлений водорода и гелия в закон Дальтона дает
p = ρ 1 R T M 1 + ρ 2 R T M 2 .
Получено еще одно уравнение с двумя неизвестными величинами — плотностью водорода и плотностью гелия.
Формулы для расчета плотности и давления смеси образуют систему уравнений:
ρ = ρ 1 + ρ 2 , p = ρ 1 R T M 1 + ρ 2 R T M 2 , >
которую требуется решить относительно плотности гелия.
Для этого выразим плотности водорода из первого и второго уравнений
ρ 1 = ρ − ρ 2 , ρ 1 = M 1 R T ( p − ρ 2 R T M 2 ) >
и приравняем их правые части:
ρ − ρ 2 = M 1 R T ( p − ρ 2 R T M 2 ) .
ρ 2 = M 2 M 2 − M 1 ( ρ − p M 1 R T ) .
Подставим полученное выражение в формулу для вычисления массы гелия
m 2 = M 2 V M 2 − M 1 ( ρ − p M 1 R T )
и произведем расчет:
m 2 = 0,004 ⋅ 4,00 0,004 − 0,002 ( 4,50 − 3,50 ⋅ 10 6 0,002 8,31 ⋅ 300 ) ≈ 13,6 кг.
Масса гелия в указанном объеме смеси составляет 13,6 кг.
Как найти среднюю молярную массу смеси газов
Если идеальные газы находятся в сообщающихся баллонах, разделенных краном, то при открытии крана газы в баллонах смешиваются между собой и каждый из них заполняет объем обоих баллонов. Для
Источник: vedy.by
- Главная   /  ТеплотехникаТехническая термодинамика
- Расчет смеси газов
Задача 229
Условие: Произвести расчет термодинамических параметров газовой смеси, совершающей изобарное расширение до объема V2 , если известны начальная температура t1=50ºC, начальное давление р1=3 МПа и масса Мсм=4 кг. Определить газовую постоянную и кажущуюся молекулярную массу, начальный объем V1 , основные параметры в конечном состоянии, изменение внутренней энергии, энтальпии, энтропии, теплоту и работу расширения в процессе 1-2. При определении молярной массы и газовой постоянной обратить внимание на способ задания смеси. Теплоемкость компонентов смеси рассчитать с использованием закона Майера. Для расчета параметров состояния использовать уравнения состояния идеальных газов. — Правильность вычисления энергетических параметров контролировать по выполнению 1 закона термодинамики. Состав газовой смеси по объему: Cp=96, 06%; C2p=2, 0%; C3H8=0, 3%; C4h20=0, 01%; C5h22=0, 1%; N2=1, 0%; CO2=0, 1%; h3O = 0, 43%; ρ=V2/V1=3, 5.
Условие: По заданному составу газовой смеси расчитать: кажущуюся (среднюю) молекулярную массу смеси, газовую постоянную, плотность, среднюю массовую теплоемкость смеси при постоянном давлении в пределах температур от t1=100ºC до t2=835ºC ,колличество тепла,полученное газовой смесью при её нагревании от t1=100ºC до t2=835ºC. Массовая доля азота — 0,6; воды — 0,2; углекислого газа — 0,2. Обьем смеси V =300 м3, давление — р1=3 бар.
Задача 111
Условие: Произвести расчет термодинамических параметров газовой смеси, совершающей изобарное расширение до объема V2 , если известны начальная температура t1=70ºC, начальное давление р1=5 МПа и масса Мсм=2 кг. Определить газовую постоянную и кажущуюся молекулярную массу, начальный объем V1 , основные параметры в конечном состоянии, изменение внутренней энергии, энтальпии, энтропии, теплоту и работу расширения в процессе 1-2.- При определении молярной массы и газовой постоянной обратить внимание на способ задания смеси. — Теплоемкость компонентов смеси рассчитать с использованием закона Майера.- Для расчета параметров состояния использовать уравнения состояния идеальных газов.- Правильность вычисления энергетических параметров контролировать по выполнению 1 закона термодинамики. Состав газовой смеси по объему: Cp=94, 2%; C2p=3, 0%; C3H8=0, 9%; C4h20=0, 17%;
C5h22=0, 22%; N2=0, 9%; CO2=0, 3%; h3O = 0, 31%; ρ=V2/V1=3, 5.
Как найти среднюю молярную массу смеси газов
Главная   /  ТеплотехникаТехническая термодинамика Расчет смеси газов Задача 229 Условие: Произвести расчет термодинамических параметров газовой смеси,
Источник: x-term.ru
1.5. Смеси газов
Возникает естественный вопрос: какими уравнениями описываются смеси идеальных газов? Ведь с чистыми газами нам редко приходится встречаться в природе. Например, наша естественная среда обитания — воздух — состоит из азота N2 (78,08 %), кислорода O2 (20,95 %), инертных газов (0,94 %), углекислого газа СO2 (0,03 %).
Пусть в некотором объеме V при некоторой температуре Т содержится смесь газов (которые мы будем нумеровать
индексом i ). Роль каждого компонента смеси будем характеризовать массовой долей:
где mi — масса i-го компонента. Наша задача — написать уравнение, подобное уравнению Клапейрона — Менделеева, и разобраться с эффективным числом степеней свободы смеси, где могут содержаться и одноатомные, и многоатомные молекулы.
Прежде всего, заметим, что мы рассматриваем идеальные газы. Молекулы не взаимодействуют друг с другом, и потому каждый компонент не мешает любому другому «жить» в том же общем сосуде. Различные газы в сосуде, в силу их предполагаемой идеальности, просто «не замечают» друг друга. Поэтому для каждого из компонентов справедливо одно и то же уравнение Клапейрона — Менделеева:
где ni — число молей вещества в i -м компоненте. Полное число n молей в смеси равно сумме числа молей ni в каждом из компонентов:
Аналогично, полная масса смеси равна сумме масс каждого из компонентов
и естественно определить молярную массу смеси m как массу одного моля смеси:
Введем величину, называемую парциальным давлением.
Парциальное давление pi — это давление, оказываемое i-м компонентом газовой смеси.
Имеет место закон Дальтона для газовой смеси:
Полное давление газовой смеси равно сумме всех парциальных давлений
Как найти среднюю молярную массу смеси газов
1.5. Смеси газов Возникает естественный вопрос: какими уравнениями описываются смеси идеальных газов? Ведь с чистыми газами нам редко приходится встречаться в природе. Например, наша естественная
Источник: online.mephi.ru
ВикиЧтение
Теплотехника
Бурханова Наталья
28. Средняя молярная масса смеси газов
Уравнение для нахождения удельной газовой постоянной смеси:
R = еgiRi= 8314,2(g1/ M1+ g2/ M2+… + gn/ Mn)
Зная молярную массу смеси, можно найти газовую постоянную смеси:
R = 8,314 / M.
Зная объемный состав смеси, получим следующие формулы:
gi= (R / Ri),
еgi = Rе(ri / Ri) = 1.
Формула для вычисления удельной газовой постоянной примет вид:
R= 1 / е(ri/Ri) = 1 / (r1/ R1 + R2+… + rn / Rn).
Средняя молярная масса смеси газов является достаточно условной величиной:
M = 8314,2 / R,
M= 8314,2 / (g1R1+ g2R2 +. + gnRn).
Если произвести замену удельных газовых постоянных R1, R2,…, Rn их значениями из уравнения Клайперона, найдем среднюю молярную массу смеси газов, если смесь определяется массовыми долями:
M= 1 / (r1/ M1+ r2/ M2+. + rn/ Mn).
В случае, когда смесь определяется объемными долями, получаем следующее выражение:
R= 1 / еriRi = 8314,2 / еriMi.
Зная, что R = 8314,2 / M, получим:
M= еriMi = r1M1 + r2M2 +. + rnMn.
Таким образом, средняя молярная масса смеси газов определяется суммой произведений объемных долей на молярные массы отдельных газов, из которых состоит смесь.
Данный текст является ознакомительным фрагментом.
Читайте также
Выхлоп двигателя дымный. В картер двигателя поступает повышенный объем газов
Выхлоп двигателя дымный. В картер двигателя поступает повышенный объем газов
Диагностирование двигателя по цвету дыма из выхлопной трубы
Сине-белый дым – неустойчивая работа двигателя. Рабочая фаска клапана подгорела. Оценить состояние газораспределительного
43. Равномерное движение и коэффициент сопротивления по длине. Формула Шези. Средняя скорость и расход потока
43. Равномерное движение и коэффициент сопротивления по длине. Формула Шези. Средняя скорость и расход потока
При ламинарном движении (если оно равномерное) ни живое сечение, ни средняя скорость, ни эпюра скоростей по длине не меняются со временем.При равномерном движении
42. Уравнение состояния для реальных газов М. Н. Вукаловича и И. И. Новикова
42. Уравнение состояния для реальных газов М. Н. Вукаловича и И. И. Новикова
Универсальное уравнение, описывающее состояние любых реальных газов, было получено в 1939 г. русскими учеными И. И. Новиковым и М. Н. Вукаловичем. В немуже учитывалось явление силового взаимодействия
8.2.3.1.8 Цвет, масса и качество бумаги
8.2.3.1.8 Цвет, масса и качество бумаги
Должны быть определены цвет, масса и качество (номер) бумаги, используемой для документации.Примечание — Если требуется конкретный номер бумаги, это должно быть
10.5. Влияние газов на свойства серебряных сплавов
10.5. Влияние газов на свойства серебряных сплавов
Серебро не очень активно взаимодействует с различными газами, за исключением кислорода. Так, азот не растворяется ни в жидком, ни в твердом серебре. Ничтожна растворимость инертных газов в серебре. Растворимость водорода в
11.5. Влияние газов на свойства сплавов золота
11.5. Влияние газов на свойства сплавов золота
Встречающиеся при плавке газы, такие как кислород, водород, углеводороды, азот, моно– и диоксид углерода, сернистый газ, пары воды, образующиеся при попадании водорода в кислородосодержащий раствор, и т. п., ни в твердом, ни в
§ 3.8 Состав и масса элементарных частиц
§ 3.8 Состав и масса элементарных частиц
Последовательная теория элементарных частиц, которая предсказывала бы возможные значения масс элементарных частиц и другие их внутренние характеристики, ещё не создана.
Советский Энциклопедический Словарь
В настоящее время
III. Масса, пространство и другие формальные категории Книга третья, рассказывающая о чувствах, пробуждаемых в нас зодчеством
III. Масса, пространство и другие формальные категории
Книга третья, рассказывающая о чувствах, пробуждаемых в нас зодчеством
В первой книге, да и отчасти во второй мы говорили преимущественно о языке архитектуры. Как будто само здание или его автор что-то хотят нам
Повышенная токсичность выхлопных газов
Повышенная токсичность выхлопных газов
Состав и количество токсичных компонентов в отработавших газах двигателя, зависят главным образом от его технического состояния, все прочие факторы изложены ниже.Содержание СО и СН в отработавших газах автомобиля определять при