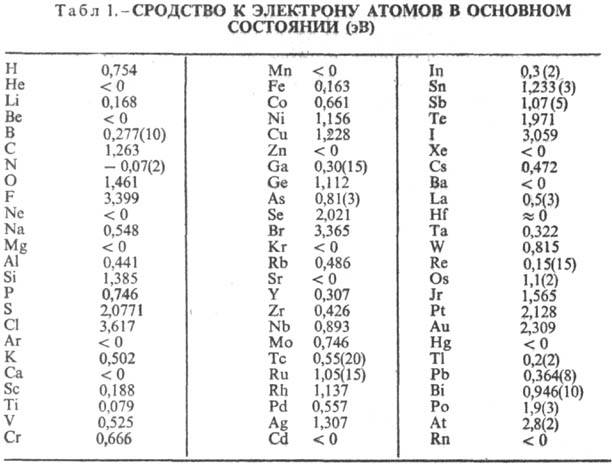
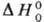СРОДСТВО К ЭЛЕКТРОНУ
СРОДСТВО К ЭЛЕКТРОНУ
частицы (молекулы, атома, иона), миним. энергия А, необходимая
для удаления электрона из соответствующего отрицат. иона на бесконечность. Для
частицы X сродство к электрону относится к процессу:
Сродство к электрону равно энергии ионизации
E отрицат. иона X—(первому потенциалу ионизации U1,
измеряется в эВ). По аналогии с потенциалом ионизации различают первое
и второе сродство к электрону, а также вертикальное и адиабатическое сродство к электрону многоатомной
частицы. Термодинамич. определение сродства к электрону-стандартная энтальпия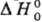
(1) при абс. нуле т-ры:
= АNА (NА~постоянная
Авогадро).
Надежных эксперим. данных
по сродству к электрону атомов и молекул до сер. 60-х гг. 20 в. практически не существовало.
В настоящее время использование равновесных методов получения и исследования
отрицат. ионов позволило получить первые сродства к электрону для большинства элементов периодич.
системы и неск. сотен орг. и неорг. молекул. Наиб. перспективные методы определения
сродства к электрону-фотоэлектронная спектроскопия (точность + 0,01 эВ) и масс-спектрометрич.
исследование равновесий ионно-молекулярных реакций. Квантовомех. расчеты
сродства к электрону аналогичны расчетам потенциалов ионизации. Наилучшая точность для многоатомных
молекул составляет 0,05-0,1 эВ.
Наибольшим сродством к электрону обладают
атомы галогенов. Для ряда элементов сродство к электрону близко к нулю или меньше нуля. Последнее
означает, что для данного элемента устойчивого отрицат. иона не существует.
В табл. 1 приведены значения сродства к электрону атомов, полученные методом фотоэлектронной
спектроскопии (работы У. Лайнебергера с сотрудниками).
Сродство к электрону молекул составляет,
как правило, От 0 до 4 эВ (табл. 2).
Обнаружены молекулы с очень
высокими значениями сродства к электрону-гекса-, пента- и тетрафториды переходных металлов.
Наибольшим из известных в настоящее время значений сродства к электрону обладает PtF6
(7,00 b 0,35 эВ).
Сродство к электрону определяет окислит.
способность частицы. Молекулы с высокими значениями сродства к электрону-сильные окислители.
С их помощью были получены хим. соед. благородных газов, соед. внедрения в графите.
Существование многозарядных
(Двух- и более) многоатомных отрицат. ионов в основном состоянии в газовой фазе
до сих пор экспериментально не подтверждено. Возможен лишь квантовомех. расчет
или расчет по циклу Борна-Габера второго или более высокого сродства к электрону для молекул.
Для ряда молекул второе сродство к электрону, полученное таким способом, является существенно
положительным (PtF6 3,8 эВ, CrF6 2,44 эВ).
Лит.: Christophoroit
А., McCorkle D., Christophorou L., «Electron-Mob Interactions and
Their’Applications», 1984, v. 2, p. 423-641; Hotop H., Lineberger W.C.,
«Phys. Chem. Ref. Data», 1985, v. 14, № 3, p. 731-50.
М. В. Коробов.

РАЗДЕЛ 2. СТРОЕНИЕ АТОМА И ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ МЕНДЕЛЕЕВА
Тема 4. Периодическая система элементов Д. И. Менделеева
Таблица 4.1
Энергия ионизации атомов некоторых элементов (эВ)
|
Элемент |
I1 |
I2 |
I3, |
I4 |
I5 |
|
Н |
13,599 |
||||
|
Не |
24,588 |
54,418 |
|||
|
Li |
5,392 |
75,641 |
122,42 |
||
|
Be |
9,323 |
18,211 |
153,85 |
217,657 |
|
|
В |
8,298 |
25,156 |
37,92 |
259,298 |
340,127 |
|
С |
11,260 |
24,383 |
47,87 |
64,48 |
392,00 |
Величина энергии ионизации может служить мерой большей или меньшей металличности элемента: чем меньше энергия ионизации, тем сильнее должны быть металлические свойства элемента.
Рассмотрим, как в связи с этим изменяются первые энергии ионизации c увеличением заряда ядра у атомов одной и той же подгруппы периодической системы (табл. 4.2.).
Таблица 4.2
Значение первого потенциала ионизации (эВ) атомов некоторых элементов
|
VА-группа |
Z |
I1, В |
V В-группа |
Z |
I1, В |
|
As |
33 |
9,82 |
V |
23 |
6,74 |
|
Sb |
51 |
8,64 |
Nb |
41 |
6,88 |
|
Bi |
83 |
7,29 |
Ta |
73 |
7,89 |
Как видно, с увеличением зарядаядраатомов элементов главных подгрупп энергия ионизации уменьшается, что свидетельствует об усилении металлическихсвойстви, соответственно, ослаблениинеметаллическихсвойств.
Эта закономерность связана с возрастанием радиусов атомов. Кроме того, увеличение промежуточных электронных слоев приводит к более сильному экранированию ядра, т. е. к уменьшению его эффективного заряда. Оба эти фактора (растущее удаление внешних электронов от ядра и уменьшение эффективного заряда) приводят к ослаблению связи внешних электронов с ядром и, следовательно, к уменьшению энергии ионизации.
У элементов одного и того же периода при переходе от щелочного металла к инертному газу заряд ядра постепенно возрастает, а радиус атома уменьшается. Поэтому энергия ионизации постепенно увеличивается, а металлические свойства ослабевают.
4.2.3. Сродствокэлектрону
Сродство к электрону − это энергия, выделяющаяся при присоединении
электрона к нейтральному атому (Еср)
Э + е = Э— – Еср.
|
Неорганическая химия. Курс лекций |
-55- |

РАЗДЕЛ 2. СТРОЕНИЕ АТОМА И ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ МЕНДЕЛЕЕВА
Тема 4. Периодическая система элементов Д. И. Менделеева
Сродство к электрону, как и энергия ионизации, обычно выражается в электрон-вольтах. Сродство к электрону численно равно, но противоположно по знаку энергии ионизации отрицательно заряженного иона Э—. Сродство атома к электрону отчасти характеризует окислительную активность простого вещества. Чем больше сродство к электрону, тем выше окислительная способность простого вещества.
Надежные значения сродства к электрону найдены лишь для небольшого числа элементов. Сродство к электрону зависит от электронной конфигурации атома. Так, сродство к электрону атома водорода равно 0,75 эВ, кислорода – 1,47 эВ, фтора – 3,52 эВ.
Сродство к электрону атомов металлов, как правило, близко к нулю или отрицательно; из этого следует, что для атомов большинства металлов присоединение электронов энергетически невыгодно. Сродство же к электрону атомов неметаллов всегда положительно и тем больше, чем ближе к благородному газу расположен неметалл в Периодической системе. Это свидетельствует об усилении неметаллических свойств атомов элементов одного периода по мере повышения заряда ядра.
Понятие электроотрицательности (ЭО) позволяет оценить способность атома данного элемента к оттягиванию на себя электронной плотности по сравнению с другими элементами соединения. Очевидно, что эта способность зависит от энергии ионизации атома и его сродства к электрону. Согласно одному из определений (Малликен) электроотрицательность атома может быть выражена как полусумма его энергии ионизации и сродства к электрону:
ЭО = ½ (I + E).
Имеется около 20 шкал электроотрицательности, в основу расчета значений которых положены разные свойства веществ. Значения электроотрицательностей разных шкал отличаются, но относительное расположение элементов в ряду электроотрицательностей примерно одинаково (табл.4.3).
|
Неорганическая химия. Курс лекций |
-56- |

РАЗДЕЛ 2. СТРОЕНИЕ АТОМА И ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ МЕНДЕЛЕЕВА
Тема 4. Периодическая система элементов Д. И. Менделеева
Таблица 4.3
Относительная электроотрицательность элементов (по Полингу)
|
H |
||||||||||||||||
|
2,1 |
||||||||||||||||
|
Li |
Be |
B |
C |
N |
O |
F |
||||||||||
|
1,0 |
1,5 |
2,0 |
2,5 |
3,0 |
3,5 |
4,0 |
||||||||||
|
Na |
Mg |
Al |
Si |
P |
S |
Cl |
||||||||||
|
0,9 |
1,2 |
1,5 |
1,8 |
2,1 |
2,5 |
3,0 |
||||||||||
|
K |
Ca |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
Ga |
Ge |
As |
Se |
Br |
|
0,8 |
1,0 |
1,3 |
1,5 |
1,6 |
1,6 |
1,5 |
1,8 |
1,9 |
1,9 |
1,9 |
1,6 |
1,6 |
1,8 |
2,0 |
2,4 |
2,8 |
|
Rb |
Sr |
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
In |
Sn |
Sb |
Te |
I |
|
0,8 |
1,0 |
1,2 |
1,4 |
1,6 |
1,8 |
1,9 |
2,2 |
2,2 |
2,2 |
1,9 |
1,7 |
1,7 |
1,8 |
1,9 |
2,1 |
2,5 |
|
Cs |
Ba |
La-Lu* |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
Tl |
Pb |
Bi |
Po |
At |
|
0,7 |
0,9 |
1,0-1,2 |
1,3 |
1,5 |
1,7 |
1,9 |
2,2 |
2,2 |
2,2 |
2,4 |
1,9 |
1,8 |
1,9 |
1,9 |
2,0 |
2,2 |
|
Fr |
Ra |
Ac** |
||||||||||||||
|
0,86 |
0,97 |
1,0 |
Строго говоря, элементу нельзя приписать постоянную электроотрицательность. Она зависит от многих факторов, в частности, от валентного состояния элемента, типа соединения, в которое он входит, и пр. Тем не менее это понятие полезно для качественного объяснения свойств химической связи и соединений.
4.2.5.Кислотно-основныесвойстваоксидовигидроксидов
Впериодической зависимости от заряда ядра и радиуса атома находятся не только свойства элементов, но и их соединений.
Впериоде с уменьшением радиуса атомов основный характер оксидов
игидроксидов постепенно ослабевает, переходя в амфотерный, а затем в кислотный, усиливающийся к концу периода.
Например, в ряду элементов третьего периода слева направо наблюдается следующее изменение кислотно-основных свойств гидроксидов:
|
NaOH, Mg(OH)2 |
Al (OH)3 |
H2SiO3, H3PO4, H2SO4, HClO4 |
|
Основные |
Амфотерный |
Кислотные |
Усиление кислотных свойств→
Аналогичный характер изменения кислотно-основных свойств оксидов
игидроксидов наблюдается и для элементов других периодов.
Вгруппах сверху вниз усиливается основный характер оксидов и гидроксидов и ослабляется кислотный характер, что объясняется увеличением радиуса элементов и ослаблением связи ЭО.
Так, в группе IA все элементы образуют основные оксиды и гидрокси-
|
Неорганическая химия. Курс лекций |
-57- |

РАЗДЕЛ 2. СТРОЕНИЕ АТОМА И ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ МЕНДЕЛЕЕВА
Тема 4. Периодическая система элементов Д. И. Менделеева
ды. Атомы Cu, Ag и Au, составляющие IВ подгруппу, имеют также на внешнем слое один электрон. Но однозарядные ионы данных металлов меньше ионов щелочных металлов, поэтому связь ЭО более прочная. Действительно, гидроксиды названных металлов – слабые основания.
Такая закономерность сохраняется и в других группах элементов Периодической системы, при этом возрастает стремление их к проявлению переменных степеней окисления.
Изменение кислотно-основных свойств оксидов в зависимости от
степени окисления элемента можно показать на примере одного эле-
мента Mn+2 -Mn+4— Mn+6— Mn+7.
Связь ЭО с увеличением степени окисления элемента упрочняется и, таким образом, усиливаются кислотные свойства оксидов и гидроксидов.
|
MnO |
MnO2 |
MnO3 |
Mn2O7 |
|
Mn(OH)2 |
Mn(OH)4 |
H2MnO4 |
HMnO4 |
|
H2MnO3 |
Следует отметить, что рассмотренная закономерность изменения кислотно – основных свойств оксидов и гидроксидов наиболее полно проявляется у элементов главных подгрупп; у элементов побочных подгрупп иногда осложняется влиянием побочных факторов, о которых говорилось выше.
4.2.6.Окислительно-восстановительныесвойства
Впериодах с повышением порядкового номера элемента восстановительные свойства простых веществ понижаются, а окислительные возрастают
истановятся максимальными у галогенов.
Вгруппах периодической системы с повышением порядкового номера элемента, т. е. сверху вниз, возрастают восстановительные свойства простых веществ, а окислительные – убывают.
Наиболее ярко восстановительные свойства выражены у щелочных металлов (самый активный из них цезий), а окислительные – у галогенов (самый активный – фтор).
Окислительные или восстановительные свойства сложных веществ зависят от степени окисления атома, изменяющего ее в ходе реакции. Соединения, включающие атомы элементов в высшей степени окисления, будут окислителями
(HNO3 – окислитель за счет азота (+V), KMnO4 – за счет марганца (+VII), K2Cr2O7
– засчетхрома(+VI) ит. д.), асодержащиеатомывминимальнойстепениокисле-
ния – восстановителями (KI, H2S). Вещества, в составе которых атомы в промежуточных степенях окисления, способны как повышать, так и понижать степень окисления, следовательно, могут быть как восстановителями, так и окислителями,
т. е. проявляютокислительно-восстановительнуюдвойственность.
|
Неорганическая химия. Курс лекций |
-58- |

РАЗДЕЛ 2. СТРОЕНИЕ АТОМА И ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ МЕНДЕЛЕЕВА
Тема 4. Периодическая система элементов Д. И. Менделеева
Контрольныевопросыиупражнения
1.Составьте электронные формулы атомов элементов 4-го периода VII группы. Какой из этих элементов способен образовывать газообразный гидрид и какова формула этого гидрида?
2.Определите период, группу, подгруппу элементов, электронная конфигурация которых имеет следующие окончания:
l) …5s14d5; 2)… 6s26p2; 3) … 3p64s2 .
К какому семейству элементов они относятся, какую максимальную степень окисления они могут проявлять?
3.Составьте электронные формулы атомов азота, имеющих степени окисления+ 5 и– 3 иукажитечислоэлектроновнавнешнемуровне.
4.Определите, сколько неспаренных электронов содержится в атоме молибдена Мо.
5.Укажите число электронов на внешнем уровне у атомов йода, имеющих степень окисления + 5 и — 1.
6.Определите суммарный спин электронов предвнешнего уровня в атомах меди и олова.
7.Составьте электронную формулу атома железа и укажите сумму значений орбитального квантового числа для всех электронов предвнешнего уровня.
8.Определите сумму значений главного и орбитального квантовых чисел последнего электрона предвнешнего уровня атома никеля.
9.Определите порядковый номер элемента, у атома которого внешние
электроны характеризуются следующими значениями квантовых чисел: n = 6; l = 1; ml = 0; s = ½.
10.Определите максимальное число неспаренных электронов, которое могут иметь атомы бериллия, кремния и серы при их переходе в возбужденное состояние.
11.Укажите, как изменяется (растет или уменьшается) атомный радиус от магния к хлору.
12.Укажите, как изменяется (растет или убывает) энергия ионизации атома от бериллия к фтору.
13.Укажите, как изменяется (растет или убывает) электроотрицательность атома от магния к барию.
14.Напишите электронную конфигурацию атома Сr и иона Сr3+ в невозбужденном состоянии и укажите все квантовые числа валентных электронов атома хрома.
15.В приведенных ниже парах выберите частицу, для которой значение первого потенциала ионизации наибольшее:
a) Ne, Na; б) S, S+; в) С, N; г) Na+, Mg+; д) N, О.
16.Объясните, почему первые потенциалы ионизации переходных элементов 4-го периода имеют близкие значения.
17.В каждой из приведенных пар выберите частицу, имеющую
|
Неорганическая химия. Курс лекций |
-59- |

РАЗДЕЛ 2. СТРОЕНИЕ АТОМА И ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ МЕНДЕЛЕЕВА
Тема 4. Периодическая система элементов Д. И. Менделеева
больший радиус на 56:
a) Fe2+, Fe3+; б) S, Se; в) С, N; г) Na+, Mg2+; д) О—, О+; е) Mо, Та.
18.Олово Sn находится в 5-м периоде и 4A подгруппе Периодической таблицы. Напишите электронную конфигурацию валентных электронов атома в основном состоянии, напишите формулу его высшего оксида и водородного соединения. Сравните радиус его атома с радиусом атома свинца.
19.Исходя из положения р-элементов в шестой группе периодической системы, укажите, как изменяются кислотные свойства соединений
H2S, H2Se, H2Te.
20.Атомы элементов, применяемых в радиотехнике как полупроводники, имеют электронную конфигурацию валентных электронов: 4s24p2 и 5s25p3. Укажите положение элементов в Периодической системе. Какие степени окисления могут они проявлять в соединениях?
|
Неорганическая химия. Курс лекций |
-60- |
Соседние файлы в папке лекции биологам
- #
- #
- #
From Wikipedia, the free encyclopedia
The electron affinity (Eea) of an atom or molecule is defined as the amount of energy released when an electron attaches to a neutral atom or molecule in the gaseous state to form an anion.
-
- X(g) + e− → X−(g) + energy
This differs by sign from the energy change of electron capture ionization.[1] The electron affinity is positive when energy is released on electron capture.
In solid state physics, the electron affinity for a surface is defined somewhat differently (see below).
Measurement and use of electron affinity[edit]
This property is used to measure atoms and molecules in the gaseous state only, since in a solid or liquid state their energy levels would be changed by contact with other atoms or molecules.
A list of the electron affinities was used by Robert S. Mulliken to develop an electronegativity scale for atoms, equal to the average of the electrons
affinity and ionization potential.[2][3] Other theoretical concepts that use electron affinity include electronic chemical potential and chemical hardness. Another example, a molecule or atom that has a more positive value of electron affinity than another is often called an electron acceptor and the less positive an electron donor. Together they may undergo charge-transfer reactions.
Sign convention[edit]
To use electron affinities properly, it is essential to keep track of sign. For any reaction that releases energy, the change ΔE in total energy has a negative value and the reaction is called an exothermic process. Electron capture for almost all non-noble gas atoms involves the release of energy[4] and thus is exothermic. The positive values that are listed in tables of Eea are amounts or magnitudes. It is the word «released» within the definition «energy released» that supplies the negative sign to ΔE. Confusion arises in mistaking Eea for a change in energy, ΔE, in which case the positive values listed in tables would be for an endo- not exo-thermic process. The relation between the two is Eea = −ΔE(attach).
However, if the value assigned to Eea is negative, the negative sign implies a reversal of direction, and energy is required to attach an electron. In this case, the electron capture is an endothermic process and the relationship, Eea = −ΔE(attach) is still valid. Negative values typically arise for the capture of a second electron, but also for the nitrogen atom.
The usual expression for calculating Eea when an electron is attached is
- Eea = (Einitial − Efinal)attach = −ΔE(attach)
This expression does follow the convention ΔX = X(final) − X(initial) since −ΔE = −(E(final) − E(initial)) = E(initial) − E(final).
Equivalently, electron affinity can also be defined as the amount of energy required to detach an electron from the atom while it holds a single-excess-electron thus making the atom a negative ion,[1] i.e. the energy change for the process
- X− → X + e−
If the same table is employed for the forward and reverse reactions, without switching signs, care must be taken to apply the correct definition to the corresponding direction, attachment (release) or detachment (require). Since almost all detachments (require +) an amount of energy listed on the table, those detachment reactions are endothermic, or ΔE(detach) > 0.
- Eea = (Efinal − Einitial)detach = ΔE(detach) = −ΔE(attach).
Electron affinities of the elements[edit]
Electron affinity (Eea) vs atomic number (Z). Note the sign convention explanation in the previous section.
Although Eea varies greatly across the periodic table, some patterns emerge. Generally, nonmetals have more positive Eea than metals. Atoms whose anions are more stable than neutral atoms have a greater Eea. Chlorine most strongly attracts extra electrons; neon most weakly attracts an extra electron. The electron affinities of the noble gases have not been conclusively measured, so they may or may not have slightly negative values.
Eea generally increases across a period (row) in the periodic table prior to reaching group 18. This is caused by the filling of the valence shell of the atom; a group 17 atom releases more energy than a group 1 atom on gaining an electron because it obtains a filled valence shell and therefore is more stable. In group 18, the valence shell is full, meaning that added electrons are unstable, tending to be ejected very quickly.
Counterintuitively, Eea does not decrease when progressing down most columns of the periodic table. For example, Eea actually increases consistently on descending the column for the group 2 data. Thus, electron affinity follows the same «left-right» trend as electronegativity, but not the «up-down» trend.
The following data are quoted in kJ/mol.
Molecular electron affinities[edit]
The electron affinity of molecules is a complicated function of their electronic structure.
For instance the electron affinity for benzene is negative, as is that of naphthalene, while those of anthracene, phenanthrene and pyrene are positive. In silico experiments show that the electron affinity of hexacyanobenzene surpasses that of fullerene.[5]
«Electron affinity» as defined in solid state physics[edit]
In the field of solid state physics, the electron affinity is defined differently than in chemistry and atomic physics. For a semiconductor-vacuum interface (that is, the surface of a semiconductor), electron affinity, typically denoted by EEA or χ, is defined as the energy obtained by moving an electron from the vacuum just outside the semiconductor to the bottom of the conduction band just inside the semiconductor:[6]
In an intrinsic semiconductor at absolute zero, this concept is functionally analogous to the chemistry definition of electron affinity, since an added electron will spontaneously go to the bottom of the conduction band. At nonzero temperature, and for other materials (metals, semimetals, heavily doped semiconductors), the analogy does not hold since an added electron will instead go to the Fermi level on average. In any case, the value of the electron affinity of a solid substance is very different from the chemistry and atomic physics electron affinity value for an atom of the same substance in gas phase. For example, a silicon crystal surface has electron affinity 4.05 eV, whereas an isolated silicon atom has electron affinity 1.39 eV.
The electron affinity of a surface is closely related to, but distinct from, its work function. The work function is the thermodynamic work that can be obtained by reversibly and isothermally removing an electron from the material to vacuum; this thermodynamic electron goes to the Fermi level on average, not the conduction band edge: 
In semiconductor physics, the primary use of the electron affinity is not actually in the analysis of semiconductor–vacuum surfaces, but rather in heuristic electron affinity rules for estimating the band bending that occurs at the interface of two materials, in particular metal–semiconductor junctions and semiconductor heterojunctions.
In certain circumstances, the electron affinity may become negative.[7] Often negative electron affinity is desired to obtain efficient cathodes that can supply electrons to the vacuum with little energy loss. The observed electron yield as a function of various parameters such as bias voltage or illumination conditions can be used to describe these structures with band diagrams in which the electron affinity is one parameter. For one illustration of the apparent effect of surface termination on electron emission, see Figure 3 in Marchywka Effect.
See also[edit]
- Ionization energy — a closely related concept describing the energy required to remove an electron from a neutral atom or molecule
- One-electron reduction
- Electron-capture mass spectrometry
- Electronegativity
- Valence electron
- Vacuum level
- Electron donor
References[edit]
- ^ a b IUPAC, Compendium of Chemical Terminology, 2nd ed. (the «Gold Book») (1997). Online corrected version: (2006–) «Electron affinity». doi:10.1351/goldbook.E01977
- ^ Robert S. Mulliken, Journal of Chemical Physics, 1934, 2, 782.
- ^ Modern Physical Organic Chemistry, Eric V. Anslyn and Dennis A. Dougherty, University Science Books, 2006, ISBN 978-1-891389-31-3
- ^ Chemical Principles the Quest for Insight, Peter Atkins and Loretta Jones, Freeman, New York, 2010 ISBN 978-1-4292-1955-6
- ^ Remarkable electron accepting properties of the simplest benzenoid cyanocarbons: hexacyanobenzene, octacyanonaphthalene and decacyanoanthracene Xiuhui Zhang, Qianshu Li, Justin B. Ingels, Andrew C. Simmonett, Steven E. Wheeler, Yaoming Xie, R. Bruce King, Henry F. Schaefer III and F. Albert Cotton Chemical Communications, 2006, 758–760 Abstract
- ^ Tung, Raymond T. «Free Surfaces of Semiconductors». Brooklyn College.
- ^ Himpsel, F.; Knapp, J.; Vanvechten, J.; Eastman, D. (1979). «Quantum photoyield of diamond(111)—A stable negative-affinity emitter». Physical Review B. 20 (2): 624. Bibcode:1979PhRvB..20..624H. doi:10.1103/PhysRevB.20.624.
- Tro, Nivaldo J. (2008). Chemistry: A Molecular Approach (2nd Edn.). New Jersey: Pearson Prentice Hall. ISBN 0-13-100065-9. pp. 348–349.
External links[edit]
- Electron affinity, definition from the IUPAC Gold Book
Эне́ргией сродства́ а́тома к электро́ну, или просто его сродством к электрону (ε), называют энергию, выделяющуюся в процессе присоединения электрона к свободному атому Э в его основном состоянии с превращением его в отрицательный ион Э− (сродство атома к электрону численно равно, но противоположно по знаку энергии ионизации соответствующего изолированного однозарядного аниона).
- Э + e− = Э− + ε
Сродство к электрону выражают в килоджоулях на моль (кДж/моль) или в электронвольтах на атом (эВ/атом).
В отличие от ионизационного потенциала атома, имеющего всегда эндоэнергетическое значение, сродство атома к электрону описывается как экзоэнергетическими, так и эндоэнергетическими значениями (см. табл.).
Зависимость сродства к электрону атома от атомного номера элемента (экзоэффект указан со знаком минус, эндоэффект со знаком плюс)
| Элемент | ε | Элемент | ε | Элемент | ε |
|---|---|---|---|---|---|
| H | -0,75 | Na | -0,78 | K | -0,92 |
| He | 0,30 | Mg | 0,32 | Ca | 0,40 |
| Li | -0,58 | Al | -0,52 | Sc | 0,14 |
| Be | 0,19 | Si | -1,39 | Ti | -0,40 |
| B | -0,33 | P | -0,78 | V | -0,94 |
| C | -1,12 | S | -2,07 | Cr | -0,98 |
| N | 0,27 | Cl | -3,61 | Mn | 1,07 |
| О | -1,47 | Br | -3,36 | Fe | -0,58 |
| F | -3,45 | I | -3,06 | Co | -0,94 |
| Ne | 0,55 | Ni | -1,28 | ||
| Cu | -1,80 |
Наибольшим сродством к электрону обладают p-элементы VII группы. Наименьшее сродство к электрону у атомов с конфигурацией s2 (Be, Mg, Zn) и s2p6 (Ne, Ar) или с наполовину заполненными p-орбиталями (N, P, As):
| Li | Be | B | C | N | O | F | Ne | |
|---|---|---|---|---|---|---|---|---|
| Электронная конфигурация | s1 | s2 | s2p1 | s2p2 | s2p3 | s2p4 | s2p5 | s2p6 |
| ε, эВ | -0,59 | 0,19 | -0,30 | -1,27 | 0,21 | -1,47 | -3,45 | 0,22 |
Небольшие расхождения в цифрах между табл. 1 и табл. 2 обусловлены тем, что данные взяты из разных источников, а также погрешностью измерений.
Литература
- Ахметов Н.С. Актуальные вопросы курса неорганической химии. — М.:Просвещение, 1991. — 224 с. ISBN 5-09-002630-0
- Корольков Д.В. Основы неорганической химии. — М.:Просвещение, 1982. — 271 с.
| |
|
|---|---|
| Химическая связь: | Ароматичность | Ковалентная связь | Ионная связь | Металлическая связь | Водородная связь | Донорно-акцепторная связь | Таутомерия | Ван-дер-Ваальсова связь |
| Отображение структуры: | Функциональная группа | Структурная формула | Скелетная формула органических соединений | Химическая формула | Лиганд | Координационная геометрия | Координационная сфера |
| Электронные свойства: | Электроотрицательность | Сродство к электрону | Энергия ионизации | Полярность химических связей | Правило октета |
| Стереохимия: | Асимметрический атом | Изомерия | Конфигурация | Хиральность | Конформация |
Сродство к электрону (Eea) атома или молекулы определяется как количество энергии, высвобождаемой, когда электрон присоединяется к нейтральному атому или молекуле в газообразном состоянии с образованием отрицательного иона.
-
- X (g) + e → X (g) + energy
Обратите внимание, что это не то же самое, что изменение энтальпии при ионизации с захватом электронов, которое определяется как отрицательное при высвобождении энергии. Другими словами, это изменение энтальпии и сродство к электрону различаются отрицательным знаком.
В физике твердого тела сродство к электрону для поверхности определяется несколько иначе (см. Ниже ).
Содержание
- 1 Измерение и использование сродства к электрону
- 1.1 Условное обозначение
- 2 Сродство к электрону элементов
- 3 Сродство к электрону
- 4 «Сродство к электрону», как определено в физике твердого тела
- 5 См. Также
- 6 Ссылки
- 7 Внешние ссылки
Измерение и использование сродства к электрону
Это свойство используется для измерения атомов и молекул только в газообразном состоянии, поскольку в в твердом или жидком состоянии их уровни энергии будут изменены при контакте с другими атомами или молекулами.
Список сродства к электрону был использован Робертом С. Малликеном для разработки шкалы электроотрицательности для атомов, равной среднему сродству электронов и потенциал ионизации. Другие теоретические концепции, использующие сродство к электрону, включают электронный химический потенциал и химическую твердость. Другой пример, молекула или атом, у которых более положительное значение сродства к электрону, чем у другого, часто называют акцептором электронов, а менее положительное — донором электронов. Вместе они могут подвергаться реакции передачи заряда.
Соглашение о знаках
Чтобы правильно использовать сродство к электрону, важно отслеживать знак. Для любой реакции, которая высвобождает энергию, изменение ΔE в общей энергии имеет отрицательное значение, и реакция называется экзотермическим процессом. Захват электронов почти всех атомов благородных газов, кроме благородных газов, включает выделение энергии и, следовательно, является экзотермическим. Положительные значения, перечисленные в таблицах E ea, представляют собой суммы или величины. Слово «высвобожденная» в определении «высвобожденная энергия» придает ΔE отрицательный знак. Возникает путаница, когда E ea принимают за изменение энергии, ΔE, и в этом случае положительные значения, перечисленные в таблицах, относятся к эндо-не экзотермическому процессу. Связь между ними: E ea = -ΔE (прикрепить).
Однако, если значение, присвоенное E ea, является отрицательным, отрицательный знак подразумевает изменение направления на противоположное, и для присоединения электрона требуется энергия. В этом случае захват электронов является эндотермическим процессом, и соотношение E ea = -ΔE (присоединить) все еще остается в силе. Отрицательные значения обычно возникают для захвата второго электрона, но также и для атома азота.
Обычное выражение для вычисления E ea при присоединении электрона:
-
- Eea= (E начальный — E конечный) attach = −ΔE (прикрепить)
Это выражение действительно следует соглашению ΔX = X (final) — X (initial), поскольку −ΔE = — (E (final) — E (initial)) = E ( начальная) — Е (конечная).
Эквивалентно сродство к электрону также можно определить как количество энергии, необходимое для отделения электрона от атома, когда он удерживает электрон с единичным избытком, что делает атом отрицательный ион, т.е. изменение энергии для процесса
-
- X → X + e
Если для прямой и обратной реакций используется одна и та же таблица, без знаков переключения, необходимо соблюдать осторожность, чтобы применить правильное определение в соответствующем направлении, присоединение (освобождение) или отсоединение (требуется). Поскольку почти все отделения (требуют +) количества энергии, указанного в таблице, эти реакции отделения являются эндотермическими, или ΔE (отсоединение)>0.
-
- Eea= (E final — E initial) detach = ΔE (detach) = −ΔE (attach).
Сродство элементов к электронам

Хотя E ea сильно различается по периодической таблице, некоторые закономерности проявляются. Как правило, неметаллы имеют более положительное значение E ea, чем металлы. Атомы, анионы которых более стабильны, чем нейтральные атомы, имеют большее значение E ea. Хлор сильнее всего притягивает лишние электроны; неон наиболее слабо притягивает лишний электрон. Электронное сродство благородных газов не было окончательно измерено, поэтому они могут иметь или не иметь слегка отрицательные значения.
Eeaобычно увеличивается через период (строку) в периодической таблице до достижения группы 18. Это вызвано заполнением валентной оболочки атома; атом группы 17 выделяет больше энергии, чем атом группы 1 при получении электрона, поскольку он получает заполненную валентную оболочку и, следовательно, более стабилен. В группе 18 валентная оболочка заполнена, а это означает, что добавленные электроны нестабильны и имеют тенденцию очень быстро выбрасываться.
Как это ни странно, E ea не уменьшается при перемещении вниз по строкам периодической таблицы, как можно ясно видеть в данных группы 2. Таким образом, сродство к электрону следует той же тенденции «влево-вправо», что и электроотрицательность, но не тенденции «вверх-вниз».
Следующие данные приведены в кДж / моль.
Сродство к электрону в таблице Менделеева |
|||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Группа → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
| ↓ Период | . | ||||||||||||||||||
| 1 | H 73 | . | He (- 50) | ||||||||||||||||
| 2 | Li 60 | Be (−50) | . | B 27 | C 122 | N −7 | O 141 | F 328 | Ne (−120) | ||||||||||
| 3 | Na 53 | Mg (- 40) | . | Al 42 | Si 134 | P 72 | S 200 | Cl 349 | Ar (−96) | ||||||||||
| 4 | K 48 | Ca 2 | Sc 18 | Ti 7 | V 51 | Cr 65 | Mn (- 50) | Fe 15 | Co 64 | Ni 112 | Cu 119 | Zn (−60) | Ga 29 | Ge 119 | As 78 | Se 195 | Br 325 | Kr (- 60) | |
| 5 | Rb 47 | Sr 5 | Y 30 | Zr 42 | Nb 89 | Mo 72 | Tc (53) | Ru (101) | Rh 110 | Pd 54 | Ag 126 | Cd ( -70) | In 37 | Sn 107 | Sb 101 | Te 190 | I 295 | Xe (-80) | |
| 6 | Cs 46 | Ba 14 | La 54 | Hf 17 | Ta 31 | W 79 | Re 6 | Os 104 | Ir 151 | Pt 205 | Au 223 | Hg (-50) | Tl 31 | Pb 34 | Bi 91 | Po (136) | At 233 | Rn (- 70) | |
| 7 | Fr (47) | Ra (10) | Ac (34) | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg (151) | Cn (<0) | Nh (67) | Fl (<0) | Mc (35) | Lv (75) | Ts (212) | Og (5) | |
| . | |||||||||||||||||||
| Ce 55 | Pr 11 | Nd 9 | Pm (12) | Sm (16) | Eu 11 | Gd (13) | Tb 13 | Dy (>34) | Ho (33) | Er (30) | Tm 99 | Yb (−2) | Lu 23 | ||||||
| Th (113) | Pa (53) | U (51) | Np ( 46) | Pu (−4  |
Am (10) | Cm (27) | Bk (−165) | Cf (−97) | Es (−29) | Fm (34) | Md (94) | No (−223) | Lr (−30) | ||||||
| Условные обозначения | |||||||||||||||||||
| Значения указаны в кДж / моль, округлены | |||||||||||||||||||
| Эквивалент в эВ см.: Сродство к электрону (данные страница) | |||||||||||||||||||
| Круглые скобки обозначают прогнозы | |||||||||||||||||||
|
Первичный От распада Синтетический Граница показывает естественное появление элемента Цвет фона показывает подкатегорию в тенденции металл – металлоид – неметалл:
|
Молекулярное сродство к электрону
Сродство молекул к электрону является сложной функцией их электронная структура. Например, сродство к электрону для бензола отрицательно, как и для нафталина, в то время как сродство антрацена, фенантрена и пирен положительны. In silico эксперименты показывают, что сродство к электрону превосходит сродство фуллерена.
«сродство к электрону», как определено в физике твердого тела
Зонная диаграмма границы раздела полупроводник-вакуум, показывающая электрон сродство E EA, определяемое как разница между энергией приповерхностного вакуума E vac и приповерхностной зоной проводимости краем E C. Также показано: уровень Ферми EF, валентная зона край E V, работа выхода W.
В области физики твердого тела сродство к электрону определяется иначе, чем в химии и атомная физика. Для границы раздела полупроводник-вакуум (то есть поверхности полупроводника) сродство к электрону, обычно обозначаемое E EA или χ, определяется как энергия, полученная при перемещении электрона из вакуума сразу за пределы полупроводник до нижней части зоны проводимости внутри полупроводника:
- EEA ≡ E vac — EC { displaystyle E _ { rm {EA}} Equiv E _ { rm {vac}} — E _ { rm {C}}}
В собственном полупроводнике с абсолютным нулем эта концепция функционально аналогична химическому определению сродства к электрону, так как добавленный электрон самопроизвольно уходит в нижнюю часть зона проводимости. При ненулевой температуре и для других материалов (металлов, полуметаллов, сильно легированных полупроводников) аналогия не выполняется, поскольку добавленный электрон вместо этого переходит в среднем на уровень Ферми. В любом случае, значение сродства к электрону твердого вещества сильно отличается от значения сродства к электрону для атома того же вещества в газовой фазе по химии и атомной физике. Например, поверхность кристалла кремния имеет сродство к электрону 4,05 эВ, тогда как изолированный атом кремния имеет сродство к электрону 1,39 эВ.
Сродство к электрону поверхности тесно связано с ее работой выхода, но отличается от нее. Работа выхода — это термодинамическая работа, которая может быть получена путем обратимого и изотермического удаления электрона из материала в вакуум; этот термодинамический электрон переходит в среднем на уровень Ферми, а не на край зоны проводимости: W = E vac — EF { displaystyle W = E _ { rm {vac}} — E _ { rm {F}}}
В физике полупроводников основное использование сродства к электрону на самом деле не в анализе поверхностей полупроводник – вакуум, а скорее в эвристических правилах сродства к электрону для оценки изгиба зон., который возникает на границе раздела двух материалов, в частности, переходов металл – полупроводник и полупроводников гетеропереходов.
В определенных обстоятельствах сродство к электрону может стать отрицательным. Часто отрицательное сродство к электрону желательно для получения эффективных катодов, которые могут подавать электроны в вакуум с небольшими потерями энергии. Наблюдаемый выход электронов как функция различных параметров, таких как напряжение смещения или условия освещения, можно использовать для описания этих структур с помощью полосовых диаграмм , в которых сродство к электрону является одним параметром. В качестве одной из иллюстраций очевидного влияния поверхностного обрыва на эмиссию электронов см. Рисунок 3 в Эффект Маркивки.
См. Также
- Энергия ионизации — тесно связанное понятие, описывающее энергию, необходимую для удаления электрона из нейтральный атом или молекула
- Одноэлектронное восстановление
- Масс-спектрометрия с захватом электрона
- Электроотрицательность
- Валентный электрон
- Уровень вакуума
- Донор электронов
Литература
- Tro, Nivaldo J. (2008). Химия: молекулярный подход (2-е изд.). Нью-Джерси: Pearson Prentice Hall. ISBN 0-13-100065-9 . стр. 348–349.
Внешние ссылки
- Сродство к электрону, определение из IUPAC Gold Book