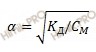Степень электролитической диссоциации
Вычислить степень электролитической диссоциации и рН 0,1 М раствора азотистой кислоты (HNO2). Кд = 5 ⋅ 10-4.
Решение задачи
Степень электролитической диссоциации – это отношение числа распавшихся на ионы частиц к общему числу частиц. Степень диссоциации выражают в долях единицы или в процентах.
Запишем уравнение диссоциации азотистой кислоты (HNO2):
Так как азотистая кислота (HNO2) является слабым электролитом, то для расчета применяют упрощенную формулу закона разбавления Оствальда:
где:
α – степень электролитической диссоциации;
KД – константа диссоциации;
CM – молярная концентрация электролита.
Подставим данные задачи в уравнение Оствальда:
Найдем равновесную концентрацию ионов водорода:
Получаем:
[H+] = 0,1 ∙ 0,07 = 0,007 (моль/л).
Вычислим pH раствора по формуле:
Водородный показатель (pH) раствора численно равен отрицательному десятичному логарифму концентрации ионов водорода в этом растворе.
pH = — lg [7 ⋅ 10-3]
pH = 3 – lg 7
pH = 2,2
Ответ:
степень электролитической диссоциации 0,07;
pH раствора 2,2.
5.75: Найти степень диссоциация α азота, если для него отношение cp/сv = 1,47 . |
| Задача из учебного пособия Волькенштейн |
|
Данная задача находится в разделе Решебник Волькенштейн на странице № 6 <<< Предыдущая задача из Волькенштейн |
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Степень диссоциации
Классификация электролитов
Диссоциация электролитов
Константа диссоциации
Примеры решения задач
Задачи для самостоятельного решения
Степень диссоциации
Вещества, которые в растворах или расплавах полностью или частично распадаются на ионы, называются электролитами.
Степень диссоциации α — это отношение числа молекул, распавшихся на ионы N′ к общему числу растворенных молекул N:
α = N′/N
Степень диссоциации выражают в процентах или в долях единицы. Если α =0, то диссоциация отсутствует и вещество не является электролитом. В случае если α =1, то электролит полностью распадается на ионы.
Классификация электролитов
Согласно современным представлениям теории растворов все электролиты делятся на два класса: ассоциированные (слабые) и неассоциированные (сильные). Неассоциированные электролиты в разбавленных растворах практически полностью диссоциированы на ионы. Для этого класса электролитов a близко к единице (к 100 %). Неассоциированными электролитами являются, например, HCl, NaOH, K2SO4 в разбавленных водных растворах.
Ассоциированные электролиты подразделяются на три типа:
-
-
- Слабые электролиты существуют в растворах как в виде ионов, так и в виде недиссоциированных молекул. Примерами ассоциированных электролитов этой группы являются, в частности, Н2S, Н2SO3, СН3СOОН в водных растворах.
- Ионные ассоциатыобразуются в растворах путем ассоциации простых ионов за счет электростатического взаимодействия. Ионные ассоциаты возникают в концентрированных растворах хорошо растворимых электролитов. В результате в растворе находятся как простые ионы, так и ионные ассоциаты. Например, в концентрированном водном растворе КCl образуются простые ионы К+, Cl— , а также возможно образование ионных пар (К+Cl— ), ионных тройников (K2Cl+, KCl2— ) и ионных квадруполей (K2Cl2, KCl32- , K3Cl2+).
- Комплексные соединения(как ионные, так и молекулярные), внутренняя сфера которых ступенчато диссоциирует на ионные и (или) молекулярные частицы.
Примеры комплексных ионов: [Cu(NH3)4]2+, [Fe(CN)6]3+, [Cr(H2O)3Cl2]+.
-
При таком подходе один и тот же электролит может относиться к различным типам в зависимости от концентрации раствора, вида растворителя и температуры. Подтверждением этому являются данные, приведенные в таблице.
Таблица. Характеристика растворов KI в различных растворителях
| Концентрация электролита, С, моль/л | Температура
t,оС |
Растворитель | Тип электролита |
| 0,01 | 25 | Н2О | Неассоциированный (сильный) |
| 5 | 25 | Н2О | Ионный ассоциат |
| 0,001 | 25 | С6Н6 | Ассоциированный (слабый) |
Приближенно, для качественных рассуждений можно пользоваться устаревшим делением электролитов на сильные и слабые. Выделение группы электролитов “средней силы” не имеет смысла. Эти электролиты являются ассоциированными. К слабым электролитам обычно относят электролиты, степень диссоцииации которых мала α<<1.
Таким образом, к сильным электролитам относятся разбавленные водные растворы почти всех хорошо растворимых в воде солей, многие разбавленные водные растворы минеральных кислот (НСl, HBr, НNО3, НСlO4 и др.), разбавленные водные растворы гидроксидов щелочных металлов. К слабым электролитам принадлежат все органические кислоты в водных растворах, некоторые водные растворы неорганических кислот, например, H2S, HCN, H2CO3, HNO2, HСlO и др. К слабым электролитам относится и вода.
Диссоциация электролитов
Уравнение реакции диссоциации сильного электролита можно представить следующим образом. Между правой и левой частями уравнения реакции диссоциации сильного электролита ставится стрелка или знак равенства:
HCl → H+ + Cl—
Na2SO3 = 2Na+ + SO32-
Допускается также ставить знак обратимости, однако в этом случае указывается направление, в котором смещается равновесие диссоциации, или указывается, что α≈1. Например:
NaOH → Na+ + OH—
Диссоциация кислых и основных солей в разбавленных водных растворах протекает следующим образом:
NaHSO3 → Na+ + HSO3—
Анион кислой соли будет диссоциировать в незначительной степени, поскольку является ассоциированным электролитом:
HSO3— → H+ + SO32-
Аналогичным образом происходит диссоциация основных солей:
Mg(OH)Cl → MgOH+ + Cl—
Катион основной соли подвергается дальнейшей диссоциации как слабый электролит:
MgOH+ → Mg2+ + OH—
Двойные соли в разбавленных водных растворах рассматриваются как неассоциированные электролиты:
KAl(SO4)2 → K+ + Al3+ + 2SO42-
Комплексные соединения в разбавленных водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы:
K3[Fe(CN)6] → 3K+ + [Fe(CN)6]3-
В свою очередь, комплексный ион в незначительной степени подвергается дальнейшей диссоциации:
[Fe(CN)6]3- → Fe3+ + 6CN—
Константа диссоциации
При растворении слабого электролита КА в растворе установится равновесие:
КА ↔ К+ + А—
которое количественно описывается величиной константы равновесия Кд, называемой константой диссоциации:
Kд = [К+] · [А—] /[КА] (2)
Константа диссоциации характеризует способность электролита диссоциировать на ионы. Чем больше константа диссоциации, тем больше ионов в растворе слабого электролита. Например, в растворе азотистой кислоты HNO2 ионов Н+ больше, чем в растворе синильной кислоты HCN, поскольку К(HNO2) = 4,6·10— 4, а К(HCN) = 4,9·10— 10.
Для слабых I-I электролитов (HCN, HNO2, CH3COOH) величина константы диссоциации Кд связана со степенью диссоциации α и концентрацией электролита c уравнением Оствальда:
Кд = (α2·с)/(1-α) (3)
Для практических расчетов при условии, что α<<1 используется приближенное уравнение:
Кд = α2·с (4)
Поскольку процесс диссоциации слабого электролита обратим, то к нему применим принцип Ле Шателье. В частности, добавление CH3COONa к водному раствору CH3COOH вызовет подавление собственной диссоциации уксусной кислоты и уменьшение концентрации протонов. Таким образом, добавление в раствор ассоциированного электролита веществ, содержащих одноименные ионы, уменьшает его степень диссоциации.
Следует отметить, что константа диссоциации слабого электролита связана с изменением энергии Гиббса в процессе диссоциации этого электролита соотношением:
ΔGT0 = — RTlnKд (5)
Уравнение (5) используется для расчета констант диссоциации слабых электролитов по термодинамическим данным.
Примеры решения задач
Задача 1. Определите концентрацию ионов калия и фосфат-ионов в 0,025 М растворе K3PO4.
Решение. K3PO4 – сильный электролит и в водном растворе диссоциирует полностью:
K3PO4 → 3К+ + РО43-
Следовательно, концентрации ионов К+ и РО43- равны соответственно 0,075М и 0,025М.
Задача 2. Определите степень диссоциации αд и концентрацию ионов ОН— (моль/л) в 0,03 М растворе NH3·H2О при 298 К, если при указанной температуре Кд(NH3·H2О) = 1,76× 10— 5.
Решение. Уравнение диссоциации электролита:
NH3·H2О → NH4+ + OH—
Концентрации ионов: [NH4+] = αС ; [OH—] = αС , где С – исходная концентрация NH3·H2О моль/л. Следовательно:
Kд = αС · αС /(1 — αС)
Поскольку α << 1, то:
Кд ≈ α 2С
Константа диссоциации зависит от температуры и от природы растворителя, но не зависит от концентрации растворов NH3·H2О. Закон разбавления Оствальда выражает зависимость α слабого электролита от концентрации.
α = √(Кд / С) = √(1,76× 10— 5 / 0,03) = 0,024 или 2,4 %
[OH—] = αС, откуда [OH— ] = 2,4·10— 2·0,03 = 7,2·10-4 моль/л.
Задача 3. Определите константу диссоциации уксусной кислоты, если степень диссоциации CH3CОOH в 0,002 М растворе равна 9,4 %.
Решение. Уравнение диссоциации кислоты:
CH3CОOH → СН3СОО— + Н+.
α = [Н+] / Сисх(CH3CОOH)
откуда [Н+] = 9,4·10—2·0,002 = 1,88·10-4 М.
Так как [CH3CОO—] = [Н+] и [CH3CОOH] ≈ Сисх(CH3CОOH), то:
Kд = [Н+]2 / Сисх(CH3CОOH)
Константу диссоциации можно также найти по формуле: Кд ≈ α 2С.
Задача 4. Константа диссоциации HNO2 при 298К равна 4,6× 10— 4. Найдите концентрацию азотистой кислоты, при которой степень диссоциации HNO2 равна 5 %.
Решение.
Кд =α 2С , откуда получаем Сисх(HNO2) = 4,6·10— 4/(5·10— 2)2 = 0,184 М.
Задача 5. На основе справочных данных рассчитайте константу диссоциации муравьиной кислоты при 298 К.
Решение. Уравнение диссоциации муравьиной кислоты
НСООН →Н+ + СООН—
В “Кратком справочнике физико–химических величин” под редакцией А.А. Равделя и А.М. Пономаревой приведены значения энергий Гиббса образований ионов в растворе, а также гипотетически недиссоциированных молекул. Значения энергий Гиббса для муравьиной кислоты и ионов Н+ и СООН— в водном растворе приведены ниже:
| Вещество, ион | НСООН | Н+ | СООН— |
| ΔGT0, кДж/моль | — 373,0 | 0 | — 351,5 |
Изменение энергии Гиббса процесса диссоциации равно:
ΔGT0 = — 351,5- (- 373,0) = 21,5 кДж/моль.
Для расчета константы диссоциации используем уравнение (5). Из этого уравнения получаем:
lnKд = — Δ GT0/RT= — 21500/(8,31 298) = — 8,68
Откуда находим: Kд = 1,7× 10— 4.
Задачи для самостоятельного решения
1. К сильным электролитам в разбавленных водных растворах относятся:
- СН3СOOH
- Na3PO4
- NaCN
- NH3
- C2H5OH
- HNO2
- HNO3
13.2. К слабым электролитам в водных растворах относятся:
- KAl(SO4)2
- NaNO3
- HCN
- NH4Cl
- C2H5OH
- H2SO3
- H2SO4
3. Определите концентрацию ионов NH4+ в 0,03 М растворе (NH4)2Fe(SO4)2;
4. Определите концентрацию ионов водорода в 6 мас.% растворе H2SO4, плотность которого составляет 1,038 г/мл. Принять степень диссоциации кислоты по первой и второй ступеням равной 100 %.
5. Определите концентрацию гидроксид-ионов в 0,15 М растворе Ba(OH)2.
6. Степень диссоциации муравьиной кислоты в 0,1 М растворе равна 4 %. Рассчитайте Концентрацию ионов водорода в этом растворе и константу диссоциации НСООН.
7. Степень диссоциации муравьиной кислоты в водном растворе увеличится при:
а) уменьшении концентрации HCOOH;
б) увеличении концентрации HCOOH;
в) добавлении в раствор муравьиной кислоты HCOONa;
г) добавлении в раствор муравьиной кислоты НCl.
8. Константа диссоциации хлорноватистой кислоты равна 5× 10— 8. Определите концентрацию HClO, при которой степень диссоциации HClO равна 0,5 %, и концентрацию ионов Н+ в этом растворе.
9. Вычислите объем воды, который необходимо добавить к 50 мл 0,02 М раствора NH3·H2О, чтобы степень диссоциации NH3·H2О увеличилась в 10 раз, если Кд(NH4OH) = 1,76·10— 5.
10. Определите степень диссоциации азотистой кислоты в 0,25 М растворе при 298 К, если при указанной температуре Кд(HNO2) = 4,6× 10— 4.
Для условий задачи 1.49 (степени диссоциации кислорода и азота в воздушной смеси, энтальпии ее равновесной диссоциации) определите среднюю молярную массу и динамическую вязкость воздуха. [c.17]
Для определения степени диссоциации разогретого воздуха, рабочая модель которого представляет собой совокупность чистых диссоциирующих компонентов N2 и О2, применяем формулу (1.29). Найдем относительные величины р = = р р и Т = Т/Т а, входящие в эту формулу. Для этого необходимо знать характеристические давление ра и температуру Т воздушной смеси. Исходя из того, что кислорода в ней 23,5%, а азота 76,5%, получаем [c.38]
По данным задачи 4.59 определите степень диссоциации воздуха за скачком уплотнения, рассматривая его как двухатомную модель смеси кислорода и азота. [c.106]
Азотирование состоит в насыщении поверхности деталей азотом в среде диссоциированного аммиака (степень диссоциации около 30%) при 550—580° С в течение 30—70 ч. При этом образуется износостойкий, коррозионно-стойкий (в воздушной среде) диффузионный слон с повышенной твердостью и толщиной до 0,4 мм. [c.53]
Для азотирования применяют аммиак. Скорость реакции разложения его зависит от температуры, давления, скорости протекания аммиака через муфель печи и поверхности азотируемых деталей и муфеля печи. При каждой температуре в муфеле печи должна поддерживаться определенная степень диссоциации аммиака, от которой зависит количество поглощаемого сталью азота. [c.166]
Для того чтобы установить связь между константами равновесия и степенью диссоциации, выразим концентрации реагентов через степень диссоциации, воспользовавшись снова примером разложения четырехокиси азота. Из сказанного выше очевидно, что [c.487]
В конце главы приведены таблицы теплоемкостей, степени диссоциации СО2 и Н2О. Выше отмечалось, что жаропроизводительность топлива макс снижается при содержании в топливе балласта, переходящего в продукты горения (влага в твердом и жидком топливе, азот и двуокись углерода в газообразном). [c.306]
Проведение азотирования по оптимальному режиму (температура 560—600 степень диссоциации аммиака 20—40%), обеспечивающему поглощение максимального количества азота, дает сокращение толщины нестойкой зоны, однако полностью не устраняет ее образования. [c.137]
Степень диссоциации азота [144] [c.452]
В табл. III.8 и III.9 приведены данные по степени диссоциации четырехокиси азота при различных температурах и давлениях. [c.207]
Контейнер для деталей предохраняют от азотирования, так как в противном случае он замыкает на себя значительную часть магнитного потока, что снижает скорость насыщения поверхностного слоя азотом. Контейнер герметично закрывают крышкой и внутрь подают аммиак NH3. Процесс ведут при температуре 550—560° С и степени диссоциации аммиака 35— [c.199]
Поглощение линии Хе I ъ=1470 А позволило исследовать диссоциацию кислорода за ударной волной в зависимости от температуры [152]. Степень диссоциации кислорода в тлеющем разряде определялась по поглощению той же линии [153]. Процесс диссоциации азота можно проследить по изменению [c.381]
Качество азотирования и цементации зависит от продолжительности и температуры процесса диффузии, содержания углерода в газе (нри цементации), степени диссоциации аммиака (при азотировании). С повышением температуры азотирования скорость диффузии азота в глубь металла сильно возрастает, твердость становится ниже, а глубина слоя — больше. Весьма опасен перегрев, так как появляются трещины, точечное выкрашивание, сколы. При этом азотированный слой имеет нитридную сетку. [c.154]
В работе [191] исследовано влияние состава газовой среды на скорость азотирования хрома и фазовый состав поверхностных слоев. Разница в скорости роста нитридных слоев объясняется главным образом различной степенью диссоциации аммиака. В работе высказано предположение о каталитическом действии насыщаемой поверхности на термическую диссоциацию молекулярных газов. Естественно, что каталитическое действие поверхности различно по отношению к разным газам. В частности, степень диссоциации аммиака в контакте с нитридом выше, чем молекулярного азота. Поскольку предварительно диссоциированный аммиак [c.169]
Рие. 16. Зависимость степени диссоциации водорода и азота от температуры [19]. [c.21]
Присутствие примесей в металлах приводит к изменению их термических, калорических, электрических и других свойств. Степень влияния примесей определяется концентрацией примеси, температурой, взаимодействием с другими примесями и т. д. Газовые примеси, образующие в металлах различные соединения, способны диссоциировать, разлагаясь на металл и газ (кислород, водород, азот), выходящий в газовую полость над металлом. Степень диссоциации соединений существенно зависит от температуры. Как видно из таблицы, при умеренных температурах интенсивно диссоциируют гидриды калия и натрия, при более высоких температу- [c.22]
При более высоких температурах, скажем при температуре 5000° К, равновесная степень диссоциации в таких газах, как кислород, азот, воздух, значительна и от степени диссоциации сильно зависит внутренняя энергия. Диссоциация при таких температурах происходит довольно медленно, требуя многих столкновений молекул, и диссоциацию можно отнести к числу медленно возбуждаемых степеней свободы. При еще более высоких температурах, порядка 10 000° и выше, роль медленно возбуждаемых степеней свободы играет ионизация. В то же время диссоциация, а тем более возбуждение колебаний немногих недиссоциированных молекул, происходит очень быстро, и эти степени свободы можно отнести к легко возбуждаемым. [c.215]
Получающийся атомарный азот растворяется в Рва, затем диффундирует в глубь детали, образуя различные азотистые фазы в соответствии с диаграммой состояния системы Ре—N (фиг. 96). Степень диссоциации аммиака поддерживается в пределах 15—40%. Длительность процесса азотирования составляет 24—60 час. в зависимости от требуемой глубины азотированного слоя. Обычно получают слой глубиной до 0,5 мм и с концентрацией азота 3—4%. Более высокое содержание азота вызывает в стали повышенную хрупкость. [c.204]
НОИ при этой температуре степени диссоциации на элементы четырехокиси и окиси азота. [c.302]
Образующийся атомарный азот диффундирует в металл. Степень диссоциации зависит от температуры процесса и от расхода аммиака. При малых расходах при 500° С количество диссоциированного аммиака около 25%, при 550°С — около 50%, а при 600° С — почти 100%. Управляя расходом, можно при любой приведенной температуре уменьшить степень диссоциации аммиака. [c.319]
N. = 2N —170,2 ккал]моль, наблюдается только при достаточно высоких температурах. Температурная зависимость степени диссоциации молекулярного азота дана на фиг. 15, из которой-следует, что диссоциация азота при одних и тех же температурах протекает менее полно, нежели диссоциация водорода. [c.79]
Водород, как и азот, оказывает вредное воздействие на качество металла шва. В зависимости от температуры водород может находиться в молекулярном, атомарном или ионизированном состоянии. Степень диссоциации водорода зависит от температуры (см. рис. 7-10). В столбе дуги подавляющее количество водорода находится в атомарном состоянии. При дуговой сварке покрытыми электродами содержание водорода в металле шва в ряде случаев может превышать величину растворимости его в железе при равновесных условиях и температуре кристаллизации. Растворимость водорода в жидких сплавах железа зависит от концентрации легирующих элементов (рис. 7-14). [c.312]
Сводный график степени диссоциации этих газов, представленный на рис. 1.22, показывает, что диссоциация водорода активно развивается при Г = (2…4) 10 К, а кислорода — при более высокой температуре. Менее всего диссоциирует азот, который при дуговой сварке существует преимущественно в молекулярной форме. [c.40]
Протекание аммиака через печь должно производиться с определенной скоростью, обеспечивающей заданную степень диссоциации аммиака, от которой зависит количество поглощаемого сталью азота. [c.279]
Следовательно, задаваясь значениями температуры при постоянном давлении р, можно для соответствующего газа установить величину Кр, а затем, пользуясь выражением (VI.6),— и степень диссоциации этого газа при выбранной температуре. Если принять, что температура столба дуги составляет в среднем 5000 °К, то для молекул водорода расчеты дадут а = 0,96, а для молекул азота а = 0,038 (рис. 108). [c.228]
При давлении р= 10 Па степень диссоциации азота а = 0,5. Рассматривая его как двухатомную модель диссоциирующего газа, определите плотность, температуру, энтальпию и внутреннюю энергию. [c.17]
Сущность явления азотирования состоит в том, что содержащийся в технологической азотоводородоаммиачной среде газообразный аммиак диссоциирует при повышенной температуре с образованием атомарного азота. Степень термической диссоциации аммиака зависит от его парциального давления в газовой фазе и температуры, а также от условий работы установок синтеза аммиака. Атомарный азот адсорбируется металлом, диффундирует в его поверхностные слои и, взаимодействуя с железом и легирующими элементами стали, образует нитриды, придающие азотированному слою высокую твердость и хрупкость. [c.820]
Наши исследования показали, что азотированный слой нестоек в 3%-ном растворе Na l, в соляной и азотной кислотах. Коррозионная стойкость в воде зависит от химсостава стали и от режима азотирования (температуры и степени диссоциации аммиака). Каждой температуре соответствует оптимальная степень диссоциации аммиака, при которой можно получить слои, коррозионно-стойкие в воде. Так, например, при температуре азотирования 560° оптимальная степень диссоциации аммиака 20—40%, при температуре 600° 40—60%. Азотирование при больших степенях диссоциации ввиду отравления поверхности водородом, препятствующим поглощению азота, сопровождается образованием слоя с низкими коррозионными свойствами. [c.119]
Влияние степени диссоциации аммиака на количество поглощенного азота и коррозионную стойкость азотированного слоя стали 4XI4H14B2M в воде [c.119]
Степень диссоциации NHg % Твердость HV Толщина слоя мм Количество поглощенного азота Zj M Результаты коррозионных испытаний (срок испытания три месяца) [c.119]
Азотиро- вание газовое Обработка инструмента из быстрорежущих и щтамповых сталей. Твердость 1100… 1200 HV, толщина слоя 0,02…0,03 мм (0,08…0,2 мм для штамповых сталей) Обработка инструменга из быстрорежущих и штамповых сгалей. Твердость 1000… 1100 HV Температура 520…540 °С при степени диссоциащш аммиака 25…30 % или 540…580 «С при степени диссоциации 35.-.40%. Выдержка 0,5… 2 ч для инструмента из быстрорежущих сталей и 8… 12 ч — из штамповых Насыщение поверхностного слоя азотом и углеродом при температуре 560…580 °С в смеси аммиака и науглероживающего газа. Выдержка 1…2 ч [c.443]
| Рис. 13. Изменение степени диссоциации JVp азота в зависимости от температуры различтлх изобарах. | 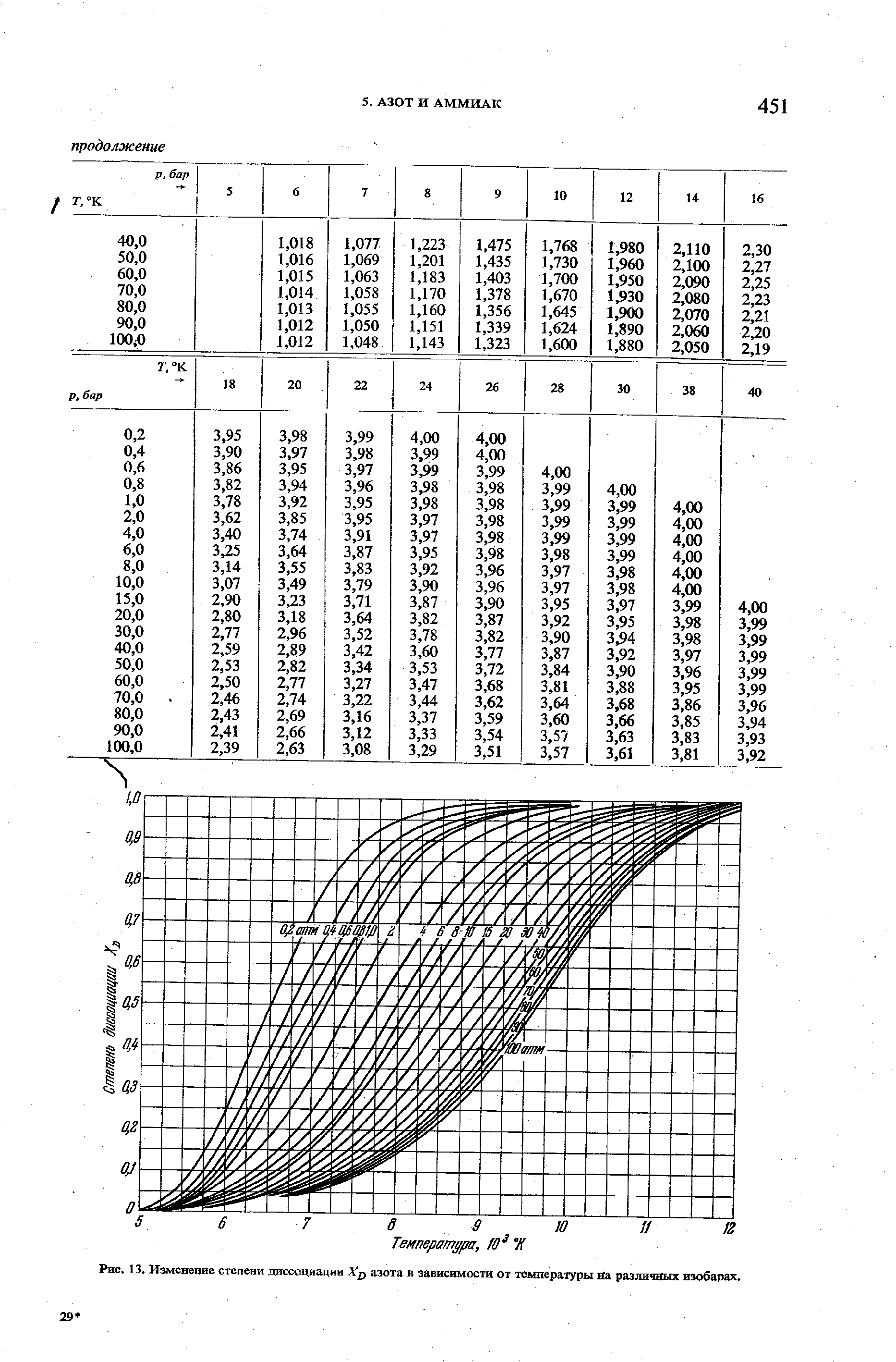 |
Фик И5- Зависимость количества 110г Л( 1цепного сгалью азота от степени диссоциации аммиака (режим азотирования мин, . [c.153]
Поглощение молекулярного азота на длине волны Х=И76А применялось для определения степени диссоциации азота за ударной волной в зависимости от температуры [53]. [c.287]
Основными по весу компонентами являются атомы и молекулы азота и кислорода и в незначительной степени окись азота NO. Диссоциация кислорода проходит в основном при Т = 2000- 5000 К, азота при Г=4000-н10ООО К (характерные температуры реакций О =59ООО К и 0 = 119 000 К соответственно). При 10 000ч-12 ООО К значительную долю составляют однократные ионы этих компонент (0 =100 000-1-200 000 К). [c.34]
На фиг. 106 показана схема установки для азотирования. Азо-гирование в зависимости от состава и назначения стали производят 8 интервале температур 480—750° в среде аммиака. Процесс азотирования ведут следующим образом. Аммиак, находящийся под давлением в баллоне 1, поступает через редуктор 2 в осушитель 3, а атем через счетчик газа 4 — в печь 6. В герметически закрытой печи аммиак под действием температуры диссоциирует по реакции 2NHз- 2N 4- ЗНг, образуя атомарный азот, и далее диссоциированный аммиак поступает в сосуд с водой II. Для контроля степени диссоциации аммиака установлен водяной манометр 9 и диссоцио-метр 10. Измерение температуры в печи производят с помощью термопары 7 и автоматического регулятора 8. Процесс насыщения стали азотом — диффузионный процесс. [c.132]
Авторы работы [98] исследовали летучесть селенида серебра до 500°С в токе сухого очищенного азота. Кажущееся давление пара в пределах 800—850°С определялось эффузионным методом, а в пределах 900—1030°С— методом потока. Остатки после возгонки несколько обогащались серебром и обеднялись по селену. Предположив, что в возгоне все серебро присутствует в виде Ag2Se, было подсчитано, что при 925°С в результате процесса термической диссоциации селенида около 70% селена находится в возгонах и лишь около 30% летит в виде недиссоциированных молекул. С повышением температуры до 1000°С степень диссоциации увеличивается до 86%. [c.109]
Азотирование инструментов проводят прн 550—560°С продолжи-тельн01стью 10—40 мин в атмосфере аммиака степень диссоциации 35—40%. Применяют азотирование в смеси 20% аммиака и 80% азота, В этом случае обеопечиваегся меньшая хрупкость слоя. [c.121]
Степень диссоциации аммиака—это число в процентах, которое получается, если разделить объем разложившегося аммиака на общий объем газа в муфеле. Это число меняется в широких пределах от 20 до 65%. Степень диссоциации определяется с помощью специального прибора — дисооциометра (фиг. 50). Он представляет собой стеклянный сосуд, имеющий 100 делений. В верхней части сосуда имеется трехходовой кран 2 и две трубки. По одной из них 3 подводится газ из муфеля, по другой 1 — вода. В нижней части сосуда имеется обычный запорный кран 4. Для определения степени диссоциации аммиака открывают нижний кран, а верхний поворачивают так, чтобы в сосуд поступал газ. Затем нижний кран закрывают, а верхний поворачивают в другое положение, перекрывая газ и открывая воду. Если бы в сосуде был только диссоциированный, т. е. разложившийся на смесь водорода и азота аммиак, то вода не смогла бы в него зайти, так как ни азот, ни водород не растворяются в воде, а давление, создаваемое ими, мешает поступлению воды. Но если, наряду с азотом и водородом, в сосуде имеется неразложившийся аммиак, то он, растворяясь в воде, освободит часть объема, которую она и заполнит. Остальная часть объема — над уровнем воды — это диссоциированный аммиак. Поскольку деления проставлены сверху вниз, а вода занимает нижнюю часть сосуда, уровень ее сразу показывает степень диссоциации в процентах. [c.104]
Не рекомендуется снижать степень диссоциации аммиака против того, что было указано. Это не улучшает процесс азоти- [c.104]
Для сталей, склонных к отпускной хрупкости второго рода, применяют низкотемпературное азотирование при 380—430° С. При таких температурах азотирование практически не происходит, так как степень диссоциации аммиака низкая (например, при 380° С всего 6%). Для повышения степени диссоциации аммиака применяют катализатор, поглощающий водород (например, кремний, образующий с водородом летучее соединение силам SiHJ. Практически применяют ферросилиций с содержанием 75% Si (кусочки ферросилиция помещают в стаканы из металлической сетки и размещают их вокруг азотируемых деталей). В присутствии ферросилиция степень диссоциации аммиака достигает 20—25%, но азотированный слой получается с низкой концентрацией азота и низкой твердостью. Для получения повышенной твердости детали перед азотированием покрывают обмазкой, состоящей из насыщенного водного раствора хромового ангидт рида СгОз. В результате реакций [c.142]
С ростом температуры степень диссоциации N204 растет и при атмосферном давлении и температуре 430—450 К диссоциация N204 до N02 заканчивается. При дальнейшем повышении температуры (Г > 450 К) происходит обратимая диссоциация двуокиси азота до окиси азота и кислорода [c.9]
Главная
→ Форумы » Физика » Решение задач по физике » степень диссоциации азота
степень диссоциации азота
Автор
Сообщение
Victor719
#11218
2012-06-03 22:03 GMT
Пользователи
8 сообщений
Кто: студент
Репутация 0 [-][+]
Помогите решить задачку, желателен подробный разбор чтобы самой понять как и чего
Найти степень диссоциации α азота, если для него γ=1.47
Личное сообщение