Для этого нужно придерживаться нескольких простых правил:
- Степень окисления атомов в простых веществах всегда равна нулю. Например, в молекуле Cl2 степень окисления хлора равна нулю.
- В единичном ионе степень окисления атома равна заряду этого иона. Например, в ионах Fe2+ и Fe3+ степень окисления железа будет равна +2 и +3 соответственно.
- В сложных соединениях сумма степеней окисления всех атомов должна равняться заряду этого соединения.
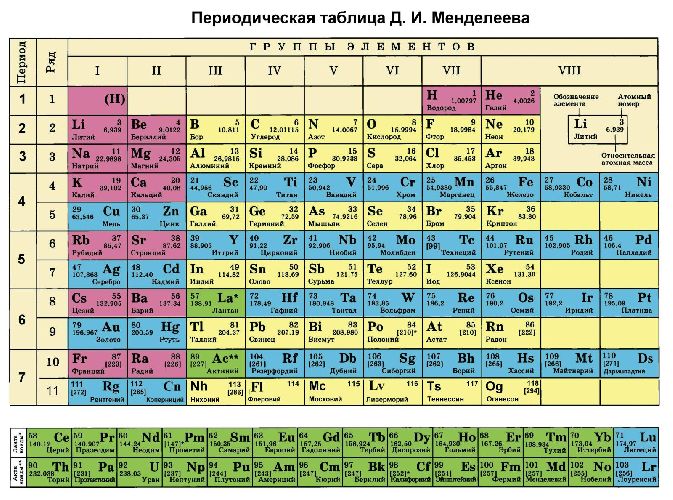
- Отрицательный заряд находится у того атома, который расположен в таблице Менделеева правее. Кроме этого, можно использовать ряд Бекетова. В соединениях с неметаллами водород всегда имеет положительную степень окисления +1.
- При расчетах степеней окисления нужно учитывать валентность химического элемента в соединении.
Рассмотрим на конкретных примерах.
Примеры
Определить степень окисления элементов в углекислом газе CO2.
1. Молекула не имеет заряда, значит сумма зарядов атомов равна нулю.
2. Кислород в таблице Менделеева находится правее, чем углерод. Значит именно кислород имеет отрицательную степень окисления.
3. Валентность углерода равна четырём, а кислорода – двум.
Исходя из всех этих утверждений мы можем рассчитать степени окисления: C+4 O2-2.
4. В конце проводим проверку: складываем степени окисления атомов в соединении (мы должны получить ноль – см. пункт 1). +4 (атом углерода) – 2 * 2 (степень окисления кислорода * 2 атома) = +4 – 4 =0. Значит у нас всё сходится.
Определить степень окисления элементов в H2S.
Действуем по тому же принципу: молекула не имеет заряда, водород одновалентен и в соединении с неметаллом имеет степень окисления +1.
H2+1 S-2
Делаем проверку: +1 * 2 – 2 = +2 -2 = 0.
Определить степень окисления элементов в H2O.
H2+1 O-2
Определить степень окисления элементов в P2O5.
Кислород находится правее фосфора, значит имеет отрицательную степень окисления. Валентность кислорода равна двум, значит валентность фосфора здесь равна пяти.
P2+5 O5-2
Проверяем: +5 * 2 – 2 * 5 = +10 – 10 = 0.
Определить степень окисления элементов в SO2 и SO3.
S+4 O2-2 и S+6 O3-2.
Определить степень окисления элементов в H3BO3.
Вспоминаем: в соединениях с неметаллами водород всегда имеет степень окисления +1.
Самым электроотрицательным элементом в соединении является кислород, значит именно он имеет отрицательную степень окисления. Исходя из этого вычислим степень окисления бора:
H3+1 B+x O3-2
+1 * 3 + x – 2*3 = 0
+3 + x – 6 = 0
x = 3
H3+1 B+3 O3-2
Определить степень окисления элементов в H2SO4.
Здесь аналогично примеру выше: водород +1, кислород -2. Находим степень окисления серы:
H2+1 S+x O4-2
+1 * 2 + x – 2 * 4 = 0
+2 + x – 8 = 0
x = 6
H2+1 S+6 O4-2
Определить степень окисления элементов в KMnO4
В перманганате калия самый электроотрицательный элемент – кислород. Именно он имеет отрицательную степень окисления (-2). В соединении содержится 4 атома кислорода, что дает суммарный заряд 4*(-2) = -8
Калий имеет на внешнем энергетическом слое всего 1 электрон, его степень окисления всегда равна +1.
Тогда, степень окисления марганца: -8 + 1 = +7
K+1Mn+7O-24
Определить степень окисления элементов в ионе Cr2O72-.
Кислород находится в таблице Менделеева правее, чем хром. Значит кислород имеет отрицательную степень окисления. Обращаю внимание, что ион имеет заряд -2. Найдем степень окисления хрома:
(Cr2+x O7-2) 2-
2 * x – 2 * 7 = – 2
2x – 14 = – 2
2x = 12
x = 6
(Cr2+6 O7-2) 2-
Найдите правильный ответ на вопрос ✅ «Определить степень окисления хим. элементов: Cl2, K3N, Na4C, Cu, CuO, SiO2, OF2, CCl4, SO3, CaH2, SiH4, Ca3P2, LiH, FeF3, NO2, N2O, P2S3. …» по предмету 📘 Химия, а если вы сомневаетесь в правильности ответов или ответ отсутствует, то попробуйте воспользоваться умным поиском на сайте и найти ответы на похожие вопросы.
Смотреть другие ответы
Главная » Химия » Определить степень окисления хим. элементов: Cl2, K3N, Na4C, Cu, CuO, SiO2, OF2, CCl4, SO3, CaH2, SiH4, Ca3P2, LiH, FeF3, NO2, N2O, P2S3.
Таблица окисления химических элементов

4.7
Средняя оценка: 4.7
Всего получено оценок: 560.
4.7
Средняя оценка: 4.7
Всего получено оценок: 560.
Чтобы определить условный заряд атомов в окислительно-восстановительных реакциях, используют таблицу окисления химических элементов. В зависимости от свойств атома элемент может проявлять положительную или отрицательную степень окисления.
Что такое степень окисления
Условный заряд атомов элементов в сложных веществах называется степенью окисления. Значение заряда атомов записывается в окислительно-восстановительных реакциях, чтобы понять, какой элемент является восстановителем, а какой – окислителем.
Степень окисления взаимосвязана с электроотрицательностью, которая показывает возможность атомов принимать или отдавать электроны. Чем выше значение электроотрицательности, тем больше способность атома отнимать электроны в реакциях.
Степень окисления может иметь три значения:
- нулевое – атом находится в состоянии покоя (все простые вещества имеют степень окисления 0);
- положительное – атом отдаёт электроны и является восстановителем (все металлы, некоторые неметаллы);
- отрицательное – атом принимает электроны и является окислителем (большинство неметаллов).
Например, степени окисления в реакции натрия с хлором выглядят следующим образом:
2Na0 + Cl20 → 2Na+1Cl-1
В реакции металлов с неметаллами металл всегда является восстановителем, а неметалл – окислителем.
Как определить
Существует таблица, в которой указаны все возможные степени окисления элементов.
|
Название |
Символ |
Степень окисления |
|
Водород |
H |
+1, -1 |
|
Гелий |
He |
0 |
|
Литий |
Li |
+1 |
|
Бериллий |
Be |
+2 |
|
Бор |
B |
-1, 0, +1, +2, +3 |
|
Углерод |
C |
-4, -3, -2, -1, 0, +2, +4 |
|
Азот |
N |
-3, -2, -1, 0, +1, +2, +3, +4, +5 |
|
Кислород |
O |
-2, -1, 0, +1, +2 |
|
Фтор |
F |
-1 |
|
Неон |
Ne |
0 |
|
Натрий |
Na |
+1 |
|
Магний |
Mg |
+2 |
|
Алюминий |
Al |
+3 |
|
Кремний |
Si |
-4, 0, +2, +4 |
|
Фосфор |
P |
3, 0, +3, +5 |
|
Сера |
S |
2, 0, +4, +6 |
|
Хлор |
Cl |
1, 0, +1, +3, +5, +7, редко +2 и +4 |
|
Аргон |
Ar |
0 |
|
Калий |
K |
+1 |
|
Кальций |
Ca |
+2 |
|
Скандий |
Sc |
+3 |
|
Титан |
Ti |
+2, +3, +4 |
|
Ванадий |
V |
+2, +3, +4, +5 |
|
Хром |
Cr |
+2, +3, +6 |
|
Марганец |
Mn |
+2, +3, +4, +6, +7 |
|
Железо |
Fe |
+2, +3, редко +4 и +6 |
|
Кобальт |
Co |
+2, +3, редко +4 |
|
Никель |
Ni |
+2, редко +1, +3, +4 |
|
Медь |
Cu |
+1, +2, редко +3 |
|
Цинк |
Zn |
+2 |
|
Галлий |
Ga |
+3, редко +2 |
|
Германий |
Ge |
-4, +2, +4 |
|
Мышьяк |
As |
-3, +3, +5, редко +2 |
|
Селен |
Se |
-2, +4, +6, редко +2 |
|
Бром |
Br |
-1, +1, +5, редко +3, +4 |
|
Криптон |
Kr |
0 |
|
Рубидий |
Rb |
+1 |
|
Стронций |
Sr |
+2 |
|
Иттрий |
Y |
+3 |
|
Цирконий |
Zr |
+4, редко +2, +3 |
|
Ниобий |
Nb |
+3, +5, редко +2, +4 |
|
Молибден |
Mo |
+3, +6, редко +2, +3, +5 |
|
Технеций |
Tc |
+6 |
|
Рутений |
Ru |
+3, +4, +8, редко +2, +6, +7 |
|
Родий |
Rh |
+4, редко +2, +3, +6 |
|
Палладий |
Pd |
+2, +4, редко +6 |
|
Серебро |
Ag |
+1, редко +2, +3 |
|
Кадмий |
Cd |
+2, редко +1 |
|
Индий |
In |
+3, редко +1, +2 |
|
Олово |
Sn |
+2, +4 |
|
Сурьма |
Sb |
-3, +3, +5, редко +4 |
|
Теллур |
Te |
-2, +4, +6, редко |
|
Иод |
I |
-1, +1, +5, +7, редко +3, +4 |
|
Ксенон |
Xe |
0 |
|
Цезий |
Cs |
+1 |
|
Барий |
Bа |
+2 |
|
Лантан |
La |
+3 |
|
Церий |
Ce |
+3, +4 |
|
Празеодим |
Pr |
+3 |
|
Неодим |
Nd |
+3, +4 |
|
Прометий |
Pm |
+3 |
|
Самарий |
Sm |
+3, редко +2 |
|
Европий |
Eu |
+3, редко +2 |
|
Гадолиний |
Gd |
+3 |
|
Тербий |
Tb |
+3, +4 |
|
Диспрозий |
Dy |
+3 |
|
Гольмий |
Ho |
+3 |
|
Эрбий |
Er |
+3 |
|
Тулий |
Tm |
+3, редко +2 |
|
Иттербий |
Ib |
+3, редко +2 |
|
Лютеций |
Lu |
+3 |
|
Гафний |
Hf |
+4 |
|
Тантал |
Ta |
+5, редко +3, +4 |
|
Вольфрам |
W |
+6, редко +2, +3, +4, +5 |
|
Рений |
Re |
+2, +4, +6, +7, редко -1, +1, +3, +5 |
|
Осмий |
Os |
+3, +4, +6, +8, редко +2 |
|
Иридий |
Ir |
+3, +4, +6, редко +1, +2 |
|
Платина |
Pt |
+2, +4, +6, редко +1, +3 |
|
Золото |
Au |
+1, +3, редко +2 |
|
Ртуть |
Hg |
+1, +2 |
|
Талий |
Tl |
+1, +3, редко +2 |
|
Свинец |
Pb |
+2, +4 |
|
Висмут |
Bi |
+3, редко +3, +2, +4, +5 |
|
Полоний |
Po |
+2, +4, редко -2, +6 |
|
Астат |
At |
– |
|
Радон |
Ra |
0 |
|
Франций |
Fr |
– |
|
Радий |
Ra |
+2 |
|
Актиний |
Ac |
+3 |
Или использовать на уроках этот вариант таблицы.
Кроме того, степени окисления химических элементов можно определить по периодической таблице Менделеева:
- высшая степень (максимально положительная) совпадает с номером группы;
- для определения минимального значения степени окисления из номера группы вычитается восемь.
Большинство неметаллов имеют положительную и отрицательную степени окисления. Например, кремний находится в IV группе, значит, его максимальная степень окисления +4, а минимальная -4. В соединениях неметаллов (SO3, CO2, SiC) окислителем является неметалл с отрицательной степенью окисления или с большим значением электроотрицательности. Например, в соединении PCl3 фосфор имеет степень окисления +3, хлор -1. Электроотрицательность фосфора – 2,19, хлора – 3,16.
Второе правило не работает для щелочных и щелочноземельных металлов, которые всегда имеют одну положительную степень окисления, равную номеру группы. Исключения составляют магний и бериллий (+1, +2). Также постоянную степень окисления имеют:
- алюминий (+3);
- цинк (+2);
- кадмий (+2).
Остальные металлы имеют непостоянную степень окисления. В большинстве реакций выступают в качестве восстановителя. В редких случаях могут быть окислителями с отрицательной степенью окисления.
Фтор – самый мощный окислитель. Его степень окисления всегда -1.
Что мы узнали?
Из урока 8 класса узнали о степени окисления. Это условная величина, показывающая, сколько электронов может отдать или принять атом в ходе химической реакции. Значение связано с электроотрицательностью. Окислители принимают электроны и имеют отрицательную степень окисления, восстановители отдают электроны и проявляют положительную степень окисления. Большинство металлов – восстановители с постоянной или переменной степенью окисления. Неметаллы могут проявлять свойства окислителя и восстановителя в зависимости от вещества, с которым реагируют.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Александр Котков
5/5
-
Александр Котков
5/5
-
Паша Кривов
4/5
-
Александр Котков
5/5
-
Лидия Маслова
5/5
Оценка доклада
4.7
Средняя оценка: 4.7
Всего получено оценок: 560.
А какая ваша оценка?

triolana
+10
Решено
6 лет назад
Химия
5 — 9 классы
Определите степени окисления атомов хлора в веществах по их формулам: CI2, KCI, CI2O5, KCIO4,с решением пж
Смотреть ответ
1
Ответ
0
(0 оценок)
0
mismoleeuwoo
6 лет назад
Светило науки — 1 ответ — 0 раз оказано помощи
Cl2 — степень окисления 0, тк простое вещество
KCl — степень окисления К +1, тк в первой группе => ст. ок. хлора -1
Cl2O5 — степень окисления О -2 (всегда, если не исключение) => ст. ок. хлора = 2+(-2)*5 = +5
KClO4 — степень окисления К +1, О -2 => ст. ок. хлора = +1 + (-2)*4 = -7
Степени окисления в итоге должны равняться нулю (+1-7+(-2)*4=0).
(0 оценок)
https://vashotvet.com/task/4162910
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,662 -
гуманитарные
33,654 -
юридические
17,917 -
школьный раздел
611,978 -
разное
16,905
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.