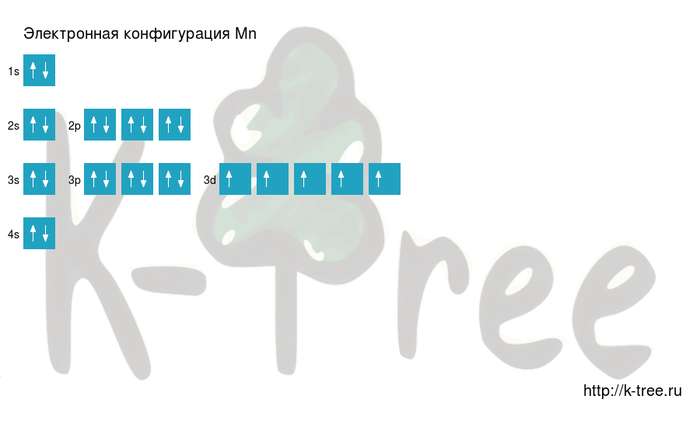
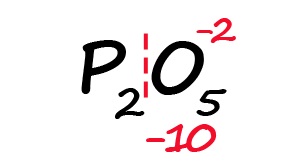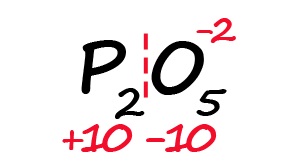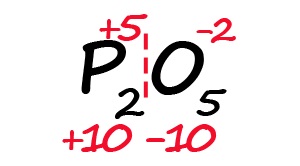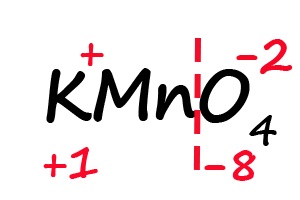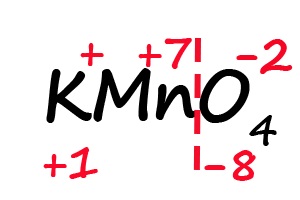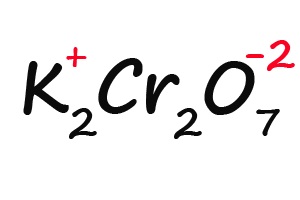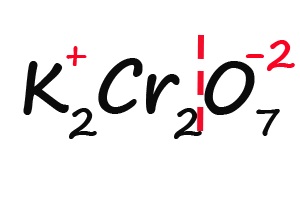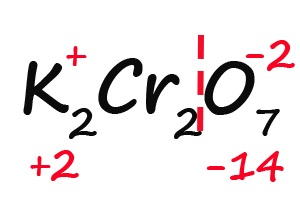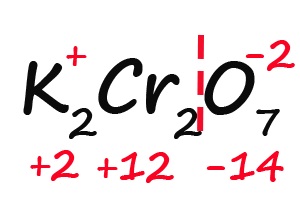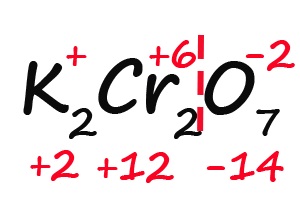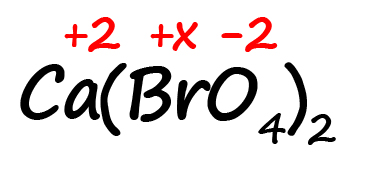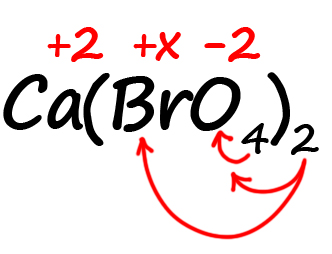Марганец в таблице менделеева занимает 25 место, в 4 периоде.
| Символ | Mn |
| Номер | 25 |
| Атомный вес | 54.9380440 |
| Латинское название | Manganum,Manganesium |
| Русское название | Марганец |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема марганца
Mn: 1s2 2s2 2p6 3s2 3p6 4s2 3d5
Короткая запись:
Mn: [Ar]4s2 3d5
Одинаковую электронную конфигурацию имеют
атом марганца и
V-2, Fe+1, Co+2, Ni+3
Порядок заполнения оболочек атома марганца (Mn) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на
‘d’ — до 10 и на ‘f’ до 14
Марганец имеет 25 электронов,
заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
5 электронов на 3d-подуровне
Степень окисления марганца
Атомы марганца в соединениях имеют степени окисления 7, 6, 5, 4, 3, 2, 1, 0, -1, -2, -3.
Степень окисления — это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Ионы марганца
Валентность Mn
Атомы марганца в соединениях проявляют валентность VII, VI, V, IV, III, II, I.
Валентность марганца характеризует способность атома Mn к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Mn
Квантовые числа определяются последним электроном в конфигурации,
для атома Mn эти числа имеют значение N = 3, L = 2, Ml = 2, Ms = +½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать.
Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo.
Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии
ионизации для каждого последующего электрона.
Энергия ионизации Mn:
Eo = 717 кДж/моль
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
Где Mn в таблице менделеева?
Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве
Степень окисления марганца.
Степень окисления марганца:
Степень окисления (окислительное число) – это вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций. Она указывает на состояние окисления отдельного атома молекулы и представляет собой лишь удобный метод учёта переноса электронов. Однако она не является истинным зарядом атома в молекуле.
Степень окисления соответствует числу электронов, которое следует присоединить к положительному иону (катиону), чтобы восстановить его до нейтрального атома, или отнять от отрицательного иона (аниона), чтобы окислить его до нейтрального атома.
Степень окисления (в отличие от валентности) может иметь нулевое, отрицательное и положительное значения.
Значения степени окисления записывают арабскими цифрами сверху над символом элемента. При указании степени окисления первым ставится знак, а потом численное значение, а не наоборот.
Степень окисления (в отличие от валентности) может иметь нулевое, отрицательное и положительное значения: -5, -4, -3, -2, -1, 0, +1, +2 , +3 , +4, +5, +6 , +7.
Следует помнить, что степень окисления является сугубо условной величиной, не имеющей физического смысла, но характеризующей образование химической связи межатомного взаимодействия в молекуле.
Степень окисления в ряде случаев не совпадает с валентностью. Например, в молекуле азотной кислоты степень окисления центрального атома азота равна +5, тогда как валентность равна IV.
Степень окисления зачастую не совпадает с фактическим числом электронов, которые участвуют в образовании связей.
Степень окисления марганца равна -3, -2, -1, 0, +1, +2 , +3, +4 , +5, +6, +7.
| Степень окисления марганца в соединениях | |
| -3 | |
| -2 | |
| -1 | Na[Mn(CO)5] |
| 0 | Mn, Mn2(CO)10 |
| +1 | MnC5H4CH3(CO)3 |
| +2 | MnCl2, MnCO3, MnO |
| +3 | MnF3, Mn(OAc)3, Mn2O3 |
| +4 | MnO2 |
| +5 | K3MnO4 |
| +6 | K2MnO4 |
| +7 | KMnO4, Mn2O7 |
Все свойства атома марганца
Источник: https://ru.wikipedia.org
Примечание: © Фото https://www.pexels.com, https://pixabay.com
Коэффициент востребованности
139
Как определить степень окисления
Материал по химии
Что такое степень окисления?
Степень окисления – это условная величина, отражающая количество принятых или отданных электронов при образовании заряженной частицы из электронейтрального атома при условии, что электроны переходят от одного атома к другому полностью.
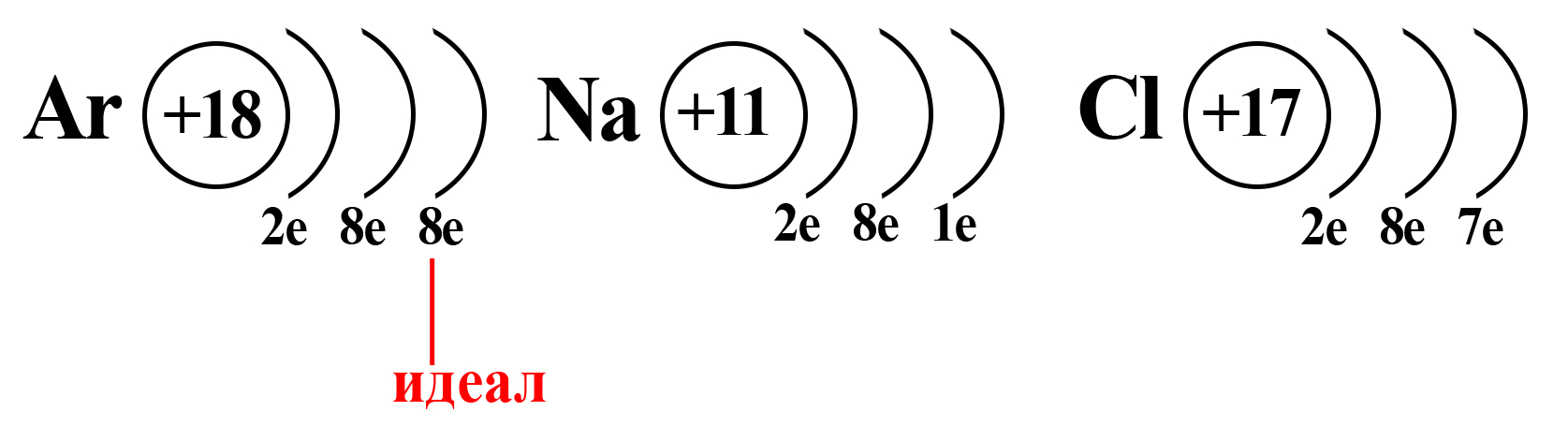
Вспомним, что идеальное количество электронов на внешнем электронном уровне атома равно восьми. Такую конфигурацию внешнего слоя имеют атомы большинства благородных газов (кроме гелия). И к такой электронной конфигурации стремятся атомы других элементов.
Как определить степень окисления
Конфигурация благородного газа
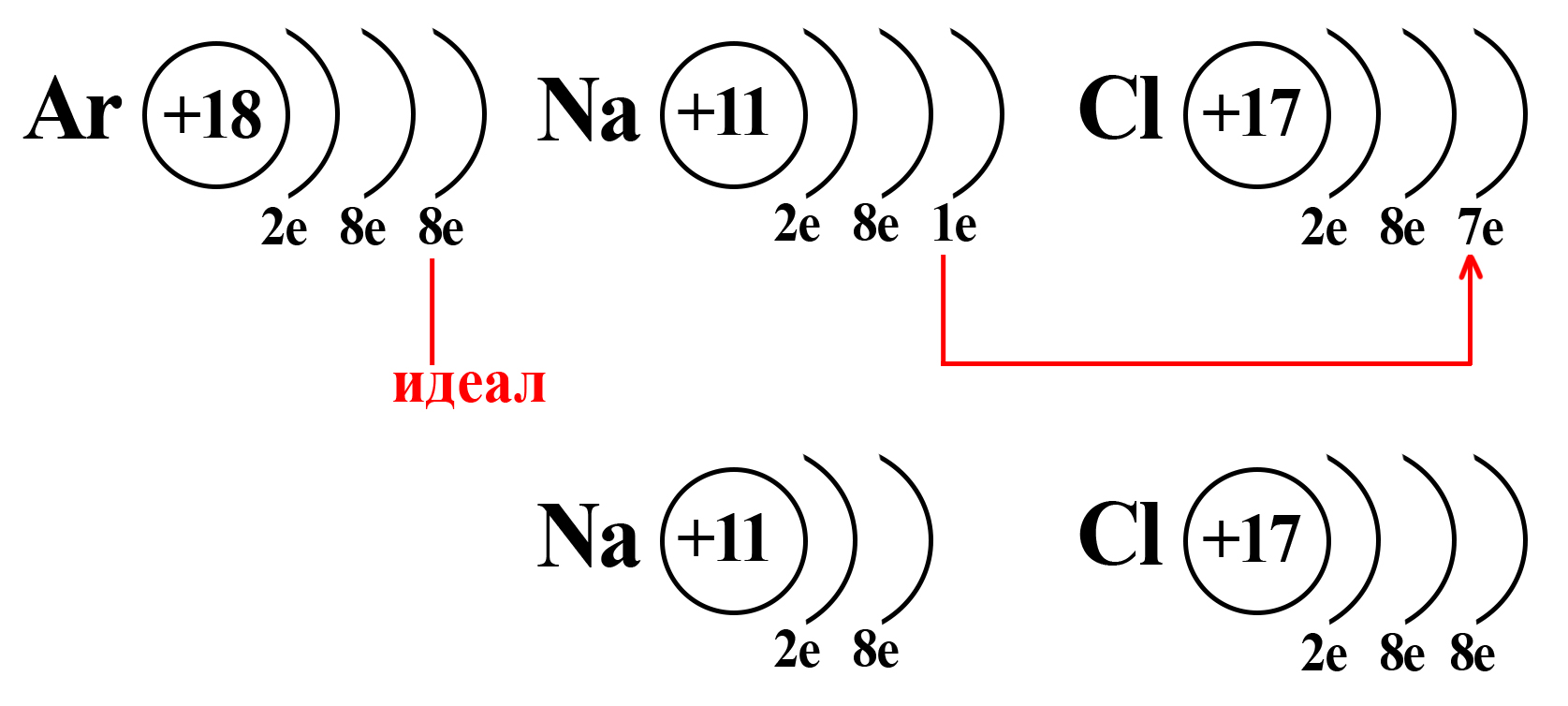
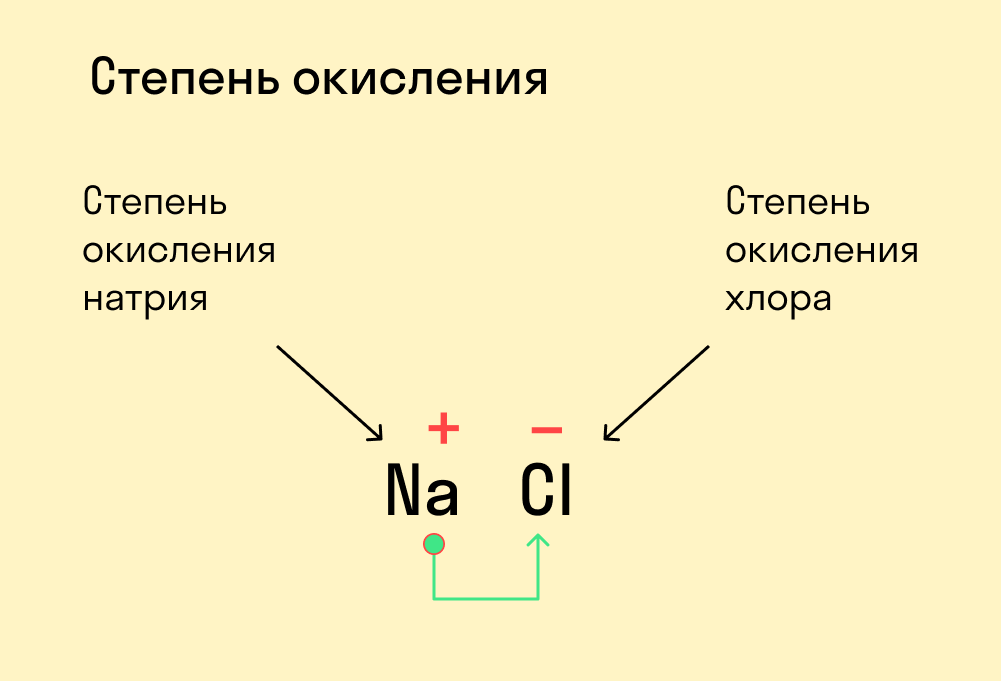
Натрий и хлор не так далеки от «идеала», как может показаться. Если атомы этих элементов столкнуться, внешний электрон натрия притянется на внешний электронный уровень хлора (из-за большей электроотрицательности хлора):
Таким образом, натрий и хлор как будто вступают в симбиоз: натрию, для приобретения «благородной» конфигурации необходимо избавиться от внешнего электрона (при потере внешнего электрона теряется и внешний уровень, а предвнешний уровень, имеющий идеальное количество электронов, становится внешним), тогда как хлору необходимо получить один электрон, чтобы завершить внешний энергетический уровень.
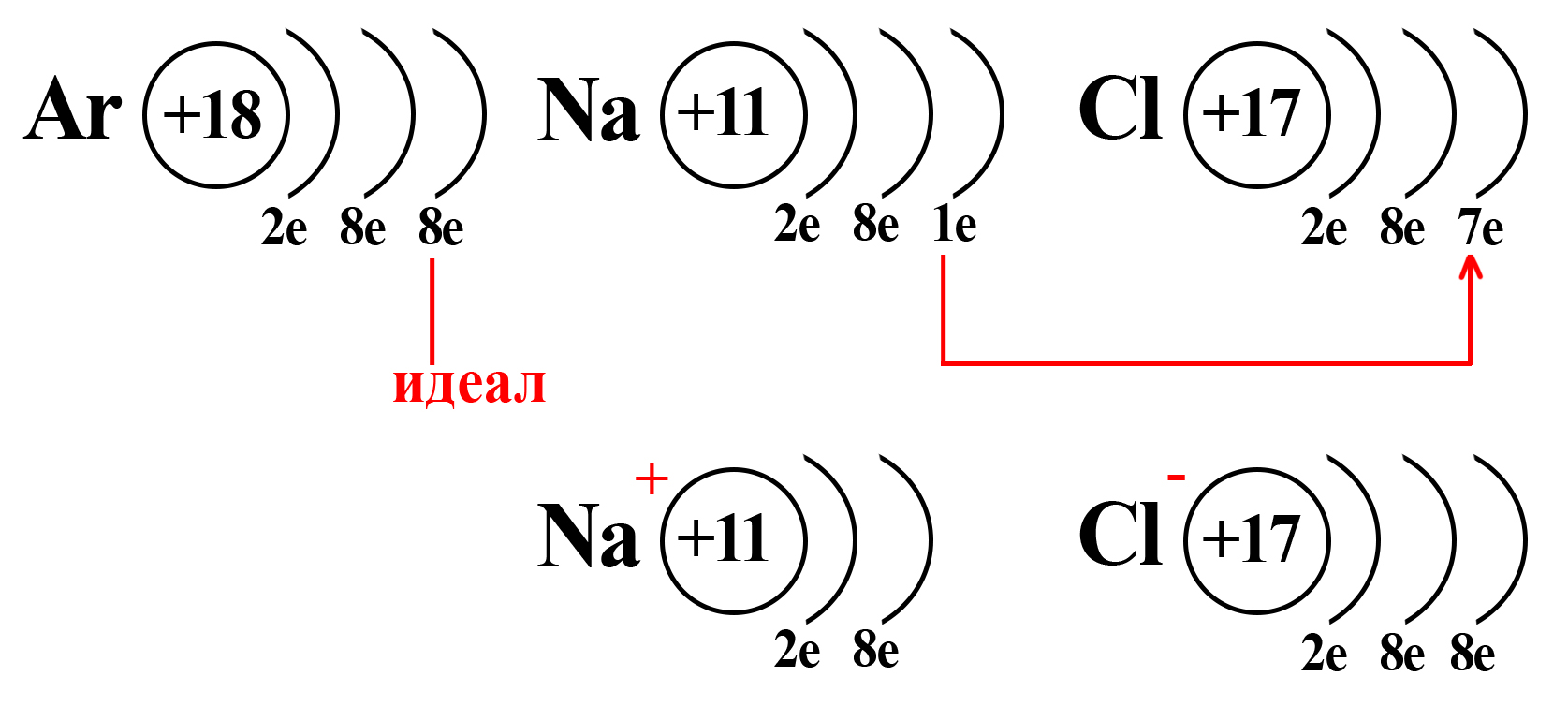
Потеряв один электрон, натрий приобретает положительный заряд, становится катионом (положительно заряженной частицей). Это объясняется тем, что ядро натрия по-прежнему имеет 11 протонов, а вот электронная оболочка, после взаимодействия с хлором, содержит 10 электронов. Таким образом, натрий будет иметь 11 положительно заряженных частиц и 10 отрицательно заряженных частиц. По простейшему уравнению: +11 – 10 = +1, становится ясно, откуда взялся положительный заряд.
Аналогичный расчет можно привести и для хлора. После взаимодействия с натрием ядро атома хлора не изменяется, оно содержит 17 положительно заряженных частиц (протонов), а оболочка – 18 отрицательно заряженных частиц (электронов). +17 – 18 = ‒1.
Полученные заряды и являются степенями окисления.
Также степень окисления можно выразить количеством электронов, которые иону нужно получить или отдать для того, чтобы стать электронейтральным атомом. Так, катион натрия, имеющий заряд «+1», должен получить 1 электрон, чтобы превратиться в атом натрия: Na+ +1ē = Na0. А анион хлора (хлорид-ион), имеющий заряд «‒1» должен отдать один электрон: Cl— -1ē = Cl0.
Для упрощения понятие «степень окисления» применяется не только для веществ с ионным строением (металл + неметалл), но и для веществ с ковалентными полярными связями. Несмотря на то, что в таком типе связи полного перехода электронов от одного атома к другому не происходит, полученные частичные заряды превращаются в целые.
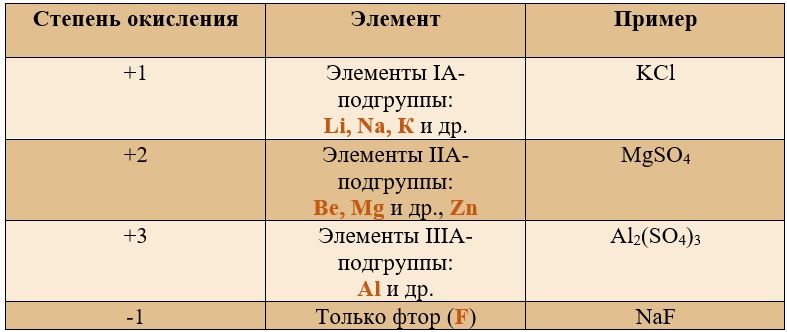
Постоянные степени окисления.
Знания этой простой, базовой темы помогут Вам решать не только тестовые задания. Одно из самых сложных заданий ЕГЭ – расстановка коэффициентов с помощью электронного баланса – не решается без знания степеней окисления.
Таблица «Элементы, имеющие постоянную степень окисления»
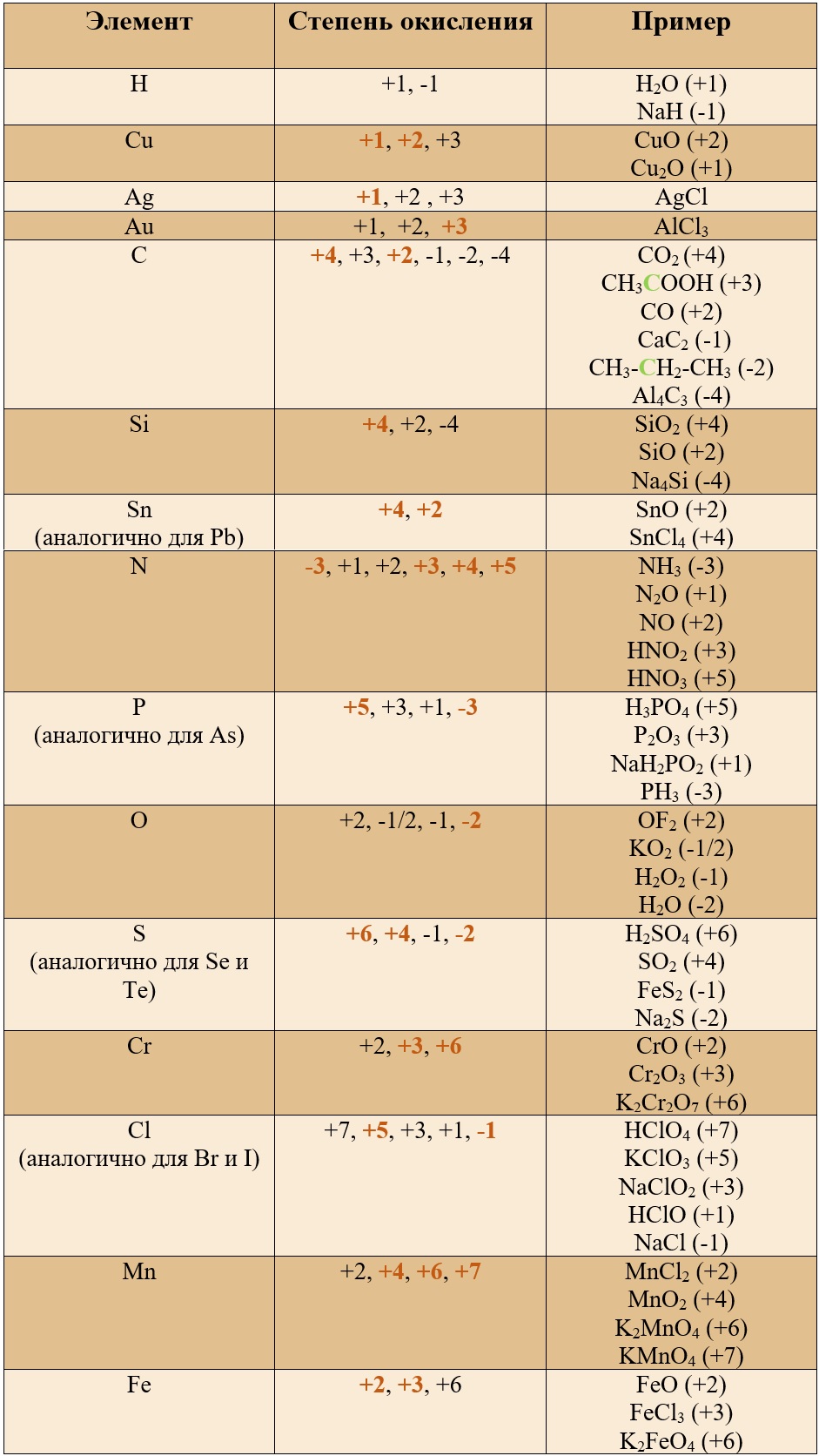
Таблица «Наиболее популярные степени окисления у остальных элементов» (Выделены бурым)*
*В таблице указаны не все возможные степени окисления.
Таким образом, медь, серебро, золото и железо не проявляют высшей степени окисления, равной номеру группы, у остальных же элементов высшая степень окисления равна номеру группы.
Для определения степени окисления не нужно учить всю таблицу, и тем более все степени окисления. Они приведены для справки, наиболее важными являются:
Определение степеней окисления в бинарных соединениях
Для примера возьмём оксид фосфора (P2O5)
- Определим степень окисления известного элемента (в нашем случае это кислород).
- Условно разделим молекулу на две части: чаще всего первая часть молекулы положительная, а вторая – отрицательная (искл: NH3 и PH3).
- Индекс после кислорода указывает на, что в молекуле содержится пять атомов кислорода, каждый из них имеет степень окисления «-2», поэтому общее количество отрицательных зарядов будет равно «-10».
- Молекула должна быть электронейтральной, то есть количество положительных и отрицательных зарядов должны быть равными. Из этого следует, что все атомы фосфора в данной молекуле в сумме должны иметь десять положительных зарядов.
- Индекс «2» после фосфора означает, что в молекуле содержится два атома фосфора, между которыми поровну нужно разделить общий положительный заряд (+10:2=+5)
Аналогичным образом происходит определение степени окисления в более сложных веществах, для примера возьмём перманганат калия (KMnO4):
- Подпишем степени окисления для элементов, имеющих постоянные их значения:
- Разделим молекулу на положительный и отрицательный «полюс» (в соединениях, состоящих из атомов трех элементов, чаще всего первые два являются положительными, а третий — отрицательным).
- Посчитаем общее количество положительных и отрицательных зарядов с учетом индексов:
- Ответим на вопрос: какого количества плюсов не хватает, что бы положительные и отрицательные заряды имели одинаковое значение? До +8 не хватает семи положительных зарядов, откуда следует, что степень окисления марганца равна «+7».
Ну и напоследок разберем степени окисления элементов в дихромате калия (K2Cr2O7):
- Подписываем известные степени окисления:
- Делим молекулу на положительную и отрицательную части:
- Считаем общее количество «плюсов» и «минусов»:
- Подсчитываем, сколько положительных зарядов не достает для того, чтобы молекула стала электронейтральной (т. е. такой молекулой, в которой количество положительных и отрицательных зарядов было одинаковым):
- Так как молекула содержит два атома хрома, двенадцать положительных зарядов должны распределиться между ними поровну, то есть, каждый хром имеет заряд +6:
Как быть, если в формуле встретились скобки? Например, как посчитать степень окисления брома в пербромате кальция?
- Для начала определим все известные степени окисления, как делали в предыдущих примерах:
- Посчитаем сумму положительных и отрицательных зарядов. Важно учесть все индексы. Помните, что индекс. Расположенный за атомом действует только на этот атом, а индекс, расположенный за скобкой, действует на всё содержимое скобок:
Таким образом, в пербромате кальция содержится: один атом кальция, два атома брома и 8 атомов кислорода (индексы, относящиеся к одному и тому же атому перемножаются).
Следовательно, мы имеем два положительных заряда от кальция и шестнадцать отрицательных от кислорода. Так как индекс «2» за скобками действует и на бром, его заряд можно выразить как 2х.
Получаем уравнение:
2 + 2х ‒ 16 = 0
2х = 14
х = 7
Степень окисления брома в пербромате кальция равна «+7».
Что такое степень окисления
Для начала давайте вспомним, как проходят химические связи в молекуле вещества. Взаимодействуя между собой, атомы могут притягивать или отдавать электроны для образования общей электронной пары. Атом с более высокой электроотрицательностью (ЭО) притягивает электроны и приобретает отрицательный заряд, а атом с меньшей ЭО, напротив, отдает электроны и обретает положительный заряд.
Степень окисления — это условный заряд, который предположительно обретет атом после перемещения электронов. Он вычисляется из предположения, что все свободные электроны полностью перемещаются от одного атома к другому и все образованные связи — ионные.
Почему в определении степени окисления мы говорим об условном заряде? Потому что в реальности он может быть другим, а химические связи атома в соединении не обязательно будут ионными. Но мы предполагаем, что все именно так, чтобы немного упростить расчеты. Это помогает в составлении формул и классификаций.
Запомните:
-
Численно степень окисления равна количеству электронов, которые перешли от одного атома к другому.
-
У атома с меньшей ЭО, который отдает электроны, — положительная степень окисления.
-
У атома с большей ЭО, который притягивает электроны, — отрицательная степень окисления.
-
Простые вещества, такие как Cl2, O2 и т. д., имеют степень окисления, равную 0, поскольку смещения электронов в данном случае не происходит.
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Узнай, какие профессии будущего тебе подойдут
Пройди тест — и мы покажем, кем ты можешь стать, а ещё пришлём подробный гайд, как реализовать себя уже сейчас
Как рассчитать степень окисления
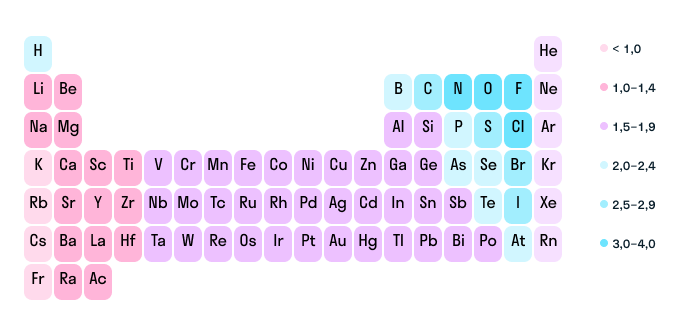
Как мы уже выяснили выше, определить степень окисления элемента (иначе говоря, окислительное число) помогает электроотрицательность. Значения ЭО легко узнать, пользуясь таблицей Менделеева или шкалой относительной электроотрицательности. Сравните, у какого химического элемента в соединении ЭО выше — этот элемент будет притягивать электроны и приобретет отрицательный заряд.
Шкала относительной электроотрицательности
Важно!
В нейтральной молекуле все окислительные числа в сумме образуют ноль. В ионе их сумма равна заряду иона.
Это правило поможет составить уравнение и посчитать степень окисления любого химического элемента в соединении, если известны данные по остальным элементам. Еще больше облегчат расчеты следующие закономерности:
-
у водорода в гидридах окислительное число −1, а во всех остальных веществах оно равно +1;
-
у кислорода степень окисления в оксидах равна −2, в пероксидах −1, в соединениях с фтором +2;
-
у неметаллов в соединениях с водородом и металлами окислительное число всегда отрицательное;
-
у металлов степень окисления всегда положительная.
Также есть элементы, которые во всех соединениях отдают или принимают одинаковое количество электронов, поэтому их окислительное число — постоянная величина.
Алгоритм действий
Итак, мы знаем основные закономерности. Давайте разберемся, как находить степени окисления на примерах. Предлагаем следующий алгоритм действий.
-
Посмотрите, является ли вещество элементарным. Если да — значит, оно находится в химически несвязанном состоянии и окислительное число равно 0. Это правило подходит как для веществ, образованных из отдельных атомов, так и для тех, что включают многоатомные молекулы одного и того же элемента.
-
Пример
Степень окисления Cl2, S8 равна 0.
-
Если это соединение, определите, состоит ли оно из ионов. В многоатомном ионе сумма всех степеней окисления равна его заряду. Узнайте эту сумму из таблицы растворимости и составьте уравнение с известными окислительными числами.
-
Если соединение — нейтральная молекула, составьте уравнение, учитывая, что все окислительные числа в сумме равны 0.
Пример
Допустим, нужно определить заряд азота в ионе аммония.
Согласно таблице растворимости заряд иона аммония NH4+ равен +1. Это значит, что сумма степеней окисления в этом соединении тоже будет равна +1.
Также известно, что водород всюду, кроме гидридов, имеет заряд +1. В данном случае есть 4 атома водорода, т. е. +1 × 4.
Составим формулу: х + (+1) × 4 = +1. Значит х = −3.
Окислительное число азота в ионе аммония равно −3, т. е. N-3H4+1.
Пример
Допустим, нужно определить степень окисления серы в соединении Na2SO4.
Мы знаем, что у щелочного металла Na постоянное окислительное число +1. Кислород, согласно вышеизложенным правилам, в оксидах имеет заряд −2.
Составим уравнение: (+1) × 2 + х + (−2) × 4 = 0. Значит х = +6.
Степень окисления серы равна +6, т. е. Na2+1S+6O4-2.
Как узнать степень окисления нескольких элементов
А как быть, если неизвестны окислительные числа двух и более элементов в соединении? В математике уравнения с двумя неизвестными не всегда имеют решение. Но в химии есть выход: можно разделить химическую формулу на несколько частей, которые имеют постоянные заряды.
Пример
Как вычислить степень окисления в сложном веществе (NH4)2SO4? Посмотрим на него как на соединение двух ионов с известными зарядами: NH4+ и SO42-.
Поскольку мы знаем окислительные числа водорода и кислорода, найти заряды азота и серы в каждом ионе не составит труда.
В ионе NH4+ формула для определения заряда азота будет следующей: х + (+1) × 4 = 1. Понятно, что х = −3, т. е. степень окисления азота −3.
В ионе SO42- формула для серы х + (−2) × 4 = −2. Следовательно, х = 6, т. е. заряд серы равен +6.
Получаем следующие окислительные числа: (N-3H4+1)2S+6O4-2.
Как определить высшую и низшую степень окисления
Выделяют высшую (или максимально положительную) и низшую (максимально отрицательную) степени окисления. В диапазоне между ними располагаются окислительные числа, которые могут принадлежать данному химическому элементу в различных соединениях. Для четных групп характерны четные числа в диапазоне, а для нечетных групп — нечетные.
Высшая степень окисления совпадает с номером группы элемента (для элементов в главной подгруппе) в короткой форме периодической системы.
Низшая степень окисления равна числу, которое получится, если от номера группы элемента отнять 8.
Исключения: фтор, железо, кобальт, родий, подгруппа никеля, кислород, благородные газы (помимо ксенона).
Проиллюстрируем на примере, как найти высшую и низшую степень окисления.
Хлор (Cl), согласно короткой периодической таблице, принадлежит к группе VII. Значит, его максимальное окислительное число будет +7. Такой условный заряд элемент приобретает в оксиде хлора Cl2O7 и хлорной кислоте HClO4. Минимальное число получаем следующим образом: 7 − 8 = −1 (характерно для хлороводорода HCl).
Картинка
По степени окисления можно понять, как поведет себя вещество в окислительно-восстановительных реакциях. Если в соединении главный действующий элемент имеет высшую степень окисления, оно является окислителем, а если он имеет низшую степень окисления — восстановителем.
Например, серная кислота является окислителем, поскольку у серы в данном случае заряд +6. А вот в сернистой кислоте у серы заряд всего +4, поэтому она может проявлять и окислительную способность, и восстановительную. В сероводороде заряд серы равен −2, и это минимальная степень окисления, а значит, данное вещество — восстановитель.
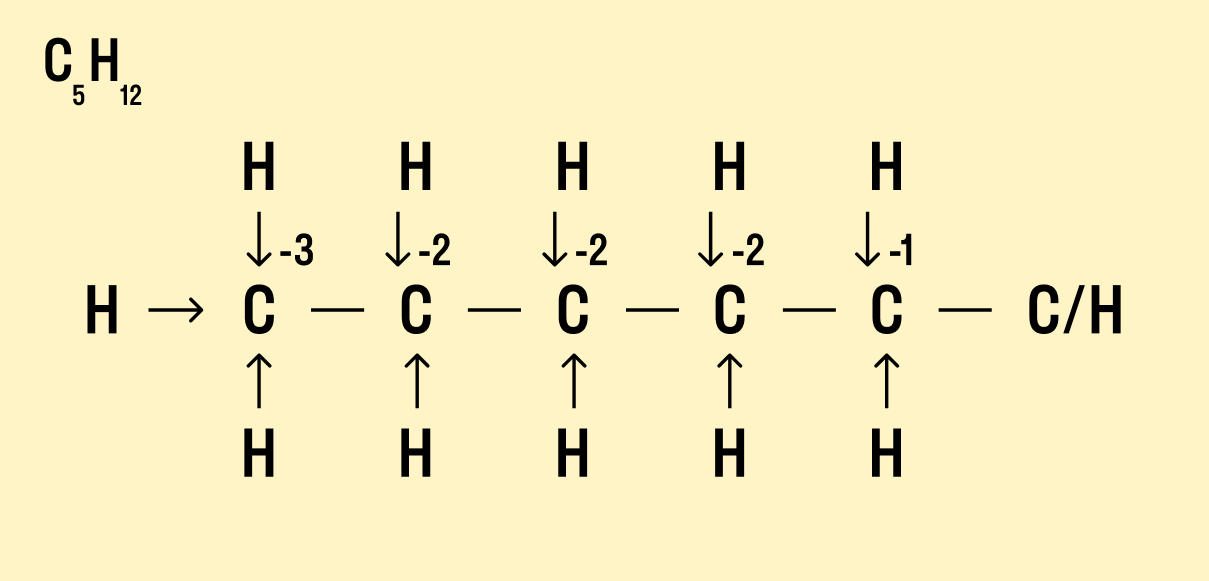
Как найти степень окисления в органическом соединении
В органической химии определять окислительные числа элементов немного сложнее, поскольку все органические вещества включают углерод, известный большим количеством неполярных связей. Если у нас всего один атом углерода, можно использовать стандартный способ.
Пример
Рассчитайте степень окисления углерода в метаноле H3C−OH.
Мы знаем, что водород Н имеет окислительное число +1, а у кислорода в данном случае оно равно −2. Составим уравнение:
х + (+1) × 4 + (+2) × 1 = 0
х + 4 − 2 = 0
х = −2
Заряд углерода равен −2, т. е. C-2H4+1O-2.
Но что делать, если атомов углерода больше? Придется анализировать структурную формулу, чтобы понять, какие химические связи есть между элементами и сколько электронов они теряют/приобретают в результате. Такой вариант нахождения окислительного числа называют графическим.
Графический метод
-
Нарисуйте структурную формулу соединения.
-
Изобразите стрелками химические связи и смещение атомов (все связи между атомами углерода С−С считайте неполярными).
-
Посчитайте, сколько стрелок ведет к атому (это «−») и сколько от него (это «+»), а затем суммируйте «+» и «−», чтобы узнать степень окисления.
-
валентность не имеет знака, в то время как у окислительного числа он есть («+» или «−»);
-
валентность равна нулю только в том случае, если атом не имеет связей с другими частицами, а степень окисления может быть равна нулю и при наличии таких связей;
-
вычисляя степень окисления, мы предполагаем, что в соединении ионные связи, хотя на самым деле это может быть не так, а валентность всегда имеет реальный смысл.
-
Почему степень окисления называют формальным зарядом, условным?
-
Что отражает численная величина степени окисления?
-
Чему равна сумма всех окислительных чисел в ионе?
-
Как определить низшую степень окисления?
-
Как найти две неизвестных степени окисления в одном веществе?
-
Как определять степени окисления в органических веществах?
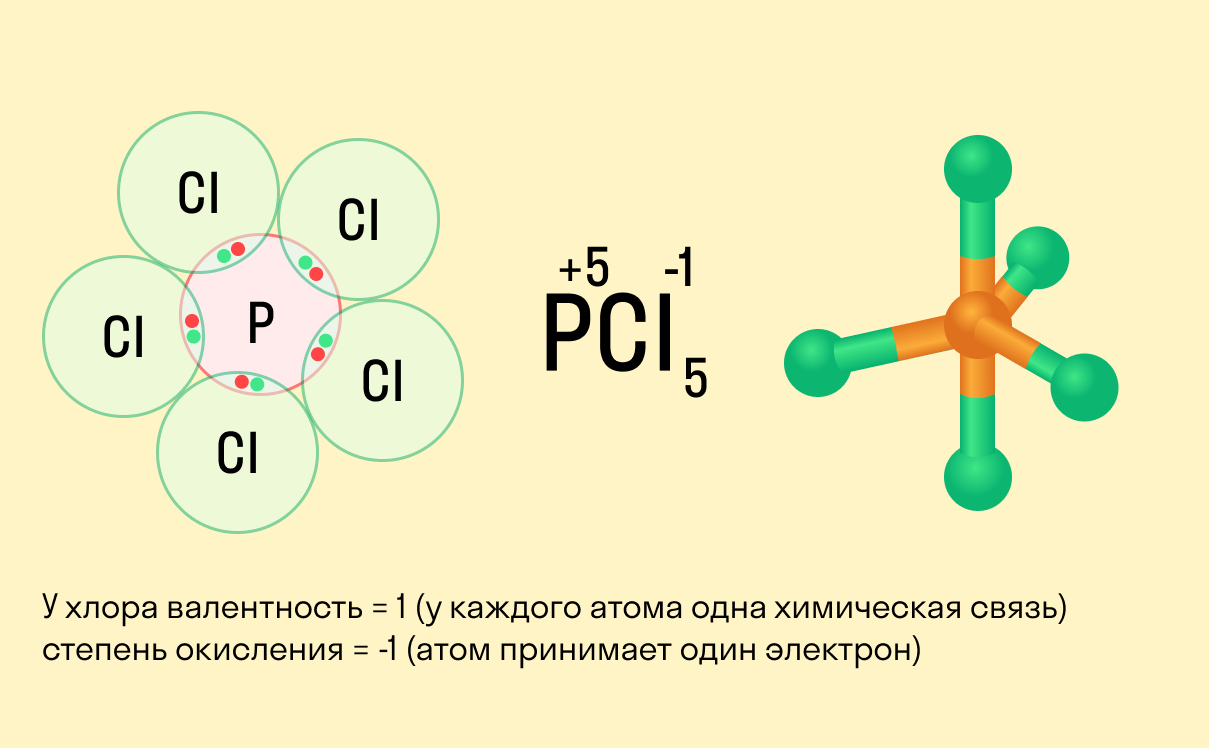
Валентность и степень окисления: в чем разница?
Школьники, которые только начали изучать данные разделы химии, нередко путают степень окисления и валентность. Численно эти показатели могут совпадать (но далеко не всегда), а вот по смыслу они в корне различаются.
Важно!
Валентность показывает, какое количество связей способен образовать один атом, а степень окисления — сколько электронов перемещается в результате этих связей.
Между этими двумя понятиями есть следующие отличия:
Поэтому отождествлять эти два понятия ни в коем случае не стоит. Более того, не нужно ориентироваться на валентность, пытаясь определить окислительное число.