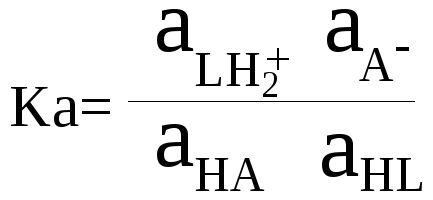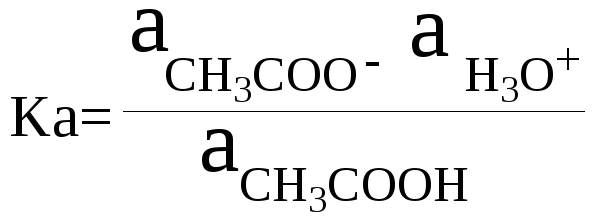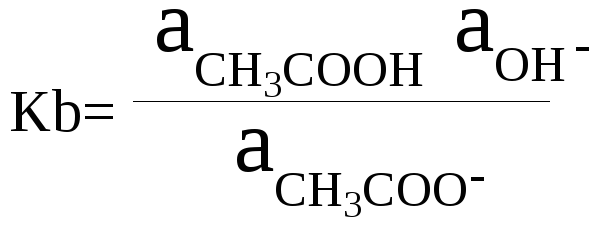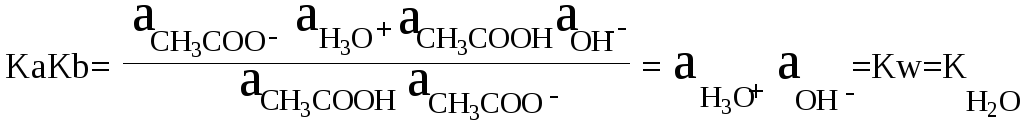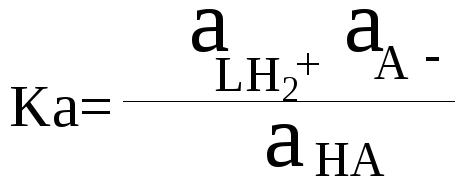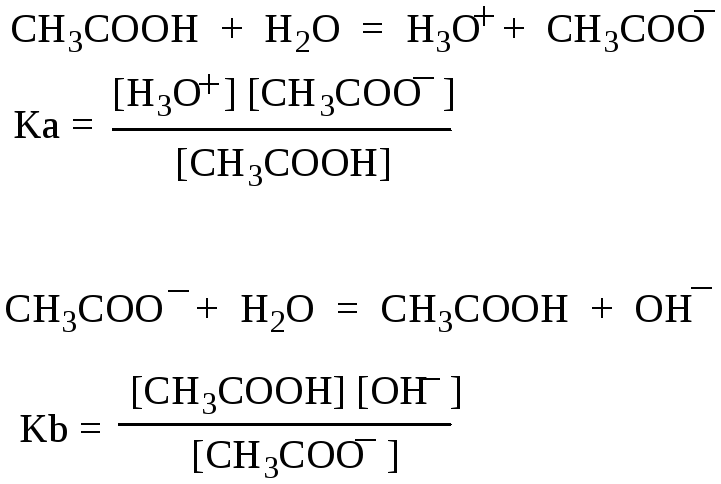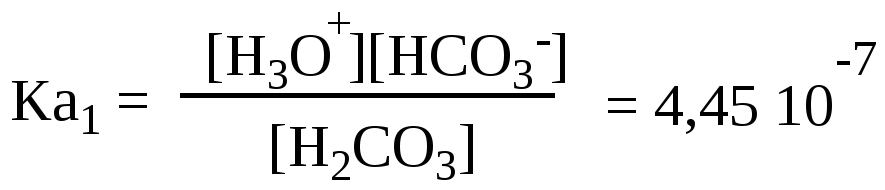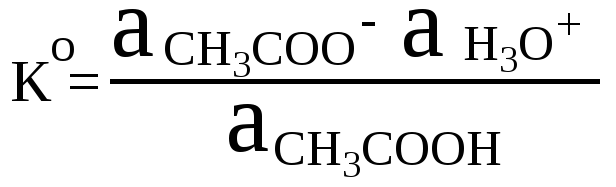Вещества,
которые в растворе(или в расплаве)
состоят полностью или частично из ионов
называются электролитами.
Различают сильные и слабые электролиты.
Сильные электролиты – вещества, которые
при растворении практически полностью
диссоциируют на ионы. Слабые электролиты
– это электролиты, которые в растворе
неполностью диссоциируют на ионы.
Свойства растворов слабых электролитов
в значительной степени обусловлены
существующими в них равновесиями между
непродиссоциировавшими молекулами и
ионами, которые образуются в результате
частичной диссоциации молекул. Реакции
диссоциации слабых электролитов
описываются законом действующих масс
и характеризуются константой и степенью
диссоциации.
Равновесия
в растворах кислот и оснований в химии
выделяются в отдельный вид в связи с
резким отличием катиона водорода от
всех остальных ионов и важностью реакций
с участием протона для большинства
разделов химии, в том числе и биохимии.
Существует несколько теорий
кислотно-основных превращений. Первой
теоретической концепцией была теория
Аррениуса.
Согласно
теории электролитической диссоциации
Аррениуса, например, в водном растворе
уксусная кислота распадается на ацетат
ионы и ионы водорода:
CH3COOH(p)
= CH3COO-(p)
+ H+(p)
Выражение
закона действующих масс для реакции
диссоциации уксусной кислоты:
К
– константа равновесия, которую для
реакций диссоциаций называют константой
диссоциации или константой ионизации;
[CH3COO-],[H+]
и [CH3COOH]
– равновесные концентрации ацетат-
ионов, ионов водорода и молекул уксусной
кислоты.
Но
теория Аррениуса не учитывает влияние
растворителя и нельзя, в частности,
представить существование катиона Н+
в растворе, так как протон лишён
электронной оболочки, меньше других
ионов и очень подвижен. Многие растворители
обладают способностью переносить
протоны к соответствующим акцепторам
или присоединять протоны к молекуле
растворителя. Это учитывает протолитическая
теория Н.Бренстеда и Т. Лоури.
Одновременно
с теорией Бренстеда и Лоури появилась
теория Льюисасогласно которой
кислоты—вещества, принимающие пару
электронов, основания—вещества, отдающие
её. Например, кислотами являются молекулы
с незаполненной восьмиэлектронной
оболочкой (BF3,SO3),
катионы-комплеrсообразователи(Fe3+,Co2+),
молекулы с поляризованными двойными
связями (CO2,SO2),
а основаниями— молекулы, содержащие
свободные электронные пары(NH3,H2O),
анионы, органические соединения с
двойными и тройными связями.
Разновидностью
теории Льюиса является концепция
жёстких и мягких кислот Пирсона.Таким
образом, в круг кислотно-основных реакций
включается комплексообразование.
Наиболее
общей теорией кислот и оснований является
теория Усановича, в соответствии с
которой кислоты — вещества, отдающие
катионы или принимающие анионы или
электроны; основания — вещества, отдающие
анионы или электроны и принимающие
катионы. Кислоты и основания Усановича
включаюткислоты и основания Льюиса
окислители и восстановители.
Согласно
протолитической теории кислотами
являются вещества―доноры
протона,
а основаниями―акцепторы
протона.
Кислотами
и основаниями могут быть как нейтральные
молекулы, так и ионы.
Пример
кислот: HCl,
H3PO4,
HCOOH,
H2O,
PCl5,
Cl2,
H3O+,
[Al(H2O)6]3+,HCO3—
,NH4+.
Пример
оснований: NH3,
H2O,
CH3NH2,
C2H5OH,
СаО, Cl–,
CH3COO–,
OH–,
[Al(H2O)5OH]2+.
Некоторые
вещества способны быть и донором и
акцептором протонов. Такие вещества
называются амфолитами.
Например, H2О,HCO3–,
[Al(H2O)5OH]2+.
Обратимые
реакции с переносом протона от кислоты
НА к основанию В называются кислотно-основными
полуреакциями. Реакция между кислотой
и основанием — «борьба» за протон между
двумя основаниями:
НА + HL
= LН2+
+ А–
кислота 1 основание
2 кислота 2 основание 1
Кислота
и получившееся при отдаче протона
основание составляют сопряжённую пару.
В этом уравнении это НА и А–
, LН2+
и LH.
Примеры
протолитических равновесий:
HCl
+ H2O
= H3O+
+ Cl–
(1)
кислота-1
основание-2 кислота-2 основание-1
HCl
+ OH-
= H2O
+ Cl–
(2)
кислота-1
основание-2 кислота-2 основание- 1
H2O
+ NH3
= NH4+
+ OH–
(3)
кислота-1
основание-2 кислота-2 основание-1
NH4+
+ H2O
= H3O+
+ NH3
(4)
кислота-1
основание-2 кислота- 2 основание-1
Растворитель
является одним из участников протолитической
реакции.
Вода
как амфолит
обладает как кислотными, так и основными
свойствами. Такие растворители являются
амфипротными.
Важнейшая особенность амфипротных
растворителей ― способность к передаче
протона от одной молекулы растворителя
к другой.
H2O
+ H2O
= H3O+
+ OH-
Такие
процессы, в которых одна молекула
растворителя проявляет свойства кислоты,
а другая — основания, называется
автопротолизом.
Название иона Н3О+
— «гидроксоний». Константа автопротолиза
воды Кw
или Кн2о
называется ионным произведением воды:
Кw
= a(Н3О+)
∙a(ОН–)
= 1,0 ∙ 10–14(25оС).
Ионное
произведение воды независимо от изменения
концентраций ионов при неизменной
температуре остаётся постоянным.
В
нейтральном растворе а(Н3О+)=а(ОН–)
= 10–7
моль/л
В
кислой среде а(Н3О+)>а(ОН–).
В щелочной среде а(Н3О+)<а(ОН–).
Кислотность
среды принято оценивать по водородному
показателю рН, который равен отрицательному
десятичному логарифму от активности
иона Н3О+
(или Н+)
рН
= – lg
а(Н3О+)
или рН = – lg
а(Н+).
При
малой ионной силе, когда активность
иона практически равна его концентрации
рН = – lg[H3O+]
.
Аналогично:
гидроксильный показатель pOH
= – lg
a(OH–)
или – lg[OH–].
Таким
образом, в нейтральной среде рН = рОН =
7.
В
кислой среде: рН < 7 , рОН >7. В щелочной
среде: рН > 7, рОН < 7.
рН + рОН = 14 (298К)
При
взаимодействии с амфипротными
растворителями (например, водой)
растворённые вещества могут проявлять
как кислотные свойства ( ур-ие 4) , так и
основными свойствами (ур-ие 3).
Сила
кислоты и основания характеризуется
константами равновесий, которые
называются соответственно константой
кислотности Ка и константой основности
Кb
(см. табл. 4 Приложения).
НА + НL
= LН2+
+ А–
кислота-1
основание-2 кислота-2 основание-1
Эта
константа показывает относительную
кислотность кислоты НА по отношению
основанию В, т.е. является константой
кислотности Ка кислоты НА.
Например,
протолитическое равновесие в водном
растворе уксусной кислоты: СН3СООН
+ Н2О
= СН3СОО–
+ Н3О+.
Константа
кислотности уксусной кислоты Ка
показывает, что уксусная кислота является
более сильной кислотой, чем вода:
В
уравнение не входит активность воды,
которая принята равной единице.
Протолитическое
равновесие в водном растворе соли
уксусной кислоты:
СН3СОО–
+ Н2О
= СН3СООН
+ ОН–
Константа
этого протолитического равновесия
является константой основности ацетат
иона:
Константа
основности ацетат иона Kb
показывает, что ацетат ион является
более сильным основанием, чем вода.
Константы
кислотности и основности сопряжённой
пары связаны между собой.
Перемножив
Ка (СН3СООН)
и Кb(СН3СОО-),
получим:
Или
в общем виде: HA
+ HL
= LH2+
+ A-
A-
+ HL = HA + L-
Произведение
констант кислотности и основности Ka∙Kb
сопряжённой пары НА и А–
равно:
Активность
растворителя HL
принята равной единице.
При
малой величине ионной силы константы
кислотности и основности можно выразить
через концентрации:
Константы химического
равновесия, в том числе константы
кислотности и основности, тоже принято
выражать в логарифмической форме:
pKa = –
lg Ka , а
pKb = – lg Kb.
Для
сопряжённых кислот и оснований pKa
+ pKb
= 14 ( 298К)
Степень протолиза
α
слабого электролита представляет собой
отношение концентрации одного из
продуктов протолиза к равновесной
концентрации протолита.
Например,
степень протолиза уксусной кислоты :
α = [H3O+]
/ [CH3COOH]равн.
Математическая
зависимость константы кислотности (или
основности) и степень протолиза связаны
законом разбавления Оствальда:
НА + Н2О
= Н3О+
+ А—
К = α2
∙Сисх.
/ (1 – α).
Для малой величины
степени протолиза α (1 – α) ≈ 1 и упрощённая
формула имеет
вид:
К = α2
∙ Сисх.
где К – константа
кислотности (Ka)
или основности (Kb),
в зависимости от
вида протолиза.
Если α <<5% то
можно считать, что Сисх
= [НА]равн.
и, если пренебречь автопротолизом
воды:
Ка = [H3O+]
∙ [A—]
/ [HA]
= [H3O+]2
/ Cисх.
______
[H3O+]
= √Ka
Cисх.
Если
α > 5% , то [HA]равн
≠ Сисх.
и тогда [НА]равн.
= Сисх
– [Н3О+].
Ка
= [Н3О+]
[А—]
/ [НА] = [H3O+]2
/ ( Сисх
– [Н3О+]
)
[H3O+]2
+ Ka
[H3O+]
– Ka
Cисх.
= 0
Решая
квадратное уравнение, получим:
_____________
[H3O+]
= 0,5 (–Ka + √Ka2
+ 4Ka Cисх.)
Например,
для 0,01M
молочной кислоты:
_____________________
[H3O+]
= 0,5 (–1,4∙10-4
+ √ 1,96∙10-8
+ 4∙1,4∙0-4∙10-2
=
1,12∙10-4моль/л;
pH
= 2,95
Протолитические
равновесия в растворах амфолитов:
Это―
растворы кислых солей(NaHCO3,NaH2PO4
и т.п. ), аминокислот и т.п. В таких
растворах сосуществуют частицы и
принимающие, и отдающие протоны.
Так,
в растворе дигидрофосфата натрия
существуют следующие протолитические
равновесия:
H2PO4–
+ H2O
= H3O+
HPO42–
Ka(H2PO4–)
= 6,2 ∙10–8
H2PO4–
+ H2O
= H3PO4
+ OH–
Kb(H2PO4–)
= 1,4 ∙10–12
В
растворе гидрофосфата натрия — следующие:
HPO42–
+ H2O
= H3O+
+ PO43–
Ka(HPO42–)
= 4,6 ∙10–13
HPO42–
+ H2O
= H2PO4–
+ OH–
Kb(HPO42–)
= 1,6 ∙ 10–7
В
растворе дигидрофосфата натрия Ka>Kb
. В растворе рН <7.
В
растворе гидрофосфата натрия Kb>Ka.
В растворе pH>7.
Приведённые
примеры показывают, что протолитические
равновесия смещены в сторону образования
более слабых кислот и оснований. Таким
образом, протолитическое
равновесие можно рассматривать как
конкуренцию различных по силе оснований
за протон.
Пример
1 Рассчитайте
степень диссоциации (протолиза), рН,
с(Н3О
+)
и с(ОН—)
в водном растворе уксусной кислоты с
концентрацией 0,1моль/л. рКа(СН3СООН)
= 4,76.
Решение:
Протолитическое
равновесие: CH3COOH
+H2O
= CH3COO–
+ H3O+
Сопряжённые
пары: кислота СН3СООН
и сопряжённое с ней основание СН3СОО–;
основание Н2О
и сопряжённая с ним кислота Н3О+.
Константа
протолитического равновесия — константа
кислотности уксусной кислоты
Ка =
Для
слабых электролитов ионная сила мала
и коэффициент активности можно принят
равным 1.
Тогда: Ка =
Поскольку
с(СН3СОО–)
=с(Н3О+),
предыдущее выражение можно представить
в виде:
Ка
=;
Тогда: Ка·с(CH3COOH)
= c(H3O+)2.Прологарифмировав
левую и правую часть, получим: рКа –
lgc(CH3COOH)
= 2pH
Равновесная
концентрация уксусной кислоты равна
исходной за вычетом концентрации,
подвергнутой протолизу:
сравн=
сисх―
с(Н3О+)
[или с(СН3СОО—)]
Для слабых
электролитов, в растворах которых
концентрация ионов очень мала можно
принять сисх
– с(Н3О+)сисх
Тогда:
4,76 – lg0,1 = 2pH. pH = 2,88. pOH = 14 – 2,88 = 11,12.
c(H3O+)
=1,32·10-3
; c(OH—)
= 7,59·10-12
. Степень протолиза:
Пример
2. Рассчитайте
[HCO3–]
и [CO32–]
в 0,01М растворе угольной кислоты, если
рН этого раствора равен 4,5.
Ка1
=
4,45∙10–7
;
Ка2
=4,69∙10–11
.
Решение:
Протолитические
равновесия:
1
ступень:
H2CO3
+ H2O
= HCO3–
+ H3O+
2
ступень:
HCO3–
+ H2O
= CO32–
+ H3O+
pH
= 4,5. Отсюда
[H3O+]
= 3,16∙10-5
моль/л
Константа
протолиза (константа кислотности) по
первой ступени:
Отсюда
[HCO3–]
= 4,45∙ 10-7
∙
10-2
/
3,16∙10-5
= 1,41∙10-4
моль/л.
Отсюда
[CO32–]=4,69∙10–11∙1,41∙10–4
/
3,16∙10–5
= 2,09∙10–10
моль/л.
Пример
3.
Вычислите концентрационную константу
кислотности уксусной кислоты в водном
растворе при наличии в растворе соли
Mg(NO3)2
с
концентрацией 0,05 моль/л,
если
рКо
= 4,75.
Решение:
Термодинамическая
константа кислотности уксусной кислоты:
Концентрационная
константа кислотности уксусной кислоты:
a(CH3COO—)
=
f(CH3COO—)
∙ [CH3COO—];
a(H3O+)
= f(H3O+)
∙ [H3O+];
a(СH3COOH)
= f(CH3COOH)
∙ [CH3COOH].
Отсюда:
Kо
= Kc
f(CH3COO—)∙f(H3O+)
/
f(CH3COOH∙),
но
поскольку
для
уксусной
кислоты
коэффициент
активности
практически
равен
1,
то
Kc
= Kо
/ f(CH3COO—
)∙f(H3O+).
Ионная
сила раствора в основном определяется
сильным электролитом ―солью: I
= 0,5( 0,05∙ 22
+ 0,1∙1) = 0,15.
В
соответствии с табл. 5 Приложения:
f(CH3COO—)
=
0,79, а f(H3O+)
=
0,85.
Если
рКо
= 4,75, то Ко
=
1,78∙10-5.
Тогда
Кс
=
1,78∙10-5
/ 0,79∙0,85 = 2,65∙10-5
Пример
4.
Рассчитайте рН 0,01М раствора молочной
кислоты. Ка = 1,4 ∙ 10-4
Решение:
Протолитическое
равновесие:
CH3CH(OH)COOH
+ H2O
= CH3CH(OH)COO—
+ H3O+
Для
слабых электролитов, у которых степень
протолиза > 5%, уже нельзя считать
концентрацию молекул, не подвергнутых
протолизу, равной исходной концентрации
электролита. Поэтому для молочной
кислоты:
[CH3CH(OH)COOH]равн
= [CH3CH(OH)COOH]
исх.
–
[H3O+].
Тогда:
Ka = [H3O+]
∙ [CH3CH(OH)COO–]
/ [CH3CH(OH)COOH]равн
= [H3O+]2
/ [CH3CH(OH)COOH]
исх.
– [H3O+]
[H3O+]2
+ Ka[H3O+]
– Ka[CH3CH(OH)COOH]
исх.
= 0
_______________________________
[H3O+]
= 0,5(–Ka + √ Ka2
+ 4Ka[CH3CH(OH)COOH]исх.
_________________________
[H3O+]
= 0,5(–1,4 ∙ 10–4
+ √ (1,4 ∙10–4)2
+ 4∙ 1,4 ∙10–4
∙10–2
=
=
1,12 ∙10–3
моль/л
;
pH = 2,9
Пример
5.
Рассчитайте
рН раствора HCN
с концентрацией
10-6
моль/л . Ка = 6,2 ∙10–10
Решение:
Для
слабых электролитов с концентрацией <
10–4
моль/л, у которых константа протолиза
< 10–8
,
необходимо учитывать автопротолиз
воды.
Протолитическое
равновесие: HCN
+ H2O
= CN–
+ H3O+
Уравнение
электронейтральности: [H3O+]
= [CN–]
+ [OH–]
[OH–]
= Kw/
[H3O+]
;
Ka
= [H3O+]
∙ [CN–]
/ [HCN];
[CN—]
= Ka
[HCN]
/ [H3O+];
Поскольку
кислота очень слабая, можно считать:
[HCN]равн=
[HCN] исх.
Тогда:
[H3O+]
= Ka
∙ [HCN]исх.
/ [H3O+]
+ Kw
/ [H3O+];
[H3O+]2
= Ka [HCN]исх.
+ Kw;
____________________
____________________
[H3O+]
= √ Ka [HCN]исх.
+ Kw = √ 6,2 ∙ 10–10
∙ 10–6
+ 10–14
=
=1,03
∙ 10–7
моль/л
;
pH
= 6,99.
Пример
6. Рассчитайте
рН раствора ацетата натрия с концентрацией
0,1 моль/л, а также степень протолиза
(гидролиза) этой соли. Ка(СН3СООН)
= 1,75 ∙10-5.
Решение:
Протолитическое
равновесие: CH3COO–
+ H2O
= CH3COOH
+ OH–
Константа
протолиза (константа основности иона
ацетата):
Kb
= [CH3COOH]
[OH–]
/ [CH3COO–]
[CH3COOH]
= [OH–]
а)
Для приближенных расчетов можно
считать,
что
[CH3COO–]равн
= [CH3COO–]
исх.
б)
Для точных расчетов: [CH3COO–]равн
= [CH3COO–]
исх.
– [OH–]
Kb
= Kw/ Ka = 10–14
/ 1,75 ∙10–5
= 5,75 ∙10–10
а)
Kw/Ka = [OH–]2
/
[CH3COO–];
[OH–]2
= Kw/Ka [CH3COO–];
2pOH
= – lgKw + lgKa – lg[CH3COO–]
= – lg10–14
+ lg1,75 ∙10–5
– lg0,1= = 10,24.
pOH
= 5,12. pH = 14 – 5,12 = 8,88.
б)
Kw/Ka = [OH–]2
/ ([CH3COO–]
исх.
– [OH–]);
[OH–]2
= Kw/Ka ([CH3COO–]
исх.
– [OH–]);
[OH–]2
= 5,75 ∙ 10–10
( 0,1 – [OH–]);
Пусть
[OH–]=
x.
x2
+ 5,75 ∙10–10
∙ x – 5,75 ∙10–10
∙ 0,1 = 0;
x
= 7,6 ∙10-6;
[OH–]
= 7,6 ∙10–6
моль/л;
рОН
= 5,12; pH = 8,88.
Степень
гидролиза соли: h
= [OH–]
/ [CH3COO–]
исх.
= 7,6 ·10–6
/ 10–1
= =7,6
·10–5
= 0,0076%.
Пример
7. Рассчитайте
рН в растворе гидрокарбоната натрия с
концентрацией соли с= 0,1моль/л.
Ka1(H2CO3)
= 4,5 ∙10–7
; Ka2(HCO3–)
= 5,0∙10–11.
Решение
В
растворе гидрокарбоната натрия
устанавливаются равновесия:
НСО3–
+ Н2О
= Н3О+
+ СО32–
НСО3–
+ Н2О
= Н2СО3
+ ОН–
В
отличие от раствора слабой кислоты
[H3O+]≠
[CO32–],
так как часть ионов Н3О+
присоединяется к НСО3–
с образованием Н2СО3.
Следовательно,
[H3O+]
= [CO32–]
― [H2CO3]
Выразим
[CO32–]
и [H2CO3]
через соответствующие константы
кислотности угольной кислоты Кa1
и Ka2
Н2СО3
+ Н2О
= Н3О+
+ НСО3–
Ka1
=
4,5 ∙10–7
Отсюда
[H2CO3]
= [H3O+]
∙ [HCO3–]
/ Ka1
HCO3–
+ H2O
= H3O+
+ CO32–
Ka2
Отсюда
[CO32–]
= Ka2
∙[HCO3–]
/ [H3O+]
Тогда
[H3O+]
= Ka2
∙[HCO3–]
/ [H3O+]
― [H3O+]
∙ [HCO3–]
/ Ka1
После
преобразования получим:
[H3O+]2
= Ka2[HCO3–]
― [H3O+]2
∙ [HCO3–]
/ Ka1
=
[H3O+]2
(1
+ [HCO3–]
/ Ka1)
= Ka2[HCO3–].
[H3O+]2
= Ka1
∙ Ka2
[HCO3–]
/ Ka1
+ [HCO3–]
Поскольку
[HCO3–]
» Ka1
,
то Ka1
+ [HCO3–]
= [HCO3–]
Тогда
[H3O+]2
= Ka1
∙Ka2
[HCO3–]
/ [HCO3–]
= Ka1∙
Ka2
________
_______________
[H3O+]
= √ Ka1∙
Ka2
=
√ 4,4 ∙10–7
4,7 ∙10–11
=
4,55 ∙10–9
моль/л.
pH
= 8,34
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
12.02.201517.78 Mб845Polunina_N_V_Obschestvennoe_zdorovye.pdf
- #
- #
- #
12.02.20151.51 Mб20POSOBIE_DLQ_PODGOTOVKI_K_EKZAMENU.rtf
- #
12.02.20153.69 Mб1918Posobie_dlya_10kl_gl_var.doc
- #
- #
- #
- #
- #
- #
Степень — протолиз
Cтраница 2
Так как Ка ( Кь) — некоторые постоянные, степень протолиза увеличивается по мере снижения исходной концентрации кислоты и становится равной единице при бесконечном разбавлении. Поэтому в сильно разбавленных растворах вода почти полностью протолизирует слабые протолиты. В отличие от Ка и Кь степень протолиза зависит от разведения и поэтому мало пригодна для количественного сравнения силы кислот и оснований.
[16]
Подобно тому как диссоциацию соли определяют степенью диссоциации, в качестве меры протолиза вводят степень протолиза.
[17]
Рассчитайте молярную концентрацию для Н3О и Н2РО4 ( по точной формуле, см. задачу 7.59), для НРО — и РО % — и степень протолиза ( %) для Н3РО4 ( по точной формуле, см. задачу 7.63), а также для Н2РС 4 и НРОд в 0 1М растворе ортофос-форной кислоты.
[18]
Известно, что связь лантаноид — вода в аквакатионах [ Ьп ( НаО) 8 ] 3 упрочняется при переходе La к Lu. Как изменяется степень протолиза аквакатионов.
[19]
Мольная доля сопряженного протолита, образовавшегося в результате протолиза растворенного протолита, показывает, какая часть растворенного протолита подвергается протолизу. Эта мольная доля обычно называется степенью протолиза.
[20]
Молярная доля сопряженного протолита, образовавшегося в результате протолиза растворенного протолита, показывает, какая часть растворенного протолита подвергается протолизу. Эта молярная доля обычно называется степенью протолиза.
[21]
Аналогичное соотношение известно и для протолиза слабого основания. Из закона разбавления Оствальда следует, что с уменьшением концентрации слабой кислоты или слабого основания значение степени протолиза увеличивается.
[22]
Так как Ка ( Кь) — некоторые постоянные, степень протолиза увеличивается по мере снижения исходной концентрации кислоты и становится равной единице при бесконечном разбавлении. Поэтому в сильно разбавленных растворах вода почти полностью протолизирует слабые протолиты. В отличие от Ка и Кь степень протолиза зависит от разведения и поэтому мало пригодна для количественного сравнения силы кислот и оснований.
[23]
Страницы:
1
2
Содержание
- Способы уменьшения степени протолиза
- ЦУ (ценные указания)
- Задачник по общей и неорганической химии
- 7. Водные растворы протолитов. 7.3. Смещение протолитических равновесий
- Теоретическая часть
- Протолитические равновесия
Способы уменьшения степени протолиза
Смещение протолитического равновесия, как любого другого химического равновесия, подчиняется принципу Ле-Шателье.
Влияние температуры определяется эндотермичностью реакций протолиза:
Cr 3+ . H2O + H2O 
HF + H2O 
SO3 2 — + H2O 
При охлаждении раствора протолитические равновесия сдвигаются влево (в сторону реагентов), а при нагревании — вправо (в сторону продуктов). Последнее часто используется на практике для увеличения полноты протекания реакций протолиза. Иногда это приводит даже к полному разрушению равновесия:
Влияние концентрации растворенного вещества определяется тем, что вода — полноправный реагент протолитических реакций. При разбавлении раствора (уменьшении концентрации вещества) степень протолиза увеличивается, при концентрировании раствора — уменьшается. Иногда в сильно разбавленных растворах протолитическое равновесие разрушается:
Влияние одноименного иона среды протолиза осуществляется введением избытка ионов H3O + (при протолизе кислот) или OH — (при протолизе оснований).
Это смещает протолитическое равновесие влево (избыток H3O + создается прибавлением сильной кислоты HB, а избыток ионов OH — — прибавлением щелочи MOH):
(1) HA + H2O 
HB + H2O = B — + H3O +
(2) B + H2O 
На практике этим пользуются для уменьшения степени протолиза, если он нежелателен. Например, вводя добавку серной кислоты в раствор соли железа(III), снижают степень протолиза катионов соли:
Fe 3+ . H2O + H2O 
Добавление продукта протолиза (A — для кислот, HB + для оснований) требует осторожности, поскольку и A — , и HB + сами являются протолитами. Например, при малом избытке ионов CN — , вводимых в раствор циановодорода, преобладает смещение равновесия протолиза HCN влево и среда остается кислотной:
HCN + H2O 
При большом избытке KCN начинает преобладать протолиз ионов CN — , и среда становится щелочной:
CN — + H2O 
Конечно, количество молекул HCN в таком растворе возрастает. Однако этот раствор скорее следует называть раствором цианида калия с добавкой циановодорода, и поэтому придется считаться с изменением типа среды, которое в химической практике может оказаться нецелесообразным.
Источник
ЦУ (ценные указания)
Задачник по общей и неорганической химии
7. Водные растворы протолитов. 7.3. Смещение протолитических равновесий
Теоретическая часть
В соответствии с принципом Ле-Шателье протолитические равновесия с участием слабых кислот и оснований поддаются смещению подобно любому другому химическому равновесию. Ограничимся рассмотрением случая, когда не изменяется величина KK (KO) и аналитическое количество растворенного вещества.
Рассмотрим смещение равновесия при добавлении воды, т.е. при уменьшении аналитической концентрации протолита с помощью разбавления водой:
Слабая кислота: HA + H2O 
Слабое основание: A + H2O 
При этом наблюдается смещение равновесия вправо, т.е. увеличение степени протолиза. Такое влияние аналитической концентрации протолита распространяется только на область разбавленных растворов (cB от 0,1 до 0,0001 моль/л). В более концентрированных растворах (cB выше 0,1 моль/л) значение KK становится переменным и начинает зависеть от количества растворенного вещества.
В области разбавленных (0,1 до 0,0001 моль/л) растворов слабых кислот HA величины αHA и pH являются функциями разбавления (по закону разбавления Оствальда) при nHA = const:
Эти выражения выведены с учетом определений:
Очевидно, что степень протолиза a HA при разбавлении (увеличении объема) раствора возрастает, а концентрация катиона оксония уменьшается.
Для слабых оснований A соотношения аналогичны:
Степень протолиза a A при разбавлении раствора увеличивается, а концентрация OH – – уменьшается, но растет концентрация H 3 O + .
При разбавлении до концентрации ниже 0,0001 моль/ л растворы становятся сильно (в пределе – бесконечно) разбавленными, а втаких растворах протолитические равновесия в значительной степени (в пределе – полностью) смещены вправо. Поэтому при бесконечном разбавлении кислотно-основные реакции становятся практически необратимыми ( a ® 1), а любые протолиты – сильными. Однако концентрация H 3 O + (для кислот) и концентрация OH – (для оснований) при увеличивающемся разбавлении становится очень малой и в пределе при V ( р ) (т.е. практически в чистой воде) приближается к значению для воды (1 . 10 –7 моль/ л при 25 ° С). Вот почему расчет pH и a обычно ограничивается областью разбавленных растворов (0,1 – 0,0001 моль/л)
Кроме разбавления, смещение протолитических равновесий вызывается добавлением одноименных ионов среды протолиза (для слабых кислот – ионов H 3 O + , для слабых оснований – ионов OH – ). Введение избытка ионов H 3 O + или OH – осуществляется добавлением сильной кислоты HB и щелочи MOH в раствор слабого протолита HA или A , причем между рассматриваемым веществом в растворе и добавками не должны протекать химические реакции:
1. HA + H2O 
2. A + H2O 
По закону действующих масс введение избытка ионов H3O + или OH − значительно уменьшает концентрацию продуктов протолиза A − или HA + . Следовательно, степень протолиза слабых кислот и оснований уменьшается. Возросшая концентрация [H3O + ] или [OH − ] определяется в основном концентрацией сильной кислоты или сильного основания, вклад протолиза слабой кислоты или основания в формирование концентраций ионов среды протолиза назначителен.
Расчет степени протолиза слабого протолита и ее уменьшение в присутствии избытка одноименных ионов среды проводится с применением этих соотношений.
Пример 10. Определите степень протолиза хлорноватистой кислоты в разбавленном растворе при 25 ° С в присутствии азотной кислоты с концентрацией 0,1 моль/л.
HClO + H2O 
Ответ . Степень протолиза HClO в присутствии HNO 3 равна 3 . 10 –7 , или 3 . 10 –5 %. Обратите внимание, что в расчетную формулу для степени протолиза не входит концентрация слабой кислоты или слабого основания, если слабый протолит находится в присутствии избытка одноименных ионов среды протолиза .
Пример 11. Определите,во сколько раз уменьшится степень протолиза хлорноватистой кислоты в 0,002М растворе при 25 ° С в присутствии азотной кислоты с концентрацией 0,1 моль/л.
HClO + H2O 
Источник
Протолитические равновесия
рованным растворам, а иначе – моляльностью (моляльной концентрацией) воды, в моль/кг:
с m = n (H 2 O) / m (H 2 O) = m (H 2 O) / < m (H 2 O) M (H 2 O)>= = 1000 (г) / <18,015 (г/моль) 1 (кг)>= 55,51
Моляльность, как это очевидно, не зависит от температуры.
Приведенное значение K K и будет верхним пределом кислотности в водном растворе. Сильными кислотами в водном растворе являются также HBr, HBrO 3 , HBrO 4 , HCl, HClO 3 , HClO 4 , H 2 CrO 4 , HIO 3 , HMnO 4 , HNCS, HNO 3 , H 4 P 2 O 7 , H 2 SO 4 , H 2 SeO 4 , H[BF 4 ], H 2 [SiF 6 ] и др. Так, тщательное изучение протолиза HNO 3 в воде дает значение K K = 26,9 (одного порядка с 55,51) и в разбавленном водном растворе протолиз азотной кислоты считается практически необратимым:
HNO 3 + H 2 O = NO 3 + H 3 O +
Поэтому ни сам ион H 3 O + , ни анионы сильных кислот не обладают в водном растворе оснόвными свойствами:
Самым сильным основанием в водном растворе будет гидроксид-ион OH (в паре H 2 O / OH ):
OH + H 2 O H 2 O + OH ; K C
В действительности для некоторых из перечисленных ниже кислот значения K K несколько меньше, чем для иона H 3 O + , но в разбавленном водном растворе это различие несущественно и все кислоты, для которых K K 1 · 10 1 , можно условно считать сильными.
K K = K B / K O = 1,008 · 10 14 / 55,51 = 1,816 · 10 16
Это значение K K будет нижним пределом кислотности в водном растворе.
Сильными основаниями будут также ионы CH 3 O , C 2 H 5 O , NH 2 , O 2 , BaOH + , SrOH + , CaOH + и некоторые другие. Они не могут существовать в водном растворе, так как их протолиз необратим:
O 2 + H 2 O = OH + OH ; NH 2 + 2 H 2 O = NH 3 · H 2 O + OH
Другими словами, ионные кристаллы Na 2 O и NaNH 2 полностью гидролизуются водой. Поэтому ни сам ион OH , ни продукты гидролиза других сильных оснований не обладают в водном растворе кислотными свойствами:
NH 3 · H 2 O + H 2 O
Не проявляют кислотных свойств также катионы щелочных и щелочноземельных элементов:
Na + · H 2 O + H 2 O
и Ba 2+ · H 2 O + H 2 O
Теперь понятно, почему реакция нейтрализации
H 3 O + + OH H 2 O + H 2 O ;
K C = 3,06 · 10 17
протекает в водном растворе практически полностью.
Все вышесказанное (разделы 4-6) суммировано в таблице 3, которую называют шкалой кислотности для данного рас-
творителя при T = Const. Шкала кислотности для водного
раствора приведена в Приложении.
Шкала кислотности для растворителя HL ( T = Const)
ВОПРОСЫ И ЗАДАНИЯ
1. Составьте уравнения протолиза:
а) хлорной кислоты и фтороводорода б) серной и угольной кислот
в) ортофосфорной кислоты и хлороводорода г) азотной и азотистой кислот
Для каждого набора определите, в каком растворе (при одинаковых молярности и температуре) значение рН ниже.
2. Составьте уравнения диссоциации гидроксидов калия и бария, а также уравнение протолиза гидрата аммиака в водном растворе. Используя справочные данные, укажите, в каком из растворов этих веществ при одинаковых молярности и температуре значение рН будет ниже.
3. Смешивают равные объемы 0,01М водных растворов следующих веществ:
в) NH 3 · H 2 O и HNO 3
Какое значение рН (> 7, 2 (0,01М)
б) H 2 SO 4 (0,02М) и KOH (0,02М)
в) HClO 4 (0,05М) и CsOH (0,07М)
Определите значение рН (> 7, определяется эндотермичностью реакций протолиза:
Cr 3+ · H 2 O + H 2 O CrOH 2+ + H 3 O + ;
HF + H 2 O F + H 3 O + ;
SO 3 2 + H 2 O HSO 3 + OH ;
При охлаждении раствора протолитические равновесия сдвигаются влево (в сторону реагентов), а при нагревании – вправо (в сторону продуктов). Последнее часто используется на практике для увеличения полноты протекания реакций протолиза. Иногда это приводит даже к полному разрушению равновесия:
Fe 3+ · H 2 O + 4 H 2 O = FeO(OH)(т) + 3 H 3 O +
Влияние концентрации растворенного вещества опре-
деляется тем, что вода – полноправный реагент протолитических реакций. При разбавлении раствора (уменьшении концентрации вещества) степень протолиза увеличивается, при концентрировании раствора – уменьшается. Иногда в сильно разбавленных растворах протолитическое равновесие разрушается:
Bi 3+ · H 2 O + 5 H 2 O(избыток) = Bi(OH) 3 (т) + 3 H 3 O +
Влияние одноименного иона среды протолиза осуще-
ствляется введением избытка ионов H 3 O + (при протолизе кислот) или OH (при протолизе оснований). Это смещает протолитическое равновесие влево (избыток H 3 O + создается прибавлением сильной кислоты HB, а избыток ионов OH – прибавлением щелочи MOH):
(2) B + H 2 O HB + + OH ; K O
На практике этим пользуются для уменьшения степени протолиза, если он нежелателен:
Fe 3+ · H 2 O + H 2 O FeOH 2+ + H 3 O + ; K K = 6,76 · 10 3 (25 C)
H 2 SO 4 + 2 H 2 O = SO 4 2 + 2H 3 O +
Добавление продукта протолиза (A для кислот, HB + для оснований) требует осторожности, поскольку и A, и HB + сами являются протолитами. При малом избытке ионов CN , вводимых в раствор циановодорода, преобладает смещение равновесия протолиза HCN влево и среда остается кислотной:
HCN + H 2 O CN + H 3 O + ; K K = 4,93 · 10 10 (25 C)
При большом избытке KCN начинает преобладать протолиз ионов CN , и среда становится щелочной:
CN + H 2 O HCN + OH ;
K O = K B / K K = 2,03 · 10 5 (25 C)
Конечно, количество молекул HCN в таком растворе возрастает. Однако этот раствор скорее следует называть раствором цианида калия с добавкой циановодорода, и поэтому придется считаться с изменением типа среды, которое в химической практике может оказаться нецелесообразным.
ВОПРОСЫ И ЗАДАНИЯ
1. Степень протолиза при разбавлении раствора водой возрастает (закон разбавления Оствальда). Приведите точную и приближенную формулы закона разбавления. Какой вид имеет графическая зависимость степени протолиза от объема раствора (количество растворенного вещества постоянно)?
2. Рассмотрите теоретическую возможность выравнивания способности к протолизу слабого и сильного протолитов. В каких экстремальных условиях это может произойти? Целесообразно ли в лабораторной практике проводить такое превращение слабого протолита в сильный?
3. В каком водном растворе протолита (концентрированном или разбавленном) при одинаковых условиях число, количество и молярная концентрация ионов растворителя будет больше? Какие ограничения и допущения необходимо принять для ответа?
4. Составьте уравнения гидролиза ортофосфата натрия и гидроортофосфата натрия в водном растворе. Используя справочные данные, укажите, в каком из растворов при одинаковых молярности и температуре значение рН будет ниже. Как изменится степень протолиза в растворе кислой соли при добавлении гидроксида натрия? Дайте обоснованный ответ.
5. Составьте уравнения гидролиза карбоната натрия и гидрокарбоната натрия в водном растворе. Используя справочные данные, укажите, в каком из растворов при одинаковых молярности и температуре значение рН будет ниже. Как изменится степень протолиза в растворе средней соли при нагревании? Дайте обоснованный ответ.
6. Составьте уравнения гидролиза сульфида калия и гидросульфида калия в водном растворе. Используя справочные данные, укажите, в каком из растворов при одинаковых молярности и температуре значение рН будет ниже. Как изменится степень протолиза в растворе средней соли при разбавлении? Дайте обоснованный ответ.
7. Составьте уравнения гидролиза перхлората меди(II) и бромида алюминия в водном растворе. Используя справочные данные, укажите, в каком из растворов с одинаковыми значениями рН и температуры молярность будет больше. Как изменится концентрация катионов оксония в растворе соли алюминия при нагревании? Дайте обоснованный ответ.
8. Заключение. Роль протонной теории
в химии и химической технологии
Изложенные в разделах 2-7 качественный и количественный аспекты протонной теории кислот и оснований показывают, что по сравнению с идеей Аррениуса эта теория обладает большей универсальностью в описании кислотнооснόвного поведения веществ.
Протонная теория рассматривает присущие веществам кислотные и оснόвные свойства вне зависимости от их агрегатного состояния и применяемого растворителя. Взаимодействие может происходить в газовой, жидкой и твердой фазах между индивидуальными веществами и в растворах любого растворителя.
В соответствии с определениями протонной теории вещества классифицируются как кислоты и основания только тогда, когда они проявляют указанные функции по отношению к партнеру в реакции протолиза. Вещество HNO 3 в водном растворе – это кислота, но не из-за того, что оно относится к типу кислотных гидроксидов, а потому, что при протолизе является донором протонов по отношению к воде. В другом растворителе, например, фтороводороде, это вещество будет уже основанием:
HNO 3 (s) + HF H 2 NO 3 + (s) + F (s)
В уравнения протолитических реакций в растворах всегда входит формула протонного растворителя, который непосредственно участвует в таких реакциях. Более того, именно кислотно-оснόвные свойства растворителя являются эталоном сравнения кислотности и основности растворенных веществ.
В рамки протонной теории укладываются все те протолиты, которые можно растворить в данном растворителе, независимо от их природы и заряда их частиц (это могут быть молекулы ковалентных веществ или частицы, образующие ионные кристаллы). Их взаимодействие с растворителем изображается уравнениями единого вида и называется одинаково – протолитической реакцией. Протонная теория значительно расширяет набор кислот и оснований в любом растворителе. В частности, в воде набор кислот и оснований не ограничивается нейтральными частицами (это хотя и распространенный, но все-таки лишь частный случай).
С количественной точки зрения все обратимые протолитические реакции в растворах характеризуются одной физической величиной – константой кислотности K K , отражающей относительную кислотность (и основность) всех протолитов в данном растворителе.
Итак, протонная теория кислот и оснований дала уникальную возможность качественного и количественного описания кислотно-оснόвных равновесий во всех протонных растворителях. В этом отношении протонная теория Брёнстеда – Лаури находится на том же уровне обобщения описаний химического взаимодействия, что и электронная теория окислитель- но-восстановительных реакций.
Протонная теория подготовила химическую науку к практическому использованию разных растворителей наравне с водой и направила усилия ученых в сторону разработки технологии синтеза соединений с применением неводных сред. Выводы и положения протонной теории кислот и оснований становятся необходимыми современному инженеруисследователю, разрабатывающему технологию различных процессов во всевозможных растворителях.
Применение неводных растворителей в современной ла- бораторно-заводской практике расширяется с каждым днем. Использование таких жидких растворителей, как аммиак, фтороводород, уксусная кислота и других идет уже в промышленном масштабе. В неводных средах можно успешно получать такие вещества, которые иным способом синтези-
ровать невозможно. Это безводные сульфиды щелочных металлов, применяемые в технологии изготовления полупроводниковых материалов и светящихся составов, различные полупродукты множества органических синтезов, например, фтор- и хлорсульфоновая кислоты HSO 3 F и HSO 3 Cl, соединения титана(IV) и циркония(IV) типа Ti(NO 3 ) 4 и Zr(SO 4 ) 2 , гидридные комплексы типа Li[AlH 4 ], гидроксид серебра AgOH и многие другие химические соединения.
Неводные растворители позволяют, с одной стороны, дифференцировать по силе те кислоты и основания, у которых кислотность или основность нивелирована в водном растворе. Так, например, хлорная кислота HClO 4 и азотная кислота HNO 3 в водном растворе ведут себя как одинаково сильные кислоты, нацело подвергаясь протолизу, но в неводном растворителе – уксусной кислоте CH 3 COOH, судя по значениям констант кислотности, азотная кислота становится в 30952 раза слабее хлорной. С другой стороны, неводные растворители способны усилить протолитические способности разных веществ (по сравнению с водным раствором), и вызвать появление кислотно-оснόвных свойств у тех веществ, которые в водной среде ведут себя как непротолиты.
Так, анилин C 6 H 5 NH 2 в воде – весьма слабое основание с константой основности 3,8 · 10 (при 25 С), но в муравьиной
кислоте он становится очень сильным акцептором протонов
С помощью неводных растворителей – безводного фтороводорода HF и жидкого аммиака NH 3 удалось «расшатать» даже чрезвычайно устойчивую молекулу бензола С 6 H 6 , который считается классическим примером веществанепротолита. Во фтороводороде бензол становится основанием:
С 6 H 6 + HF С 6 H 6 H + + F ; K O = 1,0 · 10 8 (20 C)
а в жидком аммиаке – кислотой:
С 6 H 6 + NH 3 С 6 H 5 + NH 4 + ; K K = 5,0 · 10 12 ( 33,4 C)
Источник
Растворы. Протолиз. Гидролиз
Download
Report
Transcript Растворы. Протолиз. Гидролиз
Федеральное агенство по образованию
Московская государственная академия тонкой химической
технологии имени М.В. Ломоносова
Кафедра неорганической химии
Савинкина Е.В.
Лекции по общей и неорганической химии
Растворы
Учебное пособие
Москва
МИТХТ им. М.В. Ломоносова
2010
1
УДК 546.04
ББК 24.1
Рецензент: д.х.н. Киселев Ю.М. (химический факультет МГУ)
Рекомендовано к изданию кафедрой неорганической химии МИТХТ
(протокол № 3 от 10.11.2010)
Е.В. Савинкина 2010
МИТХТ им. М.В. Ломоносова 2010
Утверждено Библиотечно-издательской комиссией МИТХТ им. М.В.Ломоносова
в качестве учебного пособия для студентов 1 курса бакалавриата по
направлениям 020100 62 (Химия), 240100 62 (Химическая технология и
биотехнология), 150600 62 (Материаловедение и технология новых
материалов), 280200 (Защита окружающей среды), 200500 62 (Метрология,
стандартизация и сертификация), 080500 (Менеджмент).
Один оптический диск
2
Объем данных 0,9 Мб
Растворы
Общие свойства растворов
Вещество А + вещество В
А+В
Новые вещества
Неоднородная смесь
Однородная смесь
(раствор)
Раствор – гомогенная система,
состоящая из двух или более компонентов,
имеющая переменный состав
4
Смеси веществ
Смеси
Грубодисперсные
системы (взвеси)
Тонкодисперсные
системы (коллоидные
системы)
Истинные растворы
Размеры частиц
более 100 нм
1 – 100 нм
менее 1 нм
5
Грубодисперсные системы
Дисперсионная среда – газообразная
Дисперсная фаза:
Дисперсионная среда – жидкая
Дисперсионная фаза:
твердая – пыль, дым, порошок
жидкая – смог, облако, туман
твердая – суспензия, паста
жидкая – эмульсия
газообразная – пена, газированная вода
Дисперсионная среда – твердая
Дисперсная фаза:
твердая – горные породы, цветные стекла, композиты
жидкая – твердые эмульсии
газообразная – твердые пены
6
Истинные растворы
Агрегатное состояние: газообразные,
жидкие, твердые растворы
Состав раствора: растворитель +
растворенное вещество
Параметры раствора: температура,
давление, содержание растворенного
вещества
7
Количественный состав раствора
Массовая доля
Молярная концентрация
(молярность)
Эквивалентная
концентрация
(нормальность)
Коэффициент
растворимости
Мольная доля
Массовая концентрация
Моляльная концентрация
(моляльность)
m( B )
m( p )
n( B )
c( B)
V ( p)
w( B)
ceq ( B)
neq ( B)
V ( p)
m( B )
ks
m( s )
n( B )
n( B ) n( s )
m( B )
( B)
V ( p)
n( B )
c m ( B)
m( s )
x( B)
8
Растворы
Идеальные
ΔV = 0; ΔQ = 0
Реальные
ΔV ≠ 0
1 л H2O + 1 л C2H5OH → 1,93 л раствора
ΔQ ≠ 0
Qрастворение = – Qразрыв связей + Qобразование связей
9
Растворы
Ненасыщенные
Вт → Вр
Насыщенные
Концентрация вещества
меньше его
растворимости
Вт
Растворимость
вещества – его
концентрация в
насыщенном растворе
Вр; истинное равновесие
Пересыщенные
Вр; метастабильное равновесие
Концентрация
вещества больше его
растворимости
10
Растворимость газов в жидкостях
Если нет химического взаимодействия
Ar(г)
Ar(р)
Влияние давления
= 1 0 (принцип Ле Шателье)
Увеличение давления →
(растворимость увеличивается)
Уменьшение давления ←
(растворимость уменьшается)
11
Растворимость газов в жидкостях
Влияние температуры
Qразрыв связей ≈ 0
Qрастворение > 0
Qобразование связей > 0
Процесс экзотермический (принцип Ле Шателье)
Уменьшение температуры →
(растворимость увеличивается)
Увеличение температуры ←
(растворимость уменьшается)
12
Растворимость газов в жидкостях
Если есть химическое взаимодействие
Cl2(г) Cl2(р)
Cl2(р) + 2Н2О
НClО + Н2О
Н3О+ + Cl + НClО
Н3О+ + ClО
13
Растворимость твердых веществ
в жидкостях
Влияние давления
ΔV ≈ 0; давление не влияет
Влияние температуры
с
Q<0
Большинство веществ
Q≈0
NaCl, LiOH, K2SO3
Т
Q>0
MnSO4, Li2CO3, CaCrO4
14
Диаграмма растворимости
Граница области метастабильных
пересыщенных растворов
с
Область пересыщенных растворов
c(B) > [B]
Кривая растворимости
c(B) = [B]
Область ненасыщенных
растворов c(B) < [B]
Тпл
Ткип
Т
15
Перекристаллизация
с
Основное вещество
Примесь
Т2
Т1
Т
16
Растворы электролитов
Электролитическая диссоциация
Сильные электролиты
MA M+(р) + A–(р)
[MA] = 0, [M+] = [A–] = c0
Степень диссоциации:
nдисс. (MA) n(M ) [M ]
1
n0 (MA)
n0 (MA)
c0
18
Слабые электролиты
MA MA(р) + M+(р) + A–(р)
[MA] > 0, [M+] = [A–] < c0
Степень диссоциации:
nдисс. (MA) n(M ) [M ]
1
n0 (MA)
n0 (MA)
c0
19
Слабые электролиты
MxAy(р)
x Ma+(р) + y Ab–(р)
Константа диссоциации KD
a x
b y
[M ] [ A ]
KD
[M x Ay ]
20
Закон разбавления Оствальда
МА
М+ + А–
[M+] [A–]
KD = –––––––––
[MA]
[M+] = [A–] = c0
[MA] = (1 – ) c0
если << 1 ( < 0,05)
KD = 2 c0
KD = 2 c0 / (1 – )
KD
c0
α
1
c0
21
Гетерогенные ионные
равновесия
МА(т)
М+ + А–
Для малорастворимых
сильных электролитов:
Kс = [M+][A–] = ПР(МА)
(произведение растворимости)
М+ + А–
МА(т)
В общем виде:
МхАу(т) х Ма+ + у Аb–
Тогда ПР = [Ma+]x [Ab–]y
ПР = const при T = const
ПР = f(T)
22
Растворимость (L), моль/л
МхАу(т)
х Ма+ + у Аb–
[Ma+] = x L; [Ab–] = y L
ПР(МхАу) = (x L)x (y L)y = xx yy Lx+y
L x y
ПР( M x Ay )
x
x y
y
23
Задача
Рассчитать растворимость сульфата
серебра, если ПР(Ag2SO4) = 1,2 . 10–5
Ag2SO4(т) 2Ag+ + SO42–
L
2L
L
ПР = [Ag+ ]2 [SO42–] = (2L)2L = 4L3
L
3
ПР
2
1,3 10 моль/ л
4
24
Условия осаждения и
растворения осадков
МА(т)
М+ + А–
с(М+) с(А–) > ПР
М+ + А– МА(т)
с(М+) с(А–) = [M+] [А–] = ПР
с
Т
с(М+) с(А–) < ПР
МА(т) М+ + А–
Для малорастворимого сильного электролита МхAy
условие растворения осадка: [Ma+]x [Ab–]y < ПР
условие выпадения осадка: [Ma+]x [Ab–]y > ПР
25
Введение одноименного иона
МхАу(т)
х Ма+ + у Аb–
Увеличение с(Ма+) или с(Аb–)
Сдвиг равновесия в сторону образования
осадка
26
Удаление одноименного иона
МхАу(т)
х Ма+ + у Аb–
Уменьшение с(Ма+) или с(Аb–)
Сдвиг равновесия в сторону растворения
осадка
27
Удаление одноименного иона
Связывание в виде менее растворимого
I
вещества (осадок AgCl
осадок AgI)
Связывание в виде комплексного иона
OH
[Pb(OH)4]2–)
(осадок PbSO4
Перевод в другую форму
H
(осадок BaCrO4
Cr2O72–)
28
Переосаждение
Ag2SO4(т)
PO43–
Ag3PO4(т)
SO42–
3 Ag2SO4(т) + 2 PO43–
2 Ag3PO4(т) + 3 SO42– (1)
KС = [SO42–]3 / [ PO43–]2
Ag2SO4(т)
2Ag+ + SO42– (2)
ПР1 = [Ag+]2[SO42–]
ПР2 = [Ag+]3[ PO43–]
Ag3PO4(т)
3Ag+ + PO43– (3)
(1) = 3(2) – 2(3)
KС = (ПР1)3 / (ПР2)2 ~ (10–5)3/(10–18)2 > 1
29
В каком минимальном объеме воды можно
растворить 1 г гипса?
Условие задачи
V(H2O) = ?
m(CaSO4.2H2O) = 1 г
ПР(CaSO4) = 4.10–5
M(CaSO4.2H2O) = 172 г/моль
Уравнение фазового
равновесия
Са2+ + SО42–
CaSO4(т)
ПР(CaSO4) = [Ca2+] [SO42–] = c2
__
V(H2O) = n / c = m / (M c) = m / (M ПР) ~ 0,920 л
30
Выпадет ли осадок при сливании равных объемов миллимолярных
растворов нитрата серебра(I) и хлорида натрия?
c0(AgNO3) = c0(NaCl) = 1.10–3 моль/л
V(p.AgNO3) = V(p.NaCl)
ПР(AgCl) = 1,7810–10
Для малорастворимого сильного электролита МхAy
условие выпадения осадка: [Ma+]x [Ab–]y > ПР
После смешивания растворов:
c(Ag+) = c0(Ag+) V(p.AgNO3) / (V(p.AgNO3) + V(p.NaCl)) =
= 1/2c0(Ag+) = 1/2c0(AgNO3)
c(Cl–) = 1/2c0(Cl–) = 1/2c0(NaCl)
12 c0(AgNO3) 1/2 c0(NaCl) = 2,510–7 > ПР(AgCl)
Осадок выпадет
31
Протолитическая теория
кислот и оснований
1923 г.
Йоханес Брёнстед
Томас Лаури
Протолитическая теория
кислотные или основные свойства частиц
обусловлены их способностью отдавать
или присоединять катион водорода
(протон Н+)
Н+
Н+
NH4+ + S2–
NH3 + HS–
Кт
Ос
Ос
Кт
Пары "сопряженная кислота / сопряженное основание":
NH4+/NH3 и HS –/ S2–
33
Кислоты
нейтральные:
H+
H+
CN– + H3O+
HCN + H2O
анионные:
H+
H2PO4– + H2O
H+
HPO42– + H3O+
катионные:
H+
NH4+ + 2 H2O
H+
NH3.H2O + H3O+
34
Основания
нейтральные:
H+
NH3.H2O + H2O
H+
NH4+ + OH– + H2O
анионные:
H+
CN– + H2O
H+
HCN + OH–
катионные:
H+
N2H5+ + H2O
H+
N2H62+ + OH–
35
Амфолиты
Н+
HCO3– + H2O
Кт
Н+
HCO3– + H2O
Ос
Н+
CO32– + H3O+
Н+
H2CO3 + OH–
36
Растворители
Апротонные:
C6H6, CS2, CCl4
Протонные
H2O, NH3, C2H5OH
(амфолиты)
Автопротолиз:
H+
H+
HL + HL
H2L+ + L–
Константа
автопротолиза
(ионное
произведение):
KS = [H2L+] [L–]
37
Ионное произведение воды
H+
H+
H2O + H2O
H3O+ + OH–
При стандартной температуре 298 К (25 С):
KB (Kw) = [H3O+] [OH–] = 1.10–14
В чистой воде при 25 С
[H3O+] = [OH–] = KB = 10–7 моль/л
38
Водородный показатель (рН)
рН = –lg[H3O+]
[H3O+] = 10–рН
Гидроксидный показатель (рОН)
pOH = –lg[OH–]
[OH–] = 10–рОН
рН + рОН = –lgKB = 14
39
Водородный показатель (рН)
В чистой воде при 25С
Если [H3O+] > 1.10–7, то рН < 7
рН = рОН = 7
Среда нейтральная
Среда кислотная
Если [OH–] > 1.10–7, то рОН < 7 и pH > 7
Среда щелочная
40
Шкала рН
При [H3O+] = 0,1 моль/л
(например, в 0,1 М растворе HCl)
pH = 1 (нижний предел).
При [OH–] = 0,1 моль/л
(например, в 0,1 М растворе KOH)
рН = 13 (верхний предел).
41
Константа кислотности
H+
H+
HA + H2O
A– + H3O+
[ H 3O ][ A ]
K K (Ka )
[ HA]
42
Сопряженная пара
СН3СООН / СН3СОО–
Al3+.H2O / AlOH2+
H2S / HS–
B(OH)3.H2O/[B(OH)4]–
СН3СООН + Н2О
СН3СОО– + H3O+
Al3+.H2O + H2O
H2S + H2O
AlOH2+ + H3O+
HS– + H3O+
B(OH)3.H2O + H2O
KК
1,7.10–5
9,6.10–6
1,1.10–7
5,8.10–10
[B(OH)4]– + H3O+
Сила кислоты
Слабые кислоты
43
Сильные кислоты
H+
HA + H2O = A– + H3O+
Бескилородные кислоты: HCl, HBr, HI
Кислородсодержащие кислоты состава
НхЭОу, если у – х 2 (правило Полинга)
Протолиз сильных кислот необратим
Анионы сильных кислот являются
непротолитами и не участвуют в
реакциях протолиза
44
Сила кислот в неводных
растворителях
Уравнение реакции протолиза
H+
HClO4 + CH3COOH
H+
HNO3 + CH3COOH
Сопряженная пара
KК
H+
ClO4– + CH3COOH2+
HClO4/ ClO4–
1.10–6
HNO3/ NO3–
1.10–7
H+
NO3– + CH3COOH2+
45
Константа основности
H+
H+
A– + H2O
HA + ОН–
[OH ][HA]
KO ( Kb )
[A ]
46
Слабые основания
Уравнение реакции протолиза
Сопряженная пара
KО
NH3·H2O + H2O
NH4+ + OH– + H2O
NH4+/ NH3·H2O
H+
H+
SO32– + H2O
H+
HSO3– + OH–
HSO3– / SO32–
H+
HSO3– + H2O
SO2∙H2O + OH–
SO2∙H2O / HSO3–
Сила основания
H+
H+
1,8 ·10–5
1,6.10–7
6,0.10–13
47
Сильные основания
Анионы:
амид-ион NH2–
метилат-ион CH3O– и другие алкоголят-ионы
гидроксид-ион ОН–
Соединения, дающие эти ионы при
диссоциации
MOH,
M(OH)2,
и др.
где М – щелочной элемент или Tl(I)
где М – Ba, Ra
Катионы – непротолиты!
48
Малорастворимые гидроксиды
Ni(OH)2(т)
Ni2+ + 2OH—
Слабое основание?
Сильное основание?
ПР = [Ni2+][OH—]2
49
Связь Kк и Ko для пары НА/А–
[H3O+] [A–] [HA] [OH–]
KК KO = –––––––––– –––––––––– = [H3O+] [OH–] = KB
[HA]
[A–]
KO = KB / KК
50
Степень протолиза ()
– отношение числа частиц, подвергшихся
протолизу, к исходному числу частиц
Для реакции протолиза слабой кислоты:
H+
HA + H2O
H+
A– + H3O+
[ H 3O ]
[A ]
c0 ( HA) c0 ( HA)
([H3O+] = [A–] при отсутствии в растворе
других протолитов)
51
Закон разбавления Оствальда
[ H 3O ][ A ] c0c0
2c0
KK
2c0
[ HA]
(1 )c0 1
При << 1 ( < 0,05):
_____
= Kк / c0
52
Степень протолиза
1
сильные протолиты
слабые протолиты
0
с0
Учет
автопротолиза
воды
53
Учет автопротолиза воды
H+
H+
HA + H2O
A– + H3O+
H+
H+
H2O + H2O
OH– + H3O+
[ A ] [ H 3O ]
(
)
c0
c0
[ A ][H 3O ] [ A ][H 3O ]
Kк
[ HA]
c0 [ A ]
54
Учет автопротолиза воды
Kкc0 – Kк[A–] = [A–][H3O+]
K к c0
[A ]
K к [ H 3O ]
Kк
K к [ H 3O ]
55
Учет автопротолиза воды
При бесконечном разбавлении:
с0 → 0; [H3O+] → 10–7 моль/л
Kк
7
K к 10
при Kк ≥ 10–5 α → 1
при Kк = 10–7 α → 0,5
56
Сдвиг протолитических
равновесий
Изменение концентрации слабого протолита
закон разбавления Оствальда
разбавление
Изменение температуры
протолиз – эндотермический процесс
нагревание
Изменение концентрации одноименных ионов
принцип Ле Шателье
введение одноименных ионов
57
Сдвиг протолитических
равновесий
Протолиз слабой кислоты в присутствии
сильной кислоты:
H+
HA + H2O
H+
A– + H3O+
[ A ]
'
c0 ( HA)
[ H 3O ][ A ] ' c0 [ H 3O ] ' c0 [ H 3O ]
Kк
'[ H 3O ]
[ HA]
(1 )c0
c0
= Kк / [H3O+]
58
Определите рН в 0,001 М
растворе серной кислоты.
2H+
H2SO4 + 2H2O = SO42 + 2H3O+
с0(H2SO4) = 0,001 мольл
pH = –lg [H3O+] = – lg(2c0) = – lg (2.10–3) = 2,7
59
Определите рН в растворе азотной кислоты с
концентрацией с0 = 1.10–11 моль/л.
H+
HNO3 + H2O = NO3– + H3O+
[H3O+] = c0 = 1.10–11
pH = – lg[H3O+] = 11
H2O + H2O
H3O+ + OH–
рН
13
[H3O+] = 1.10–7
7
Ответ: рН 7
1
?
Раствор основания
с0
60
Раствор кислоты
Определите рН в 0,002М растворе
хлорноватистой кислоты при 25 °C.
H+
H+
HClO + H2O
ClO– + Н3O+; Kк = 2,82 . 10–8
[ClO–] = [H3O+]; [HClO] = c0
[ClO ][H 3O ] [ H 3O ]2
KK
[ HClO]
c0
pH lg[ H 3O ] lg K K c0 lg 2,82 10 8 0,002 5,12
61
Определите pH в 0,002М
растворе аммиака при 25 °С.
H+
H+
NH4+ + OH– + H2O
NH3·H2O + H2O
KK = 5,75 . 10–10
KB = 1 . 10–14
[NH4+] = [OH–]; [NH3 . H2O] = c0
K B [ NH 4 ][OH ] [OH ]2
KO
KK
[ NH 3 H 2O]
c0
KB
1 10 14 0,002
pH 14 pOH 14 lg[OH ] 14 lg
c0 14 lg
10,27
10
KK
5,75 10
62
Обратимый гидролиз
солей
1. Диссоциация
2. Протолиз
Гидролиз солей
KCl = K+ + Cl–
непротолиты
Нет гидролиза, нейтральная среда, рН 7
NH4NO3 = NH4+ + NO3–
Кт
H+
NH4+ + 2H2O
непротолит
H+
NH3.H2O + H3O+
Гидролиз по катиону, кислотная среда, pH < 7
64
Гидролиз солей
ZnSO4 = Zn2+ + SO42–
H+
H+
Zn2+.H2O + H2O
ZnOH+ + H3O+
Гидролиз по катиону, кислотная среда, рН < 7
KNO2 = K+ + NO2–
H+
NO2– + H2O
H+
HNO2 + OH–
Гидролиз по аниону, щелочная среда, pH > 7
65
Гидролиз солей
NH4CN = NH4+ + CN–
H+
NH4+ + 2H2O
H+
CN–
H+
NH3.H2O + H3O+
Kк = 6.10–10
H+
OH–
+ H2O
HCN +
Гидролиз по катиону и аниону, рН ?
Ko > Kк
Слабощелочная среда, pH > 7
Ko = 2.10–3
66
Гидролиз кислых солей
NaHCO3 = Na+ + HCO3–
H+
H+
HCO3– + H2O
CO32– + H3O+
Kк = 6.10–11
Кт
H+
HCO3– + H2O
H+
H2CO3 + OH–
Ko = 2.10–8
Ос
Ko > Kк; слабощелочная среда, pH > 7
67
Гидролиз солей
Усиление (α↑)
Повышение
температуры
Понижение
концентрации
Связывание
одноименных ионов
Ослабление (α↓)
Понижение
температуры
Повышение
концентрации
Введение
одноименных ионов
68
Необратимый гидролиз
PIIICl–I3(ж) + 3H2Oизб. = H2[PHO3](p) + 3HCl(p)
H+
H2[PHO3] + H2O
H+
H[PHO3]– + H3O+
H+
HCl + H2O = Cl– + H3O+
pH < 7
69
Необратимый гидролиз
Mg3N + 8H2O = 2NH3.H2O + Mg(OH)2
H+
NH4+ + OH– + H2O
Если Mg(OH)2 в осадке:
NH3·H2O + H2O
H+
Mg(OH)2(т)
Mg2+ + 2OH–
Если Mg(OH)2 в растворе:
Mg(OH)2 = Mg2+ + 2OH–
pH > 7
70
Необратимый гидролиз
Al2S3(т) + 6H2O = 2Al(OH)3↓ + 3H2S↑
Совместный гидролиз:
2Al3+ +3S2– + 6H2O = 2Al(OH)3↓ + 3H2S↑
71
Определите рН 0,1 М раствора
хлорида железа(III).
FeCl3 = Fe3+ + 3 Cl–
H+
Fe3+.H2O + H2O
H+
[Fe(H2O)6]3+ + H2O
H+
FeOH2+ + H3O+
H+
[Fe(H2O)5(OH)]2+ + H3O+
[H3O+] [FeOH2+]
[H3O+]2
Kк = –––––––––––––– = –––––––––– (если считать [Fe3+] = с0)
[Fe3+]
с0
_____
________
pH = – lg[H3O+] = –lgKк c0 = – lg7.10–3.10–1 = 1,6
72
Определите рН 0,1 М раствора
хлорида железа(III).
Более строгий подход:
если считать [Fe3+] = с0(1 – α)
2с0
Kк = –––––––––
(1 – )
73
Определите рН 0,1 М раствора
хлорида железа(III).
При с0 = 0,1 моль /л и Kк = 7103 = 0,007:
0,007 = 2 0,1 {1 }
0,12 + 0,007 0,007 = 0
= 0,23; второй корень отрицательный
рH = lg[H3O+] = lgс0 = lg 0,23 0,1 = 1,6
74
FeCl3 + H2O + Zn = ?
FeCl3 = Fe3+ + 3 Cl–
H+
H+
Fe3+.H2O + H2O
FeOH2+ + H3O+
Zn + 2H3O+ = Zn2+ + H2 + 2H2O
75
Определите рН в 0,1 М растворе
ортофосфата натрия.
Na3PO4 = 3 Na+ + PO43–
H+
H+
PO43– + H2O
HPO42– + OH–
K в [ HPO42 ][OH ] [OH ]2
Ko
3
Kк
c0
[ PO4 ]
K в c0
10 1410 1
pH lg[ H 3O ] 14 lg[OH ] 14 lg K o c0 14 lg
14 lg
12,7
13
Kк
5 10
76
Na3PO4 + H2O + Zn = ?
Na3PO4 (т) = 3 Na+ + PO43–
H+
H+
HPO42– + OH–
PO43– + H2O
Zn + 2H2O + 2OH– = [Zn(OH)4]2– + H2
77
Определите рН раствора, содержащего 0,001 моль/л
уксусной кислоты и 0,1 моль/л ацетата натрия.
CH3COONa = Na+ + CH3COO–
c1
H+
CH3COOH + H2O
c0
H+
CH3COO– + Н3О+
x
[CH3COOH] = c0 – x
[CH3COO–] = c1 + x
78
Определите рН раствора, содержащего 0,001 моль/л
уксусной кислоты и 0,1 моль/л ацетата натрия.
[ H 3O ][CH 3COO ] x(c1 x) c1 x
Kк
[CH 3COOH ]
c0 x
c0
pH = – lg[H3O+] = – lg x = –lg(Kкc0 /c1) =
= – lg 1,810–510–3/10–1 = 6,7
При разбавлении раствора рН не меняется!
Буферный раствор
79
Определите pH в водном растворе
NaHA
HA– – амфолит
(HCO3–, HS–, H2PO4–, HPO42– и т.д.)
Диссоциация:
NaHA = Na+ + HA–
Протолиз иона-амфолита HA– как основания:
H+
H+
HA– + H2O
H2A + OH–;
Kо(H2A/HA–) = Kв/Kк(H2A/HA–)
Протолиз иона-амфолита HA– как кислоты:
H+
HA– + H2O
H+
A2– + H3O+;
Kк(HA–/A2–)
80
Определите pH в водном растворе
NaHA
Без вывода:
2
[H 3O ] K к (H 2 A/HA ) K к (HA /A )
2
pH lg K к (H 2 A/HA ) K к (HA /A )
рН не зависит от концентрации амфолита
Буферный раствор
81
Определите pH в водном растворе
NaHA
1
2
pH pK к (H 2 A/HA ) pK к (HA /A )
2
•
•
•
•
•
•
HA–
HCO3–
HSO3–
HS–
H2PO4–
HPO42–
pK = –lgK
pKк(H2A/HA–)
6,37
1,78
6,98
2,14
7,21
pKк(HA–/A2–)
10,33
7,20
12,91
7,21
12,34
pH
8,35
4,49
9,94
4,68
9,78
82
Кислотно-основные индикаторы
Индикатор
Метиловый
оранжевый
Цвет сопряженной
кислоты
Интервал
pH
Цвет сопряженного
основания
красный
3,1–4,4
оранжевожёлтый
красный
5,0–8,0
синий
Бромтимоловый синий
жёлтый
6,0–7,6
синий
Фенолфталеин
бесцветный
8,2–10,0
малиновокрасный
Лакмус
83
Метиловый оранжевый
Желтый
Красный
84