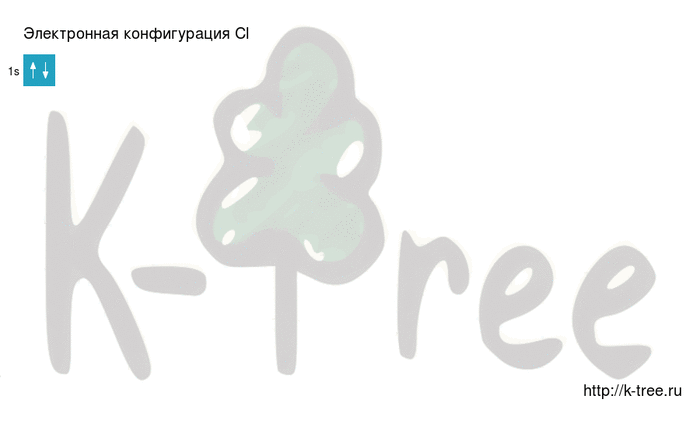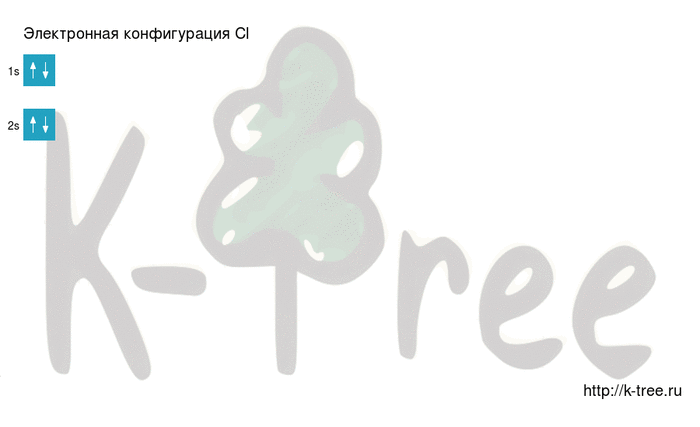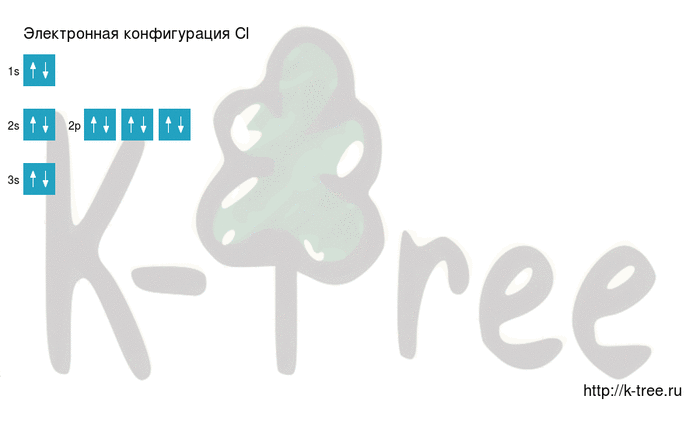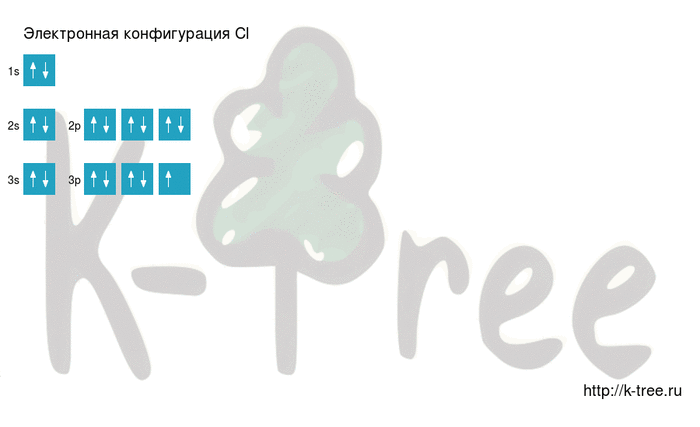Электронное строение атома хлора
Электронное строение нейтрального атома хлора в основном состоянии.
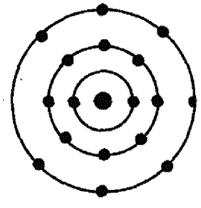
Схема строения электронных оболочек
Распределение электронов по энергетическим уровням (или по электронным слоям) в атоме хлора.
Cl
+17
2
8
7
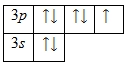
Электронно-графическая схема
Распределение электронов по атомным орбиталям в атоме хлора.
| 3 | ↑↓ | ↑↓ | ↑↓ | ↑ | ||
| 2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ||
| 1 | ↑↓ | |||||
| s | p |
Валентные орбитали атома хлора выделены фиолетовым цветом.
Электронная конфигурация
Полная электронная конфигурация атома хлора.
17Cl 1s2 2s2 2p6 3s2 3p5
Сокращённая электронная конфигурация атома хлора.
17Cl [Ne] 3s2 3p5
Квантовые числа валентных электронов
Главное (n), орбитальное (l), магнитное (m) и спиновое (s) квантовые числа валентных электронов атома хлора.
| Орбиталь | Квантовое число | |||
|---|---|---|---|---|
| n | l | m | s | |
| 3s | 3 | 0 | 0 | +½ |
| -½ | ||||
| 3p | 3 | 1 | -1 | +½ |
| -½ | ||||
| 1 | +½ | |||
| -½ | ||||
| 2 | +½ |
На чтение 9 мин Просмотров 11 Опубликовано 12 апреля 2023 Обновлено 11 апреля 2023
Содержание
- Строение атома хлора
- Общие сведения о строении атома хлора
- Электронное строение атома хлора
- Примеры решения задач
- Хлор Cl
- Электронная схема хлора
- Степень окисления хлора
- Ионы хлора
- Валентность Cl
- Квантовые числа Cl
- Энергия ионизации
- Хлор, свойства атома, химические и физические свойства
- Хлор, свойства атома, химические и физические свойства.
- Атом и молекула хлора. Формула хлора. Строение атома хлора:
- Изотопы и модификации хлора:
- Свойства хлора (таблица): температура, плотность, давление и пр.:
Строение атома хлора
Общие сведения о строении атома хлора
Относится к элементам p-семейства. Неметалл. Элементы-неметаллы, входящие в эту группу, носят общее название галогены. Обозначение – Cl. Порядковый номер – 17. Относительная атомная масса – 35,453 а.е.м.
Электронное строение атома хлора
Атом хлора состоит из положительно заряженного ядра (+17), состоящего из 17 протонов и 18 нейтронов, вокруг которого по 3-м орбитам движутся 17 электронов.
Рис.1. Схематическое строение атома хлора.
Распределение электронов по орбиталям выглядит следующим образом:
На внешнем энергетическом уровне атома хлора находится семь электронов, все они считаются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
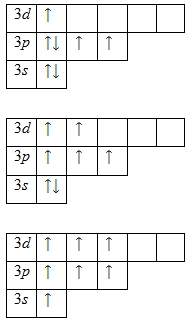
Наличие одного неспаренного электрона свидетельствует о том, что хлор способен проявлять степень окисления +1. Также возможно несколько возбужденных состояний из-за наличия вакантной 3d-орбитали. Сначала распариваются электроны 3p -подуровня и занимают свободные d-орбитали, а после – электроны 3s-подуровня:
Этим объясняется наличие у хлора ещё трех степеней окисления: +3, +5 и +7.
Примеры решения задач
| Задание | Даны два элемента с зарядами ядер Z=17 и Z=18. Простое вещество, образованное первым элементом, — ядовитый газ с резким запахом, а вторым – не ядовитый, лишенный запаха, не поддерживающий дыхания газ. Напишите электронные формулы атомов обоих элементов. Какой из них образует ядовитый газ? |
| Решение | Электронные формулы заданных элементов будут записываться следующим образом: |
Заряд ядра атома химического элемента равен его порядковому номеру в Периодической таблице. Следовательно, это хлор и аргон. Два атома хлора образуют молекулу простого вещества – Cl2, которое представляет собой ядовитый газ с резким запахом
| Задание | Назовите элементы, в атомах которых распределение электронов по энергетическим уровням в основном состоянии соответствует рядам чисел: а) 2,8,7; б) 2,8,8,1; в) 2,8,13,1; г)2,8,18,1. Какие из них относятся к одной группе? Какие находятся в одном периоде? |
| Ответ | Определить положение химического элемента в Периодической таблице можно сложив все электроны, имеющиеся в атоме, не учитывая их распределения по энергетическим уровням: |
В одной группе –первой, но разных подгруппах расположены калий и медь. Калий и хром находятся в одном периоде – четвертом.
Источник
Хлор Cl
Хлор в таблице менделеева занимает 17 место, в 3 периоде.
| Символ | Cl |
| Номер | 17 |
| Атомный вес | 35.4460000 |
| Латинское название | Chlorum |
| Русское название | Хлор |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема хлора
Короткая запись:
Cl: [Ne]3s 2 3p 5
Одинаковую электронную конфигурацию имеют атом хлора и P -2 , S -1
Порядок заполнения оболочек атома хлора (Cl) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
Хлор имеет 17 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
5 электронов на 3p-подуровне
Степень окисления хлора
Атомы хлора в соединениях имеют степени окисления 6, 5, 4, 3, 2, 1, 0, -1, -2.
Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Ионы хлора
Валентность Cl
Атомы хлора в соединениях проявляют валентность VI, V, IV, III, II, I.
Валентность хлора характеризует способность атома Cl к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Cl
Квантовые числа определяются последним электроном в конфигурации, для атома Cl эти числа имеют значение N = 3, L = 1, Ml = 0, Ms = -½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать. Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo. Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии ионизации для каждого последующего электрона.
Перейти к другим элементам таблицы менделеева
Источник
Хлор, свойства атома, химические и физические свойства
Хлор, свойства атома, химические и физические свойства.
35,446-35,457* 1s 2 2s 2 2p 6 3s 2 3p 5
Хлор — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 17. Расположен в 17-й группе (по старой классификации — главной подгруппе седьмой группы), третьем периоде периодической системы.
Атом и молекула хлора. Формула хлора. Строение атома хлора:
Хлор (лат. Chlorum, от греч. χλωρός – «жёлто-зелёный») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Cl и атомным номером 17. Расположен в 17-й группе (по старой классификации – главной подгруппе седьмой группы), третьем периоде периодической системы.
Хлор – неметалл. Относится к группе галогенов.
Хлор обозначается символом Cl.
Как простое вещество хлор при нормальных условиях представляет собой ядовитый газ желтовато-зелёного цвета, тяжелее воздуха, с резким запахом и сладковатым, «металлическим» вкусом.
Молекула хлора двухатомна.
Химическая формула хлора Cl2.
Электронная конфигурация атома хлора 1s 2 2s 2 2p 6 3s 2 3p 5 . Потенциал ионизации (первый электрон) атома хлора равен 1251,19 кДж/моль (12,967632(16) эВ).
Строение атома хлора. Атом хлора состоит из положительно заряженного ядра (+17), вокруг которого по трем оболочкам движутся 17 электронов. При этом 10 электронов находятся на внутреннем уровне, а 7 электронов – на внешнем. Поскольку хлор расположен в третьем периоде, оболочек всего три. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлены s- и р-орбиталями. Третья – внешняя оболочка представлена s- и р-орбиталями. На внешнем энергетическом уровне атома хлора на 3s-орбитали находятся два спаренных электрона, на 3p-орбитали – четыре спаренных и один неспаренный электрон. В свою очередь ядро атома хлора состоит из 17 протонов и 18 нейтронов. Хлор относится к элементам p-семейства.
Радиус атома хлора (вычисленный) составляет 79 пм.
Атомная масса атома хлора составляет 35,446-35,457 а. е. м.
Хлор – химически активный неметалл.
Хлор – токсичный, ядовитый, удушающий газ.
Изотопы и модификации хлора:
Свойства хлора (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Хлор |
| 102 | Прежнее название | |
| 103 | Латинское название | Chlorum |
| 104 | Английское название | Chlorine |
| 105 | Символ | Cl |
| 106 | Атомный номер (номер в таблице) | 17 |
| 107 | Тип | Неметалл |
| 108 | Группа | Галоген |
| 109 | Открыт | Карл Вильгельм Шееле, Швеция, 1774 г. |
| 110 | Год открытия | 1774 г. |
| 111 | Внешний вид и пр. | Ядовитый газ желтовато-зелёного цвета, тяжелее воздуха, с резким запахом и сладковатым, «металлическим» вкусом |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | 2 аллотропные модификации хлора:
– хлор с простой орторомбической кристаллической решёткой, – хлор с тетрагональной кристаллической решёткой |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,017 % |
| 120 | Содержание в морях и океанах (по массе) | 2,0 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,0001 % |
| 122 | Содержание в Солнце (по массе) | 0,0008 % |
| 123 | Содержание в метеоритах (по массе) | 0,037 % |
| 124 | Содержание в организме человека (по массе) | 0,12 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса)* | 35,446-35,457 а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s 2 2s 2 2p 6 3s 2 3p 5 |
| 203 | Электронная оболочка | K2 L8 M7 N0 O0 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 79 пм |
| 205 | Эмпирический радиус атома* | 100 пм |
| 206 | Ковалентный радиус* | 102 пм |
| 207 | Радиус иона (кристаллический) | Cl –
(в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 175 пм |
| 209 | Электроны, Протоны, Нейтроны | 17 электронов, 17 протонов, 18 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 3 |
| 212 | Группа в периодической таблице | 17-ая группа (по старой классификации – главная подгруппа 7-ой группы) |
| 213 | Эмиссионный спектр излучения |  |
| 300 | Химические свойства | |
| 301 | Степени окисления | -1 , 0, +1 , +2, +3 , +4, +5 , +6, +7 |
| 302 | Валентность | I, III, IV, V, VI, VII |
| 303 | Электроотрицательность | 3,16 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 1251,19 кДж/моль (12,967632(16) эВ) |
| 305 | Электродный потенциал | Cl2 + 2e – → 2Cl – , E o = +1,359 В |
| 306 | Энергия сродства атома к электрону | 348,575(3) кДж/моль (3,612725(28) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность* | 0,0032 г/см 3 (при 0 °C и иных стандартных условиях , состояние вещества – газ),
1,5625 г/см 3 (при температуре кипения -34,04 °C и иных стандартных условиях , состояние вещества – жидкость), 1,6552 г/см 3 (при -70 °C и иных стандартных условиях , состояние вещества – жидкость), 1,9 г/см 3 (при -102 °C/-105 °C и иных стандартных условиях , состояние вещества – твердое тело) |
| 402 | Температура плавления* | -101,5 °C (171,6 K, -150,7 °F) |
| 403 | Температура кипения* | -34,04 °C (239,11 K, -29,27 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 6,406 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип) | 20,41 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,471 Дж/г·K (при 0-24 °C) |
| 410 | Молярная теплоёмкость* | 33,949 Дж/(K·моль) |
| 411 | Молярный объём | 11,0308 см³/моль |
| 412 | Теплопроводность | 8,9·10 -3 Вт/(м·К) (при стандартных условиях ),
0,009 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Простая орторомбическая
|
| 513 | Параметры решётки | a = 6,29, b = 4,50 Å, c = 8,21 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | |
| 516 | Название пространственной группы симметрии | Cmca |
| 517 | Номер пространственной группы симметрии | 64 |
| 521 | Кристаллическая решётка #2 | |
| 522 | Структура решётки | Тетрагональная |
| 523 | Параметры решётки | a = 8,56 Å, c = 6,12 Å |
| 524 | Отношение c/a | 0,714 |
| 525 | Температура Дебая | |
| 526 | Название пространственной группы симметрии | P42/ncm |
| 527 | Номер пространственной группы симметрии | |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7782-50-5 |
201* Указан диапазон значений атомной массы в связи с различной распространённостью изотопов данного элемента в природе.
205* Эмпирический радиус атома хлора согласно [3] составляет 99 пм.
206* Ковалентный радиус хлора согласно [1] и [3] составляет 102±4 пм.
401* Плотность хлора согласно [3] и [4] составляет 0,00321 г/см 3 (при 0 °C /20 °C и иных стандартных условиях , состояние вещества – газ) и 1,557 г/см 3 (при -35 °C и иных стандартных условиях , состояние вещества – жидкость).
402* Температура плавления хлора согласно [3] и [4] составляет -100,95 °C (172,2 K, -149,71 °F) и -101,03 °C (172,12 K, -149,85 °F) соответственно.
403* Температура кипения хлора согласно [3] и [4] составляет -34,55 °C (238,6 K, -30,19 °F) и -34,1 °C (239,05 K, -29,38 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) хлора согласно [3] составляет 6,41 кДж/моль.
410* Молярная теплоемкость хлора [3] составляет 21,838 Дж/(K·моль).
Источник
Cl (хлор) — элемент с прядковым номером 17 в периодической системе.
Находится в III периоде. Температура плавления: -101 ℃. Плотность: 0.00295 г/см3.
Электронная формула атома хлора:
1s2 2s2 2p6 3s2 3p5
Сокращенная электронная конфигурация Cl:
[Ne] 3s2 3p5
Ниже приведена электронно-графическая схема атома хлора
Распределение электронов по энергетическим уровням в атоме Cl
1-й уровень (K): 2
2-й уровень (L): 8
3-й уровень (M): 7
Валентные электроны хлора
Количество валентных электронов в атоме хлора — 7.
Ниже приведены их квантовые числа (N — главное, L — орбитальное, M — магнитное, S — спин)
| Орбиталь | N | L | M | S |
|---|---|---|---|---|
| s | 3 | 0 | 0 | +1/2 |
| s | 3 | 0 | 0 | -1/2 |
| p | 3 | 1 | -1 | +1/2 |
| p | 3 | 1 | 0 | +1/2 |
| p | 3 | 1 | 1 | +1/2 |
| p | 3 | 1 | -1 | -1/2 |
| p | 3 | 1 | 0 | -1/2 |
Степени окисления, которые может проявлять хлор: -1, +1, +2, +3, +4, +5, +6, +7
Содержание материала
- Атом и молекула хлора. Формула хлора. Строение атома хлора:
- Хранение хлора
- Стандарты качества хлора
- Валентность Cl
- Нахождение в природе галогенов
- Изотопный состав
- Бром
- Способы получения брома
- Физические свойства брома
- Химические свойства брома
- Примеры решения задач
Атом и молекула хлора. Формула хлора. Строение атома хлора:
Хлор (лат. Chlorum, от греч. χλωρός – «жёлто-зелёный») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Cl и атомным номером 17. Расположен в 17-й группе (по старой классификации – главной подгруппе седьмой группы), третьем периоде периодической системы.
Хлор – неметалл. Относится к группе галогенов.
Хлор обозначается символом Cl.
Как простое вещество хлор при нормальных условиях представляет собой ядовитый газ желтовато-зелёного цвета, тяжелее воздуха, с резким запахом и сладковатым, «металлическим» вкусом.
Молекула хлора двухатомна.
Химическая формула хлора Cl2.
Электронная конфигурация атома хлора 1s2 2s2 2p6 3s2 3p5. Потенциал ионизации (первый электрон) атома хлора равен 1251,19 кДж/моль (12,967632(16) эВ).
Строение атома хлора. Атом хлора состоит из положительно заряженного ядра (+17), вокруг которого по трем оболочкам движутся 17 электронов. При этом 10 электронов находятся на внутреннем уровне, а 7 электронов – на внешнем. Поскольку хлор расположен в третьем периоде, оболочек всего три. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлены s- и р-орбиталями. Третья – внешняя оболочка представлена s- и р-орбиталями. На внешнем энергетическом уровне атома хлора на 3s-орбитали находятся два спаренных электрона, на 3p-орбитали – четыре спаренных и один неспаренный электрон. В свою очередь ядро атома хлора состоит из 17 протонов и 18 нейтронов. Хлор относится к элементам p-семейства.
Радиус атома хлора (вычисленный) составляет 79 пм.
Атомная масса атома хлора составляет 35,446-35,457 а. е. м.
Хлор – химически активный неметалл.
Хлор – токсичный, ядовитый, удушающий газ.
Хлор, свойства атома, химические и физические свойства
Хранение хлора
Производимый хлор хранится в специальных «танках» или закачивается в стальные баллоны высокого давления. Баллоны с жидким хлором под давлением имеют специальную окраску — болотный цвет. Следует отметить что при длительной эксплуатации баллонов с хлором в них накапливается чрезвычайно взрывчатый треххлористый азот, и поэтому время от времени баллоны с хлором должны проходить плановую промывку и очистку от хлорида азота.
Стандарты качества хлора
Согласно ГОСТ 6718-93 «Хлор жидкий. Технические условия» производятся следующие сорта хлора
| Наименование показателя ГОСТ 6718-93 | Высший сорт | Первый сорт |
|---|---|---|
| Объемная доля хлора, не менее, % | 99,8 | 99,6 |
| Массовая доля воды, не более, % | 0,01 | 0,04 |
| Массовая доля треххлористого азота, не более, % | 0,002 | 0,004 |
| Массовая доля нелетучего остатка, не более, % | 0,015 | 0,10 |
Валентность Cl
Атомы хлора в соединениях проявляют валентность VI, V, IV, III, II, I.
Валентность хлора характеризует способность атома Cl к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Нахождение в природе галогенов
Галогены являются химически активными веществами, в связи с чем, в природе они встречаются только в виде соединений. Их распространённость в земной коре снижается при увеличении атомного радиуса (от фтора к иоду). Например, содержание астата в земной коре исчисляется граммами.
Наиболее распространённые соединения фтора — флюорит CaF2, криолит Na3AlF6 и др., хлора — каменная соль (галит) NaCl, сильвин KCl и сильвинит KCl⋅NaCl.
Бром и иод не образуют индивидуальных минералов, но их соединения содержатся в морской воде и могут накапливаться водорослями.
Изотопный состав
В природе встречаются 2 стабильных изотопа хлора: с массовым числом 35 и 37. Доли их содержания соответственно равны 75,78 % и 24,22 %.
| Изотоп | Относительная масса, а.е.м. | Период полураспада | Тип распада | Ядерный спин |
|---|---|---|---|---|
| 35Cl | 34.968852721 | Стабилен | — | 3/2 |
| 36Cl | 35.9683069 | 301000 лет | β-распад в 36Ar | 0 |
| 37Cl | 36.96590262 | Стабилен | — | 3/2 |
| 38Cl | 37.9680106 | 37,2 минуты | β-распад в 38Ar | 2 |
| 39Cl | 38.968009 | 55,6 минуты | β-распад в 39Ar | 3/2 |
| 40Cl | 39.97042 | 1,38 минуты | β-распад в 40Ar | 2 |
| 41Cl | 40.9707 | 34 c | β-распад в 41Ar | |
| 42Cl | 41.9732 | 46,8 c | β-распад в 42Ar | |
| 43Cl | 42.9742 | 3,3 c | β-распад в 43Ar |
Бром
Способы получения брома
Промышленный способ
- Исходное сырьё для получения брома — морская вода, озёрные и подземные рассолы и щелока калийного производства, содержащие бром в виде бромид-иона Br-
Бром втесняют при помощи хлора:
2Вг— + Cl2 = Br2 + 2Сl—
Далее бром отгоняют из раствора водяным паром или воздухом.
Лабораторный способ
- В лаборатории для получения брома используют сильные окислители:
2NaBr + МnO2 + 2H2SO4 = Br2↓ + MnSO4 + Na2SO4 + 2Н2O
MnO2 + 4HBr → MnBr2 + Br2 + 2H2O
НВг + 2H2SO4 = 3Br2↓ + S↓ + 4Н2O
2HBr + Cl2 → Br2 + 2HCl
Физические свойства брома
В обычных условиях бром – красно-бурая жидкость с резким зловонным запахом. При Т=-7,2°C жидкий бром застывает, образуя красно-коричневые игольчатые кристаллы.
Пары брома жёлто-бурого цвета, Ткип = 58,78°C.
В воде бром растворяется лучше других галогенов (3,58 г брома в 100 г H2O при 20°C). Хорошо растворим во многих органических растворителях.
Бромная вода имеет желто-бурую окраску, быстро исчезающую, при взаимодействии растворенного Br2 с каким-либо веществом. «Обесцвечивание бромной воды» — широко используется в качестве теста на обнаружение в растворе многих неорганических и органических веществ.
Химические свойства брома
Химические свойства брома сходны с хлором. Различаются только условия протекания реакций.
Взаимодействие с простыми веществами
С металлами
Жидкий бром сильный окислитель. Например, железо и алюминий самовозгораются при соприкосновении с бромом даже при обычной температуре.
Al(тв) + 3/2Br2(ж) = AlBr3(тв), ΔH°298 = -513 кДж/моль
Al(тв) + 3/2Cl2(г) = AlBr3(тв), ΔH°298 = -704 кДж/моль
Fe(тв) + 3/2Br(тв) = FeBr3(тв), ΔH°298 = -269 кДж/моль
Fe(тв) + 3/2Cl2(г) = FeBr3(тв), ΔH°298 = -399 кДж/моль
С водородом
Взаимодействие брома с водородом происходит лишь при повышенной температуре. Реакция эндотермической и обратимой.
Br2 + H2 ↔ 2HBr
С азотом, углеродом, кислородом и благородными газами
Непосредственно не взаимодействует
С галогенами
Бром окисляется более активными галогенами:
5Cl2 + Br2 + 6H2O = 2HBrO3 + 10HCl
Взаимодействие со сложными веществами
- Бром окисляет сложные соединения:
Na2SO3 + Br2 + H2O = Na2SO4 + 2HBr
BaS + 4Br2 + 4H2O = BaSO4 + 8HBr
- диспропорционирует в водном растворе:
3BrO— ↔ BrO3— + 2Br—
4BrO— ↔ BrO4— + 3Br—
Обесцвечивание бромной воды
Обесцвечивание бромной воды – качественная реакция на многие неорганические и органические соединения:
- в воде SO2 и H2S в газообразном и растворенном виде, а также растворимые сульфиты и сульфиды реагируют с бромной водой, обесцвечивая ее:
Br2 + SO2 + 2Н2O = 2НВr + H2SO4
Br2 + Na2SO3 + Н2O = 2HBr + Na2SO4
Br2 + H2S = 2НВr + S↓
3Br2 + Na2S + ЗН2O = 6HBr + Na2SO3
- Обесцвечивание бромной воды непредельными органическими соединениями:
R-CH=CH-R’ + Br2 → R-CHBr-CHBr-R’
- Фенол и анилин также легко взаимодействуют с бромной водой:
С6Н5ОН + ЗBr2 → С6Н2Вг3ОН↓ + ЗНВr
С6Н5NH2 + ЗВr2 → С6H2Br3NH2↓ + ЗНВr
Примеры решения задач
ПРИМЕР 1
Задание Даны два элемента с зарядами ядер Z=17 и Z=18. Простое вещество, образованное первым элементом, — ядовитый газ с резким запахом, а вторым – не ядовитый, лишенный запаха, не поддерживающий дыхания газ. Напишите электронные формулы атомов обоих элементов. Какой из них образует ядовитый газ? Решение Электронные формулы заданных элементов будут записываться следующим образом:
17Z 1s22s22p63s23p5;
18Z 1s22s22p63s23p6.
Заряд ядра атома химического элемента равен его порядковому номеру в Периодической таблице. Следовательно, это хлор и аргон. Два атома хлора образуют молекулу простого вещества – Cl2, которое представляет собой ядовитый газ с резким запахом Ответ Хлор и аргон.
ПРИМЕР 2
Задание Назовите элементы, в атомах которых распределение электронов по энергетическим уровням в основном состоянии соответствует рядам чисел: а) 2,8,7; б) 2,8,8,1; в) 2,8,13,1; г)2,8,18,1. Какие из них относятся к одной группе? Какие находятся в одном периоде? Ответ Определить положение химического элемента в Периодической таблице можно сложив все электроны, имеющиеся в атоме, не учитывая их распределения по энергетическим уровням:
а) 2+8+7 =17. Это хлор.
б) 2+8+8+1 =19. Это калий.
в) 2+8+13+1 = 24. Это хром.
г) 2+8+18+1 = 29. Это медь.
В одной группе –первой, но разных подгруппах расположены калий и медь. Калий и хром находятся в одном периоде – четвертом.
Теги
Хлор в таблице менделеева занимает 17 место, в 3 периоде.
| Символ | Cl |
| Номер | 17 |
| Атомный вес | 35.4460000 |
| Латинское название | Chlorum |
| Русское название | Хлор |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема хлора
Cl: 1s2 2s2 2p6 3s2 3p5
Короткая запись:
Cl: [Ne]3s2 3p5
Одинаковую электронную конфигурацию имеют
атом хлора и
P-2, S-1
Порядок заполнения оболочек атома хлора (Cl) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на
‘d’ — до 10 и на ‘f’ до 14
Хлор имеет 17 электронов,
заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
5 электронов на 3p-подуровне
Степень окисления хлора
Атомы хлора в соединениях имеют степени окисления 6, 5, 4, 3, 2, 1, 0, -1.
Степень окисления — это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Ионы хлора
Валентность Cl
Атомы хлора в соединениях проявляют валентность VI, V, IV, III, II, I.
Валентность хлора характеризует способность атома Cl к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Cl
Квантовые числа определяются последним электроном в конфигурации,
для атома Cl эти числа имеют значение N = 3, L = 1, Ml = 0, Ms = -½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать.
Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo.
Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии
ионизации для каждого последующего электрона.
Энергия ионизации Cl:
Eo = 1251 кДж/моль
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
Где Cl в таблице менделеева?
Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве