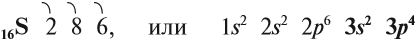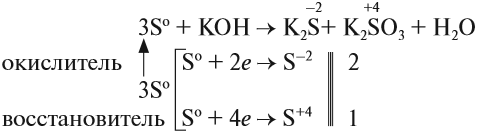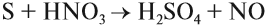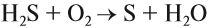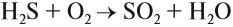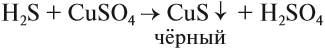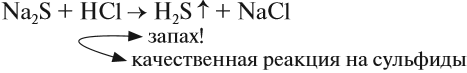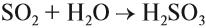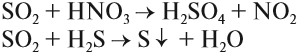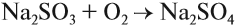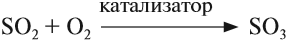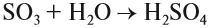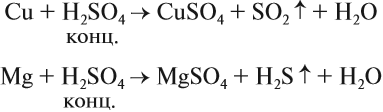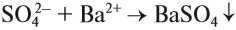Строение атома серы

4.6
Средняя оценка: 4.6
Всего получено оценок: 272.
4.6
Средняя оценка: 4.6
Всего получено оценок: 272.
Сера (S) – неметалл, относящийся к группе халькогенов. Строение атома серы легко определить, обратившись к периодической таблице Менделеева.
Строение
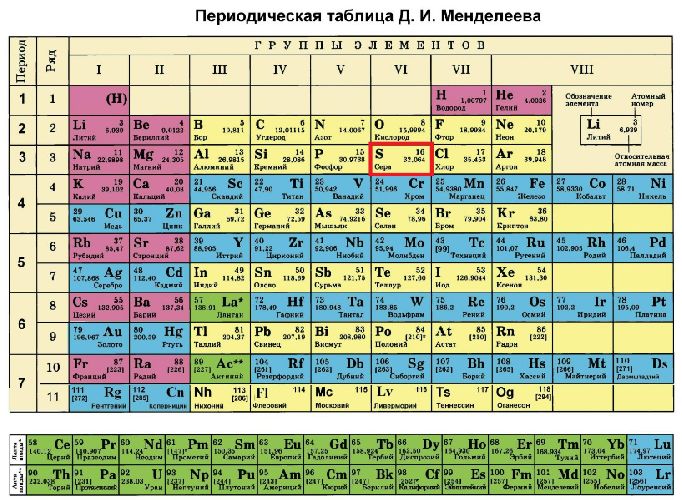
Сера в периодической таблице находится под 16 номером в третьем периоде, VI группе. Относительная атомная масса элемента – 32.
Природная сера имеет несколько изотопов:
- 32S;
- 33S;
- 34S;
- 36S.
Кроме этого, искусственно получено 20 радиоактивных изотопов.
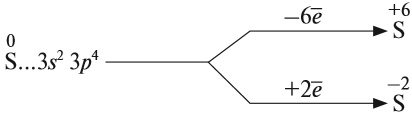
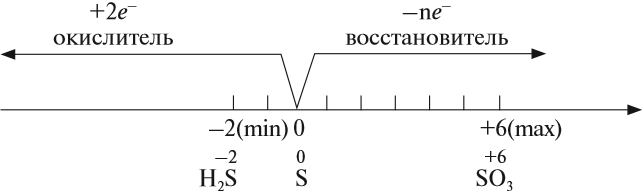
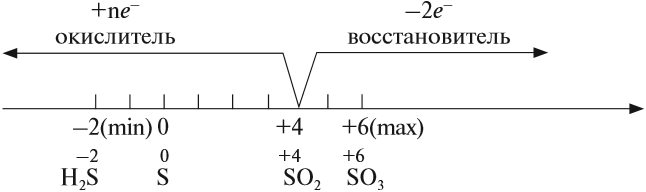
Сера – элемент р-семейства. Атом серы включает ядро с положительным зарядом +16 (16 протонов, 16 нейронов) и 16 электронов, расположенных на трёх электронных оболочках. На внешнем энергетическом уровне находится 6 электронов, которые определяют валентность элемента. До завершения внешнего р-уровня не хватает двух электронов, что определяет степень окисления серы как -2.
Атом серы может переходить в возбуждённое состояние за счёт вакантных 3d-орбиталей (всего пять d-орбиталей). Поэтому атом может проявлять степень окисления +4 и +6.
Отрицательную степень окисления сера проявляет в составе солей – Al2S3, SiS2, Na2S. Четвёртая степень окисления проявляется в реакциях с галогенами (SCl4, SBr4, SF4) и при взаимодействии с кислородом (SO2). Наивысшая степень окисления (+6) проявляется с наиболее электроотрицательными элементами – H2SO4, SF6, SO3.
Электронное строение атома серы – 1s22s22p63s23p4 или +16 S)2)8)6.
Физические свойства
Сера – кристаллическое соединение, которое при нагревании приобретает пластичную форму. Цвет неметалла варьирует от ярко-жёлтого до коричневого. Модификации серы зависят от количества атомов серы в молекуле.
Сера – слабый проводник тепла и электрического тока. Не взаимодействует с водой, но хорошо растворяется в органических растворителях – феноле, бензоле, аммиаке, сероуглероде.
В природе сера встречается в виде самородков и в составе руд, минералов, горных пород. Сера находится в сульфидах, сульфатах, каменном угле, нефти, газе. Серу накапливают бактерии, перерабатывающие сероводород.
Химические свойства
Сера – активный элемент, реагирующий при нагревании практически со всеми элементами, кроме инертных газов и N2, I2, Au, Pt. Сера не взаимодействует с соляной кислотой. Основные реакции серы с элементами описаны в таблице.
|
Взаимодействие |
Продукты реакции |
Пример |
|
С металлами |
Сульфиды |
Cu + S → CuS |
|
С кислородом при 280°С |
Оксид серы |
– S + O2 → SO2; – 2S + 3O2 → 2SO3 |
|
С водородом при нагревании |
Сероводород |
H2 + S → H2S |
|
С фосфором при нагревании в отсутствии воздуха |
Сульфид фосфора |
2P + 3S → P2S3 |
|
С фтором |
Фторид серы |
S + 3F2 → SF6 |
|
С углеродом |
Сероуглерод |
2S + C → CS2 |
|
С кислотами |
Кислота |
S + 2HNO3 → 2NO + H2SO4 |
|
Со щёлочью |
Сульфиды и сульфиты |
3S + 6KOH → K2SO3 + 2K2S + 3H2O |
Сера входит в состав белков. Большое количество серы накапливается в волосах.
Что мы узнали?
Сера – кристаллический неметалл жёлтого цвета. Схема строения атома – +16 S)2)8)6. Проявляет три степени окисления: -2, +4, +6. Известно 24 изотопа серы. Это активный элемент, вступающий в реакцию с металлами и неметаллами. Образует соли – сульфиты и сульфиды, а также серную кислоту. Сера нерастворима в воде и соляной кислоте. Входит в состав живых организмов. В природе находится в свободном и связанном виде.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Александр Котков
5/5
-
Александр Котков
5/5
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 272.
А какая ваша оценка?
Электронное строение атома серы
Электронное строение нейтрального атома серы в основном состоянии.
Схема строения электронных оболочек
Распределение электронов по энергетическим уровням (или по электронным слоям) в атоме серы.
S
+16
2
8
6
Электронно-графическая схема
Распределение электронов по атомным орбиталям в атоме серы.
| 3 | ↑↓ | ↑↓ | ↑ | ↑ | ||
| 2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ||
| 1 | ↑↓ | |||||
| s | p |
Валентные орбитали атома серы выделены фиолетовым цветом.
Электронная конфигурация
Полная электронная конфигурация атома серы.
16S 1s2 2s2 2p6 3s2 3p4
Сокращённая электронная конфигурация атома серы.
16S [Ne] 3s2 3p4
Квантовые числа валентных электронов
Главное (n), орбитальное (l), магнитное (m) и спиновое (s) квантовые числа валентных электронов атома серы.
| Орбиталь | Квантовое число | |||
|---|---|---|---|---|
| n | l | m | s | |
| 3s | 3 | 0 | 0 | +½ |
| -½ | ||||
| 3p | 3 | 1 | -1 | +½ |
| -½ | ||||
| 1 | +½ | |||
| 2 | +½ |
Содержание материала
- Строение
- Сера в природе
- Природные минералы серы
- Физические свойства
- Применение
- Электронное строение атома серы
- Валентность S
- Сероводород
- Строение атома серы
- Серный ангидрид и серная кислота
- Продукты питания богатые серой
Строение
Сера в периодической таблице находится под 16 номером в третьем периоде, VI группе. Относительная атомная масса элемента – 32.
Природная сера имеет несколько изотопов:
- 32S;
- 33S;
- 34S;
- 36S.
Кроме этого, искусственно получено 20 радиоактивных изотопов.
Сера – элемент р-семейства. Атом серы включает ядро с положительным зарядом +16 (16 протонов, 16 нейронов) и 16 электронов, расположенных на трёх электронных оболочках. На внешнем энергетическом уровне находится 6 электронов, которые определяют валентность элемента. До завершения внешнего р-уровня не хватает двух электронов, что определяет степень окисления серы как -2.
Атом серы может переходить в возбуждённое состояние за счёт вакантных 3d-орбиталей (всего пять d-орбиталей). Поэтому атом может проявлять степень окисления +4 и +6.
Отрицательную степень окисления сера проявляет в составе солей – Al2S3, SiS2, Na2S. Четвёртая степень окисления проявляется в реакциях с галогенами (SCl4, SBr4, SF4) и при взаимодействии с кислородом (SO2). Наивысшая степень окисления (+6) проявляется с наиболее электроотрицательными элементами – H2SO4, SF6, SO3.
Электронное строение атома серы – 1s22s22p63s23p4 или +16 S)2)8)6.
Сера в природе
Самородная сера на вулкане Килауэа
Большие скопления самородной серы (с содержанием > 25 %) редки, они встречаются в местах вулканической активности, им сопутствуют сернистые фумаролы и сернистые воды.
Серная руда разрабатывается в месторождениях самородной серы, добывается из сульфидных руд и промышленных газов.
Серные бактерии могут окислять сероводород от гниющих органических остатков до серы и накапливать её.
Природные минералы серы
Сера является шестнадцатым по химической распространённости элементом в земной коре. Встречается в свободном (самородном) состоянии и в связанном виде.
Важнейшие природные минералы серы: FeS2 — железный колчедан, или пирит, ZnS — цинковая обманка, или сфалерит (вюрцит), PbS — свинцовый блеск, или галенит, HgS — киноварь, Sb2S3 — антимонит, Cu2S — халькозин, CuS — ковеллин, CuFeS2 — халькопирит. Кроме того, сера присутствует в нефти, природном угле, природных газах и сланцах. Сера — шестой элемент по содержанию в природных водах, встречается в основном в виде сульфат-иона и обусловливает «постоянную» жёсткость пресной воды. Жизненно важный элемент для высших организмов, составная часть многих белков, концентрируется в волосах.
Физические свойства
Сера – кристаллическое соединение, которое при нагревании приобретает пластичную форму. Цвет неметалла варьирует от ярко-жёлтого до коричневого. Модификации серы зависят от количества атомов серы в молекуле.
Рис. 3. Сера.
Сера – слабый проводник тепла и электрического тока. Не взаимодействует с водой, но хорошо растворяется в органических растворителях – феноле, бензоле, аммиаке, сероуглероде.
В природе сера встречается в виде самородков и в составе руд, минералов, горных пород. Сера находится в сульфидах, сульфатах, каменном угле, нефти, газе. Серу накапливают бактерии, перерабатывающие сероводород.
Применение
Примерно половина производимой серы используется в производстве серной кислоты.
Серу применяют для вулканизации каучука, как фунгицид в сельском хозяйстве и как сера коллоидная — лекарственный препарат. Также сера в составе серобитумных композиций применяется для получения сероасфальта, а в качестве заместителя портландцемента — для получения серобетона. Сера находит применение для производства пиротехнических составов, ранее использовалась в производстве пороха, применяется для производства спичек.
Электронное строение атома серы
Атом серы состоит из положительно заряженного ядра (+16), состоящего из 16 протонов и 16 нейтронов, вокруг которого по 3-м орбитам движутся 16 электронов.
Рис.1. Схематическое строение атома серы.
Распределение электронов по орбиталям выглядит следующим образом:
+16S)2)8)6;
1s22s22p63s23p4.
На внешнем энергетическом уровне атома серы находится шесть электронов, все они считаются валентными. Энергетическая диаграмма принимает следующий вид:
Наличие двух неспаренных электронов свидетельствует о том, что сера способна проявлять степень окисления +2. Также возможно несколько возбужденных состояний из-за наличия вакантной 3d-орбитали. Сначала распариваются электроны 3p -подуровня и занимают свободные d-орбитали, а после – электроны 3s-подуровня:
Этим объясняется наличие у серы ещё двух степеней окисления: +4 и +6.
Валентность S
Атомы серы в соединениях проявляют валентность VI, V, IV, III, II, I.
Валентность серы характеризует способность атома S к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Сероводород
H2S — сероводород, сильно ядовитый газ с противным запахом тухлых яиц. Правильнее сказать, белки яиц при гниении разлагаются, выделяя сероводород.
Задание 15.4. Исходя из степени окисления атома серы в сероводороде, предcкажите, какие свойства будет проявлять этот атом в окислительно-восстановительных реакциях.
Поскольку сероводород — восстановитель (атом серы имеет низшую степень окисления), он легко окисляется. Кислород воздуха окисляет сероводород даже при комнатной температуре:
Сероводород горит:
Сероводород немного растворим в воде, причём его раствор проявляет свойства очень слабой кислоты (сероводородной H2S). Она образует соли сульфиды:
Вопрос. Как, имея сульфид, получить сероводород?
Сероводород в лабораториях получают, действуя на сульфиды более сильными (чем H2S) кислотами, например:
Строение атома серы
В атоме серы 16 электронов (рис. 51), из них 6 электронов — на внешнем электронном слое:
В соединениях с металлами и водородом сера обычно проявляет степень окисления, равную –2, например 


Серный ангидрид и серная кислота
Серный ангидрид SO3 — бесцветная жидкость, бурно реагирующая с водой:
Серная кислота H2SO4 — сильная кислота, которая в концентрированном виде активно поглощает влагу из воздуха (это свойство применяется при осушении различных газов) и из некоторых сложных веществ:
Кроме того, концентрированная серная кислота, являясь сильным окислителем, окисляет углерод:
Поэтому, попадая на кожу, концентрированная серная кислота вызывает тяжёлые ожоги, а попадая на ткани, бумагу и другие вещества, обугливает их.
Являясь окислителем (+6 — высшая степень окисления для серы!), концентрированная серная кислота реагирует почти со всеми металлами (кроме железа и благородных металлов) без выделения водорода:
Задание 15.7. Уравняйте эти схемы методом электронного баланса. Укажите, какой атом является окислителем в каждом случае.
Но разбавленная серная кислота и её соли — сульфаты — окислительных свойств (за счёт атома серы) практически не проявляют:
Задание 15.8. Определите, какой атом является окислителем в данной реакции.
Растворы серной кислоты проявляют все свойства сильных кислот.
Задание 15.9. Составьте уравнения реакций, отражающие эти свойства. (При затруднении см. урок 2.2.)
Качественной реакцией на SO42– является образование белого осадка BaSO4, нерастворимого в кислотах:
Серная кислота имеет разнообразное применение: её используют при получении стиральных порошков, лекарств, красителей, удобрений и других необходимых веществ.
Продукты питания богатые серой
Богаты серой мясные и рыбные продукты – индейка, говядина, свинина, мясо кролика, курица, говяжья и индюшачья печень, морская рыба (камбала, сардина, окунь, зубатка), перепелиные и куриные яйца, сыр, крупы и бобовые, овощи (белокочанная и брюссельская капуста, лук, чеснок, салат, репа).
Теги
Содержание
- Строение атома и свойства серы
- Сероводород
- Сернистый газ и сернистая кислота
- Серный ангидрид и серная кислота
- Выводы
Строение атома и свойства серы
Сера — элемент шестой группы третьего периода периодической системы Менделеева. Поэтому строение атома серы изображается так:
Строение атома серы указывает на то, что это неметалл, т. е. атом серы способен и к приёму электронов и к отдаче электронов:
Задание 15.1. Составить формулы соединений серы, содержащие атомы серы с данными степенями окисления.
Простое вещество «сера» — твёрдый хрупкий минерал жёлтого цвета, нерастворимый в воде. В природе встречается как самородная сера, так и её соединения: сульфиды, сульфаты. Сера как активный неметалл легко реагирует с водородом, кислородом, почти со всеми металлами и неметаллами:
Задание 15.2. Назовите полученные соединения. Определите, какие свойства (окислителя или восстановителя) проявляет сера в этих реакциях.
Как типичный неметалл простое вещество сера может быть и окислителем, и восстановителем:
Иногда эти свойства проявляются в одной реакции:
Поскольку атом-окислитель и атом-восстановитель одинаковые, их можно «сложить», т. е. на оба процесса нужно три атома серы.
Задание 15.3. Расставьте остальные коэффициенты в этом уравнении.
Сера может реагировать с кислотами — сильными окислителями:
Таким образом, являясь активным неметаллом, сера образует множество соединений. Рассмотрим свойства сероводорода, оксидов серы и их производных.
Сероводород
H2S — сероводород, сильно ядовитый газ с противным запахом тухлых яиц. Правильнее сказать, белки яиц при гниении разлагаются, выделяя сероводород.
Задание 15.4. Исходя из степени окисления атома серы в сероводороде, предcкажите, какие свойства будет проявлять этот атом в окислительно-восстановительных реакциях.
Поскольку сероводород — восстановитель (атом серы имеет низшую степень окисления), он легко окисляется. Кислород воздуха окисляет сероводород даже при комнатной температуре:
Сероводород горит:
Сероводород немного растворим в воде, причём его раствор проявляет свойства очень слабой кислоты (сероводородной H2S). Она образует соли сульфиды:
Вопрос. Как, имея сульфид, получить сероводород?
Сероводород в лабораториях получают, действуя на сульфиды более сильными (чем H2S) кислотами, например:
Сернистый газ и сернистая кислота
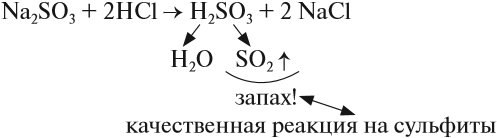
SO2 — сернистый газ с резким удушливым запахом. Ядовит. Растворяется в воде, образуя сернистую кислоту:
Эта кислота средней силы, но очень неустойчива, существует только в растворах. Поэтому при действии на её соли — сульфиты — другими кислотами можно получить сернистый газ:
При кипячении полученного раствора эта кислота разлагается полностью.
Задание 15.5. Определите степень окисления серы в сернистом газе, сернистой кислоте, сульфите натрия.
Поскольку степень окисления +4 для серы является промежуточной, все перечисленные соединения могут быть и окислителями и восстановителями:
Например:
Задание 15.6. Расставьте коэффициенты в этих схемах методом электронного баланса. Укажите, какие свойства проявляет атом серы со степенью окисления +4 в каждой из реакций.
Восстановительные свойства сернистого газа применяются на практике. Так, при восстановлении теряют цвет некоторые органические соединения, поэтому оксид серы IV и сульфиты применяют при отбеливании. Сульфит натрия, растворённый в воде, замедляет коррозию труб, так как легко поглощает кислород из воды, а именно кислород является «виновником» коррозии:
Окисляясь в присутствии катализатора, сернистый газ превращается в серный ангидрид SO3:
Серный ангидрид и серная кислота
Серный ангидрид SO3 — бесцветная жидкость, бурно реагирующая с водой:
Серная кислота H2SO4 — сильная кислота, которая в концентрированном виде активно поглощает влагу из воздуха (это свойство применяется при осушении различных газов) и из некоторых сложных веществ:
Кроме того, концентрированная серная кислота, являясь сильным окислителем, окисляет углерод:
Поэтому, попадая на кожу, концентрированная серная кислота вызывает тяжёлые ожоги, а попадая на ткани, бумагу и другие вещества, обугливает их.
Являясь окислителем (+6 — высшая степень окисления для серы!), концентрированная серная кислота реагирует почти со всеми металлами (кроме железа и благородных металлов) без выделения водорода:
Задание 15.7. Уравняйте эти схемы методом электронного баланса. Укажите, какой атом является окислителем в каждом случае.
Но разбавленная серная кислота и её соли — сульфаты — окислительных свойств (за счёт атома серы) практически не проявляют:
Задание 15.8. Определите, какой атом является окислителем в данной реакции.
Растворы серной кислоты проявляют все свойства сильных кислот.
Задание 15.9. Составьте уравнения реакций, отражающие эти свойства. (При затруднении см. урок 2.2.)
Качественной реакцией на SO42– является образование белого осадка BaSO4, нерастворимого в кислотах:
Серная кислота имеет разнообразное применение: её используют при получении стиральных порошков, лекарств, красителей, удобрений и других необходимых веществ.
Выводы
Изложенное выше можно отразить в шутливом стишке: «Сера, сера, буква S, 32 атомный вес, сера в воздухе горит, образует ангидрид (какой кислоты?), ангидрид плюс вода — получилась кислота (какая?)».
Содержание
- Строение атома серы и схема электронной оболочки
- Строение
- Физические свойства
- Химические свойства
- Строение атома серы и схема электронной оболочки
- Строение
- Физические свойства
- Химические свойства
- Строение атома серы
- Строение
- Физические свойства
- Химические свойства
- Сера, свойства атома, химические и физические свойства
- Сера, свойства атома, химические и физические свойства.
- Атом и молекула серы. Формула серы. Строение атома серы:
- Изотопы и модификации серы:
- Свойства серы (таблица): температура, плотность, давление и пр.:
Строение атома серы и схема электронной оболочки
Сера (S) – неметалл, относящийся к группе халькогенов. Строение атома серы легко определить, обратившись к периодической таблице Менделеева.
Строение
Сера в периодической таблице находится под 16 номером в третьем периоде, VI группе. Относительная атомная масса элемента – 32.
Рис. 1. Положение в периодической таблице.
Природная сера имеет несколько изотопов:
Кроме этого, искусственно получено 20 радиоактивных изотопов.
Сера – элемент р-семейства. Атом серы включает ядро с положительным зарядом +16 (16 протонов, 16 нейронов) и 16 электронов, расположенных на трёх электронных оболочках. На внешнем энергетическом уровне находится 6 электронов, которые определяют валентность элемента. До завершения внешнего р-уровня не хватает двух электронов, что определяет степень окисления серы как -2.
Атом серы может переходить в возбуждённое состояние за счёт вакантных 3d-орбиталей (всего пять d-орбиталей). Поэтому атом может проявлять степень окисления +4 и +6.
Отрицательную степень окисления сера проявляет в составе солей – Al2S3, SiS2, Na2S. Четвёртая степень окисления проявляется в реакциях с галогенами (SCl4, SBr4, SF4) и при взаимодействии с кислородом (SO2). Наивысшая степень окисления (+6) проявляется с наиболее электроотрицательными элементами – H2SO4, SF6, SO3.
Электронное строение атома серы – 1s22s22p63s23p4 или +16 S)2)8)6.
Физические свойства
Сера – кристаллическое соединение, которое при нагревании приобретает пластичную форму. Цвет неметалла варьирует от ярко-жёлтого до коричневого. Модификации серы зависят от количества атомов серы в молекуле.
Сера – слабый проводник тепла и электрического тока. Не взаимодействует с водой, но хорошо растворяется в органических растворителях – феноле, бензоле, аммиаке, сероуглероде.
В природе сера встречается в виде самородков и в составе руд, минералов, горных пород. Сера находится в сульфидах, сульфатах, каменном угле, нефти, газе. Серу накапливают бактерии, перерабатывающие сероводород.
Химические свойства
Сера – активный элемент, реагирующий при нагревании практически со всеми элементами, кроме инертных газов и N2, I2, Au, Pt. Сера не взаимодействует с соляной кислотой. Основные реакции серы с элементами описаны в таблице.
Источник
Строение атома серы и схема электронной оболочки
Сера (S) – неметалл, относящийся к группе халькогенов. Строение атома серы легко определить, обратившись к периодической таблице Менделеева.
Строение
Сера в периодической таблице находится под 16 номером в третьем периоде, VI группе. Относительная атомная масса элемента – 32.
Рис. 1. Положение в периодической таблице.
Природная сера имеет несколько изотопов:
Кроме этого, искусственно получено 20 радиоактивных изотопов.
Сера – элемент р-семейства. Атом серы включает ядро с положительным зарядом +16 (16 протонов, 16 нейронов) и 16 электронов, расположенных на трёх электронных оболочках. На внешнем энергетическом уровне находится 6 электронов, которые определяют валентность элемента. До завершения внешнего р-уровня не хватает двух электронов, что определяет степень окисления серы как -2.
Атом серы может переходить в возбуждённое состояние за счёт вакантных 3d-орбиталей (всего пять d-орбиталей). Поэтому атом может проявлять степень окисления +4 и +6.
Отрицательную степень окисления сера проявляет в составе солей – Al2S3, SiS2, Na2S. Четвёртая степень окисления проявляется в реакциях с галогенами (SCl4, SBr4, SF4) и при взаимодействии с кислородом (SO2). Наивысшая степень окисления (+6) проявляется с наиболее электроотрицательными элементами – H2SO4, SF6, SO3.
Электронное строение атома серы – 1s22s22p63s23p4 или +16 S)2)8)6.
Физические свойства
Сера – кристаллическое соединение, которое при нагревании приобретает пластичную форму. Цвет неметалла варьирует от ярко-жёлтого до коричневого. Модификации серы зависят от количества атомов серы в молекуле.
Сера – слабый проводник тепла и электрического тока. Не взаимодействует с водой, но хорошо растворяется в органических растворителях – феноле, бензоле, аммиаке, сероуглероде.
В природе сера встречается в виде самородков и в составе руд, минералов, горных пород. Сера находится в сульфидах, сульфатах, каменном угле, нефти, газе. Серу накапливают бактерии, перерабатывающие сероводород.
Химические свойства
Сера – активный элемент, реагирующий при нагревании практически со всеми элементами, кроме инертных газов и N2, I2, Au, Pt. Сера не взаимодействует с соляной кислотой. Основные реакции серы с элементами описаны в таблице.
Источник
Строение атома серы

Всего получено оценок: 210.
Всего получено оценок: 210.
Сера (S) – неметалл, относящийся к группе халькогенов. Строение атома серы легко определить, обратившись к периодической таблице Менделеева.
Строение
Сера в периодической таблице находится под 16 номером в третьем периоде, VI группе. Относительная атомная масса элемента – 32.

Природная сера имеет несколько изотопов:
Кроме этого, искусственно получено 20 радиоактивных изотопов.
Сера – элемент р-семейства. Атом серы включает ядро с положительным зарядом +16 (16 протонов, 16 нейронов) и 16 электронов, расположенных на трёх электронных оболочках. На внешнем энергетическом уровне находится 6 электронов, которые определяют валентность элемента. До завершения внешнего р-уровня не хватает двух электронов, что определяет степень окисления серы как -2.
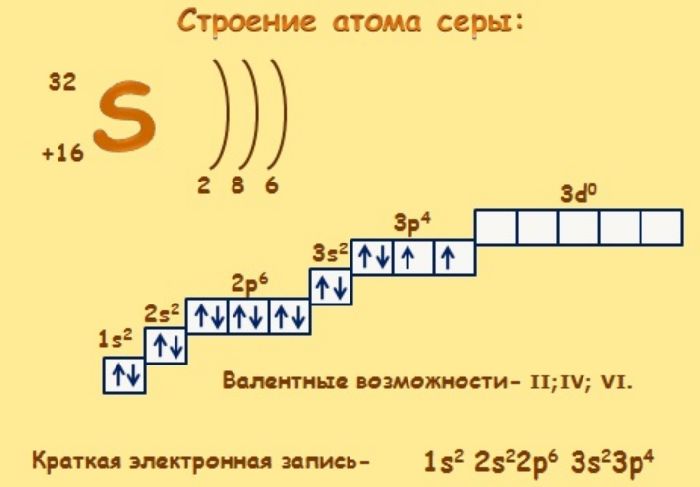
Отрицательную степень окисления сера проявляет в составе солей – Al2S3, SiS2, Na2S. Четвёртая степень окисления проявляется в реакциях с галогенами (SCl4, SBr4, SF4) и при взаимодействии с кислородом (SO2). Наивысшая степень окисления (+6) проявляется с наиболее электроотрицательными элементами – H2SO4, SF6, SO3.
Электронное строение атома серы – 1s 2 2s 2 2p 6 3s 2 3p 4 или +16 S)2)8)6.
Физические свойства
Сера – кристаллическое соединение, которое при нагревании приобретает пластичную форму. Цвет неметалла варьирует от ярко-жёлтого до коричневого. Модификации серы зависят от количества атомов серы в молекуле.
Сера – слабый проводник тепла и электрического тока. Не взаимодействует с водой, но хорошо растворяется в органических растворителях – феноле, бензоле, аммиаке, сероуглероде.
В природе сера встречается в виде самородков и в составе руд, минералов, горных пород. Сера находится в сульфидах, сульфатах, каменном угле, нефти, газе. Серу накапливают бактерии, перерабатывающие сероводород.
Химические свойства
Сера – активный элемент, реагирующий при нагревании практически со всеми элементами, кроме инертных газов и N2, I2, Au, Pt. Сера не взаимодействует с соляной кислотой. Основные реакции серы с элементами описаны в таблице.
Источник
Сера, свойства атома, химические и физические свойства
Сера, свойства атома, химические и физические свойства.
32,059-32,076 1s 2 2s 2 2p 6 3s 2 3p 4
Сера — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 16. Расположен в 16-й группе (по старой классификации — главной подгруппе шестой группы), третьем периоде периодической системы.
Атом и молекула серы. Формула серы. Строение атома серы:
Сера (лат. Sulfur, из старославянского «сѣра» — «сера, смола», вообще «горючее вещество, жир») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением S и атомным номером 16. Расположен в 16-й группе (по старой классификации – главной подгруппе шестой группы), третьем периоде периодической системы.
Сера – неметалл. Относится к группе халькогенов.
Сера обозначается символом S.
Как простое вещество сера при нормальных условиях представляет собой светло-жёлтое порошкообразное вещество или лимонно-жёлтые кристаллы.
Молекула серы. Сера отличается способностью образовывать устойчивые цепочки и циклы из атомов. Наиболее стабильны циклические молекулы S8, имеющие форму короны, образующие ромбическую и моноклинную серу. Кроме того, возможны молекулы с замкнутыми (S4, S6) цепями и открытыми цепями.
Химическая формула серы чаще всего записывается просто S, так как она, хотя и имеет молекулярную структуру, является смесью простых веществ с разными молекулами.
Электронная конфигурация атома серы 1s 2 2s 2 2p 6 3s 2 3p 4 . Потенциал ионизации (первый электрон) атома серы равен 999,59 кДж/моль (10,36001 эВ).
Строение атома серы. Атом серы состоит из положительно заряженного ядра (+16), вокруг которого по четырем оболочкам движутся 16 электрона. При этом 10 электронов находятся на внутреннем уровне, а 6 электронов – на внешнем. Поскольку сера расположена в третьем периоде, оболочек всего три. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлены s- и р-орбиталями. Третья – внешняя оболочка представлена s- и р-орбиталями. На внешнем энергетическом уровне атома серы на 3s-орбитали находятся два спаренных электрона, на 3p-орбитали – два спаренных и два неспаренных электрона. В свою очередь ядро атома серы состоит из 16 протонов и 16 нейтронов. Сера относится к элементам p-семейства.
Радиус атома серы (вычисленный) составляет 88 пм.
Атомная масса атома серы составляет 32,059-32,076 а. е. м.
Изотопы и модификации серы:
Свойства серы (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Сера |
| 102 | Прежнее название | |
| 103 | Латинское название | Sulfur |
| 104 | Английское название | Sulfur |
| 105 | Символ | S |
| 106 | Атомный номер (номер в таблице) | 16 |
| 107 | Тип | Неметалл |
| 108 | Группа | Халькоген |
| 109 | Открыт | Известна с глубокой древности |
| 110 | Год открытия | 2000 лет до н.э. |
| 111 | Внешний вид и пр. | Светло-жёлтое, порошкообразное вещество или лимонно-жёлтые кристаллы |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | более 30 аллотропных модификаций серы. Из них наиболее известны:
– ромбическая сера (α-сера или α-форма серы) с простой орторомбической кристаллической решёткой, – моноклинная сера (β-сера или β-форма серы) с простой моноклинной кристаллической решёткой, – аморфная сера (пластическая сера), – ромбоэдрическая сера |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,042 % |
| 120 | Содержание в морях и океанах (по массе) | 0,093 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,05 % |
| 122 | Содержание в Солнце (по массе) | 0,04 % |
| 123 | Содержание в метеоритах (по массе) | 4,0 % |
| 124 | Содержание в организме человека (по массе) | 0,2 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса)* | 32,059-32,076 а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s 2 2s 2 2p 6 3s 2 3p 4 |
| 203 | Электронная оболочка | K2 L8 M6 N0 O0 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 88 пм |
| 205 | Эмпирический радиус атома* | 100 пм |
| 206 | Ковалентный радиус* | 102,5 пм |
| 207 | Радиус иона (кристаллический) | S 2-
(в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 180 пм |
| 209 | Электроны, Протоны, Нейтроны | 16 электронов, 16 протонов, 16 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 3 |
| 212 | Группа в периодической таблице | 16-ая группа (по старой классификации – главная подгруппа 6-ой группы) |
| 213 | Эмиссионный спектр излучения |  |
| 300 | Химические свойства | |
| 301 | Степени окисления | -2 , -1, 0 , +1 , +2 , +3, +4 , +5, +6 |
| 302 | Валентность | II, IV, VI |
| 303 | Электроотрицательность | 2,58 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 999,59 кДж/моль (10,36001 эВ) |
| 305 | Электродный потенциал | S2 2- + 2e – → 2S 2- , E o = -0,524 В,
2S + 2e – → S2 2- , E o = -0,476 В, 5S + 2e – → S5 2- , E o = -0,34 В |
| 306 | Энергия сродства атома к электрону | 200,4101(1) кДж/моль (2,0771042(6) эВ) – сера 32 S,
200,4101(2) кДж/моль (2,0771045(12) эВ) – 34 S |
| 400 | Физические свойства | |
| 401 | Плотность | 1,92 г/см 3 (при 20 °C и иных стандартных условиях , состояние вещества – твердое тело) – аморфная сера, а также моноклинная сера (β-сера),
2,07 г/см 3 (при 20 °C и иных стандартных условиях , состояние вещества – твердое тело) – ромбическая сера (α-сера), 2,209 г/см 3 (при 20 °C и иных стандартных условиях , состояние вещества – твердое тело) – ромбоэдрическая сера, 1,7988 г/см 3 (при 125 °C и иных стандартных условиях , состояние вещества – жидкость) |
| 402 | Температура плавления* | 115,21 °C (388,36 K, 239,38 °F) – ромбическая сера (α-сера),
119,3 °C (392,45 K, 246,74 °F) – моноклинная сера (β-сера) |
| 403 | Температура кипения | 444,6 °C (717,8 K, 832,3 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 1,727 кДж/моль – моноклинная сера (β-сера) |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 45 кДж/моль – моноклинная сера (β-сера) |
| 409 | Удельная теплоемкость при постоянном давлении | 0,708 Дж/г·K (при 25 °C) – ромбическая сера (α-сера),
0,736 (при 25 °C) – моноклинная сера (β-сера) |
| 410 | Молярная теплоёмкость* | 22,75 Дж/(K·моль) |
| 411 | Молярный объём | 16,35969 см³/моль |
| 412 | Теплопроводность | 0,205 Вт/(м·К) (при стандартных условиях ) – аморфная сера,
0,27 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | Ромбическая сера (α-сера) |
| 512 | Структура решётки | Простая орторомбическая
|
| 513 | Параметры решётки | a = 10,437 Å, b = 12,845 Å, c = 24,369 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | |
| 516 | Название пространственной группы симметрии | Fddd |
| 517 | Номер пространственной группы симметрии | 70 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7704-34-9 |
201* Указан диапазон значений атомной массы в связи с различной распространённостью изотопов данного элемента в природе.
205* Эмпирический радиус атома серы согласно [3] составляет 127 пм.
206* Ковалентный радиус серы согласно [1] и [3] составляет 105±3 пм и 102 пм соответственно.
402* Температура плавления ромбической серы (α-серы) согласно [3] и [4] составляет 112,85 °C (386 K, 235,13 °F) и 112,8 °C (385,95 K, 235,04 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) моноклинной серы (β-сера) согласно [4] составляет 1,72 кДж/моль.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) моноклинной серы (β-сера) согласно [4] составляет 9,2 кДж/моль.
410* Молярная теплоемкость серы согласно [3] составляет 22,61 Дж/(K·моль).
Источник