| Сульфат алюминия | |
|---|---|
 |
|
| Традиционные названия | сернокислый алюминий |
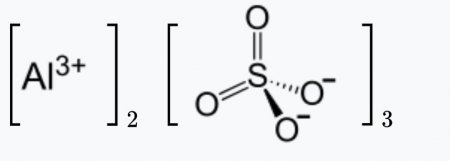
| Хим. формула | Al2O12S3 |
| Рац. формула | Al2(SO4)3 |
| Состояние | твердое |
| Молярная масса | 342,15 г/моль |
| Плотность |
2,710 г/см3 (безв.) 1,690 г/см3 (18-водн.) |
| Температура | |
| • плавления | 700 °C |
| • кипения | 1600 °C |
| • разложения | 580 °C |
| ГОСТ | ГОСТ 3758-75 |
| Рег. номер CAS | 10043-01-3 |
| PubChem | 24850 |
| Рег. номер EINECS | 233-135-0 |
| SMILES |
O=S1(=O)O[Al]2OS(=O)(=O)O[Al](O1)OS(=O)(=O)O2 |
| InChI |
1S/2Al.3H2O4S/c;;3*1-5(2,3)4/h;;3*(H2,1,2,3,4)/q2*+3;;;/p-6 DIZPMCHEQGEION-UHFFFAOYSA-H |
| Кодекс Алиментариус | E520 |
| RTECS | BD1700000 |
| ChEBI | 74768 |
| ChemSpider | 23233 |
| Токсичность | малотоксично |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Сульфат алюминия — сложное неорганическое соединение, соль алюминия и серной кислоты с химической формулой Al2(SO4)3. Выглядит как бесцветные кристаллы, может образовывать кристаллогидраты с различным содержанием воды. Применяется при очистке воды, крашении тканей, дублении кож, как реактив в фотографии, для получения квасцов.
Физические свойства
Бесцветные кристаллы, пластинки или порошок. Имеет орторомбическую решетку. Плотность — 2,710 г/см3, удельная теплоёмкость при постоянном давлении — 259,6 Дж/(моль К). Плохо растворим в спиртах, хорошо растворим в воде, гигроскопичен. Устойчив при обычной температуре.
Образует кристаллогидрат с формулой Al2(SO4)3·18H2O, выглядящий как бесцветные кристаллы, плавящиеся при 86,5 °C (с разложением) и с плотностью 1,690 г/см3. При длительном хранении 18-водный кристаллогидрат может частично выветриваться до содержания 14—14,5 молекул воды. 18-водный кристаллогидрат теряет воду при нагревании, образуя формы:
- 150 °C — Al2(SO4)3·14 H2O,
- 160 °C — Al2(SO4)3·10 H2O,
- 250 °C — Al2(SO4)3·3 H2O,
- 420 °C — полностью безводную.
Химические свойства
Сульфат алюминия разлагается при температуре выше 580 °C на γ-модификацию окиси алюминия и серный ангидрид:
- Al2(SO4)3 →580∘C Al2O3 + 3 SO3
Задубливает желатиновые фотослои, что используется в производстве фотографических материалов для повышения механической прочности слоев фотоэмульсии, а в цветной фотографии также для предохранения красителей от гидролитического распада. Механизм дубления обусловлен связыванием ионами алюминия ионизированных карбоксильных групп желатины.
Получение
Сульфат алюминия получают взаимодействием гидроксида алюминия с серной кислотой:
- 2 Al(OH)3 + 3 H2SO4 ⟶ Al2(SO4)3 + 6 H2O
Также сульфат алюминия получают взаимодействием алюминия с серной кислотой:
- 2 Al + 3 H2SO4 ⟶ Al2(SO4)3 + 3 H2
Применение
Сульфат алюминия применяется как коагулянт для очистки воды хозяйственно-питьевого и промышленного назначения и используется в бумажной, текстильной, кожевенной и других отраслях промышленности.
Используется в качестве пищевой добавки E520.
В фотографии входит в составы стабилизирующих растворов и дубящих фиксажей.

Онлайн калькуляторы
На нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике.

Справочник
Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание!

Заказать решение
Не можете решить контрольную?!
Мы поможем! Более 20 000 авторов выполнят вашу работу от 100 руб!
Формула сульфата алюминия
Определение и формула сульфата алюминия

Формула –
Молярная масса равна г/моль.
Физические свойства – белое вещество (может иметь разные оттенки), плавящееся с разложением.
В обычных условиях образует кристаллогидрат с формулой .
Химические свойства сульфата алюминия
- Сульфат алюминия хорошо растворяется в воде (происходит гидролиз по катиону):
- При нагревании до температуры
протекает окислительно-восстановительная реакция диспропорционирования (сульфат алюминия разлагается на оксид алюминия, оксид серы
и кислород):
- Реагирует с кипящей водой:
- Взаимодействует с растворами разбавленных щелочей:
- Вступает в реакцию с растворами концентрированных щелочей:
- Реагирует с гидроксидом аммония:
- Вступает в реакцию обмена с солями с образованием осадков:
Получение
Сульфат алюминия можно получить при взаимодействии оксида алюминия с кислым сульфатом калия при высокой температуре ():
Применение
Сульфат алюминия находит применение в качестве коагулянта для очистки воды хозяйственно-питьевого и промышленного назначения. Он также применяется во многих отраслях промышленности, например, в бумажной. Кроме того, используется как пищевая добавка .
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |
Размещено 4 года назад по предмету
Химия
от ПиФаГоР1997
составьте формулу вещества сульфат алюминия
-
Ответ на вопрос
Ответ на вопрос дан
Юлe4каформула вещества во вложении)))
-
Ответ на вопрос
Ответ на вопрос дан
sweetlana1сульфат алюминия — Al2(SO4)3
Не тот ответ на вопрос, который вам нужен?
Найди верный ответ
Самые новые вопросы
Математика — 3 года назад
Сколько здесь прямоугольников
История — 3 года назад
Какое управление было в древнейшем риме? как звали первого и последнего из царей рима?
Литература — 3 года назад
Уроки французского ответе на вопрос : расскажите о герое по следующему примерному плану: 1.почему мальчик оказался в райцентре ? 2.как он чувствовал себя на новом месте? 3.почему он не убежал в деревню? 4.какие отношения сложились у него с товарищами? 5.почему он ввязался в игру за деньги? 6.как характеризуют его отношения с учительницей ? ответе на эти вопросы пожалуйста ! сочините сочинение пожалуйста
Русский язык — 3 года назад
Помогите решить тест по русскому языку тест по русскому языку «местоимение. разряды местоимений» для 6 класса
1. укажите личное местоимение:
1) некто
2) вас
3) ни с кем
4) собой
2. укажите относительное местоимение:
1) кто-либо
2) некоторый
3) кто
4) нам
3. укажите вопросительное местоимение:
1) кем-нибудь
2) кем
3) себе
4) никакой
4. укажите определительное местоимение:
1) наш
2) который
3) некий
4) каждый
5. укажите возвратное местоимение:
1) свой
2) чей
3) сам
4) себя
6. найдите указательное местоимение:
1) твой
2) какой
3) тот
4) их
7. найдите притяжательное местоимение:
1) самый
2) моего
3) иной
4) ничей
8. укажите неопределённое местоимение:
1) весь
2) какой-нибудь
3) любой
4) этот
9. укажите вопросительное местоимение:
1) сколько
2) кое-что
3) она
4) нами
10. в каком варианте ответа выделенное слово является притяжательным местоимением?
1) увидел их
2) её нет дома
3) её тетрадь
4) их не спросили
Русский язык — 3 года назад
Переделай союзное предложение в предложение с бессоюзной связью.
1. океан с гулом ходил за стеной чёрными горами, и вьюга крепко свистала в отяжелевших снастях, а пароход весь дрожал.
2. множество темноватых тучек, с неясно обрисованными краями, расползались по бледно-голубому небу, а довольно крепкий ветер мчался сухой непрерывной струёй, не разгоняя зноя
3. поезд ушёл быстро, и его огни скоро исчезли, а через минуту уже не было слышно шума
Русский язык — 3 года назад
помогите прошу!перепиши предложения, расставляя недостающие знаки препинания. объясни, что соединяет союз и. если в предложении один союз и, то во втором выпадающем списке отметь «прочерк».пример:«я шёл пешком и,/поражённый прелестью природы/, часто останавливался».союз и соединяет однородные члены.ночь уже ложилась на горы (1) и туман сырой (2) и холодный начал бродить по ущельям.союз и соединяет:1) части сложного предложенияоднородные члены,2) однородные членычасти сложного предложения—.поэт — трубач зовущий войско в битву (1) и прежде всех идущий в битву сам (ю. янонис).союз и соединяет:1) части сложного предложенияоднородные члены,2)
Физика — 3 года назад
Вокруг прямого проводника с током (смотри рисунок) существует магнитное поле. определи направление линий этого магнитного поля в точках a и b.обрати внимание, что точки a и b находятся с разных сторон от проводника (точка a — снизу, а точка b — сверху). рисунок ниже выбери и отметь правильный ответ среди предложенных.1. в точке a — «от нас», в точке b — «к нам» 2. в точке a — «к нам», в точке b — «от нас» 3. в обеих точках «от нас»4. в обеих точках «к нам»контрольная работа по физике.прошу,не наугад важно
Информация
Посетители, находящиеся в группе Гости, не могут оставлять комментарии к данной публикации.
Что ты хочешь узнать?
Задай вопрос
Все науки
Русский яз.
Литература
Математика
Алгебра
Геометрия
Английский яз.
Немецкий яз.
Українська мова
Українська література
Беларуская мова
Қазақ тiлi
Французский яз.
Кыргыз тили
Оʻzbek tili
Биология
Химия
Физика
История
Окружающий мир
Обществознание
ОБЖ
География
Информатика
Экономика
Музыка
Право
МХК
Психология
Астрономия
Физкультура и спорт
Другие предметы
Сайт znanija.org не имеет отношения к другим сайтам и не является официальным сайтом компании.
- Сайт
- Главная страница
- Напиши свой вопрос
- Кабинет
- Вход в личный кабинет
- Регистрация на сайте
Содержание
- Физические свойства
- Химические свойства
- Получение
- Применение
Сульфат алюминия — сложное неорганическое соединение, соль алюминия и серной кислоты с химической формулой Al2(SO4)3. Выглядит как бесцветные кристаллы, может образовывать кристаллогидраты с различным содержанием воды. Применяется при очистке воды, крашении тканей, дублении кож, как реактив в фотографии, для получения квасцов.
| Сульфат алюминия | |
|---|---|
| Общие | |
| Традиционные названия | сернокислый алюминий |
| Хим. формула | Al2O12S3 |
| Рац. формула | Al2(SO4)3 |
| Физические свойства | |
| Состояние | твердое |
| Молярная масса | 342,15 г/моль |
| Плотность |
2,710 г/см3 (безв.) 1,690 г/см3 (18-водн.) |
| Термические свойства | |
| Температура | |
| • плавления | 700 °C |
| • кипения | 1600 °C |
| • разложения | 580 °C |
| Классификация | |
| Рег. номер CAS | 10043-01-3 |
| PubChem | 24850 |
| Рег. номер EINECS | 233-135-0 |
| SMILES |
O=S1(=O)O[Al]2OS(=O)(=O)O[Al](O1)OS(=O)(=O)O2 |
| InChI |
1S/2Al.3H2O4S/c;;3*1-5(2,3)4/h;;3*(H2,1,2,3,4)/q2*+3;;;/p-6 DIZPMCHEQGEION-UHFFFAOYSA-H |
| Кодекс Алиментариус | E520 |
| RTECS | BD1700000 |
| ChEBI | 74768 |
| ChemSpider | 23233 |
| Безопасность | |
| Токсичность | малотоксично |
| NFPA 704 |
Физические свойства
Бесцветные кристаллы, пластинки или порошок. Имеет орторомбическую решетку. Плотность — 2,710 г/см3, удельная теплоёмкость при постоянном давлении — 259,6 Дж/(моль К). Плохо растворим в спиртах, хорошо растворим в воде, гигроскопичен. Устойчив при обычной температуре.
Образует кристаллогидрат с формулой Al2(SO4)3·18H2O, выглядящий как бесцветные кристаллы, плавящиеся при 86,5 °C (с разложением) и с плотностью 1,690 г/см3. При длительном хранении 18-водный кристаллогидрат может частично выветриваться до содержания 14—14,5 молекул воды. 18-водный кристаллогидрат теряет воду при нагревании, образуя формы:
- 150 °C — Al2(SO4)3·14 H2O,
- 160 °C — Al2(SO4)3·10 H2O,
- 250 °C — Al2(SO4)3·3 H2O,
- 420 °C — полностью безводную.
Химические свойства
Сульфат алюминия разлагается при температуре выше 580 °C на γ-модификацию окиси алюминия и серный ангидрид:
Задубливает желатиновые фотослои, что используется в производстве фотографических материалов для повышения механической прочности слоев фотоэмульсии, а в цветной фотографии также для предохранения красителей от гидролитического распада. Механизм дубления обусловлен связыванием ионами алюминия ионизированных карбоксильных групп желатины.
Получение
Сульфат алюминия получают взаимодействием гидроксида алюминия с серной кислотой:
Также сульфат алюминия получают взаимодействием алюминия с серной кислотой:
Применение
Сульфат алюминия применяется как коагулянт для очистки воды хозяйственно-питьевого и промышленного назначения и используется в бумажной, текстильной, кожевенной и других отраслях промышленности.
Используется в качестве пищевой добавки E-520.
В фотографии входит в составы стабилизирующих растворов и дубящих фиксажей.
Сульфат алюминия, характеристика, свойства и получение, химические реакции.
Сульфат алюминия – неорганическое вещество, имеет химическую формулу Al2(SO4)3.
Краткая характеристика сульфата алюминия
Физические свойства сульфата алюминия
Получение сульфата алюминия
Химические свойства сульфата алюминия
Химические реакции сульфата алюминия
Применение и использование сульфата алюминия
Краткая характеристика сульфата алюминия:
Сульфат алюминия – неорганическое вещество белого цвета.
Химическая формула сульфата алюминия Al2(SO4)3.
Сульфат алюминия – неорганическое химическое соединение, соль серной кислоты и алюминия.
Хорошо растворяется в воде, этиленгликоле. Плохо растворим в этаноле.
С водой сульфат алюминия образует кристаллогидраты с различным содержанием воды Al2(SO4)3·nH2O, где n может быть вплоть до 18. Наиболее распространенными являются гексадекагидрат Al2(SO4)3·16H2O и октадекагидрат Al2(SO4)3·18H2O.
Устойчив при обычной температуре.
Гигроскопичен.
Сульфат алюминия пожаро- и взрывобезопасен. По степени воздействия на организм продукт относится к веществам 3-го класса опасности в соответствии с ГОСТ 12.1.005.
В земной коре сульфат алюминия находится как в свободном чистом состоянии, в форме кристаллогидратов, а также в составе двойных солей.
Сульфат алюминия в чистом состоянии распространён в природе в виде минерала миллозевичита. В форме кристаллогидратов сульфат алюминия встречается в природе в виде минерала алуногена Al2(SO4)3·17H2O.
Двойные соли сульфат алюминия образует с сульфатами ряда металлов, к которым, к примеру, относится и природный минерал алунит K2SO4·Al2(SO4)3·Al(OH)3.
В пищевой промышленности сульфат алюминия используется в виде добавки Е520.
Физические свойства сульфата алюминия:
| Наименование параметра: | Значение: |
| Химическая формула | Al2(SO4)3 |
| Синонимы и названия иностранном языке | aluminium sulphate (aluminum sulfate (англ.)
алюминий сернокислый (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные гексагональные кристаллы |
| Цвет | белый, бесцветный |
| Вкус | сладковато-терпкий |
| Запах | без запаха |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 2710 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 2,710 |
| Температура разложения, °C | 770 |
| Температура плавления, °C | 770 |
| Молярная масса, г/моль | 342,15 |
| Гигроскопичность | гигроскопичен |
| Растворимость в воде (25 oС), г/100 г | 38,5 |
Получение сульфата алюминия:
В промышленности сульфат алюминия получается взаимодействием гидроксида алюминия с серной кислотой.
В лаборатории сульфат алюминия получают в результате следующих химических реакций:
- 1. взаимодействия сульфата меди и алюминия:
3CuSO4 + 2Al → 3Cu + Al2(SO4)3.
- 2. взаимодействия оксида алюминия и гидросульфата калия:
Al2O3 + 6KHSO4 → Al2(SO4)3 + 3K2SO4 + 3H2O (t = 400-550 °C).
Химические свойства сульфата алюминия. Химические реакции сульфата алюминия:
Химические свойства сульфата алюминия аналогичны свойствам сульфатов других металлов. Однако, сульфат алюминия не реагирует с кислотами. Поэтому для него характерны следующие химические реакции:
1. реакция взаимодействия сульфата алюминия и гидроксида натрия:
Al2(SO4)3 + 6NaOH → 2Al(OH)3 + 3Na2SO4.
В результате реакции образуются гидроксид алюминия и сульфат натрия.
2. реакция взаимодействия сульфата алюминия и гидроксида калия:
Al2(SO4)3 + 6KOH → 2Al(OH)3 + 3K2SO4.
В результате реакции образуются гидроксид алюминия и сульфат калия.
3. реакция взаимодействия сульфата алюминия и гидроксида лития:
Al2(SO4)3 + 6LiOH → 2Al(OH)3 + 3Li2SO4.
В результате реакции образуются гидроксид алюминия и сульфат лития.
4. реакция взаимодействия сульфата алюминия и нитрата бария:
Al2(SO4)3 + 3Ba(NO3)2 → 3BaSO4 + 2Al(NO3)3.
В результате реакции образуются сульфат бария и нитрат алюминия.
5. реакция взаимодействия сульфата алюминия и нитрата свинца:
Al2(SO4)3 + 3Pb(NO3)2 → 3PbSO4 + 2Al(NO3)3.
В результате реакции образуются сульфат свинца и нитрат алюминия.
6. реакция взаимодействия сульфата алюминия и фосфата натрия:
2Na3PO4 + Al2(SO4)3 → 2AlPO4 + 3Na2SO4.
В результате реакции образуются фосфат алюминия и сульфат натрия.
7. реакция взаимодействия сульфата алюминия и фосфата калия:
2K3PO4 + Al2(SO4)3 → 2AlPO4 + 3K2SO4.
В результате реакции образуются фосфат алюминия и сульфат калия.
8. реакция взаимодействия сульфата алюминия и гидрокарбоната натрия:
Al2(SO4)3 + 6NaHCO3 → 3Na2SO4 + 2Al(OH)3 + 6CO2.
В результате реакции образуются сульфат натрия, гидроксид алюминия и оксид углерода (IV).
9. реакция взаимодействия сульфата алюминия и гидрокарбоната кальция:
3Ca(HCO3)2 + Al2(SO4)3 → 2Al(OH)3 + 3CaSO4 + 6CO2.
В результате реакции образуются сульфат кальция, гидроксид алюминия и оксид углерода (IV). Данная реакция используется для очистки воды. Гидроксид алюминия выпадает в осадок и его хлопья увлекают за собой различные примеси.
10. реакция взаимодействия сульфата алюминия и карбоната натрия и воды:
Al2(SO4)3 + 3Na2CO3 + 3H2O → 2Al(OH)3 + 3CO2 + 3Na2SO4.
В результате реакции образуются сульфат натрия, гидроксид алюминия и оксид углерода (IV).
11. реакция термического разложения сульфата алюминия:
2Al2(SO4)3 → 2Al2O3 + 6SO2 + 3O2 (t = 770-860°C).
В результате реакции образуются оксид алюминия, оксид серы (IV) и кислород.
12. реакция термического разложения октадекагидрата сульфата алюминия:
Al2(SO4)3•18H2O → Al2(SO4)3 + 18H2O (t = 420 °C).
Октодекагидрат сульфата алюминия разлагается на сульфат алюминия и воду.
Применение и использование сульфата алюминия:
Сульфат алюминия используется во множестве отраслей промышленности и для бытовых нужд:
– как коагулянт для очистки воды хозяйственно-питьевого и промышленного назначения;
– в фотографии входит в составы стабилизирующих растворов и дубящих фиксажей;
– как пищевая добавка Е520;
– в качестве морилки при крашении и печати текстильных изделий;
– в бумажной, текстильной, кожевенной и других отраслях промышленности.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
сульфат алюминия реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие сульфата алюминия
реакции
Коэффициент востребованности
5 290





