Помогите с лабораторкой
Распознавание сульфид- и сульфит-ионов в растворе
1. В пробирку с раствором сульфида натрия добавьте несколько капель нитрата меди(II) или нитрата свинца(II).
2. В пробирку с раствором сульфита натрия добавьте 1 мл раствора серной кислоты.
Задания. 1. Отметьте признаки проведенных вами химических реакций. 2. Составьте уравнения реакций в молекулярном, ионном и сокращенном ионном виде.
а) Осаждение
катионами кадмия.
Растворы солей
кадмия осаждают сульфид-анион в виде
желтого осадка сульфида кадмия
,
растворимого в концентрированной
соляной кислоте:
;
.
К 1 — 2 каплям раствора
соли, содержащей S2–,
добавьте 1 каплю раствора соли кадмия.
Отметьте цвет образовавшегося осадка.
Напишите уравнение реакции.
б) Осаждение
катионами цинка.
Растворы
солей цинка осаждают сульфид-анион в
виде белого осадка сульфида цинка
,
растворимого в сильных кислотах и
щелочах:
.
Опыт проведите
аналогично предыдущему.
Азот
В природных водах
азот встречается, как правило, в виде
ионов
,
и
.
Соединения азота в больших количествах
попадают в воду, в том числе питьевую,
в основном при нарушении агрохимических
приемов работы.
Опыт 2. Обнаружение иона аммония
Для обнаружения
в воде катиона аммония используют
реактив Несслера, т.е. смесь
и
,
который образует скрасно-бурый осадок иодида
оксодимеркураммония:
.
Реакция чрезвычайно
чувствительна и показывает присутствие
даже случайных примесей солей аммония.
К 1 — 2 каплям
раствора, содержащего соли аммония,
добавьте 4 — 6 капель реактива Несслера.
Отметьте цвет образовавшегося осадка.
Из-за присутствия следов аммиака или
солей аммония в воде осадок не выпадает,
но раствор окрашивается в желтый или
оранжевый цвет. Напишите полное уравнение
химической реакции.
Опыт 3. Определение нитрит-иона no2‾
а) Реакция с
иодидом калия
.
В слабокислой
среде нитриты окисляют анион
до свободного иода:
.
К 2 — 3 каплям
раствора, содержащего нитрит-ион,
добавьте 2 — 3 капли 2 н раствора серной
кислоты, 2 — 3 капли иодида калия и 1 — 2
капли бензола или крахмала. Бензол,
экстрагируя образовавшийся иод,
окрашивается в фиолетовый цвет, а крахмал
дает с иодом синее окрашивание.
б) Окисление
перманганатом калия
.
Перманганат калия
в кислой среде окисляет нитрит-ион до
нитрат-иона:
.
К 2 — 3 каплям раствора
перманганата калия добавьте 2 — 3 капли
2 н раствора серной кислоты и 5 — 6 капель
раствора, содержащего нитрит-ион.
Обесцвечивание раствора указывает на
наличие в воде иона
.
Однако аналогичные реакции и обесцвечивание
раствора будут иметь место и в присутствии
других восстановителей (S2–,
и др.), так что перед анализом на нитрит-ион
убедитесь в отсутствии в анализируемом
растворе других восстановителей.
в) Определение
дифениламином
.
Дифениламин в
присутствии иона
окрашивается в интенсивно-синий цвет.
Аналогичная окраска возникает при
действии на дифениламин сильных
окислителей, таких как,
,
и др.
На тщательно
вымытое и досуха вытертое часовое стекло
поместите 1 каплю раствора дифениламина
в концентрированной серной кислоте.
Рядом нанесите 1 каплю анализируемого
раствора. Осторожно перемешайте обе
капли чистой стеклянной палочкой.
Образование интенсивно-синей окраски
свидетельствует о наличии в растворе
ионов
или
.
Опыт 4. Обнаружение нитрат-иона no3‾
а) Осаждение
хлоридом марганца
.
Исследуемый раствор
при нагревании с двойным объемом
насыщенного хлорида марганца
в концентрированной соляной кислоте
становится темно-бурым вследствие
образования комплексных ионов [MnCl6]2–:
3MnCl2
+ 12Cl‾ + 2NO2‾
+ 8H+
= 3[MnCl6]2–
+ 2NO ↑ + 4H2O.
Проведите опыт
(под тягой!) и запишите результаты.
б) Определение
дифениламином
.
На тщательно
вымытое и досуха вытертое часовое стекло
поместите 1 каплю раствора дифениламина
в концентрированной серной кислоте.
Рядом нанесите 1 каплю анализируемого
раствора. Осторожно перемешайте обе
капли чистой стеклянной палочкой.
Образование интенсивно-синей окраски
свидетельствует о наличии в растворе
ионов
или
.
Фтор
Фтор может
присутствовать в природных водах в виде
бесцветного аниона
,
токсичность которого оценивается между
средней и низкой. Попадая в организм,
фтор отлагается в костях. Избыток его
в питьевой воде вызывает повреждение
эмали на зубах. Большие дозы подавляют
образование коллагена.
Источниками
поступления фтора в окружающую среду
являются заводы по производству алюминия
(в качестве флюса используется криолит
),
а также электронная промышленность
(при производстве интегральных схем в
больших объемах используется плавиковая
кислота).
Предельно допустимая
концентрация аниона фтора в воде
составляет 1,5 мг/л.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
РАСЧЕТ СОДЕРЖАНИЯ РАСТВОРЕННОГО СЕРОВОДОРОДА,
ГИДРОСУЛЬФИД- И СУЛЬФИД-ИОНОВ <1>
———————————
<1> В Российской Федерации применяют ПНД Ф 14.1:2:4.178-02 «Количественный химический анализ вод. Методика выполнения измерений массовой концентрации сульфидов, гидросульфидов и сероводорода в пробах питьевых, природных и сточных вод фотометрическим методом».
При необходимости определения содержания растворенного сероводорода, гидросульфид- и сульфид-ионов раздельно используют приведенные ниже способы расчета исходя из их суммарного содержания в пробе при pH в диапазоне от 5,4 до 10 ед. pH и в интервале температур от 5 °C до 40 °C, а также в диапазоне pH от 10 до 13 ед. pH без учета температуры пробы.
А.1 Графический способ расчета (ориентировочный)
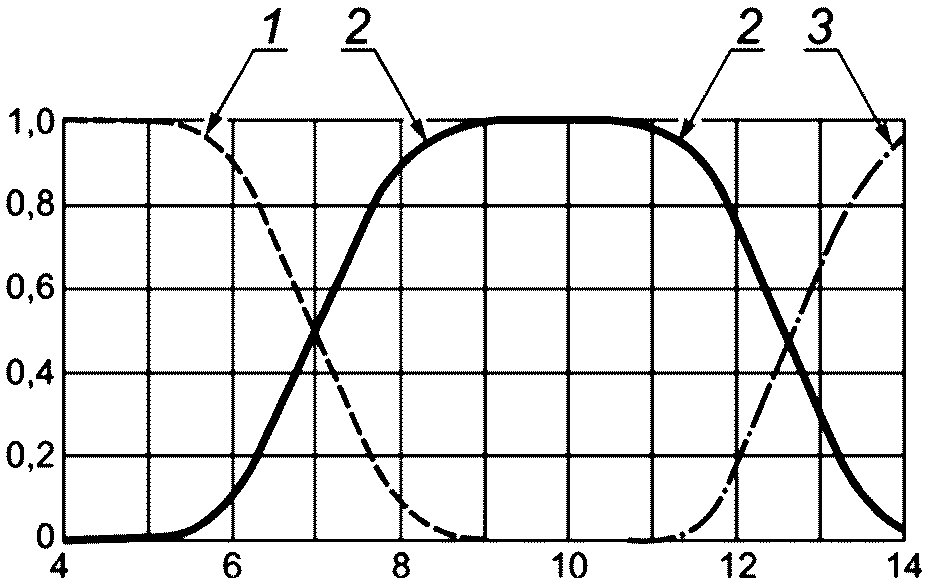
Для графического описания соотношения форм сероводорода используют распределительную диаграмму, приведенную на рисунке А.1, которая описывает состояние равновесной системы H2S — HS— — S2-. Применение данного метода допустимо только для приближенной оценки соотношения форм сероводорода (в мольных долях), т.к. не учитывается влияние температуры.
1 — сероводород; 2 — гидросульфид-ион; 3 — сульфид-ион
Рисунок А.1 — Диаграмма распределения форм сероводорода
(в мольных долях) в зависимости от значения pH
А.2 Расчетный способ
Для расчета ориентировочного количественного содержания форм сероводорода используют таблицу А.1, в которой приведены значения относительного содержания форм сероводорода (%), рассчитанные по константам диссоциации сероводорода, с учетом влияния двух параметров: pH и температуры пробы воды.
Если pH и температура пробы, измеренные на месте отбора, совпадают с данными, приведенными в таблице А.1, то используют табличные данные по относительному содержанию сероводорода, рассчитывают относительное содержание гидросульфидов по формуле (А.4), а расчет массовых концентраций определяемых форм проводят по формулам (А.5) и (А.6).
Если измеренные параметры отличаются от приведенных в таблице А.1, то относительное содержание сероводорода рассчитывают методом линейной интерполяции.
Зная значение pH и температуру воды при отборе пробы, а также используя данные таблицы А.1, выбирают интервалы pH и температуры, в которых находятся измеренные значения. Вычисляют коэффициенты p и q:
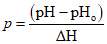
где pH — измеренное значение pH;
pHo — меньшее ближайшее значение pH по таблице А.1 в выбранном интервале;
— разность значений pH в выбранном интервале;
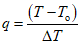
где T — измеренное значение температуры;
To — меньшее ближайшее значение температуры по таблице А.1 в выбранном интервале;
— разность значений температуры (шаг в выбранном интервале 5 °C).
Таблица А.1
Относительное содержание сероводорода
|
pH |
Относительное содержание сероводорода |
||||||
|
5 |
15 |
20 |
25 |
30 |
35 |
40 |
|
|
5,4 |
98,5 |
98,1 |
97,8 |
97,4 |
97,0 |
96,6 |
96,1 |
|
5,6 |
97,4 |
96,7 |
96,2 |
95,6 |
94,9 |
94,2 |
93,4 |
|
5,8 |
96,4 |
95,3 |
94,7 |
93,8 |
92,8 |
91,8 |
90,7 |
|
5,9 |
95,2 |
93,7 |
92,9 |
91,8 |
90,5 |
89,4 |
87,9 |
|
6,0 |
94,0 |
92,2 |
91,2 |
89,8 |
88,2 |
86,8 |
85,2 |
|
6,1 |
92,8 |
90,6 |
89,4 |
87,8 |
86,0 |
84,2 |
82,4 |
|
6,2 |
91,5 |
89,0 |
87,6 |
85,8 |
83,7 |
81,7 |
79,6 |
|
6,3 |
88,9 |
85,8 |
84,2 |
82,0 |
79,6 |
77,3 |
74,9 |
|
6,4 |
86,2 |
82,7 |
80,7 |
78,2 |
75,4 |
72,8 |
70,2 |
|
6,5 |
83,6 |
79,6 |
77,2 |
74,4 |
71,2 |
68,4 |
65,5 |
|
6,6 |
81,0 |
76,4 |
73,8 |
70,6 |
67,1 |
64,0 |
60,8 |
|
6,7 |
77,0 |
71,8 |
68,9 |
65,4 |
61,7 |
58,4 |
55,1 |
|
6,8 |
72,9 |
67,1 |
64,0 |
60,2 |
56,3 |
52,9 |
49,4 |
|
6,9 |
67,9 |
61,7 |
58,4 |
54,5 |
50,6 |
47,2 |
43,8 |
|
7,0 |
62,9 |
56,3 |
52,9 |
48,8 |
44,8 |
41,5 |
38,1 |
|
7,1 |
57,3 |
50,6 |
47,2 |
43,2 |
39,4 |
36,2 |
33,0 |
|
7,2 |
51,7 |
44,8 |
41,5 |
37,6 |
33,9 |
30,9 |
28,0 |
|
7,3 |
46,2 |
39,7 |
36,6 |
33,0 |
29,7 |
27,0 |
24,4 |
|
7,4 |
40,8 |
34,6 |
31,8 |
28,4 |
25,4 |
23,0 |
20,7 |
|
7,5 |
35,4 |
29,5 |
26,9 |
23,9 |
21,2 |
19,0 |
17,0 |
|
7,6 |
29,9 |
24,4 |
22,0 |
19,3 |
17,0 |
15,1 |
13,4 |
|
7,7 |
26,0 |
21,2 |
19,0 |
16,6 |
14,6 |
13,0 |
11,5 |
|
7,8 |
22,2 |
17,9 |
16,0 |
14,0 |
12,2 |
10,8 |
9,6 |
|
7,9 |
18,4 |
14,6 |
13,1 |
11,4 |
9,9 |
8,7 |
7,7 |
|
8,0 |
14,5 |
11,4 |
10,1 |
8,7 |
7,5 |
6,6 |
5,8 |
|
8,1 |
12,4 |
8,8 |
8,6 |
7,4 |
6,4 |
5,6 |
5,0 |
|
8,2 |
10,4 |
7,2 |
7,2 |
6,2 |
5,3 |
4,6 |
4,1 |
|
8,3 |
8,4 |
6,5 |
5,8 |
5,0 |
4,2 |
3,7 |
3,2 |
|
8,4 |
6,3 |
4,9 |
4,3 |
3,7 |
3,1 |
2,7 |
2,4 |
|
8,5 |
5,4 |
4,2 |
3,6 |
3,2 |
2,6 |
2,3 |
2,0 |
|
8,6 |
4,4 |
3,4 |
3,0 |
2,6 |
2,2 |
1,9 |
1,7 |
|
8,7 |
3,5 |
2,7 |
2,4 |
2,0 |
1,8 |
1,5 |
1,4 |
|
8,8 |
2,6 |
2,0 |
1,7 |
1,5 |
1,3 |
1,1 |
1,0 |
|
9,0 |
1,8 |
1,4 |
1,2 |
1,0 |
0,9 |
0,8 |
0,7 |
|
9,2 |
1,1 |
0,8 |
0,7 |
0,6 |
0,5 |
0,4 |
0,4 |
|
9,6 |
0,6 |
0,4 |
0,4 |
0,4 |
0,3 |
0,2 |
0,2 |
|
10,0 |
0,2 |
0,1 |
0,1 |
0,1 |
0,1 |
0,1 |
0,1 |
|
Примечание — В настоящей таблице приведены данные для минерализации воды 1 г/дм3. Поскольку влияние минерализации на результаты расчета соотношения форм сероводорода незначительно по сравнению с влиянием pH, данные таблицы могут быть использованы и при расчете относительного содержания сероводорода для проб воды с меньшей минерализацией. |
———————————
<1> В Российской Федерации применяют ПНД Ф 14.1:2:4.178-02 «Количественный химический анализ вод. Методика выполнения измерений массовой концентрации сульфидов, гидросульфидов и сероводорода в пробах питьевых, природных и сточных вод фотометрическим методом».
Относительное содержание сероводорода , %, вычисляют по формуле
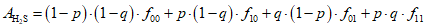
где f00 — относительное содержание сероводорода при pH, соответствующем нижней границе выбранного интервала, и нижней границе интервала температур (таблица А.1), %;
f10 — относительное содержание сероводорода при pH, соответствующем верхней границе выбранного интервала, и нижней границе интервала температур (таблица А.1), %;
f01 — относительное содержание сероводорода при pH, соответствующем нижней границе выбранного интервала, и верхней границе интервала температур (таблица А.1), %;
f11 — относительное содержание сероводорода при pH, соответствующем верхней границе выбранного интервала, и верхней границе интервала температур (таблица А.1), %.
В связи с тем, что содержанием сульфидов при pH < 10 можно пренебречь, относительное содержание гидросульфидов AHS, %, вычисляют по формуле
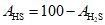
Используя значения относительного содержания сероводорода и гидросульфид-ионов в пробе и их суммарное содержание в мг/дм3, найденное экспериментально, вычисляют массовую концентрацию сероводорода , мг/дм3, и гидросульфид-ионов
, мг/дм3, по формулам
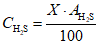
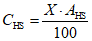
где X — суммарное содержание сероводорода, гидросульфид- и сульфид-ионов, найденное по методике, мг/дм3;
— относительное содержание сероводорода, %;
— относительное содержание гидросульфид-иона, %.
Пример расчета — По результатам измерений суммарное содержание сероводорода, гидросульфид- и сульфид-ионов составляет 1,2 мг/дм3, значение pH при отборе пробы равно 7,55, температура 18 °C.
1 Рассчитывают коэффициенты p и q:
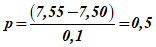
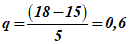
2 По таблице А.1 находят:
f00 = 29,5 (для pH 7,50 и 15 °C);
f10 = 24,4 (для pH 7,60 и 15 °C);
f01 = 26,9 (для pH 7,50 и 20 °C);
f11 = 22,0 (для pH 7,60 и 20 °C).
3 По формуле (А.3) рассчитывают относительное содержание сероводорода в пробе. Оно составит для данной пробы 25,45%.
По формуле (А.4) рассчитывают относительное содержание гидросульфид-иона в пробе — 74,55% соответственно.
4 По формулам (А.5) и (А.6) переводят относительное содержание в абсолютное:
массовая концентрация сероводорода в пробе — 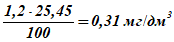
массовая концентрация гидросульфид-ионов — 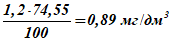
массовая концентрация сульфид-ионов — 0 мг/дм3.
Приложение Б
(обязательное)
Скачать документ целиком в формате PDF
1) По каплям приливать раствор ацетата свинца, до тех пор пока не начнёт образовываться белый осадок (Дробное осаждение):
Pb(2+) + S (2-) = PbS (черный осадок)
2) Отфильтровать надосадочную жидкость
3) К фильтрату прилить избыток растворимой соли кальция:
Ca(2+) + SO4(2-) = CaSO4 (белый)
Ca(2+) + SO3(2-) = CaSO3 (Белый)
4) Разделить осадок и раствор
5) Зафиксировать количество осадка, прилить к нему раствор HCl (избыток, конц)
CaSO3+2HCl=CaCl2+SO2+H2O (часть осадка растворится и выделится газ с характерным запахом)
CaSO4+HCl= реакция не пойдёт, часть осадка не растворится
6) К фильтрату прибавить раствор HCl
S2O3(2-)+2H(+)=S+SO2+H2O Выделится газ с характерным запахом и образуется коллоидный раствор серы
С помощью какого катиона можно распознать сульфид — ион?
Химия | 5 — 9 классы
С помощью какого катиона можно распознать сульфид — ион?
Составьте уравнение реакции в молекулярном и ионном виде.
Помогитеее?
С помощью химических реакций распознайте оксид кальция и цинка.
Составьте Уравнение в кратком ионно — малекулярном виде.
Качественные реакции на ионы?
Качественные реакции на ионы.
Напишите молекулярное полное ионное и сокращенное ионное уравнение.
А) S сульфид ион (Na2S).
1. Сокращенное ионное уравнение реакции, соответствующее молекулярному H2SO4 + 2NaOH = Na2SO4 + 2H2O : А?
1. Сокращенное ионное уравнение реакции, соответствующее молекулярному H2SO4 + 2NaOH = Na2SO4 + 2H2O : А.
2Na( + ) + SO4(2 — ) = Na2SO4 Б.
2OH( — ) + SO3 = SO4(2 — ) + H2O В.
2OH( — ) + SO2 = SO3(2 — ) + H2O Г.
H( + ) + OH( — ) = H2O 2.
Составьте молекулярные и ионные уравнения реакций для следующей схемы превращений : SО3→ Н2SО4 → NаНSО4 ↓ ВаSО4 3.
С помощью какого катиона можно распознать сульфид — ион?
Составьте уравнение реакции в молекулярном и ионном виде.
4. По термохимическому уравнению реакции СН4(г) + 2О2(г) = СО2(г) + 2Н2О + 880 кДж рассчитайте количество теплоты, которое выделится при сгорании 44, 8 г метана СН4 в избытке кислорода.
С помощью какого катиона можно распознать сульфит — ион?
С помощью какого катиона можно распознать сульфит — ион?
Составьте возможное уравнение реакции в молекулярном ионном виде .
Как доказать что соль содержит катион алюминия?
Как доказать что соль содержит катион алюминия?
Составьте соответствующие уравнения реакций в молекулярном и ионном виде.
Написать в молекулярном и ионном виде уравнения реакции обмена между нитратом свинца 2 и сульфидом калия?
Написать в молекулярном и ионном виде уравнения реакции обмена между нитратом свинца 2 и сульфидом калия.
Составьте уравнения химических реакций в молекулярном, полном и сокращенном ионном виде?
Составьте уравнения химических реакций в молекулярном, полном и сокращенном ионном виде.
Сульфид бария + гидроксид меди(2) написать уравнения реакций в молекулярном полном и сокращенном ионном виде?
Сульфид бария + гидроксид меди(2) написать уравнения реакций в молекулярном полном и сокращенном ионном виде.
Составьте реакцию ионного обмена между хлоридом меди 2 и гидроксидом калия в молекулярном виде, запишите полное ионное уравнение и сокращенное ионное уравнения?
Составьте реакцию ионного обмена между хлоридом меди 2 и гидроксидом калия в молекулярном виде, запишите полное ионное уравнение и сокращенное ионное уравнения.
Составьте уравнение реакций в молекулярном, ионном и сокращенном ионном виде?
Составьте уравнение реакций в молекулярном, ионном и сокращенном ионном виде.
Если вам необходимо получить ответ на вопрос С помощью какого катиона можно распознать сульфид — ион?, относящийся к уровню подготовки учащихся 5 — 9 классов, вы открыли нужную страницу. В категории Химия вы также найдете ответы на похожие вопросы по интересующей теме, с помощью автоматического «умного» поиска. Если после ознакомления со всеми вариантами ответа у вас остались сомнения, или полученная информация не полностью освещает тематику, создайте свой вопрос с помощью кнопки, которая находится вверху страницы, или обсудите вопрос с посетителями этой страницы.
22 * 2 = 44 44 — 32 = 12 значит, это СО2, или, проще сказать, углерод.
Потому что элементы соединяясь друг с другом образуют соединения.
P2O5 + 6NaOH→2Na3PO4 + 3H2O H2SO4 + 2NaOH→2H2O + Na2SO4 H2SO4 + Zn→ZnSO4 + H2 H2SO4 + MgCO3→MgSO4 + CO2 + H2O H2SO4 + 2AgNO3→2HNO3 + Ag2SO4 2NaOH + Zn0→Na2ZnO2 + H2 2NaOH + MgCO3→Mg(OH)2 + Na2CO3 2NaOH + 2AgNO3→Ag2O + 2NaNO3 + H2O Zn + 2AgNO3→2Ag + Z..
СвойстваЭтилен(другое название —этен) — химическое соединение, описываемое формулой С2H4. В природе этилен практически не встречается. Это бесцветный горючий газ со слабым запахом. Частичнорастворим в воде(25, 6 мл в 100 мл воды при 0°C), этаноле ..
Жозеф Луи Пруст открыл закон постоянства веществ.
Caco3 + 2hno3 = h20 + c02 + ca(no3)2 n (caco3) = 280 * 0. 1 : 100 = 0. 28 V(co2) = 6. 272дм³.
А)Дано : O2 V = 11, 2 лm — ? N — ? Решение : m = n • M, N = n • NA n = V / Vm = 11, 2 / 22, 4 = 0, 5 моль M(O2) = 16 • 2 = 32 г / моль m = 0, 5 • 32 = 16 г, N = 0, 5 • 6 • 1023 = 3 • 1023молекул Ответ : m(O2) = 16 г, N(O2) = 3 •1023молекул. Б)Дано..
Решение находится на фото.
T = 273 К P = 101325 Па R = 8, 314 Дж / (моль * л) p = 999800 г / м³ PV = m(NH₃)RT / M(NH₃) m(NH₃) = PVM(NH₃) / RT m(H₂O) = Vp w = m(NH₃) / w = PM(NH₃) / w = 101325Па * 17г / мол..
Смотри, пишешь массы веществ, которые должны прореагировать, дальше сокращаешь их пока не получается. В таких долях и надо будет взять вещества, чтобы они прореагировали.
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e2ec8ee6c6197a0 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Лабораторный опыт 5 Химия 9 класс Рудзитис, Фельдман. Распознавание сульфид- и сульфит-ионов в растворе
Помогите с лабораторкой
Распознавание сульфид- и сульфит-ионов в растворе
1. В пробирку с раствором сульфида натрия добавьте несколько капель нитрата меди(II) или нитрата свинца(II).
2. В пробирку с раствором сульфита натрия добавьте 1 мл раствора серной кислоты.
Задания. 1. Отметьте признаки проведенных вами химических реакций. 2. Составьте уравнения реакций в молекулярном, ионном и сокращенном ионном виде.
http://gomolog.ru/reshebniki/9-klass/rudzitis-i-feldman-2019/lab/kachestvennaya-reakciya-na-sulfid-iony.html
http://class.rambler.ru/temy-gdz/laboratornyy-opyt-5-himiya-9-klass-rudzitis-feldman-raspoznavanie-sulfid-i-sulfit-ionov-v-rastvore-8342.htm