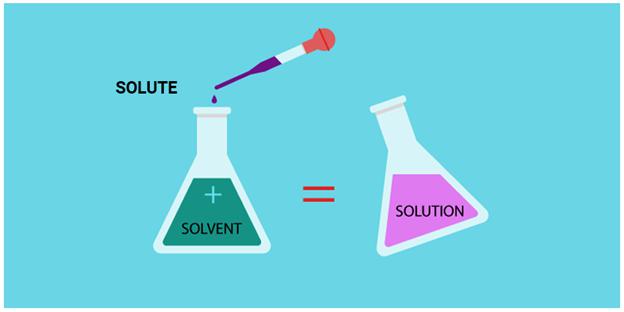
Массовая доля — один из важных параметров, который активно используется для расчетов и не только в химии. Приготовление сиропов и рассолов, расчет внесения удобрений на площадь под ту или иную культуру, приготовление и назначение лекарственных препаратов. Для всех этих расчетов нужна массовая доля. Формула для ее нахождения будет дана ниже.
В химии она рассчитывается:
- для компонента смеси, раствора;
- для составной части соединения (химического элемента);
- для примесей к чистым веществам.
Раствор — это тоже смесь, только гомогенная.
Массовая доля — это отношение массы компонента смеси (вещества) ко всей его массе. Выражают в обычных числах или в процентах.
Формула для нахождения такая:
? = (m (сост. части) · m (смеси, в-ва)) / 100% .
Содержание:
- Нахождение массовой доли химического элемента
- Нахождение массовой доли вещества в смесях и растворах
- Массовая доля примесей
- Видео
Нахождение массовой доли химического элемента
Массовая доля химического элемента в веществе находится по отношению атомной массы химического элемента, умноженной на количество его атомов в этом соединении, к молекулярной массе вещества.
Например, для определения w кислорода (оксигена) в молекуле углекислого газа СО2 вначале найдем молекулярную массу всего соединения. Она составляет 44. В молекуле содержится 2 атома кислорода. Значит w кислорода рассчитываем так:
w(O) = (Ar(O) · 2 ) / Mr(СО2)) х 100%,
w(O) = ((16 · 2) / 44) х 100% = 72,73%.
Аналогичным образом в химии определяют, например, w воды в кристаллогидрате — комплексе соединения с водой. В таком виде в природе находятся многие вещества в минералах.
Например, формула медного купороса CuSO4 · 5H2O. Чтобы определить w воды в этом кристаллогидрате, нужно в уже известную формулу подставить, соответственно, Mr воды (в числитель) и общую m кристаллогидрата (в знаменатель). Mr воды 18, а всего кристаллогидрата — 250.
w( H2O ) = ((18 · 5) / 250 ) · 100% = 36%
Нахождение массовой доли вещества в смесях и растворах
Массовая доля химического соединения в смеси или растворе определяется по той же формуле, только в числителе будет масса вещества в растворе (смеси), а в знаменателе — масса всего раствора (смеси):
? = (m (в-ва) · m (р-ра)) / 100% .
Следует обратить внимание, что массовая концентрация — это отношение массы вещества к массе всего раствора, а не только растворителя.
Например, растворили 10 г поваренной соли в 200 г воды. Нужно найти процентную концентрацию соли в полученном растворе.
Для определения концентрации соли нам нужна m раствора. Она составляет:
m (р-ра) = m (соли) + m (воды) = 10 + 200 = 210 (г).
Находим массовую долю соли в растворе:
? = ( 10 · 210) / 100% = 4,76%
Таким образом, концентрация поваренной соли в растворе составит 4,76%.
Если в условии задачи дается не m, а объем раствора, то его нужно перевести в массу. Делается это обычно через формулу для нахождения плотности:
p = m / V,
где m — масса вещества (раствора, смеси), а V — его объем.
Такую концентрацию используют чаще всего. Именно ее имеют в виду (если нет отдельных указаний), когда пишут о процентном содержании веществ в растворах и смесях.
Массовая доля примесей
В задачах часто дается концентрация примесей в веществе или вещества в его минералах. Следует обратить внимание на то, что концентрация (массовая доля) чистого соединения будет определяться путем вычитания из 100% доли примеси.
Например, если говорится, что из минерала получают железо, а процент примесей 80%, то чистого железа в минерале 100 — 80 = 20%.
Соответственно, если написано, что в минерале содержится только 20% железа, то во все химические реакции и в химическом производстве будут участвовать именно эти 20%.
Например, для реакции с соляной кислотой взяли 200 г природного минерала, в котором содержание цинка 5%. Для определения массы взятого цинка пользуемся той же формулой:
? = (m (в-ва) · m (р-ра)) / 100% ,
из которой находим неизвестную m раствора:
m (Zn) = ( w · 100% ) / m (минер.)
m (Zn) = (5 · 100) / 200 = 10 (г)
То есть, в 200 г взятого для реакции минерала содержится 5% цинка.
Задача. Образец медной руды массой 150 г содержит сульфид меди одновалентной и примеси, массовая доля которых составляет 15%. Вычислите массу сульфида меди в образце.
Решение задачи возможно двумя способами. Первый — это найти по известной концентрации массу примесей и вычесть ее из общей m образца руды. Второй способ — это найти массовую долю чистого сульфида и по ней уже рассчитать его массу. Решим обоими способами.
- I способ
Вначале найдем m примесей в образце руды. Для этого воспользуемся уже известной формулой:
? = ( m (примесей) · m (образца)) / 100% ,
m(примес.) = (w · m (образца)) · 100% , (А)
m(примес.) = (15 · 150) / 100% = 22,5 (г).
Теперь по разности найдем количество сульфида в образце:
150 — 22,5 = 127,5 г
- II способ
Вначале находим w соединения:
100 — 15 = 85%
А теперь по ней, воспользовавшись той же формулой, что и в первом способе (формула А), найдем m сульфида меди:
m(Cu2S) = (w · m (образца)) / 100% ,
m(Cu2S) = (85 · 150) / 100% = 127,5 (г).
Ответ: масса сульфида меди одновалентного в образце составляет 127,5 г.
Видео
Из видео вы узнаете, как правильно производить рассчеты по химическим формулам и как найти массовую долю.
|
Конечно в вопросе нужно было бы уточнить массовую долю чего и в чем, так как есть много вариантов. Попробую описать основные из них. Находим массовую долю какого-либо вещества: Можно так же найти массовую долю раствора — вот как: автор вопроса выбрал этот ответ лучшим Чтобы понять и уметь находить массовую долю чего бы там не было, следует прежде всего вспомнить что такое доля. Доля — это часть от целого и обычно она считается либо в процентах, либо отношением. Например четверть — это четвертая часть целого, это доля. Если же речь идет о массе, то в этом случае четвертая часть уже будет массовой долью. Например мы хотим найти сколько воды в человеке массой 100 килограмм. Зная, что человеческое тело содержит примерно 90% воды, мы находим что воды в человеке 90/100, или 0.9 — это и есть массовая доля воды в человеческом организме. То есть в общем случае мы имеем формулу: Для растворов она примет вид: Я вам расскажу своими словами, так чтобы вы поняли: Массовая доля вещества — это та часть, которую занимает определенной вещество в общей массе. То есть для примера: торт весит 1 килограмм , а крема в нем 0.5 килограмм, то есть массовая доля крема в тортике равна 50%. Это выходя с того, что массовая доля= масса основного вещества/общая масса всего продукта. Это же относится и к химическим растворам и реактивам. Знаете ответ? |
Загрузить PDF
Загрузить PDF
Состав молекулы в массовых процентах — это доля каждого элемента в общей массе молекулы. Массовый процент какого-либо элемента в соединении определяется как отношение массы данного элемента к полной молекулярной массе соединения, умноженное на 100%. Хоть это определение и звучит замысловато, на самом деле определить массовую долю довольно легко!
-
1
Атомы. Материя состоит из атомов, а те, в свою очередь, состоят из протонов, нейтронов и электронов. Атомы — элементарные кирпичики, из которых сложено все, что окружает нас.
-
2
Молекулы. Молекулы — это электрически нейтральные химические соединения двух или большего количества атомов, скрепленных друг с другом химическими связями.
- Например, вода состоит из молекул H2O. Каждая молекула воды включает в себя два атома водорода, соединенных химическими связями с одним атомом кислорода.
-
3
Моли. Моль — это единица измерения количества вещества. Один моль определяется как количество вещества, содержащее 6,02 x10^ 23 элементарных составляющих, и повсеместно используется для выражения количества химических веществ.
- Величина 6,02 x 10^23 примерно равна числу атомов в 12 граммах чистого углерода и называется “числом Авогадро”.
-
4
Химические соединения. Это чистые химические вещества, состоящие из двух или более химических элементов.
- Вода, состоящая из молекул H2O, является химическим веществом.
-
5
Атомная масса. Это масса отдельного атома либо молекулы. Атомная масса выражается в граммах на моль (г/моль).
- Учтите, что атомная масса отличается от атомного веса; она соответствует полной массе частицы (атома или молекулы) в состоянии покоя.
-
6
Молекулярная масса. Это масса отдельной молекулы. Другими словами, это сумма масс всех атомов, входящих в данную молекулу.
- Как и в случае с атомной массой, молекулярная масса отлична от веса молекулы.
Реклама
-
1
Выпишите элементы, входящие в химическое соединение.
- Например, вам необходимо вычислить массовые проценты в лимонной кислоте, имеющей химическую формулу C6H8O7, как показано на рисунке. Молекула кислоты содержит следующие элементы: углерод (C), водород (H) и кислород (O).
-
2
Выпишите атомную массу каждого элемента. Для определения атомных масс используйте периодическую таблицу элементов (таблицу Менделеева). Как правило, атомная масса приведена в этой таблице сразу под символом соответствующего элемента, и выражена в единицах г/моль.
- Для приведенного выше примера находим: атомная масса углерода равна 12,01 г/моль, водорода — 1,00 г/моль, кислорода — 15,99 г/моль.
-
3
Найдите массовый вклад каждого элемента, входящего в соединение. Массовый вклад отдельного соединения равен атомной массе данного элемента, умноженной на количество его атомов в молекуле соединения. Количество атомов каждого элемента в молекуле обозначается числом в подписи, стоящим после символа соответствующего элемента.
- В нашем примере отметим, что молекула лимонной кислоты состоит из 6 атомов углерода, 8 атомов водорода и 7 атомов кислорода. Таким образом, мы можем вычислить массовый вклад каждого элемента, см. рисунок.
Массовый вклад углерода: 6 x 12,01 г/моль = 72,06 г/моль
Массовый вклад водорода: 8 x 1,00 г/моль = 8,00 г/моль
Массовый вклад кислорода: 7 x 15,99 г/моль = 111,93 г/моль
- В нашем примере отметим, что молекула лимонной кислоты состоит из 6 атомов углерода, 8 атомов водорода и 7 атомов кислорода. Таким образом, мы можем вычислить массовый вклад каждого элемента, см. рисунок.
-
4
Вычислите общую молекулярную массу вашего соединения. Общая молекулярная масса равна сумме массовых вкладов каждого элемента, и соответствует массе одной молекулы соединения.
- В нашем примере молекулярная масса рассчитывается так:
Молекулярная масса C6H8O7 = 72,06 г/моль + 8,00 г/моль + 111,93 г/моль = 191,99 г/моль
- В нашем примере молекулярная масса рассчитывается так:
-
5
Найдите массовый состав в процентах. Массовая доля элемента в процентах вычисляется как отношение массового вклада данного элемента к общей молекулярной массе соединения, умноженное на 100%.
- В нашем примере массовые проценты каждого элемента рассчитываются так, как показано на рисунке. Таким образом, C6H8O7 состоит из 37,53% углерода, 4,16% водорода и 58,29% кислорода.
Реклама
Советы
- Вы можете проверить правильность своих вычислений, сложив массовые проценты всех элементов — в сумме должно получиться 100%. Однако помните, что вы не всегда можете получить точно 100%, поскольку массовый вклад каждого элемента был округлен до второго знака после запятой.
Реклама
Об этой статье
Эту страницу просматривали 12 950 раз.
Была ли эта статья полезной?
Что такое массовая доля в химии? Знаете ли вы ответ? Как находить массовую долю элемента в веществе? Сам процесс вычисления вовсе не так сложен. А вы еще испытываете затруднения в подобных задачах? Тогда вам улыбнулась удача, вы нашли эту статью! Интересно? Тогда скорее читайте, сейчас вы все поймете.
Что такое массовая доля?
Итак, для начала выясним, что такое массовая доля. Как находить массовую долю элемента в веществе, ответит любой химик, так как они часто употребляют этот термин при решении задач или во время пребывания в лаборатории. Конечно, ведь ее расчет — их повседневная задача. Чтобы получить определенное количество того или иного вещества в лабораторных условиях, где очень важен точный расчет и все возможные варианты исхода реакций, необходимо знать всего пару простых формул и понимать суть массовой доли. Поэтому эта тема так важна.
Этот термин обозначается символом “w” и читается как “омега”. Он выражает отношение массы данного вещества к общей массе смеси, раствора или молекулы, выражается дробью или в процентах. Формула расчета массовой доли:
w = m вещества / m смеси.
Преобразуем формулу.
Мы знаем, что m=n*M, где m — масса; n — количество вещества, выраженное в единицах измерения моль; M — молярная масса вещества, выраженная в грамм/моль. Молярная масса численно равна молекулярной. Только молекулярная масса измеряется в атомных единицах масс или а. е. м. Такая единица измерения равна одной двенадцатой доле массы ядра углерода 12. Значение молекулярной массы можно найти в таблице Менделеева.
Количество вещества n нужного объекта в данной смеси, равно индексу, умноженному на коэффициент при данном соединении, что очень логично. Например, чтобы рассчитать количество атомов в молекуле, надо узнать, сколько атомов нужного вещества находится в 1 молекуле = индекс, и умножить это число на количество молекул = коэффициент.
Не стоит бояться таких громоздких определений или формул, в них прослеживается определенная логика, поняв которую, можно даже сами формулы не учить. Молярная масса M равна сумме атомных масс Ar данного вещества. Напомним, что атомная масса — масса 1 атома вещества. То есть исходная формула массовой доли:
w = ( n вещества*M вещества)/m смеси.
Из этого можно сделать вывод, что если смесь состоит из одного вещества, массовую долю которого надо вычислить, то w=1, так как масса смеси и масса вещества совпадают. Хотя смесь априори не может состоять из одного вещества.
Так, с теорией разобрались, но как находить массовую долю элемента в веществе на практике? Сейчас все покажем и расскажем.
Проверка усвоенного материала. Задача легкого уровня
Сейчас мы разберем две задачи: легкого и среднего уровня. Читайте далее!
Необходимо узнать массовую долю железа в молекуле железного купороса FeSO4*7 H2O. Как решить эту задачу? Рассмотрим решение далее.
Решение:
Возьмем 1 моль FeSO4*7 H2O, тогда узнаем количество железа, умножив коэффициент железа на его индекс: 1*1=1. Дан 1 моль железа. Узнаем его массу в веществе: из значения в таблице Менделеева видно, что атомная масса железа 56 а. е. м. = 56 грамм/моль. В данном случае Ar=M. Следовательно, что m железа = n*M = 1 моль* 56 грамм/моль = 56 г.
Теперь нужно найти массу всей молекулы. Она равна сумме масс исходных веществ, то есть 7 моль воды и 1 моль сульфата железа.
m= (n воды* M воды) + (n сульфата железа*M сульфата железа) = (7 моль*(1*2+16) грамм/моль) + (1 моль* (1 моль*56 грамм/моль+1 моль*32 грамм/моль + 4 моль*16 грамм/моль) = 126+152=278 г.
Остается лишь разделить массу железа на массу соединения:
w=56г/278 г=0.20143885~0.2=20%.
Ответ: 20%.
Задача среднего уровня
Решим более сложную задачу. В 500 г воды растворено 34 г нитрата кальция. Нужно найти массовую долю кислорода в полученном растворе.
Решение
Так как при взаимодействии Ca(NO3)2 с водой идет только процесс растворения, а из раствора не выделяются продукты реакции, масса смеси равна сумме масс нитрата кальция и воды.
Нам нужно найти массовую долю кислорода в растворе. Обратим внимание на то, что кислород содержится как в растворенном веществе, так и в растворителе. Найдем количество искомого элемента в воде. Для этого посчитаем моль воды по формуле n=m/M.
n воды=500 г/(1*2+16) грамм/моль=27.7777≈28 моль
Из формулы воды H2O найдем, что количество кислорода = количеству воды, то есть 28 моль.
Теперь найдем количество кислорода в растворенном Ca(NO3)2. Для этого узнаем количество самого вещества:
n Ca(NO3)2=34 г/(40*1+2*(14+16*3)) грамм/моль≈0.2 моль.
n Ca(NO3)2 относится к n O как 1 к 6, что следует из формулы соединения. Значит, n O = 0.2 моль*6 = 1.2 моль. Суммарно количество кислорода равно 1.2 моль+28 моль=29.2 моль
m O= 29.2 моль*16 грамм/моль=467.2 г.
m раствора=m воды + m Ca(NO3)2= 500 г+34 г=534 г.
Осталось только само вычисление массовой доли химического элемента в веществе:
w O=467.2 г /534 г≈0.87=87%.
Ответ: 87%.
Надеемся, что мы понятно объяснили вам то, как находить массовую долю элемента в веществе. Данная тема вовсе не сложная, если в ней хорошо разобраться. Желаем вам удачи и успехов в будущих начинаниях.
Как найти массовую долю вещества
Людям в зависимости от рода их профессии приходится сталкиваться с растворами, имеющими строго заданное содержание в них растворенного вещества: приготовление лекарственных растворов, растворение проявителя для фотографий, раствор для аккумулятора с содержанием серной кислоты и т.д. Поэтому на уроках химии школьники с помощью задач учатся рассчитывать массовую долю растворенных веществ – отношение массы растворенного вещества к общей массе раствора.
Инструкция
Прочитайте внимательно задачу. Кратко с левой стороны страницы запишите ее данные с использованием буквенных обозначений и формул химических веществ, если они есть. Определите из вопроса задачи, что нужно найти.
Запишите с правой стороны листа общую формулу массовой доли растворенного вещества
ω = m1 / m,
где m1 – масса растворенного вещества, а m – масса всего раствора.
Если содержание массовой доли растворенного вещества нужно узнать в процентах, умножьте полученное число на 100%:
ω = m1 / m х 100%
В задачах, где нужно вычислить массовые доли каждого из элементов, входящих в состав химического вещества, используйте таблицу Д.И. Менделеева. Например, узнайте массовые доли каждого из элементов, входящих в состав углеводорода, формула которого C6H12
m (C6H12) = 6 х 12 + 12 х 1= 84 г/моль
ω (С) = 6 m1(С) / m (C6H12) х 100% = 6 х 12 г / 84 г/моль х 100% = 85%
ω (Н) = 12 m1(Н) / m (C6H12) х 100% = 12 х 1 г / 84 г/моль х 100% = 15%
Полезный совет
Задачи на нахождение массовой доли вещества после упаривания, разбавления, концентрирования, смешивания растворов решайте с помощью формул, полученных из определения массовой доли. Например, задачу на упаривание можно решить с помощью такой формулы
ω 2= m1 / (m – Dm) = (ω 1• m) / (m – Dm), где ω 2 – массовая доля вещества в упаренном растворе, Dm — разница между массами до нагревания и после.
Источники:
- как определить массовую долю вещества
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.