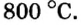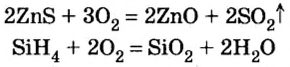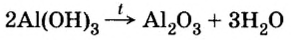Определение железа и алюминия. При анализе силикатов, известняков, некоторых руд и других горных пород эти элементы часто определяют гравимеФрическим методом в смеси с титаном, марганцем и фосфатом как сумму так называемых полуторных оксидов. Обычно после отделения кремниевой кислоты в кислом растворе приводят осаждение сульфидов (меди и других элементов) и в. фильтрате после удаления сероводорода осаждают сумму полуторных оксидов аммиаком в аммиачном буферном растворе. Осадок гидроксидов промывают декантацией и переосаждают, после чего фильтруют, промывают и прокаливают. Прокаленный осадок содержит оксиды ЕегОз, АЬОз, ТЮг, МпОг. Иногда анализ на этом заканчивается, так как бывает достаточным определить только сумму оксидов и не требуется устанавливать содержание каждого компонента. При необходимости более детального анализа прокаленный осадок сплавляют с пиросульфатом калия для перевода оксидов в растворимые сульфаты и после растворения плава определяют в растворе отдельные компоненты — железо титриметрическим или гравиметрическим методом, титан и марганец — фотометрическим и фосфор — гравиметрическим (марганец и фосфор анализируются обычно из отдельной навески). Содержание алюминия рассчитывают по разности. Прямое гравиметрическое определение же- [c.165]
Определение суммы полуторных оксидов [c.170]
Тенденции развития аналитического контроля в химической промышленности те же, что и в других сферах народного хозяйства. Это, конечно, инструментализация анализа, автоматизация экспресс-определений, что достигается использованием физических и физико-химических методов. Широко распространены химические методы, которые пока преобладают, например, в контроле производства минеральных удобрений. Так, в апатитовом концентрате, применяемом для производства фосфорных удобрений, химическими методами определяют основные компоненты — оксиды фосфора (V) и кальция, фтор, воду, сумму полуторных оксидов. В производствах органических веществ очень большое значение имеют методы газовой хроматографии для этой цели используют автоматизированные промышленные хроматографы. В гл. II были приведены данные об использовании этого метода в нефтехимии. [c.154]
Работа 7. Определение суммы полуторных оксидов в производстве фосфорного сырья [c.341]
Определение суммы полуторных оксидов. Фильтрат после отделения кремниевой кислоты объемом — 200 мл нагревают почти до кипения и медленно при размешивании нейтрализуют аммиаком (1 1) до слабощелочной реакции (до слабого запаха). Раствор с осадком отстаивают на кипящей водяной бане 5 мин и после просветления раствора над осадком отфильтровывают гидроксиды через фильтр белая лента . Осадок промывают на фильтре 3—4 раза горячим 2 %-ным раствором хлорида аммония. Фильтрат собирают в мерную колбу вместимостью 500 мл для определения кальция и магния. [c.321]
Выделение и определение суммы полуторных оксидов основано на осаждении последних аммиаком или каким-нибудь органическим основанием. При осаждении необходимо строго регулировать pH раствора созданием соответствующей буферной среды. Осаждение проводят в присутствии индикатора метилового красного (pH 4,4—6,2). Чтобы избежать получения водных оксидо элементов, входящих в группу полуторных оксидов, в коллоидном состоянии осаждение следует вести из горячего, кислого раствора в присутствии достаточного количества электролита (аммониевых солей). Отфильтрованный осадок гидратированных оксидов также очень легко переходит в коллоидное состояние, особенно оксиды алюминия (III) и титана (IV), поэтому промывать осадок необходимо горячим раствором электролита, которым обычно служит раствор аммониевых солей . - [c.170]
Таблица оксидов.
Оксиды: основные оксиды, кислотные оксиды, амфотерные оксиды:
Оксид (именуемые также окисел, окись) – это бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом.
Химический элемент кислород по электроотрицательности находится на втором месте после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. Исключение составляет, например, дифторид кислорода OF2.
В зависимости от химических свойств различают:
— солеобразующие оксиды:
- основные оксиды. К ним относятся оксиды металлов, степень окисления которых +1, + 2;
- кислотные оксиды. К ним относятся оксиды металлов со степенью окисления +5, + 6, + 7, и оксиды неметаллов;
- амфотерные оксиды. К ним относятся оксиды металлов со степенью окисления +3, +4, и оксиды-исключения: ZnO, BeO, SnO, PbO;
— несолеобразующие оксиды: оксид углерода (II) СО, оксид азота (I) N2O, оксид азота (II) NO, оксид кремния (II) SiO и оксид серы (II) SO.
В зависимости от количества атомов элементов в оксиде, кроме кислорода различают:
— простые, включающие в молекулу атомы одного элемента, кроме кислорода, и находящихся в в одной степени окисления. Например, оксид лития Li2O.
— сложные оксиды, включающие в молекулу атомы двух и более элементов, кроме кислорода. Например, оксид лития-кобальта (III) Li2O·Co2O3;
— двойные оксиды, в которые атомы одного и того же элемента входят в двух или более степенях окисления. Например, оксид марганца (II, IV) Mn5O8. Во многих случаях такие оксиды могут рассматриваться как соли кислородсодержащих кислот.
Таблица оксидов (1 часть):
| Атомный номер | Химический элемент | Символ | Оксиды |
| 1 | Водород | H | H2O (вода) |
| 2 | Гелий | He | нет |
| 3 | Литий | Li | Li2O (оксид лития) |
| 4 | Бериллий | Be | BeO (оксид бериллия) |
| 5 | Бор | B | B2O3 (оксид бора (III)) |
| 6 | Углерод | C | CO (оксид углерода (II), монооксид углерода, угарный газ),
CO2 (оксид углерода (IV), диоксид углерода, углекислый газ), C3O2 (диоксид триуглерода), (C3O2)n (политрикарбодиоксид), C5O2 (1,2,3,4-пентатетраен-1,5-дион), C6O6 (диангидрид этилентетракарбоновой кислоты) C12O9 (меллитовый ангидрид), C12O12 (гексагидроксибензол трисоксалат), и др. |
| 7 | Азот | N | N2O (оксид азота (I), закись азота, оксонитрид азота, веселящий газ),
NO (оксид азота (II), мон(о)оксид азота, окись азота, нитрозил-радикал), N2O3 (оксид азота (III), азотистый ангидрид, сесквиоксид азота), NO2 (диоксид азота, оксид азота (IV), двуокись азота), N2O5 (оксид азота (V), пентаоксид азота, пентаоксид диазота, нитрат нитрила, нитрат нитрония, азотный ангидрид), N2O4 (димер диоксида азота, тетраоксид диазота, азотный тетраоксид), и др. |
| 8 | Кислород | O | — |
| 9 | Фтор | F | нет |
| 10 | Неон | Ne | нет |
| 11 | Натрий | Na | Na2O (оксид натрия) |
| 12 | Магний | Mg | MgO (оксид магния) |
| 13 | Алюминий | Al | Al2O3 (оксид алюминия) |
| 14 | Кремний | Si | SiO (оксид кремния (II), монооксид кремния),
SiO2 (оксид кремния (IV), диоксид кремния, кремнезём) |
| 15 | Фосфор | P | P4O (монооксид тетрафосфора),
P4O2 (диоксид тетрафосфора), P2O3 или P4O6 (оксид фосфора (III), фосфористый ангидрид, гексаоксид тетрафосфора), P4O8 (оксид фосфора (IV), октаоксид тетрафосфора), P2O5 или P4O10 (оксид фосфора (V), пентаоксид фосфора, фосфористый ангидрид, гексаоксид тетрафосфора) |
| 16 | Сера | S | SO (оксид серы (II), монооксид серы, моноокись серы),
SO2 (оксид серы (IV), диоксид серы, двуокись серы, сернистый газ, сернистый ангидрид), SO3 (оксид серы (VI), трёхокись серы, серный газ, ангидрид серной кислоты) |
| 17 | Хлор | Cl | Cl2O (оксид хлора (I), гемиоксид хлора, ангидрид хлорноватистой кислоты),
ClO2 (диоксид хлора, оксид хлора (IV), двуокись хлора), ClOClO3 (перхлорат хлора ), Cl2O6 (дихлоргексаоксид, оксид хлора (V, VII), перхлорат хлорила), Cl2O7 (оксид хлора (VII), дихлорогептаоксид, хлорный ангидрид), и др. |
| 18 | Аргон | Ar | нет |
| 19 | Калий | K | K2O (оксид калия) |
| 20 | Кальций | Ca | CaO (оксид кальция, окись кальция, негашёная известь, в просторечии — кирабит, кипелка) |
| 21 | Скандий | Sc | Sc2O3 (оксид скандия, сесквиоксид скандия) |
| 22 | Титан | Ti | TiO (оксид титана (II)),
Ti2O3 (оксид титана(III), трёхокись титана), TiO2 (оксид титана (IV), диоксид титана, двуокись титана, титановые белила) |
| 23 | Ванадий | V | VO (оксид ванадия (II), окись ванадия),
V2O3 (оксид ванадия (III), трехокись ванадия), VO2 (оксид ванадия (IV), диоксид ванадия, двуокись ванадия), V2O5 (оксид ванадия (V), пентаоксид диванадия) |
| 24 | Хром | Cr | CrO (оксид хрома (II), закись хрома),
Cr2O3 (оксид хрoма (III), сесквиоксид хрома, хромовая зелень, эсколаит), CrO2 (оксид хрома (IV), диоксид хрома, двуокись хрома), CrO3 (оксид хрома (VI), триоксид хрома, трёхокись хрома, хромовый ангидрид) |
| 25 | Марганец | Mn | MnO (оксид марганца (II), окись марганца, монооксид марганца),
Mn3O4 (оксид марганца (II,III), окисел марганца), Mn5O8 (оксид марганца (II,IV), окисел марганца), Mn2O3 (оксид марганца (III), окисел марганца), MnO2 (оксид марганца (IV), диоксид марганца), MnO3 (оксид марганца (VI), окисел марганца), Mn2O7 (оксид марганца (VII)) |
| 26 | Железо | Fe | FeO (оксид железа (II), закись железа),
Fe2O3 (оксид железа (III), окись железа, колькотар, крокус, железный сурик, гематит), Fe3O4 (оксид железа (II,III), закись-окись железа, железная окалина, магнетит, магнитный железняк), и др. |
| 27 | Кобальт | Co | CoO (оксид кобальта (II), окись кобальта),
Co3O4 (оксид кобальта (II,III), окись кобальта), Co2O3 (оксид кобальта (III), окись кобальта), CoO2•H2O (оксид кобальта (IV), гидрат оксида кобальта) |
| 28 | Никель | Ni | NiO (оксид никеля (II), окись никеля, бунзенит),
Ni2O3 (оксид никеля (III), окисел никеля; сесквиоксид никеля) |
| 29 | Медь | Cu | Cu2O (оксид меди (I), гемиоксид меди, оксид димеди, закись меди, куприт),
CuO (оксид меди (II), окись меди), Cu2O3 (оксид меди (III), триоксид димеди) |
| 30 | Цинк | Zn | ZnO (оксид цинка, окись цинка) |
| 31 | Галлий | Ga | Ga2O (оксид галлия (I), закись галлия, гемиоксид галлия),
Ga2O3 (оксид галлия (III)) |
| 32 | Германий | Ge | GeO (оксид германия (II), окись германия),
GeO2 (оксид германия (IV), диоксид германия, двуокись германия) |
| 33 | Мышьяк | As | As2O3 (оксид мышьяка (III), триоксид мышьяка),
As2O5 (оксид мышьяка (V), пентоксид мышьяка) |
| 34 | Селен | Se | SeO2 (оксид селена (IV), диоксид селена, двуокись селена, доунеит, селенолит),
SeO3 (оксид селена (VI), триоксид селена, селеновый ангидрид) |
| 35 | Бром | Br | Br2O (оксид брома, оксид брома (I), окись брома, ангидрид бромноватистой кислоты) |
Таблица оксидов (2 часть):
| 36 | Криптон | Kr | нет |
| 37 | Рубидий | Rb | Rb2O (оксид рубидия, окись рубидия) |
| 38 | Стронций | Sr | SrO (оксид стронция, окись стронция) |
| 39 | Иттрий | Y | Y2O3 (оксид иттрия, сесквиоксид иттрия) |
| 40 | Цирконий | Zr | ZrO2 (оксид циркония (IV), оксид циркония, диоксид циркония) |
| 41 | Ниобий | Nb | NbO (оксид ниобия (II), окись ниобия),
Nb2O3 (оксид ниобия (III), окись ниобия), NbO2 (оксид ниобия (IV), окись ниобия), Nb2O5 (оксид ниобия (V), окись ниобия) |
| 42 | Молибден | Mo | Mo2O3 (оксид молибдена (III), окись молибдена),
MoO2 (оксид молибдена (IV), окись молибдена), Mo2O5 (оксид молибдена (V), окись молибдена), MoO3 (оксид молибдена (VI), триоксид молибдена, триоксомолибден, молибдит) |
| 43 | Технеций | Tc | TcO2 (оксид технеция (IV), окись технеция (IV)),
Tc2O7 (оксид технеция (VII), окись технеция (VII)) |
| 44 | Рутений | Ru | Ru2O3 (оксид рутения (III), окись рутения (III), сесквиоксид рутения),
RuO2 (оксид рутения(IV), окись рутения (IV)), RuO4 (оксид рутения(VIII), тетраоксид рутения) |
| 45 | Родий | Rh | RhO (оксид родия (II), окисел родия),
Rh2O3 (оксид родия (III), сесквиоксид родия), RhO2 (оксид родия (IV), окисел родия) |
| 46 | Палладий | Pd | PdO (оксид палладия (II), окись палладия),
Pd2O3•n H2O (оксид палладия (III), окисел палладия), PdO2 (оксид палладия (IV), окисел палладия) |
| 47 | Серебро | Ag | Ag2O (оксид серебра (I)),
Ag+1Ag+3O2 или Ag2O2 (оксид серебра (I,III), оксид серебра (III)-серебра (I), монооксид серебра, диоксид дисеребра) |
| 48 | Кадмий | Cd | Cd2O (оксид кадмия (I)),
CdO (оксид кадмия (II)) |
| 49 | Индий | In | In2O (оксид индия (I), окись индия (I), гемиоксид индия, закись индия),
InO (оксид индия (II), окись индия (II)), In2O3 (оксид индия (III)) |
| 50 | Олово | Sn | SnO (оксид олова (I), монооксид олова, олово окись (II), олово закись, олово одноокись),
SnO2 (оксид олова (IV), окись олова, двуокись олова, диоксид олова, касситерит), Sn3O4 |
| 51 | Сурьма | Sb | Sb2O3 (оксид сурьмы (III), сесквиоксид сурьмы, сурьмянистый ангидрид),
Sb2O5 (оксид сурьмы (V), пятиокись сурьмы, сурмяный ангидрид), Sb2O4 или SbIIISbVO4 (тетраоксид сурьмы, диоксид сурьмы) |
| 52 | Теллур | Te | TeO2 (оксид теллура (IV), диоксид теллура, теллурит, двуокись теллура, ангидрид теллуристой кислоты),
TeO3 (оксид теллура (VI), триоксид теллура, трёхокись теллура, ангидрид теллуровой кислоты), Te2O5, Te4O9 |
| 53 | Йод | I | I+12O (монооксид дийода),
I+2O (монооксид йода), I+4O2 (диоксид йода), I+3, +52O4 или I+3O(I+5O3) или (I+3, +5O2)2 (тетраоксид дийода, иодноватокислый йод), I+52O5 или O(IO2)2 (оксид йода (V), пентаоксид дийода, иодноватый ангидрид), I+3, +54O9 или I+3(I+5O3)3 или I+3(OI+5O2)3 (иодат йода (III), иодноватокислый йод, нонаоксид тетрайода) |
| 54 | Ксенон | Xe | XeO2 (оксид ксенона (IV), диоксид ксенона),
XeO3 (триоксид ксенона), XeO4 (тетраоксид ксенона) |
| 55 | Цезий | Cs | Cs2O (оксид цезия, окись цезия) |
| 56 | Барий | Ba | BaO (оксид бария, окись бария, безводный барит) |
| 57 | Лантан | La | La2O3 (оксид лантана (III), сесквиоксид лантана) |
| 58 | Церий | Ce | Ce2O3 (оксид церия (III)),
CeO2 (оксид церия (IV), диоксид церия, двуокись церия) |
| 59 | Празеодим | Pr | PrO (оксид празеодима (II), монооксид празеодима),
Pr2O3 (оксид празеодима (III), сесквиоксид празеодима), PrO2 (оксид празеодима (IV), окись празеодима), Pr6O11 (оксид празеодима (III, IV), ундекаоксид гексапразеодима) |
| 60 | Неодим | Nd | NdO (оксид неодима (II), окисел неодима),
Nd2O3 (оксид неодима (III), сесквиоксид неодима) |
| 61 | Прометий | Pm | Pm2O3 (оксид прометия (III), сесквиоксид прометия) |
| 62 | Самарий | Sm | SmO (оксид самария (II), монооксид самария, окись самария),
Sm2O3 (оксид самария (III), сесквиоксид самария, окись самария) |
| 63 | Европий | Eu | EuO (оксид европия (II), монооксид европия, окись европия),
Eu3O4 или или EuO•Eu2O3 (оксид европия (II,III)), Eu2O3 (оксид европия (III)) |
| 64 | Гадолиний | Gd | Gd2O3 (оксид гадолиния (III), окись гадолиния) |
| 65 | Тербий | Tb | Tb2O3 (оксид тербия (III), трехокись тербия, триоксид тербия),
Tb4O7 (оксид тербия (III, IV), гептаоксид тетратербия), TbO2 (оксид тербия (IV), диоксид тербия), Tb6O11 |
| 66 | Диспрозий | Dy | Dy2O3 (оксид диспрозия (III), окись диспрозия, триоксид диспрозия) |
| 67 | Гольмий | Ho | Ho2O3 (оксид гольмия (III), окись гольмия) |
| 68 | Эрбий | Er | Er2O3 (оксид эрбия (III), окись эрбия, триоксид эрбия) |
| 69 | Тулий | Tm | Tm2O3 (оксид тулия (III), сесквиоксид тулия) |
| 70 | Иттербий | Yb | Yb2O3 (оксид иттербия (III), окись иттербия , сесквиоксид иттербия) |
Таблица оксидов (3 часть):
| 71 | Лютеций | Lu | Lu2O3 (оксид лютеция (III), окисел лютеция) |
| 72 | Гафний | Hf | HfO2 (оксид гафния (IV), окись гафния) |
| 73 | Тантал | Ta | Ta2O (оксид тантала (I), закись тантала),
TaO (оксид тантала (II), окись тантала), TaO2 (оксид тантала (IV), окись тантала), Ta2O5 (оксид тантала (V), окись тантала, пентаоксид тантала) |
| 74 | Вольфрам | W | WO2 (оксид вольфрама (IV), окись вольфрама, двуокись вольфрама, диоксид вольфрама),
WO3 (оксид вольфрама (VI), триоксид вольфрама, трёхокись вольфрама, вольфрамовый ангидрид, ангидрид вольфрамовой кислоты) |
| 75 | Рений | Re | Re2O (оксид рения (I), окись рения),
ReO (оксид рения (II), окись рения), Re2O3 (оксид рения (III), окисел рения), ReO2 (оксид рения (IV), окись рения (IV)), Re2O5 (оксид рения (V), окисел рения), ReO3 (оксид рения (VI), окись рения (VI)), Re2O7 (оксид рения (VII), окись рения (VII), рениевый ангидрид) |
| 76 | Осмий | Os | |
| 77 | Иридий | Ir | |
| 78 | Платина | Pt | |
| 79 | Золото | Au | |
| 80 | Ртуть | Hg | |
| 81 | Таллий | Tl | |
| 82 | Свинец | Pb | |
| 83 | Висмут | Bi | |
| 84 | Полоний | Po | |
| 85 | Астат | At | |
| 86 | Радон | Rn | |
| 87 | Франций | Fr | |
| 88 | Радий | Ra | |
| 89 | Актиний | Ac | |
| 90 | Торий | Th | |
| 91 | Протактиний | Pa | |
| 92 | Уран | U | |
| 93 | Нептуний | Np | |
| 94 | Плутоний | Pu | |
| 95 | Америций | Am | |
| 96 | Кюрий | Cm | |
| 97 | Берклий | Bk | |
| 98 | Калифорний | Cf | |
| 99 | Эйнштейний | Es | |
| 100 | Фермий | Fm | |
| 101 | Менделевий | Md | |
| 102 | Нобелий | No | |
| 103 | Лоуренсий | Lr | |
| 104 | Резерфордий (Курчатовий) | Rf | |
| 105 | Дубний (Нильсборий) | Db | |
| 106 | Сиборгий | Sg | |
| 107 | Борий | Bh | |
| 108 | Хассий | Hs | |
| 109 | Мейтнерий | Mt | |
| 110 | Дармштадтий | Ds |
Коэффициент востребованности
33 644
Содержание:
Благодаря способности атомов по-разному и в неодинаковых количествах соединяться между собой существует свыше 10 млн сложных веществ. О том, что они разделяются на две большие группы — органические и неорганические вещества — вы уже знаете из курса природоведения и уроков химии в 7 классе (вспомните, что лежит в основе этой классификации).
Состав оксидов:
Остановимся более детально на изучении формул оксидов и рассмотрим такие примеры:
Как видим, каждая формула состоит из атомов двух химических элементов, один из которых — кислород. Изучая свойства кислорода в 7 классе, вы узнали, что его бинарные соединения с металлическим или неметаллическим химическим элементом называются оксидами. Качественный состав приведенных веществ свидетельствует об их принадлежности к оксидам. А в составе формул отмечаем наличие и металлических, и неметаллических химических элементов.
Оксиды — это бинарные соединения любого химического элемента с кислородом.
Обозначим металлический или неметаллический элемент буквой
где 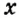
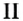
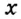
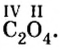
Номенклатура оксидов:
До введения правил составления, написания и чтения названий веществ, т. е. их номенклатуры, оксиды, как и многие другие вещества, называли произвольно. В настоящее время пользуются современной научной номенклатурой оксидов:
- название каждого оксида состоит из двух слов в именительном падеже. Первое слово — оксид, а второе — название химического элемента. Если элемент имеет переменную валентность, ее указывают в круглых скобках после названия элемента, без промежутка. Оба слова пишутся с маленькой буквы.
Поупражняемся в составлении названий оксидов на примере конкретных формул.
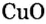
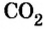
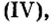
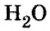
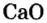
Обратите внимание! Между названием элемента и записанным в скобках значением валентности промежутка нет.
До сих пор мы имели дело только с молекулярными формулами веществ, но существуют еще и структурные формулы. В отличие от молекулярных, они показывают последовательность соединения атомов в веществе.
Структурные формулы — это формулы, в которых черточками показывают валентность, а символы химических элементов записывают в той последовательности, в которой атомы соединяются друг с другом.
Пример 1. Оксид углерода 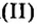
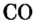
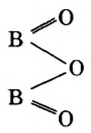
Пример 2. Оксид бора 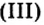
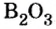
Обратите внимание на то, что в этой формуле атомы бора соединены атомом кислорода.
Физические свойства оксидов:
При нормальных условиях оксиды различны по агрегатному состоянию. Так, оксид меди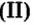
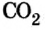
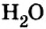
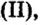
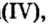
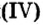
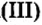
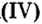
С такими физическими свойствами оксидов, как агрегатное состояние, цвет и др., вы ознакомитесь во время выполнения задания рубрики Страница естествоиспытателя.
Итоги:
Кроме оксидов, существуют и другие группы бинарных соединений элементов с кислородом, в частности пероксиды (приставка пер означает избыток, сверх). То есть, пероксид содержит в своем составе больше атомов кислорода, чем их должно быть, исходя из правил определения валентности элементов в бинарных соединениях. Так, известный вам пероксид водорода 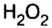
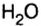
Сравним структурную формулу пероксида водорода со структурной формулой оксида водорода и выясним, в чем отличие между этими группами сложных кислородсодержащих неорганических веществ.
Отличие заключается в том, что в оксидах атомы кислорода между собой не соединены: 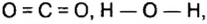

Пероксиды находят разнообразное применение. Так, пероксид водорода незаменим в производстве отбеливателей бумаги, текстильных материалов, синтетических моющих средств, используется как антисептическое средство, для реставрации произведений живописи на основе свинцовых красок, как окислитель ракетного топлива и источник кислорода (вспомните получение кислорода из пероксида водорода).
Пероксид натрия применяют на подводных лодках для очистки воздуха от углекислого газа и увеличения содержания кислорода:
Оксиды
На нашей планете есть вещество, благодаря которому существует жизнь. Ему посвящено множество песен, стихов, сказок, с ним связано немало народных обычаев. Вы, наверное, уже догадались, что это — вода. Она утоляет жажду, снимает усталость, дарит радость и энергию. Можно долго смотреть, как течет ручей, плещутся о берег волны, любоваться радугой* (рис. 7).
С точки зрения химии вода — сложное вещество, имеющее химическую формулу 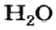
Оксид — соединение, образованное двумя химическими элементами, одним из которых является Оксиген.
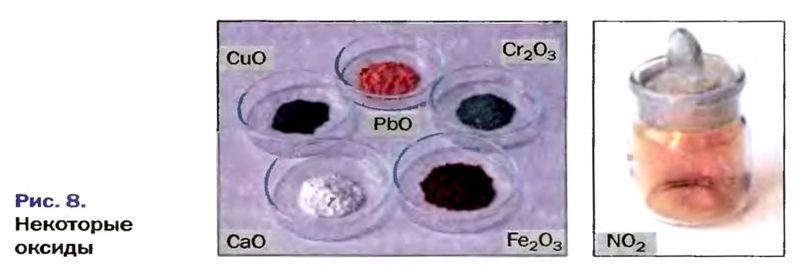
Оксиды образуют почти все элементы (рис. 8). Общая формула оксидов —
* — Радуга возникает благодаря эффекту преломления солнечных лучей в каплях воды.
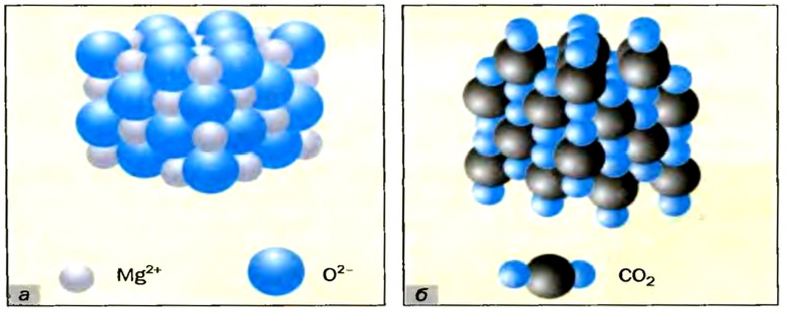
Большинство оксидов металлических элементов являются ионными соединениями. Так, оксиды с формулами 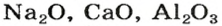
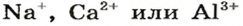
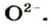
Оксиды, образованные неметаллическими элементами, имеют преимущественно молекулярное строение (например, вода 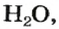
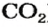
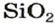
Формулы оксидов:
Количественный состав оксидов разнообразен. Он определяется валентностью элементов.
Для элемента с постоянной валентностью существует один оксид. Одновалентный Литий образует оксид с формулой 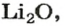
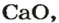
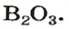
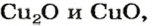
Обозначив химический элемент символом Е, приведем общие формулы для всех существующих оксидов:
Вы научились составлять формулы соединений, образованных двумя элементами, по значениям валентности элементов. Напомним, как это сделать.
Выведем формулу молекулярного соединения — оксида Сульфура, в котором Сульфур проявляет валентность 4. Сначала запишем символы элементов и укажем над ними значения их валентности: 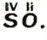
Это интересно. Химикам пока не удалось получить оксиды и другие соединения Гелия, Неона, Аргона.
Больше всего оксидов образует Нитроген:
и 2 и получаем соответствующие индексы в формуле соединения:
Чтобы составить формулу ионного оксида, необходимо знать заряд иона металлического элемента (его значение совпадает со значением валентности элемента). Заряд иона Оксигена равен —2. Следует помнить, что любое соединение электронейтрально. Если оно состоит из ионов, то сумма их зарядов равна нулю.
Выведем формулу ионного соединения — литий оксида. Литий — одновалентный металлический элемент; он образует ион 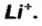
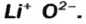
Вам известно правило: наибольшее значение валентности элемента совпадает с номером группы периодической системы, где он находится. Оксид, в котором элемент проявляет такую валентность, называют высшим.
Для веществ молекулярного строения, в том числе и оксидов, кроме химических формул, используют графические формулы. В 7 классе вы составляли такие формулы для некоторых веществ. Напомним, что в графической формуле атомы соединяют с помощью черточек:
Это интересно. Высшие оксиды элементов I группы Купрума и Аурума —
Количество черточек возле каждого атома равно значению его валентности в соединении. Необходимо учитывать, что одинаковые атомы в молекулах оксидов не соединяются.
Названия оксидов:
Химическое название оксида состоит из двух слов: первое — название элемента, а второе — «оксид»:
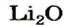
Если элемент образует несколько оксидов, то в названии каждого соединения после названия элемента указывают (без отступа) римской цифрой в скобках значение его валентности:

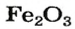
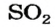
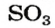
В названии соединения склоняется лишь второе слово: бор оксида, сульфур(VI) оксидом.
Для некоторых оксидов, кроме химических названий, существуют еще и традиционные (тривиальные). Такие названия для соединений 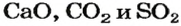
Распространенность в природе:
Оксиды содержатся в каждой из трех оболочек нашей планеты — в атмосфере, гидросфере, литосфере.
Самым распространенным оксидом в атмосфере и гидросфере является вода, а в литосфере — силиций(IV) оксид 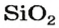
Это интересно. Для воды 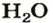
Выводы:
Оксид — соединение, образованное двумя элементами, одним из которых является Окси-ген. Общая формула оксидов —
Большинство оксидов металлических элементов состоят из ионов, а большинство оксидов неметаллических элементов — из молекул.
Оксиды имеют химические названия, а некоторые — еще и тривиальные. Первым словом в химическом названии оксида является название соответствующего элемента, а вторым — «оксид».
В природе встречается много оксидов. Наиболее распространены вода и силиций(IV) оксид.
Свойства и применение оксидов
Свойства оксидов, как и других веществ, зависят от их внутреннего строения, т. е. от того, из каких частиц они состоят — атомов, молекул или ионов.
Физические свойства оксидов
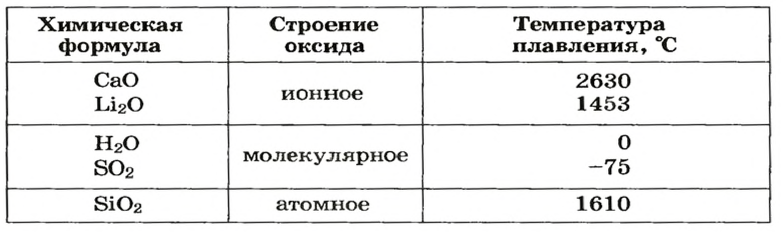
В ионных оксидах (рис. 15, а) противоположно заряженные ионы сильно притягиваются друг к другу. Поэтому такие оксиды при обычных условиях являются твердыми веществами, плавятся при высокой температуре (табл. 3). Большинство ионных оксидов не растворяются в воде, а остальные реагируют с ней.
В оксидах молекулярного строения (рис. 15, б) притяжение между частицами (молекулами) очень слабое. Поэтому температуры плавления (табл. 3) и кипения соединений невысоки, а их агрегатные состояния при обычных условиях различны. Немало таких оксидов летучи, растворимы в воде (во время растворения многих из них происходят химические реакции), некоторые имеют запах.
Оксиды атомного строения — твердые вещества с высокими температурами плавления (табл. 3) и кипения. Они не растворяются в воде.
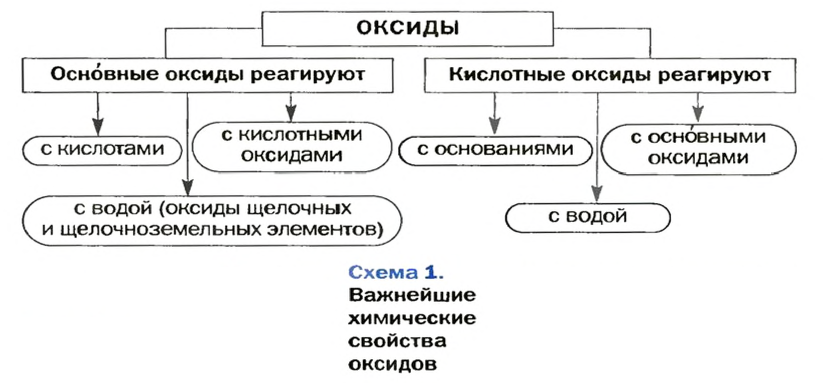
Химические свойства оксидов
Способность оксида взаимодействовать с другими веществами зависит от его типа. Рассмотрим отдельно реакции, в которые вступают основные и кислотные оксиды. Вы уже знаете, что основными называют оксиды, которые соответствуют основаниям, а кислотными — те, что соответствуют кислотам.
Строение и температуры плавления некоторых оксидов
Реакции с участием основных оксидов
Реакция с водой:
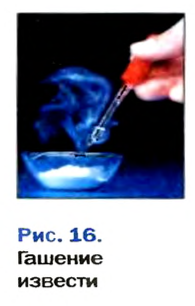
Строители, садоводы нередко смешивают негашеную известь (кальций оксид) с водой.
При этом происходит химическая реакция и образуется гашеная известь — кальций гидроксид 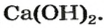
Среди основных оксидов в аналогичную реакцию вступают только соединения щелочных 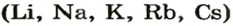
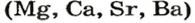
Реакции оксидов с водой относят к реакциям соединения.
Вывести формулу продукта реакции оксида с водой можно следующим образом. Сначала нужно сложить вместе все атомы, имеющиеся в формулах реагентов, и разместить их в определенном порядке. Первым записывают символ металлического элемента, затем — символы Оксигена и Гидрогена. Если все индексы в составленной формуле окажутся четными, их нужно разделить на 2. Эту «двойку» ставим как коэффициент в химическом уравнении:
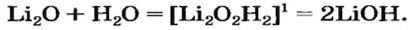
При наличии возле атомов Оксигена и Гидрогена одинакового индекса его выносят за скобки:
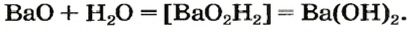
Формулу основания можно также записать, исходя из того, что заряд иона металлического элемента в нем такой же, как и в оксиде:
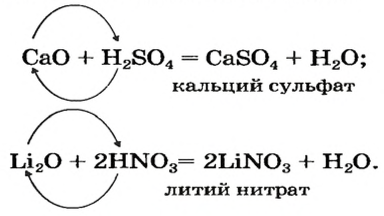
Реакции с кислотными оксидами
Основные оксиды реагируют с соединениями противоположного химического характера, т. е. имеющими кислотные свойства. Среди них — кислотные оксиды.
Продуктом реакции между основным и кислотным оксидами является соответствующая соль. Она состоит из катионов металлического элемента, которые содержались в основном оксиде, и анионов остатка кислоты, которая происходит от кислотного оксида. В формуле соли, как вам известно, сначала записывают катион, а затем — анион.
Примеры уравнений реакций с участием основного и кислотного оксидов:
Это интересно. Оксиды 
Реакции с кислотами:
Основные оксиды взаимодействуют не только с кислотными оксидами, но и с кислотами. Продуктами такой реакции являются соль и вода:
Реакции, в которых соединения обмениваются своими составными частями, называют реакциями обмена.
Реакции с участием кислотных оксидов
Реакция с водой
Почти все кислотные оксиды реагируют с водой (исключение — оксид 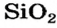
Формулы кислот — продуктов реакций кислотных оксидов с водой — выводят так же, как и оснований, складывая вместе все атомы, имеющиеся в формулах реагентов. На первом месте в формуле кислоты записывают атомы Гидрогена, на втором — атомы кислотообразующего элемента, а на последнем — атомы Оксигена:
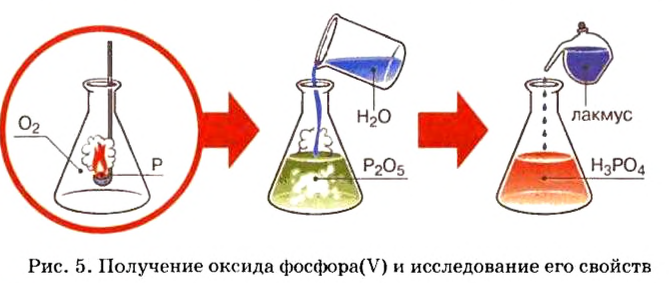
Учителя часто демонстрируют ученикам, как взаимодействует с водой фосфор(V) оксид. Во время этой реакции выделяется столько теплоты, что часть воды быстро испаряется (рис. 17). Если количество воды намного превышает количество оксида, то реакция происходит в соответствии с таким уравнением:
Общее название продуктов взаимодействия основных и кислотных оксидов с водой — гидраты оксидов, или, сокращенно, гидроксиды. Заметим, что гидроксильные группы (группы атомов ОН) содержатся в формулах не только оснований (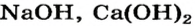
Реакции с основными оксидами
Кислотные оксиды взаимодействуют с соединениями противоположного химического характера — с основными оксидами и основаниями.
Реакции между кислотными и основными оксидами рассмотрены ранее. Приводим уравнение еще одной такой реакции с участием кислотного оксида
Реакции с основаниями
Кислотные оксиды взаимодействуют с основаниями с образованием солей и воды:
Соль происходит от кислоты, которая соответствует данному кислотному оксиду.
Изложенный материал обобщает схема 1.
Реакции разложения оксидов
Некоторые оксиды в определенных условиях разлагаются на простые вещества
или на другие оксиды и кислород:
Обратите внимание на последнюю реакцию: валентность элемента в оксиде, который образуется, ниже, чем в исходном оксиде.
Реакции оксидов с простыми веществами
Немало оксидов металлических элементов взаимодействуют при высокой температуре с водородом, углеродом, активными металлами. Продуктами большинства этих химических превращений являются металлы и другие оксиды:
Такие реакции используют в черной и цветной металлургии.
Некоторые оксиды реагируют с кислородом:
Применение оксидов
Известно почти триста оксидов. Многие из них применяют на практике. Из железных руд (они содержат оксиды Феррума) получают железо. Кварц 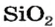
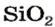

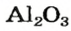
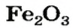
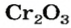
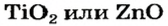
* — Состав кристаллов: рубин — 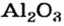
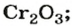
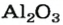
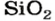
Выводы:
Оксиды ионного строения — твердые вещества. Они, как правило, не растворяются в воде, имеют высокие температуры плавления.
Оксиды молекулярного строения существуют в различных агрегатных состояниях, имеют невысокие температуры плавления и кипения. Большинство этих соединений растворяется в воде, некоторые летучи, имеют запах.
Среди основных оксидов с водой реагируют только оксиды щелочных и щелочноземельных элементов. Продукты этих реакций — основания. Основные оксиды взаимодействуют с кислотными оксидами и кислотами с образованием солей.
Почти все кислотные оксиды реагируют с водой (продукты реакций — оксигенсодержащие кислоты), а также с основными оксидами и основаниями с образованием солей.
Реакции, при которых соединения обмениваются своими составными частями, называют реакциями обмена.
Многие оксиды применяют на практике.
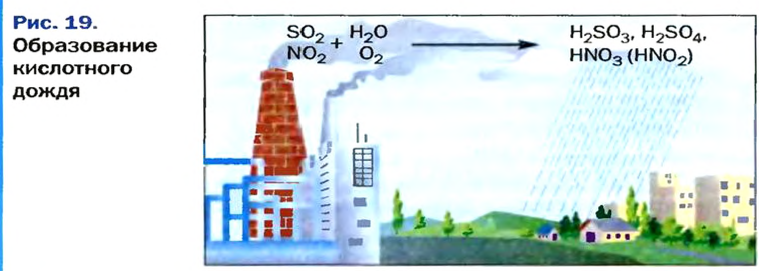
Кислотные осадки
В газовых выбросах промышленных предприятий, теплоэлектростанций, автомобильных двигателей содержатся небольшие количества оксидов Сульфура и Нитрогена. Попадая в атмосферу, они нередко вызывают так называемые кислотные осадки, которые наносят значительный ущерб окружающей среде.
В результате реакции оксида 
Часть ее взаимодействует с кислородом и превращается в сульфатную кислоту:
Оксиды Нитрогена появляются в атмосфере вследствие реакций с участием главных компонентов воздуха — азота и кислорода. Сгорание топлива и горючего сопровождается высокой температурой. В этих условиях образуется небольшое количество нитроген(II) оксида:
Это соединение быстро взаимодействует с кислородом
а нитроген(IV) оксид реагирует с атмосферной влагой:
Так в воздухе появляются примеси кислот — сульфитной, сульфатной, нитритной и нитратной. Вместе с дождем или снегом они выпадают на земную поверхность (рис. 19).
Кислотные осадки негативно влияют на растения, вызывают болезни у животных, людей, разрушают строительные материалы, особенно мрамор и известняк, усиливают коррозию металлов.
Оксиды Сульфура и Нитрогена принимают участие в образовании смога. Это — воздух, загрязненный многими токсичными веществами, который надолго зависает над большими городами и промышленными регионами.
Меры, направленные на уменьшение выбросов упомянутых оксидов, являются одними из важнейших в деле охраны природы. В современной теплоэнергетике предпочитают использовать топливо, содержащее как можно меньше Сульфура. Газовые выбросы промышленных предприятий, теплоэлектростанций очищают от сульфур(IV) оксида пропусканием их через водную суспензию кальций гидроксида, распыляют в них порошок мела, известь. Образование оксидов Нитрогена предотвращают, понижая температуру сжигания топлива или горючего. Среди важнейших мер, предпринимаемых на транспорте, — изменение конструкций двигателей, режимов их работы, введение различных добавок к горючему, замена его на другое (например, на сжиженный природный газ или этиловый спирт).
Расчеты по химическим уравнениям
В средние века алхимики не знали, что с помощью вычислений можно определить, какая масса вещества должна вступить в реакцию или образоваться в результате реакции. Они брали для экспериментов произвольные порции веществ и по их остаткам выясняли, какая масса каждого вещества прореагировала.
В настоящее время расчеты не только масс, но и количеств вещества реагентов и продуктов реакций, объемов газов осуществляют по химическим уравнениям. При этом используют значения относительных атомных, молекулярных, формульных или молярных масс. Благодаря таким расчетам химик или инженер-технолог может целенаправленно осуществлять химические превращения, получать продукты реакций в необходимом количестве, избегая избытка исходных веществ.
В этом параграфе рассмотрены решения нескольких задач с использованием химических уравнений. Напомним, что коэффициенты в уравнениях указывают на соотношение количеств вещества реагентов и продуктов реакций:
Пример №1
Какое количество вещества литий гидроксида образуется в результате реакции 4 моль литий оксида с достаточным количеством воды?
Решение
1. Составляем химическое уравнение:
2. Готовим запись для составления пропорции. Под формулами соединений 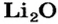
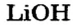
3. Рассчитываем количество вещества литий гидроксида. Составляем пропорцию и решаем ее: по уравнению реакции из 1 моль 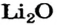
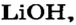
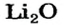
Ответ:
Пример №2
Какая масса углекислого газа прореагирует с 28 г кальций оксида?
Решение
1-й способ
1. Составляем химическое уравнение:
Согласно уравнению, в реакцию вступают одинаковые количества вещества оксидов, например 1 моль 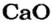
2. Определяем молярные массы веществ, указанных в условии задачи:
Масса 1 моль 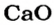
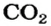
3. Записываем под формулами реагентов в химическом уравнении массы 1 моль каждого соединения, а над формулами — известную из условия задачи массу кальций оксида и неизвестную массу углекислого газа:
4. Вычисляем массу углекислого газа. Составляем пропорцию и решаем ее: по уравнению реакции
56 г 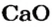
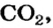
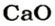
2-й способ
1. Составляем химическое уравнение:
2. Рассчитываем количество вещества кальций оксида:
3. Записываем под формулами реагентов в химическом уравнении их количества вещества согласно коэффициентам, а над формулами — вычисленное количество вещества кальций оксида и неизвестное количество вещества углекислого газа:
4. Вычисляем количество вещества углекислого газа:
5. Находим массу углекислого газа:
Ответ:
Пример №3
Какой объем сернистого газа (н. у.) прореагирует с натрий гидроксидом с образованием натрий сульфита количеством вещества 0,2 моль?
Решение
1. Записываем химическое уравнение и готовим запись для составления пропорции:
2. Находим количество вещества сернистого газа. Составляем пропорцию и решаем ее:
из 1 моль 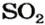
из х моль 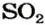
3. Вычисляем объем сернистого газа при нормальных условиях:
Ответ:
В некоторых задачах речь идет о двух одновременно протекающих реакциях. Способ их решения заключается в составлении математического уравнения с одним неизвестным (или системы двух уравнений с двумя неизвестными).
Пример №4
После добавления достаточного количества воды к 11,6 г смеси оксидов Лития и Кальция образовалось 17,0 г смеси гидроксидов. Найти массы оксидов в смеси.
Решение
1. Принимаем массу литий оксида за х г. Тогда масса кальций оксида будет равна (в граммах):
2. Вычисляем молярные массы оксидов и гидроксидов Лития и Кальция:
3. Составляем уравнения реакций с записями масс реагентов и продуктов, обозначив неизвестные массы соединений 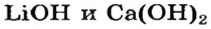
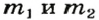
4. Записываем две пропорции и получаем математические выражения для масс гидроксидов:
5. Приравниваем сумму найденных масс гидроксидов к 17,0 г, решаем уравнение и находим массы оксидов:
Ответ:
Выводы:
Для того чтобы вычислять массы, количества вещества реагентов и продуктов реакций, объемы газов, используют химические уравнения.
Решение задач осуществляют составлением пропорций, а также по формулам, которые отображают связь между соответствующими физическими величинами.
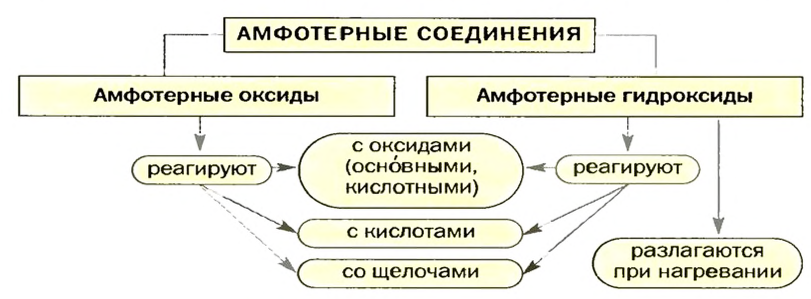
Амфотерные оксиды и гидроксиды
Некоторые оксиды и гидроксиды металлических элементов в зависимости от того, с какими веществами они реагируют, проявляют основные или кислотные свойства.
Способность соединения проявлять основные и кислотные свойства называют амфотерностью, а само соединение — амфотерным.
Приводим формулы важнейших амфотерных соединений:
По физическим свойствам амфотерные оксиды похожи на основные оксиды, а амфотерные гидроксиды — на нерастворимые основания.
Амфотерные соединения взаимодействуют с кислотами и щелочами, с кислотными и основными оксидами. Рассмотрим эти химические превращения подробнее.
Цинк оксид реагирует с кислотой как основный оксид, а цинк гидроксид — как основание:
Продукт реакции 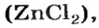
Если вместо кислоты взять щелочь, то цинк оксид будет вести себя как кислотный оксид, а цинк гидроксид — как кислота.
Уравнение реакции цинк гидроксида с натрий гидроксидом:
Для того чтобы формула образующейся соли была вам понятной, изменим порядок записи элементов в формуле цинк гидроксида на общепринятый для кислот:
Эта соль является продуктом аналогичной реакции с участием цинк оксида:
В последних реакциях амфотерные соединения проявляют кислотные свойства, поэтому продукт каждой реакции (натрий цинкат 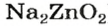
Это интересно. Амфотерные гидроксиды проявляют большую химическую активность, чем амфотерные оксиды.
Если в реакции со щелочью принимает участие амфотерный оксид или гидроксид трехвалентного элемента, то возможны два варианта их взаимодействия.
Рассмотрим реакции между алюминий оксидом и калий гидроксидом. Продуктом одной из реакций является соль, которая происходит от алюминий гидроксида 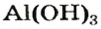
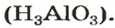
Продукт другой реакции — соль более простого состава. Выведем ее формулу, сначала выяснив формулу соответствующей «кислоты» (на самом деле — амфотерного соединения). Для этого сложим вместе все атомы в формулах алюминий оксида и воды и в полученной формуле уменьшим индексы вдвое:
Теперь заменим в формуле кислоты символ Гидрогена на символ Калия:
Соответствующее химическое уравнение:
Сопоставив коэффициенты перед формулами реагентов в уравнениях (1) и (2), увидим, что ортоалюминат образуется при добавлении к алюминий оксиду втрое большего количества щелочи.
Такие же соли получаются в результате аналогичных реакций с участием алюминий гидроксида:
На рисунке 30 показан результат опыта, который подтверждает амфотерность хром(III) гидроксида
Это интересно. Алюминаты Кальция являются составными частями цемента.
Амфотерные соединения взаимодействуют (большей частью, при нагревании) с основными и кислотными оксидами с образованием солей:
При нагревании амфотерные гидроксиды, как и нерастворимые основания, разлагаются на соответствующие оксиды и воду:
Изложенный материал обобщен в схеме 4.
Выводы:
Некоторые оксиды и гидроксиды металлических элементов проявляют как основные, так и кислотные свойства. Их называют амфотерными соединениями.
По физическим свойствам амфотерные оксиды похожи на основные оксиды, а амфотерные гидроксиды — на нерастворимые основания.
Амфотерные соединения взаимодействуют с кислотами и щелочами, с кислотными и основными оксидами с образованием солей. Амфотерные гидроксиды разлагаются при нагревании.
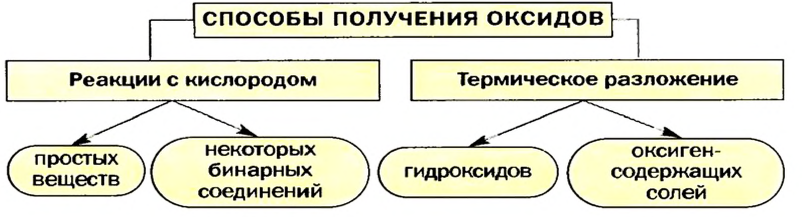
Способы получения оксидов
Известны несколько способов получения оксидов. Некоторые из них основаны на реакциях простых или сложных веществ с кислородом, другие — на термическом разложении оксигенсодержащих соединений.
Реакции простых веществ с кислородом
В такую реакцию (как правило, при нагревании) вступают почти все металлы и неметаллы. В 7 классе вы наблюдали за тем, как горят на воздухе или в кислороде сера, углерод, магний, фосфор.
Другие примеры аналогичных реакций:
Реакции сложных веществ с кислородом
Большинство бинарных соединений элементов с Гидрогеном горят в кислороде или на воздухе. Продуктами этих реакций являются оксиды и вода:
С кислородом взаимодействуют также сульфиды металлических элементов (они содержатся в полиметаллических рудах):
Такие реакции используют в цветной металлургии; из образующихся оксидов металлических элементов получают медь, цинк, кадмий и др.
Термическое разложение гидроксидов
Основания, оксигенсодержащие кислоты и амфотерные гидроксиды являются термически неустойчивыми соединениями (исключение составляют гидроксиды щелочных элементов). При нагревании они разлагаются на соответствующие оксиды (рис. 38):
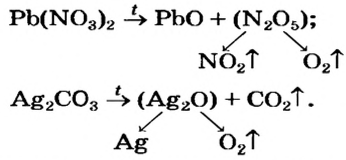
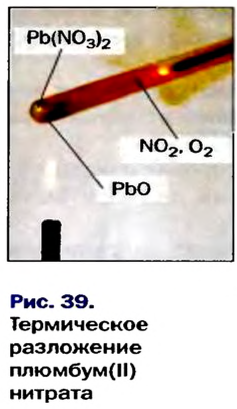
Термическое разложение оксигенсодержащих солей
Соли, образованные газообразными кислотными оксидами 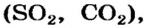
Если оксид термически неустойчив, то вместо него образуются продукты его разложения (рис. 39):
Оксигенсодержащие соли Натрия и Калия при нагревании либо не разлагаются, либо разлагаются, но не на оксиды.
Соли, образованные нелетучими кислотными оксидами (например, 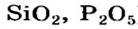
Если элемент образует два или больше оксидов, то один оксид нередко удается превратить в другой с помощью нагревания
или осуществив его реакцию с кислородом
Изложенный материал обобщает схема 6.
Схема 6. Получение оксидов
Получение оксидов в промышленности
В отличие от лабораторных способов получения различных соединений промышленная технология предусматривает использование реагентов в больших количествах и предъявляет такие требования:
- Исходные вещества должны быть доступными и дешевыми. Лучше всего использовать природное сырье.
- Энергозатраты при подготовке и осуществлении химических реакций должны быть минимальными.
Рассмотрим, как получают негашеную известь, или кальций оксид. Суть единственного промышленного способа, который используют не одно столетие, заключается в разложении известняка 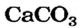
Почему для производства кальций оксида не используют другие реакции? Например, взаимодействие кальция с кислородом: 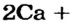
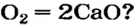
* — Уравнение реакции:
Выводы:
Оксиды получают с помощью реакций простых и некоторых сложных веществ с кислородом, а также термическим разложением гидроксидов и оксигенсодержащих солей.
Промышленные методы получения оксидов, как и других соединений, предусматривают использование доступных и дешевых веществ при минимально возможных энергозатратах.
Взаимодействие оксидов с водой
Вы убедились, насколько активным веществом является кислород. Способны ли оксиды — продукты взаимодействия кислорода с простыми и сложными веществами — к взаимодействию с другими веществами? Выясним это на опытах и начнем со взаимодействия оксидов с самым распространенным в природе оксидом — оксидом водорода, или водой.
Опыт 1. Получим оксид фосфора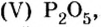
Как образовалась кислая среда, если в колбу доливали воду? Вывод один — кислота образовалась из оксида фосфора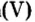
Действительно, часть воды вступила во взаимодействие с оксидом фосфора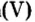
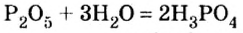
Воды было добавлено в избытке, поэтому оставшаяся ее часть растворила в себе образовавшуюся кислоту, раствор которой мы и обнаружили с помощью индикатора.
Немало оксидов неметаллов, а также оксиды некоторых металлов с высоким значением валентности 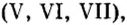
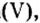
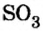
Химический элемент сера есть как в сернистой 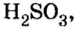
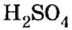
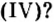
Существует правило: чтобы определить валентность кислотообразующего элемента в молекуле кислородсодержащей кислоты, необходимо от суммы единиц валентности кисло рода отнять сумму единиц валентности водорода.
Воспользуемся этим правилом и определим валентность серы в сернистой и серной кислотах.
Вычисления показали, что сера в сернистой кислоте четырехвалентна, а в серной — шестивалентна.
Следовательно, вступая в реакцию с водой, оксид серы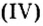
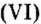
Вам известна соль перманганат калия 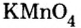
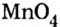
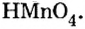
Пример №5
Составить формулу оксида, соответствующего марганцевой кислоте.
Решение
1. Воспользовавшись данным правилом, определим валентность марганца в марганцевой кислоте:
2. Составим формулу семивалентного оксида марганца.
Наименьшее общее кратное для единиц валентности марганца и кислорода — 14. По очереди разделив его на 7 (валентность марганца) и на 2 (валентность кислорода ), получим индексы 2 и 7.
Ответ:
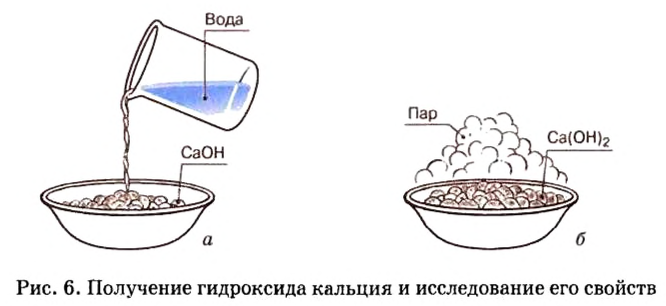
Опыт 2. В фарфоровую чашку поместим немного негашеной извести, или оксида кальция и осторожно дольем немного воды (рис. 6, о). Наблюдается «вскипание» образовавшейся смеси (рис. 6, б). Оно вызвано тем, что негашеная известь активно реагирует с водой и реакция сопровождается сильным разогретом. По окончании этой реакции содержимое фарфоровой чашки растворим в избытке воды и образовавшуюся неоднородную смесь отфильтруем.
В дальнейшем будем работать с прозрачным фильтратом, который разделим на 3 пробирки. В первую пробирку добавим несколько капель лакмуса и будем наблюдать, как раствор сразу же начнет синеть. До этих пор вы знали, что в растворах кислот лакмус приобретает розовый цвет. Появление другого цвета индикатора свидетельствует о наличии в растворе другого вещества.
Рассмотрим уравнение реакции между оксидом кальция и водой и выясним, что это за вещество:
Таким образом, в растворе есть основание. Выдвигаем гипотезу (предположение), что лакмус можно использовать в качестве индикатора для обнаружения оснований. Чтобы проверить это, проведем следующий опыт.
Опыт 3. Нальем в пробирку 1—2 мл раствора гидроксида натрия 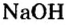
В растворе оснований лакмус изменяет свой цвет на синий.
Опыт 4. Во вторую пробирку с гидроксидом кальция, полученным в опыте 2, добавим несколько капель метилового оранжевого. Наблюдается появление желтой окраски раствора.
Опыт 5. Прибавим несколько капель метилового оранжевого к раствору гидроксида натрия или любого другого растворимого в воде основания. Наблюдаем такой же результат — раствор приобретает желтый цвет.
В растворе оснований метиловый оранжевый приобретает желтый цвет.
Есть еще одно вещество, чувствительное к наличию в растворе оснований. Это — фенолфталеин. Вспомните, раствор этого вещества в воде бесцветен. Проведем опыт.
Опыт 6. В пробирку с водой добавим несколько капель раствора фенолфталеина. Цвет раствора не изменился.
Опыт 7. В третью пробирку с раствором гидроксида кальция, полученного в опыте 2, добавим несколько капель фенолфталеина — раствор сразу становится ярко-малинового цвета.
Опыт 8. Добавим несколько капель фенолфталеина к раствору гидроксида натрия или любого другого растворимого в воде основания. Наблюдаем такой же результат, как и в опыте 7.
В растворе оснований фенолфталеин приобретает малиновый цвет.
Опыт 9. Поместим в химический стакан немного оксида меди
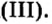
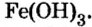
Валентность металла в основании равна валентности металла в соответствующем оксиде:
Таким образом, одни оксиды металлов взаимодействуют с водой и образуют растворимые основания, или щелочи, другие с водой не взаимодействуют, но соответствующие им нерастворимые в воде основания существуют.
Большинство оксидов неметаллов взаимодействуют с водой при обычных условиях и образуют кислоты.
Оксиды, которые взаимодействуют с водой и образуют основания, и оксиды, которые не взаимодействуют с водой, но им соответствуют основания, называют основными.
Итоги:
- Оксиды способны к взаимодействию с другими веществами.
- Оксидам отвечают гидроксиды — кислоты и основания.
- Валентность кислотообразующего элемента в кислоте равна его валентности в соответствующем оксиде.
- Валентность металла в основании совпадает с его валентностью в соответствующем оксиде.
- Присутствие щелочи в растворе (щелочной среды) обнаруживают с помощью индикаторов: лакмуса, фенолфталеина, метилового оранжевого.
Первый индикатор был изготовлен из природного сырья. Случилось это так. Как-то английскому ученому Роберту Бойлю (1627— 1691 гг.) понадобился сосуд, в котором он изготовил водную настойку лакмусового лишайника. Он освободил сосуд от настойки, налил в нее соляной кислоты и заметил, что бесцветный до этого раствор кислоты стал красным. Потом он добавил несколько капель настойки в раствор гидроксида натрия. Теперь раствор стал синим. Так был открыт и впервые использован индикатор для определения кислой и щелочной среды, который назвали лакмусом. Впоследствии настойкой стали пропитывать бумажные полоски, а зятем высушивать их и использовать в химических лабораториях.
Общие свойства оксидов
Из предыдущего параграфа вы узнали о взаимодействии оксидов с водой и образовании гидроксидов. Следует уточнить, что при обычных условиях взаимодействуют с водой и образуют щелочи лишь оксиды металлов, расположенных в вытеснительном ряду от лития до натрия включительно
Взаимодействие оксидов металлов с кислотами
Если в реакцию с кислотами вступают лишь металлы, расположенные в вытеснительном ряду до водорода, то относительно оксидов металлов таких ограничений не существует. С кислотами взаимодействуют как оксиды металлов, расположенных в вытеснительном ряду до водорода, так и оксиды металлов, расположенных в нем после водорода. Подтвердим это опытами.
Опыт 1. Возьмем немного оксида магния — твердого, нерастворимого в воде вещества белого цвета — и дольем к нему 2—3 мл раствора азотной кислоты. Для ускорения реакции содержимое пробирки подогреем. Через небольшой промежуток времени осадок исчезает. Это химическое явление описывается таким уравнением реакции:
Продукты реакции — соль и вода.
Опыт 2. Возьмем немного оксида меди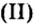
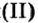
Как и в предыдущем опыте, продуктами реакции являются соль и вода.
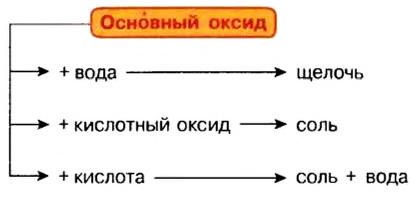
Оксиды, которые взаимодействуют с кислотами с образованием соли, называют основными оксидами.
Гидратами основных оксидов являются основания.
К основным оксидам относятся лишь оксиды металлов, к тому же с невысокой валентностью — I, II, реже — III, в отдельных случаях — IV.
Вспомните определение реакций присоединения, разложения, замещения и сделайте вывод, к каким из них относятся рассмотренные реакции. Анализ состава веществ до и после реакции указывает, что эти уравнения не относятся ни к одной из них. Это новый тип реакций.
Что в них особенного? Они характеризуются тем, что в реакцию вступают два сложных вещества и в результате реакции образуются также сложные вещества.
Реакция, при которой два сложных вещества обмениваются составными частями, в результате чего образуются новые сложные вещества, называется реакцией обмена.
Воспользовавшись уравнением реакции обмена между оксидом меди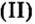
Как вам известно, первой составной частью формул оксидов является металлический или неметаллический элемент, второй — кислород. Первой составной частью формул кислот является водород, второй — кислотный остаток. В данном уравнении реакции первые части сложных веществ закрашены в синий цвет, вторые — в красный. Легко заметить, что оксид обменял свою вторую составную часть — кислород — на вторую составную часть кислоты — кислотный остаток. Если же рассматривать кислоту, то можем сказать, что ее первая составная часть — атомы водорода — обменялись местами с атомом металла, соединились при этом с кислородом и образовали воду. А с кислотным остатком соединились атомы металла, то есть образовалась соль.
Взаимодействие оксидов неметаллов со щелочами
Повторим опыт, известный вам еще из курса природоведения,— взаимодействие углекислого газа с известковой водой. Теперь вы знаете, что углекислый газ, или оксид углерода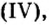
Опыт 3. Нальем в пробирку 2—3 мл прозрачного раствора гидроксида кальция (известковой воды) и пропустим туда углекислый газ. Его можно получить при взаимодействии кусочков мрамора (карбоната кальция 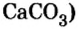
Наблюдаем, что прозрачный раствор в пробирке с известковой водой достаточно быстро мутнеет. Запишем уравнение реакции и выясним, какое из образовавшихся веществ выпало r осадок (в химии любое помутнение называют осадком, потому что оно вызвано образованием нерастворимого вещества):
Как и в предыдущих опытах с оксидами металлов, продуктами реакции являются два сложных вещества — соль и вода.
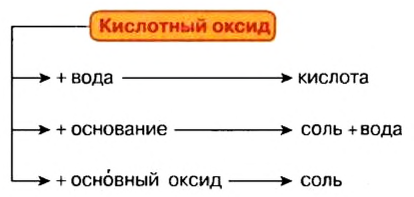
Оксиды, которые взаимодействуют с основаниями и образуют при этом соль, называют кислотными оксидами.
К кислотным оксидам относится большинство оксидов неметаллов, а также оксиды металлов с высокой валентностью. Кислотным оксидам отвечают гидроксиды — кислоты.
Взаимодействие основных и кислотных оксидов между собой
Основные оксиды взаимодействуют с кислотными оксидами:
Происходит реакция соединения, образовавшийся продукт относится к классу солей.
Обратите внимание, образовавшиеся соли содержат кислотный остаток кислоты, соответствующей взятому для реакции кислотному оксиду.
Понятие об амфотерных оксидах
Исследуя химические свойства сложных веществ, ученые обнаружили группу оксидов, которые нельзя отнести ни к основным, ни к кислотным. А все потому, что эти оксиды вступают во взаимодействие и с кислотами, и с основаниями (щелочами). В обоих случаях продуктами реакций являются соли. Оксиды с такими свойствами называют амфотерными оксидами. Амфотерный в переводе с греческого означает и тот, и другой; оба. К ним относятся: оксид бериллия 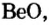
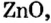
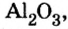
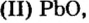
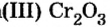
Понятие о солеобразующих и несолеобразующих оксидах
Рассмотренные в этом параграфе примеры химических явлений указывают на то, что из оксида можно получить соль, подействовав на него кислотой или щелочью. Однако некоторые оксиды этим свойством не обладают. Это касается оксида углерода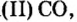
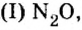
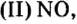
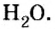
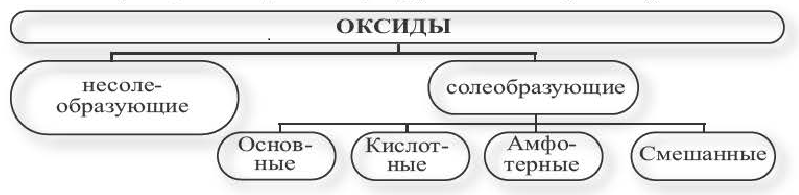
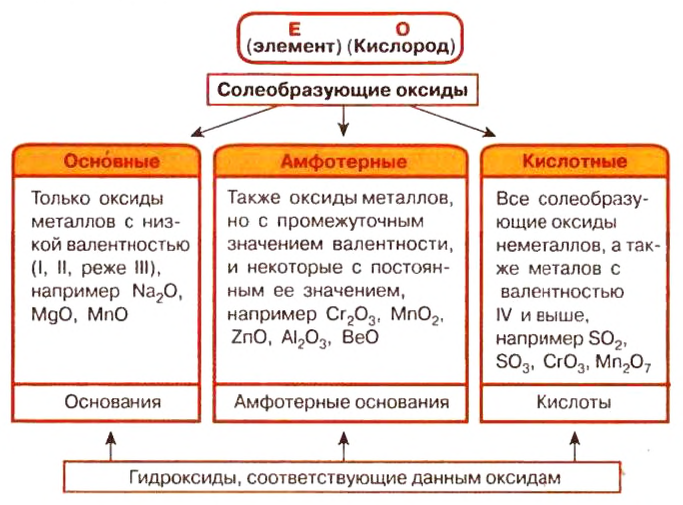
Классификация оксидов
Обобщим в виде схемы разделение оксидов на группы и отметим, какие гидроксиды отвечают каждой группе:
Итоги:
- По способности к взаимодействию с другими веществами и образованию солей оксиды делятся на солеобразующие и не солеобразующие.
-
Солеобразующие оксиды делятся на основные, кислотные, амфотерные.
-
Основным оксидам отвечают гидроксиды оснований, кислотным — кислоты, амфотерным — амфотерные гидроксиды.
- Основные оксиды взаимодействуют с водой, кислотами, кислотными оксидами:
- Кислотные оксиды взаимодействуют с водой, основаниями (щелочами), основными оксидами:
Были рассмотрены общие химические свойства оксидов. Соединениям этого класса свойственно и другое взаимодействие, в частности доокисление оксидов. Из названия легко догадаться, что это реакция с кислородом. Действительно, если элемент в соединениях проявляет переменную валентность, то при определенных условиях его оксид с низшей валентностью окисляется до оксида с высшей валентностью, например:
Определите валентность углерода и серы до и после реакции, чтобы убедиться, что это действительно так.
Доокисление оксидов причастно к такому экологически опасному явлению, как кислотные дожди. В продуктах горения нефти, газа, угля, древесины, выбросах нефтеперерабатывающих, металлургических, химических заводов, автомобильного транспорта содержатся оксид ceры
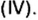
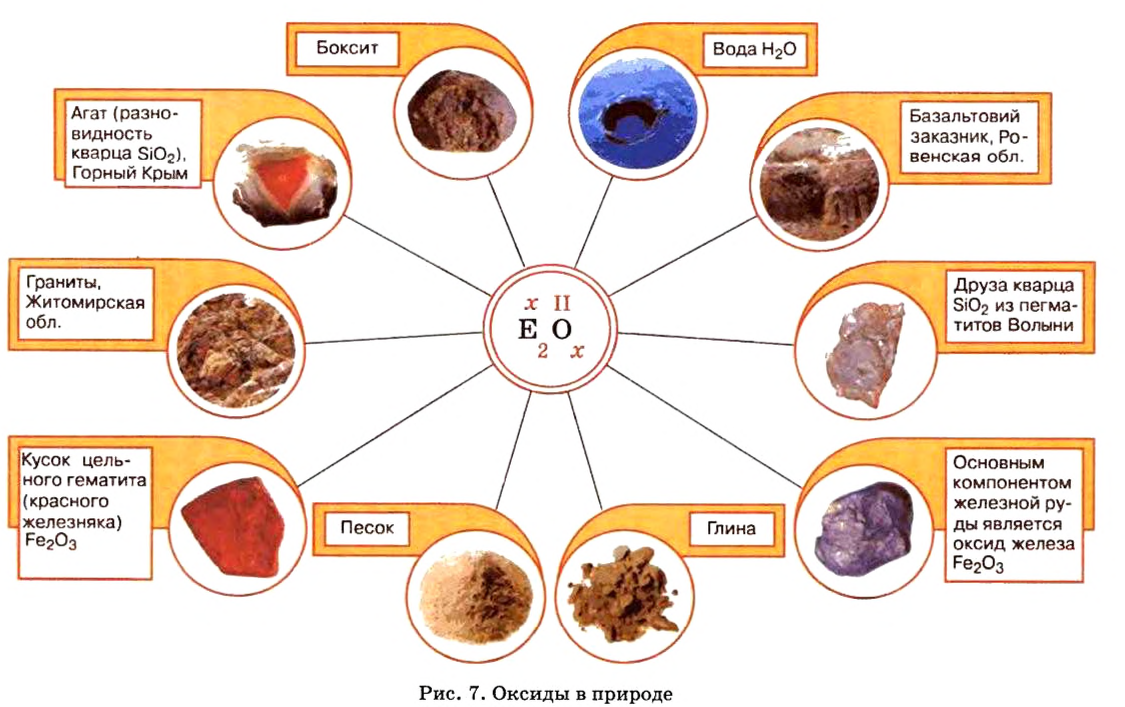
Оксиды в природе
Вы уже знаете, что среди химических элементов чемпионами по распространению в природе является кислород, кремний, алюминий, железо. Своим первенством они обязаны оксидам. Оксиды — самые распространенные вещества на нашей планете. Больше всего оксидов содержится в оболочках Земли: атмосфере (оксид углерода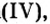
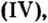
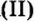
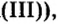
Из уроков природоведения вы узнали, что воздух приблизительно на 0,03 % состоит из углекислого газа. На первый взгляд, это вроде бы немного. Однако, если учесть, что воздушная оболочка Земли достигает до 15 км в высоту, становится понятным, насколько распространен этот газообразный оксид.
А что уж говорить о другом оксиде неметалла — оксиде водорода, которым покрыто 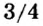
Только оксиду углерода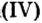
О распространении воды вы знаете, наверное, больше всего. Поэтому обобщите свои знания о воде, дополните их новой информацией и подготовьте рассказ, изобразив его схематически. Образование скалистых гор, почвы, невозможно без оксида кремния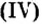
Залежи оксидов железа в Украине в большом количестве находятся вблизи Кривого Рога.
По рисунку 7 вы сможете дополнительно ознакомиться с распространением оксидов в природе.
Применение оксидов основывается на разнообразии их химических и физических свойств. Так, свойство оксидов взаимодействовать с другими веществами используют при получении сплавов железа: чугуна и стали, кислот.
Без использования свойства оксида водорода (воды) растворять другие вещества, образуя растворы, нельзя представить быт, пищевую промышленность, производства лекарств и т. п. Высокая теплоемкость воды дает возможность использовать ее для отопления помещений, в теплообменниках на заводах по производству кислот, в производстве удобрений и т. п. Вода также является ценным сырьем, из которого изготавливают кислоты, спирты, водород, кислород, щелочи и много других веществ. Она вдохновляет поэтов и художников на создание шедевров искусства.
Однако не следует забывать, что в воде зародилась жизнь и без воды живая природа существовать не может. Поэтому забота о сохранении чистоты водоемов — дело каждого.
Оксид кремния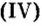
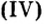
Из оксида алюминия приблизительно на 50 % состоят бокситовые руды, залежи которых есть в Украине. Из этого оксида на алюминиевых заводах получают «крылатый» металл алюминий. Вам хорошо известно, что самолетов и ракетостроение без него было бы невозможным.
Твердость оксида алюминия и оксида кремния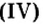
На природных рудах — оксидах железа (буром, красном, магнитном железняках) работают доменные печи. Так называют сооружения, в которых из руд выплавляют железо в виде чугуна. Из руды магнитного железняка, в состав которой входит железная окалина 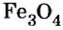
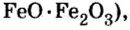
Оксид серы
— производство
оксид углеводорода
— производство сахара, газированных вод, соды.
оксид бериллия- в ядерных реакторах.
оксид титана
— изготовление белой краски( титановые белила)
оксид алюминия — производство алюминия, огнеупорных и абразивных материалов,синтетических драгоценных камней (рубины, сапфиры и др.)
оксид фосфора — осушитель газов и жидкостей
оксид кальция — производство гашеной извести,карбида, кальция, хлорной извести; в строительстве
Оксид Ванадия
— катализатор в производстве аммиака и серной кислоты
Оксид кремния
— производство стекла, керамики,фарфора, абразивных материалов; компонент строительных смесей; фильтр для воды на водоочистительных станциях; в виде кварца—для изготовления линз.
Оксид магния — производство резины, огнеупорных материалов
Оксид углерода — восстановление металлов из руд в металлургии
Оксид серы
— производство
в текстильной, бумажной, сахарной промышленности в качестве отбеливателя; обеззараживание помещений,хранение фруктов и ягод
Оксид хрома
— производство абразивных материалов; изготовление зеленой краски
оксид железа
— производство чугуна и стали; изготовление красок
Оксид водорода — растворитель на многих производствах; сырье для производства других веществ (водорода, кислорода, ацетилена, спирта, кислот и др.); теплообменник на заводах
Оксид азота
— производство
окислитель жидкого ракетного топлива
Относительно использования оксида углерода
Рассмотренные оксиды распространены в природе и используются человеком в больших количествах. Однако многие другие оксиды, хотя и уступают по распространению и масштабах использования, являются не менее важными. Приведем конкретные примеры.
Многие химические производства прекратили бы свою работу без катализаторов, в том числе и оксида ванадия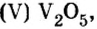
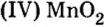
Белая, зеленая, коричневая и некоторые другие краски своим цветом обязаны оксидам металлических элементов — цинка, хрома, железа, кобальта и т. п.
Оксид серы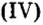
Оксид магния применяют для производства огнеупорных материалов, из которых изготавливают тигли и огнеупорный кирпич.
Добавляя в стекло вместо части оксида кремния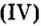
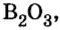
В медицине применяют оксид цинка, оксид магния, оксид алюминия и другие.
Строительство было бы невозможным без оксида кремния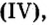
По рисунку 8 вы можете еще раз убедиться в разностороннем применении оксидов.
Итоги:
- По распространению в природе оксиды занимают первое место среди сложных неорганических веществ.
- Благодаря разнообразию физических и химических свойств оксиды находят широкое применение в разных отраслях народного хозяйства и быту.
Было рассмотрено применение каждого из оксидов. Однако существуют производства, где задействованы сразу несколько оксидов, например производство чугуна в специально построенных печах, которые называются доменными, или домнами. Во-первых, железо добывают из руд, которые содержат 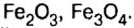
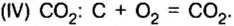
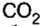
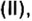
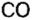
Руды содержат тугоплавкие примеси, в основном оксид кремния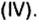


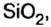
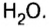
Получение оксидов
Оксиды получают из простых и сложных веществ путем их окисления или разложения при нагревании.
1. Окисление простых веществ:
(К какому типу относятся эти реакции?)
2.Окисление сложных веществ:
3. Разложение нерастворимых оснований при нагревании:
Справочный материал по оксидам
| Элемент | Образованный оксид | ||
| Основный | Кислотный | Амфотерный | |
| X | + | ||
| Y | + | + | |
| Z | + | ||
| T | + | + |
Определите элементы X,Y,Z иT.
| 1. Na | 2. Pb | 3. Cr | 4. Ca | 5. Fe | 6. Zn | 7. Al |
| X-…. | Y-…. | Z-…. | T-…. |
Какие вещества называют оксидами? На основе каких правил можно дать названия оксидам?
В VlI классе вы ознакомились лишь с некоторыми представителями неорганических соединений. В этом учебном году вы ознакомитесь с этими соединениями более подробно. Оксидами называются самые простые представители неорганических соединений.
Сложные вещества, состоящие из двух элементов, один из которых является кислородом, называются оксидами (кроме Na2O2, H2O2, KO2, CaO2, BaO2).
Классификация оксидов
Оксиды классифицируются по своему составу, и свойствам.
Оксиды, не взаимодействующие с кислотами и основаниями, называются несолеобразующими оксидами.
N2O, NO, СО, SiO
Оксиды, взаимодействующие с кислотами и основаниями, образуя соль и воду, называются солеобразующими оксидами. Солеобразующие оксиды подразделяются на основные, кислотные, амфотерные и смешанные оксиды.
Оксиды, взаимодействующие с кислотами и кислотными оксидами, образуя соли, называются основными оксидами:
Li2O, Na2O, K2O, MgO, CaO, BaO, HgO, MnO,
FeO, Cu2O, CuO, Ag2O
Степень окисления это формальный, т.е. условный заряд атома в молекуле при ионной связи. В основных оксидах степень окисления металла по своему числовому значению равна валентности металла. Степень окисления кислорода во всех оксидах равна -2.
Оксиды, взаимодействующие с щелочами и основными оксидами, образуя соль, называются кислотными оксидами. Кислотные оксиды также называют кислотными ангидридами. К кислотным оксидам относятся следующие оксиды:
CO2, N2O3, NO2, N2O5, P2O3, P2O5, SO2, SO3, SiO2,
CrO3, Mn2O7, Cl2O7
Оксиды, взаимодействующие как с кислотами (или кислотными оксидами), так и с щелочами (или основными оксидами), образуя соль, называются амфотерными оксидами. Оксиды, которые в зависимости от условий проявляют свойства как кислотных, так и основных оксидов, называются амфотерными оксидами. Примерами амфотерных оксидов являются следующие оксиды:
BeO, ZnO, Cr2Q3, Al2O3, Fe2O3, MnO2, PbO, PbO2 и др.
Вещества, образованные соединением двух различных оксидов одного и того же элемента, называются смешанными оксидами.
Pb2O3, Mn3O4,Fe3O4
Существуют также другие бинарные кислородные соединения, которые не называются оксидами. Например, пероксиды Na2O2, Н2О2, супероксиды NaО2, KО2 и К2О4 и озонид калия KO3 не являются оксидами.
Номенклатура оксидов
Некоторые оксиды имеют исторические названия, например, СО угарный газ, CO2 углекислый газ, SO2 сернистый газ, N2O веселящий газ, SiO2 кварц, песок.
При наименовании оксида металла с переменной валентностью по международной номенклатуре вначале произносится слово оксид, затем название металла и далее в скобках римскими цифрами отмечается его валентность. Если металл с постоянной валентностью, то его валентность не указывается. (По-гречески 1 моно, 2 ди, 3 три, 4 тетра, 5 пента, б гекса, 7 гепта, 8 окта.)
| Оксиды металлов с постоянной валентностью | Оксиды металлов с переменной валентностью | ||
| Оксид металла | Международное название | Оксид металла | Международное название |
| Li2O | Оксид лития | CuO | Оксид меди(II) |
| ZnO | Оксид цинка | Cu2O | Оксид меди(I) |
Оксиды неметаллов раньше называли подобно оксидам металлов с переменной валентностью. В настоящее же время при наименовании оксидов неметаллов по международной номенклатуре вначале указывается по-гречески количество атомов кислорода и добавляется слово «оксид». Затем указывается название первого элемента, образующего оксид. Если число первого элемента составляет единицу, то оно не указывается, а дается лишь название элемента (СО монооксид углерода, SO2 диоксид серы). Также используется наименование оксидов неметаллов как названия оксидов металлов (CO2 оксид углерода (IV), N2O — оксид азота (I)).
Графические формулы оксидов
В оксидах кислород соединяется только с атомом другого элемента.
| Na2O | MgO | CO2 |
| Na-O-Na | Mg = O | O = C = O |
| оксид натрия | оксид магния | диоксид углерода (или углекислый газ) |
Если в соединениях, образованных при взаимодействии элементов с кислородом, атомы кислорода соединяются между собой, то такие соединения называются пероксидами.
| Na2O | BaO2 | H2O2 |
| Na-O-O-Na | 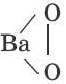 |
H-O-O-H |
| пероксид натрия | пероксид бария | пероксид водорода |
Физические свойства оксидов
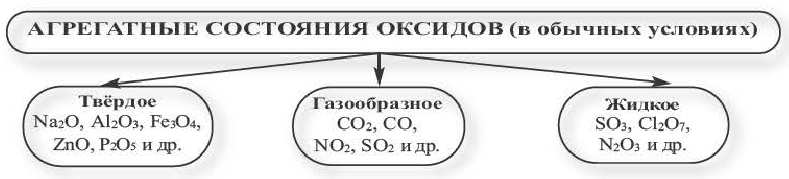
Оксиды в обычных условиях бывают в трёх агрегатных состояниях.
Все основные, амфотерные и смешанные оксиды в нормальных условиях бывают в твердом состоянии. Кислотные же оксиды при комнатной температуре бывают в трех агрегатных состояниях.
Получение и химические свойства оксидов
Получение оксидов
Оксиды получают различными методами. Ознакомимся с некоторыми из них.
Непосредственное взаимодействие простых веществ с кислородом.
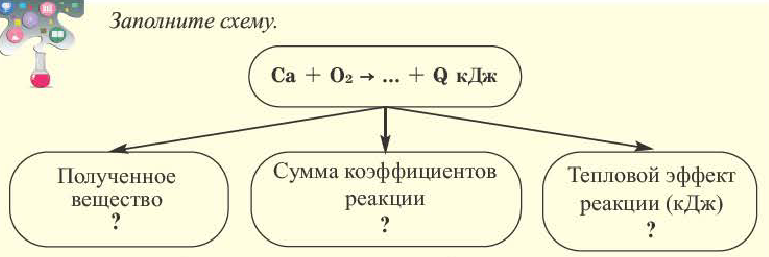
4 Li + O2 
Хотя металлы Na и К и вступают в реакцию соединения с кислородам, но оксид не получается.
Разложение гидроксидов малоактивных металлов (т.е. нерастворимых в воде оснований).
Mg(OH)2

 |
Влейте в пробирку 1 мл раствора сульфата меди (II) и добавьте к нему 0,5 мл раствора гидроксида натрия. Осторожно подогрейте до тех пор, пока цвет полученного осадка не изменится. После того как раствор в пробирке остынет, осторожно процедите его. Что вы наблюдаете в обоих случаях? Какое и вменение цвета произошло? Отметьте свои соображения в тетради. |
Разложение неустойчивых или слабых кислородсодержащих кислот.
H2CO3 

Разложение некоторых солей.
CaCO3 
Если элемент образует несколько оксидов, путем окисления оксида с низковалентным элементом или, наоборот, восстановления оксида с высоковалентным элементам можно получить новые оксиды:
2NO +O2 → 2NO2
CO2 + C 
Вытеснение одного оксида другим оксидам из их солей. Малолетучие кислотные оксиды вытесняют летучие оксиды из их солей.
Na2CO3 + SiO2 
Na2SiO3 + CO2 ↑ 
| Оксид | Оксид, вытесненный из своей соли |
| SiO2 | P2O5, NO2, CO2 |
| P2O5 | CO2 |
| NO2 | CO2 |
Эти реакции являются необратимыми.
В результате горения некоторых сложных веществ.
CH4 + 2O2 
Химические свойства оксидов. Изучим химические свойства каждого типа оксидов в отдельности. Каждый вид оксида обладает присущими ему химическими свойствами.
Основные оксиды не вступают в реакцию с щелочами.
Взаимодействие основных оксидов с водой. Из основных оксидов лишь те оксиды, которые образованы щелочными и щелочноземельными металлами, вступая в обычных условиях в реакцию соединения с водой, образуют гидроксиды (щелочи).
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
Другие основные оксиды не вступают в реакцию с водой.
Взаимодействие основных оксидов с кислотами и кислотными оксидами. Основные оксиды, вступая во взаимодействие с кислотными оксидами, образуют соли. При реакции с кислотами образуют соль и воду.
CaO + CO2 
Взаимодействие основных оксидов малоактивных металлов с восстановителями. Основные оксиды малоактивных металлов восстанавливаются посредством H2, С, СО до металла. Li2O, Na2O, K2O, CaO, BaO и др. в эти реакции не вступают, т.е. не восстанавливаются до металла.
CuO+C 
Взаимодействие кислотных оксидов с водой. Кроме оксида кремния (IV) (SiO2), все другие кислотные оксиды, вступая в реакцию соединения с водой, образуют кислоты. Эти реакции называются реакциями гидратации. Реакция взаимодействия NO2 с водой не является реакцией гидратации.
3NO2+H2O
SO3 + H2O → H2SO4
Кислотные оксиды не вступают в реакцию с большинством кислот. Амфотерные оксиды ни при каких условиях не вступают в реакцию с водой. Поскольку амфотерным оксидам присущи двойственные свойства, они вступают в реакции как с кислотами, так и с щелочами.
ZnO + 2NaOH
Na2ZnO2 — цинкат натрия
ZnO + H2SO4 → ZnSO4 + H2O
ZnSO4 — сульфат цинка
Взаимодействие амфотерных оксидов с восстановителями. Амфотерные оксиды, взаимодействуя с восстановителями H2, С, СО, востанавливаются до свободного металла.
ZnO + C 
Смешанные оксиды ни при каких условиях не вступают в реакцию с водой.
Взаимодействие сметанных оксидов с кислотами. При реакции этих оксидов с кислотами образуются две различные соли.
Fe3O4 + 8НС1 → FeCl2+ 2FeCl3 + 4H2O
Взаимодействие смешанных оксидов с восстановителями. Смешанные оксиды, взаимодействуя с восстановителями H2, С, СО, восстанавливаются до свободного металла.
Fe3O4 + 4С0 
Разложение оксидов. Некоторые оксиды при нагревании разлагаются до свободного металла.
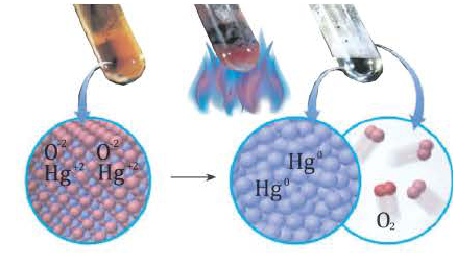
2HgO 
Задача:
Определите оксиды:
| X | Y | Z |
| A) K2O | Fc2O3 | CrO3 |
| В) Fe2O3 | CrO3 | CrO |
| С) K2O | CrO3 | Fc2O3 |
| D) CrO3 | K2O | Fc2O3 |
| Е) Fe2O3 | K2O | CrO3 |
| Оксид металла | Вещества, вступившие в реакцию | ||
| H2O | NaOH | НCl | |
| XaOb | + | + | |
| YaOb | + | + | |
| ZaOb | + | + |
Решение: Li2O, Na2O, K2O, CaO, BaO в нормальных условиях вступают в реакцию как с водой, так и с кислотами.
В таком случае, XaOb 
Амфотерные оксиды (ВеО, ZnO, Fe2O3, Cr2O3, Al2O3) вступают в реакцию как с щелочами, так и с кислотами. В таком случае, YaOb 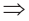
Из кислотных оксидов CO2, SO2, SO3, NO2, N2O5, Р2О3, P2O5, CrO3, Cl2O7 взаимодействуют как с водой, так и с щелочами. В таком случае, ZaOb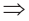
Ответ: А
Задача:
Какие выражения верные?
1) X неметалл
2) Y2O3 кислотный оксид
3) Z2O3 амфотерный оксид
4) Y неметалл
5) X металл
| Оксиды | Вещества, вступившие в реакцию | |
| NaOH | H2O | |
| XO | + | + |
| Y2O3 | + | |
| Z2O3 | + | + |
Решение: Если XO вступает в реакцию как с щелочами, так и с кислотами, то это амфотерный оксид (BeO, ZnO). Если Y2O3 вступает в реакцию только с щелочами, то это кислотный оксид (N2O3, Р2О3). Если Z2O3 вступает в реакцию как с щелочами, так и с кислотами, то это амфотерный оксид (F2O3, Cr2O3, Al2O3).
Ответ: 2, 3, 5
- Основания в химии
- Кислоты в химии
- Соли в химии
- Хлор в химии
- Водород как химический элемент
- Вода в химии и её элементный состав, молекулярное строение, формула и молярная масса
- Железо как химический элемент
- Озон как химический элемент

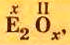
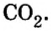
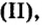
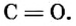
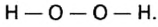
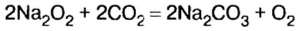

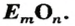
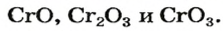
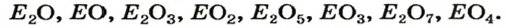
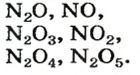
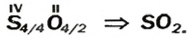
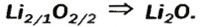

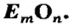

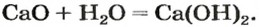
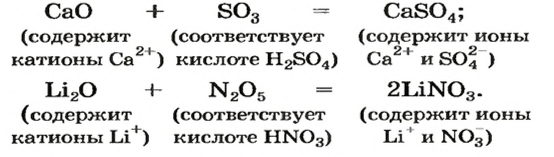
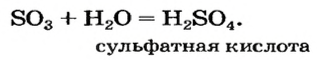
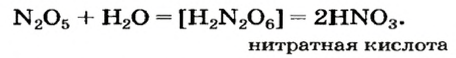

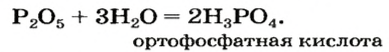
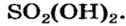
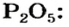
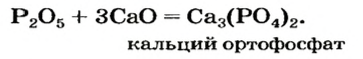
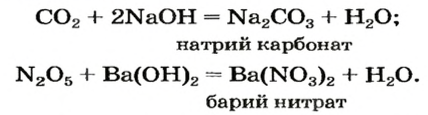
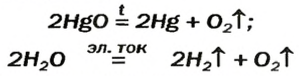
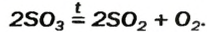
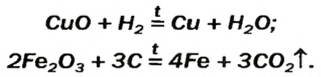
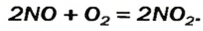

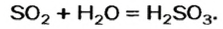
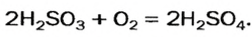
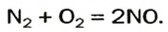
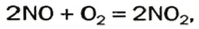
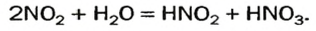
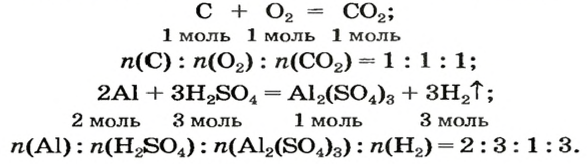
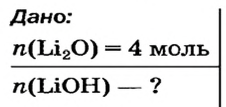
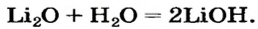
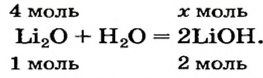
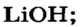
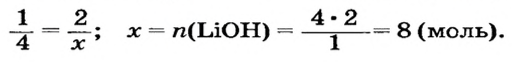
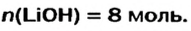
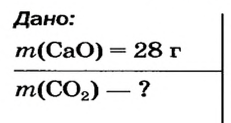
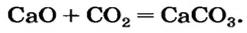
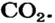

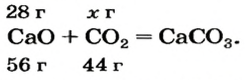
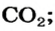
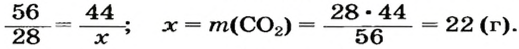
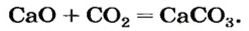
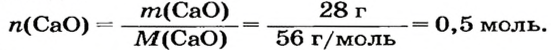
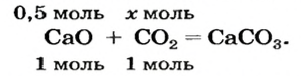
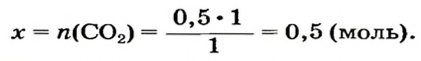
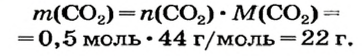
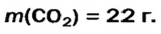
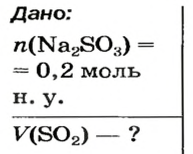
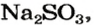
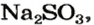
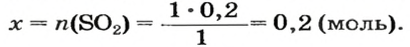
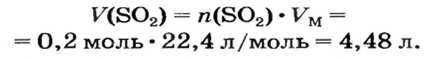
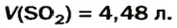
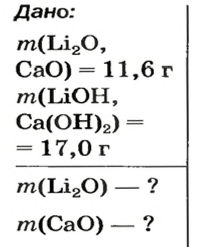
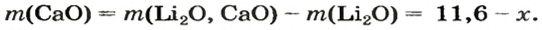
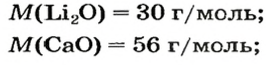
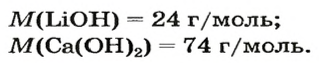
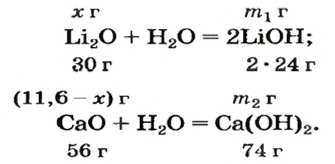
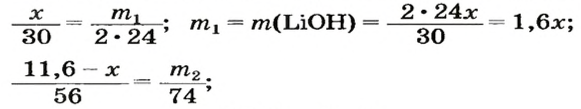
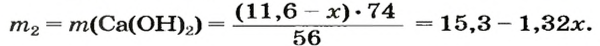
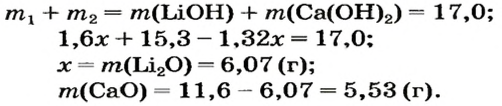
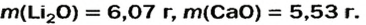

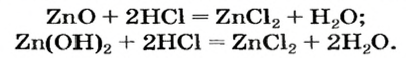
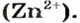
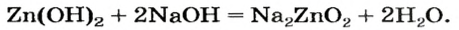
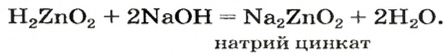
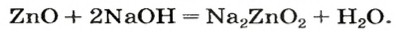
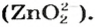
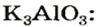
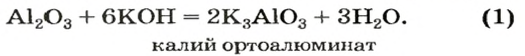
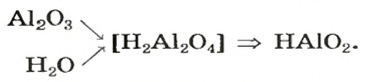
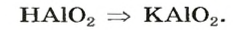
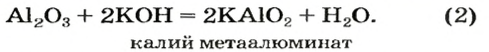
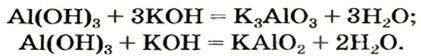
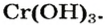

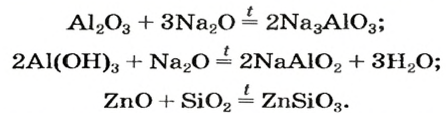
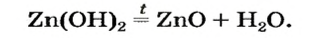

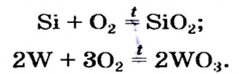
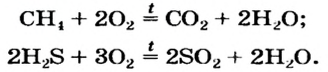
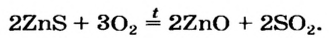

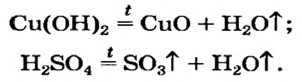
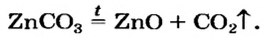
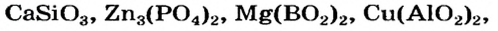
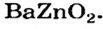
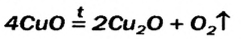
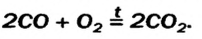
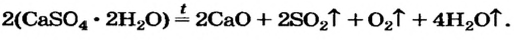
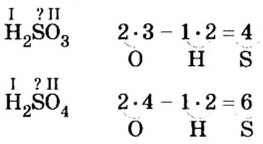
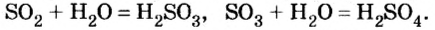
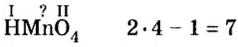
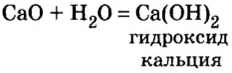
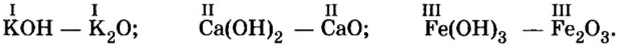
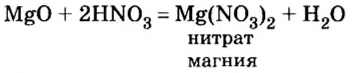
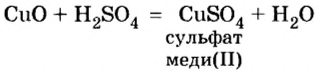
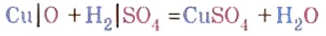
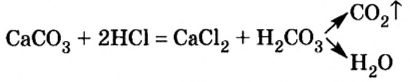
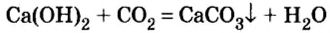
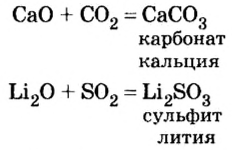
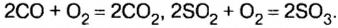
 Оксид серы
Оксид серы  — производство
— производство 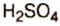
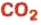 оксид углеводорода
оксид углеводорода  — производство сахара, газированных вод, соды.
— производство сахара, газированных вод, соды. оксид бериллия- в ядерных реакторах.
оксид бериллия- в ядерных реакторах. оксид титана
оксид титана — изготовление белой краски( титановые белила)
— изготовление белой краски( титановые белила) 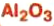 оксид алюминия — производство алюминия, огнеупорных и абразивных материалов,синтетических драгоценных камней (рубины, сапфиры и др.)
оксид алюминия — производство алюминия, огнеупорных и абразивных материалов,синтетических драгоценных камней (рубины, сапфиры и др.)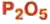 оксид фосфора — осушитель газов и жидкостей
оксид фосфора — осушитель газов и жидкостей оксид кальция — производство гашеной извести,карбида, кальция, хлорной извести; в строительстве
оксид кальция — производство гашеной извести,карбида, кальция, хлорной извести; в строительстве Оксид Ванадия
Оксид Ванадия  — катализатор в производстве аммиака и серной кислоты
— катализатор в производстве аммиака и серной кислоты Оксид кремния
Оксид кремния — производство стекла, керамики,фарфора, абразивных материалов; компонент строительных смесей; фильтр для воды на водоочистительных станциях; в виде кварца—для изготовления линз.
— производство стекла, керамики,фарфора, абразивных материалов; компонент строительных смесей; фильтр для воды на водоочистительных станциях; в виде кварца—для изготовления линз. Оксид магния — производство резины, огнеупорных материалов
Оксид магния — производство резины, огнеупорных материалов Оксид углерода — восстановление металлов из руд в металлургии
Оксид углерода — восстановление металлов из руд в металлургии Оксид серы
Оксид серы — производство
— производство 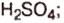 в текстильной, бумажной, сахарной промышленности в качестве отбеливателя; обеззараживание помещений,хранение фруктов и ягод
в текстильной, бумажной, сахарной промышленности в качестве отбеливателя; обеззараживание помещений,хранение фруктов и ягод Оксид хрома
Оксид хрома — производство абразивных материалов; изготовление зеленой краски
— производство абразивных материалов; изготовление зеленой краски оксид железа
оксид железа — производство чугуна и стали; изготовление красок
— производство чугуна и стали; изготовление красок Оксид водорода — растворитель на многих производствах; сырье для производства других веществ (водорода, кислорода, ацетилена, спирта, кислот и др.); теплообменник на заводах
Оксид водорода — растворитель на многих производствах; сырье для производства других веществ (водорода, кислорода, ацетилена, спирта, кислот и др.); теплообменник на заводах Оксид азота
Оксид азота — производство
— производство  окислитель жидкого ракетного топлива
окислитель жидкого ракетного топлива