Образование
Помощь в обучении
Сумма коэффициентов в уравнении окислительно восстановительной реакции
Сумма коэффициентов в уравнении окислительно восстановительной реакции
Сумма,или подбор стехиометрических коэффициентов при написании уравнений окислительно-восстановительных реакций основан на равенстве числа электронов,отдаваемых восстановителем и получаемых окислителем.
Искомая сумма вычисляется в несколько этапов.Рассмотрим на примере реакции лабораторного получения хлора окислением хлороводорода HCl перманганатом калия KMnO4,который при этом восстанавливается до иона Mn+2.
1.Уравнения полуреакций в явном виде(при участии молекул воды):
MnO4[-] + 8H[+] + 5e -> Mn[+2] + 4H2O
2.Необходимо уравнять число электронов в обеих полуреакциях,Первое уравнение надо умножить на 2,второе на 5:
2MnO4[-] + 16H[+] + 10e -> 2Mn[+2] + 8H2O
3.Суммируем уравнения и получаем уравнение в ионном виде:
2MnO4[-] + 16H[+] + 10Cl[-] -> 2Mn[+2] + 8H2O + 5Cl2[0]
В конечном уравнении правая часть должна быть равна левой,включая сумму зарядов ионов(в нашем случае +4,так как 16−10−2=2×2).
Оставить ответ Отменить ответ
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
Стехиометрические расчёты
Содержание:
Одним из важнейших химических понятий, на котором основываются стехиометрические расчёты, является химическое количество вещества. Количество некоторого вещества X обозначается n(X). Единицей измерения количества вещества является моль.
Моль – это количество вещества, в котором содержится 6,02·10 23 молекул, атомов, ионов или других структурных единиц, из которых состоит вещество.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Стехиометрические расчёты
Стехиометрическими расчетами называют нахождение значений количества, масс и объемов веществ (реагентов и продуктов), участвующих в химических реакциях. Формульное количество вещества B (nB) и масса этого вещества (mB) связаны между собой соотношением.
Решение задач по уравнениям химических реакций
Вспомните! Уравнения химических реакций. Закон сохранения массы вещества. Составление и решение пропорции
По уравнениям химических реакций можно решать множество количественных задач. Мы остановимся на расчетных задачах по нахождению массы (m) и числа молей 
Решение задач осуществляется по следующему алгоритму:







Задача 1. Сколько граммов хлорида натрия образуется при взаимодействии 92 г натрия с хлором?

Задача 2. Сколько молей углекислого газа образуется при горении 36 г углерода?

Задача 3. Вычислите массу цинка (Zn), который должен взаимодействовать с соляной кислотой с выделением 10 г водорода.
Ответ: 325 г Zn.
Задача 4. Рассчитайте количество веществ оксида меди (CuO) и углекислого газа, полученных при разложении 5 г малахита а также их массу.
Расчет количества вещества:
Расчет по уравнению реакции:
а) 1 моль (м-т) : 2 моля (CuO) = 0,0225 моль (м-т) : х моль (CuO)
х = 0,045 моль (CuO)
Ответ: 0,045 моль CuO, 3,6 г CuO.
0,0225 моль 0,99 г
Закон авогадро и молярный объем газов
Какие газы вы знаете? Что такое плотность?
Многие химические вещества существуют в газообразном состоянии, например и др. Встречаются также сложные газообразные вещества: метан углекислый газ сернистый газ хлороводород HCl, сероводород и др. Газообразные вещества подчиняются физическим законам, о которых вы знаете из курса физики. Состояние газообразных веществ характеризуется температурой, давлением и объемом.
Объем газов зависит от температуры и давления. При постоянном давлении и температуре расстояния между молекулами газообразных веществ примерно одинаковы.
Из курса физики вам известно понятие «плотность»
Отсюда:
В таблице 8 приведены некоторые величины, характеризующие известные вам газы.
Рассчитаем объем 1 моля каждого газа (при н.у.):
Как видно из этих расчетов, объемы одного моля различных газов при нормальных условиях (н. у.), т. е. при температуре 0°С и давлении 1 атм (101,3 кПа), примерно одинаковы и составляют 22,4 л. При стандартных условиях (t = 25°С, p = 101,3 кПа) молярный объем составляет 24 л. Эта величина называется молярным объемом и обозначается (рис. 20). Молярным объемом газов называют отношение объема газа (V) при н. у. к
количеству вещества
В 1 моль любых веществ, в том числе и газах, содержится одинаковое число молекул, которое называется числом Авогадро моль
В равных объемах газов, взятых при одинаковых условиях, содержится одинаковое число молекул. Этот закон был сформулирован итальянским ученым Авогадро в 1811 году.
Плотностью газа при н. у. называется отношение молярной массы газа на молярный объем.
Плотность газа при нормальных условиях:
Доказательство закона Авогадро
Найдите число молекул и массы кислорода и углекислого газа объемом 50 л, взятых при нормальных условиях (н. у.).
Число молекул равных объемов (50 л) газов, взятых при одинаковых условиях (н. у.), одинаково.
Расчет масс газов.
Массы газов разные.
Определение плотности газов
Найдите плотности кислорода и углекислого газа при нормальных условиях.
Нахождение объема, числа молекул, количества вещества по известной массе газа и обратные задачи
а) Определите объем, число молекул, количество вещества 8,8 г углекислого газа при н. у.
б) Рассчитайте массу, количество вещества и число молекул 67,2 л кислорода при н. у.
в) Рассчитать объем, массу, число молекул в 0,5 моль аммиака (н. у.).
г) Определите объем (н. у), массу и количество вещества сернистого газа числом молекул
Нормальные и стандартные условия, молярный объем, число и закон Авогадро.
Относительная плотность газов
Кроме плотности веществ, в химии часто применяют понятие относительная плотность.
Относительной плотностью (D) одного газа по отношению к другому газу называется отношение масс газов, взятых в равных объемах при одинаковых условиях.
Часто относительную плотность различных газов определяют по отношению к водороду или воздуху.
По формулам относительных плотностей можно рассчитать значение молярной массы газов.
Нахождение относительной плотности
Рассчитайте относительные плотности кислорода и углекислого газа по водороду и воздуху
Расчет молярных масс газов по относительным плотностям газов
Рассчитать молярные массы газов, если известны относительные плотности:
Расчет массы неизвестного газа по значению относительной плотности
Рассчитайте массу 50 л (н. у.) неизвестного газа, если относительная плотность этого газа по воздуху равна 0,586. Какова относительная плотность по водороду?
Закон объемных отношений
Напишем уравнение реакции между газообразными веществами, когда в результате реакции также образуется газ:
Отношение количеств реагирующих и образовавшихся веществ выглядит следующим образом: 2 : 1 : 2. Теперь возьмем отношение объемов этих газов при нормальных условиях:
Как видим, отношения объемов газов соответствуют отношениям коэффициентов перед формулами веществ в уравнении.
При одинаковых условиях объемы реагирующих газов и газообразных продуктов реакции относятся между собой как небольшие целые числа. Это закон объемных отношений Гей-Люссака.
Из рассмотренных примеров можно сделать вывод, что при решении задач удобно пользоваться коэффициентами, т.к. они в уравнениях химических реакций указывают объемные отношения веществ.
Определите объем кислорода, необходимого для окисления 60 л оксида серы (IV) до оксида серы (VI) по уравнению:
Закон объемных отношений.
- 1. Моль — мера количества вещества. В 1 моль любого вещества содержится число Авогадро структурных единиц (6,02-1023).
- 2. Молярная масса вещества (М) численно равна относительной молекулярной массе (Мг).
- 3. Расчеты по химическим уравнениям производятся на основе закона сохранения масс веществ.
- 4. В равных объемах газов, взятых при одинаковых условиях, содержится одинаковое число молекул. (Закон Авогадро.)
- 5. Относительной плотностью одного газа по отношению к другому газу (Dy(X)) называется отношение масс газов, взятых в равных объемах при одинаковых условиях.
- 6. Объемы реагирующих газообразных веществ относятся между собой и к объемам образующихся газообразных продуктов, как небольшие целые числа, равные коэффициентам в уравнении химической реакции. (Закон объемных отношений Гей-Люссака.)
- 7. При нормальных условиях (н. у.) любой газ занимает 22,4 л. Эта величина называется молярным объемом (У = 22,4 л/моль).
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Стехиометрия — это основа для химических расчетов. Стехиометрические уравнения. Стехиометрические вещества
Стехиометрия – это раздел химии, который изучает количественные соотношения между веществами, вступившими в реакцию и образовавшимися в ходе нее (от др.-греч. «стехион» – «элементный состав», «мейтрен» – «измеряю»).
Стехиометрия является важнейшей теоретической основой для материальных и энергетических расчетов, без которых невозможно организовать ни одно химическое производство. Химическая стехиометрия позволяет рассчитать количество сырья, необходимого для конкретного производства, с учетом нужной производительности и возможных потерь. Ни одно предприятие не может быть открыто без предварительных расчетов.
Немного истории
Само слово «стехиометрия» — это изобретение немецкого химика Иеремии Бениамина Рихтера, предложенное им в своей книге, в которой впервые была описана идея возможности расчетов по химическим уравнениям. Позднее идеи Рихтера получили теоретическое обоснование с открытием законов Авогадро (1811), Гей-Люссака (1802), закона постоянства состава (Ж.Л. Пруст, 1808), кратных отношений (Дж. Дальтон, 1803), развитием атомно-молекулярного учения. Сейчас эти законы, а также закон эквивалентов, сформулированный самим Рихтером, называют законами стехиометрии.
Понятие «стехиометрия» используют в отношении и веществ, и химических реакций.
Стехиометрические уравнения
Стехиометрические реакции – реакции, в которых исходные вещества взаимодействуют в определенных соотношениях, а количество продуктов соответствует теоретическим расчетам.
Стехиометрические уравнения – уравнения, которые описывают стехиометрические реакции.
Стехиометрические коэффициенты (коэффициенты уравнений) показывают количественные соотношения между всеми участниками реакции, выраженные в молях.
Большинство неорганических реакций – стехиометрические. Например, стехиометрическими являются три последовательные реакции получения серной кислоты из серы.
Расчетами по этим уравнениям реакций можно определить, сколько необходимо взять каждого вещества, чтобы получить определенное количество серной кислоты.
Большинство органических реакций являются нестехиометрическими. Например, уравнение реакции крекинга этана выглядит так:
Однако на самом деле в ходе реакции всегда будут получаться разные количества побочных продуктов – ацетилена, метана и других, рассчитать которые теоретически невозможно. Некоторые неорганические реакции тоже не поддаются расчетам. Например, реакция разложения нитрата аммония:
Она идет по нескольким направлениям, поэтому невозможно определить, сколько нужно взять исходного вещества, чтобы получить определенное количество оксида азота (I).
Стехиометрия – это теоретическая основа химических производств
Все реакции, которые используются в химическом анализе или на производстве, должны быть стехиометрическими, то есть подвергаться точным расчетам. Будет ли завод или фабрика приносить выгоду? Стехиометрия позволяет это выяснить.
На основании стехиометрических уравнений составляют теоретический баланс. Необходимо определить, какое количество исходных веществ потребуется для получения нужного количества интересующего продукта. Далее проводятся эксплуатационные опыты, которые покажут реальный расход исходных веществ и выход продуктов. Разница между теоретическими расчетами и практическими данными позволяет оптимизировать производство и оценить будущую экономическую эффективность предприятия. Стехиометрические расчеты, кроме того, дают возможность составить тепловой баланс процесса с целью подбора оборудования, определить массы образующихся побочных продуктов, которые нужно будет удалять, и так далее.
Стехиометрические вещества
Согласно закону постоянства состава, предложенному Ж.Л. Прустом, любое химически чистое вещество имеет постоянный состав, вне зависимости от способа получения. Это означает, что, например, в молекуле серной кислоты H2SO4 независимо от способа, которым она была получена, на два атома водорода всегда будет приходиться один атом серы и четыре атома кислорода. Стехиометрическими являются все вещества, имеющие молекулярную структуру.
Однако в природе широко распространены вещества, состав которых может отличаться в зависимости от метода получения или источника происхождения. Подавляющее большинство из них – это кристаллические вещества. Можно даже сказать, что для твердых веществ стехиометрия – это скорее исключение, чем правило.
Для примера рассмотрим состав хорошо изученных карбида и оксида титана. В оксиде титана TiOx X=0.7–1.3, то есть на один атом титана приходится от 0,7 до 1,3 атомов кислорода, в карбиде TiCx X=0.6–1.0.
Нестехиометричность твердых тел объясняется дефектом внедрения в узлах кристаллической решетки либо, наоборот, появлением вакансий в узлах. К таким веществам относятся оксиды, силициды, бориды, карбиды, фосфиды, нитриды и другие неорганические вещества, а также высокомолекулярные органические.
И хотя доказательства существования соединений с переменным составом были представлены только в начале 20-го века И. С. Курнаковым, такие вещества часто называют бертоллидами по фамилии ученого К.Л. Бертолле, предполагавшего, что состав любого вещества меняется.
http://natalibrilenova.ru/stehiometricheskie-raschyotyi/
http://fb.ru/article/392051/stehiometriya—eto-osnova-dlya-himicheskih-raschetov-stehiometricheskie-uravneniya-stehiometricheskie-veschestva
Сумма коэффициентов в уравнении окислительно восстановительной реакции
Сумма,или подбор стехиометрических коэффициентов при написании уравнений окислительно-восстановительных реакций основан на равенстве числа электронов,отдаваемых восстановителем и получаемых окислителем.
Искомая сумма вычисляется в несколько этапов.Рассмотрим на примере реакции лабораторного получения хлора окислением хлороводорода HCl перманганатом калия KMnO4,который при этом восстанавливается до иона Mn+2.
1.Уравнения полуреакций в явном виде(при участии молекул воды):
MnO4[-] + 8H[+] + 5e -> Mn[+2] + 4H2O
2Cl[-] — 2e -> Cl2[0]
2.Необходимо уравнять число электронов в обеих полуреакциях,Первое уравнение надо умножить на 2,второе на 5:
2MnO4[-] + 16H[+] + 10e -> 2Mn[+2] + 8H2O
10Cl[-] — 10e->5Cl2
3.Суммируем уравнения и получаем уравнение в ионном виде:
2MnO4[-] + 16H[+] + 10Cl[-] -> 2Mn[+2] + 8H2O + 5Cl2[0]
В конечном уравнении правая часть должна быть равна левой,включая сумму зарядов ионов(в нашем случае +4,так как 16−10−2=2×2).
Химическая кинетика.
-
Что
изучает кинетика?
-
возможность
протекания химических процессов; -
энергетические
характеристики физических и химических
процессов; -
скорости
протекания химических превращений и
механизмы этих превращений; -
тепловые
эффекты биохимических процессов.
-
Что
называют истинной скоростью химической
реакции?
-
количество
вещества, прореагировавшего в единицу
времени в единице объема; -
производная
от концентрации реагирующего вещества
по времени в постоянном объеме; -
пропорциональна
произведению концентраций реагирующих
веществ, возведенных в степени, равные
стехиометрическим коэффициентам в
реакции; -
изменение
концентрации вещества за единицу
времени в единице объема.
-
Что
называют средней скоростью химической
реакции?
-
количество
вещества, прореагировавшего в единицу
времени в единице объема; -
производная
от концентрации реагирующего вещества
по времени в постоянном объеме; -
пропорциональна
произведению концентраций реагирующих
веществ, возведенных в степени, равные
стехиометрическим коэффициентам в
реакции; -
изменение
концентрации вещества за единицу
времени в единице объема.
-
Какое
уравнение можно использовать для
вычисления средней скорости гомогенной
реакции по изменению концентрации (с)
или количества вещества (п) продуктов
реакции: а) υ=;
б) υ= —
;
в) υ =
;
г) υ= —
-
а,
в; -
а,
г; -
б,
в; -
б,
г.
-
Какое
уравнение можно использовать для
вычисления средней скорости гетерогенной
реакции по изменению количества вещества
исходных веществ: а) υ=
—
;
б) С
в) υ= —
;
г) υ=
-
а,
б; -
г;
-
в;
-
б.
-
какое
уравнении можно использовать для
вычисления средней скорости гомогенной
реакции по изменению концентрации или
количества вещества исходных веществ:
а) υ=;
б) ) υ= —
;
в) υ=
;
г) υ= —
:
-
а;
-
б,
в; -
а,
г; -
б,
г.
-
Как
изменяются скорости прямой и обратной
реакции во времени от начала реакции?
-
прямой
– увеличивается, обратной – уменьшается; -
прямой–
уменьшается, обратной– увеличивается; -
прямой
и обратной – увеличивается; -
прямой
и обратной– уменьшается.
-
Скорость
химической реакции зависит от:
-
температуры,
времени, концентрации; -
природы
реагирующих веществ, температуры,
концентрации; -
времени,
температуры, концентрации, природы
реагирующих веществ; -
времени,
температуры, концентрации.
-
Какие
из следующих факторов влияют на скорость
химической реакции: а) природа реагирующих
веществ, б) концентрация реагирующих
веществ, в) катализатор, г) растворитель,
д) температура:
-
а,
в, д; -
а,
б, в, д; -
все
факторы; -
б,
в, д.
-
скорость
измеряется количеством вещества,
вступающего в реакцию или образующегося
в результате реакции за единицу времени
на единице поверхности раздела фаз для
реакций:
-
гомогенных;
-
гетерогенных;
-
протекающих
в газовой фазе; -
протекающих
в твердой фазе.
-
скорость
измеряется количеством вещества,
вступающего в реакцию или образующегося
в результате реакции за единицу времени
в единице объема для реакции:
-
гомогенной;
-
гетерогенной;
-
на
границе твердое тело – жидкость; -
на
границе газ – жидкость.
-
Единицы
измерения скорости химической реакции:
а) мольл-1с-1,
б) лмоль-1,
в) смоль-1,
г) мольл-1мин-1.
-
а,
г; -
а;
-
б,
в, г; -
а,
в.
-
Сформулируйте
основной закон химической кинетики:
-
скорость
сложной реакции, состоящей из ряда
последовательных стадий, определяется
скоростью самой медленной стадии; -
скорость
реакции пропорциональна произведению
концентраций реагирующих веществ,
возведенных в степени, равные
стехиометрическим коэффициентам в
уравнении реакции; -
скорость
реакции определяется изменением числа
реагирующих молекул в единицу времени
в единице объема; -
скорость
реакции увеличивается при увеличении
температуры.
-
Закон
действующих масс устанавливает
зависимость между скоростью химической
реакции и:
-
температурой;
-
концентрацией
реагирующих веществ; -
массой
реагирующих веществ; -
количеством
реагирующих веществ.
-
От
каких факторов зависит величина
константы скорости химической реакции?
-
от
времени реакции, температуры, катализатора; -
от
природы реакции, температуры, концентрации; -
от
природы реакции, температуры, катализатора; -
от
природы реакции и температуры.
-
Когда
численное значение константы скорости
и скорости совпадают?
-
если
концентрации реагирующих веществ
постоянны и равны единице; -
если
концентрации реагирующих веществ
постоянны; -
если
реагирующие вещества и продукты реакции
находятся в одной фазе; -
никогда
не совпадают.
-
Какие
из перечисленных воздействий приведут
к изменению константы скорости реакции:
а) изменение температуры, б) изменение
объема реакционного сосуда, в) введение
в систему катализатора, г) изменение
концентрации реагтрующих веществ.
-
а,
в; -
б,
г; -
а,
б, г; -
а,
в, г.
-
В
каких случаях скорость реакции
определяется изменением концентрации
реагирующих веществ в единицу времени?
-
если
давление в системе постоянное; -
если
объем системы постоянен; -
если
температура системы постоянна; -
если
энергия системы постоянна.
-
Для
какой реакции при изменении количества
вещества А скорость не изменится: а)
А(г)+В(г)→;
б) 2А(г)+В2(г)→;
в) 2А(Т)+2В(г)→;
г) 3А(г)+
В2(г)→.
-
а;
-
в;
-
б,
г; -
а,
г.
-
Сумму
показателей степеней при концентрациях,
входящих в кинетическое уравнение
называют?
-
общим
кинетическим порядком реакции; -
молекулярностью
реакции; -
порядком
реакции по веществу; -
стехиометрическими
коэффициентами.
-
Что
называют порядком реакции по веществу?
-
показатель
степени при концентрации, входящей в
кинетическое уравнение -
сумму
показателей степеней при концентрациях,
входящих в кинетическое уравнение; -
сумму
стехиометрических коэффициентов
реакции; -
стехиометрический
коэффициент вещества.
-
Что
называют общим кинетическим порядком
реакции?
-
показатель
степени при концентрации, входящей в
кинетическое уравнение; -
сумму
показателей степеней при концентрациях,
входящих в кинетическое уравнение; -
сумму
стехиометрических коэффициентов
реакции; -
произведение
показателей степеней при концентрациях,
входящих в кинетическое уравнение.
-
Биохимические
реакции, протекающие в организме
человека, преимущественно относятся
к реакциям:
-
1
порядка; -
0
порядка; -
1
порядка, переходящие в 0 порядок; -
2
порядка.
-
Реакция
радиоактивного распада относится к
реакциям:
-
1
порядка; -
3
порядка; -
2
порядка; -
0
порядка.
-
Время
необходимое для распада половины
количеств радиоактивного вещества
(реакция 1-го порядка):
-
прямо
пропорционально константе скорости
процесса распада; -
обратно
пропорционально константе скорости
процесса распада; -
зависит
от исходного количества вещества; -
равно
половине константы скорости процесса
распада.
-
Что
называется молекулярностью реакции?
-
число
молекул, вступающих в данную химическую
реакцию; -
сумма
стехиометрических коэффициентов
реакции; -
число
молекул, реагирующих в одном элементарном
химическом акте; -
произведение
стехиометрических коэффициентов
реакции.
-
Могут
ли порядок реакции и молекулярность
быть дробными величинами?
-
и
порядок, и молекулярность могут; -
порядок
– может, молекулярность – нет; -
молекулярность
– может, порядок – нет; -
и
порядок, и молекулярность не могут.
-
Число
молекул, реагирующих в одном элементарном
химическом акте называется:
-
молекулярностью
реакции; -
порядком
реакции по веществу; -
общим
кинетическим порядком реакции; -
стехиометрическим
коэффициентом вещества.
-
Для
каких реакций порядок и молекулярность
всегда совпадают?
-
для
сложных; -
для
простых протекающих в одну стадию; -
никогда
не совпадают; -
для
многостадийных реакций.
-
Как
подразделяют химические реакции по
механизму протекания?
-
простые
и сложные; -
гомогенные
и гетерогенные; -
экзотермические
и эндотермические; -
обратимые
и необратимые.
-
Что
называют простой химической реакцией?
-
продукт
образуется в результате непосредственного
взаимодействия частиц реагентов; -
конечный
продукт получается в результате
осуществления двух и более простых
реакций с образованием промежуточных
продуктов; -
исходные
вещества и продукты находятся в одной
фазе; -
продукт
образуется в результате взаимодействия
не более двух частиц.
-
Что
называют сложной химической реакцией?
-
продукт
образуется в результате непосредственного
взаимодействия частиц реагентов; -
конечный
продукт получается в результате
осуществления двух и более простых
реакций с образованием промежуточных
продуктов; -
исходные
вещества и продукты находятся в одной
фазе4 -
продукт
образуется в результате взаимодействия
более двух частиц.
-
Что
называется лимитирующей стадией сложной
химической реакции?
-
самая
быстрая стадия; -
стадия,
имеющая низкую энергию активации; -
самая
медленная реакция; -
самая
сложная реакция.
-
Какие
стадии называются сопряженными?
-
реакции,
в которых продукт первой элементарной
стадии вступает в реакцию второй стадии
и т.д. пока не образуется конечный
продукт; -
реакции,
в которых одно и то же вещество
одновременно взаимодействует с одним
или несколькими реагентами, участвуя
в одновременно протекающих реакциях; -
реакции,
из которых одна вызывает протекание в
системе другой реакции, не осуществимой
в отсутствии первой; -
реакции,
в которых продукты реакции разлагаются
с образованием исходных веществ.
-
Какие
реакции называются последовательными?
-
реакции,
в которых продукт первой элементарной
стадии вступает в реакцию второй стадии
и т.д. пока не образуется конечный
продукт -
реакции,
в которых одно и то же вещество
одновременно взаимодействует с одним
или несколькими реагентами, участвуя
в одновременно протекающих реакциях; -
реакции,
из которых одна вызывает протекание в
системе другой реакции, не осуществимой
в отсутствии первой; -
реакции,
в которых продукты реакции разлагаются
с образованием исходных веществ.
-
Какие
реакции называются параллельными?
-
реакции,
в которых продукт первой элементарной
стадии вступает в реакцию второй стадии
и т.д. пока не образуется конечный
продукт; -
реакции,
в которых одно и то же вещество
одновременно взаимодействует с одним
или несколькими реагентами, участвуя
в одновременно протекающих реакциях; -
реакции,
из которых одна вызывает протекание в
системе другой реакции, не осуществимой
в отсутствии первой; -
реакции,
в которых продукты реакции разлагаются
с образованием исходных веществ.
-
Скорость
параллельных реакций определяется:
-
скоростью
самой медленной стадии; -
разностью
скоростей всех стадий; -
суммой
скоростей всех стадий; -
скоростью
самой быстрой стадии.
-
Реакции,
в которых продукт первой элементарной
стадии вступает в реакцию второй стадии
и т.д. пока не образует конечный продукт
называется:
-
параллельными;
-
последовательными;
-
сопряженными;
-
конкурирующими.
-
Реакции,
в которых одно и то же вещество
одновременно взаимодействует с одним
или несколькими реагентами, участвуя
в одновременно протекающих реакциях
называют:
-
параллельными;
-
последовательными;
-
сопряженными;
-
конкурирующими.
-
Экспериментально
установлено, что кинетическое уравнение
реакции: 2 NO
(г)+
О2(г)→2NO2(г)
имеет вид u
= kc2(NO)c(О2)
-
реакция
является тримолекулярной; -
реакция
протекает в одну стадию; -
реакция
имеет третий порядок; -
реакция
идет первый порядок как по кислороду,
так и по монооксиду азота.
-
С
ростом температуры увеличивается
скорость реакций:
-
экзотермических;
-
экзо-
и эндотермических; -
эндотермических;
-
обратимых.
-
К
какому типу реакции относятся реакции
гидролиза бедков?
-
последовательные;
-
параллельные;
-
сопряженные;
-
простые.
-
Процесс
окисления глюкозы в организме – это:
а) совокупность последовательных
реакций, б) совокупность
последовательно-параллельных реакций,
в) экзэргонический процесс, г)
эндэргонический процесс.
-
а,
б, в, г; -
б,
в; -
а,
б, г; -
а,
б, в;
-
Как
формулируется правило Вант-Гоффа?
-
при
повышении температуры на 10 градусов
скорость химической реакции увеличивается
в 2-4 раза; -
для
большинства химических реакций скорость
реакции увеличивается с ростом
температуры; -
скорость
реакции пропорциональна произведению
концентраций реагирующих веществ,
возведенных в степени, равные их
стехиометрическим коэффициентам
реакции; -
при
понижении температуры на 10 градусов
скорость химической реакции увеличивается
в 2-4 раза.
-
при
повышении температуры на каждые 10
градусов скорость большинства реакций:
-
увеличивается
в 2-4 раза; -
не
изменяется; -
уменьшается
в 2-4 раза; -
увеличивается
в 7-8 раз.
-
Укажите
возможные значения температурного
коэффициента скорости реакций,
протекающих в живых организмах:
-
2-4;
-
7-9;
-
больше
9; -
меньше
2.
-
Увеличение
скорости реакции с повышением температуры
вызывается главным образом:
-
увеличением
средней кинетической энергии молекул; -
возрастанием
числа активных молекул; -
ростом
числа столкновений; -
уменьшением
энергии активации реакции.
-
Каковы
причины влияния температуры на скорость
реакции?
-
изменение
концентрации реагирующих веществ
вследствие теплового расширения или
сжатия жидкости; -
температурная
зависимость константы скорости; -
изменение
энергии активации при изменении
температуры; -
возрастания
числа активных молекул.
-
Укажите
правило Вант-Гоффа о температурной
зависимости скорости реакции:
-
υ
2=υ1g∆t10; -
K
= A e-EaRT; -
=K
CaCb; -
= ±;
-
Укажите
уравнение Аррениуса о температурной
зависимости скорости реакции:
-
=
γ; -
K
= A e-EaRT; -
=K
CaCb; -
υ
2=υ1g∆t10.
-
Если
константа скорости одной реакции (к)
больше константы скорости второй
реакции (к*),
то такое соотношение между энергиями
активации этих реакций:
-
Еа
› Еа*; -
Еа
‹
Еа*; -
нельзя
определить; -
Еа
›› Еа*;
-
Если
прямая реакция экзотермична, а обратная
эндотермична, то какая из них
характеризуется более высоким значением
энергии активации?
-
прямая;
-
обратная.
-
Как
можно увеличить скорость реакции
синтеза аммиака N2(г)+3H2(г)↔2NH3(г),
∆Н‹0?а) повысить температуру, б)
уменьшить концентрацию азота, в)
увеличить давление, г) уменьшить объем
реакционной смеси:
-
а, в;
-
а,
в, г; -
а, б;
-
в, г.
-
Чем
объяснить повышение скорости реакции
при введении в систему катализатора?
а) уменьшением энергии активации, б)
увеличением средней кинетической
энергии молекул, в) возрастанием числа
столкновений, г) ростом числа активных
молекул.
-
а,
г; -
а,
в, г; -
а,
б, в, г; -
в,
г;
-
действие
катализатора на скорость химической
реакции объясняется:
-
возникновением
активированных комплексов; -
увеличением
числа столкновений; -
возникновением
активированных комплексов и изменением
энергии активации; -
изменением
энергии активации.
-
Чем
обусловлено ускоряющее действие
катализаторов?
-
существенным
уменьшением энергии активации
соответствующего превращения; -
существенным
увеличением энергии активации
соответствующего превращения; -
образованием
активированного комплекса; -
существенным
увеличением числа столкновений.
-
Действие
ферментов: а) изменяет тепловой эффект
реакции, б) снижает энергию активации,
в) увеличивает скорости прямой и обратной
реакций, г) является избирательным.
-
а,
б, в, г; -
б,
в, г; -
б,
г; -
а,
б, г.
-
Действие
катализаторов: а) а) изменяет тепловой
эффект реакции, б) снижает энергию
активации, в) увеличивает скорости
прямой и обратной реакций, г) является
избирательным.
-
а,
б, в, г; -
б,
в, г; -
б,
г; -
б,
в;
-
При
действии ферментов: а) снижается энергия
активации, б) увеличивается скорость
прямой и обратной реакций, в) изменяется
тепловой эффект реакции, г увеличивается
скорость только прямой реакции.
-
а,
б, в; -
а,
б; -
б,
в; -
а,
г;
-
чем
объясняется повышение скорости
биохимической реакции при введении в
систему фермента: а) уменьшением энергии
активации, б) увеличением средней
кинетической энергии молекул, в) ростом
числа активных молекул, г) уменьшением
числа столкновений молекул.
-
а,
в; -
а,
б, в, г; -
б,
в; -
а,
в, г.
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
|
3 |
2 |
1 |
1 |
3 |
2 |
2 |
3 |
3 |
2 |
1 |
1 |
2 |
2 |
3 |
1 |
1 |
3 |
3 |
|
20 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
31 |
32 |
33 |
34 |
35 |
36 |
37 |
38 |
|
1 |
1 |
2 |
3 |
1 |
2 |
3 |
3 |
1 |
2 |
1 |
1 |
2 |
3 |
3 |
1 |
2 |
3 |
2 |
|
39 |
40 |
41 |
42 |
43 |
44 |
45 |
46 |
47 |
48 |
49 |
50 |
51 |
52 |
53 |
54 |
55 |
56 |
57 |
|
1 |
3 |
2 |
1 |
2 |
1 |
1 |
2 |
1 |
2 |
1 |
2 |
2 |
2 |
2 |
1 |
3 |
1 |
2 |
|
58 |
59 |
60 |
||||||||||||||||
|
2 |
2 |
1 |
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #






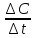 ;
; ;
; ;
;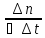
 ;
;
 ;
;
 ;
; ;
; ;
; :
: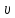 =K
=K
 ;
; =
= =K
=K