The boiling point of a substance is the temperature at which the substance changes state from liquid state to gas state. The boiling point of a liquid varies depending on the surrounding atmospheric pressure, but it is usually close to the melting point of the solid form of the same substance.
How is Boiling Point Determined?
Boiling point of a substance can be determined by using a Boiling Point Apparatus. This method uses the fact that liquids boil when their vapor pressure equals the atmospheric pressure. The apparatus consists of a container of liquid, a heater, and a mercury manometer. First, the liquid is placed in the container and heated until its vapors fill the container. The mercury manometer is then used to measure the atmospheric pressure inside the container. When the mercury column in the manometer reaches the same level as the liquid in the container, this indicates that the vapors have reached atmospheric pressure and the boiling point has been reached.
Boiling point of Water
Boiling point of water is the temperature at which the liquid water becomes water vapor. The boiling point of water is 212 degrees Fahrenheit using Fahrenheit to Celsius conversion (100 degrees Celsius). The boiling point of water is also known as the “saturation temperature.”
Boiling Point Formula of Liquid
The boiling point of a liquid is the temperature at which the liquid changes state from a liquid to a gas. The boiling point of a liquid is also the temperature at which the vapor pressure of the liquid is equal to the atmospheric pressure. The boiling point of a liquid is affected by the atmospheric pressure, which is why boiling points are usually given at standard atmospheric pressure.
The boiling point of a liquid is the temperature at which the vapor pressure of the liquid is equal to the atmospheric pressure.
The boiling point depends on the pressure of the surrounding atmosphere. When the atmospheric pressure is equal to the vapor pressure of the liquid, the liquid will boil. The boiling point also depends on the purity of the liquid, impurities lower the boiling point of a liquid.
Example: Water boils at 100 degrees Celsius (212 degrees Fahrenheit) at sea level, but only at 93 degrees Celsius (199.4 degrees Fahrenheit) at an altitude of 2,438 meters (8,000 feet).
The formula for calculating the change in the boiling point is:
Kb = RTb2M / ΔHv
where,
Kb is the boiling point constant
R is the universal gas constant (8.314 J/mol-K)
Tb is the boiling point of the liquid
M is the molar mass of the liquid
ΔHv is the heat of vaporization for the particular liquid (2260 J/kg: latent heat of vaporization of water)
Properties of Boiling Point
Following are the properties of the boiling point:
- Boiling point of a liquid varies depending on the surrounding pressure. For example, water boils at 100°C (212°F) at sea level, but only at 93°C (199°F) at an altitude of 1,000 m (3,281 ft).
- Boiling point of a liquid can also be affected by the presence of other substances in the liquid. For example, the boiling point of water is lower when salt is added to it.
- Boiling point of a liquid is a measure of the liquid’s ability to change state from a liquid to a gas. The higher the boiling point, the greater the liquid’s ability to resist changes in state.
- Boiling point of a liquid is also a measure of the liquid’s ability to vaporize. The higher the boiling point, the greater the liquid’s ability to resist vaporization.
- Boiling point of a liquid is a function of the liquid’s vapor pressure. The vapor pressure is the pressure exerted by the vapor of the liquid on the walls of the container.
- Boiling point of a liquid is also a function of the liquid’s volatility. The volatility of a liquid is a measure of the liquid’s ability to vaporize.
- Boiling point of a liquid is affected by the surrounding pressure. The higher the surrounding pressure, the higher the boiling point.
Factors Affecting the Boiling Point of Liquid
The boiling point of a liquid is the temperature at which it changes from a liquid to a gas. The factors that affect the boiling point of a liquid are its pressure, temperature, and purity.
- Purity: The higher the purity of a liquid, the higher its boiling point. This is because impurities lower the vapor pressure of a liquid, making it easier for the liquid to boil.
- Pressure: The boiling point of liquid increases as the pressure on the liquid increases. This is because the vapor pressure of a liquid increases as the pressure on the liquid increases.
- Temperature: The boiling point of a liquid also increases as the temperature around the liquid increases.
How to Find the Boiling Point of a Substance?
To determine the boiling point of a substance, we need to heat the substance until it reaches its boiling point. The boiling point of a substance is defined as the temperature at which the liquid changes its state to gas form. At this temperature, the vapor pressure of the liquid is equal to the atmospheric pressure.
We use a thermometer to measure the temperature of the substance as it is heated. As the substance approaches its boiling point, we will notice that the rate of heating will begin to slow down. This is because the heat is being used to convert the liquid into a gas, rather than increase the temperature of the liquid.
Once the substance reaches its boiling point, it will begin to boil. You can then remove the thermometer and checked the temperature to get the boiling point.
Also, Check
- Molarity
- Mole Concept
- Difference Between Molarity and Molality
Solved Examples on Boiling Point Formula
Example 1: Find the Kb of LiCl if 2 g of LiCl is dissolved in 500 g of water which boils at 100.6°C.
Solution:
Given,
Mass of LiCl = 2 g
Molar mass of LiCl = 42 g/mol
Mass of water = 500 g
Molar mass of water = 18 g/mol
Boiling point of solution = 100.6°CR = 8.314 J/mol-K (Universal gas constant)
Tb = 100.6 + 273 = 373.6 K (Boiling point in Kelvin)
V = 500 / 1000 = 0.5 L (Volume in litres)
M = (2 / 42) + (500 / 18) = 25 mol/L (Molality)
Hv= 2260 J/kg (latent heat of vaporization of water)Kb = RTb2M / ΔHv
= 8.314 × 373.6 × 0.5 × 25 / 2260
= 68.7 molal
Example 2: Find the boiling point of 1 molar solution of sucrose.
Solution:
Given,
Molarity of solution (M) = 1 mol/L
Boiling point elevation (ΔTb) = 100°C (the Kb for sucrose is 100°C/m)
R = 8.314 J/mol-K (universal gas constant)Tb = 100 + 273 = 373 K (boiling point in Kelvin)
Kb = RTb2M / ΔHv
= 8.314 × 373 × 2 × 1 / 2260
= 2.74 molal
Example 3: Find the Kb of the glucose if the solution of glucose in water boils at 103°C when the concentration of the solution is 0.5 molar.
Solution:
Given,
Concentration of solution (c) = 0.5 molar
Boiling point elevation (ΔTb) = 103°C (the Kb for sucrose is 100°C/m)R = 8.314 J/mol-K (universal gas constant)
Tb = 103 + 273 = 376 K (boiling point in Kelvin)
Kb = RTb2M / ΔHv
= 8.314 × 376 × 2 × 0.5 / 2260
= 1.38 molal
FAQs on Boiling Point
Question 1: What is the boiling point of the liquid?
Answer:
The boiling point of a liquid is the temperature at which the liquid changes state from a liquid to a gas.
Question 2: What factors affect the boiling point of a liquid?
Answer:
The boiling point of a liquid is affected by the pressure of the surrounding atmosphere, the purity of the liquid, and the presence of any dissolved solids.
Question 3: How does the boiling point of a liquid change with altitude?
Answer:
The boiling point of a liquid decreases with the rise in altitude. This is because the atmospheric pressure is lower at higher altitudes, and the boiling point of a liquid is inversely affected by the pressure of the surrounding atmosphere.
Question 4: How does the boiling point of a liquid change with the addition of solids?
Answer:
The boiling point of liquid increases with the addition of solids. This is because the solids take up space in the liquid, and the liquid must heat up to a higher temperature in order to vaporize.
Question 5: What is the boiling point of alcohol?
Answer:
The boiling point of alcohol is 78.37 degrees Celsius (172 degrees Fahrenheit).
Question 6: What is the boiling point of mercury?
Answer:
The boiling point of mercury is 356.7 degrees Celsius (673 degrees Fahrenheit.
Last Updated :
17 Jan, 2023
Like Article
Save Article
Температура кипения раствора
Найти температуру кипения раствора 50-процентной сахарозы (С12Н22О11)? Эбулиоскопическая константа воды 0,52.
Решение задачи
Следствие из закона Рауля: повышение температуры кипения раствора, раствор закипает при более высокой температуре, так как концентрация молекул растворителя в нём всегда ниже, чем в чистом растворителе, и давление насыщенного пара раствора достигает атмосферного при более высокой температуре.
Где:
Dt кип. — повышение температуры кипения раствора;
К эб. – эбулиоскопическая постоянная;
Cm– моляльная концентрация;
gB – масса растворенного вещества;
gA – масса растворителя;
µB – молярная масса растворенного вещества.
Пусть масса раствора равна 100 грамм, следовательно, масса растворённого вещества равна 5 грамм, а масса растворителя 100 – 50 = 50 грамм.
Учитывая, что молярная масса сахарозы (С12Н22О11) равна 342 г/моль (смотри таблицу Менделеева), получаем повышениетемпературы кипения раствора:
Dt кип. = 0,52 ⋅ 1000 ⋅ 50 / 342 ⋅ 50 = 1,52 (0С).
Вода кипит при температуре 100 0С, следовательно, температура кипения раствора:
t кип. = 101,52 (0С).
Ответ:
температура кипения раствора 101,52 0С.
-
Определение температуры кипения
Над всеми жидкостями в результате их
испарения устанавливается равновесие
между жидкостью и паром, а следовательно,
и определенное давление пара. Величина
этого давления зависит от природы
жидкости и от температуры. С повышением
температуры увеличивается кинетическая
энергия молекул в жидкости, все большее
их количество способно перейти в газовую
фазу и следовательно, давление пара
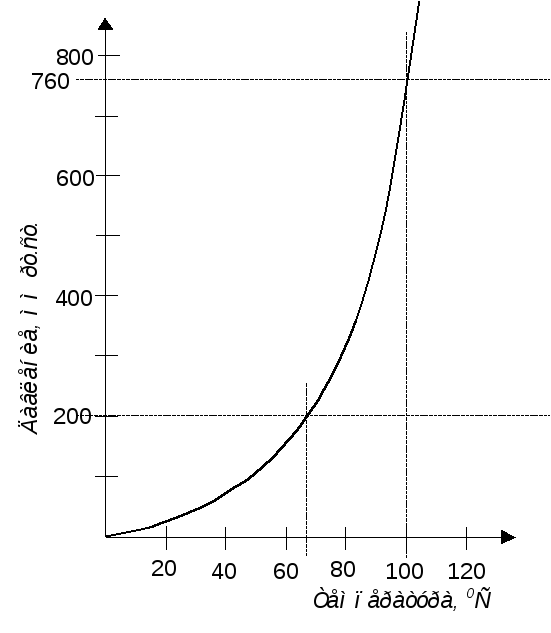
над жидкостью возрастает (рисунок 4).
Рисунок 4 – Кривая
давления водяного пара
Температуру,
при которой давление пара становится
равным внешнему давлению, называют
температурой
кипения. Точка пересечения
(рисунок 4) горизонтальной прямой,
отвечающей давлению 760 мм рт. ст., и кривой
давления пара соответствуеттемпературе
кипения при нормальном давлении.
Любая жидкость, не разлагающаяся при
нагревании до температуры, при которой
давление пара становится равным 760 мм
рт. ст., имеет свою характерную температуру
кипения при нормальном атмосферном
давлении. На рисунке 4 видно также, что
при давлении 200 мм рт. ст. вода кипела бы
приблизительно при 66С.
Эту зависимость температуры кипения
от давления используют в лабораторной
практике и промышленности для перегонки
без разложения веществ, кипящих при
высоких температурах (вакуумная
перегонка). В ряде справочных и учебных
пособий приведены номограммы, позволяющие
связать между собой температуры кипения
при атмосферном давлении и в вакууме,
т. е. определить то максимальное остаточное
давление, которое должно быть в перегонной
установке, чтобы вещество перегонялось
ниже температуры его разложения (см.,
например, /3, с. 32/).
Этой же цели (очистка высококипящих
веществ) служат и другие модификации
перегонки. Например, перегонка с водяным
паром позволяет перегнать высококипящее
вещество при атмосферном давлении,
однако давление паров над поверхностью
жидкости, равное атмосферному,
складывается из суммы парциальных
давлений самого вещества и паров воды.
Водяной пар в этом способе продувают
(барботируют) через толщу вещества в
перегонном кубе.
В большинстве случаев определение
температуры кипения производится при
перегонке вещества в процессе его
очистки. В случае необходимости
определение температуры кипения малого
количества жидкости можно пользоваться
микрометодом
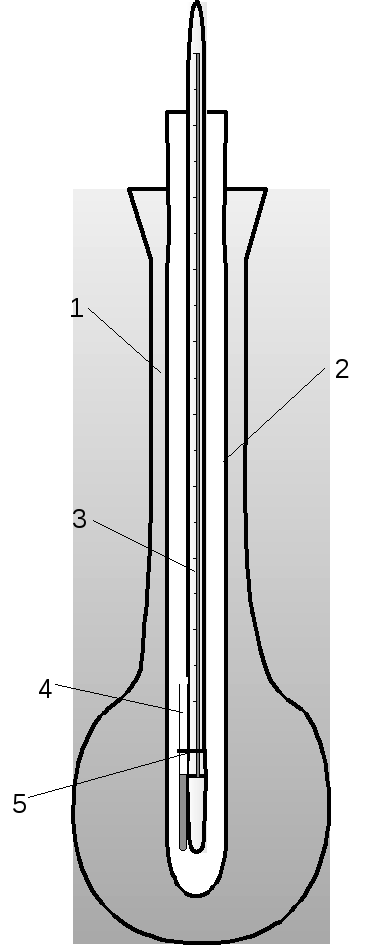
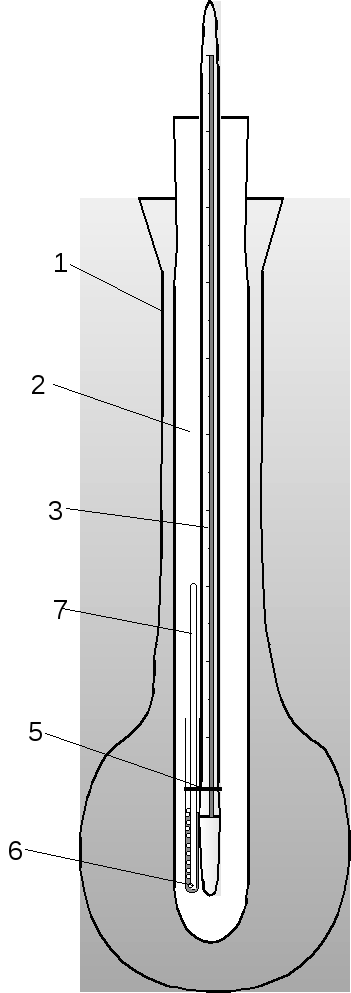
Сиволобова(рисунок 6).
Для его проведения можно использовать
стандартный прибор для определения
температуры плавления, описанный выше
(рисунок 5). В запаянную с одного конца
тонкостенную стеклянную трубку (6) –
диаметр ~ 3 мм – помещают каплю жидкости.
В трубку опускают капилляр (4), запаянный
с верхнего конца, прикрепляют трубку к
термометру резинкой (5) и нагревают в
приборе до тех пор, пока из капилляра
не начнут выходить пузырьки непрерывной
струей. Отмечают температуру, при которой
началось непрерывное выделение пузырьков.
Она соответствует температуре кипения
жидкости. Обязательно записывают
атмосферное давление по барометру. По
значению температуры кипения можно
вещество идентифицировать и определить
его чистоту.
|
|
|
|
1 – внешняя стеклянная колба; 2 – 4 – капилляр с веществом; 5 – резиновое |
|
|
Рисунок 5 – прибор для определения |
Рисунок 6 – Прибор для определения температуры кипения (по Сиволобову) |
В этой статье обсуждается тема — как определить температуру кипения соединения? Мы все уже должны знать, что температура кипения любого вещества напрямую не зависит от температуры, но именно давление играет жизненно важную роль в определении точки кипения вещества.
Когда мы рассматриваем соединение, оно состоит из более чем одного элемента, каждый из которых имеет свои значения температуры кипения. Как же тогда найти температуру, при которой соединение кипит? Является ли это средним значением отдельных температур кипения или за температуру кипения принимается наибольшее значение? Теперь мы узнаем ответ на этот вопрос в этой статье.
Что вы имеете в виду под точкой кипения?
Температура кипения вещества или соединения – это такое значение температуры, при котором давление паров жидкости/вещества становится равным по величине значению атмосферного давления.
Окружающее давление варьируется от места к месту. Для простоты понимания примем значение атмосферного давления за 1 атм. При давлении в 1 атм вода кипит при 100 градусах Цельсия, в этот момент жидкая вода начинает переходить в газообразное состояние, то есть в пар. Давайте обсудим больше о температуре кипения в следующих разделах.
Как найти наивысшую температуру кипения соединения?
Температура кипения соединения зависит от многих факторов. Если мы хотим найти соединение с более высокой температурой кипения, мы обращаемся к следующим факторам:
- Межмолекулярные силы– Межмолекулярные силы – это те силы, которые действуют между элементами молекул. Трудно кипятить элементы, обладающие высокими межмолекулярными силами, потому что силы притяжения не позволяют легко разрывать связи. Элементы могут иметь много типов связей, это ионная связь, диполь-дипольные взаимодействия, сила Ван-дер-Ваальса и водородная связь. Самая сильная связь – ионная связь, самая слабая – сила Ван-дер-Ваальса.
- Молекулярная масса– Чем крупнее молекула, тем больше склонность к поляризации. А когда склонность к поляризации возрастает, нам потребуются дополнительные усилия, чтобы вскипятить вещество. Причина этого в том, что силы притяжения увеличиваются по величине, когда элемент становится все более и более полярным.
- Форма— Если соединение имеет очень длинную цепочку атомов, это приведет к большей площади поверхности. Из-за большей площади поверхности сила притяжения Ван-дер-Вааль также увеличивается, следовательно, температура кипения также увеличивается. Но когда имеет место разветвление, силы отталкивания побеждают силы притяжения. Следовательно, при разветвлении температура кипения снижается.
Кредиты изображения: Точка кипения
Как найти самую низкую температуру кипения соединения?
Мы уже обсуждали, как определить, будет ли температура кипения высокой или нет. Мы можем использовать те же факторы, чтобы узнать, будет ли температура кипения низкой или нет.
Факторы включают межмолекулярные силы, которые в основном бывают четырех типов: ионная связь, сила Ван-дер-Ваала, водородная связь и диполь-диполь. Затем другими факторами являются форма и молекулярная масса соединения. В предыдущих разделах мы уже видели, насколько сильно эти факторы влияют на температуру кипения соединений.
Как найти температуру кипения химического соединения?
Точку кипения любого химического соединения можно определить, выполнив следующие действия. Рассмотрим пример, в котором мы берем решение. Раствор состоит из растворенного вещества и растворителя. Уравнение, которое мы будем использовать, называется уравнением Клаузиуса Клапейрона.
Уравнение выглядит следующим образом:
Как найти температуру кипения органического соединения?
Мы можем определить температуру кипения органического соединения, проведя простой эксперимент. Эксперимент обсуждается в разделе, приведенном ниже. Мы сразу перейдем к процедурной части эксперимента.
- Пробирку наполняют на 2/3rd высота с органическим соединением, температура кипения которого должна быть определена.
- Затем с помощью резинки пробирку перевязывают термометром таким образом, чтобы колба термометра совпадала с дном пробирки.
- Парафиновую жидкость наливают в химический стакан, который затем держат на горячей плите.
- Пробирку вместе с термометром погружают в этот разогревающийся парафин.
- Берется капиллярная трубка, которую запаивают, нагревая на бунзеновской горелке.
- Открытый конец погружается внутрь пробирки.
- Мы наблюдаем, как пузырьки выходят из открытого конца капиллярной трубки, и через некоторое время пузырьки начинают выходить с большей скоростью. Отметьте температуру как t1, показанную на термометре.
- Теперь выключите плитку и дайте парафиновой жидкости остыть, пузырьки перестанут выходить из капиллярной трубки.
- Теперь запишите эту температуру как t2.
- Среднее значение t1 и t2 представляет собой температуру кипения органического соединения.
Какое соединение имеет самую высокую температуру кипения?
Этанол или этиловый спирт имеют самые высокие точка кипения. Это происходит из-за сильного влияния силы Ван-дер-Ваальса и диполь-дипольных взаимодействий. Эти силы являются частью сильных сил притяжения между молекулами.
Указанные силы являются частью межмолекулярных сил притяжения. Эти силы связывают атомы вместе с большей силой. Нам нужна большая энергия, чтобы разорвать эти связи, поэтому температура кипения соединения также становится выше. Мы обсудили влияние этих факторов на температуру кипения.
Какое органическое соединение имеет самую высокую температуру кипения?
Когда мы говорим об органических соединениях, пропан-1-ол или пропанол имеют самую высокую температуру кипения. Это объясняется присутствием в соединении сильных Н-связей и ОН-группы.
Н-связь также привлекательна по своей природе. Из-за водородных связей, присутствующих внутри пропанола, энергия, необходимая для кипения, увеличивается, поскольку водородные связи слишком прочны и их нелегко разрушить. Если бы водородные связи были слабее, то энергия, необходимая для разрыва связей, была бы меньше, и ее можно было бы легко вскипятить.
Температура кипения это температура, при которой давление паров жидкости равно давлению окружающей среды, и жидкость превращается в пар.
Явление кипения зависит от давления, и, следовательно, температура кипения жидкости может изменяться в зависимости от окружающего давления.
Например, из-за изменения атмосферного давления на разных высотах вода закипает при температуре 100°C (212°F) на уровне моря, но при температуре 93,4°C (200,1°F), на высоте 1 905 метров (6 250 футов).
При заданном давлении разные жидкости будут кипеть при разных температурах.
Что такое температура кипения
Мы знаем, что чистая вода кипит при температуре 100°C при давлении 1 атм, но интересная вещь происходит с температурой кипения, если мы добавляем в эту воду небольшое количество соли.
Экспериментально доказано, что добавление в жидкость любой формы нелетучего растворимого вещества повышает ее температуру кипения.
Величина, на которую изменяется температура кипения, прямо пропорциональна количеству добавляемого растворимого вещества.
Пусть T0b обозначает температуру кипения чистой жидкости, а Tb обозначает температуру кипения раствора (растворенное вещество + чистая жидкость). Затем,
Tb m
Tb = Kb m
Где ΔTb = T0b − Tb — повышение температуры кипения,
‘m’ — это молярность,
‘Kb’ — это молярная высота, температура кипения или эбуллиоскопическая константа, значение которой зависит только от растворителя
Далее уравнение можно записать в виде,
ΔTb = (1000 × Kb × w) / (M × W)
где ‘вес растворенного вещества ‘ — молярная масса растворенного вещества, а » W’ — вес растворителя в граммах.
Пример решения задачи на температуру кипения
Пример: Каково повышение температуры кипения, когда 147 г молочной кислоты (C6H105) растворяется в 647г циклогексана (C6H12)? Постоянная температура кипения циклогексана составляет 2,79°C/м.
Решение: Определите молярность раствора молочной кислоты
m = (147 г / 162,14 г/моль) / 0,647 кг = 1,40127
ΔTb = Kb m
ΔTb = (2,79°C, кг моль-1) (1,40127 моль/кг)
ΔTb = 3,91°C
Зависит ли температура кипения от примесей
Когда в кипящую жидкость добавляется примесь или растворенное вещество (нелетучее), температура ее кипения увеличивается.
Это указывает на то, что растворы, как правило, имеют более высокую температуру кипения по сравнению с чистыми растворителями.
Например, если вы добавите в кипящую воду нелетучие примеси, такие как немного сахара или щепотку соли, ее температура кипения повысится.
Пример решения задачи на зависимость температуры кипения от примесей
Вопрос: Раствор 10,0 г нелетучего, не диссоциирующего соединения, растворенный в 0,200 кг бензола, кипит при 81,2 °C. Рассчитайте молекулярную массу соединения.
Эбуллиоскопическая постоянная для бензола: 2,53 °C/м и температура кипения чистого бензола: 80,1°C
Примеры ответов:
- 115 г/моль
- 145 г/моль
- 120 г/моль
- 100 г/моль
Ответ: (а)
Решение:
ΔTb = (1000 × Kb × w) / (M × W)
1.1 = (1000×2,53×10) / (М×200)
M = 115 г/моль
Интересные факты о температуре кипения
- Знаете ли вы, что если вы подниметесь на гору, то обнаружите, что температура кипения там снижается? Это происходит главным образом потому, что чем выше температура, тем больше пара вы найдете!
- Вы можете вскипятить воду, чтобы использовать ее в качестве дезинфицирующего средства. Да! Это связано с тем, что при кипячении воды микроорганизмы и бактерии повреждаются из-за ее обжигающего тепла, в результате чего ее можно легко использовать как отличный способ дезинфекции и очистки вашего дома. Всего около минуты кипячения воды достаточно, чтобы убить микроорганизмы.
- Как известно, растворитель-это жидкость, которую можно использовать для разбавления и/или растворения раствора. Но знаете ли вы, что вода-отличный и мощный растворитель? Ряд соединений может быть растворен с использованием воды. Например, люди часто используют его в качестве растворителя для своих напитков, таких как кофе и/или чай.
- Хотя добавление различных типов растворенных веществ в воду, когда она кипит, имеет тенденцию изменять ее температуру кипения, увеличивая ее, спирт является типом летучего растворенного вещества, которое при добавлении в него в конечном итоге снижает температуру кипения воды.
- Вода имеет тенденцию кипеть при относительно более низкой температуре, когда она кипит на большей высоте.
Часто задоваемы вопросы отверы о температуре кипения?
Температура кипения некоторых веществ?
- Температура кипения воды — 100 °C
- Температура кипения спирта — 78, 39 °C
- Температура кипения масла — средняя температура 120-150°C
- Температура кипения сахара — 190 °C
- Температура кипения антифриза — от 108 до 125 °C
- Температура кипения молока — 100,5 °С
- Температура кипения железа — 2862 °C
- Температура кипения меди — 2567 °С
- Температура кипения ртути — 356, 58 °C
Каковы основные аспекты, от которых, как правило, зависит температура кипения жидкости?
Температура, атмосферное давление и давление паров жидкости являются тремя основными факторами, на которых основана температура кипения конкретной жидкости.
Пар имеет тенденцию увеличиваться с повышением температуры, что соответственно влияет на температуру кипения жидкости.
Атмосферное давление, как правило, влияет на температуру кипения совершенно аналогичным образом, поскольку чем больше давление, тем выше будет температура кипения.
И давление пара столь же важно, потому что чем выше это давление, тем быстрее жидкость испарится.
Какой элемент имеет самую низкую и самую высокую температуру кипения?
Вода имеет самую высокую температуру кипения — 100°C. Молекулы, присутствующие в воде, могут объединяться, образуя прочные водородные связи друг с другом.
И в результате образующаяся межмолекулярная сила настолько сильна, что требуется огромное количество энергии, чтобы разделить ее на части. Именно по этой причине вода имеет высокую температуру кипения.
Жидкий гелий, с другой стороны, имеет самую низкую температуру кипения — 4,2°C выше абсолютного нуля.
Это происходит потому, что связи, которые образует этот элемент, слабее по своей природе и требуют меньше энергии, поэтому его температура кипения так низка.
Кипит ли вода быстрее, чем масло?
Нет, вода не кипит быстрее масла. На самом деле все наоборот. Это связано в первую очередь с тем, что масло обладает относительно меньшей теплоемкостью по сравнению с водой, в результате чего для достижения определенных температур также требуется половина энергии.
А кипячение воды занимает больше времени, потому что для этого требуется очень много энергии.
Однако это означает, что масло, которое мы обычно используем для приготовления пищи, замедляет весь процесс приготовления по той же причине.
Влияют ли примеси на температуру кипения жидкости? Если да, то каким образом?
Да, примесь будет влиять на температуру кипения жидкости, увеличивая ее. Когда в жидкость добавляется примесь, давление ее паров, скорее всего, снизится, что приведет к повышению температуры ее кипения.
Например, если вы кипятите воду на плите и добавляете в нее даже щепотку соли, вы заметите, что температура кипения воды увеличится. Однако в случае температуры плавления жидкости примеси только снижают ее.