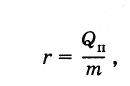«A watched pot never boils» may seem like the ultimate truism when cooking, but under the right circumstances, the pot boils even faster than expected. Whether camping or chemistry, predicting the boiling point can be challenging.
TL;DR (Too Long; Didn’t Read)
Determining boiling point based on pressure can be accomplished using equations, estimation, nomographs, on-line calculators, tables and graphs.
Understanding Boiling Point
Boiling occurs when the vapor pressure of a liquid equals the air pressure of the atmosphere above the liquid. For example, at sea level, water boils at 212°F (100°C). As elevation increases, the amount of atmosphere above the liquid decreases, so the boiling temperature of the liquid decreases. In general, the lower the atmospheric pressure, the lower the boiling temperature of any liquid. Besides atmospheric pressure, the molecular structure and attraction between the molecules of the liquid impacts the boiling point. Liquids with weak intermolecular bonds boil, in general, at lower temperatures than liquids with strong intermolecular bonds.
Calculating Boiling Point
Calculating boiling point based on pressure can be done using several different formulas. These formulas vary in complexity and accuracy. In general, units in these calculations will be in the metric or System International (SI) system, resulting in temperatures in degrees Celsius (oC). To convert to Fahrenheit (oF), use the conversion:
T(^oF)=frac{9}{5}T(^oC)+32
where T means temperature. As for atmospheric pressure, the pressure units cancel out, so which units are used, whether mmHg, bars, psi or another unit, is less important than being sure that all the pressure measurements are the same units.
One formula for calculating the boiling point of water uses the known boiling point at sea level, 100°C, the atmospheric pressure at sea level and the atmospheric pressure at the time and elevation where the boiling takes place.
-
At higher elevations, the lower boiling point of water requires cooking food for longer times to ensure adequate internal temperatures. For safety, use a meat thermometer to check temperatures.
The formula:
BP_{corr}=BP_{obs}-(P_{obs}-760text{ mmHg})times 0.045^otext{C/mmHg}
can be used to find an unknown boiling temperature for water.
In this formula, BPcorr means boiling point at sea level, BPobs is the unknown temperature, and Pobs means the atmospheric pressure at the location. The value 760mmHg is standard atmospheric pressure in millimeters of mercury at sea level and 0.045oC/mmHg is the approximate change in water temperature with each millimeter mercury change in pressure.
If the atmospheric pressure equals 600 mmHg and the boiling point is unknown at that pressure, then the equation becomes
100°text{C}=BP_{obs}-(600text{ mmHg}-760text{ mmHg})times 0.045°text{C/mmHg}
Calculating the equation gives:
100°text{C}=BP_{obs}-(-160text{ mmHg})times 0.045°text{C/mmHg} = BP_{obs}+7.2
The units of mmHg cancel each other out, leaving the units as degrees Celsius. Solved for the boiling point at 600mmHg, the equation becomes:
BP_{obs}=100°text{C}-7.2°text{C}=92.8°text{C}
So the boiling point of water at 600mmHg, an altitude of approximately 6400 feet above sea level, will be 92.8°C, or:
92.8timesfrac{9}{5}+32=199°text{F}
Warnings
Equations for Calculating Boiling Point
The equation detailed above uses a known pressure and temperature relationship with a known change in temperature with change in pressure. Other methods for calculating boiling points of liquids based on atmospheric pressure, like the Clausius–Clapeyron equation:
ln{frac{P_1}{P_2}}=-frac{L}{R}times (frac{1}{T_1}-frac{1}{T_2})
incorporate additional factors. In the Clausius-Clapeyron equation, for example, the equation incorporates the natural log (ln) of the starting pressure divided by the ending pressure, the latent heat (L) of the material and the universal gas constant (R). Latent heat relates to the attraction between molecules, a property of the material that influences the rate of vaporization. Materials with higher latent heats require more energy to boil because the molecules have a stronger attraction to each other.
Estimating Boiling Point
In general, an approximation of the drop in boiling point for water can be made based on altitude. For every 500 feet increase in altitude, the boiling point of water drops about 0.9°F.
Determining Boiling Point Using Nomographs
A nomograph can be also be used to estimate the boiling points of liquids. Nomographs use three scales to predict boiling point. A nomograph shows a boiling point temperature scale, a boiling point temperature at sea level pressure scale and a general pressure scale.
To use the nomograph, connect two known values using a ruler and read the unknown value on the third scale. Start with one of the known values. For example, if the boiling point at sea level is known and the barometric pressure is known, connect those two points with a ruler. Extending the line from the two connected knowns shows what the boiling point temperature at that elevation should be. Conversely, if the boiling point temperature is known and the boiling point at sea level is known, use a ruler to connect the two dots, extending the line to find the barometric pressure.
Using On-Line Calculators
Several on-line calculators provide boiling point temperatures at different elevations. Many of these calculators only show the relationship between atmospheric pressure and the boiling point of water, but others show additional common compounds.
Using Graphs and Tables
Graphs and tables of boiling points of many liquids have been developed. In the case of the tables, the liquid’s boiling point is shown for different atmospheric pressures. In some cases, the table only shows one liquid and the boiling point at various pressures. In other cases, several liquids at different pressures may be shown.
Graphs show boiling point curves based on temperature and barometric pressure. The graphs, like the nomograph, use known values to create a curve or, as with the Clausius-Clapeyron equation, use the natural log of the pressure to develop a straight line. The graphed line shows the known boiling point relationships, given a set of pressure and temperature values. Knowing one value, follow the value line to the graphed pressure-temperature line, then turn to the other axis to determine the unknown value.
Зависимость температуры кипения жидкости от давления
Из приведенных
рассуждений ясно, что температура
кипения жидкости должна зависеть от
внешнего давления. Наблюдения подтверждают
это.
Чем
больше внешнее давление, тем выше
температура кипения. Так, в паровом
котле при давлении, достигающем 1,6 · 106
Па, вода не кипит и при температуре 200
°С. В медицинских учреждениях кипение
воды в герметически закрытых сосудах
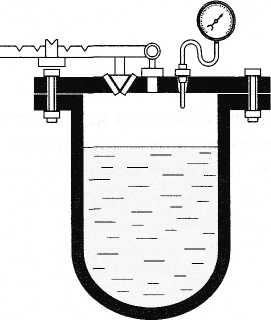
— автоклавах (рис. 6.11) также происходит
при повышенном давлении. Поэтому
температура кипения значительно выше
100 °С. Автоклавы применяют для стерилизации
хирургических инструментов, перевязочного
материала и т. д.
Рис. 6.11
И
наоборот, уменьшая внешнее давление,
мы тем самым понижаем температуру
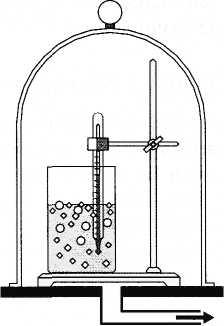
кипения. Под колоколом воздушного насоса
можно заставить воду кипеть при комнатной
температуре (рис. 6.12). При подъеме в горы
атмосферное давление уменьшается,
поэтому уменьшается температура кипения.
На высоте 7134 м (пик Ленина на Памире)
давление приближенно равно 4 · 104
Па (300 мм рт. ст.). Вода кипит там примерно
при 70 °С. Сварить, например, мясо в этих
условиях невозможно.
Рис. 6.12
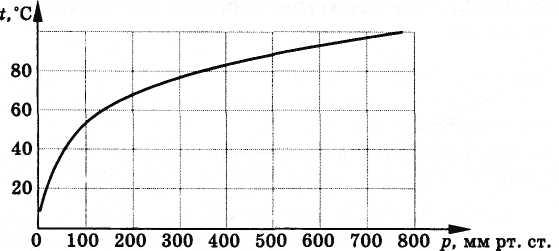
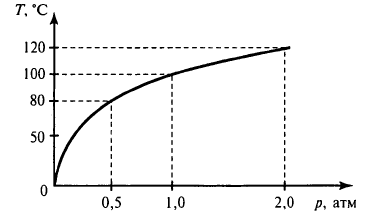
На рисунке 6.13
изображена кривая зависимости температуры
кипения воды от внешнего давления. Легко
сообразить, что эта кривая является
одновременно и кривой, выражающей
зависимость давления насыщенного
водяного пара от температуры.
Рис. 6.13
Различие температур кипения жидкостей
У каждой жидкости
своя температура кипения. Различие
температур кипения жидкостей определяется
различием в давлении их насыщенных
паров при одной и той же температуре.
Например, пары эфира уже при комнатной
температуре имеют давление, большее
половины атмосферного. Поэтому, чтобы
давление паров эфира стало равным
атмосферному, нужно небольшое повышение
температуры (до 35 °С). У ртути же насыщенные
пары имеют при комнатной температуре
совсем ничтожное давление. Давление
паров ртути делается равным атмосферному
только при значительном повышении
температуры (до 357 °С). Именно при этой
температуре, если внешнее давление
равно 105 Па, и кипит ртуть.
Различие температур
кипения веществ находит большое
применение в технике, например при
разделении нефтепродуктов. При нагревании
нефти раньше всего испаряются наиболее
ценные, летучие ее части (бензин), которые
можно таким образом отделить от «тяжелых»
остатков (масел, мазута).
Жидкость закипает,
когда давление ее насыщенного пара
сравнивается с давлением внутри жидкости.
§ 6.6. Теплота парообразования
Требуется ли
энергия для превращения жидкости в пар?
Скорее всего да! Не так ли?
Мы отмечали (см. §
6.1), что испарение жидкости сопровождается
ее охлаждением. Для поддержания
температуры испаряющейся жидкости
неизменной к ней необходимо подводить
извне теплоту. Конечно, теплота и сама
может передаваться жидкости от окружающих
тел. Так, вода в стакане испаряется, но
температура воды, несколько более
низкая, чем температура окружающего
воздуха, остается неизменной. Теплота
передается от воздуха к воде до тех пор,
пока вся вода не испарится.
Чтобы поддерживать
кипение воды (или иной жидкости), к ней
тоже нужно непрерывно подводить теплоту,
например подогревать ее горелкой. При
этом температура воды и сосуда не
повышается, но каждую секунду образуется
определенное количество пара.
Таким
образом, для превращения жидкости в пар
путем испарения или путем кипения
требуется приток теплоты. Количество
теплоты, требующееся для превращения
данной массы жидкости в пар той же
температуры, называется теплотой
парообразования этой жидкости.
На что расходуется
подводимая к телу энергия? Прежде всего
на увеличение его внутренней энергии
при переходе из жидкого состояния в
газообразное: ведь при этом увеличивается
объем вещества от объема жидкости до
объема насыщенного пара. Следовательно,
увеличивается среднее расстояние между
молекулами, а значит, и их потенциальная
энергия.
Кроме того, при
увеличении объема вещества совершается
работа против сил внешнего давления.
Эта часть теплоты парообразования при
комнатной температуре составляет обычно
несколько процентов всей теплоты
парообразования.
Теплота
парообразования зависит от рода жидкости,
ее массы и температуры. Зависимость
теплоты парообразования от рода жидкости
характеризуется величиной, называемой
удельной
теплотой парообразования.
Удельной теплотой
парообразования данной жидкости
называется отношение теплоты
парообразования жидкости к ее массе:
(6.6.1)
где
r
— удельная теплота парообразования
жидкости; т
—
масса жидкости; Qn
— ее теплота парообразования. Единицей
удельной теплоты парообразования в СИ
является джоуль
на килограмм (Дж/кг).
Удельная
теплота парообразования воды очень
велика: 2,256·106
Дж/кг при температуре 100 °С. У других
жидкостей (спирт, эфир, ртуть, керосин
и др.) удельная теплота парообразования
меньше в 3—10 раз.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Данный калькулятор поможет Вам определить температуру кипения воды (°C), удельный объем насыщенного пара (м3/кг) и удельную теплоту парообразования (кДж/кг) при заданном давлении (мбар).
Кипение представляет собой внутреннее парообразование, которое происходит во всем объеме жидкости при температуре, когда давление насыщенного пара равно давлению в жидкости. Согласно исследованиям и уравнению Клапейрона — Клаузиуса, градус кипения напрямую зависит от атмосферного давления, так как кипение происходит, когда давление пара жидкости равно атмосферному давлению над этой жидкостью. Ниже представлен график зависимости температуры кипения воды от деления.
С ростом давления температура кипения увеличивается, а с уменьшением, наоборот, становится все ниже. При нормальном атмосферном давлении 760 мм рт. ст. вода кипит при + 100 °C.
В горной местности давление уменьшается, а под землей (в шахте) увеличивается. Так температура кипения воды на вершине самой высокой горы Эверест будет составлять примерно 69 °C.
Выберите способ ввода данных:
Температура кипения воды при этом давлении:
Удельный объем насыщенного пара:
Удельная теплота парообразования:
Зависимость температуры кипения воды от давления
Калькулятор рассчитывает температуру кипения воды в зависимости от давления воздуха
Статьи, описывающие этот калькулятор
- Зависимость температуры кипения воды от высоты над уровнем моря
Зависимость температуры кипения воды от давления
Давление воздуха, мм.рт.ст.
Точность вычисления
Знаков после запятой: 1
Ссылка скопирована в буфер обмена
Похожие калькуляторы
- • Зависимость температуры кипения воды от высоты над уровнем моря
- • Зависимость давления от высоты над уровнем моря
- • Давление насыщенного водяного пара
- • Уравнение Клапейрона-Менделеева. Связь между числом молей газа, его температурой, объемом и давлением.
- • Абсолютная влажность воздуха и относительная влажность воздуха
- • Раздел: Физика ( 52 калькуляторов )
PLANETCALC, Зависимость температуры кипения воды от давления