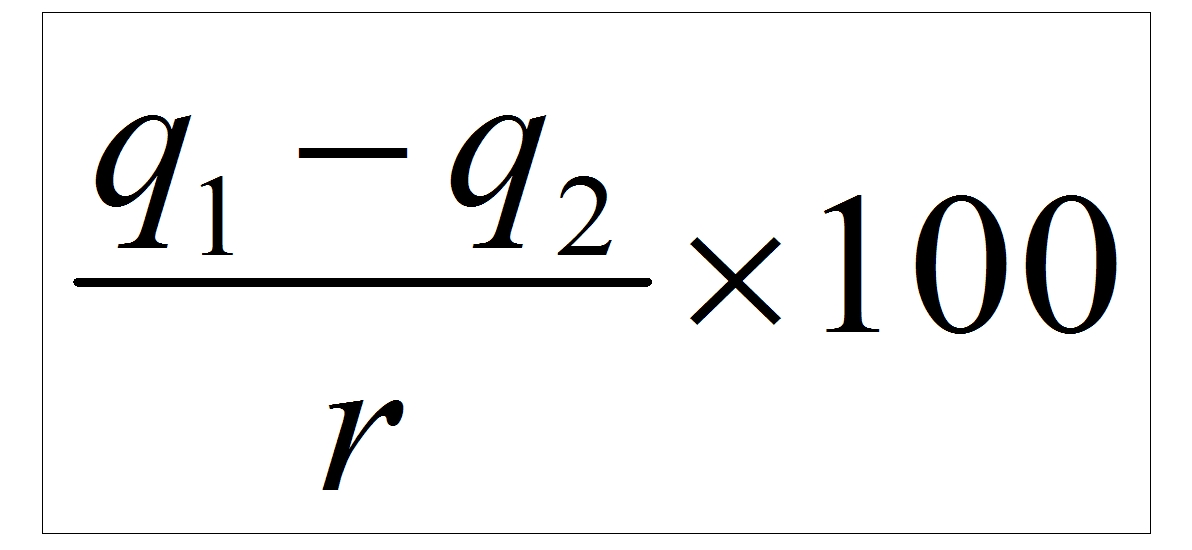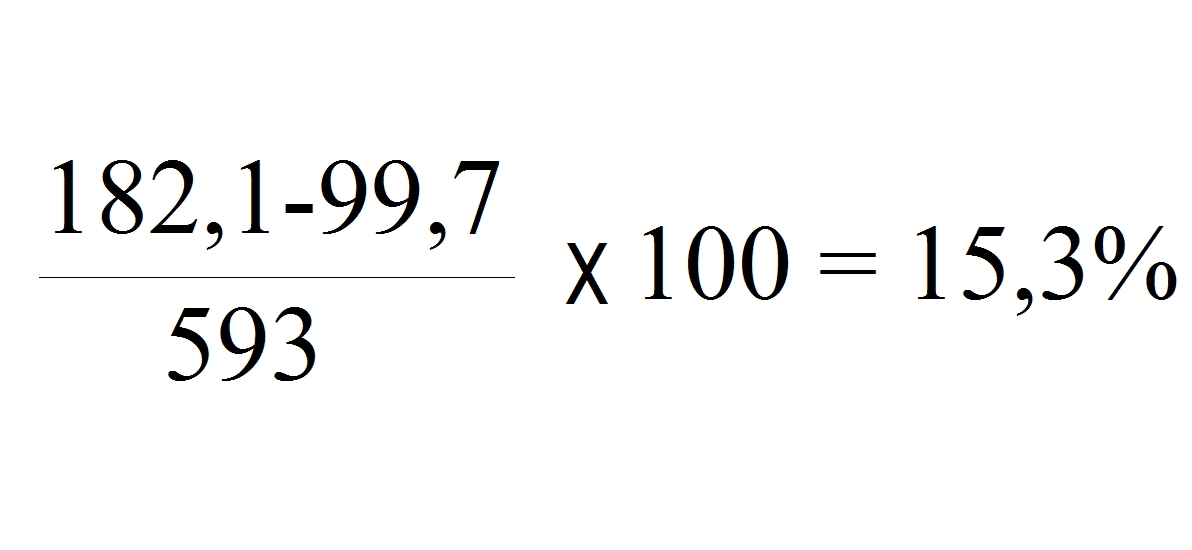Насыщенный пар имеет несколько важных параметров, одним из которых является температура.
В статье подробно описана эта характеристика, приведены зависимости различных параметров пара от его температуры, рассказывается о расчете.
Содержание
- Что это за параметр, как он обозначается?
- От чего зависит?
- При какой t° водяной пар станет насыщенным?
- Какова максимальная и минимальная?
- Таблица зависимости
- Как найти температуру насыщения водяного пара
- Формула и правила расчета
- Несколько примеров
- Параметры, которые зависят от температуры НП
- Масса
- Упругость
- Давление
- Плотность
- Применение знаний на практике
- Видео по теме статьи
- Заключение
Что это за параметр, как он обозначается?
Температурой является скалярная величина, обозначающая степень нагретости тела или газа.
Для насыщенного пара свойственна степень нагретости, величина которой зависит от температуры воды. Это связано с основной характеристикой насыщенного пара – термодинамическим равновесием со своей водой.
Температура насыщенного пара равна температуре жидкости. В физике, единицей измерения температуры насыщенного пара принято считать Цельсий. В формулах и описании различных характеристик она обозначается буквой «t» или значком «°C».
Температура насыщенного пара также может рассчитываться в Кельвинах. При этом данный параметр обозначается буквой «К». При расчетах стоит учитывать, что 1°C = 274 К.
От чего зависит?
На температурный параметр насыщенного пара воздействуют различные факторы:
- Химическое свойство вещества. Различные химические элементы имеют отличные параметры нагретости для кипения. Например, водород закипает при -253 градусах, а вода при 100°C.
- Величина атмосферного давления. С увеличением давления повышается температура парообразования.
- Плотность. Зависимость прослеживается недолгое время. При низкой плотности, между молекулами пара остается воздушное пространство с разностью температуры. Часть нагретости пара отдается воздуху, что снижает температуру самого пара. При увеличении плотности температура стабилизируется.
- Степень насыщения жидкостью. Эта зависимость прослеживается на момент дисбаланса термодинамического равновесия и до появления конденсации. Также существует зависимость температуры пара от внешней температуры. Чем она ниже, тем выше конденсация.
График:
При какой t° водяной пар станет насыщенным?
Насыщенным водяной пар становится при достижении термодинамического равновесия со своей водой. Нижним порогом считается +1°C в закрытом сосуде, а верхний – при +100°C. Тут прослеживается зависимость от давления.
Величина атмосферного давления в 100 кПа позволяет доводить воду до кипения при 100 °C. Образование насыщенного пара при высокой температуре зависит от интенсивности подвода тепла к жидкости.
Насыщенный пар может образовываться и при +1. В этом случае образование насыщенного пара зависит от отвода тепла от жидкости.
И в том и в другом случае, вода и образованный пар должны находится в закрытом сосуде и в термодинамическом равновесии между собой.
Какова максимальная и минимальная?
Максимальной температурой насыщенного пара может быть значение, равное температуре кипения его жидкости. Если данный параметр пара превышает температуру кипения жидкости, пар переходит в состояние перегретого.
Например:
- Нижний порог образования, насыщенного водяного пара составляет +1 градус в закрытом сосуде. При 0 градусов осуществляется фазовый переход воды из жидкого состояния в твердое. С поверхности льда также может образоваться насыщенный пар, но уже в температурном равновесии со льдом.
- Верхней температурной точкой является значение 100 градусов в Земном атмосферном давлении. Повышение температуры пара приведет к дисбалансу термодинамического равновесия и переходу в состояние перегретого пара.
При измерении верхней и нижней температурной точки образования насыщенного пара стоит учитывать свойства и химическую структуру самого вещества, а также параметры давления.
Таблица зависимости
Зависимость различных параметров насыщенного пара от его температуры приведена ниже.
| °C | ABS — кгс/см2 | U — м3/кг | P — кг/м3 | hf-кДж/кг | h — кДж/кг | L — кДж/кг |
| 0 | 0,006 | 206 | 0,004 | 0 | 2493 | 2493 |
| 5 | 0,008 | 147 | 0,006 | 20 | 2502 | 2481 |
| 10 | 0,01 | 106 | 0,009 | 41 | 2512 | 2470 |
| 20 | 0,02 | 57 | 0,01 | 83 | 2532 | 2448 |
| 30 | 0,04 | 32 | 0,03 | 125 | 2551 | 2425 |
| 40 | 0,07 | 19 | 0,05 | 167 | 2570 | 2403 |
| 50 | 0,12 | 12 | 0,08 | 209 | 2589 | 2380 |
| 60 | 0,20 | 7,6 | 0,13 | 251 | 2608 | 2356 |
| 70 | 0,31 | 5, | 0,19 | 293 | 2626 | 2333 |
| 80 | 0,48 | 3,41 | 0,2 | 335 | 2644 | 2310 |
| 90 | 0,71 | 2,3 | 0,4 | 377 | 2662 | 2285 |
| 100 | 1,03 | 1,6 | 0,5 | 419 | 2679 | 2260 |
| 374 | 225 | 0,0031 | 332 | 2100 | 2100 | 0 |
Согласно таблице, можно проследить следующие зависимости от температурного параметра:
- рост абсолютного давления пара (ABS);
- снижение его объема (U);
- увеличение плотности (P);
- увеличение энтальпии жидкости (hf) и энтальпии пара (h);
- снижение удельной теплоты парообразования (L).
Исключением является температурный порог сверхкритической воды 374 градуса. При такой температуре прослеживается: равенство энтальпии пара и воды, полное отсутствие удельной теплоты парообразования.
Как найти температуру насыщения водяного пара
Расчет температуры насыщенного водяного пара помогает определить множество параметров при проектировании различных паровых систем и оборудования.
Формула и правила расчета
Расчет температуры насыщенного пара выполняется по формуле:
Выражение состоит из следующих значений:
- «T» — температура насыщенного пара.
- «P» — давление.
- «V» — общий объем.
- «v» — количество полученного вещества.
- «R» — значение газовой постоянной.
Данное выражение является производным из формулы Менделеева-Клапейрона для идеальных газов.
Несколько примеров
Задача:
- Давление 8000 Па.
- Объем пара 5,3 М3.
- Количества вещества 6 моль.
- Газовая постоянная 8,31 кДж.
- Температура пара в Кельвинах (К) неизвестна.
Решение:
Температура пара будет равна 850 градусов Кельвина.
Задача:
- Давление 500 кПа.
- Объем пара 9,7 М3.
- Количество вещества 9 моль.
- Газовая постоянная 8,31 кДж.
- Температура неизвестна.
Решение:
Температура насыщенного пара, при данных параметрах 65 градуса Цельсия.
Параметры, которые зависят от температуры НП
Рассмотрим, какое влияние оказывает температура насыщенного пара на различные параметры.
Масса
С повышением температуры масса пара снижается. При термодинамическом равновесии, это происходит за счет процесса конденсации. Часть пара возвращается обратно в воду. При перегреве, вода из пара полностью выпаривается, что приводит также к уменьшению массы.
Упругость
При повышении температуры заметно увеличивается упругость пара. Это связано с увеличением плотности и степени насыщения. Также упругость зависит от величины капель конденсации. Чем они больше, тем больше упругость.
Давление
С повышением температуры давление возрастает, так как ускоряется процесс парообразования и скорость движения молекул. Чем выше температура, тем скорость движения выше.
Плотность
Она увеличивается при нагревании и уменьшается при охлаждении. Связано это также с увеличением скорости парообразования при нагревании.
Применение знаний на практике
Знания о влиянии температуры на характеристики насыщенного пара используются в промышленности. Например, системы отопления регулируются за счет изменения температуры, что позволяет контролировать массу и давление пара.
Также эти знания используются при работе с химически вредными жидкостями. Зная температуру испарения, можно значительно снизить время и затраты при очистке или разделении веществ лабораторным путем.
Видео по теме статьи
Зависимость давления насыщенного пара от температуры рассмотрена в видео:
Заключение
Температура насыщенного пара всегда должна быть равной температуре жидкости. От этого зависит степень насыщения и термодинамическое равновесие пара и жидкости. Только такие условия сохраняют пар в насыщенном состоянии.
Калькулятор определяет параметры насыщенного водяного пара по заданному давлению пара. На основании выбранных параметров насыщенного пара определяются:
-
- температура насыщенного пара (по табличным данным) на линии насыщения;
- плотность насыщенного пара (по табличным данным) на линии насыщения;
- удельная теплота парообразования/удельная энтальпия насыщенного пара (по табличным данным) на линии насыщения;
- удельный объем насыщенного водяного пара (расчет) на линии насыщения;
- удельный объем насыщенного водяного пара (расчет) с учетом степени сухости пара;
- удельная энтальпия воды (расчет) на линии насыщения;
- удельная энтальпия насыщенного пара (расчет) с учетом степени сухости пара;
- масса пара в трубопроводе (расчет);
- масса пара в сосуде/оборудовании (расчет);
- скорость пара в трубопроводе (расчет);
- рекомендуемая скорость пара в трубопроводе (справочные данные).
Определение свойств насыщенного пара.
Определение параметров инженерных систем исходя из выбранных свойств насыщенного пара.
Для выполнения расчета необходимо задать исходные данные выше.
Примечание.
Расчет составлена на базе справочных данных («Таблицы теплофизических свойств воды и водяного пара», Издательство МЭИ, 1999 г.) приведенных в табличном виде.
Степень сухости пара – массовая доля сухого насыщенного пара в влажном. Обычно сухость пара обозначается буквой — Х. Безразмерная величина. Данная величина может быть отрицательной для недогретой до кипения воды и превосходить единицу для перегретого пара. Для насыщенного пара находится в пределах от 0 до 1. При степени сухости насыщенного пара Х=1 пар называют сухой насыщенный пар (СНП). При степени сухости насыщенного пара от 0 до 1 пар называют влажный насыщенный пар.
При эксплуатации паровых котлов, паропроводов, турбин, машини и т.д. стремятся к получению и использованию СНП. Повышение влажности пара (y, y=(1-x)), ведет к увеличению эксплуатационных затрат.
В комментарии к калькулятору приветствуются пожелания, замечания и рекомендации по улучшению программы.
Поделиться ссылкой:
The boiling point of a substance is the temperature at which the substance changes state from liquid state to gas state. The boiling point of a liquid varies depending on the surrounding atmospheric pressure, but it is usually close to the melting point of the solid form of the same substance.
How is Boiling Point Determined?
Boiling point of a substance can be determined by using a Boiling Point Apparatus. This method uses the fact that liquids boil when their vapor pressure equals the atmospheric pressure. The apparatus consists of a container of liquid, a heater, and a mercury manometer. First, the liquid is placed in the container and heated until its vapors fill the container. The mercury manometer is then used to measure the atmospheric pressure inside the container. When the mercury column in the manometer reaches the same level as the liquid in the container, this indicates that the vapors have reached atmospheric pressure and the boiling point has been reached.
Boiling point of Water
Boiling point of water is the temperature at which the liquid water becomes water vapor. The boiling point of water is 212 degrees Fahrenheit using Fahrenheit to Celsius conversion (100 degrees Celsius). The boiling point of water is also known as the “saturation temperature.”
Boiling Point Formula of Liquid
The boiling point of a liquid is the temperature at which the liquid changes state from a liquid to a gas. The boiling point of a liquid is also the temperature at which the vapor pressure of the liquid is equal to the atmospheric pressure. The boiling point of a liquid is affected by the atmospheric pressure, which is why boiling points are usually given at standard atmospheric pressure.
The boiling point of a liquid is the temperature at which the vapor pressure of the liquid is equal to the atmospheric pressure.
The boiling point depends on the pressure of the surrounding atmosphere. When the atmospheric pressure is equal to the vapor pressure of the liquid, the liquid will boil. The boiling point also depends on the purity of the liquid, impurities lower the boiling point of a liquid.
Example: Water boils at 100 degrees Celsius (212 degrees Fahrenheit) at sea level, but only at 93 degrees Celsius (199.4 degrees Fahrenheit) at an altitude of 2,438 meters (8,000 feet).
The formula for calculating the change in the boiling point is:
Kb = RTb2M / ΔHv
where,
Kb is the boiling point constant
R is the universal gas constant (8.314 J/mol-K)
Tb is the boiling point of the liquid
M is the molar mass of the liquid
ΔHv is the heat of vaporization for the particular liquid (2260 J/kg: latent heat of vaporization of water)
Properties of Boiling Point
Following are the properties of the boiling point:
- Boiling point of a liquid varies depending on the surrounding pressure. For example, water boils at 100°C (212°F) at sea level, but only at 93°C (199°F) at an altitude of 1,000 m (3,281 ft).
- Boiling point of a liquid can also be affected by the presence of other substances in the liquid. For example, the boiling point of water is lower when salt is added to it.
- Boiling point of a liquid is a measure of the liquid’s ability to change state from a liquid to a gas. The higher the boiling point, the greater the liquid’s ability to resist changes in state.
- Boiling point of a liquid is also a measure of the liquid’s ability to vaporize. The higher the boiling point, the greater the liquid’s ability to resist vaporization.
- Boiling point of a liquid is a function of the liquid’s vapor pressure. The vapor pressure is the pressure exerted by the vapor of the liquid on the walls of the container.
- Boiling point of a liquid is also a function of the liquid’s volatility. The volatility of a liquid is a measure of the liquid’s ability to vaporize.
- Boiling point of a liquid is affected by the surrounding pressure. The higher the surrounding pressure, the higher the boiling point.
Factors Affecting the Boiling Point of Liquid
The boiling point of a liquid is the temperature at which it changes from a liquid to a gas. The factors that affect the boiling point of a liquid are its pressure, temperature, and purity.
- Purity: The higher the purity of a liquid, the higher its boiling point. This is because impurities lower the vapor pressure of a liquid, making it easier for the liquid to boil.
- Pressure: The boiling point of liquid increases as the pressure on the liquid increases. This is because the vapor pressure of a liquid increases as the pressure on the liquid increases.
- Temperature: The boiling point of a liquid also increases as the temperature around the liquid increases.
How to Find the Boiling Point of a Substance?
To determine the boiling point of a substance, we need to heat the substance until it reaches its boiling point. The boiling point of a substance is defined as the temperature at which the liquid changes its state to gas form. At this temperature, the vapor pressure of the liquid is equal to the atmospheric pressure.
We use a thermometer to measure the temperature of the substance as it is heated. As the substance approaches its boiling point, we will notice that the rate of heating will begin to slow down. This is because the heat is being used to convert the liquid into a gas, rather than increase the temperature of the liquid.
Once the substance reaches its boiling point, it will begin to boil. You can then remove the thermometer and checked the temperature to get the boiling point.
Also, Check
- Molarity
- Mole Concept
- Difference Between Molarity and Molality
Solved Examples on Boiling Point Formula
Example 1: Find the Kb of LiCl if 2 g of LiCl is dissolved in 500 g of water which boils at 100.6°C.
Solution:
Given,
Mass of LiCl = 2 g
Molar mass of LiCl = 42 g/mol
Mass of water = 500 g
Molar mass of water = 18 g/mol
Boiling point of solution = 100.6°CR = 8.314 J/mol-K (Universal gas constant)
Tb = 100.6 + 273 = 373.6 K (Boiling point in Kelvin)
V = 500 / 1000 = 0.5 L (Volume in litres)
M = (2 / 42) + (500 / 18) = 25 mol/L (Molality)
Hv= 2260 J/kg (latent heat of vaporization of water)Kb = RTb2M / ΔHv
= 8.314 × 373.6 × 0.5 × 25 / 2260
= 68.7 molal
Example 2: Find the boiling point of 1 molar solution of sucrose.
Solution:
Given,
Molarity of solution (M) = 1 mol/L
Boiling point elevation (ΔTb) = 100°C (the Kb for sucrose is 100°C/m)
R = 8.314 J/mol-K (universal gas constant)Tb = 100 + 273 = 373 K (boiling point in Kelvin)
Kb = RTb2M / ΔHv
= 8.314 × 373 × 2 × 1 / 2260
= 2.74 molal
Example 3: Find the Kb of the glucose if the solution of glucose in water boils at 103°C when the concentration of the solution is 0.5 molar.
Solution:
Given,
Concentration of solution (c) = 0.5 molar
Boiling point elevation (ΔTb) = 103°C (the Kb for sucrose is 100°C/m)R = 8.314 J/mol-K (universal gas constant)
Tb = 103 + 273 = 376 K (boiling point in Kelvin)
Kb = RTb2M / ΔHv
= 8.314 × 376 × 2 × 0.5 / 2260
= 1.38 molal
FAQs on Boiling Point
Question 1: What is the boiling point of the liquid?
Answer:
The boiling point of a liquid is the temperature at which the liquid changes state from a liquid to a gas.
Question 2: What factors affect the boiling point of a liquid?
Answer:
The boiling point of a liquid is affected by the pressure of the surrounding atmosphere, the purity of the liquid, and the presence of any dissolved solids.
Question 3: How does the boiling point of a liquid change with altitude?
Answer:
The boiling point of a liquid decreases with the rise in altitude. This is because the atmospheric pressure is lower at higher altitudes, and the boiling point of a liquid is inversely affected by the pressure of the surrounding atmosphere.
Question 4: How does the boiling point of a liquid change with the addition of solids?
Answer:
The boiling point of liquid increases with the addition of solids. This is because the solids take up space in the liquid, and the liquid must heat up to a higher temperature in order to vaporize.
Question 5: What is the boiling point of alcohol?
Answer:
The boiling point of alcohol is 78.37 degrees Celsius (172 degrees Fahrenheit).
Question 6: What is the boiling point of mercury?
Answer:
The boiling point of mercury is 356.7 degrees Celsius (673 degrees Fahrenheit.
Last Updated :
17 Jan, 2023
Like Article
Save Article
Свойства пара
СВОЙСТВА НАСЫЩЕННОГО ПАРА
Что это такое и как им пользоваться
Численные значения параметров теплоты, а также взаимосвязь между температурой и давлением, приведенные в настоящем Руководстве, взять из Таблицы «Свойства насыщенного пара».
Определение применяемых терминов:
Насыщенный пар
Чистый пар, температура которого соответствует температуре кипения воды при данном давлении.
Абсолютное давление
Абсолютное давления пара в барах (избыточное плюс атмосферное).
Зависимость между температурой и давлением
Каждому значению давления чистого пара соответствует определенная температура. Например: температура чистого пара при давлении 10 бар всегда равна 180°С.
Удельный объём пара
Масса пара, приходящаяся на единицу его объёма, кг/м3.
Теплота кипящей жидкости
Количество тепла, которое требуется чтобы повысить температуру килограмма воды от 0°С до точки кипения при давлении и температуре, указанных в Таблице. Выражается в ккал/кг.
Скрытая температура парообразования
Количество тепла в ккал/кг, необходимое для превращения одного килограмма воды при температуре кипения в килограмм пара. При конденсации одного килограмма пара в килограмм воды высвобождает такое же самое количество теплоты. Как видно из Таблицы, для каждого сочетания давления и температуры величина этой теплоты будет разной.
Полная теплота насыщенного пара
Сумма теплоты кипящей жидкости и скрытой теплоты парообразования в ккал/кг. Она соответствует полной теплоте, содержащейся в паре с температурой выше 0°С.
Как пользоваться таблицей
Кроме определения зависимости между давлением и температурой пара, Вы, также, можете вычислить количество пара, которое превратится в конденсат в любом теплообменнике, если известно передаваемое им количество теплоты в ккал. И наоборот, Таблицу можно использовать для определения количества переданной теплообменником теплоты если известен расход образующегося конденсата.
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
Абсолют. Давление бар |
Температ пара °C |
Уд.объем пара м3/кг |
Плотность пара кг/м3 |
Теплота жидкости ккал/кг |
Скрытая теплота парообра- зования ккал/кг |
Полная теплота пара |
|
P |
t |
V |
7 |
q |
r |
X=q+r |
|
0,010 |
7,0 |
129,20 |
0,007739 |
7,0 |
593,5 |
600,5 |
|
0,020 |
17,5 |
67,01 |
0,01492 |
17,5 |
587,6 |
605,1 |
|
0,030 |
24,1 |
45,67 |
0,02190 |
24,1 |
583,9 |
608,0 |
|
0,040 |
29,0 |
34,80 |
0,02873 |
28,9 |
581,2 |
610,1 |
|
0,050 |
32,9 |
28,19 |
0,03547 |
32,9 |
578,9 |
611,8 |
|
0,060 |
36,2 |
23,47 |
0,04212 |
36,2 |
577,0 |
613,2 |
|
0,070 |
39,0 |
20,53 |
0,04871 |
39,0 |
575,5 |
614,5 |
|
0,080 |
41,5 |
18,10 |
0,05523 |
41,5 |
574,0 |
615,5 |
|
0,090 |
43,8 |
16,20 |
0,06171 |
43,7 |
572,8 |
616,5 |
|
0,10 |
45,8 |
14,67 |
0,06814 |
45,8 |
571,8 |
617,6 |
|
0,20 |
60,1 |
7,650 |
0,1307 |
60,1 |
563,3 |
623,4 |
|
0,30 |
69,1 |
5,229 |
0,1912 |
69,1 |
558,0 |
627.1 |
|
0,40 |
75,9 |
3,993 |
0,2504 |
75,8 |
554,0 |
629,8 |
|
0,50 |
81,3 |
3,240 |
0,3086 |
81,3 |
550,7 |
632,0 |
|
0,60 |
86,0 |
2,732 |
0,3661 |
85,9 |
547,9 |
633,8 |
|
0,70 |
90,0 |
2,365 |
0,4229 |
89,9 |
545,5 |
635,4 |
|
0,80 |
93,5 |
2,087 |
0,4792 |
93,5 |
543,2 |
636,7 |
|
0,90 |
96,7 |
1,869 |
0,5350 |
96,7 |
541,2 |
637,9 |
|
1,00 |
99,6 |
1,694 |
0,5904 |
99,7 |
539,3 |
639,0 |
|
1,5 |
111,4 |
1,159 |
0,8628 |
111,5 |
531,8 |
643,3 |
|
2,0 |
120,2 |
0,8854 |
1,129 |
120,5 |
525,9 |
646,4 |
|
2,5 |
127,4 |
0,7184 |
1,392 |
127,8 |
521,0 |
648,8 |
|
3,0 |
133,5 |
0,6056 |
1,651 |
134,1 |
516,7 |
650,8 |
|
3,5 |
138,9 |
0,5240 |
1,908 |
139,5 |
512,9 |
652,4 |
|
4,0 |
143,6 |
0,4622 |
2,163 |
144,4 |
509,5 |
653,9 |
|
4,5 |
147,9 |
0,4138 |
2,417 |
148,8 |
506,3 |
655,1 |
|
5,0 |
151,8 |
0,3747 |
2,669 |
152,8 |
503,4 |
656,2 |
|
6,0 |
158,8 |
0,3155 |
3,170 |
160,1 |
498,0 |
658,1 |
|
7,0 |
164,9 |
0,2727 |
3,667 |
166,4 |
493,3 |
659,7 |
|
8,0 |
170,4 |
0,2403 |
4,162 |
172,2 |
488,8 |
661,0 |
|
9,0 |
175,4 |
0,2148 |
4,655 |
177,3 |
484,8 |
662,1 |
|
10 |
179,9 |
0,1943 |
5,147 |
182,1 |
481,0 |
663,1 |
|
11 |
184,1 |
0,1774 |
5,637 |
186,5 |
477,4 |
663,9 |
|
12 |
188,0 |
0,1632 |
6,127 |
190,7 |
473,9 |
664,6 |
|
13 |
191,6 |
0,1511 |
6,617 |
194,5 |
470,8 |
665,3 |
|
14 |
195,0 |
0,1407 |
7,106 |
198,2 |
467,7 |
665,9 |
|
15 |
198,3 |
0,1317 |
7,596 |
201,7 |
464,7 |
666,4 |
|
16 |
201,4 |
0,1237 |
8,085 |
205,1 |
461,7 |
666,8 |
|
17 |
204,3 |
0,1166 |
8,575 |
208,2 |
459,0 |
667,2 |
|
18 |
207,1 |
0,1103 |
9,065 |
211,2 |
456,3 |
667,5 |
|
19 |
209,8 |
0,1047 |
9,555 |
214,2 |
453,6 |
667,8 |
|
20 |
212,4 |
0,09954 |
10,05 |
217,0 |
451,1 |
668,1 |
|
25 |
223,9 |
0,07991 |
12,51 |
229,7 |
439,3 |
669,0 |
|
30 |
233,8 |
0,06663 |
15,01 |
240,8 |
428,5 |
669,3 |
|
40 |
250,3 |
0,04975 |
20,10 |
259,7 |
409,1 |
668,8 |
|
50 |
263,9 |
0,03943 |
25,36 |
275,7 |
391,7 |
667,4 |
|
60 |
275,6 |
0,03244 |
30,83 |
289,8 |
375,4 |
665,2 |
|
70 |
285,8 |
0,02737 |
36,53 |
302,7 |
359,7 |
662,4 |
|
80 |
295,0 |
0,02353 |
42,51 |
314,6 |
344,6 |
659,2 |
|
90 |
303,3 |
0,02050 |
48,79 |
325,7 |
329,8 |
655,5 |
|
100 |
311,0 |
0,01804 |
55,43 |
336,3 |
315,2 |
651,5 |
|
110 |
318,1 |
0,01601 |
62,48 |
346,5 |
300,6 |
647,1 |
|
120 |
324,7 |
0,01428 |
70,01 |
356,3 |
286,0 |
642,3 |
|
130 |
330,8 |
0,01280 |
78,14 |
365,9 |
271,1 |
637,0 |
|
140 |
336,6 |
0,01150 |
86,99 |
375,4 |
255,7 |
631,1 |
|
150 |
342,1 |
0,01034 |
96,71 |
384,7 |
239,9 |
624,6 |
|
200 |
365,7 |
0,005877 |
170,2 |
436,2 |
141,4 |
577,6 |
1 ккал = 4,186 кдж
1 кдж = 0,24 ккал
1 бар = 0,102 МПа
ПАР ВТОРИЧНОГО ВСКИПАНИЯ
Что такое пар вторичного вскипания:
Когда горячий конденсат или вода
из котла, находящиеся под определенным давлением, выпускают в пространство, где
действует меньшее давление, часть жидкости вскипает и превращается в так
называемый пар вторичного вскипания.
Почему он имеет важное значение :
Этот пар важен потому, что в нем
содержится определенное количество теплоты, которая может быть использована для
повышения экономичности работы предприятия, т.к. в противном случае она будет
безвозвратно потеряна. Однако, чтобы получить пользу от пара вторичного
вскипания, нужно знать как в каком количестве он образуется в конкретных
условиях.
Как он образуется :
Если воду нагревать при атмосферном давлении, ее
температура будет повышаться пока не достигнет 100°С – самой высокой
температуры, при которой вода может существовать при данном давлении в виде
жидкости. Дальнейшее добавление теплоты не повышает температуру воды, а
превращает ее в пар.
Теплота, поглощенная водой в
процессе повышения температуры до точки кипения, называется физической теплотой
или тепло-содержанием. Теплота, необходимая для превращения воды в пар, при
температуре точки кипения, называется скрытой теплотой парообразования.
Единицей теплоты, в общем случае, является килокалория (ккал), которая равна
количеству тепла, необходимому для повышения температуры одного килограмма воды
на 1°С при атмосферном давлении.
Однако, если воду нагревать при
давлении выше атмосферного, ее точка кипения будет выше 100°С, в силу чего
увеличится также и количество требуемой физической теплоты. Чем выше давление,
тем выше температура кипения воды и ее теплосодержание. Если давление
понижается, то теплосодержание также уменьшается и температура кипения воды
падает до температуры, соответствующей новому значению давления. Это значит,
что определенное количество физической теплоты высвобождается. Эта избыточная
теплота будет поглощаться в форме скрытой теплоты парообразования, вызывая
вскипание части воды и превращение ее в пар. Примером может служить выпуск
конденсата из конденсатоотводчика или выпуск воды из котла при продувке.
Количество образующегося при этом пара можно вычислить.
Конденсат при температуре пара 179,9
°C
и
давлении 10 бар обладает теплотой в количестве 182, 1ккал/кг. См. Колонку 5
таблицы параметров пара. Если его выпускать в атмосферу, т.е. при абсолютном
давлении 1 бар, теплосодержание конденсата сразу же упадет до 99,7 ккал/кг.
Избыток теплоты в количестве 82,3 ккал/кг вызовет вторичное вскипание части
конденсата. Величину части конденсата в %, которая превратится в пар вторичного
вскипания, определяют следующим образом :
Разделите разницу между
теплосодержанием конденсата при большем и при меньшем давлениях на величину
скрытой теплоты парообразования при меньшем давлением значении давления и
умножьте результат на 100.
Выразив это в виде формулы,
получим :
% пар вторичного вскипания
q1 = теплота конденсата при
большем значении давления до его выпуска
q2 = теплота конденсата при
меньшем значении давления, т.е. в пространстве, куда производится выпуск
r =
скрытая теплота парообразования пара при меньшем значении давления, при
котором производится выпуск конденсата
% пара вторичного вскипания =
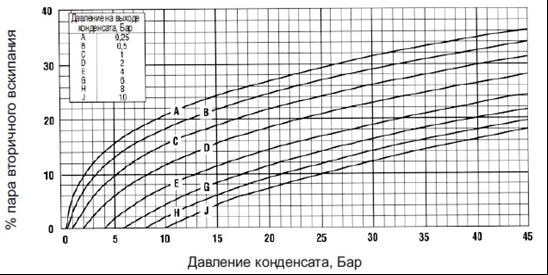
График 1.
График 2. 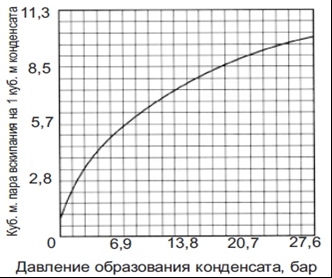
Объем пара вторичного вскипания при выпуске
одного кубического метра конденсата в систему с атмосферным давлением.
Для упрощения
расчетов, на графике показано количество пара вторичного вскипания, которое
будет образовываться, если выпуск конденсата будет производится при разных
давлениях на выходе
Пар… основные понятия
Влияние присутствия воздуха на температуру пара
Рис. 1 поясняет, к чему приводит
присутствие воздуха в паропроводах, а в
Таблице 1 и на Графике 1 показана зависимость снижения температуры пара от
процентного содержания в нем воздуха при различных давлениях.
Влияние присутствия воздуха на теплопередачу
Воздух, обладая отличными
изоляционными свойствами, может образовать, по мере конденсации пара,
своеобразное «покрытие» на поверхностях теплопередачи и значительно
понизить ее эффективность.
При определенных условиях, даже
такое незначительное количество воздуха в паре как 0,5% по объему может
уменьшить эффективность тепло — передачи
на 50%. См. Рис.1
СО2 в газообразной
форме, образовавшись в котле и перемещаясь вместе с паром, может растворится в
конденсате, охлажденном ниже температуры пара, и образовать угольную кислоту.
Эта кислота весьма агрессивна и, в конечном итоге «проест»
трубопроводы и теплообменное оборудование. См. Рис.2. Если в систему попадает
кислород, он может вызвать питтинговую
коррозию чугунных и стальных поверхностей. См. Рис. 3.
Паровая камера со 100%
содержанием пара. Общее давление 10 бар.
Давления пара 10 бар температура пара 180°С
Рис.1. Камера, в которой
находится смесь пара и воздуха, передает только ту часть теплоты, которая
соответствует парциальному давлению пара, а не полному давлению в ее полости.
Паровая камера с содержанием
пара 90%
И воздуха 10%. Полное давление
10 бар. Давление
Пара 9 бар, температура пара 175,4°С
Таблица 1.
|
Снижение температуры паро-воздушной |
||||
|
Давление |
Температура насыщ. пара |
Температура паро-воздушной смеси от |
||
|
бар |
°C |
10% |
20% |
30% |
|
2 |
120,2 |
116.7 |
113.0 |
110.0 |
|
4 |
143.6 |
140.0 |
135.5 |
131.1 |
|
6 |
158.8 |
154.5 |
150.3 |
145.1 |
|
8 |
170.4 |
165.9 |
161.3 |
155.9 |
|
10 |
179.9 |
175.4 |
170.4 |
165.0 |
Свойства пара
Теплофизические свойства воды и водяного пара (программа расчета)
Методические указания по очистке и контролю возвратного конденсата (РД 34.37.515-93)