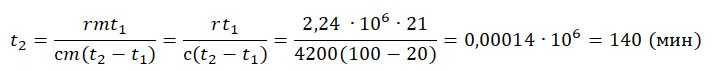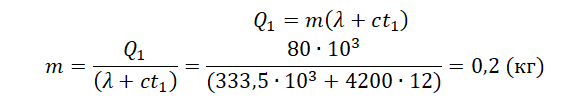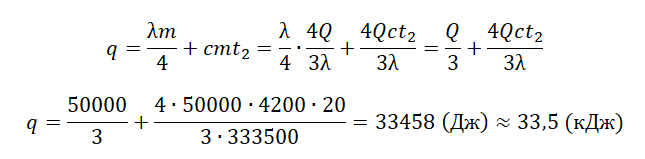The boiling point of a substance is the temperature at which the substance changes state from liquid state to gas state. The boiling point of a liquid varies depending on the surrounding atmospheric pressure, but it is usually close to the melting point of the solid form of the same substance.
How is Boiling Point Determined?
Boiling point of a substance can be determined by using a Boiling Point Apparatus. This method uses the fact that liquids boil when their vapor pressure equals the atmospheric pressure. The apparatus consists of a container of liquid, a heater, and a mercury manometer. First, the liquid is placed in the container and heated until its vapors fill the container. The mercury manometer is then used to measure the atmospheric pressure inside the container. When the mercury column in the manometer reaches the same level as the liquid in the container, this indicates that the vapors have reached atmospheric pressure and the boiling point has been reached.
Boiling point of Water
Boiling point of water is the temperature at which the liquid water becomes water vapor. The boiling point of water is 212 degrees Fahrenheit using Fahrenheit to Celsius conversion (100 degrees Celsius). The boiling point of water is also known as the “saturation temperature.”
Boiling Point Formula of Liquid
The boiling point of a liquid is the temperature at which the liquid changes state from a liquid to a gas. The boiling point of a liquid is also the temperature at which the vapor pressure of the liquid is equal to the atmospheric pressure. The boiling point of a liquid is affected by the atmospheric pressure, which is why boiling points are usually given at standard atmospheric pressure.
The boiling point of a liquid is the temperature at which the vapor pressure of the liquid is equal to the atmospheric pressure.
The boiling point depends on the pressure of the surrounding atmosphere. When the atmospheric pressure is equal to the vapor pressure of the liquid, the liquid will boil. The boiling point also depends on the purity of the liquid, impurities lower the boiling point of a liquid.
Example: Water boils at 100 degrees Celsius (212 degrees Fahrenheit) at sea level, but only at 93 degrees Celsius (199.4 degrees Fahrenheit) at an altitude of 2,438 meters (8,000 feet).
The formula for calculating the change in the boiling point is:
Kb = RTb2M / ΔHv
where,
Kb is the boiling point constant
R is the universal gas constant (8.314 J/mol-K)
Tb is the boiling point of the liquid
M is the molar mass of the liquid
ΔHv is the heat of vaporization for the particular liquid (2260 J/kg: latent heat of vaporization of water)
Properties of Boiling Point
Following are the properties of the boiling point:
- Boiling point of a liquid varies depending on the surrounding pressure. For example, water boils at 100°C (212°F) at sea level, but only at 93°C (199°F) at an altitude of 1,000 m (3,281 ft).
- Boiling point of a liquid can also be affected by the presence of other substances in the liquid. For example, the boiling point of water is lower when salt is added to it.
- Boiling point of a liquid is a measure of the liquid’s ability to change state from a liquid to a gas. The higher the boiling point, the greater the liquid’s ability to resist changes in state.
- Boiling point of a liquid is also a measure of the liquid’s ability to vaporize. The higher the boiling point, the greater the liquid’s ability to resist vaporization.
- Boiling point of a liquid is a function of the liquid’s vapor pressure. The vapor pressure is the pressure exerted by the vapor of the liquid on the walls of the container.
- Boiling point of a liquid is also a function of the liquid’s volatility. The volatility of a liquid is a measure of the liquid’s ability to vaporize.
- Boiling point of a liquid is affected by the surrounding pressure. The higher the surrounding pressure, the higher the boiling point.
Factors Affecting the Boiling Point of Liquid
The boiling point of a liquid is the temperature at which it changes from a liquid to a gas. The factors that affect the boiling point of a liquid are its pressure, temperature, and purity.
- Purity: The higher the purity of a liquid, the higher its boiling point. This is because impurities lower the vapor pressure of a liquid, making it easier for the liquid to boil.
- Pressure: The boiling point of liquid increases as the pressure on the liquid increases. This is because the vapor pressure of a liquid increases as the pressure on the liquid increases.
- Temperature: The boiling point of a liquid also increases as the temperature around the liquid increases.
How to Find the Boiling Point of a Substance?
To determine the boiling point of a substance, we need to heat the substance until it reaches its boiling point. The boiling point of a substance is defined as the temperature at which the liquid changes its state to gas form. At this temperature, the vapor pressure of the liquid is equal to the atmospheric pressure.
We use a thermometer to measure the temperature of the substance as it is heated. As the substance approaches its boiling point, we will notice that the rate of heating will begin to slow down. This is because the heat is being used to convert the liquid into a gas, rather than increase the temperature of the liquid.
Once the substance reaches its boiling point, it will begin to boil. You can then remove the thermometer and checked the temperature to get the boiling point.
Also, Check
- Molarity
- Mole Concept
- Difference Between Molarity and Molality
Solved Examples on Boiling Point Formula
Example 1: Find the Kb of LiCl if 2 g of LiCl is dissolved in 500 g of water which boils at 100.6°C.
Solution:
Given,
Mass of LiCl = 2 g
Molar mass of LiCl = 42 g/mol
Mass of water = 500 g
Molar mass of water = 18 g/mol
Boiling point of solution = 100.6°CR = 8.314 J/mol-K (Universal gas constant)
Tb = 100.6 + 273 = 373.6 K (Boiling point in Kelvin)
V = 500 / 1000 = 0.5 L (Volume in litres)
M = (2 / 42) + (500 / 18) = 25 mol/L (Molality)
Hv= 2260 J/kg (latent heat of vaporization of water)Kb = RTb2M / ΔHv
= 8.314 × 373.6 × 0.5 × 25 / 2260
= 68.7 molal
Example 2: Find the boiling point of 1 molar solution of sucrose.
Solution:
Given,
Molarity of solution (M) = 1 mol/L
Boiling point elevation (ΔTb) = 100°C (the Kb for sucrose is 100°C/m)
R = 8.314 J/mol-K (universal gas constant)Tb = 100 + 273 = 373 K (boiling point in Kelvin)
Kb = RTb2M / ΔHv
= 8.314 × 373 × 2 × 1 / 2260
= 2.74 molal
Example 3: Find the Kb of the glucose if the solution of glucose in water boils at 103°C when the concentration of the solution is 0.5 molar.
Solution:
Given,
Concentration of solution (c) = 0.5 molar
Boiling point elevation (ΔTb) = 103°C (the Kb for sucrose is 100°C/m)R = 8.314 J/mol-K (universal gas constant)
Tb = 103 + 273 = 376 K (boiling point in Kelvin)
Kb = RTb2M / ΔHv
= 8.314 × 376 × 2 × 0.5 / 2260
= 1.38 molal
FAQs on Boiling Point
Question 1: What is the boiling point of the liquid?
Answer:
The boiling point of a liquid is the temperature at which the liquid changes state from a liquid to a gas.
Question 2: What factors affect the boiling point of a liquid?
Answer:
The boiling point of a liquid is affected by the pressure of the surrounding atmosphere, the purity of the liquid, and the presence of any dissolved solids.
Question 3: How does the boiling point of a liquid change with altitude?
Answer:
The boiling point of a liquid decreases with the rise in altitude. This is because the atmospheric pressure is lower at higher altitudes, and the boiling point of a liquid is inversely affected by the pressure of the surrounding atmosphere.
Question 4: How does the boiling point of a liquid change with the addition of solids?
Answer:
The boiling point of liquid increases with the addition of solids. This is because the solids take up space in the liquid, and the liquid must heat up to a higher temperature in order to vaporize.
Question 5: What is the boiling point of alcohol?
Answer:
The boiling point of alcohol is 78.37 degrees Celsius (172 degrees Fahrenheit).
Question 6: What is the boiling point of mercury?
Answer:
The boiling point of mercury is 356.7 degrees Celsius (673 degrees Fahrenheit.
Last Updated :
17 Jan, 2023
Like Article
Save Article
В настоящей статье мы поговорим о кипятильнике.g с теплотой парообразования и ее детальным анализом.
Количество тепла необходимо добавить к любой жидкости, если вы собираетесь преобразовать эту жидкость в газ. Символ, обозначающий изменение энтальпии парообразования, — ∆H.VAP, парообразование процесс, происходящий именно в точка кипения есть не что иное, как кипение.
Температура кипения с учетом теплоты парообразования
Экспериментально установлено, что в определенной точке температуры мы можем иметь давление пара, имеющее то же значение, что и атмосферное давление, окружающее жидкость, и также в этой точке жидкость приближается к состоянию пара. Процесс парообразования, происходящий точно при температуре кипения, есть не что иное, как кипение.
Количество тепла, которое необходимо добавить к любой жидкости, если вы собираетесь преобразовать эту жидкость в газ, само по себе является теплотой парообразования.. Изменение температуры кипения с теплотой парообразования прямо пропорционально.
Как найти температуру кипения по теплоте парообразования?
Если мы возьмем один грамм любой жидкости, чтобы испарить ее при постоянной температуре, нам может понадобиться некоторое количество тепла, и это необходимое количество тепла обычно называют теплотой парообразования. Мы можем найти температуру кипения с теплотой парообразования по уравнению Клаузиуса-Клапейрона.
Точно так же молярная теплота парообразования соответствует необходимому количеству теплоты в случае одного моля жидкости при отсутствии изменения температуры.
Как рассчитать температуру кипения по давлению пара?
В критической точке энтальпия парообразования стремится к нулю. До этого момента энтальпия парообразования может быть уменьшена за счет влияния давление, т. е. за счет повышения давления. Таким образом, более высокое давление пара соответствует более низкой температуре кипения и наоборот. Мы можем рассчитать температуру кипения по уравнению Клаузиуса-Клапейрона:
ln(P2/P1)=-ΔHVAPР⋅(1/T2−1/T1)
Где,
P1 – давление паров вещества при Т1
P2 – давление паров этого вещества при Т2
ΔHvap – энтальпия парообразования.
R — газовая постоянная — обычно выражается как 8.314 Дж / К.⋅моль.
Мы не увидим фазового перехода, соответствующего процессу парообразования в так называемой критической точке. Тепло необходимо для преодоления молекулярных связей, просто называемое скрытой теплотой.
Как рассчитать температуру кипения энтропии парообразования?
При нормальном давлении энтропия испарения большинства жидкостей имела бы несколько близкие значения. Согласно правилу Трутона, большинство жидкостей обладают энтропией испарения около от 85 до 88 Дж моль-1 K-1. Установлено, что теплота парообразования, деленная на температуру кипения этой жидкости, непосредственно дает теплоту парообразования.
Равна ли теплота парообразования температуре кипения?
Процесс парообразования, происходящий точно при температуре кипения, есть не что иное, как кипение. Экспериментально установлено, что в определенной точке температуры мы можем иметь давление пара, имеющее то же значение, что и атмосферное давление, окружающее жидкость, и также в этой точке жидкость приближается к состоянию пара.
Эту точку также называют точкой испарения. Процесс парообразования, происходящий точно при температуре кипения, есть не что иное, как кипение.
Как найти температуру кипения по графику давления пара?
На кривой давления пара линия, проведенная из точки на оси давления, соответствующей стандартному давлению, пересекает кривую в точке. Эта точка при экстраполяции к оси температуры совпадает с осью точки кипения. Таким образом, мы можем найти точку кипения.
Назовите факторы, влияющие на температуру кипения и теплоту парообразования?
Мы уже узнали, что процесс парообразования, происходящий именно при температуре кипения, есть не что иное, как кипение, поэтому мы изучаем изменение температуры кипения в зависимости от теплоты парообразования. Ниже перечислены факторы, которые могут повлиять на теплоту парообразования.
- Температура, если вещество находится в жидкой фазе
- Количество молей, присутствующих в жидкой фазе
- Давление пара в испаренной фазе
Что вы понимаете под теплотой парообразования в химии?
Если мы возьмем один грамм любой жидкости, чтобы испарить ее при постоянной температуре, нам может понадобиться некоторое количество тепла, и это необходимое количество тепла обычно называют теплотой парообразования. Точно так же молярная теплота парообразования соответствует необходимому количеству теплоты в случае одного моля жидкости при отсутствии изменения температуры.
Как объяснить температуру кипения теплотой парообразования?
Энтальпия парообразования такая же, как теплота парообразования, т. е. количество тепла, которое необходимо добавить к любой жидкости, если вы собираетесь преобразовать эту жидкость в газ. Символ, обозначающий изменение энтальпии парообразования, — ∆H.VAP.
Может ли теплота парообразования быть численно отрицательной?
Предполагается, что энтальпия конденсации или теплота конденсации точно такая же (численно), что и энтальпия парообразования и отличается только знаком. Следует отметить, что энтальпия парообразования считается всегда положительной, тогда как изменения энтальпии конденсации оказываются отрицательными..
Что вы знаете о температуре кипения?
Экспериментально установлено, что в определенной точке температуры мы можем иметь давление пара, имеющее то же значение, что и атмосферное давление, окружающее жидкость, и также в этой точке жидкость приближается к состоянию пара. Процесс парообразования, происходящий точно при температуре кипения, есть не что иное, как кипение.
Важна ли температура кипения с теплотой парообразования?
Чтобы преобразовать воду в парообразное состояние, нам нужно разорвать водородную связь, которая, как известно, присутствует между атомами водорода и кислорода, из которых состоит вода. Чтобы разорвать связь, требуется очень высокая теплота испарения, что фактически способствует возможности жизни на Земле.
Какие факторы участвуют в повышении температуры кипения с увеличением теплоты парообразования?
Нам известно о существовании четырех межмолекулярных сил, а именно ионной связи, водородной связи, диполь-дипольного взаимодействия и дисперсионных сил Ван-дер-Ваальса. Все они оказались силами притяжения, которые участвуют независимо на основе существующей функциональной группы. Продолжая увеличивать количество присоединенных атомов углерода, мы можем добиться повышения температуры кипения..
Назовите жидкость, которая имеет самую высокую температуру кипения?
Наблюдается, что ацетон имеет максимально возможную температуру кипения с теплотой парообразования, которая составляет 56.0. ∘С. Возможно, это верно из-за наличия большего количества атомов углерода в ацетоне.
Чему равна температура кипения при теплоте парообразования в воде?
Обычно теплота парообразования, соответствующая воде, очень высока, а это означает, что если мы хотим превратить один грамм воды в газ при неизменной температуре, нам потребуется большое количество тепла. Таким образом, теплота парообразования оказывается равной приблизительно 540 кал/г, в то время как температура, поддерживаемая постоянной, будет составлять 100 кал/г.° С
Что вы имеете в виду под удельной теплоемкостью?
Удельная теплоемкость — это в основном параметр, который измеряет теплоту. Если мы должны увеличить температуру вещества, взятого в единице массы, нам потребуется определенное количество теплоты. Эта необходимая теплота есть не что иное, как удельная теплота этого вещества. Возникает связь между теплом и изменением температуры, что обусловливает использование воды в качестве регулятора температуры.
Что такое высокая удельная теплоемкость?
Если мы должны увеличить температуру вещества, взятого в единице массы, нам потребуется определенное количество теплоты. Эта необходимая теплота есть не что иное, как удельная теплота этого вещества. Наблюдается, что вода обладает высокой удельной теплоемкостью или просто теплоемкостью, из чего следует, что для повышения температуры воды необходимо подвод большего количества тепла по сравнению с остальными веществами.
Что означает символ «∆H»?
Это символ, связанный с термодинамическими свойствами, которые оказались очень полезными.. Мы уже знаем о символе «Н», который соответствует энтальпии вещества. Энтальпия — это не что иное, как общая сумма внутренней энергии, которой обладает любая система, вместе с произведением давления и объема, присутствующих в этой системе. Кроме того, ∆H связан с изменением или изменением, наблюдаемым в энтальпии системы в химической реакции.
Что вы имеете в виду под точкой испарения?
Экспериментально установлено, что в определенной точке температуры мы можем иметь давление пара, имеющее то же значение, что и атмосферное давление, окружающее жидкость, и также в этой точке жидкость приближается к состоянию пара. Эту точку также называют точкой испарения. Процесс парообразования, происходящий точно при температуре кипения, есть не что иное, как кипение.
Объясните, влияет ли давление жидкости на температуру кипения с теплотой парообразования?
Давление также является физическим свойством, связанным с веществом. В критической точке энтальпия парообразования стремится к нулю. До этого момента энтальпия парообразования может быть уменьшена влиянием давления, т. е. повышением давления. Мы не увидим фазового перехода, соответствующего процессу парообразования в так называемой критической точке. Тепло необходимо для преодоления молекулярных связей, которые просто называются скрытой теплотой.
Что вы понимаете под теплотой раствора?
Когда вещество добавляется к растворителю, наблюдается выделение или поглощение растворенного тепла. Количество теплоты, которое, как считается, выделяется при дальнейшем растворении одного моля в растворителе, есть не что иное, как теплота раствора.
Какие факторы влияют на скрытую теплоту парообразования?
На испарение в основном влияет хорошо известная температура кипения жидкости. Факторы, влияющие на парообразование, означают факторы, влияющие на температуру кипения.
Здесь перечислены факторы, влияющие на температуру кипения и теплоту парообразования.
- давление
- Добавление примесей
Какое приложение связано с кривой давления пара?
На кривой давления пара линия, проведенная из точки на оси давления, соответствующей стандартному давлению, пересекает кривую в точке. Эта точка при экстраполяции к оси температуры совпадает с осью в точка кипения. Таким образом, мы можем найти температуру кипения с теплотой парообразования.
Вспомните уравнение Клаузиуса Клапейрона.
Более высокое давление пара соответствует более низкой температуре кипения и наоборот. Мы можем рассчитать температуру кипения с учетом теплоты парообразования по уравнению Клаузиуса-Клапейрона:
ln(P2/P1)=-ΔHвапR⋅(1/T2−1/T1)
Где,
P1 – давление паров вещества при Т1
P2 – давление паров этого вещества при Т2
ΔHvap – энтальпия парообразования.
R — газовая постоянная — обычно выражается как 8.314 Дж / К⋅моль.
Обзор
В критической точке энтальпия парообразования стремится к нулю. До этого момента энтальпия парообразования может быть уменьшена за счет влияния давление, т. е. за счет повышения давления. Таким образом, более высокое давление пара соответствует более низкой температуре кипения и наоборот. Мы можем рассчитать температуру кипения по уравнению Клаузиуса-Клапейрона.
Жидкость может переходить в парообразное состояние двумя способами – испарением и кипением. Испаряются жидкости во всем температурном диапазоне, в то время, как кипение происходит при строго определенной температуре для каждой конкретной жидкости.
Что такое кипение
Кипение – это:
- бурный переход жидкости в пар. Во всем объеме жидкости образуются пузырьки, пар в этих пузырьках насыщенный;
- эндотермический процесс, он происходит с поглощением энергии.
Образование пара во всем объеме жидкости называют кипением.
Примечание: Интересен тот факт, что перед началом кипения от чайника с водой доносится специфический шум.
Различия между испарением и кипением
Характерным проявлением кипения может служить образование пузырьков пара внутри жидкости (рис. 1):
Рис. 1. Во время испарения пар образуется только на поверхности, а во время кипения – во всем объеме жидкости
На следующем рисунке 2 представлены отличия процессов испарения и кипения подробнее:
Рис. 2. Есть два процесса образования пара – испарение и кипение, рисунок поясняет их основные отличия
Образование пара (парообразование):
- на поверхности – это испарение,
- во всем объеме – это кипение.
Испарение происходит при любой температуре с поверхности, а кипение – только при одной конкретной температуре, но во всем объеме жидкости.
Процессы кипения и конденсации на графиках
Пусть небольшое количество воды находится в просторном закупоренном сосуде.
Разберем, как выглядят на температурных графиках процессы кипения и конденсации. Для начала рассмотрим график нагревания и кипения (рис. 3).
Вначале вода имела температуру +20 градусов Цельсия. Будем нагревать эту воду. Поначалу ее температура будет расти. На графике это показано наклонной синей линией, находящейся в левой части рисунка.
Рис. 3. График нагревания воды, ее кипения и нагревания полученного пара
До бесконечности температура подниматься не будет. Как только температура достигнет некоторого предела, вода закипит. Из рисунка следует, когда температура воды достигла отметки +100 градусов Цельсия и начался процесс кипения. Этот процесс на рисунке схематично обозначен горизонтальной красной линией.
Горизонтальное положение линии кипения означает, что во время кипения температура воды не изменяется. Температура будет оставаться неизменной до тех пор, пока вся вода не превратится в газообразное состояние — пар. Для компактности рисунка я укоротил эту линию, на самом деле, длину этой линии нужно увеличить.
Уже после того, как вся вода превратилась в пар, температура пара начала повышаться. Это изображено на рисунке наклонной синей линией, находящейся правее красной линии.
Будем теперь отбирать тепловую энергию у молекул. Предположим, что мы охлаждаем горячий водяной пар, находящийся в закупоренном сосуде. Процессы его охлаждения и конденсации представлены на графике (рис. 4). Этот график можно получить, зеркально отразив вокруг вертикальной оси график, связанный с нагреванием, рассмотренный ранее.
Рис. 4. График охлаждения пара, его конденсации и охлаждения полученной воды
Из графика следует:
Вначале температура пара уменьшается от +180 градусов Цельсия до +100 градусов. Это наклонная синяя линия, расположенная в левой части рисунка.
Затем, происходит конденсация пара. Молекулы пара собираются в капли жидкости. При этом, температура пара не изменяется и остается равной +100 градусам Цельсия.
Как только весь пар конденсируется, образовавшаяся жидкая вода начинает охлаждаться до конечной температуры + 20 градусов Цельсия. На графике охлаждение воды – это синяя наклонная линия, находящаяся справа от красной линии конденсации.
Температура кипения и как ее найти на графике
Чтобы жидкость закипела, ее нужно нагреть до температуры кипения.
На рисунке 5 представлен температурный график нагревания воды. Температуру кипения можно определить по горизонтальной линии, обозначающую процесс кипения. Нужно продолжить эту линию пунктиром по направлению к вертикальной оси температур. Точка, в которой пунктир упрется в ось и будет температурой кипения жидкости.
Рис. 5. Если на графике температуры найти горизонтальную линию кипения, а потом провести пунктир к оси температуры, мы найдем температуру кипения
Температура кипения – это температура, при которой пар образуется во всем объеме жидкости. Такая температура у каждой жидкости своя, ее можно найти в справочнике физики.
Температуры кипения некоторых веществ
Сравним для наглядности значения температуры кипения некоторых веществ.
Нам известно, что температура кипения питьевой воды равна 100 градусам на шкале Цельсия.
При комнатной температуре некоторые вещества пребывают в газообразном состоянии, но при более низких температурах они превращаются в жидкости. Например, кислород превращается в кипящую жидкость при минус 183 градусах Цельсия.
В противоположность этому, вещества, которые мы привыкли видеть твердыми при комнатной температуре, в кипящую жидкость превратятся при более высоких температурах. К примеру, медь станет кипящей жидкостью при 2567 град. Цельсия, а железо – при 2500 град. Цельсия
На рисунке 6 представлен список некоторых веществ и указана температура, при которой эти вещества кипят.
Рис. 6. Таблица — температура кипения некоторых веществ
Расширенный список жидкостей и их температуру кипения можно найти в справочнике физики.
Почему температура жидкости при кипении не изменяется
Тепловая энергия, которую получает жидкость во время кипения, тратится на образование пара во всем объеме жидкости. Поэтому во время кипения температура жидкости не изменяется.
Разберем подробнее, что происходит, когда мы сообщаем тепловую энергию какой-либо жидкости.
Получаемая от источника тепловая энергия передается молекулам жидкости. Скорость движения молекул увеличивается, а значит, растет их кинетическая энергия. Чем выше температура, тем быстрее будут двигаться молекулы.
Находясь в жидкости, каждая молекула притягиваются к соседним молекулам. То есть, молекулы удерживаются в жидкости силами притяжения соседних молекул. Если есть взаимодействие молекул – их взаимное притяжение, значит, есть потенциальная энергия такого взаимодействия.
По мере нагревания, энергия движения некоторых молекул увеличится настолько, что они преодолеют притяжение соседних молекул и, покинут жидкость. Чем выше температура, тем большее число молекул сможет покинуть жидкость.
Мы помним, что при испарении жидкость покидают молекулы, находящиеся только на ее поверхности. А во время кипения энергию, достаточную для того, чтобы вылететь из жидкости, получают не только молекулы на поверхности, но и молекулы, находящиеся внутри жидкости.
Примечания:
- Наблюдая за кипящей жидкостью, можно заметить, что пар образуется внутри жидкости во всем ее объеме. Пузырьки пара буду образовываться даже у дна. Они будут подниматься к поверхности, при этом расширяясь. Внутри пузырьков находятся молекулы, энергия которых достаточна для того, чтобы покинуть жидкость.
- Вместо слов «Внутри жидкости», физики говорят — «Во всем объеме жидкости».
Как давление влияет на температуру кипения
Мы можем влиять на температуру кипения жидкостей, изменяя давление. Если давление воздуха увеличить, то температура кипения, так же, возрастет. К примеру, вода при давлении 220 атмосфер (это 21,6 миллионов Паскалей) закипит только тогда, когда ее температура поднимется до 370 градусов Цельсия.
А уменьшая давление, мы наоборот, температуру кипения жидкостей понизим. Именно из-за пониженного давления, температура кипения воды в высокогорных районах ниже, чем, на равнинной местности, которая ближе к уровню мирового океана. В горах вода закипает при температуре 90 градусов Цельсия. Из-за этого, некоторые продукты высоко в горах сварить не получится.
Чем выше давление, тем выше температура кипения жидкости. Уменьшив давление, мы понизим температуру кипения.
Что такое удельная теплота парообразования
Возьмем какую-либо жидкость массой 1 кг, предварительно нагретую до температуры кипения. Будем сообщать ей тепловую энергию, чтобы испарить эту жидкость полностью.
Та энергия (теплота), которую мы затратим, чтобы испарить с помощью кипения 1 кг жидкости, называется удельной теплотой парообразования. Удельной величиной эту теплоту называют потому, что она приходится на 1 кг жидкости.
Удельная теплота парообразования — это энергия, которую нужно затратить, чтобы испарить 1 кг жидкости, предварительно нагретой до температуры кипения.
(large L left( frac{text{Дж}}{text{кг}}right)) – удельная теплота парообразования (конденсации).
На рисунке 7 представлена таблица, в которой содержится удельная теплота парообразования (конденсации) при температуре кипения для некоторых жидкостей и металлов в расплавленном состоянии.
Рис. 7. Таблица – удельная теплота парообразования (конденсации) некоторых веществ при температуре кипения
Что происходит с энергией во время кипения и конденсации
Кипение: жидкость получает тепловую энергию (количество теплоты), из нее вырываются молекулы. Полученная энергия тратится на преодоление притяжения соседних молекул и на расширение образовавшегося пара.
Конденсация: молекулы пара отдают тепловую энергию в окружающее пространство, собираясь в капельки — превращаясь в жидкость.
Выполняется закон сохранения энергии. Именно поэтому теплота парообразования и теплота конденсации совпадают. Процессы кипения и конденсации протекают при одной и той же температуре. Различие кроется в том, что кипение происходит с поглощением энергии, а конденсация связана с выделением энергии.
Как удельная теплота парообразования связана с количеством теплоты — формула
Пусть жидкость предварительно нагрета до температуры кипения, и нам известны:
- ее масса (количество килограммов) и
- удельная теплота парообразования;
Мы можем посчитать общее количество теплоты, требуемое для перевода всей жидкости в пар. Расчеты нужно вести по формуле:
[large boxed{ Q = L cdot m }]
(large m left( text{кг} right) ) – масса вещества;
(large L left( frac{text{Дж}}{text{кг}} right) ) – удельная теплота парообразования (конденсации);
(large Q left( text{Дж} right) ) – количество теплоты, поглощенное жидкостью во время кипения, т. е. общая тепловая энергия для перевода всей жидкости в пар;
Формулу можно применять так же, чтобы рассчитать количество теплоты, выделяемое в окружающую среду молекулами пара при их конденсации.
Для процесса конденсации величина (large Q ) – это количество теплоты, выделенное молекулами пара в окружающую среду;
Чем удельная теплота парообразования отличается от количества теплоты
Отличия удельной теплоты парообразования от количества теплоты, приведены на рисунке 8:
Рис. 8. Если жидкость находится при температуре кипения, то удельная теплота парообразования — это энергия для перевода в пар одного кг жидкости, а количество теплоты – это энергия перевода в пар нескольких кг жидкости
В любом случае, жидкость предварительно нужно нагреть до температуры кипения.
Количество теплоты – это энергия, необходимая для конденсации или образования пара при температуре кипения для нескольких килограммов жидкости.
Удельная теплота парообразования – это энергия, необходимая для перевода в пар 1-го килограмма жидкости.
Выводы
- Жидкость может переходить в парообразное состояние двумя способами: испарением или кипением.
- Образование пара (парообразование) на поверхности – это испарение, а во всем объеме – это кипение.
- Кипение – это эндотермический процесс, который происходит с поглощением энергии. Во всем объеме жидкости образуются пузырьки, пар в этих пузырьках насыщенный;
- Чтобы жидкость начала кипеть, ее нужно нагреть до температуры кипения. Каждая жидкость кипит при строго определенной для нее температуре.
- Удельная теплота парообразования — это энергия, которую нужно затратить, чтобы испарить 1 кг жидкости, предварительно нагретой до температуры кипения.
- На графике температур процессы кипения и конденсации изображаются горизонтальными линиями.
- Умножив удельную теплоту парообразования (large L ) на количество килограммов m кипящей жидкости, получим общее количество теплоты (large Q ), затраченной на перевод всей жидкости в пар во время ее кипения.
Фазовые переходы — это термодинамические процессы, приводящие к изменению агрегатного состояния вещества.
Плавление и отвердевание
ОпределениеПлавление — переход вещества из твердого состояния в жидкое.
Для расчета количества теплоты, необходимого для процесса плавления, следует применять формулу:
Q=λm
m — масса вещества, λ (Дж/кг) — удельная теплота плавления.
Плавление каждого вещества происходит при определенной температуре, которую называют температурой плавления. Все проводимое тепло идет на разрушение кристаллической решетки, при этом увеличивается потенциальная энергия молекул. Кинетическая энергия остается без изменения и температура в процессе плавления не изменяется.
Удельная теплота плавления показывает, какое количество теплоты необходимо сообщить 1 кг данного вещества, чтобы перевести его из твердого состояния в жидкое при условии, что оно уже нагрето до температуры плавления. В процессе отвердевания 1 кг данной жидкости, охлажденной до температуры отвердевания, выделится такое же количество теплоты.
Внимание! Удельная теплота плавления — табличная величина.
ОпределениеОтвердевание, или кристаллизация — переход состояния из жидкого состояния в твердое (это процесс, обратный плавлению).
Отвердевание происходит при той же температуре, что и плавление. В процессе отвердевания температура также не изменяется. Количество теплоты, выделяемое в процессе отвердевания:
Q=−λm
Парообразование и конденсация
ОпределениеПарообразование, или кипение — переход вещества из жидкого состояния в газообразное.
Количество теплоты, необходимое для процесса кипения, вычисляют по формуле:
Q=rm
m — масса вещества, r (Дж/кг) — удельная теплота парообразования.
Парообразование происходит при определенной температуре, которую называют температурой кипения. В отличие от испарения, процесс парообразования идет со всего объема жидкости. Несмотря на то, что к кипящему веществу подводят тепло, температура не изменяется. Все затраты энергии идут на увеличение промежутком между молекулами. Температура кипения зависит от рода вещества и внешнего атмосферного давления.
Удельная теплота парообразования показывает, какое количество теплоты необходимо затратить, чтобы перевести в пар 1 кг жидкости, нагретой до температуры кипения. Такое же количество теплоты выделится в процессе конденсации 1 кг пара, охлажденного до температуры конденсации.
Внимание! Удельная теплота парообразования — табличная величина.
ОпределениеКонденсация — процесс, обратный кипению. Это переход вещества из газообразного состояния в жидкое.
Конденсация происходит при температуре кипения, которая также не изменяется во время всего процесса. Количество теплоты, выделяемое в процессе конденсации:
Q=−rm
Тепловые процессы при нагревании и охлаждении
Все фазовые переходы, а также процессы нагревания и остывания вещества можно отобразить графически. Посмотрите на график фазовых переходов вещества:
Он показывает зависимость температуры вещества от времени в процессе его нагревания и остывания. Опишем процессы, отображаемые на графике, в таблице.
| Процесс | Что происходит | Количество выделенной теплоты |
| 1–2 | Нагревание твердого тела |
Q=cтm(tпл−t0) ст — удельная теплоемкость вещества в твердом состоянии. |
| 2–3 | Плавление при температуре плавления (tпл) |
Q=λm |
| 3–4 | Нагревание жидкости |
Q=cжm(tкип−tпл) сж — удельная теплоемкость вещества в жидком состоянии. |
| 4–5 | Кипение при температуре кипения (tкип) |
Q=rm |
| 5–6 | Нагревание пара |
Q=cпm(t−tкип) сп — удельная теплоемкость вещества в газообразном состоянии. |
| 6–7 | Охлаждение пара |
Q=cпm(tкип−t) |
| 7–8 | Кипение при температуре кипения (tкип) |
Q=−rm |
| 8–9 | Охлаждение жидкости |
Q=cжm(tпд−tкип) |
| 9–10 | Отвердевание при температуре плавления (tпл) |
Q=−λm |
| 10–11 | Охлаждение твердого тела |
Q=cтm(t0−tпл) |
Внимание! На участках 2–3 и 9–10 вещество частично находится в жидком и твердом состояниях, а на 4–5 и 7–8 — в жидком и газообразном.
Частные случаи тепловых процессов
| Что происходит | График | Формула количества теплоты |
| Полностью растопили лед, имеющий отрицательную температуру. | 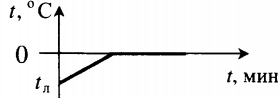 |
Q=cлm(tпл−tл)+λm cл — удельная теплоемкость льда, tл — начальная температура льда. |
| Лед, взятый при отрицательной температуре, превратили в воду при комнатной температуре. | 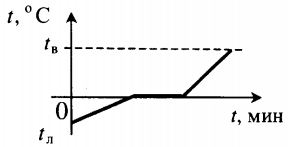 |
Q=cлm(tпл−tл)+λm+cвm(tв−tпл) cв — удельная теплоемкость воды. |
| Взяли лед при температуре 0 оС и полностью испарили. | 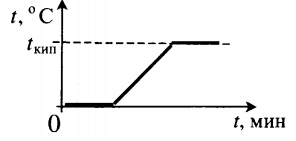 |
Q=λm+cвm(tкип−tпл)+rm |
| Взяли воду при комнатной температуре и половину превратили в пар. | 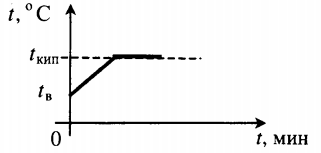 |
Q=cвm(tкип−tв)+rm2 |
Подсказки к задачам
| Единицы измерения | Температуру можно оставлять в градусах Цельсия, так как изменение температуры в градусах Цельсия равно изменению температуры в Кельвинах. |
| Кипяток | Вода, которая при нормальном атмосферном давлении имеет температуру в 100 оС. |
| Объем воды 5 л | m = 5 кг, так как:
m=ρV=103· Внимание! Равенство V (л) = m (кг) справедливо только для воды. |
Пример №1. Какое количество теплоты нужно сообщить льду массой 2 кг, находящемуся при температуре –10 оС, чтобы превратить его в воду и нагреть ее до температуры +30 оС?
Можно выделить три тепловых процесса:
- Нагревание льда до температуры плавления.
- Плавление льда.
- Нагревание воды до указанной температуры.
Поэтому количество теплоты будет равно сумме количеств теплоты для каждого из этих процессов:
Q=Q1+Q2+Q3
Q=cлm(0−t1)+λm+cвm(t2−0)
Удельные теплоемкости и удельную теплоту плавления смотрим в таблицах:
- Удельная теплоемкость льда = 2050 Дж/(кг∙К).
- Удельная теплоемкость воды = 4200 Дж/(кг∙К).
- Удельная теплота плавления льда = 333,5∙103 Дж/кг.
Отсюда:
Q=2050·2(0−(−10))+333,5·103·2+4220·2·30=961200 (дж)=961,2 (кДж)
Уравнение теплового баланса
Суммарное количество теплоты, которое выделяется в теплоизолированной системе равно количеству теплоты (суммарному), которое в этой системе поглощается.
Математически уравнение теплового баланса с учетом знаков количества теплоты записывается так:
Qотд=−Qпол
Отданное количество теплоты меньше нуля (Qотд < 0), а полученное количество теплоты положительно (Qполуч > 0).
Подсказки к задачам на уравнение теплового баланса
| Теплообмен происходит в калориметре | Потерями энергии можно пренебречь. |
| Жидкость нагревают в некотором сосуде | Начальные и конечные температуры жидкости и сосуда совпадают. |
| В жидкость опускают термометр | Через некоторое время он покажет конечную температуру жидкости и термометра. |
| Мокрый снег | Содержит воду и лед при 0 оС. Учтите, что лед плавится, если он находится при температуре 0 оС и получает энергию от более нагретого тела. Вода кристаллизируется при температуре 0 оС, если она отдает энергию более холодному телу. Если лед и вода находятся при температуре 0 оС, то никаких агрегатных переходов между ними не происходит. |
Частные случаи теплообмена
| В воду комнатной температуры бросили ком снега, содержащий некоторое количество воды, после чего установилась некоторая положительная температура. | 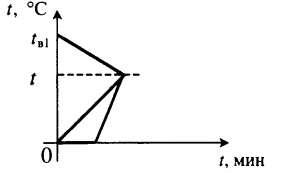
Уравнение теплового баланса: Q1+Q2+Q3=0 cвmв1(t−tв1)+cвmв2(t−0)+λmл+cвmл(t−0)=0 |
| Для получения некоторой положительной температуры воды используют горячую воду и лед, имеющий отрицательную температуру. | 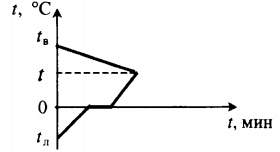
Уравнение теплового баланса: Q1+Q2=0 cвmв(t−tв)+cлmл(0−tл)+λmл+cвmл(t−0)=0 |
| В воду комнатной температуры бросают раскаленное твердое тело, в результате часть воды испаряется. | 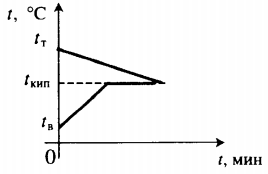
Уравнение теплового баланса: Q1+Q2=0 cтmт(100−tт)+cвmв(100−tв)+rmп=0 |
| Воду комнатной температуры нагревают до кипения, вводя пар при t = 100 оС. | 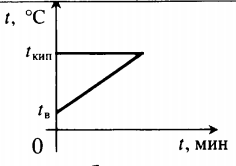
Уравнение теплового баланса: Q1+Q2=0 −rmп+cвmв(100−tв)=0 |
| Лед, имеющий температуру плавления, нагревают до положительной температуры, вводя пар при t = 100 оС. | 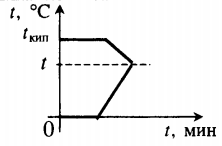
Уравнение теплового баланса: Q1+Q2=0 −rmп+cвmп(t−tкип)+λmл+cвmл(t−tпл)=0 |
Пример №2. В кастрюлю, где находится вода объемом 2 л при температуре 25 оС, долили 3 л кипятка. Какая температура воды установилась?
2 л = 2 кг
3 л = 3 кг
Количество теплоты, отданное кипятком, равно количеству теплоты, принятому более прохладной водой. Поэтому:
cm1(t−t0)=−cm2(t−tкип)
Или:
m1(t−t0)=−m2(t−tкип)
m1t+m2t=m1t0+m2tкип
(m1+m2)t=m1t0+m2tкип
t=m1t0+m2tкипm1+m2
t=2·25+3·1002+3=3505=70 (°C)
Взаимные превращения механической и внутренней энергии
Если в тексте задачи указан процент одного вида энергии, перешедший в другой, то он указывается в виде десятичной дроби перед этой энергией, которой тело обладало вначале.
Частные случаи закона сохранения энергии
| При неупругом ударе о стенку пуля нагрелась |
mv22=cmΔt |
| Тело падает с некоторой высоты и в момент падения нагревается |
mgh=cmΔt |
| В результате того, что пуля пробивает стену, ее скорость уменьшается, 50% выделившейся при этом энергии идет на нагревание пули |
0,5(mv202−mv22)=cmΔt |
| Летящая пуля при ударе о стенку расплавилась. Начальная температура пули меньше температуры плавления |
mv22=cmΔt+λm |
| Капля воды, падая с некоторой высоты, в момент удара испарилась. Температура капли у поверхности земли меньше температуры кипения. На нагрев пошло 60% выделившейся механической энергии |
0,6mgh=cmΔt+rm |
| Вследствие сгорания топлива ракета поднялась на некоторую высоту |
qmтоп=mрgh |
| Вследствие сгорания топлива снаряд приобрел некоторую скорость, и на это было затрачено 25% энергии |
0,25qmтопmсv22 |
Пример №3. Свинцовая дробинка, летящая со скоростью 100 м/с, попадает в доску и входит в нее. 52% кинетической энергии дробинки идет на ее нагревание. На сколько градусов нагрелась дробинка? Удельная теплоемкость свинца 130 Дж/(кг∙К).
Запишем закон сохранения энергии для этого случая:
0,52mv22=cmΔt
Δt=0,52v22c=0,52·10022·130=20 (К)
Примеры КПД
| Устройство | Полезная энергия (работа), затраченная энергия (полная работа) | КПД |
| Электронагреватель, электроплитка, электрочайник, кипятильник. |
Qполезн=cmΔT Иногда: Qполезн=cmΔT+rm Wзатр=Pt (произведение мощности на время) |
η=cmΔTPt100% |
| Газовая горелка, паровая турбина, спиртовка, плавильная печь. |
Qполезн=cmΔT Qзатр=qmтоп |
η=cmΔTqmтоп100% |
| Двигатель автомобиля, самолета. |
Aполезн=Nt=Nsv Qзатр=qmтоп |
η=cmΔTvqmтоп100 |
| Ружье с пороховым зарядом, пушка |
Eполезн=mv22 Qзатр=qmпор |
η=mv22qmпор100 |
Внимание! Если в задаче указано время, в течение которого происходит один тепловой процесс, а спрашивают о времени протекания другого, то считайте, что мощность нагревателя или холодильника постоянна:
Q1t1=Q2t2
Пример №4. Для нагревания на электроплитке некоторого количества воды от 20 до 100 оС потребовалась 21 минута. Сколько времени после этого необходимо для полного испарения воды? Удельная теплоемкость воды 4200 Дж (кг∙К), удельная теплота парообразования 2,24 МДж/кг.
Будем считать, что мощность электроплитки постоянна. Поэтому:
Q1t1=Q2t2
Количество теплоты, сообщенное воде при нагревании:
Q1=сm(t2−t1)
Количество теплоты, которое нужно сообщить, чтобы вода полностью испарилась:
Q1=rm
Отсюда:
сm(t2−t1)t1=rmt2
Задание EF17544
Кусок льда, имеющий температуру 0°С, помещён в калориметр с электронагревателем. Чтобы превратить этот лёд в воду с температурой 12°С, требуется количество теплоты 80 кДж. Какая температура установится внутри калориметра, если лёд получит от нагревателя количество теплоты 60 кДж? Теплоёмкостью калориметра и теплообменом с внешней средой пренебречь.
Ответ:
а) 0°С
б) 4°С
в) 6°С
г) 9°С
Алгоритм решения
1.Записать исходные данные и перевести единицы измерения величин в СИ.
2.Записать уравнение теплового баланса для первого случая.
Решение
Запишем исходные данные:
• Начальная температура льда: t0 = 0 oC.
• Конечная температура воды в первом случае: t1 = 12 oC.
• Количество теплоты, выделенное электронагревателем в первом случае: Q1 = 80 кДж.
• Количество теплоты, выделенное электронагревателем во втором случае: Q2 = 60 кДж.
Составим уравнение теплового баланса для первого случая:
Q1=λm+cmt1
Внимание! Вместо разности температур используется значение только конечной температуры, так как начальная температура равна 0.
Найдем массу льда из уравнения теплового баланса для первого случая. Учтем что:
• Удельная теплоемкость воды: c = 4200 Дж/(кг∙К).
• Удельная теплота плавления льда: λ = 333,5 кДж/(кг∙К).
Отсюда:
Чтобы расплавить кусок льда массой 0,5 кг, нужно затратить следующее количество теплоты:
Лед не расплавится весь, так как ему будет сообщено лишь 60 кДж теплоты. Поэтому в калориметре температура будет равна 0 оС.
Ответ: а
pазбирался: Алиса Никитина | обсудить разбор
Задание EF18791
Внимательно прочитайте текст задания и выберите верный ответ из списка
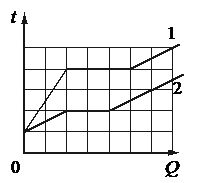
Используя данные графиков, выберите из предложенного перечня два верных утверждения и укажите их номера.
Ответ:
а) Температура плавления первого тела в 1,5 раза больше, чем второго.
б) Тела имеют одинаковую удельную теплоёмкость в твёрдом агрегатном состоянии.
в) Удельная теплоёмкость второго тела в твёрдом агрегатном состоянии
в 3 раза больше, чем первого.
г) Оба тела имеют одинаковую удельную теплоту плавления.
д) Тела имеют одинаковую удельную теплоёмкость в жидком агрегатном состоянии.
Алгоритм решения
- Проанализировать каждое из утверждений.
- Проверить истинность утверждений с помощью графика.
- Выбрать и записать верные утверждения.
Решение
Проверим первое утверждение, согласно которому, температура плавления первого тела в 1,5 раза больше, чем второго.
Если это было бы так, то количество клеток до горизонтального участка графика 1 относилось к количеству клеток до горизонтального участка графика 2 как 3 к 2. Но мы видим, что до 1 графика 4 клетки, до 1 — 2. Следовательно, температура плавления первого тела в 2 раза больше, чем второго.
Первое утверждение неверно.
Проверим второе утверждение, согласно которому тела имеют одинаковую удельную теплоёмкость в твёрдом агрегатном состоянии.
Если бы это было так, то соответствующие участки графиков совпадали бы. Только в таком случае температура тел увеличивалась на одну и ту же температуру при получении одного и того же количества теплоты. Но мы видим, что это не так.
Второе утверждение неверно.
Проверим третье утверждение, согласно которому удельная теплоёмкость второго тела в твёрдом агрегатном состоянии в 3 раза больше, чем первого.
Если это было бы так, то первое тело при сообщении телам одинакового количества теплоты нагревалось бы втрое быстрее второго. И это действительно так, потому что температура второго во время нагревания в твердом состоянии увеличилась только на 1 клетку, в то время как температура первого тела — на 2 клетки.
Третье утверждение верно.
Проверим четвертое утверждение, согласно которому оба тела имеют одинаковую удельную теплоту плавления.
Если это было бы так, то протяженность горизонтальных участков обоих графиков была бы одинаковой. Но это не так. Протяженность этого участка для тела 1 составляет 3 клетки, для тела 2 — 2 клетки.
Четвертое утверждение верно.
Проверим пятое утверждение, согласно которому тела имеют одинаковую удельную теплоёмкость в жидком агрегатном состоянии.
Если бы это было так, то соответствующие участки графиков были параллельными. Только при таком условии при повышении температуры на одно и то же количество градусов тела бы получли одинаковое количество теплоты. И это действительно так.
Пятое утверждение верно.
Вывод: верным утверждения «в» и «д».
Ответ: вд
pазбирался: Алиса Никитина | обсудить разбор
Задание EF22685
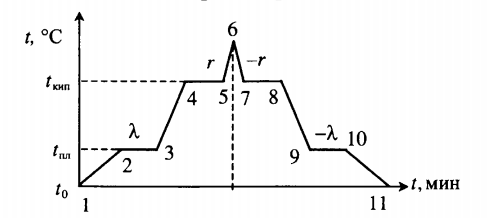
В сосуде лежит кусок льда. Температура льда t1 = 0 °C. Если сообщить ему количество теплоты Q = 50 кДж, то 3/4 льда растает. Какое количество теплоты q надо после этого сообщить содержимому сосуда дополнительно, чтобы весь лёд растаял и образовавшаяся вода нагрелась до температуры t2 = 20 °C? Тепловыми потерями на нагрев сосуда пренебречь.
Алгоритм решения
1.Записать исходные данные и перевести единицы измерения в СИ.
2.Записать уравнение теплового баланса.
3.Выполнить решение в общем виде.
4.Определить и вычислить искомую величину.
Решение
Запишем исходные данные:
• Начальная температура льда: t1 = 0 oC.
• Конечная температура воды: t2 = 20 oC.
• Количество теплоты, переданное льду изначально: Q = 50 кДж.
• Удельная теплоемкость воды: c = 4200 Дж/(кг∙К).
• Удельная теплота плавления льда: λ = 333,5 кДж/(кг∙К).
50 кДж = 50000 Дж
333,5 кДж = 333500 Дж
Составим уравнение теплового баланса:
Qобщ=Q+q
где q — количество теплоты, необходимое для того, чтобы окончательно растопить лед и нагреть воду:
q=Q2+Q3
Мы знаем, что изначально было растоплено 3/4 льда. Поэтому:
Q=3λm4
Отсюда масса льда равна:
m=4Q3λ
На растопку оставшегося льда уйдет следующее количество теплоты:
Q2=λm4
На нагревание воды уйдет следующее количество теплоты:
Q3=cmt2
Внимание! Вместо разности температур используется значение только конечной температуры, так как начальная температура равна 0.
Отсюда:
pазбирался: Алиса Никитина | обсудить разбор
Алиса Никитина | Просмотров: 13.3k
Испарение сопровождается остыванием жидкости. Чем она холоднее, тем менее интенсивно происходит образование пара. Но скорость процесса можно поддерживать, если жидкость подогревать, то есть подводить к ней тепло.
Так возникает понятие удельной теплоты парообразования. У каждого жидкости и даже твердого тела (ведь и его можно превратить в пар) эта величина своя. Рассмотрим, как найти удельную теплоту парообразования.
Содержание
- Единица измерения
- Формула для величины
- Какие данные нужны, чтобы рассчитать значение?
- Алгоритм и правила расчета
- Несколько примеров нахождения
- Таблица для ряда веществ
- Видео по теме статьи
- Заключение
Единица измерения
Удельная теплота парообразования – это величина, которая показывает, сколько теплоты необходимо сообщить веществу массой 1 кг, чтобы превратить его в пар. При этом температура вещества должна быть постоянной.
Обычно рассматриваемую величину обозначают латинскими буквами L, r или греческой λ (лямбда). Теплота в системе СИ измеряется в Джоулях (Дж), масса – в килограммах (кг). Таким образом, L измеряется в Дж/кг.
Так как теплота в джоулях принимает зачастую большие значения, может встречаться обозначения кДж (килоджоули) – Дж*1000, или МДж (мегаджоули) – Дж*1000 000.
Формула для величины

- Q – теплота,
- m – масса.
Ее часто используют для расчетов энергетических затрат на выпаривание воды из растворов: Q= L* m.
L определяют в лабораториях и заносят в таблицы, составляют справочники, которыми можно пользоваться любому желающему. При этом всегда указывают температуру и давление, при которых находилось L.
С ростом температуры L уменьшается, так как жидкость расширяется, взаимодействие между ее частицами уменьшается, и ее легче превратить в пар. Когда плотность пара и жидкости сравниваются, наступает критическое состояние.
Оно характеризуется определенным давлением и температурой. Для воды — это 374 ℃ и 218,5 атм. В таком состоянии L=0.
Какие данные нужны, чтобы рассчитать значение?
Чтобы вычислить искомую величину, применяют знания о том, что теплота испарения равна теплоте конденсации со знаком «минус». Это значит, что когда пар конденсируется (превращается в воду), он охлаждается и отдает свое тепло окружающей среде. Можно применить формулу: Q= L* m.
Для расчетов необходимы следующие данные:
- Q – теплота, отданная паром, Дж,
- m – масса образовавшейся в процессе конденсации воды, кг;
- L – удельная теплота парообразования, Дж/кг – собственно то, что нужно определить.
Применяют также закон сохранения энергии и понятие теплоемкости: Qв=С*Mв*(T2-T1), где:
- С – удельная теплоемкость воды, которая нагревается под действием сконденсированного пара, Дж/(кг*К), – считается известной и берется из таблицы,
- Mв – ее масса;
- T2-T1 – изменение температуры в Кельвинах или градусах Цельсия.
Алгоритм и правила расчета

- Анализируют, как проходит процесс, какое вещество отдает, а какое получает тепло.
- Переводят все единицы измерения в одну систему.
- Записывают необходимые формулы.
- Решают уравнение с одним неизвестным.
При проведении расчетов надо следить за размерностью величин. В системе СИ масса измеряется в кг, теплота в Дж, а температура в градусах Кельвина. Разность температур можно считать в градусах Цельсия.
Часто бывает нужно найти удельную теплоту парообразования при условиях кипения жидкости и нормальном атмосферном давлении (760 мм рт. ст.). В таких условиях получают чистую воду из растворов или выделяют из смеси веществ ее части.
Процесс используется в химической и пищевой промышленности и даже на бытовом уровне.
Несколько примеров нахождения
Задача №1. Сколько необходимо энергии для превращения в пар следующих кипящих веществ:
- 2 кг этилового спирта;
- 2 кг воды;
- 2 кг расплавленного свинца.
Необходимо воспользоваться формулой Q= L* m и взять значение L из таблицы. Получится:
- 0,84*МДж*2 кг = 1,68 МДж;
- 2,3 МДж*2 кг = 4,6 МДж;
- 8,6 МДж *2 кг = 17,2 МДж.
Как видно, превратить в пар воду сложнее, чем этанол, но легче, чем металл. На первый взгляд, это очевидно, но когда дело касается веществ, близких по температуре кипения, то разница становится менее заметна, ее невозможно угадать. Тем не менее, она имеет особое значение.
Задача №2. Как вычислить, сколько энергии необходимо, чтобы превратить 1 тонну воды при 20 ℃ в пар при 100 ℃?
Решение: 1 т = 1000 кг.

- Q1 – тепло, ушедшее на нагревание воды с 20 до 100 градусов,
- Q2 – тепло, необходимое для образования пара (процесс происходит без изменения температуры).
Q1 = С*M* (T2-T1), С воды = 4200 Дж/(кг*К), Q2 = L*M, L воды при обычном кипении = 2,3 МДж/кг, T2-T1 = 100-20 = 80.
Подставляя известные величины, находят искомую энергию: Q = 4200*1000*80+2,3 *106*1000 = 4,2*80*106+2300*106=2636 (МДж)
Задача №3. Сколько надо затратить электроэнергии, чтобы превратить 1 л воды в пар?
Решение: Q= Lводы*m. Масса 1 литра обычной водопроводной воды равна 1 кг. Q=2260 кДж/кг *1 кг=2260 кДж=2,3 МДж.
1 кВт*ч = 3,6 МДж. Из простой пропорции следует, что надо затратить 0,64 кВт*ч. Для 2-х литров величина возрастет в 2 раза, для 3-х – в три, и так далее.
Зная тарифы на электроэнергию, несложно посчитать стоимость, во сколько рублей обойдется такое кипячение. Надо также учитывать, что частично энергия уйдет в воздух и на нагрев сосуда, частей плиты, поэтому реальный расход будет выше.
Таблица для ряда веществ
Удельная теплота парообразования при нормальном атмосферном давлении (1 атм = 760 мм рт. ст.) и температуре кипения (для каждого вещества она своя).
| Вещество | L, МДж/кг | T кипения, ℃ |
| Вода | 2,3 | 100 |
| Этиловый спирт | 0,84 | 78,4 |
| Метиловый спирт | 1,1 | 64,1 |
| Ртуть | 0,28 | 357 |
| Жидкий азот | 0,2 | -195,8 |
| Аммиак | 1,4 | -33,4 |
| Фреон 12 | 0,16 | -24,9 |
| Расплавленный алюминий | 10,9 | 2450 |
Для воды при 20 ℃ L=2,45МДж/кг.
Видео по теме статьи
Об удельной теплоте парообразования расскажет видео:
Заключение
Единица измерения удельной теплоты парообразования – Дж/кг. Она показывает, сколько при заданной температуре надо подвести тепла, чтобы преобразовать 1 кг вещества в пар. Величина определяется путем проведения экспериментов.
Для воды при 100 ℃ ее значение 2260 кДж/кг. Эта величина довольно большая в сравнении с характеристиками других веществ. С ростом температуры значение удельной теплоты образования пара уменьшается.