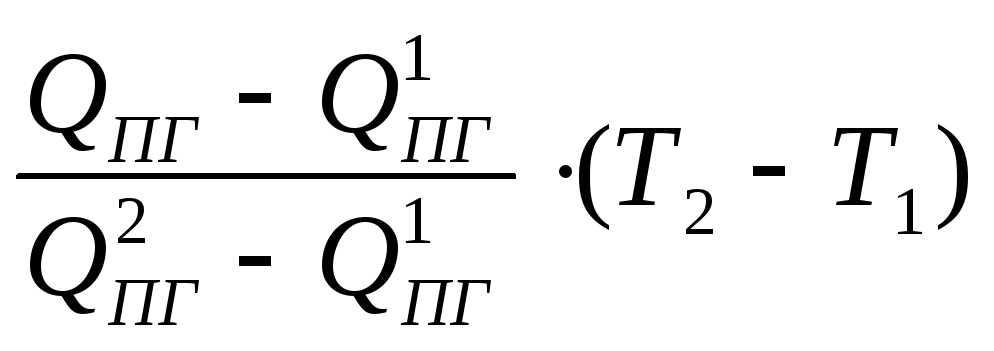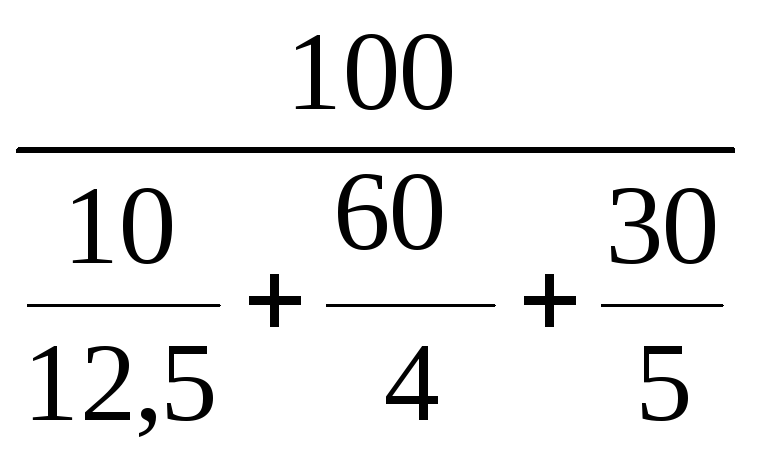Выделяющееся
в зоне горения тепло расходуется на
нагревание продуктов горения, на нагрев
горючего вещества и окружающей среды.
Та температура, до которой в процессе
горения нагреваются продукты горения,
называется температурой
горения. В
технике и пожарном деле различают
теоретическую,
калориметрическую, адиабатическую
и действительную
температуру горения (табл.3.1).
Таблица
3.1. Условия определения температуры
горения
-
Температура
горенияУсловия
определенияQ
потерь
Учет
диссоциации ПГТеоретическая
0
1
да
Калориметрическая
0
1
нет
Адиабатическая
0
1
нет
Действительная
0
1
нет
В
общем случае для вычисления температуры
горения используется следующая
зависимость:
QПГ
= VПГ
ТГ
, где
(3.6)
QПГ
– теплота (теплосодержание) продуктов
горения, кДж/кг;
VПГ
– объем
продуктов горения, м3/кг;
–средняя
объемная теплоемкость смеси продуктов
горения в интервале температур от
Т0
до Тг,
кДж/м3К;
ТГ
– температура горения, К.
При
расчете калориметрической температуры
горения исходят из того, что теплопотери
в окружающую среду отсутствуют, и в этом
случае низшая теплота сгорания горючего
вещества (Qн)
равна теплосодержанию продуктов горения
(QПГ),
т.е. энергии, необходимой для нагревания
продуктов горения от 00С
до теоретической температуры горения.
В
реальных условиях температура горения
зависит не только от состава горючего
материала, но и от условий горения:
разбавления продуктов горения избыточным
воздухом (что учитывается коэффициентом
избытка воздуха ),
начальной температуры воздуха, полноты
сгорания исходного горючего материала
и наличия теплопотерь (коэффицент
теплопотерь ).
Qпотерь
= Qизлучения
+ Qнедожог
+ Qдиссоциации
ПГ
(3.7)
В
зависимости от рода учитываемых потерь
теплоты из зоны горения вычисляется та
или иная температура горения.
Расчет
температуры горения проводят по уравнению
энергетического баланса:
Qн
(1 – )
= VПГпр
Ср
(ТГ –
Т0)
, где (3.8)
Qн
– тепло, выделяемое в реакции горения,
кДж;
– коэффициент
теплопотерь; Qн
(1 – )=
QПГ;
VПГпр
– объем продуктов полного горения с
учетом избытка воздуха, м3;
Ср
– средняя объемная теплоемкость
продуктов горения при постоянном
давлении,
кДж/м3К;
ТГ
– температура горения, К;
Т0
– начальная температура, К.
Из
уравнения (3.8) следует, что для расчета
температуры горения необходимо знать
теплоту горения, объем и теплоемкость
продуктов горения.
В
первом приближении температуру горения
можно рассчитать непосредственно из
уравнения (3.6), имея в виду, что средняя
теплоемкость газообразных продуктов
горения в интервале температур 1500 –
2500 К может быть принята равной
=
1,75 кДж/м3К.
Однако, теплоемкость зависит от
температуры, и поэтому для более точных
расчетов значения теплоемкостей берут
из таблиц (приложение 3 и 4), а подсчет
производят методом последовательных
приближений (методом итераций), каждый
раз определяя теплосодержание продуктов
горения при выбранной температуре.
Алгоритм
расчета температуры горения
1.
Рассчитать суммарный объем продуктов
горения и отдельно объем каждого
компонента продуктов горения.
VПГпр
= V(CO2)
+ V(H2O)
+ V(N2)
+ V(SO2)
+ Vвозд
Расчет
объема продуктов горения выполняется
в зависимости от характера горючего
вещества (индивидуальное вещество,
смесь газов или вещество сложного
элементного состава). Методика расчета
приведена в примерах 2.8,
2.9,
и 2.10.
Для
индивидуальных веществ можно также
определять количество продуктов горения
в молях (коэффициенты в уравнении реакции
горения).
2. Рассчитать низшую
теплоту сгорания вещества.
Для
индивидуальных веществ расчет выполняется
по I
следствию закона Гесса (при наличии
табличных значений энтальпий образования).
По
формуле Д.И. Менделеева (3.3) расчет Qн
может быть выполнен как для веществ с
известным элементным составом, так и
для индивидуальных веществ.
Для
газовых смесей Qн
рассчитывается по формулам (3.4) и (3.5).
3.
Если по условию задачи есть теплопотери
(),
то рассчитывается количество тепла,
пошедшего на нагрев продуктов горения
QПГ
QПГ
= Qн
(1 –
),
кДж/кг или кДж/м3
(3.9)
4.
Находим среднее теплосодержание
продуктов горения Qср
при
отсутствии теплопотерь ()
Qср
=
,
кДж/м3
(3.10)
при
наличии теплопотерь
Qср
=
,
кДж/м3
(3.11)
5.
По значению Qср
с помощью таблиц приложений 3 и 4
(“Теплосодержание газов при постоянном
давлении”), ориентируясь
на азот ,
приближенно определяем температуру
горения Т1.
При
подборе температуры горения ориентируются
на азот, т.к. в большей степени продукты
горения состоят именно из азота. Однако,
поскольку теплосодержание углекислого
газа и паров воды выше, чем у азота, то
их присутствие в продуктах горения
несколько понижает температуру горения,
поэтому ее нужно принимать несколько
ниже (на 100-2000С),
чем по азоту.
6.
Рассчитываем теплосодержание продуктов
горения при выбранной температуре Т1:
(3.12)
где
Q1(CO2),
Q1(H2O),
Q1(N2),
Q1(SO2),
Q1(возд)
– табличные значения теплосодержания
газов
при
выбранной температуре Т1.
7.
Сравниваем Q1ПГ
с Qн
или QПГ,
рассчитанных по п.2 или п.3.
Если
Q1ПГ
< Qн
(QПГ),
то выбираем
температуру
Т2
> Т1
на 1000С;
если
Q1ПГ
> Qн
(QПГ),
то выбираем
температуру
Т2
< Т1
на 1000С
.
8.
Повторяем расчет теплосодержания
продуктов горения при новой температуре
Т2:
9.
Расчет проводим до получения неравенства:
Q1ПГ
< Qн
(QПГ)
< Q2ПГ
, где
Q1ПГ
и
Q2ПГ
– теплосодержание продуктов горения
при температурах Т1
и Т2,
отличающихся
на 1000С.
10.
Интерполяцией определяем температуру
горения ТГ:
ТГ
= Т1
+
(3.13)
Если
потери тепла не учитывались, то получаем
адиабатическую температуру горения, а
если учитывались, то
действительную температуру горения
вещества.
|
Расчет |
Пример |
1.
Составляем уравнение реакции горения
анилина:
С6Н5NH2
+ 7,75(O2
+ 3,76 N2)
= 6 CO2
+ 3,5 H2O
+ 7,753,76
N2
+ 0,5 N2
По уравнению
реакции горения определяем число моль
продуктов горения и число моль избытка
воздуха:
nвтеор
= 7,75
4,76 = 36,89 моль
nв
= nвтеор
(
–1) = 36,89 (1,1 – 1) = 3,689 моль
nпгпр
= n(СО2)+n(Н2О)
n(N2)+n(Vв)
= 6 + 3,5 + 7,753,76
+ 0,5 + 3,689 = 42,829 моль
2.
Теплота горения анилина по справочным
данным составляет
Qгор
= 3484, кДж/моль = 3484000 Дж/моль
3.
По условию задачи теплопотери составляют
20 %, следовательно,
= 0,2.
QПГ
= 3484000
(1 – 0,2) = 2787200 Дж/моль
4.
Определяем среднее теплосодержание
продуктов горения:
Qср
=
65077,4 Дж
5.
По таблице приложения 3, ориентируясь
на азот, определяем Т1
= 18000С
6.
Рассчитываем теплосодержание продуктов
горения при 18000С.
QПГ1800
= 96579,56
+ 77598,83,5
+ 59539,97,753,76
+ 660003,689
= 2859312,7 Дж
7.
QПГ1800
= 2859312,7 > QПГ
= 2787200 ,
следовательно, выбираем Т2
= 17000С
8.
Рассчитываем теплосодержание продуктов
горения при 17000С.
QПГ1700
= 90545,96
+ 72445,13,5
+ 55936,57,753,76
+ 56397,43,689=2662844,5
Дж
QПГ1700
= 2662844,5 < QПГ
= 2787200,
следовательно температура горения
находится в интервале от 1700 до 18000С.
9.
Рассчитываем температуру горения:
ТГ
=1700 +
=
17630С
= 2036 К
|
Расчет известным |
Пример |
1.
По формулам (2.9) – (2.12) определяем объем
каждого компонента продуктов горения
1 кг горючего сланца.
V(СО2)
=
= 0,651 м3
V(H2O)
=
= 0,746 м3
V(SО2)
=
=
0,028 м3
V(N2)
=
= 3,455 м3
VПГ
= 0,651 + 0,746 + 0,028 + 3,455 = 4,88 м3
2.
Горение протекает с коэффициентом
избытка воздуха 1,2, следовательно, в
состав продуктов горения будет входить
избыточный воздух.
По
формуле (3.8) определяем теоретический
объем воздуха, необходимый для горения
данной массы образца угля:
Vвтеор
=
=
4,28 м3
Избыток
воздуха определим по формуле (2.4):
Vв=
Vвтеор(
1)
= 4,28(1,2
– 1) = 0,856 м3
С
учетом избытка воздуха практический
объем продуктов горения составит:
VПГ*
= VПГ
+ Vв
= 4,88 + 0,856 = 5,736 м3
3.
Рассчитываем Qн
по формуле Д.И. Менделеева.
Qн
= 339,435
+ 12575
– 108,9(10
+ 1 – 4) – 25,1(95
+ 15) = 15881,7 кДж/кг
4. С учетом теплопотерь
определяем теплосодержание продуктов
горения:
QПГ
= 15881,7 (1,1 – 1) = 14293,53 кДж/кг
5. Определяем
среднее теплосодержание продуктов
горения:
Qср
=
2480,22
кДж/м3
По
таблице приложения 4, ориентируясь на
азот, определяем Т1
= 15000С.
6.
Определяем теплосодержание продуктов
горения при 15000С:
QПГ1500
= 3505,70,651
+ 2781,30,746
+ 2176,73,455
+ 3488,20,028
+ 2194,70,856
= 13853,889 кДж
7.
QПГ1500
= 13853,889 < QПГ
= 14293,53, следовательно, выбираем Т2
= 16000С.
8.
Определяем теплосодержание продуктов
горения при 16000С:
QПГ1600
= 3771,40,651
+ 3004,20,746
+ 2335,53,455
+ 3747,50,028
+ 2355,20,856
= 14886,44 кДж
9.
QПГ1600=
14886,44 > QПГ
= 14293,53, следовательно, температура
горения вещества находится в интервале
от 1500 до 16000С.
10.
Определяем температуру горения:
ТГ
=1500 +
=
15560С
= 1829 К
ГОРЕНИЕ
ГАЗО- И ПАРОВОЗДУШНЫХ СМЕСЕЙ
|
Расчет |
Пример |
Концентрационные
пределы распространения пламени (область
воспламенения) для газо- и паровоздушных
смесей могут быть рассчитаны по следующей
формуле
,
%, (4.1)
где
Н(В)
— нижний
(верхний) концентрационный предел
распространения пламени ( НКПР и ВКПР
), %;
—
число молекул кислорода ( коэффициент
перед кислородом в уравнении реакции
горения вещества );
a
и b
— константы, имеющие значения, приведенные
в таблице 4.1.
Таблица
4.1. Значения коэффициентов “а”
и “b”
для расчета концентрационных пределов
распространения пламени
-
КПР
а
b
НКПР
8,684
4,679
ВКПР
7,5
1,550
0,560
7,5
0,768
6,554
1. Составляем
уравнение реакции горения этанола.
С3Н8
+ 5( О2
+ 3,76 N2
) =3СО2
+ 4Н2О
+ 5·
3,76 N2
=
5
2.
н
= НКПР =
2,07
%
в
= ВКПР =
12,03%
|
Расчет |
Пример |
Значения
НКПР И ВКПР следует применять при
расчетах безопасных концентраций газов
и паров с использованием коэффициентов
безопасности:
г.без.
,
где
(4.2)
г.без.
– безопасная концентрация горючих
газов, паров или пылей, % объемных;
н
– НКПР, % объемных;
Кб
– коэффициент безопасности.
1.
При расчете взрывобезопасных концентраций
газов, паров и пылей внутри технического
оборудования, трубопроводов, вентиляционных
систем.
Кб
= 2.
2.
При расчете предельно-допустимых
взрывобезопасных концентраций газов,
парво, пылей в воздухе рабочей зоны с
потенциальными источниками зажигания
Кб
= 20.
1. Составляем
уравнение реакции горения амилацетата.
СН3СООС5Н11
+ 9,5( О2
+ 3,76 N2
) =7СО2
+ 7Н2О
+ 9,5·
3,76 N2
=
9,5
2.
н
= НКПР =
1,14 %
3.
Рассчитаем безопасную концентрацию:
г.без.
=
0,05 %
0,3
> 0,05, следовательно, проводить
сварочные работы нельзя.
|
Расчет |
Пример |
Стехиометрической
концентрацией называется такая
концентрация, когда реагирующие вещества
взяты в эквивалентных отношениях, при
этом коэффициент избытка воздуха
= 1.
Расчет
стехиометрической концентрации
производится по уравнению реакции
горения индивидуального вещества. Общие
формулы для вычисления объемной и
массовой стехиометрической концентрации
следующие:
стехобъем
=
,
%
(4.3)
стехмасс
=
,
г/м3.
(4.4)
1.
Уравнение реакции горения пропана.
С3Н8
+ 5( О2
+ 3,76 N2
) = 3СО2
+4Н2О
+ 5·
3,76 N2
=
5
стехобъем
=
= 4,03 %
2.
Молярная масса М (С3Н8)
= 46 г/моль (кг/кмоль);
Vм
=
=
26,1 м3/кмоль
стехмасс
=
= 71,0 г/м3.
|
Расчет на |
Пример |
1.
В примере 7.1. были рассчитаны значения
НКПР и ВКПР для пропана.
н
= 2,07 %; в
= 12,03%.
Это
означает, что в 100 м3
пропано-воздушной смеси на НКПР содержится
2,07
м3
пропана и 97,93 м3
воздуха (Vвпр);
на ВКПР – 12,03 м3
пропана и 87,97 м3
воздуха.
2.
Для НКПР рассчитаем теоретический объем
воздуха, необходимый для сгорания 2,07
м3
пропана.
2,07
м3
х
м3
С3Н8
+ 5( О2
+ 3,76 N2
) = 3СО2
+4Н2О
+ 5·
3,76 N2
Vм
м3
54,76Vм
м3
х
= Vвтеор
= 2,07
5
4,76 = 49,27 м3
3.
Коэффициент избытка воздуха на нижнем
концентрационном пределе распространения
пламени составит
=
= 1,99
3.
Аналогично рассчитаем для ВКПР Vвтеор
и соответствующее значение :
12,03
м3
х
м3
С3Н8
+ 5( О2
+ 3,76 N2
) = 3СО2
+4Н2О
+ 5·
3,76 N2
Vм
м3
54,76Vм
м3
х
= Vвтеор
= 12,03
5
4,76 = 286,31 м3
=
= 0,31
Формула
(4.1.) для расчета концентрационных
пределов распространения пламени
справедлива при температурах среды
близкой к 200С.
Как было указано выше, КПР не являются
постоянной величиной и зависят от многих
факторов. С повышением температуры
область КПР расширяется, и, следовательно,
для повышенных температур необходимо
производить расчет с учетом изменения
температуры.
Приближенно
это можно сделать с помощью следующих
формул:
н(t)
= н
(4.6)
в(t)
= в
,
где (4.7)
н,
в
– концентрационные пределы распространения
пламени, рассчитанные или определенные
экспериментально при
200С;
н(t)
,н(t)
– концентрационные пределы распространения
пламени при температуре Т;
1550
К, 1100 К – температура горения соответственно
на НКПР и ВКПР.
|
Расчет |
Пример |
1.
В примере 7.1. были рассчитаны значения
НКПР и ВКПР для пропана при 200С:
н
= 2,07 %; в
= 12,03%.
2.
С учетом заданной температуры КПР
составят:
н(t)
= 2,07
= 1,61 %
в(t)
= 12,03
= 16,20 %
Для
определения КПР смесей газов и паров
можно воспользоваться формулой Ле
Шателье:
н(см)
=
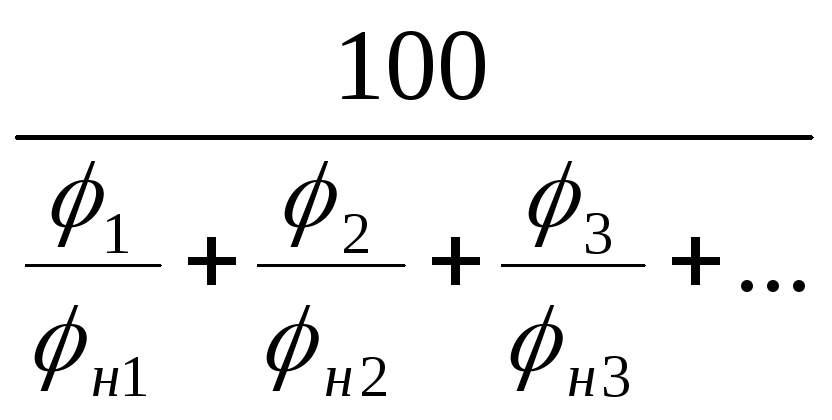
% (4.7)
в(см)
=
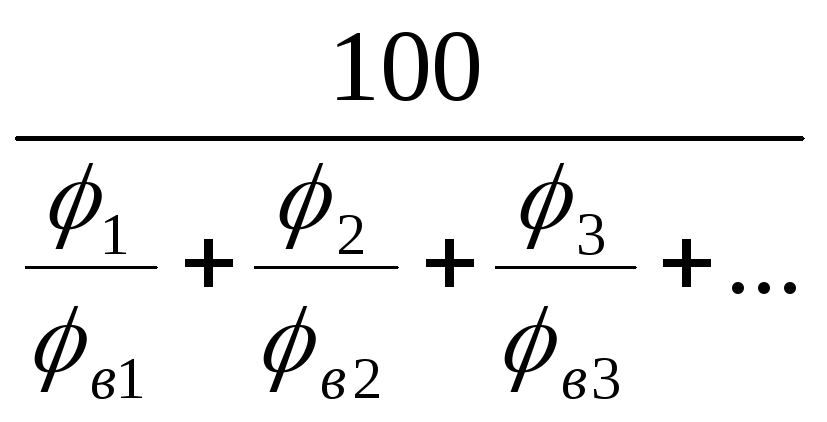
% где (4.8)
н(см),
н(см)
– концентрационные пределы распространения
пламени смеси;
н1,
н2,
н3
— НКПР
каждого компонента газовой смеси;
в1,
в2,
в3
— ВКПР
каждого компонента газовой смеси.
|
Расчет |
Пример |
1.
Определяем НКПР и ВКПР каждого горючего
компонента (по справочным данным или
расчетным путем):
для
угарного газа н
= 12,5 %; в
= 74 %
для
водорода н
= 4 %; в
= 75 %
для
метана н
= 5 %; в
= 15 %
2.
Определяем НКПР и ВКПР для смеси газов
по формулам (4.6) и (4.7):
н(см)
=
= 4,58 %
в(см)
=
= 34 %.
При
взрыве газо- и паровоздушных смесей
протекает кинетическое горение в
замкнутом объеме. Давление, развиваемое
при взрыве в этих условиях, зависит от
соотношения числа молей продуктов
горения, числа молей исходных веществ
и температуры взрыва. Для большинства
горючих веществ давление при взрыве
лежит в пределах 0,6 – 1 МПа.
Наименьшее
давление при взрыве развивается при
концентрациях горючего вещества, равных
нижнему и верхнему концентрационным
пределам распространения пламени. Оно
обычно не превышает 0,3 МПа. Это объясняется
низкой температурой взрыва. На НКПР она
равна 1550 К, на ВКПР – 1100 К. Наибольшее
давление при взрыве наблюдается при
концентрации, близкой к стехиометрической.
Расчет
максимального давления взрыва производится
по следующей формуле:
Рвзр
=
, где
(4.9)
Р0
– начальное давление, кПа (МПа);
Т0
– начальная температура, К;
Твзр
– температура
взрыва, К;
m
– число молей (киломолей) газообразных
продуктов горения;
n
– число молей (кисломолей) исходных
газообразных веществ.
|
Расчет |
Пример |
1.
Уравнение реакции горения гексана в
воздухе:
С6Н14
+ 9,5( О2
+ 3,76 N2
) =6СО2
+ 7Н2О
+ 9,5·
3,76 N2
2.
Рассчитаем число молей (киломолей)
газообразных веществ до и после взрыва:
m
= 6 + 7 + 9,53,76
= 48,72 моль
n
= 1 + 9,54,76
= 46,22 моль
3.
Максимальное давление взрыва составит:
Рвзр
=
=921,1
кПа
Список
расчетных задач
|
1.1. |
Расчет |
|
|
1.2. |
Определение |
|
|
3.1. |
Составление |
|
|
3.2. |
Составление |
|
|
3.3. |
Расчет по |
|
|
3.4. |
Расчет |
|
|
3.5. |
Расчет |
|
|
3.6. |
Расчет |
|
|
3.7. |
Расчет элементного |
|
|
3.8. |
Расчет |
|
|
3.9. |
Расчет |
|
|
3.10. |
Расчет |
|
|
3.11. |
Расчет |
|
|
3.12. |
Перевод |
|
|
3.13. |
Расчет |
|
|
3.14. |
Расчет |
|
|
3.15. |
Расчет известным |
|
|
4.1. |
Расчет |
|
|
4.2. |
Расчет |
|
|
4.3. |
Расчет |
|
|
4.4. |
Расчет |
|
|
4.5. |
Расчет |
|
|
4.6. |
Расчет |
Изначально ученые думали, что все горючие материалы содержат в себе особое вещество – «флогистон», мол именно из-за него происходит процесс горения. Однако в XVIII веке химики выяснили, что в действительности нет никакого таинственного элемента, а причиной горения огня является кислород. Опытным путем было доказано, что пламя – это следствие от взаимодействия горючего материала с окислителем.
Прежде чем мы перейдем к температуре горения, важно познакомиться с физикой процесса горения и изучить фазы этого процесса.
Описание процесса горения
Горение – это химическая реакция, при которой крупные молекулы разбиваются на более мелкие, более быстрые молекулы, посредством перестановки связей между атомами. В результате реакции выделяется энергия в виде тепла и света. Пламя – видимый процесс горения воздуха. Огонь появляется в следствии окислительно-восстановительной реакции. Чтобы данная реакция произошла, необходимо наличие 3 основных компонентов:
- топливо: твердое, жидкое, газообразное (древесина, уголь, нефть, газ и другие);
- окислитель: кислород;
- активатор: триггер для старта процесса, например, искра, солнце, спички и тд.
Горение древесины
Фазы горения дров
Древесина сама по себе не самовоспламеняется, она должна пройти различные фазы, прежде чем вступить в процесс горения.
Разогрев древесины
Прежде чем дрова загорятся, они должны нагреться от какого-либо источника тепла и достигнуть температуры горения. Как только температурный порог очага преодолевает 150°C, начнется процесс испарения влаги из древесины и постепенное обугливание. Действительно, так называемая сухая древесина всегда содержит от 15 до 20% влаги.
Как только температура достигнет 300 °C – поверхность древесины начнет тлеть и выделять белый дым. Этот дым – это смесь пара от испарившейся влаги, а также компоненты термического разложения.
На этой стадии процесс возгорания еще не начался, поэтому если остановить нагрев, то горение так и не наступит.
Разжигание костра
Вспышка дымовых газов
На втором этапе выделение газообразных составляющих начинает усиливаться. При достижении критической массы пиролизных газов, происходит вспышка и начинается возгорание. Появляется ярко-желтое пламя на поверхности дров, происходит резкий скачок градусов.
Для достижения этой стадии, необходимо чтобы пиролизные газы нагрелись от 200 до 300 °C. Только при такой температуре возможен старт воспламенения пиролизного газа.
Вспышка пиролизных газов
Воспламенение древесины
После возгорания газа – воспламеняется и сама древесина. Как только она достигает температуры от 450 до 650 °C (при помощи внешнего источника тепла), начинает гореть не только поверхность, но и внутренняя часть полена.
Также на скорость воспламенения могут повлиять следующие факторы:
- Плотность древесины – небольшие и пористые дрова воспламеняются быстрее плотных;
- Форма дров – массивные полена горят хуже ребристых и зазубренных;
- Влажность – сырая древесина намного дольше загорается, поскольку требует время на испарение влаги;
- Кислород – нужен достаточный поток кислорода, чтобы пламя не затухало.
Воспламенение дров
Горение древесины
При соблюдении всех необходимых условий, пламя полностью охватывает всю область древесины и не затухает. Это означает, что воспламенение перешло в стадию горения. У этой стадии есть две фазы – горение пламенем и тление.
- Горение пламенем длится до тех пор, пока горит пиролизный газ.
- Тление характеризуется постепенным сгоранием угля, при этом пиролизный газ выделяется настолько медленно, что из-за малой концентрации он не может воспламениться. При тлении дров, кислород способствует дальнейшему распространению реакции на остатки топлива.
Пока в зоне горения будет достаточно кислорода, топлива и концентрации необходимой температуры, эта стадия будет продолжаться.
Горение дров в костре
Именно на фазе горения наблюдаются самые высокие температуры пламени.
Затухание древесины
Как только прекращается поддержка одного из вышеперечисленных условий, процесс переходит в завершающую стадию – затухание.
Затухание костра
Температура горения различных видов дров
Разные породы дров сгорают по-разному. От одних не остается практически нечего, лишь горсть пепла, другие же оставляют после себя много углей и золы. Как правило, температура возгорания дерева составляет 200-300 °C.
Породы древесины делятся на два основных семейства в зависимости от их плотности:
- твёрдые лиственные породы (дуб, бук, ясень, каштан, граб, грецкий орех, фруктовые деревья и т.д.);
- мягкие лиственные породы (тополь, ива, ольха, береза и т.д.) и хвойные породы (ель, пихта, сосна, лиственница, пихта и др.);
Мягкие лиственные и хвойные породы горят быстрее. Однако если они хранятся неправильно, то быстро разлагаются. Тем не менее, они ценятся за их высокую температуру сгорания, которая повышает эффективность печей и каминов, а также позволяет быстро поднимать температуру в доме.
Твердые лиственные породы горят дольше, выделяемая температура от их сгорания выше. Дрова от таких деревьев используют как в промышленности, так и для топки домашних печей и каминов.
Дрова из березы
Дрова из дуба
Особенности горения различных видов древесины заключаются в следующем:
- Ель и сосна имеют одинаковую температуру горения – 620-630°C, пихта – 750°C, однако эти дрова могут стрелять смолой.
- Лиственница выделяет большую температуру – 860°C, но она также стреляет смолой.
- Береза часто используется для каминов, так как она имеет неплохую температуру горения – 815°C, а также дает хороший аромат. Горит сравнительно быстро.
- Бук считается идеальным видом дров, поскольку его температура горения — 1040°C, угли горят почти без искр, кроме того, имеют высокую теплопроводность. Энергетическая/теплотворная способность древесины бука часто приводится в качестве эталона по сравнению с другими видами древесины. Его запах, как правило, очень ценится, именно поэтому копчение продуктов производится в основном на буковой древесине.
- Дуб имеет множество применений, в основном из-за своих углей. Теплотворная способность почти такая же, как у бука – 850-900°C. Однако дуб оставляет после себя много пепла, поэтому он хорошо подходит для печей, но не для открытых каминов.
- Ясень, как и бук, имеет максимальную температуру горения — 1040°C. Это идеальные дрова для каминов, так как угли практически не стреляют искрами.
- Граб, также имеет очень высокую теплотворную способность – 1020 °C. Дает приятное пламя и долго горит.
- Тополь, ольха, осина выделяют не так много тепла, в районе 470-600 °C, однако их достаточно часто используются в качестве дров.
- Акация – этот вид древесины горит медленно и имеет среднюю теплотворную способность (700 °C). Данный вид дров быстро сохнет, а когда горит – издает приятное потрескивание.
Цвет огня в зависимости от температуры
В зависимости от цвета пламени – можно определить примерную температуру огня. Хорошим примером будет огонь обычного костра. У самого основания дров, в месте где самая активная реакция – цвет огня белый, либо ярко-желтый. Чуть выше уже начинается оранжевый цвет – знак того, что температура там ниже. В самой вершине пламени – цвет огня ярко-красный. Дальше реакция уже не происходит – виден только дым. Если проще, то у огня есть свой диапазон температур, в котором каждая цветовая гамма говорит о том, сколько градусов в той или иной части костра:
- слегка видный красный — 500°C;
- вишнёвый тёмный — 800°C;
- вишнёвый яркий —1000°C;
- красно-оранжевый — 1100°C;
- ярко-оранжевый — 1200°C;
- белесовато-жёлтый — 1300°C;
- белый — 1400°C;
- ярко-белый — 1500°C.
Температура костра из дров
Факторы, влияющие на температуру горения дров
Существует несколько факторов, которые могут повлиять на температуру горения – это влажность и контактная площадь. Понимая степень влияния того или иного фактора, можно добиться наибольшей температуры пламени, путем нехитрых манипуляций с дровами.
Влажность дров
Вся свежая древесина содержит в себе определенное количество влаги. Это может быть: древесный сок, смола, а также вода в стволе, впитанная корнями. Также важно и то, что вода остается и на коре дерева, особенно после недавних осадков. Как правило, в свежесрубленной древесине содержится от 40 до 50% влаги, а некоторые сорта могут достигать отметки до 65% (тропические, прибрежные, болотные и влаголюбивые деревья). Именно поэтому при заготовке дров, а также при производстве пиломатериалов и мебели, древесина проходит длительную сушку, срок которой может достигать несколько лет. Однако и это полностью не избавляет древесину от влаги, остается порядка 15-20% воды, поэтому перед горением можно наблюдать испаряющийся белый пар от дров.
Если разводить костер из свежей древесины, то температура горения будет ниже. Это связано с тем, что около 50% выделяемого тепла будет уходить на испарение влаги. Костер часто издает громкие хлопки и шарящие звуки – это звук, испаряющийся воды внутри древесины. Обязательно стоит учитывать, что дров для костра на природе или в холодное время года понадобится в два раза больше, ведь сырая древесина дольше разгорается и выделяет меньше тепла, нежели сухая. Чтобы развести нужно искать именно сухостой.
Для измерения влажности древесины используются специальные влагомеры.
Определение влажности дров
Контактная площадь
Размер древесины может стать препятствием при разведении огня. Ведь чем больше масштаб полена – тем выше требования на просушку и разогрев. В связи с этим большие полена длительное время разгораются не так интенсивно горят.
Чтобы избежать этого, нужно рубить древесину на маленькие кусочки. Это даст ряд преимуществ:
- Влага быстрее будет испаряться
- Увеличится приток к местам горения
- Будет больше выделятся пиролизного газа
- Повысится общая температура внутри костра.
Именно поэтому важно раскалывать мокрые дрова на маленькие кусочки. Таким образом костер загорится быстрее, пламя будет гореть интенсивней.
Мелкие колотые дрова
Как измеряется температура огня
Без специального оборудования измерить температуру огня невозможно, бытовые приборы для этого не подойдут. Для этого необходимо использовать профессиональный пирометр.
Данный прибор работает бесконтактно. Все что нужно сделать, это просто навести его на открытый огонь, по инфракрасному излучению устройство определит примерную температуру огня. Замер можно проводить с любого расстояния, однако прибор должен видеть замеряемый объект, воздух должен быть прозрачным (т.е. не задымленным).
Как правило, пирометр показывает температуру огня от обычного костра или в камине в диапазоне от 750 до 1200 градусов по Цельсию.
Измерение температуры огня
Как измеряется температура углей в мангале
Температуру углей в мангале можно определить с определенной точностью без использования специальных приборов. Все что нужно, это поднести руку на расстоянии примерно 10 см над мангалом.
Количество секунд, которые вы выдержите – будет равняться примерной температуре углей:
- 1 сек – от 350 °C и выше
- 2 сек. – в районе 300 °C
- 3 сек. – около 250 °C
- 4 сек. – 220 °C
- 5 сек. – менее 200 °C
Температура углей в мангале
Пламя — это явление, которое вызвано свечением газообразной раскалённой среды. В некоторых случаях оно содержит твёрдые диспергированные вещества и (или) плазму, в которых происходят превращения реагентов физико-химического характера. Именно они и приводят к саморазогреву, тепловыделению и свечению. В газообразной среде пламени содержатся заряженные частицы — радикалы и ионы . Это объясняет существование электропроводности пламени и его взаимодействие с электромагнитными полями. На таком принципе построены приборы, которые могут приглушить огонь, изменить его форму или оторвать его от горючих материалов при помощи электромагнитного излучения.
Виды пламени
Свечение огня делится на два вида:
- несветящиеся;
- светящиеся.
Почти каждое свечение видимо для человеческого глаза, но не каждое способно испускать нужное количество светового потока.
Свечение пламени обуславливается следующими факторами .
- Температурой.
- Плотностью и давлением газов, которые участвуют в реакции.
- Наличием твёрдого вещества.
Наиболее общая причина свечения — это присутствие в пламени твёрдого вещества .
Многие газы горят слабо светящимся или несветящимся пламенем. Из них наиболее распространены сероводород (пламя голубого цвета как при горении), аммиак (бледно-жёлтое), метан, окись углерода (пламя бледно-голубого цвета), водород. Пары летучих некоторых жидкостей горят едва светящимся пламенем (спирт и сероуглерод), а пламя ацетона и эфира становится немного коптящим из-за небольшого выделения углерода.
Температура пламени
Для разных горючих паров и газов температура пламени неодинакова. А ещё неодинакова температура разных частей пламени, а область полного сгорания имеет более высокие показатели температуры.
Некоторое количество горючего вещества при сжигании выделяет определённое количество теплоты. Если строение вещества известно, то можно рассчитать объём и состав полученных продуктов горения. А если знать удельную теплоту этих веществ, то можно рассчитать ту максимальную температуру, которую достигнет пламя.
Стоит помнить о том, что если вещество горит в воздухе, то на каждый объём вступающего в реакцию кислорода приходится четыре объёма инертного азота. А так как в пламени присутствует азот, он нагревается теплотой, которая выделяется при реакции. Исходя из этого можно сделать вывод о том, что температура пламени будет состоять из температуры продуктов горения и азота.
Невозможно точно определить температуру, но можно это сделать приблизительно, так как удельная теплота изменяется с температурой.
Вот некоторые показатели по температуре открытого огня в разных материалах .
-
Горение магния — 2200 градусов.
- Горение спирта не превышает температуры 900 градусов.
- Горение бензина — 1300−1400 градусов.
- Керосина — 800, а в среде чистого кислорода — 2000 градусов.
- Горение пропан-бутана может достигать температуры от 800 до 1970 градусов.
- При сгорании дерева температурный показатель колеблется от 800 до 1000 градусов, а воспламеняется оно при 300 градусах.
- Температурный параметр горения спички составляет 750−850 градусов.
- В горящей сигарете — от 700 до 800 градусов.
- Большинство твёрдых материалов воспламеняется при температурном показателе в 300 градусов.
Пламя свечи
Пламя, которое каждый человек может наблюдать при горении свечи, спички или зажигалки, представляет из себя поток раскалённых газов, которые вытягиваются вертикально вверх, благодаря силе Архимеда. Фитиль свечи вначале нагревается и начинает испаряться парафин. Для самой нижней части характерно небольшое свечение синего цвета — там мало кислорода и много топлива. Именно из-за этого топливо не полностью сгорает и образуется оксид углерода, который при окислении на самом крае конуса пламени ему придаёт синий цвет.
За счёт диффузии в центр поступает немного больше кислорода. Там происходит последующее окисление топлива и температурный показатель растёт. Но для полного сгорания топлива этого недостаточно. Внизу и в центре содержатся частицы угля и несгоревшие капельки. Они светятся из-за сильного нагревания. А вот испарившееся топливо, а также продукты сгорания, вода и углекислый газ практически не светятся. В самом верху наибольшая концентрация кислорода. Там не догоревшие частицы, которые в центре светились, догорают. Именно по этой причине эта зона практически не светится, хотя там наиболее высокий температурный показатель.
Классификация пламени
Классифицируют свечение огня следующим образом.
-
По восприятию визуальному: цветные, прозрачные, коптящие.
- По высоте: короткие и длинные.
- По скорости распространения: быстрые и медленные.
- По температурному показателю: высокотемпературные, низкотемпературные, холодные.
- По характеру перемещения среды реакционной: пульсирующие, турбулентные, ламинарные.
- По состоянию горючей среды: предварительно перемешанные и диффузионные.
- По излучению: бесцветные, окрашенные, светящиеся.
- По агрегатному состоянию горючих веществ: пламя аэродисперсных и твёрдых реагентов, жидких и газообразных.
В диффузном ламинарном пламени выделяют три оболочки (зоны). Внутри конуса пламени существует:
- зона тёмная, где нет горения из-за малого количества окислителя — 300−350 градусов;
- зона светящаяся, где осуществляется термическое разложение горючего и оно сгорает частично — 500−800 градусов;
- зона слегка светящаяся, где окончательно сгорают продукты разложения горючего и достигается максимальный температурный показатель в 900−1500 градусов.
Температурный параметр пламени зависит от интенсивности подвода окислителя и природы горючего вещества. Пламя распространяется по предварительно перемешанной среде. Происходит распространение по нормали от каждой точки фронта к поверхности пламени.
По реально существующим смесям газовоздушным распространение всегда осложнено возмущающими внешними воздействиями, которые обусловлены трением, конвективными потоками, силами тяжести и прочими факторами.
Именно из-за этого реальная скорость распространения от нормальной всегда отличается. В зависимости от того, какой характер носит скорость распространения, различают такие диапазоны:
- При горении детонационном — более 1000 метров в секунду.
- При взрывном — 300−1000.
- При дефлаграционном — до 100.
Пламя окислительное
Оно располагается в самой верхней части огня, которая имеет наибольший температурный показатель. В этой зоне горючие вещества почти полностью превращены в продукты горения. Здесь наблюдается недостаток топлива и избыток кислорода . Именно по этой причине вещества , которые помещены в эту зону, окисляются интенсивно.
Пламя восстановительное
Эта часть наиболее близка к центру или находится чуть ниже его. Здесь мало кислорода для горения и много топлива. Если в эту область внести вещество, в котором имеется кислород, то он отнимется у вещества.
Температура огня в зажигалке
Зажигалка — это устройство портативное, которое предназначено для получения огня. Она может быть бензиново или газовой, в зависимости от применяемого топлива. Ещё существуют зажигалки, в которых собственного топлива нет. Они предназначаются для поджига газовой плиты. Качественная турбозажигалка — это прибор относительно сложный. Температура огня в ней может достигать 1300 градусов.
Химический состав и цвет пламени
У карманных зажигалок небольшой размер, это позволяет их переносить без каких-либо проблем. Довольно редко можно встретить настольную зажигалку. Ведь они из-за своих больших размеров для переноски не предназначены. Их дизайн разнообразен . Есть зажигалки каминные. Они имеют небольшую толщину и ширину, но довольно длинные.
На сегодняшний день становятся популярными рекламные зажигалки. Если в доме нет электроэнергии, то невозможно ей поджечь газовую плиту. Газ поджигает образующаяся электрическая дуга. Достоинствами этих зажигалок являются следующие качества.
- Долговечность и простота конструкции.
- Быстрое и надёжное зажигание газа.
Первая зажигалка с современным кремнём создана в Австрии в 1903 году после изобретения ферроцериевого сплава бароном Карлом Ауэром фон Вельсбахом.
Ускорилось развитие зажигалок в период Первой мировой войны. Солдаты начали применять спички для того, чтобы видеть в темноте дорогу, но их местоположение выдавала интенсивная вспышка при поджиге. Необходимость в огне без значительной вспышки способствовало развитию зажигалок.
В то время лидерами производства зажигалок «кремнёвых» были Германия и Австрия. Такое портативное устройство, которое предназначено для получения огня, находящиеся в кармане многих курильщиков, при неправильном обращении может таить в себе немало опасностей.
Зажигалка в период работы не должна вокруг себя разбрызгивать искры. Огонь должен быть стабильным и ровным. Температура огня в зажигалках карманных достигает примерно 800−1000 градусов. Свечение красного или оранжевого цвета вызвано частицами углерода, которые раскалились. Для бытовых горелок и турбозажигалок применяется в основном газ бутан, который легко сжигается, не имеет запаха и цвета. Бутан получают путём переработки при высоких температурах нефти, а также её фракций. Бутан — это легковоспламенимые углеводороды, но он абсолютно безопасен в конструкциях современных зажигалок.
Подобные зажигалки в быту очень полезны. Ими можно поджечь любой воспламеняющийся материал. В комплект турбозажигалок входит настольная подставка. Цвет пламени зависит от горючего материала и температуры горения. Пламя костра или камина в основном имеет пёстрый вид . Температура горения дерева ниже температуры горения фитиля свечи. Именно из-за этого цвет костра не жёлтый, а оранжевый.
Медь, натрий и кальций при высоких температурных показателях светятся различными цветами.
Электрическая зажигалка была изобретена в 1770 году. В ней водородная струя воспламенялась от искры машины электрофорной. Со временем бензиновые зажигалки уступили место газовым, которые более удобные. В них обязательно должна находиться батарейка — источник энергии.
Не очень давно появились зажигалки сенсорные, в которых без механического воздействия происходит зажигание газа воздействием на сенсорный датчик. Сенсорные зажигалки карманного типа. В основном, в них содержится информация рекламного типа, которая нанесена при помощи тампонной или шелкотрафаретной печати.
Содержание
- По каким способом можно определить температуру горения
- ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ ГОРЕНИЯ
- Определение температуры горения
По каким способом можно определить температуру горения
5.2. ТЕОРЕТИЧЕСКАЯ ТЕМПЕРАТУРА ГОРЕНИЯ
Температура горения любого вещества не является постоянной величиной. Она зависит от условий горения (в замкнутом объеме или на открытом воздухе), от условий теплоотдачи, полноты сгорания топлива, коэффициента избытка воздуха и других факторов.
Для сравнения температуры горения Тг разных веществ расчет ведется при строго одинаковых следующих условиях.
· Горючее и воздух вступают в реакцию горения при температуре Т = 0 ° С.
· Количество воздуха равно теоретически необходимому, то есть коэффициент избытка воздуха α=1.
· Горение происходит мгновенно до полного окисления (СО2, Н2О, SO 2) без образования промежуточных продуктов неполного горения (например, угарного газа СО).
· Вся выделенная теплота сообщается продуктам горения и расходуется исключительно на их нагревание.
Рассчитанная при этих условиях температура называется теоретической. Практически реализуемая температура горения T (при пожарах, при горении в печах, каминах, камерах сгорания и других технических устройствах) всегда ниже теоретической T г. Это связано с тем, что реальный процесс горения происходит с избытком воздуха, в условиях неполного сгорания. Кроме того, теплота горения частично расходуется на нагрев окружающей среды, а при температурах выше 1700 ° С – на диссоциацию продуктов горения.
Например, при горении древесины, отличие Тг от практически реализуемой температуры горения может достигать более 500 ° С (табл. 5.6).
Температура горения древесины
Древесина
Q , МДж/кг
Расчет теоретической температуры горения
При определении теоретической температуры горения Тг предполагается, что вся выделившаяся теплота сообщается продуктам сгорания. Температура, до которой нагреются продукты сгорания, зависит от количества сообщаемой им теплоты, состава и количества продуктов сгорания и их удельной теплоемкости. Для расчета теоретической температуры горения Тг запишем уравнение теплового баланса.
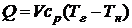
где Q – теплотворная способность топлива, Дж/кг;
V – объем продуктов сгорания, образующихся при горении 1 кг топлива, м 3 /кг;
с p –объемная удельная теплоемкость продуктов сгорания, Дж/(м 3 ∙град);
Тг – теоретическая температура горения, ° С;
Тн – начальная температура воздуха, ° С.
При горении в нормальных условиях (Тн=0 ° С) уравнение (5.3) примет вид:
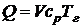
Из (5.4) следует формула для расчета теоретической температуры горения:
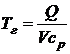
Поскольку продукты сгорания реальных топлив, как правило, состоят из разных газов, теплоемкость и плотность которых различны, то эта формула (5.4) записывается в следующем виде:
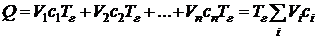
Соответственно, формула для расчета с учетом (5.6) примет вид
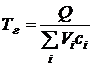
Для повышения точности расчетов необходимо учитывать зависимость теплоемкости газов от температуры. Однако, для оценочных расчетов можно принять средние значения теплоемкости (табл. 5.7).
Средняя теплоемкость (с p ) газов в диапазоне температур (1000÷3000) ° С
Источник
ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ ГОРЕНИЯ
Определение температуры горения пиросоставов имеет большое значение, так .как яляется критерием для оценки существующих составов и облегчает создание новых, более совершенных составов.
Температуру горения можно определить:
1) вычислением по формуле (6.6) (см. ниже). При этом используется общеизвестное положение, что температура горения равна ее теплоте, деленной на суммарную теплоемкость продуктов реакции горения;
2) .непосредственным намерением пр,и помощи оптических пирометров ил’и термопар (см. § 6 этой главы).
Известно, что в разных зонах пл.амя имеет разную температуру. Расчетным путем .может ‘быть найден только верхний предел температуры или, .иначе .говоря, максимальная температура пламени. Однако этот способ определения температуры не .всегда приемлем ‘из-за отсутствия точных данных о теплоемкости многих соединений при высоких температурах (выше 2000° С); для многих соединений не определены с достаточной точностью скрытые теплоты испарения. Кроме того, в действительности, температура горения должна быть значительно ниже вследствие затраты тепла на термическую диссоциацию продуктов горения, а также вследствие тепловых потерь в окружающее пространство.
Удовлетворительные результаты вычисления температуры горения описываемым ниже способом с использованием формулы (6.6) могут быть получены в том случае, если искомая температура не превышает 2000—2500° С. В противном случае могут быть .получены только ориентировочные данные.
Так .как при горении пиросоставов обычно имеется возможность для расширения газов, то при расчетах пользуются значениями теплоемкости Ср при постоянном давлении. Молекулярные теплоемкости газов Ср при постоянном объеме и при постоянном давлении Су связаны соотношением
(6.1) кал/ (г • моль -град)
где л’—газовая постоянная, равная 1,98
В табл. 6.5 приведены полученные опытным путем значения молекулярной теплоемкости Ср при различной температуре для двух- и трехатомных газов и водяного пара.
Значения средней молекулярной теплоемкости газов Ср (кал/град; 1 кал =4,186 Дж)
| Интервал темпера | Нг, N», Oa, СО | Нар | со, | Интервал темпера | Н;, N„. 0;, СО | H„0 | со; |
| туры, °С | туры, °С | ||||||
| 0—100 | 7,0 | 8,0 | 9,1 | 0—2000 | 7,7 | 10,3 | 12,3 |
| 0—500 | 7,1 | 8,3 | 10,3 | 0—2500 | 7,8 | 11,4 | 12,5 |
| 0—1000 | 7,3 | 8,8 | 11,3 | 0—3000 | 8,0 | 12,8 | 12,7 |
| 0—1500 | 7,5 | 9,5 | 11,9 |
Для простых веществ, находящихся в твердом состоянии, грубо приближенно можно считать (согласно правилу Дюлонга 72 и Пти), что их грамм-атомная теплоемкость при высоких температурах равна или больше 6,4 кал/град (36,8 Дж/град).
Для соединений, находящихся в твердом состоянии при высоких температурах, молекулярная теплоемкость (табл. 6.6) приближенно равняется сумме атомных теплоемкостей составляющих его элементов (правило Неймана — Коппа).
Таблица 6.6 Средняя молекулярная теплоемкость твердых веществ Ср
| Символ | Температура. °С | с? | Символ | Температура, °C | °р |
| Fe | 20—1500 | 9,6 | КС1 | 13,3 | |
| Си | 20—1500 | 9,4. | А^Оз | 30—1100 | 27,7 |
| NaCI | 20—785 | 13,6 | А40з | 30—1500 | 28,1 |
| MgO | 20—1735 | 12,1 | AlaOj | 20—2030 | 28,5 |
| MgO | 20—2370 | 14,0 | BaClz | 19,6 | |
| MgO | 20—2780 | 14,3 | BaCOj | 31,8 | |
| Примечание. 1 кал=4,186 Дж. |
Теплоемкость вещества в жидком состоянии обычно больше, чем в твердом. Иногда приближенно принимают теплоемкость жидких высоко плавящихся веществ равной 1,3 Ср твердых тел. Скрытая теплота плавления (испарения). Для многих простых веществ справедлива формула
где Qs — теплота плавления в ккал/г-атом;
7’s—температура плавления в К.
Однако зависимость эта оправдывается с достаточной точностью далеко не для всех простых веществ.
Зяачение Qs для многих неорганических соединений может быть приближенно вычислено по эмпирической формуле
где п — число атомов в молекуле соединения.
Скрытая теплота испарения вещества уменьшается с повышением температуры.
Для воды теплота испарения составляет при 100° С 9,7 ккал/ моль i(39,6 кДж/моль).
Зависимость между теплотой кипения Qn в ккал/моль (кДж/моль) и температурой кипения жидкости Гк в К выражается формулой Трутона:
Qк-=0,02 ккал (0,08 кДж). (6.4)
Для многих (в особенности высококипящих) неорганических соединений Ок может быть с большей точностью, чем по формуле Трутона, вычислена по эмпирической формуле, предложенной автором:
Tк
Очевидно, теплота испарения (кипения) соединений значительно больше теплоты их плавления.
Максимальную температуру горения вычисляют по формуле
t = Q — E (Qs + Qk) / E Cp
где Q—теплота горения;
E Ср — сумма теплоемкостей продуктов горения;
E(Qs+Qk.)—сумма скрытых теплот плавления и кипения
Пример 3. Вычислить максимальную температуру пламени состава красного огня, содержащего 65% КСlOз, 20% SrСОз и 15 % C13H12O2 (идитола).
Реакция горения приближенно может быть выражена уравнением
7,1 КС10з+ l,8SrC03+C13H1202=7,l KC1 +1,85гСОз+ +6Н20 пар+4,ЗС02+8,7СО.
Расчет теплоты горения ведется в ккал (1 ккал =4,11186 кДж) с использованием закона Гесса
Ниже приводится теплота образования начальных и конечных продуктов реакции; теплота образования идитола принята равной 0,74 ккал/г.
Для Н20 пар. . 6.57,4=344
Для СО2 . 4,3.94=404
ДляСО2 . 8,7-26=22б
Для КСl . . . . 7,1.106=752
Для C13H1202 . . . 0,74.200=148
Для КСlOз . 7,1.96=682
Количество тепла, выделяющееся при горении, равно 1726—830=896 ккал.
Теплоемкость Ср газов и водяного пара в интервале О—1500° С (см. табл. 6.7) равна:
для Н2О. . 6.9,5=57,0
для С02. . . . . . . . 4,3.11,9=51,2
для СО . . . . . . . . 8,7.7,5=65,2
Теплоемкость KC1 и SrСОз принимаем равной соответственно 12,8 и 32,0 кал/град моль и суммируем Отсюда
E Ср= 173,44-148,5=321,9 кал/град,
t=567*1000 / 321,9 = 1760 C
Если бы мы приняли во внимание частично протекающую в пламени термическую диссоциацию: SrCO3=SrO+CO2, то при расчете получили бы значение температуры порядка 1600° С.
Аналогичным методом был проведен расчет [23] для стехиомегрической смеси (WОз+2А1) и сделан вывод, что температура горения не должна превышать температуру кипения Аl2Оз, т. е. должна быть равной примерно 3000° С.
Необходимо еще раз отметить, что если температура горения превышает 2000—2500° С, то данные, полученные расчетным путем, являются лишь ориентировочными, а потому могут быть полезными только при сравнении между собой составов, резко обличающихся по своему рецепту.
Для ракетных топлив требуется высокая точность расчета температуры горения и других характеристик процессов горения. В этом случае для вычисления температуры горения выполняются весьма трудоемкие расчеты, при которых учитываются процессы термической диссоциации и испарения продуктов грения. Исходные данные для таких расчетов имеются в справочнике [86].
Дата добавления: 2016-01-09 ; просмотров: 1935 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Источник
Определение температуры горения
Под температурой горения понимают ту температуру,которую приобретают продукты сгорания в результате сообщения им тепла, выделенного при сжигании. Различают теоретическую и калориметрическую температуры горения.
Теоретическую температуру горения tт определяют с учетом процессов диссоциации, протекающих при образовании продуктов сгорания:

где 
qдисс – тепло, израсходованноеина процессы диссоциации, кДж/м 3 или кДж/кг;
Vпр – объем продуктов сгорания, образующихся при сгорании единицы топлива,
с – объемная теплоемкость продуктов сгорания, кДж/(м 3 ∙ град) или
Калориметрическую температуру tк определяют из условия полного сгорания топлива и использования всего выделившегося при горении тепла только на повышение температуры продуктов сгорания при адиабатных условиях (отсутствие теплообмена с внешней средой) и n = 1.

При подогретом воздухе (или топливе) калориметрическую температуру определяют по выражению:

где Qф – физическое тепло подогретых воздуха и топлива.
Газообразные продукты сгорания любого топлива представляют собой смесь различных газообразных составляющих. Каждой из этих составляющих при той или иной температуре присуща определенная величина теплоемкости. Это дает возможность определить теплоемкость теплоемкость продуктов сгорания в целом для соответствующей температуры. Например, теплоемкость продуктов сгорания, состоящих из 9,45 % СО2, 18,9 % Н2О и 71,65 % N2 при температуре 1500 ˚ С может быть определена следующим образом.
Объемные теплоемкости при этой температуре составят :
для СО2 2,3636 кДж/(м 3 ∙ град),
для Н2О 1,8389 кДж/(м 3 ∙ град),
для N2 1.447 кДж/(м 3 ∙ град).
В 1 м 3 продуктов сгорания содержится 0,0945 м 3 СО2, 0,189 м 3 Н2О, 0,7165 м 3 N2.
Следовательно, теплоемкость 1 м 3 продуктов сгорания будет равна:
СО2. . . . . .2,3636 ∙ 0,0945 = 0,223
Н2О . . . . . . 1,8389 ∙ 0,189 = 0,348
N2 . . . . . . . .1,447 ∙ 0,7165 = 1,035
Кроме теплоемкостей пользуются также величинами энтальпий. Энтальпия представляет собой произведение теплоемкости газа при постоянном давлении на температуру:
Например, энтальпия СО2 при температуре 1500 ˚ С равна:
i (СО2) = 2,3636 ∙ 1500 = 3545,34 кДж/м 3 .
3.4.4.4 Основные формулы для расчета горения топлива
Сведем все формулы, необходимые для расчета горения топлива, в единую таблицу.
Таблица 3.2 – Основные формулы для расчета горения топлива
| Искомый параметр | Жидкое и твердое топливо | Газообразное топливо |
| Пересчет на рабочий состав |    |
  |
| Состав смеси |  где где  |
|
| Низшая теплота сгорания |   |
    |
| Расход кислорода на горение при n=1 | V(О2)=0,01(1,867С Р +5,6Н Р + +0,7(S Р -О Р )) | V(О2)=0,01(0,5(СО+Н2+3Н2S)+∑(n+m/4)СnНm) |
Таблица 3.2 – Продолжение
| Расход сухого воздуха | VВ=n(1+k)V(О2), где k=79/21=3,76;n – коэффициент расхода воздуха | |
| Объемы компонентов продуктов сгорания | V(RО2)=0,01(1,867С Р +0,7S Р ) RО2=СО2+SО2 V(Н2О)=0,01(11,2Н Р + +1,242W Р ) V(N2)=0,008N Р +nkV(О2) V(О2)’=(n-1)V(О2) | V(RО2)=0,01(СО2+SО2+СО+ +Н2S+∑nСnНm) V(Н2О)=0,01(Н2О+Н2+ Н2S+ +0,5∑mСnНm) V(N2)=0,01N2+nkV(О2) V(О2)’=(n-1)V(О2) |
| Объем продуктов сгорания | VПС= V(RО2)+ V(Н2О)+ V(N2)+ V(О2)’ | |
| Калориметрическая температура горения |  |
Задача 1
Воздух при давлении p1=0.1 МПа и температуре t1=15 °C вытекает из резервуара.
Найти значение р2, при котором теоретическая скорость адиабатного истечения будет равна критической, и величину этой скорости.
Источник
Газификация по стране идет полным ходом, снабжая квартиры и частные дома дешевым «голубым» топливом. С его помощью люди отапливают помещение, греют воду и готовят еду. Все из-за выделяемого количества тепла при его горении, которое прекрасно подходит под самые различные цели.
В этой статье мы разберем какая температура горения газа в газовой плите, отчего она зависит и как ее определить. А также поможем правильно подобрать оптимальную терморежим для приготовления различных блюд.
Температура пламени при различных режимах горения
Воспламенение газа происходит при температуре от 650 до 700 градусах, а стабильный процесс горения – от 850 до 900. Таких значений вполне достаточно для готовки блюд и нагрева горячей воды: для мытья рук и даже отопления помещения.
Отметим, температура пламени неоднородна – на разных его участках она будет отличаться. Например, внутренняя часть имеет голубой оттенок (около 800 градусов), средняя – оранжевый (около 1000), а внешняя – желтый (до 1500 градусов). Значений выше этого показателя кухонная плита достичь не в состоянии. А вот промышленные образцы вполне могут выдать и 2000 градусов.
Регулируется теплоотдача пламени с помощью ручек плиты. С их помощью также изменяется расстояние от пламени до дна холодной посуды. Важно всегда обращать на это свое внимание: при соприкосновении огня и холодной посуды газ может не сгореть полностью, выделяя при этом вредные вещества в помещении. Поэтому, при готовке отрегулируйте высоту пламени так, чтобы оно лишь слегка касалось кастрюли, чайника или сковороды.
От чего зависит температура горения
Температура пламени в газовой плите сильно зависит от двух факторов:
- химический состав поступающей газовой смеси;
- интенсивность подачи топлива.
Зависимость температуры от вида топлива
В быту используют два вида газа: природный и сжиженный. Сам по себе газ не имеет запаха и цвета, поэтому для безопасности он проходит одоризацию. В газовую смесь добавляют специально вещество этантиол (или этилмеркаптан), который не влияет на горючесть, но обладает резким специфичным запахом. Именно запах этантиола чувствую люди, когда происходит утечка.
Природный газ состоит в основном из метана – порядка 97% от всего объема. Оставшиеся 3% представлены различными смесями, в том числе и этилмеркаптаном. Именно природный газ может достигнуть температуры в 1500 градусов.
Сжиженный газ используется там, где пока нет возможности провести газопровод. В этом случае в баллоны под давлением заливают либо пропан-бутановую смесь (65 к 35), либо бутан-пропановую (85 к 15). Такие смеси горят хуже метана, поэтому температура горения не превышает 1000 градусов.
Из-за разницы температур для каждого вида газа используется свое оборудование. Многие производители газовых плит укомплектовывают свои модели специальными жиклёрами и редукторами, чтобы беспроблемно можно было перевести плиту с природного газа на сжиженный. Если их не использовать и просто подключить баллоны к плите, она начнет сильно коптить и постоянно гаснуть.
Внимание!
Не занимайтесь переводом плиты на другой тип газа самостоятельно! Обратитесь в газовую службу, специалисты помогут решить все ваши проблемы.
Влияние интенсивности горения на температуру пламени
Используя поворотные регуляторы, вы можете полностью открывать кран или частично его перекрывать, тем самым прибавляя или убавляя поступающий в конфорку объем газа. Чем больше объем, тем сильнее пламя конфорки, а следовательно, и жаропроизводительность.
Как определить температуру пламени?
Все просто, когда плита оснащена термометром с выносным датчиком: все температурные значения сразу выводятся на экран, обеспечивая легкий контроль над ними. Еще лучше если есть в наличии термостат (поддерживает в духовке постоянный терморежим) и терморегулятор (включает конфорку автоматически на нужное значение).
Но что делать, если термометр установлен только в духовке, а для приготовления блюда нужно точно соблюдать определенные температурные значения.
Как определить температуру в духовке
Если открыть кран духовки на полную мощность, то температура поднимется до 280 градусов. Среднее значение в 260 градусов, а минимальная – 160.
Можно воспользоваться следующим способом. Включите духовку и спустя 10 минут положите рядом с выпекаемой едой лист писчей бумаги и воспользуйтесь нашей таблицей:
| Диапазон температур | Через сколько обуглятся края бумаги |
|---|---|
| 270-300 градусов | 5 секунд |
| 250-270 градусов | 15 секунд |
| 230-250 градусов | 30 секунд |
| 200-230 градусов | 1 минута |
| 180-200 градусов | 5 минут |
| 150-180 | 10 минут |
| До 150 градусов | не обуглится |
Как определить температуру конфорки
Чтобы определить температуру конфорки, можно воспользоваться разными жидкостями:
| Жидкость | Температура кипения |
|---|---|
| Вода | 100 градусов |
| Кукурузное или соевое масло | 150 градусов |
| Подсолнечное масло | 200 градусов |
| Оливковое масло | 250 градусов |
В рецептах же обычно руководствуются терминами «медленный», средний и «сильный» огонь. Позволяя выбрать терморежим «на глазок».
Какой подобрать терморежим для готовки блюд
Для готовки различных блюд важно соблюдать температурные режимы, которые поможет проконтролировать термометр на плите. Для этого воспользуйтесь нашей таблицей:
| Блюдо | Диапазон температур |
|---|---|
| Овощное рагу, стейки или жарка котлет | 190-230 градусов |
| Жаренный картофель | 130-190 градусов |
| Тушенное мясо с овощами | до 130 градусов |
| Выпекание пирогов | 200-220 градусов |
| Сварить в воде или молоке | 95-98 градусов |
Выводы по теме
Температура горения газа в газовой плите зависит от его интенсивности и химического состава: природный газ может достичь значений до 2000 градусов, а сжиженный только до 1000. Важно проследить за высотой пламени и его температурой. Различные блюда требуют определенного терморежима. Определить можно «на глазок», либо с помощью термометра, встроенного прямо в плиту.