Металлы и сплавы — это незаменимая основа для литейного и ювелирного производства, ковки и многих других сфер. Что бы ни делал человек из металла (какой бы это ни был процесс), для правильной работы ему нужно знать, при какой температуре плавится тот или иной металл. Мы подробно рассмотрим процесс плавления, его отличие от кипения, а также сравним температуры в таблицах.
Таблица температур плавления
Узнать какая нужна температура для плавления металлов, поможет таблица по возрастанию температурных показателей.
| Элемент или соединение | Необходимый температурный режим |
|---|---|
| Литий | +18°С |
| Калий | +63,6°С |
| Индий | +156,6°С |
| Олово | +232°С |
| Таллий | +304°С |
| Кадмий | +321°С |
| Свинец | +327°С |
| Цинк | +420°С |
Таблица плавления среднеплавких металлов и сплавов.
| Элемент либо сплав | Температурный режим |
|---|---|
| Магний | +650°С |
| Алюминий | +660°С |
| Барий | +727°С |
| Серебро | +960°С |
| Золото | +1063°С |
| Марганец | +1246°С |
| Медь | +1083°С |
| Никель | +1455°С |
| Кобальт | +1495°С |
| Железо | +1539°С |
| Дюрали | +650°С |
| Латуни | +950…1050°С |
| Чугун | +1100…1300°С |
| Углеродистые стали | +1300…1500°С |
| Нихром | +1400°С |
Таблица плавления тугоплавких металлов и сплавов.
| Наименование элемента | Температурный режим |
|---|---|
| Титан | +1680°С |
| Платина | +1769,3°С |
| Хром | +1907°С |
| Цирконий | +1855°С |
| Ванадий | +1910°С |
| Иридий | +2447°С |
| Молибден | +2623°С |
| Тантал | +3017°С |
| Вольфрам | +3420°С |
Что такое температура плавления
Каждый металл имеет неповторимые свойства, и в этот список входит температура плавления. При плавке металл уходит из одного состояния в другое, а именно из твёрдого превращается в жидкое. Чтобы сплавить металл, нужно приблизить к нему тепло и нагреть до необходимой температуры – этот процесс и называется температурой плавления. В момент, когда температура доходит до нужной отметки, он ещё может пребывать в твёрдом состоянии. Если продолжать воздействие – металл или сплав начнет плавиться.
Плавление и кипение – это не одно и то же. Точкой перехода вещества из твердого состояния в жидкое, зачастую называют температуру плавления металла. В расплавленном состоянии у молекул нет определенного расположения, но притяжение сдерживает их рядом, в жидком виде кристаллическое тело оставляет объем, но форма теряется.
При кипении объем теряется, молекулы между собой очень слабо взаимодействуют, движутся хаотично в разных направлениях, совершают отрыв от поверхности. Температура кипения – это процесс, при котором давление металлического пара приравнивается к давлению внешней среды.
Для того, чтобы упростить разницу между критическими точками нагрева мы подготовили для вас простую таблицу:
| Свойство | Температура плавки | Температура кипения |
|---|---|---|
| Физическое состояние | Сплав переходит в расплав, разрушается кристаллическая структура, проходит зернистость | Переходит в состояние газа, некоторые молекулы могут улетать за пределы расплава |
| Фазовый переход | Равновесие между твердым состоянием и жидким | Равновесие давления между парами металла и воздухом |
| Влияние внешнего давления | Нет изменений | Изменения есть, температура уменьшается при разряжении |
При какой температуре плавится
Металлические элементы, какими бы они ни были — плавятся почти один в один. Этот процесс происходит при нагреве. Оно может быть, как внешнее, так и внутреннее. Первое проходит в печи, а для второго используют резистивный нагрев, пропуская электричество либо индукционный нагрев. Воздействие выходит практически схожее. При нагреве, увеличивается амплитуда колебаний молекул. Образуются структурные дефекты решётки, которые сопровождаются обрывом межатомных связей. Под процессом разрушения решётки и скоплением подобных дефектов и подразумевается плавление.
У разных веществ разные температуры плавления. Теоретически, металлы делят на:
- Легкоплавкие – достаточно температуры до 600 градусов Цельсия, для получения жидкого вещества.
- Среднеплавкие – необходима температура от 600 до 1600 ⁰С.
- Тугоплавкие – это металлы, для плавления которых требуется температура выше 1600 ⁰С.
Плавление железа
Температура плавления железа достаточно высока. Для технически чистого элемента требуется температура +1539 °C. В этом веществе имеется примесь — сера, а извлечь ее допустимо лишь в жидком виде.
Без примесей чистый материал можно получить при электролизе солей металла.
Плавление чугуна
Чугун – это лучший металл для плавки. Высокий показатель жидкотекучести и низкий показатель усадки дают возможность эффективнее пользоваться им при литье. Далее рассмотрим показатели температуры кипения чугуна в градусах Цельсия:
- Серый — температурный режим может достигать отметки 1260 градусов. При заливке в формы температура может подниматься до 1400.
- Белый — температура достигает отметки 1350 градусов. В формы заливается при показателе 1450.
Важно! Показатели плавления такого металла, как чугун – на 400 градусов ниже, по сравнению со сталью. Это значительно снижает затраты энергии при обработке.
Плавление стали
Сталь — это сплав железа с примесью углерода. Её главная польза — прочность, поскольку это вещество способно на протяжении длительного времени сохранять свой объем и форму. Связано это с тем, что частицы находятся в положении равновесия. Таким образом силы притяжения и отталкивания между частицами равны.
Справка! Сталь плавится при 1400 °C.
Плавление алюминия и меди
Температура плавления алюминия равна 660 градусам, это означает то, что расплавить его можно в домашних условиях.
Чистой меди – 1083 градусов, а для медных сплавов составляет от 930 до 1140 градусов.
От чего зависит температура плавления
Для разных веществ температура, при которой полностью перестраивается структура до жидкого состояния – разная. Если взять во внимание металлы и сплавы, то стоит подметить такие моменты:
- В чистом виде не часто можно встретить металлы. Температура напрямую зависит от его состава. В качестве примера укажем олово, к которому могут добавлять другие вещества (например, серебро). Примеси позволяют делать материал более либо менее устойчивым к нагреву.
- Бывают сплавы, которые благодаря своему химическому составу могут переходить в жидкое состояние при температуре свыше ста пятидесяти градусов. Также бывают сплавы, которые могут “держаться” при нагреве до трех тысяч градусов и выше. С учетом того, что при изменении кристаллической решетки меняются физические и механические качества, а условия эксплуатации могут определяться температурой нагрева. Стоит отметить, что точка плавления металла — важное свойство вещества. Пример этому – авиационное оборудование.
Термообработка, в большинстве случаев, почти не изменяет устойчивость к нагреву. Единственно верным способом увеличения устойчивости к нагреванию можно назвать внесение изменений в химический состав, для этого и проводят легирование стали.
Твердый, тугоплавкий, достаточно тяжелый материал светло-серого цвета, который имеет металлический блеск. Механической обработке поддается с трудом. При комнатной температуре достаточно хрупок и ломается. Ломкость металла связана с загрязнением примесями углерода и кислорода.
Примечание! Технически, чистый металл при температуре выше 400 °C становится очень пластичным. Демонстрирует химическую инертность, неохотно вступает в реакции с другими элементами. В природе встречается в виде таких сложных минералов, как: гюбнерит, шеелит, ферберит и вольфрамит.
Вольфрам можно получить из руды, благодаря сложным химическим переработкам, в качестве порошка. Используя прессование и спекание, из него создают детали обычной формы и бруски.
Вольфрам — крайне стойкий элемент к любым температурным воздействиям. По этой причине размягчить вольфрам не могли более сотни лет. Не существовало такой печи, которая смогла бы нагреться до нескольких тысяч градусов по Цельсию. Ученым удалось доказать, что это самый тугоплавкий металл. Хотя бытует мнение, что сиборгий, по некоторым теоретическим данным, имеет большую тугоплавкость, но это лишь предположение, поскольку он является радиоактивным элементом и у него небольшой срок существования.

Определения, принцип измерения, советы и рекомендации, нормативные требования и многое другое
Температура плавления — характеризующее свойство твердых кристаллических веществ. Это температура, при которой вещество переходит из твердого состояния в жидкое. Измерение температуры плавления — метод термического анализа, часто применяемый для определения свойств твердых кристаллических веществ. Метод используется в научных и прикладных исследованиях, в лабораториях контроля качества на производстве для идентификации твердых кристаллических веществ и для проверки их чистоты.
На этой странице приведена важная информация о методах измерения температуры плавления. Также даны практические советы для повседневной работы.
Выберите тему
- Что такое температура плавления?
- Для чего измеряют температуру плавления?
- Принцип определения температуры плавления
- Капиллярный метод
- Фармакопейные правила определения температуры плавления
- Надлежащая подготовка образцов
- Настройка прибора
- Калибровка и настройка прибора для определения температуры плавления
- Влияние скорости нагрева на измерение температуры плавления
- Измерение температуры плавления: советы и рекомендации
- Влияние примесей на температуру плавления: депрессия температуры плавления
- Идентификация вещества по температуре плавления смеси
1. Что такое температура плавления?
Температура плавления — характеризующее свойство твердого кристаллического вещества. Это температура, при которой вещество переходит из твердого состояния в жидкое. Такой переход происходит при нагревании. В процессе плавления вся энергия, подводимая к веществу, расходуется на плавление, а температура остается постоянной (см. график ниже). Во время фазового перехода две физические фазы вещества существуют одновременно.
Кристаллические вещества отличаются наличием упорядоченной трехмерной структуры — кристаллической решетки. Частицы вещества удерживаются в этой структуре за счет образования связей определенного типа. Когда твердое кристаллическое вещество нагревается, энергия частиц увеличивается, и они начинают двигаться более интенсивно, пока, наконец, не разрываются структурные связи. Когда кристаллическая структура разрушается, твердый материал переходит в жидкое состояние.
Чем сильнее связи между частицами, тем больше энергии требуется для их преодоления. Чем больше требуется энергии, тем выше температура плавления. Таким образом, температура плавления вещества является показателем прочности его кристаллической решетки.
При температуре плавления изменяется не только агрегатное состояние: существенно меняются и многие другие физические характеристики. Среди них — термодинамические свойства, например удельная теплоемкость и энтальпия, а также реологические свойства, такие как объем и вязкость. Что не менее важно, изменяются двойное лучепреломление и светопроницаемость. По сравнению с другими физическими величинами изменение светопроницаемости легко регистрировать и использовать для определения точки плавления.


2. Для чего измеряют температуру плавления?
Температуру плавления часто используют для идентификации органических и неорганических кристаллических соединений и для определения степени их чистоты. Чистые вещества плавятся при четко определенной температуре (в очень узком диапазоне 0,5–1 °C), тогда как вещества, содержащие примеси, обычно имеют широкий температурный интервал плавления. Температура, при которой загрязненное вещество полностью плавится, обычно ниже температуры плавления чистого вещества. Эту особенность называют депрессией температуры плавления. Ее можно использовать для качественной оценки чистоты вещества.
Определение температуры плавления используется как в научных исследованиях, так и в лабораториях контроля качества для идентификации веществ и проверки их чистоты.
3. Принцип определения температуры плавления
В процессе плавления изменяется светопроницаемость вещества. По сравнению с другими физическими величинами изменение светопроницаемости легко регистрировать и использовать для определения точки плавления. Порошки из кристаллических материалов непрозрачны, но прозрачны их расплавы. Этого явного различия в оптических свойствах достаточно, чтобы определять температуру плавления, измеряя интенсивность света, проходящего через вещество в капилляре, по мере нагревания печи.
Расплавление твердого кристаллического вещества происходит в несколько этапов. При температуре разрушения вещество остается в основном твердым и содержит небольшую долю расплава. Следующий этап — температура образования мениска, при которой вещество в основном расплавлено, но с некоторой долей твердой фазы. При температуре прозрачности вещество полностью расплавлено.


4. Капиллярный метод
Для измерения температуры плавления обычно используют тонкие стеклянные трубки (капилляры) с внутренним диаметром 1 мм и толщиной стенки 0,1–0,2 мм. Капилляр заполняют мелко измельченным веществом таким образом, чтобы получился столбик высотой 2–3 мм, и помещают его в нагревательное устройство (водяную баню или металлический блок) как можно ближе к точному термометру. Температура нагревательного устройства поднимается с постоянной скоростью, которую задает пользователь. Температуру плавления определяют визуально, наблюдая за процессом расплавления вещества. В современных приборах, таких как Melting Point Excellence МЕТТЛЕР ТОЛЕДО, температура и диапазон плавления определяются автоматически с помощью видеокамеры. Капиллярный метод определения температуры плавления считается стандартным. Он описан во многих национальных Фармакопеях.
В приборах Melting Point Excellence МЕТТЛЕР ТОЛЕДО можно размещать одновременно до шести капилляров.
5. Фармакопейные правила определения температуры плавления

Требования Фармакопеи к определению температуры плавления относятся как к конструкции прибора, так и к процедуре измерения.
Краткий обзор требований:
- Используются капилляры с внешним диаметром 1,3–1,8 мм и толщиной стенок 0,1–0,2 мм.
- Постоянная скорость нагрева 1 °C в минуту.
- Если не указано иное, в большинстве Фармакопей требуется регистрировать температуру в точке C, когда твердая фаза отсутствует (соответствует температуре прозрачности).
- Регистрируемая температура — это температура нагревательной установки (масляной бани или металлического блока), в которой размещена термопара.
Приборы МЕТТЛЕР ТОЛЕДО для определения температуры плавления полностью соответствуют требованиям Фармакопеи.
Дополнительная информация о международных нормах и стандартах доступна по ссылке
www.mt.com/MPDP-norms
6. Надлежащая подготовка образцов
Для точного определения температуры плавления необходима надлежащая подготовка образцов.
В процессе подготовки образца сухое порошкообразное вещество измельчается в ступке. Им наполняют капилляры, которые затем помещают в печь. В комплект дополнительных принадлежностей для определения температуры плавления входят 150 специальных капилляров, агатовая ступка с пестиком, пинцет, лопатка (b) и пять приспособлений для заполнения капилляров (a). Кроме того, в комплект входят три стандартных образца: либо эталоны температуры плавления МЕТТЛЕР ТОЛЕДО (бензофенон, бензойная кислота, сахарин), либо эталоны температуры плавления согласно Фармакопее США (кофеин, ванилин, ацетанилид).

Порядок подготовки образцов с использованием принадлежностей МЕТТЛЕР ТОЛЕДО:
Шаг 1. Сначала необходимо высушить образец в эксикаторе. Затем разотрите небольшую порцию вещества в ступке.
Шаг 2. Заполните несколько капилляров, пользуясь специальным приспособлением МЕТТЛЕР ТОЛЕДО. Зажим приспособления надежно удерживает капилляр во время заполнения. С его помощью удобно набирать небольшие порции порошка из ступки.
Шаг 3. Для перемещения столбика образца вниз по капилляру следует освободить зажим и осторожно постучать по столу нижним концом капилляра. При постукивании по твердой поверхности порошок уплотняется в нижнем конце капилляра. При этом из него удаляются воздушные промежутки.
Шаг 4. На приспособление нанесены деления для проверки высоты столбика вещества в капилляре. Как правило, высота столбика не должна превышать 3 мм.
 |
|
Подготовка образца для определения температуры плавления: шаг 1 |
 |
|
Подготовка образца для определения температуры плавления: шаг 2a |
 |
|
Подготовка образца для определения температуры плавления: шаг 2b |
 |
|
Подготовка образца для определения температуры плавления: шаг 3 |
 |
|
Подготовка образца для определения температуры плавления: шаг 4 |
7. Настройка прибора
Настройка прибора, наряду с правильной подготовкой образца, имеет большое значение для точного определения температуры плавления. Правильный выбор начальной и конечной температуры, а также скорости нагрева необходим для уменьшения погрешностей, связанных с неравномерным или слишком быстрым накоплением тепла в образце.
а) Начальная температура
Измерение температуры плавления начинается при заданной температуре, близкой к предполагаемой температуре плавления. Нагрев до начальной температуры происходит относительно быстро. По достижении начальной температуры капилляры помещаются в печь, где начинается подъем температуры с заданной скоростью.
Начальную температуру обычно рассчитывают так:
Начальная Т = предполагаемая Т плавления – (5 мин × скорость нагрева)
b) Скорость нагрева
Скорость нагрева от начальной до конечной температуры постоянна.
Результаты сильно зависят от скорости нагрева — чем она выше, тем выше будет измеренная температура плавления.
В Фармакопеях указана постоянная скорость нагрева 1 °C/мин. Для достижения максимальной точности используйте скорость нагрева 0,2 °C/мин, если вещество не подвержено разложению. Если в диапазоне измерения вещество разлагается, используйте скорость нагрева 5 °C/мин. Для предварительного анализа можно использовать скорость нагрева 10 °C/мин.
c) Конечная температура
Максимальная температура, достигаемая в процессе анализа.
Конечную температуру обычно рассчитывают так:
Конечная Т = предполагаемая Т плавления + (3 мин × скорость нагрева)
d) Режимы измерения температуры плавления
Для измерения температуры плавления можно применять один из двух режимов: Фармакопейный или термодинамический. В Фармакопейном режиме не учитывается то, что температура печи в ходе нагрева отличается (в большую сторону) от температуры образца, то есть измеряется температура печи, а не температура образца. Вследствие этого Фармакопейные значения температуры плавления сильно зависят от скорости нагрева. Результаты измерений сопоставимы только в тех случаях, когда используется одинаковая скорость нагрева.
Чтобы рассчитать термодинамическую температуру плавления, нужно из значения Фармакопейной температуры плавления вычесть произведение термодинамического коэффициента f и квадратного корня из скорости нагрева. Термодинамический коэффициент определяется для каждого прибора опытным путем. С физической точки зрения корректной является термодинамическая температура плавления. Ее значение не зависит от скорости нагрева и других факторов. Это очень удобно, так как позволяет сравнивать температуры плавления различных веществ, измеренные в разных экспериментальных установках.
Автоматическое измерение температуры плавления и каплепадения
В этом руководстве по измерению температуры плавления и каплепадения описана автоматизированная процедура анализа, даны рекомендации по методикам измерения и подтверждения рабочих характеристик.

8. Калибровка и настройка прибора для определения температуры плавления
Прежде чем использовать прибор для измерения, рекомендуется оценить его погрешность. Для оценки погрешности прибор калибруют с помощью стандартов с сертифицированными значениями температуры плавления. Номинальное значение, включая погрешность, сравнивают со значением, полученным при измерении.
Если результаты калибровки окажутся неудовлетворительными, то есть выяснится, что измеренное значение температуры находится вне диапазона допусков сертифицированного стандартного вещества, производится регулировка прибора.
Для обеспечения точности измерения рекомендуется регулярно, например раз в месяц, калибровать печь по сертифицированным стандартам.
Приборы Melting Point Excellence выпускаются с завода после калибровки и настройки с использованием стандартов МЕТТЛЕР ТОЛЕДО. Настройка выполняется на основании результатов калибровки по трем точкам, для которой используются бензофенон, бензойная кислота и кофеин. После настройки выполняется поверка по ванилину и нитрату калия.

9. Влияние скорости нагрева на измерение температуры плавления
Результаты сильно зависят от скорости нагрева — чем она выше, тем выше будет измеренная температура плавления. Это объясняется тем, что по техническим причинам температура плавления измеряется не непосредственно внутри вещества, а в нагревательном блоке вне капилляра. В ходе нагрева температура внутри образца отстает от температуры печи. Чем выше скорость нагрева, тем быстрее поднимается температура печи, увеличивая разницу между измеренной и истинной температурой плавления.
Вследствие этого температуры плавления сопоставимы только в том случае, если они измерены при одинаковой скорости нагрева.
Изменение температур образца и печи в ходе нагрева
Измерение температуры плавления начинается при заданной температуре, близкой к предполагаемой температуре плавления. На рисунке ниже сплошной красной линией показано изменение температуры образца. На начальном этапе температуры образца и печи одинаковы, так как перед началом измерения было достигнуто температурное равновесие. Температура образца поднимается пропорционально температуре печи. Следует помнить, что температура образца при нагреве отстает, поскольку на передачу тепла от печи к образцу требуется некоторое время. Температура печи в процессе нагрева всегда выше температуры образца. В какой-то момент образец под действием тепла печи начинает плавиться. Пока образец полностью не расплавится, его температура остается постоянной. Различают две характерные температуры, TA и TC, соответствующие двум стадиям плавления: точке разрушения и точке прозрачности. Как только образец полностью расплавится, температура образца в капилляре начинает заметно подниматься. Она растет вслед за температурой печи с задержкой, как и в начале измерения.
Фармакопейная и термодинамическая температура плавления
Для измерения температуры плавления можно применять один из двух режимов: Фармакопейный или термодинамический. В Фармакопейном режиме не учитывается то, что температура печи в ходе нагрева отличается (в большую сторону) от температуры образца, то есть измеряется температура печи, а не температура образца. Вследствие этого Фармакопейные значения температуры плавления сильно зависят от скорости нагрева. Результаты измерений сопоставимы только в тех случаях, когда используется одинаковая скорость нагрева.
Чтобы рассчитать термодинамическую температуру плавления, нужно из значения Фармакопейной температуры плавления вычесть произведение термодинамического коэффициента f и квадратного корня из скорости нагрева. Термодинамический коэффициент определяется для каждого прибора опытным путем. С физической точки зрения корректной является термодинамическая температура плавления (см. рисунок ниже). Ее значение не зависит от скорости нагрева и других факторов. Это очень удобно, так как позволяет сравнивать температуры плавления различных веществ, измеренные в разных экспериментальных установках.
 |
|
Повышение температуры образца и печи |
 |
|
Фармакопейная и термодинамическая температура плавления |

10. Измерение температуры плавления: советы и рекомендации
- Для окрашенных или разлагающихся образцов (азобензол, бихромат калия, йодид кадмия), также образцов, склонных к образованию пузырьков воздуха в расплаве (мочевина), можно либо снизить пороговое значение B, либо использовать в качестве критерия оценки значение C, поскольку увеличение светопроницаемости при плавлении будет не таким большим.
- Вещества, которые разлагаются (сахар) или возгоняются (кофеин): запаяйте концы капилляра в пламени горелки. Летучие компоненты создают внутри капилляра повышенное давление, которое подавляет дальнейшее разложение или возгонку.
- Гигроскопичные образцы: запаяйте концы капилляра в пламени горелки.
- Скорость нагрева: обычно 1 °C/мин. Для достижения максимальной точности используйте скорость нагрева 0,2 °C/мин, если вещество не подвержено разложению, в противном случае — 5 °C/мин. Для предварительного анализа можно использовать скорость нагрева 10 °C/мин.
- Начальная температура: выбирается в расчете на 3–5 минут нагрева до ожидаемой точки плавления, на 5–10 °C ниже нее (в 3–5 раз больше скорости нагрева).
- Конечная температура: для получения качественной кривой нагрева необходимо, чтобы конечная температура была приблизительно на 5 °C выше температуры плавления.
- Используйте термодинамическую температуру плавления, если СОП и прибор это допускают. Термодинамическая температура является физически корректной характеристикой, не зависящей от свойств прибора.
- Неправильная подготовка образцов: для анализа пригодны только образцы в виде однородного сухого порошка. Влажные образцы необходимо высушить. Крупные кристаллы или неоднородные вещества следует тонко растереть в ступке. Для обеспечения сопоставимых результатов важно заполнять все капилляры на одинаковую высоту и хорошо уплотнять столбик.
- Для определения температуры плавления с высокой точностью и повторяемостью рекомендуется использовать одинаковые капилляры, изготовленные с соблюдением заданных допусков, например капилляры МЕТТЛЕР ТОЛЕДО. При использовании других капилляров следует откалибровать и при необходимости настроить прибор.
У вас есть отдельный вопрос?

11. Влияние примесей на температуру плавления: депрессия температуры плавления
Вещества, содержащие примеси, имеют более низкую температуру плавления по сравнению с чистым материалом. Это объясняется тем, что примеси снижают прочность связей кристаллической решетки. Вследствие этого для разрыва связей и разрушения структуры требуется меньшая энергия.
Температуру плавления удобно использовать в качестве показателя чистоты вещества, так как в присутствии примесей она в большинстве случаев снижается, а диапазон плавления расширяется.
12. Идентификация вещества по температуре плавления смеси
Если температура плавления двух образцов одинакова, то по температуре плавления их смеси можно определить, являются ли они одним и тем же веществом. Температура плавления смеси двух веществ, как правило, ниже температуры плавления каждого из них в чистом виде. Это явление называется депрессией температуры плавления.
Для идентификации вещества по температуре плавления его смешивают со стандартом в соотношении 1:1. Если температура плавления смеси оказывается ниже температуры плавления стандарта, можно утверждать, что образец не аналогичен стандартному веществу. Если температура плавления при смешивании не снижается, то образец идентичен стандарту.
Обычно в подобных случаях измеряют температуру плавления образца, стандарта и их смеси, поэтому в современных приборах для определения температуры плавления предусмотрено размещение в нагревательном блоке как минимум трех капилляров.
 |
|
График 1. Образец и стандарт идентичны |
 |
|
График 2. Образец отличается от стандарта |
Дополнительно: оборудование и решения
Металлы обладают рядом оригинальных свойств, которые присущи только этим материалам. Существует температура плавления металлов, при которой кристаллическая решетка разрушается. Вещество сохраняет объем, но уже нельзя говорить о постоянстве формы.
В чистом виде отдельные металлы встречают крайне редко. На практике применяют сплавы. У них есть определенные отличия от чистых веществ. При образовании сложных соединений происходит объединение кристаллических решеток между собой. Поэтому у сплавов свойства могут заметно отличаться от составляющих элементов. Температура плавления уже не остается постоянной величиной, она зависит от концентрации входящих в сплав ингредиентов.
Содержание:
- Понятие о шкале температур
- Кристаллические решетки металла
- Температура плавления металлов
- Сплавы металлов
- Сплав Вуда
- Сплавы для пайки
- Температура плавления неметаллов
- Заключение
Понятие о шкале температур
Некоторые неметаллические предметы тоже обладают похожими свойствами. Самым распространённым является вода. Относительно свойств жидкости, занимающей господствующее положение на Земле, была разработана шкала температур. Реперными точками признаны температура изменения агрегатных состояний воды:
- Превращения из жидкости в твердое вещество и наоборот приняты за ноль градусов.
- Кипения (парообразования внутри жидкости) при нормальном атмосферном давлении (760 мм рт. ст.) принята за 100 ⁰С.
Внимание! Кроме шкалы Цельсия на практике измеряют температуру в градусах Фаренгейта и по абсолютной шкале Кельвина. Но при исследовании свойств металлических предметов другие шкалы используют довольно редко.
Кристаллические решетки металла
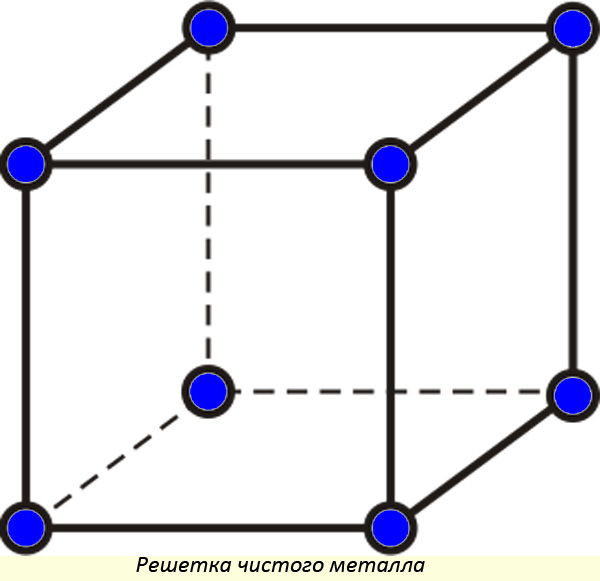
В идеальном виде принято считать, что металлам свойственна кубическая решетка (в реальном веществе могут быть изъяны). Между молекулами имеются равные расстояния по горизонтали и вертикали.
Твердое вещество характеризуется постоянством:
- формы, предмет сохраняет линейные размеры в разных условиях;
- объема, предмет не изменяет занимаемое количество вещества;
- массы, количество вещества, выраженное в граммах (килограммах, тоннах);
- плотности, в единице объема содержится постоянная масса.
При переходе в жидкое состояние, достигнув определенной температуры, кристаллические решетки разрушаются. Теперь нельзя говорить о постоянстве формы. Жидкость будет принимать ту форму, в какую ее зальют.
Когда происходит испарение, то постоянным остается только масса вещества. Газ займет весь объем, который будет ему предоставлен. Здесь нельзя утверждать, что плотность постоянная величина.
Когда соединяются жидкости, то возможны варианты:
- Жидкости полностью растворяются одна в другой, так себя ведут вода и спирт. Во всем объеме концентрация веществ будет одинаковой.
- Жидкости расслаиваются по плотности, соединение происходит только на границе раздела. Только временно можно получать механическую смесь. Перемешав разные по свойствам жидкости. Примером является масло и вода.
Металлы образуют сплавы в жидком состоянии. Чтобы получить сплав, каждый из компонентов должен быть в жидком состоянии. У сплавов возможны явления полного растворения одного в другом. Не исключаются варианты, когда сплав будет получен только в результате интенсивного перемешивания. Качество сплава в этом случае не гарантируется, поэтому стараются не смешивать компоненты, которые не позволяют получать стабильные сплавы.
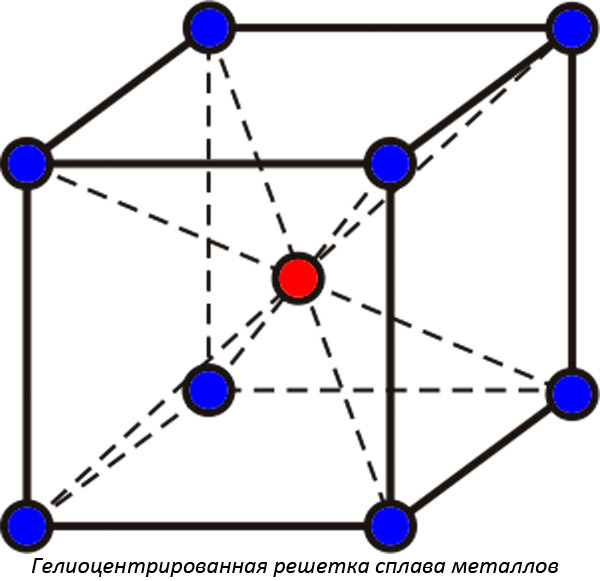
Образующиеся растворимые друг в друге вещества при застывании образуют кристаллические решетки нового типа. Определяют:
- Гелиоцентрированные кристаллические решетки, их еще называют объёмно-центрированными. В середине находится молекула одного вещества, а вокруг располагаются еще четыре молекулы другого. Принято называть подобные решетки рыхлыми, так как в них связь между молекулами металлов слабее.
- Гранецентрированные кристаллические решетки образуют соединения, в которых молекулы компонента располагаются на гранях. Металловеды называют подобные кристаллические сплавы плотными. В реальности плотность сплава может быть выше, чем у каждого из входящих в состав компонентов (алхимики средних веков искали варианты сплавов, при которых плотность будет соответствовать плотности золота).
Температура плавления металлов
Разные вещества имеют различную температуру плавления. Принято делить металлы на:
- Легкоплавкие – их достаточно нагревать до 600 ⁰С, чтобы получать вещество в жидком виде.
- Среднеплавкие металлы расплавляются в диапазоне температур 600…1600 ⁰С.
- Тугоплавкими называют металлы, которые могут расплавляться при температуре более 1600 ⁰С.
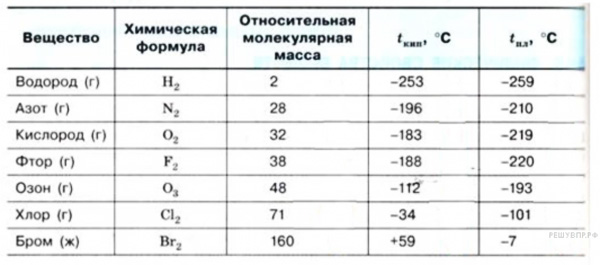
В таблице по возрастанию показаны легкоплавкие металлы. Здесь видно, что самым необычным металлом является ртуть (Hg). В обычных условиях она находится в жидком состоянии. Этот металл имеет самую низкую температуру плавления.
Таблица 1, температуры плавления и кипения легкоплавких металлов:
Таблица 2, температуры плавления и кипения среднеплавких металлов:
Таблица 3, температуры плавления и кипения тугоплавких металлов:
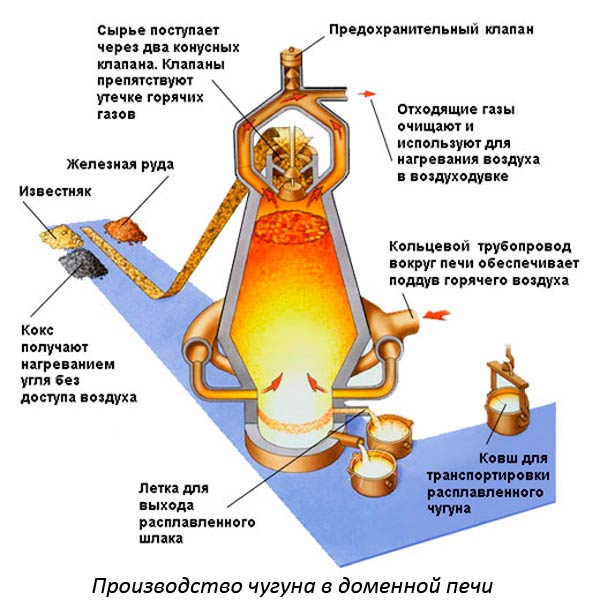
Чтобы вести процесс плавки используют разные устройства. Например, для выплавки чугуна применяют доменные печи. Для плавки цветных металлов производят внутренний нагрев с помощью токов высокой частоты.
В изложницах, изготовленных из неметаллических материалов, находятся цветные металлы в твердом состоянии. Вокруг них создают переменное магнитное поле СВЧ. В результате кристаллические решетки начинают расшатываться. Молекулы вещества приходят в движение, что вызывает разогрев внутри всей массы.
При необходимости плавки небольшого количества легкоплавких металлов используют муфельные печи. В них температура поднимается до 1000…1200 ⁰С, что достаточно для плавки цветных металлов.
Черные металлы расплавляют в конвекторах, мартенах и индукционных печах. Процесс идет с добавлением легирующих компонентов, улучшающих качество металла.
Сложнее всего проводить работу с тугоплавкими металлами. Проблема в том, что нужно использовать материалы, имеющие температуру более высокую, чем температура плавления самого металла. В настоящее время авиационная промышленность рассматривает использование в качестве конструкционного материала Титан (Ti). При высокой скорости полета в атмосфере происходит разогрев обшивки. Поэтому нужна замена алюминию и его сплавам (AL).
Максимальная температура плавления этого довольного легкого металла привлекает конструкторов. Поэтому технологи разрабатывают технологические процессы и оборудование, чтобы производить детали из титана и его сплавов.
Сплавы металлов
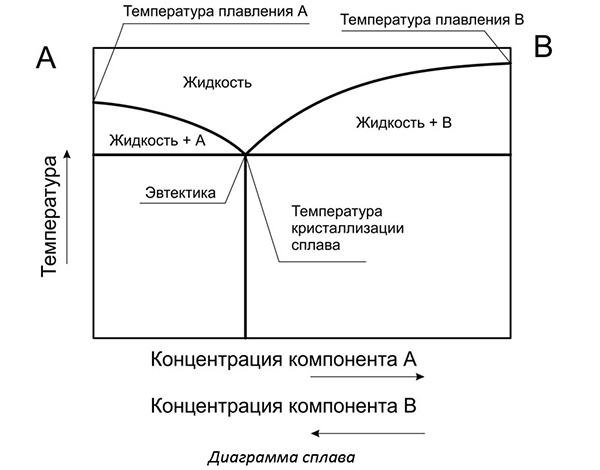
Чтобы проектировать изделия из сплавов, сначала изучают их свойства. Для изучения в небольших емкостях расплавляют изучаемые металлы в разном соотношении между собой. По итогам строят графики.
Нижняя ось представляет концентрацию компонента А с компонентом В. По вертикали рассматривают температуру. Здесь отмечают значения максимальной температуры, когда весь металл находится в расплавленном состоянии.
При охлаждении один из компонентов начинает образовывать кристаллы. В жидком состоянии находится эвтектика – идеальное соединение металлов в сплаве.
Металловеды выделяют особое соотношение компонентов, при котором температура плавления минимальная. Когда составляют сплавы, то стараются подбирать количество используемых веществ, чтобы получать именно эвтектоидный сплав. Его механические свойства наилучшие из возможных. Кристаллические решетки образуют идеальные гранецентрированные положения атомов.
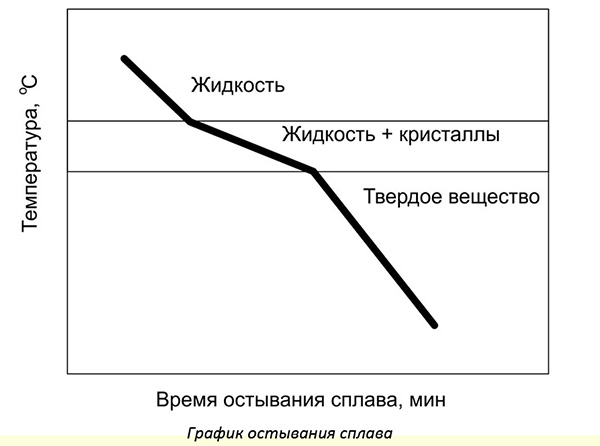
Изучают процесс кристаллизации путем исследования твердения образцов при охлаждении. Строят специальные графики, где наблюдают, как изменяется скорость охлаждения. Для разных сплавов имеются готовые диаграммы. Отмечая точки начала и конца кристаллизации, определяют состав сплава.
Сплав Вуда
В 1860 г. американский зубной техник Барнабас Вуд искал оптимальные соотношения компонентов, чтобы изготавливать зубы для клиентов при минимальных температурах плавления. Им был найден сплав, который имеет температуру плавления всего 60,2…68,5 ⁰С. Даже в горячей воде металл легко расплавляется. В него входят:
- олово — 12,5…12,7 %;
- свинец — 24,5…25,0 %;
- висмут — 49,5…50,3 %;
- кадмий — 12,5…12,7 %.
Сплав интересен своей низкой температурой, но практического применения так и не нашел. Внимание! Кадмий и свинец – это тяжелые металлы, контакт с ними не рекомендован. У многих людей могут происходить отравления при контакте с кадмием.
Сплавы для пайки
На практике многие сталкиваются с плавлением при пайке деталей. Если поверхности соединяемых материалов очищены от загрязнений и окислов, то их нетрудно спаять припоями. Принято делить припои на твердые и мягкие. Мягкие получили наибольшее распространение:
- ПОС-15 — 278…282 °C;
- ПОС-25 — 258…262 °C;
- ПОС-33 — 245…249 °C;
- ПОС-40 — 236…241 °C;
- ПОС-61 — 181…185 °C;
- ПОС-90 — 217…222 °C.
Их выпускают для предприятий, изготавливающих разные радиотехнические приборы.
Твердые припои на основе цинка, меди, серебра и висмута имеют более высокую температуру плавления:
- ПСр-10 — 825…835 °С;
- ПСр-12 — 780…790 °С;
- ПСр-25 — 760…770 °С;
- ПСр-45 — 715…721 °С;
- ПСр-65 — 738…743 °С;
- ПСр-70 — 778…783 °С;
- ПМЦ-36 — 823…828 °С;
- ПМЦ-42 — 830…837 °С;
- ПМЦ-51 — 867…884 °С.
Использование твердых припоев позволяет получать прочные соединения.
Внимание! Ср означает, что в составе припоя использовано серебро. Такие сплавы обладают минимальным электрическим сопротивлением.
Температура плавления неметаллов
Неметаллические материалы могут быть представлены в твердом и жидком виде. Неорганические вещества представлены в табл. 4.
Таблица 4, температура плавления неорганических неметаллов:
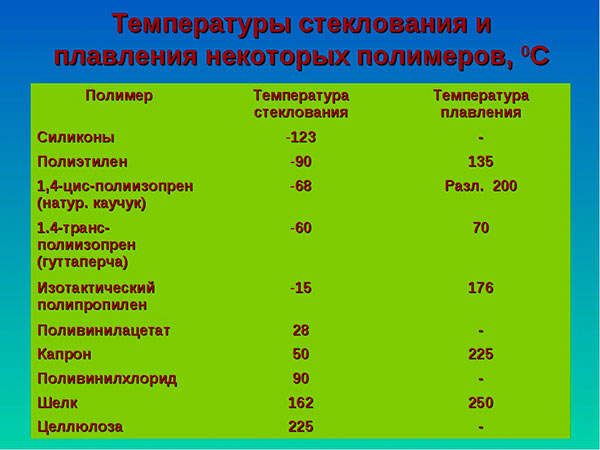
На практике для пользователей наибольший интерес представляют органические материалы: полиэтилен, полипропилен, воск, парафин и другие. Температура плавления некоторых веществ показана в табл. 5.
Таблица 5, температура плавления полимерных материалов:
Внимание! Под температурой стеклования понимают состояние, когда материал становится хрупким.
Видео: температура плавления известных металлов.
Заключение
- Температура плавления зависит от природы самого вещества. Чаще всего – это постоянная величина.
- На практике используют не чистые металлы, а их сплавы. Обычно они имеют свойства гораздо лучше, чем чистый металл.
Republished by Blog Post Promoter
При какой температуре плавится металл
На чтение 3 мин Просмотров 1.8к. Опубликовано 19.06.2020
При термическом воздействии на детали в процессе сварки важно учитывать температуру плавления металлов. От этого показателя зависят токовые параметры. Необходимо создать электрической дугу или пламя в газовой горелке такой тепловой мощности, чтобы разрушить молекулярные связи. Параметр, при котором сталь или цветной сплав плавится, учитывают при выборе конструкционных материалов для узлов, испытывающих силу трения или металлоконструкций, испытывающих термическое воздействие.
Содержание
- Процесс плавления
- Классификация металлов по температуре плавления
- Разница между температурой плавления и кипения
- Таблицы температур плавления металлов и сплавов
Процесс плавления
При термовоздействии на деталь изменение внутренней структуры происходит за счет накопления энергии молекулами. Скорость их движения возрастает. В критической точке нагрева начинается разрушение кристаллической структуры, межмолекулярные связи уже не могут удержать молекулы в узлах решетки. Взамен колебательным движениям в пределах узла происходит хаотическое движение, образуется ванна расплава в месте нагрева. Точку начала расплавления вещества в лабораторных условиях определяют до сотых долей градуса, причем этот показатель не зависит от внешнего давления на заготовку. В вакууме и под давлением металлические заготовки начинают плавиться при одной и той же температуре, это объясняется процессом накопления внутренней энергии, необходимой для разрушения межмолекулярных связей.
В физике переход твердого тела в жидкое состояние характерен только для веществ кристаллической структуры. Температуру плавления металлов чаще обозначают диапазоном значений, для сплавов точно определить нагрев до пограничного фазового состояния сложно. Для чистых элементов каждый градус имеет значение, особенно, если это легкоплавкие элементы,
значения не имеет. Сводная таблица показателей t обычно делится на 3 группы. Помимо легкоплавких элементов, которые максимально нагревают до +600°С, указывают тугоплавкие, выдерживающие нагрев свыше +1600°С, и среднеплавкие. В этой группе сплавы, образующие ванну расплава при температуре от +600 до 1600°С.
Разница между температурой плавления и кипения
Точкой фазового перехода вещества из твердого кристаллического состояния в жидкое нередко называют температуру плавления металла. В расплаве молекулы не имеют определенного расположения, но притяжение удерживает их вместе, в жидком состоянии кристаллическое тело сохраняет объем, но теряет форму.
При кипении теряется объем, молекулы слабо взаимодействуют, хаотично движутся во всех направлениях, отрываются от поверхности. Температура кипения – это когда давление металлических паров достигает давления внешней среды.
Для наглядности разницу между критическими точками нагрева лучше представить в виде таблицы:
| Свойства | Температура плавки | Температура кипения |
|---|---|---|
| Физическое состояние | Сплав превращается в расплав, кристаллическая структура разрушается, исчезает зернистость | Переход в газообразное состояние, отдельные молекулы улетают за пределы расплава |
| Фазовый переход | Равновесие между жидкой и твердой фазами | Равновесие между давлением паров металла и внешним давлением воздуха |
| Влияние внешнего давления | Не меняется | Изменяется, падает при разряжении |
Для удобства границы фазового перехода указаны по группам в порядке возрастания t фазового перехода из твердого в жидкое состояние. Из всех элементов выбраны часто встречающиеся.
Таблица плавления легкоплавких металлов и сплавов (расплавляются до +600°С).
| Название элемента или соединения | Буквенный символ в периодической таблице элементов | Температура образования расплава | Температура закипания |
|---|---|---|---|
| Ртуть | Hg | -38,9°С | +356,7°С |
| Литий | Li | +18°С | +1342°С |
| Цезий | Cs | +28,4°С | +667,5°С |
| Калий | K | +63,6°С | +759°С |
| Натрий | Na | +97,8°С | +883°С |
| Индий | In | +156,6°С | +2072°С |
| Олово | Sn | +232°С | +2600°С |
| Висмут | Bi | +271,4°С | +1564°С |
| Таллий | Tl | +304°С | +1473°С |
| Кадмий | Cd | +321°С | +767°С |
| Свинец | Pb | +327°С | +1750°С |
| Цинк | Zn | +420°С | +907°С |
Таблица плавления среднеплавких металлов и сплавов, диапазон фазового перехода от +600 до 1600°С.
| Наименование | Обозначение металла или химический состав сплава | Температура плавления | Температура кипения |
|---|---|---|---|
| МЕТАЛЛЫ | |||
| Сурьма | Sb | +630,6°С | +1587°С |
| Магний | Mg | +650°С | +1100°С |
| Алюминий | Al | +660°С | +2519°С |
| Барий | Ba | +727°С | +1897°С |
| Кальций | Ca | +842°С | +1484°С |
| Серебро | Ag | +960°С | +2180°С |
| Золото | Au | +1063°С | +2660°С |
| Марганец | Mn | +1246°С | +2061°С |
| Медь | Cu | +1083°С | +2580°С |
| Бериллий | Be | +1287°С | +2471°С |
| Кремний | Si | +1415°С | +2350°С |
| Никель | Ni | +1455°С | +2913°С |
| Кобальт | Co | +1495°С | +2927°С |
| Железо | Fe | +1539°С | +900°С |
| СПЛАВЫ | |||
| Дюрали | Al+ Mg+Cu+Mn | +650°С | |
| Латуни | сплавы на основе меди и цинка | +950…1050°С | |
| Нейзильбер | Cu+Zn+Ni | +1100°С | |
| Чугун | углеродистое железо | +1100…1300°С | |
| Углеродистые стали | +1300…1500°С | ||
| Нихром | Fe+Ni+Cr+Si+Mn+Al | +1400°С | |
| Инвар | Fe+Ni | +1425°С | |
| Фехраль | Fe+Cr+Al+Mn+Si | +1460°С |
Таблица плавления тугоплавких металлов и сплавов (свыше +1600°С).
| Название | Символ элемента, формула соединения | Температура плавления | Температура кипения |
|---|---|---|---|
| Титан | Ti | +1680°С | +3300°С |
| Карбид титана | TiC | +3150°С | – |
| Торий | Th | +1750°С | +4788°С |
| Платина | Pt | +1769,3°С | +3825°С |
| Хром | Cr | +1907°С | +2671°С |
| Карбиды хрома | Cr23C6 | +1660°С | – |
| Cr7С3 | +1780°С | – | |
| Cr3С2 | +1890°С | – | |
| Цирконий | Zr | +1855°С | +4409°С |
| Карбид циркония | ZrC | +3530°С | – |
| Ванадий | V | +1910°С | +3407°С |
| Родий | Rh | +1964°С | +3695°С |
| Иридий | Ir | +2447°С | +4428°С |
| Ниобий | Nb | +2477°С | +4744°С |
| Молибден | Mo | +2623°С | +4639°С |
| Тантал | Ta | +3017°С | +5458°С |
| Вольфрам | W | +3420°С | +5555°С |
МенюСтатьи |
Температура плавления сталиТемпература плавления (температура ликвидус) — это температура, при которой вещество переходит в полностью жидкое состояние. Температура затвердевания (температуру солидус) — это такая температура, при которой вещество переходит полностью в твердое состояние. Для чистых веществ (элементов) температуры ликвидус и солидус совпадают. Для растворов же, к которым в том числе относятся сталь и чугун, существует, так называемый, температурный интервал кристаллизации, в котором одновременно сосуществуют твердая и жидкая фазы. Расчет температуры плавления и затвердевания сталиРомашкин А.Н. Температуры плавления и затвердевания стали зависят от ее состава. Как правило при расчете TL и TS делают допущение об аддитивности влиянии легирующих и примесей на значения этих величин. При этом изменение температуры плавления/затвердевания, обусловленное наличием того или иного элемента, рассчитывают как TL/S сплав = Т0 — ΣdTL/Si Влияние различных элементов на температуру плавления и кристаллизации определяют по диаграммам состояния для каждого элемента i (использованные диаграммы состояния приведены ниже в таблице).
При этом допускали, что их влияние на рассматриваемые величины носит линейный характер, т.е. dTL/Si = kL/Si·[i] kL/Si = {(TL/Si)а — (TL/Si)b}/{[i]а — [i]b} Конкретные значения kL/S i были получены следующим образом: kLC = (1539 — 15…)/… = 64 kSC = (1539 — …)/… = 356 при С < 0,1 kLC = (1539 — 15…)/… = 64 kSC = (1539 — …)/… = 141 при С > 0,1 kLCr = (1539 — 1515)/22 = 1,09 kSCr = (1539 — 1505)/22 = 1,54 kLNi = (1539 — 1449)/50 = 1,80 kSNi = (1539 — 1436)/50 = 2,06 kLMo = (1539 — 1460)/33 = 2,39 kSMo = (1539 — 1450)/33 = 2,70 kLV = (1539 — 1475)/30 = 2,13 kSV = (1539 — 1468)/30 = 2,37 kLS = (1539 — 1530)/0,20 = 45,0 kSS = (1539 — 1365)/0,20 = 870 если содержание серы более 0,2, то dTSS= 1539 — 1365 = 174 kLP = (1539 — 1400)/5 = 27,8 kSP = (1539 — 1050)/5 = 97,8 Влияние углерода на температуры ликвидус и солидус целесообразно рассчитывать с учетом изображенных на рисунке ниже рагрессионных выражений.
Диаграмма состояния железо-углерод Таким образом, температура ликвидус и солидус рассчитываются как TL = T0 — (dTLC + 1,09·[Cr] + 1,80·[Ni] + 2,39·[Мо] + 2,13·[V] + 45·[S] + 27,8·[P]) TS = T0 — (dTSC + 1,54·[Cr] + 2,06·[Ni] + 2,70·[Мо] + 2,37·[V] + 870·[S] + 97,8·[P]) Следует подчеркнуть, что величина TS не представляет практического интереса, так как в процессе кристаллизации происходит значимое перераспределение элементов между жидкой и твердой фазой, в результате которого жидкость обогащается ликватами, прежде всего углеродом, серой и фосфором (чем определяется способность элементов к ликвации Вы можете узнать здесь), что, естественно, снижает температуру затвердевания, поэтому температура, при которой разливаемый металл полностью затвердевает в большинстве случае составляет величину гораздо меньшую, чем расчетное значение TS. Ниже приведена работа А. Н. Смирнова, более подробно рассматривающая вопрос определения температуры плавления и затвердевания стали Расчет температуры ликвидус сталиА. Н. Смирнов, Л. Неделькович, М. Джурджевич, Т. В. Чернобаева и 3. Оданович Донецкий государственный технический университет (Украина) и Белградский университет (Югославия) Точная оперативная информация о температуре ликвидус стали имеет большое практическое значение, так как в зависимости от имеющегося в цехе оборудования для внепечной обработки именно эта температура определяет температурный режим от выпуска до окончания разливки плавки, особенно на МНЛЗ. Это дает возможность работать с оптимально низкой степенью перегрева и обеспечивает мелкозернистую литую структуру и высокое качество заготовки. Известно, что измерение температуры ликвидус (TL) не вызывает значительных затруднений. Однако заданный химический состав стали достигается к концу внепечной обработки перед началом непрерывной разливки, что существенно ограничивает возможности использования экспериментальных данных (записи кривой охлаждения). Поэтому для оперативного определения значения TL целесообразно проводить расчеты с использованием данных о химическом составе стали. Между тем, выбор какого-либо универсального метода расчета температуры ликвидус на практике вызывает значительные затруднения, так как рекомендации специалистов, занимающихся решением этой проблемы, довольно противоречивы. Сравнение точности и надежности методов расчета TL для стали различных марок выполнено в настоящей работе. Большая часть известных методов расчета температуры ликвидус углеродистой и легированной стали основана на полиномных выражениях, которые в обобщенном виде могут быть представлены следующим образом [1…9]: TL = Тплав Fe — (Σ(a0 + a1∙[i] + a2∙[i]2)) где Tплав Fe — температура плавления чистого железа (в соответствии с большей частью известных рекомендаций TплавFе= 1539 °С); а0 — коэффициент приведения температуры плавления чистого железа (вводится в случае принятия значения температуры плавления железа отличного от приведенного выше); а1 и а2 — коэффициенты значимости 1-го и 2-го порядка для соответствующего элемента i, содержащегося в стали данной марки; [i] — содержание элемента i в стали данной марки, %. В качестве основы выражений такого типа принята гипотеза о том, что каждый из химических элементов влияет на снижение температуры ликвидус железа независимо один от другого. При этом результирующее влияние всех растворенных в стали элементов на снижение температуры ликвидус может быть получено на основании двойных диаграмм состояния Fe-Хi,. Поэтому эти выражения различаются только тем, каким образом аппроксимируется линия ликвидус в бинарной диаграмме со стороны железа. В простейшем случае она заменяется касательной прямой на линию ликвидус со стороны железа, а выражение для температуры ликвидус упрощается до полинома первого порядка. Подобные выражения, как видно из табл. 1 [1…4], различаются по значениям коэффициентов аi и принятой температуре плавления железа. Влияние изменения концентрации каждого химического элемента на снижение температуры плавления железа может быть также учтено описанием линии ликвидус с помощью полинома второго порядка или вписыванием ломаной линии в кривую значений температуры ликвидус. Причем неодинаковый наклон звеньев ломаной линии в концентрационных промежутках учитывает влияние собственной концентрации каждого элемента на снижение температуры плавления железа. В качестве иллюстрации в табл. 1 приведены данные работ [5…7], где учитывается только концентрационная зависимость влияния углерода, и работ [8, 9], где эта концентрационная зависимость выражается и для ряда других элементов в стали. Приведенными в табл. 1 данными можно пользоваться только в тех концентрационных областях, в которых при затвердевании образуется твердый раствор. Однако средние квадратичные отклонения σ (табл. 1) не могут служить обобщенным критерием оценки достоверности и применимости каждой из формул, так как специалисты обычно используют несколько отличные в техническом исполнении методы и приборы для измерения температуры ликвидус стали. По-видимому, такая оценка должна проводиться для данных, которые получены в примерно одинаковых условиях при достаточно надежном измерении температуры ликвидус применительно к большому массиву марок стали. В настоящей работе были отобраны результаты измерений температуры ликвидус для стали 87 марок по данным А.А. Howe [10]. Химический состав стали некоторые из этих марок и результаты измерений температуры ликвидус приведены в табл. 2. При этом для стали состава 1-10 температуру ликвидус определяли путем термического анализа образца массой 400 г, для стали состава 11-20 — одновременно путем термического и дифференциального термического анализа образца массой 40 г. Было определено, что расчетные значения температуры ликвидус в большей части случаев превышают экспериментальные данные. С уменьшением температуры ликвидус, которое соответствует росту содержания углерода и легирующих элементов в стали, величина разброса расширяется. Результаты оценки достоверности расчетов температуры ликвидус (табл. 3) показывают, что использование предложенных формул не отличается высокой степенью точности, так как даже наиболее точные из результатов расчетов имеют среднее квадратичное отклонение около ±2,5, соответствующее полосе разброса ±7,5 °С. По мнению авторов настоящей статьи, такое отклонение расчетных данных от экспериментальных может быть вызвано в основном тем, что эти формулы не учитывают характер взаимодействия отдельных химических элементов при определенной их концентрации. Из работ [11-13] известно, что, если при наличии какого-либо другого элемента или с увеличением собственной концентрации коэффициент активности данного элемента изменяется, то и его влияние на TL стали должно соответственно изменяться. Возрастание влияния коэффициента активности углерода с повышением его концентрации в стали проиллюстрировано на примере стали, содержащей 1,48 % С (табл. 4). При таком увеличении коэффициента активности углерода его действительное влияние на снижение температуры ликвидус, определенное экспериментально, оказывается значительно большим, чем это можно принять по результатам расчетов по известным формулам. Поэтому в большей части случаев расчетные значения TL заметно превышают экспериментальные. В противном случае, если сталь содержит элемент, снижающий активность углерода, и соответственно углерод уменьшает активность этого элемента в стали (Б, табл. 4, марганцовистая сталь), действительное снижение температуры ликвидус, определенное экспериментально, меньше, чем рассчитайное по формулам, не учитывающим взаимное влияние активностей, что выражается в положительном отклонении разностей между экспериментальными и расчетными значениями TL. Более сложный пример (В, табл. 4) для стали с высоким содержанием никеля иллюстрирует большие отклонения разностей между экспериментальными и расчетными значениями TL в положительную сторону практически по всем формулам, что, по-видимому, является следствием неадекватного описания линии ликвидус в бинарной системе Fe-Ni. Следует отметить, что рассмотрены (табл. 4) только двухкомпонентные и трехкомпонентные системы, причину отклонения расчетных экспериментальных значений TL в которых можно достаточно аргументированно объяснить. Наибольший разброс отклонений значений TL наблюдается для легированной стали многокомпонентного состава, где взаимодействие между элементами более сложное. Следовательно, для стали такого состава отклонения, вызванные неадекватным учетом эффектов таких взаимодействий на снижение температуры ликвидус, менее предсказуемы. Как видно из табл. 2, для группы углеродистой и низколегированной стали dTср имеет отрицательное значение и по абсолютному значению в каждом отдельном случае большеdTmin. В более 90 % случаев значения dTmin распределены по нормальному закону в интервале ± 2 °С около фактической температуры ликвидус, а около 70 % — в интервале ± 1 °С. Таблица 1. Коэффициенты a0, а1 и a2 характеризующие степень влияния содержащихся в стали химических элементов на снижение температуры ликвидус*
Таблица 2. Химический состав (1-20) и температуря ликвидус* стали
Таблица 3. Характеристика точности расчета температуры ликвидус* углеродистой и легированной стали
Для группы высоколегированной стали значения dTср также нормально распределены с отклонениями как в положительную, так и в отрицательную стороны от экспериментальных значений температуры ликвидус. Вместе с тем, для этой группы абсолютные значения dTср не всегда больше dTmin, что является следствием разброса результатов расчета. Большая часть значений dTmin (около 80 %) и в этом случае находится в интервале ± 2 °С от экспериментальных значений TL, но со значительно большей, чем для группы углеродистой и низколегированной стали, полосой разброса (от — 8 °С до +11 °С) вне интервала. В целом сталь обеих групп характеризуется тем, что формулы, при использовании которых для расчета получают значения TL, изменяются по отношению к экспериментальной температуре без какой-либо закономерности, а лишь в зависимости от состава стали. Этот факт, по-видимому, не может служить признаком того, что отдельные формулы в определенных областях лучше описывают совокупное влияние всех содержащихся в стали элементов, а прежде всего подтверждением случайности результата взаимной компенсации ошибок вследствие неучитываемости интерактивных эффектов элементов для каждого конкретного состава стали. Этот факт также характеризует ограничение применимости каждой из выбранных формул (на основе dTmin из табл. 2) в узкой области составов стали, для которых экспериментально определена температура ликвидус. Таким образом, расчет значений TL для стали различных марок невозможно провести с помощью только одной «универсальной» формулы. Вместе с тем, результаты расчетов подтверждают, что при дифференцированном подходе к выбору используемых формул расчетные значения TL могут вполне удовлетворительно приблизиться к экспериментальным. Расчеты температуры ликвидус, выполненные с помощью вышеприведенных формул для стали 87 марок, позволяют рекомендовать некоторые формулы для практического применения. Так, при расчете TL более предпочтительно использовать следующие формулы (номера из табл. 1) для стали:
В дальнейшем одним из наиболее вероятных путей улучшения известных способов определения TL может быть учет в расчетах взаимодействия между химическими элементами при их влиянии на снижение температуры ликвидус. Такие способы, основанные на законах термодинамики растворов, известны [13], однако их практическое применение в настоящее время затруднительно не только из-за более сложных математических выражений, для использования которых необходимо привлечение ЭВМ, но также и из-за недостаточной методической проработки этих методов применительно к стали основного массива промышленных марок. Не менее эффективным путем уточнения расчетных формул может быть их корректировка для условий конкретного сталеплавильного цеха при создании значительной базы практических данных, полученных при измерении температуры ликвидус стали, выплавляемой в этом цехе. Это позволит корректно оценить ошибку при измерении температуры и исключить влияние на разброс результатов расчетов, а также даст возможность внести соответствующие поправки в формулы или даже разработать новые. ЗаключениеДля оперативного определения температуры ликвидус рекомендуется использовать расчетные методы, учитывающие химический состав стали. Таблица 4. Отклонения расчетных значений температуры ликвидус от экспериментальных (Тзксп- Tрасч) для стали составов (табл. 2) 3 (А), 11 (Б) и 13 (В)
Анализ известных формул для расчета TL показывает, что при дифференцированном подходе к выбору используемых формул расчетные значения температуры ликвидус могут вполне удовлетворительно приблизиться к экспериментальным. Рекомендованы формулы для определения TL углеродистой, низколегированной и высоколегированной стали. Дальнейшее развитие методов определения TL возможно при учете в расчетах взаимодействия между химическими элементами и их влияния на снижение температуры ликвидус. На практике эффективным путем уточнения расчетных формул может быть их корректировка для условий конкретного цеха за счет создания значительной базы экспериментальных данных температуры ликвидус стали, выплавляемой в рамках производственной программы этого цеха. Библиографический список
Задать интересующий Вас вопрос, написать комментарий к данной статье Вы можете здесь. Напишите нам и мы обязательно ответим. |
Наши партнёрыСпец-предложениеПредлагаем услуги по оптимизации геометрии разливочной оснастки с целью обеспечения повышения коэффициента использования металла и снижения осевой пористости слитков подробнее |