Определение температуры плавления и теплоты кристаллизации олова
1. Цель работы:
определение температуры плавления и
теплоты кристаллизации олова, расчет
изменения энтропии при кристаллизации
олова из расплава.
2. Подготовка к
работе:
прочитать в учебнике [1] §§ 74, 75.
Для выполнения лабораторной работы
студент должен знать: а) понятие энтропии,
расчет изменения энтропии при фазовом
переходе; б) фазовые переходы 1-го рода;
в) понятие удельной теплоты плавления
и ее физический смысл.
3. Выполнение работы
3.1. Описание
лабораторной установки
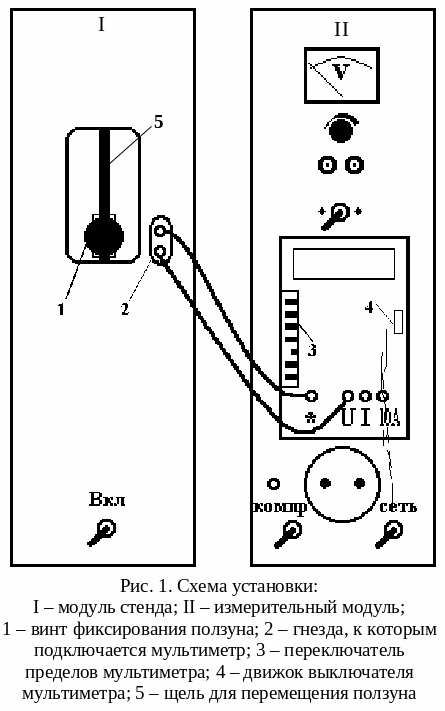
Конструктивно
установка состоит (рис. 1) из модуля I
стенда и измерительного модуля II,
размещенных в унифицированных корпусах.
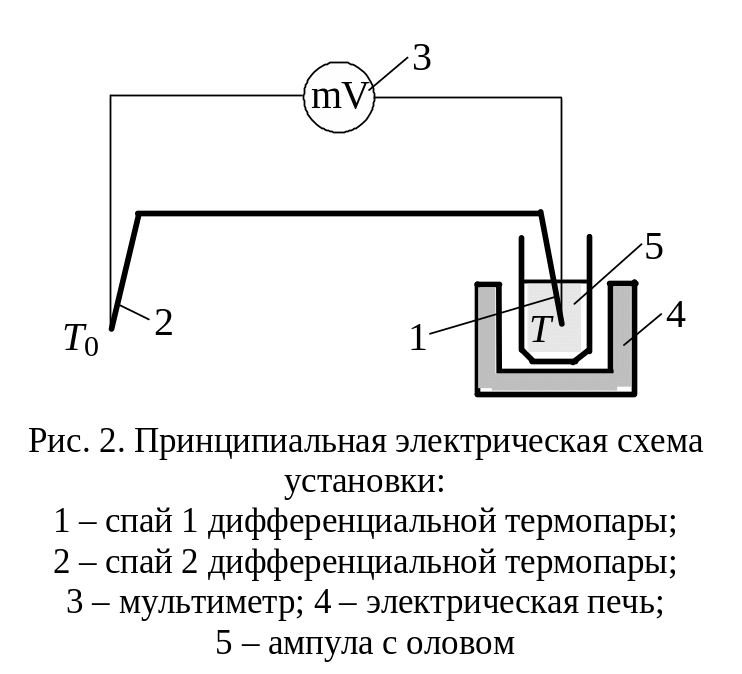
Принципиальная
электрическая схема установки показана
на рис. 2.
Спай 2 дифференциальной термопары (рис.
2) находится в окружающей среде с
постоянной температурой Т0,
а спай 1 – в ампуле с оловом при температуре
Т. Так как термопары включены
навстречу друг другу, то милливольтметр
показывает термо-ЭДС, пропорциональную
разности температур Т – Т0.
Ампула с оловом нагревается с помощью
электрической печи.
В
модуле I
находится ампула с оловом, которая
нагревается в электрической печи,
питающейся переменным током. Внутри
ампулы находится металлическая
трубка-чехол с дифференциальной
хромель-копелевой термопарой, горячий
спай которой находится в ампуле, а
холодный – на воздухе. Выводы термопары
соединены внутри модуля I
с гнездами 2 (рис. 1). Здесь также расположено
окно, в котором на вертикальной штанге
установлен ползун, жестко соединенный
с ампулой. Ползун фиксируется на штанге
с помощью винта 1. Если, отвернув винт
ползуна, опустить ползун вниз до упора,
то ампула с оловом опустится в печь.
Если же поднять ползун вверх до упора
и зафиксировать винтом, то ампула с
оловом будет находиться вне печи.
На
лицевой панели модуля измерительного
стенда II
расположен мультиметр, который подключен
к выходным гнездам модуля I
для измерения ЭДС.
3.2. Методика
измерений и расчета
Переход твердого вещества в жидкое
состояние (плавление) и обратный переход
(кристаллизация) относятся к фазовым
переходам первого рода, при которых
скачком изменяются плотность, внутренняя
энергия, энтропия тела. При этом
поглощается (при плавлении) или выделяется
(при кристаллизации) энергия, называемая
теплотой плавления (кристаллизации).
П
ри
атмосферном давлении прямое и обратное
фазовые превращения кристаллического
вещества происходят при строго
определенной температуре, поэтому
изобарный фазовый переход одновременно
является изотермическим. Одним из
возможных способов измерения температуры
и теплоты плавления и кристаллизации
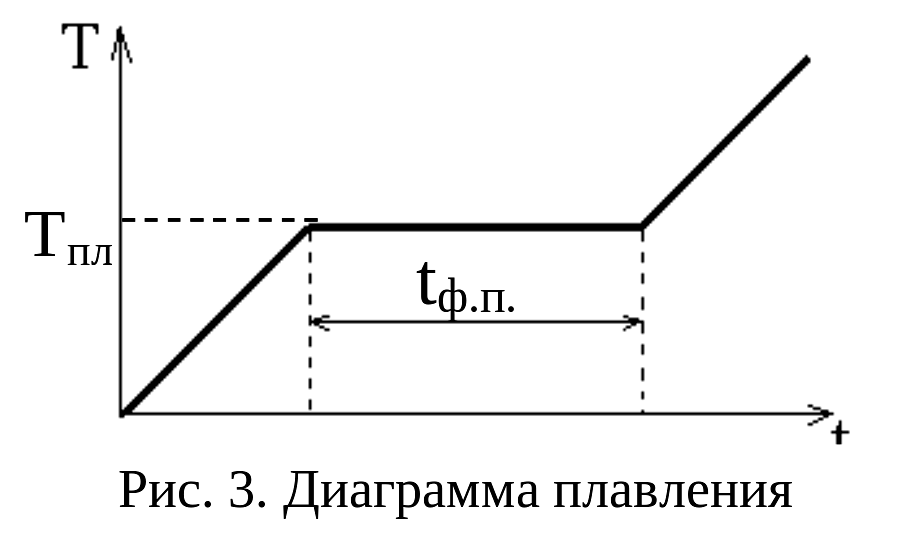
является получение диаграммы плавления
или отвердевания, т. е. кривой зависимости
температуры Т исследуемого вещества
от времени t при
неизменном внешнем давлении. Эта кривая
качественно показана на рис. 3. Правая
и левая возрастающие части на рис. 3
показывают нагревание твердого образца
и ампулы (слева) и нагревание расплава
и ампулы (справа). Тепловая мощность на
любом из этих участков равна изменению
внутренней энергии системы в единицу
времени:
,
(1)
где
– энергия, подводимая к образцу в единицу
времени,
;
m – масса олова; m1
– масса ампулы; с – удельная
теплоемкость олова; с1
– удельная теплоемкость ампулы;
– скорость изменения температуры
системы.
Горизонтальный участок на рис. 3
соответствует процессу плавления
металла. Ордината его – температура
плавления, а приращение абсциссы –
время фазового перехода tф.п..
Для этого случая закон сохранения
энергии может быть записан следующим
образом:
,
(2)
где – удельная
теплота плавления олова.
Учитывая, что мощность N в процессах
нагревания и плавления не изменяется,
из формул (1) и (2), найдем:
.
(3)
Изменение энтропии S,
определяется по формуле:
,
где Q = m, а Т
= Тпл.
С учетом этого изменение энтропии в
процессе плавления (кристаллизации):
,
(4)
где Тпл
– температура плавления олова.
Следовательно, для определения теплоты
кристаллизации и
изменения энтропии S
в рассматриваемом процессе необходимо
измерить Тпл
и tф.п.,
вычислить производную
функции T = f(t) в произвольной
точке, соответствующей температуре
твердого олова в процессе его нагревания
(охлаждения). Производная
находится из графика, построенного по
экспериментальным данным (кривая
охлаждения), а скорость охлаждения
образца приблизительно равна:
.
(5)
3.3. Подготовка
установки к работе
3.3.1. Опустите ампулу с оловом в печь, для
чего отверните на пол-оборота винт 1
(рис. 1) и опустите ползун вниз по штанге
до упора.
3.3.2.
Соедините проводами гнезда 2 (рис. 1)
модуля I
и гнезда «*» и «U» мультиметра измерительного
стенда, затем нажмите кнопку 200 mV
(третью снизу кнопку левого вертикального
ряда кнопок 3 мультиметра), все остальные
кнопки должны быть отжаты.
3.3.3.
Подсоедините к питающей сети 220 В вилки
обоих стендов и включите оба стенда с
помощью тумблеров «Вкл», «Сеть» на
лицевых панелях, а также мультиметр –
с помощью движка 4 (сдвинуть вниз),
находящегося с правой стороны его
панели. Процесс нагревания и плавления
олова занимает около 8 минут.
3.3.4. Проследите по показаниям мультиметра
в течение нескольких минут за процессом
плавления олова. Так как он происходит
при постоянной температуре, то при этом
показания милливольтметра практически
не изменяются. Окончание процесса
плавления можно определить как момент
времени, после которого показания
мультиметра начинают возрастать.
3.3.5. Через 1,5 минуты после окончания
процесса плавления отключите электрическую
печь и поднимите ампулу с оловом из
печи, для чего отверните на пол-оборота
винт 1 и поднимите ползун по штанге вверх
до упора, после этого винт закрутите.
3.4. Определение
удельной теплоты плавления
3.4.1. Включите секундомер и через каждые
15 секунд снимайте показания мультиметра
U, пропорциональные разности
температур олова и окружающей среды Т
– Т0:
U = k(Т
– Т0),
(6)
где k = 0,0000543 В/К для термопары
хромель-копель.
3.4.2.
Измерения продолжайте до тех пор, пока
не будут пройдены три области процесса
охлаждения: область полного расплава;
область кристаллизации; область
охлаждения твердого олова. Время опыта
– около 10 минут.
3.4.3.
Результаты измерений занесите в таблицу.
Таблица
Результаты экспериментальных измерений
и расчета
изменения энтропии
|
№ опыта |
U |
(Т – Т0) |
Т |
t |
Тпл |
|
S |
|
мВ |
К |
К |
с |
К |
Дж/кг |
Дж/К |
|
|
1 |
|||||||
|
2 |
|||||||
|
3 |
|||||||
|
… |
|||||||
|
40 |
3.4.4.
По данным таблицы постройте диаграмму
затвердевания олова T
= f (t),
экспериментальные точки должны быть
обязательно показаны на графике. Из
диаграммы определите температуру
плавления олова Тпл,
время фазового перехода tф.п.
и скорость изменения температуры системы
,
воспользовавшись на диаграмме участком
полного расплава диаграммы и приближенным
соотношением (5). Затем по формуле (3)
вычислите удельную теплоту плавления
олова
и изменение энтропии S
в процессе кристаллизации по формуле
(4).
Параметры установки:
m
= 78 г; m1
= 50 г; с
= 230 Дж/(кгК);
с1
= 1503 Дж/кгК.
4.
Сделайте
вывод, в
котором укажите
особенности метода измерений и расчета.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1.
Перечислите явления переноса. При каких
условиях они возникают?
2.
Запишите уравнения диффузии, внутреннего
трения и теплопроводности. Что переносится
в каждом из указанных явлений?
3. Каков физический смысл коэффициентов
диффузии, внутреннего трения и
теплопроводности?
4. Какова причина возникновения внутреннего
трения? В чем отличие механизма
возникновения силы внутреннего трения
в газах и жидкостях?
5. Выведите формулу Пуазейля для
определения объема жидкости, протекающей
по трубе за единицу времени.
6. От каких параметров зависит коэффициент
внутреннего трения? Каков характер
зависимости коэффициента внутреннего
трения жидкости от температуры?
7. Какое течение жидкости называют
ламинарным? Турбулентным?
8. Назовите критерий определения характера
течения жидкости.
9. Как зависит коэффициент теплопроводности
от температуры?
10. Какими термодинамическими параметрами
характеризуется состояние термодинамической
системы?
11. Назовите термодинамические процессы,
протекающие в газах, и запишите их
уравнения.
12. Сформулируйте первое начало
термодинамики и запишите его для
равновесных термодинамических процессов.
13. Что такое теплоемкость? Удельная и
молярная? Какая связь между ними?
14. Пользуясь первым законом термодинамики,
рассчитайте удельные теплоемкости при
постоянном давлении Cp
и постоянном объеме CV.
15. Какой процесс называют адиабатным и
как на практике реализовать такой
процесс?
16. Приведите уравнения адиабатного
процесса. Что характеризует показатель
адиабаты (коэффициент Пуассона
)?
17. В чем состоит экспериментальный метод
Клемана и Дезорма для определения
коэффициента Пуассона?
18. Чем отличается характер плавления
кристаллических и аморфных тел? Почему
при плавлении (или кристаллизации)
кристаллического вещества его температура
остается постоянной?
19. Какие превращения называются фазовыми
переходами I и II
рода? Приведите примеры.
20. Какие термодинамические процессы
называют обратимыми, необратимыми?
21. Сформулируйте II начало
термодинамики.
22. Что называют энтропией? Каков характер
изменения энтропии при обратимых и
необратимых процессах? В открытых и
адиабатно изолированных системах?
23. Расскажите принцип работы термопары?
Что такое дифференциальная термопара?
24. Приведите зависимость термоЭДС от
измеряемой температуры.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
1. Савельев, И. В. Курс физики : учеб.
пособие для студентов вузов, обучающихся
по техн. и технолог. направлениям и
специальностям : в 3 т. Т. 1. Механика.
Молекулярная физика. Колебания и волны.
– Изд. 3-е, стереотип. – СПб. : Лань, 2007. –
352 с.
2. Трофимова, Т. И.
Курс физики : учеб. пособие для инж. –
тех. специальностей вузов. – Изд. 10-е,
испр. – М. : Высш. шк., 2005. – 560 с.
3. Детлаф, А. А. Курс физики : учеб.
пособие для студентов втузов / А. А. Детлаф,
Б. М. Яворский. – 4-е изд., испр. – М. : Изд.
Центр «Академия», 2003. – 720 с.
Составители
Демидова Нина
Николаевна
Соколова Людмила
Григорьевна
Цвеклинская Ирина
Валентиновна
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Вася Иванов
Мореплаватель — имя существительное, употребляется в мужском роде. К нему может быть несколько синонимов.
1. Моряк. Старый моряк смотрел вдаль, думая о предстоящем опасном путешествии;
2. Аргонавт. На аргонавте были старые потертые штаны, а его рубашка пропиталась запахом моря и соли;
3. Мореход. Опытный мореход знал, что на этом месте погибло уже много кораблей, ведь под водой скрывались острые скалы;
4. Морской волк. Старый морской волк был рад, ведь ему предстояло отчалить в долгое плавание.
Олово представляет собой мягкий металл серебристо-белого цвета. Оно настолько ковкое и податливое, что его листы толщиной в тысячную долю миллиметра можно свернуть в трубочку. Такой материал называется оловянная бумага. В периодической таблице элементов Д. И. Менделеева этому элементу соответствует номер 50, атомный вес 118,69 и знак «Sn» (с лат. станнум). Известно 10 его стабильных изотопов. Получают металл в основном из минерала касситерита, представляющего собой диоксид олова.
В основном металл в сплаве со свинцом используется для пайки. Кроме того, его используют в качестве антикоррозионного покрытия для пищевых стальных тар, поскольку оно является нетоксичным. Композиты в составе с оловом используются в качестве фунгицидов, красок, зубной пасты (SnF2) и керамики.
История открытия и изучения олова
По археологическим находкам ученые смогли установить, что с оловом человечество познакомилось еще в 4 тысячелетии до н. э. Письменные напоминания об этом металле можно встретить в Четвертой Книге Моисея, Библии.
Сначала олово было малодоступным. Его можно было встретить только у правителей, полководцев, богатых граждан, купцов. Он был главным компонентом оловянистой бронзы, которая появилась в середине 3 тысячелетия до н. э. Тогда бронза считалась самым прочным сплавом. Компоненты для его изготовления имели исключительную ценность в период «бронзового века».
Отдельно от примесей, чистый металл было получено в 12 веке. Его упоминания есть в работах Р. Бэкона.
Касситеритстатья: Касситерит
Касситерит
(от греч. kassiteros — олово) — главный рудный минерал для получения олова. Теоретически содержит 78,62 % Sn. Образует отдельные выделения, зерна, сплошные массивные агрегаты, в которых зерна минерала достигают в размере 3 — 4 мм и даже больше.
- Плотность 6040-7120 кг/м³ (наиболее низкая у светлоокрашенных касситеритов).
- Твердость 6½.
- Блеск — матовый, на гранях — алмазный.
- Спайность несовершенная.
- Излом раковистый.
Основные формы выделения касситерита:
- микровключения в других минералах;
- акцессорные выделения минерала в породах и рудах;
- сплошные или вкрапленные руды: игольчатые радиально-лучистые агрегаты (Приморье), коломорфные и криптокристаллические выделения и скопления (Приморье); кристаллическая форма — главная форма выделения касситерита. В России месторождения касситерита имеются на Северо-Востоке, в Приморье, Якутии, Забайкалье; за рубежом — в Малайзии, Таиланде, Индонезии, КНР, Боливии, Нигерии и др.
Распространённость олова в природе
Распространённость олова в природе отражена в следующей таблице:
| Геол. объект | Камен. метеориты | Дуниты и др. | Базальты и др. | Диориты и др. | Гранитоиды | Глины и др. | Вода океанов | Живое вещество(% на живой вес) | Почва | Зола растений |
| Содержание, вес. % | 001⋅10−4 | 05⋅10−5 | 01,5⋅10−4 | 0000− | 0003⋅10−4 | 1⋅10−3 | 07⋅10−7 | 00005⋅10−5 | 1⋅10−3 | 005⋅10−4 |
В незагрязнённых поверхностных водах олово содержится в субмикрограммовых концентрациях. В подземных водах его концентрация достигает единиц микрограмм на литр, увеличиваясь в районе оловорудных месторождений, оно попадает в воды за счёт разрушения в первую очередь сульфидных минералов, неустойчивых в зоне окисления. ПДКSn = 2 мг/дм³.
Олово является амфотерным элементом, то есть элементом, способным проявлять кислотные и основные свойства. Это свойство олова определяет и особенности его распространения в природе. Благодаря этой двойственности олово проявляет литофильные, халькофильные и сидерофильные свойства. Олово по своим свойствам проявляет близость к кварцу, вследствие чего известна тесная связь олова в виде окиси (касситерита) с кислыми гранитоидами (литофильность), часто обогащёнными оловом, вплоть до образования самостоятельных кварц-касситеритовых жил. Щелочной характер поведения олова определяется в образовании довольно разнообразных сульфидных соединений (халькофильность), вплоть до образования самородного олова и различных интерметаллических соединений, известных в ультраосновных породах (сидерофильность).
Содержание
- 1 История
- 2 Происхождение названия
- 3 Нахождение в природе
- 3.1 Месторождения
- 3.2 Распространённость в природе
- 3.3 Формы нахождения
- 3.3.1 Твёрдая фаза. Минералы
- 3.3.2 Собственно минеральные формы
- 3.3.2.1 Самородные элементы, сплавы и интерметаллические соединения
- 3.3.2.2 Окисные соединения олова
- 3.3.2.3 Сульфидные соединения олова
- 3.3.3 Коллоидная форма
- 3.3.4 Формы нахождения олова в жидкой фазе
- 3.4 Промышленные типы месторождений олова
- 4 Производство
- 5 Физические свойства
- 6 Оловянная чума
- 7 Применение
- 8 Изотопы
- 9 Физиологическое действие
Получение олова из руды и месторождения
Процесс получения сплава зависит от того, в какой форме его нашли. Олово в виде руды не имеет значительных отличий от производства других цветных металлов. Процесс состоит из трех этапов:
- Добыча, обработка расходного сырья (руды).
- Восстановительная плавка для получения чернового металла.
- Рафинирование подготовленного сырья допустимыми способами.
Разработка россыпных месторождений осуществляется с помощью промышленных песковых насосов.
Изотопы
Основная статья: Изотопы олова
Природное олово состоит из десяти стабильных нуклидов с массовыми числами 112 (в смеси 0,96 % по массе), 114 (0,66 %), 115 (0,35 %), 116 (14,30 %), 117 (7,61 %), 118 (24,03 %), 119 (8,58 %), 120 (32,85 %), 122 (4,72 %) и 124 (5,94 %). Для некоторых из них энергетически возможен двойной бета-распад, однако экспериментально он пока (2014 г.) не наблюдался, поскольку предсказываемый период полураспада очень велик (более 1020 лет).
Олово обладает наибольшим среди всех элементов числом стабильных изотопов, что связано с тем, что 50 (число протонов в ядрах олова) является магическим числом — оно составляет заполненную протонную оболочку в ядре и повышает, тем самым, энергию связи и стабильность ядра. Известны два дважды магических изотопа олова, оба они радиоактивны, так как удалены от полосы бета-стабильности: нейтронодефицитное 100Sn (Z = N = 50) и нейтроноизбыточное 132Sn (Z = 50, N = 82).
Изотопы олова 117Sn и 119Sn являются мёссбауэровскими изотопами и применяются в гамма-резонансной спектроскопии.
Марки олова
Известны следующие марки олова:
- О1, О1пч. Это обозначение указывает на то, что в сплаве содержится 99,9% Sn. Изготавливается в виде проволоки, прутков, чушек.
- ОВЧ-000. Сплав высокой чистоты. Содержание Sn в составе — 99,99%. Изготавливается в виде прутков, чушек.
- О2. Содержание Sn в составе — 99,565%. Производится в виде прутков, проволоки, чушек.
- О3. Сплав содержит 98,49% Sn. Изготавливается чушками.
- О4. Самое «грязное» соединение. Содержит большое количество сторонних примесей. Их примерное количество — 3,5% от общей массы.
Маркировка указывается на готовых изделиях с помощью штампа.
Собственно минеральные формы
Самородные элементы, сплавы и интерметаллические соединения
Хотя концентрации этих минералов в породах очень низки, однако распространены они в широком круге генетических образований. Среди самородных форм вместе с Sn выявлены Fe, Al, Cu, Ti, Cd и т. д., не считая уже известные самородные платиноиды, золото и серебро. Эти же элементы образуют между собой и различные сплавы: (Cu + Sn + Sb), (Pb + Sn + Sb) и др., а также твёрдые растворы. Среди интерметаллических соединений установлены стистаит SnSb, атакит (Pd,Pt)3Sn, штумырлит Pt(Sn,Bi), звягинцевит (Pd,Pt)3(Pb,Sn), таймырит (Pd,Cu,Pt)3Sn и другие.
Приведённые формы нахождения олова и других элементов встречаются в различных геологических образованиях:
- Группа интрузивных и эффузивных магматических пород: траппы, пикриты Сибирской платформы, гипербазиты и габброиды Камчатки, кимберлиты Якутии, лампроитыАлдана и т. д.; гранитоиды Приморья, Дальнего Востока, Тянь-Шаня.
- Группа метасоматически и гидротермально изменённых пород: медно-никелевые руды Сибирской платформы, золоторудные объекты Урала, Кавказа, Узбекистана и т. д..
- Группа современного рудообразования: пелагические осадки Тихого океана, продукты Большого Трещинного Толбачинского извержения, гидротермальная система Узон на Камчатке и пр.
- Группа осадочных пород различного происхождения.
Свойства олова
Чтобы понять, где лучше применять олово, нужно знать характеристики, свойства химического элемента.
Химические свойства олова
Олово — химический элемент периодической таблицы Менделеева с атомным номером 50. Оно относится к группе легких металлов. Химические свойства:
- Электроотрицательность — 1,8.
- Температура плавления — 231°C.
- Температура кипения — 2630°C.
- Плотность — 7300 кг/м³.
- Атомная масса химического элемента — 118,71.
- Теплоемкость — 0,226 кДж/(кг·°С).
Олово инертно к воздействию воды, воздуха, если в помещении комнатная температура. На поверхности заготовки, которая находится на открытом воздухе, образуется оксидная пленка, защищающая металл от окисления, образования ржавчины.
Физические свойства олова
К физическим свойствам олова относят:
- Плотность — 7,31 г/см3.
- Металлический блеск — есть.
- Прозрачность —нет.
- Цвет — серо-белый.
- Спайность — нет.
- Прочность — ковкий металл.
- Твердость — до 2 по шкале Мооса.
- Высокая электропроводность.
Белое олово является парамагнетиком, а серое диамагнетиком.
Оптические свойства олова
Оптическими свойствами олова считаются:
- Умеренная анизотропия.
- Не плеохроирует.
- Тип металла — изотропный.
- Олово не флуоресцентный материал.
Кристаллографические свойства олова
Кристаллографическими свойствами олова является:
- Тетрагональная сингония.
- Пространственная группа металла — I 41/amd.
- Точечная группа — 4/mmm.
Происхождение названия
Латинское название stannum, связанное с санскритским словом, означающим «стойкий, прочный», первоначально относилось к сплаву свинца и серебра, а позднее к другому, имитирующему его сплаву, содержащему около 67 % олова; к IV веку этим словом стали называть собственно олово.
Слово олово — общеславянское, имеющее соответствия в балтийских языках (ср. лит. alavas, alvas — «олово», прусск. alwis — «свинец»). Оно является суффиксальным образованием от корня ol- (ср. древневерхненемецкое elo — «жёлтый», лат. albus — «белый» и пр.), так что металл назван по цвету.
Виды олова
Виды олова для пайки:
- ПОС-18. Содержит несколько основных компонентов — олово (18%), свинец (около 81), сурьму (2,5%). Применяется при лужении металлов. Подходит для создания швов при низких стандартах. Температура плавления — 270°C.
- ПОС-30. Содержит олово (28%), свинец (около 70%), сурьму (2%). Применяется для пайки меди, стали, латуни. Температура плавления — 270°C.
- ПОС-50. Содержит олово (50%), свинец (около 50%), сурьму (0,8%). Применяется для спаивания радиодеталей, получения высокого качества шва. Температура плавления — 230°С.
- ПОС-90. Содержит олово (90%), свинец (9–10%), сурьму (0,15%).
Отдельные виды оловянных припоев — ПОС-40, ПОС-60. Применяются для пайки радиодеталей.
Добыча
Мировые месторождения касситерита разрабатывают в Юго-Восточной Азии, в основном в Китае, Индонезии, Малайзии и Таиланде. Другие важные месторождения касситерита находятся в Южной Америке (Боливии, Перу, Бразилии) и Австралии. В России запасы оловянных руд расположены в Чукотском автономном округе (рудник/посёлок Валькумей, разработка месторождения закрыта в начале 90-х годов), в Приморском крае (Кавалеровский район), в Хабаровском крае (Солнечный район, Верхнебуреинский район (Правоурмийское месторождение)), в Якутии (месторождение Депутатское) и других районах.
Как отличить олово от припоя?
Прежде всего, чтобы отличить чистое олово от припоя, нужно знать, что оно без примесей хрустит. Если взять пруток олова и попытаться отломить от него кусок, то будет слышен хруст.
Также при определении олова рекомендуется смотреть вот на что:
- Вес. Припой с содержанием свинца будет всегда тяжелее олова. Поэтому если взять в руки или положить на весы олово и припой, то разница в весе будет более чем ощутимая;
- Внешний вид. На вид чистое олово имеет серебристый и слегка белый оттенок, в то время как свинец всегда темноватый. Происходит это из-за того, что свинец активно окисляется на воздухе, поэтому он сильно темнеет;
- Чистое олово хрустит при деформации. Отличие припоя со свинцом как раз в том, что его структура мягка. Припой можно легко резать, гнуть, ломать, и при этом такого хруста как у чистого олова не будет.
Чаще всего людям нужно знать, чистое перед ними олово или нет, при изготовлении каких-то определённых вещей. Никому не хотелось бы носить предметы с содержанием свинца, поскольку все знают, что свинец вреден, и со временем могут возникнуть серьезные проблемы со здоровьем.
Оловянная чума
Серое и белое олово
При температуре ниже 13,2 °C происходит увеличение удельного объёма чистого олова на 25,6 %, и оно спонтанно переходит в другое фазовое состояние — серое олово (α-Sn), в кристаллической решётке которого атомы располагаются менее плотно. Одна модификация переходит в другую тем быстрее, чем ниже температура окружающей среды. При −33 °C скорость превращений становится максимальной. Олово трескается и превращается в порошок. Причём соприкосновение серого олова и белого приводит к «заражению» последнего. Совокупность этих явлений называется «оловянной чумой». Нынешнее название этому процессу в 1911 году дал Г. Коэн. Начало научного изучения этого фазового перехода было положено в 1870 году работами петербургского учёного, академика Ю. Фрицше. Установлено, что это есть процесс аллотропического превращения белого олова в серое со структурой типа алмаза. Много ценных наблюдений и мыслей об этом процессе высказано Д. И. Менделеевым в его «Основах химии».
Белое олово — серебристо-белый, блестящий металл со специфической тетрагональной структурой и электронным s2p2-состоянием — β-фазой. Серое олово — ковалентный кристалл со структурой алмаза и электронным sp3-состоянием — α-фазой. Фазовые переходы олова из белого в серое и обратно сопровождаются перестройкой электронной структуры и сильным (25,6 %) объёмным эффектом. Белое олово можно переохладить до гелиевых температур (температура фазового α-β-равновесия около +13,2 °C).
Одним из средств предотвращения «оловянной чумы» является добавление в олово стабилизатора, например, висмута. С другой стороны, ускоряет процесс перехода белого олова в серое при не очень низких температурах катализатор хлорстаннат аммония (NH4)2SnCl6.
Любопытные факты:
- «Оловянная чума» — одна из причин гибели экспедиции Скотта к Южному полюсу в 1912 г. Она осталась без горючего из-за того, что топливо просочилось из запаянных оловом баков, поражённых «оловянной чумой».
- Некоторые историки указывают на «оловянную чуму» как на одно из обстоятельств поражения армии Наполеона в России в 1812 г. — сильные морозы привели к превращению оловянных пуговиц на мундирах солдат в порошок.
- «Оловянная чума» погубила многие ценнейшие коллекции оловянных солдатиков. Например, в запасниках петербургского музея Александра Суворова превратились в труху десятки фигурок — в подвале, где они хранились, лопнули зимой батареи отопления.
При какой температуре плавится олово?
Олово относится к легким металлам. Оно пластичное и ковкое, на вид серебристо-белого цвета. Олово является достаточно дорогим металлом. Температура плавления олова составляет 231 градус. При 2500 градусах олово начинает закипать.
На сегодняшнее время существует достаточно большое количество припоев с использованием олова. При выборе припоя рекомендуется обращать внимание на его обозначения. ПОС-40 имеет лишь 40% олова в своём составе, ПОС-61 уже больше, то есть, 61% олова.
Состав припоя легко определить и визуальным способом. Если припой сильно темный или матового цвета, то он содержит небольшое количество чистого олова, но не более 30-40%. Если припой блестит и светлый на вид, то процентное содержание олова в нем выше.
Следует заметить, что в некоторых странах запрещено при изготовлении электроники использовать свинцовые припои. Как правило, на корпусах таких электронных устройств есть специальный логотип, который указывает на то, что устройство сделано с применением бессвинцовой технологии.
Производство
В процессе производства рудоносная порода (касситерит) подвергается дроблению до размеров частиц в среднем ~ 10 мм, в промышленных мельницах, после чего касситерит за счет своей относительно высокой плотности и массы отделяется от пустой породы вибрационно-гравитационным методом на обогатительных столах. В дополнение применяется флотационный метод обогащения/очистки руды. Таким образом удается повысить содержание олова в руде до 40-70 %. Далее проводят обжиг концентрата в кислороде для удаления примесей серы и мышьяка. Полученный концентрат оловянной руды выплавляется в печах. В процессе выплавки восстанавливается до свободного состояния посредством применения в восстановлении древесного угля, слои которого укладываются поочередно со слоями руды, или алюминием (цинком) в электропечах: SnO2 + C = Sn + CO2. Особо чистое олово полупроводниковой чистоты готовят электрохимическим рафинированием или методом зонной плавки.
Сферы применения олова
Сферы применения олова:
- Защита металлических поверхностей. Применяется в виде специального покрытия. Оно не выделяет вредных веществ при эксплуатации, устойчиво к образованию ржавчины.
- Изготовление белой жести (второе название луженое железо). Используется для производства дымовых труб, тары для хранения пищевых продуктов, подшипников.
- Производство сантехники, запорной арматуры, фурнитуры.
- Изготовление сплавов.
- Производство припоев.
- Изготовление ограждений, лестничных перил.
- Производство скульптур, скамеек, вешалок, светильников для украшения интерьера.
Больше 50% добытого металла применяется для получения белой жести, предметов из стали с дополнительным защитным покрытием.
Соединения.
Олово образует различные химические соединения, многие из которых находят важное промышленное применение. Кроме многочисленных неорганических соединений, атом олова способен к образованию химической связи с углеродом, что позволяет получать металлоорганические соединения, известные как оловоорганические (см. также МЕТАЛЛООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ). Водные растворы хлоридов, сульфатов и фтороборатов олова служат электролитами для осаждения олова и его сплавов. Оксид олова применяют в составе глазури для керамики; он придает глазури непрозрачность и служит красящим пигментом. Оксид олова можно также осаждать из растворов в виде тонкой пленки на различных изделиях, что придает прочность стеклянным изделиям (или уменьшает вес сосудов, сохраняя их прочность). Введение станната цинка и других производных олова в пластические и синтетические материалы уменьшает их возгораемость и препятствует образованию токсичного дыма, и эта область применения становится важнейшей для соединений олова. Огромное количество оловоорганических соединений расходуется в качестве стабилизаторов поливинилхлорида – вещества, используемого для изготовления тары, трубопроводов, прозрачного кровельного материала, оконных рам, водостоков и др. Другие оловоорганические соединения используются как сельскохозяйственные химикаты, для изготовления красок и консервации древесины.
Преимущества и недостатки олова
К преимуществам отлова относятся:
- Пластичность. Из олова изготавливают сложные изделия для украшения интерьера.
- Инертность. Металл применяется в пищевой промышленности для изготовления посуды, тар для хранения продуктов.
- Низкая температура плавления. Олово используется для нанесения на металлические детали в виде защитного покрытия.
Недостатки:
- Низкий показатель прочности. Сплав не подходит для изготовления деталей, которые будут подвергаться большим нагрузкам.
- Редкость. Из-за этого увеличивается цена на материал.
Физиологическое действие
О роли олова в живых организмах практически ничего не известно. В теле человека содержится примерно (1—2)· 10−4 % олова, а его ежедневное поступление с пищей составляет 0,2—3,5 мг. Металлическое олово не токсично, что позволяет применять его в пищевой промышленности. Олово представляет опасность для человека в виде паров и различных аэрозольных частиц, пыли. При воздействии паров или пыли олова может развиться станноз — поражение легких. Станнан (оловянистый водород) — сильнейший яд. Также очень токсичны некоторые оловоорганические соединения. Временно допустимая концентрация соединений олова в атмосферном воздухе 0,05 мг/м3, ПДК олова в пищевых продуктах 200 мг/кг, в молочных продуктах и соках — 100 мг/кг. Токсическая доза олова для человека — 2 г.
Вредные примеси, содержащиеся в олове в обычных условиях хранения и применения, в том числе в расплаве при температуре до 600 °C, не выделяются в воздух рабочей зоны в объёмах, превышающих предельно допустимую концентрацию в соответствии с ГОСТ. Длительное (в течение 15—20 лет) воздействие пыли олова оказывает фиброгенное воздействие на лёгкие и может вызвать заболевание работающих пневмокониозом.
Сплавы олова
Сплавы на основе олова также известны, как белые металлы, обычно содержат в своем составе медь, сурьму и свинец. Сплавы обладают различными механическими свойствами в зависимости от их состава.
Сплавы олова со свинцом нашли свое коммерческое использование для широкого набора составов. Так, 61,9% олова и 38,1% свинца соответствуют эвтектическому составу, градус затвердевания которого составляет 183 °C. Сплавы с другим соотношением этих металлов плавятся и кристаллизуются в широком интервале температур, когда существует равновесие между твердой и жидкой фазами. При такой кристаллизации в расплаве начинают выделяться твердые сегрегации, которые приводят к образованию различных структур. Сплав эвтектического состава, так как имеет наименьшую температуру плавления, используется в качестве предохранителя от перегрева компонентов электроники.
Также существуют сплавы, в которых помимо указанных металлов присутствует небольшое количество сурьмы (до 2,5%). Основной проблемой сплавов на основе олова и свинца является их отрицательное влияние на экологию, поэтому в последнее время разрабатываются их заменители, в которых не используется свинец, например, сплавы с серебром и медью.
Сплавы олова со свинцом и сурьмой используют для декоративных украшений, а некоторые сплавы олова, меди и сурьмы используют в качестве смазки для уменьшения трения в подшипниках, благодаря их антифрикционным свойствам. Помимо вышесказанных сплавов, олово используют в бронзовых сплавах и в сплавах с титаном и цирконием.
Источники:
- https://metalloy.ru/metally/olovo
- https://obrabotkametalla.info/splavy/temperatura-plavleniya-olova
- https://zen.yandex.ru/media/svarkapajka/kak-bez-truda-otlichit-chistoe-olovo-ot-pripoia-svinca-60758132063a3d24f993d93c
- https://chem.ru/olovo.html
Формы нахождения
Основная форма нахождения олова в горных породах и минералах — рассеянная (или эндокриптная). Однако олово образует и минеральные формы, и в этом виде часто встречается не только как акцессорий в кислых магматических породах, но и образует промышленные концентрации преимущественно в окисной (касситерит SnO2) и сульфидной (станнин) формах.
Твёрдая фаза. Минералы
В общем можно выделить следующие формы нахождения олова в природе:
- Рассеянная форма
; конкретная форма нахождения олова в этом виде неизвестна. Здесь можно говорить об изоморфно рассеянной форме нахождения олова вследствие наличия изоморфизма с рядом элементов (Ta, Nb, W — с образованием типично кислородных соединений; V, Cr, Ti, Mn, Sc — с образованием кислородных и сульфидных соединений). Если концентрации олова не превышают некоторых критических значений, то оно изоморфно может замещать названные элементы. Механизмы изоморфизма различны. - Минеральная форма
: олово установлено в минералах-концентраторах. Как правило, это минералы, в которых присутствует железо Fe+2: биотиты, гранаты, пироксены, магнетиты, турмалины и т. д. Эта связь обусловлена изоморфизмом, например по схеме Sn+4 + Fe+2 → 2Fe+3. В оловоносных скарнах высокие концентрации олова установлены в гранатах (до 5,8 вес.%) (особенно в андрадитах), эпидотах (до 2,84 вес.%) и т. д.
На сульфидных месторождениях олово входит как изоморфный элемент в сфалериты (Силинское месторождение, Россия, Приморье), халькопириты (Дубровское месторождение, Россия, Приморье), пириты. Высокие концентрации олова выявлены в пирротине грейзенов Смирновского месторождения (Россия, Приморье). Считается, что из-за ограниченного изоморфизма происходит распад твёрдых растворов с микровыделениями Cu2+1Fe+2SnS4 или тиллита PbSnS2 и других минералов.
В данном случае нужно применить формулу Q=c*m*(t-33), где Q — количество выделившегося тепла (Q=5 кДж), c- удельная теплоёмкость олова (если величина не дана в самом условии задачи, то нужно найти в справочных таблицах, с=0,218 кДж/(кг*К)), m — масса кг, t — исходная температура олова.
Сначала выразим в явном виде температуру: t=Q/(c*m)+33.
Подставляя величины получаем: t=5/(0,218*0,1)+33=262,4°. Но температура плавления олова 231,9°С.
Если бы даже начальная температура кусочка олова была 231,9°С, то при охлаждении до 33°С могло бы выделиться 0,218*0,1*(231,9-33)=4,336 кДж тепла. Поскольку тепла выделилось больше, то это может быть только в том случае, если часть олова была в жидком виде, и дополнительное количество тепла (5-4,336=0,664 кДж) выделилось при кристаллизации. Удельная теплота плавления (и кристаллизации) олова 60,7 кДж/кг, значит кристаллизации подверглось 0,664/60,7=0,011 кг олова. Т.е. «кусок олова» состоял из 89 г твёрдого олова и 11 г жидкого олова.
Короче говоря, в задаче даны несогласованные между собой данные. Нельзя говорить о куске олова, часть которого ещё жидкая. Если же он был полностью твёрдым, то либо его масса была больше 100 г, либо он остыл до более низкой температуры (до 2,54°С), либо это было не олово, либо автор задачи не умеет считать.