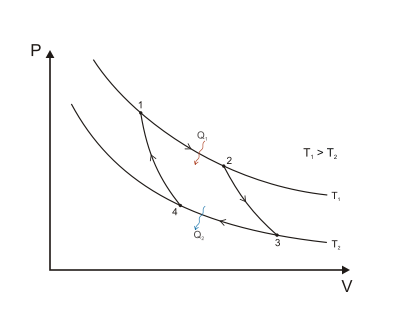
Среди многих циклических процессов особо выделяется один — цикл Карно. Цикл Карно — четырёхтактный цикл, состоящий из двух изотерм и двух адиабат и имеющий максимально возможное КПД при заданных температурах нагревателя и холодильника (рис. 1).
Рис. 1. Цикл Карно
Внешний вид изотермического и адиабатического процессов по сути одинаковы. Однако адиабаты идут несколько «круче». Рассмотрим данный циклический процесс по частям. Процесс 1-2 — адиабатическое сжатие, 2-3 — изотермическое расширение, 3-4 — адиабатическое расширение, 4-1 — изотермическое сжатие.
Цикл Карно в школьных задачах вводится фразами «идеальный цикл», цикл Карно», «цикл с максимальным КПД» или «идеальная машина». В любом случае, эти слова намекают на рассмотрение процесса через классическую тепловую машину (рис. 2).
Рис. 2. Тепловая машина
В случае, если рассматривать цикл Карно в качестве обычного цикла, тогда его КПД можно рассчитать как:
(1)
- где
Если ввести температуры нагревателя () и холодильника (
) и считать, что в рамках процесса они не меняются, можно ввести КПД цикла Карно, характеризующее саму машину:
(2)
- где
Вывод: задачи на цикл Карно чаще всего связаны с поиском КПД. Для цикла можно использовать как соотношение (1) (в случае, если даны энергетические параметры), так и соотношение (2) (в случае, если даны температуры).
From Wikipedia, the free encyclopedia
A Carnot cycle is an ideal thermodynamic cycle proposed by French physicist Sadi Carnot in 1824 and expanded upon by others in the 1830s and 1840s. By Carnot’s theorem, it provides an upper limit on the efficiency of any classical thermodynamic engine during the conversion of heat into work, or conversely, the efficiency of a refrigeration system in creating a temperature difference through the application of work to the system.
In a Carnot cycle, a system or engine transfers energy in the form of heat between two thermal reservoirs at temperatures 





| External video |
|---|
Stages[edit]
A Carnot cycle as an idealized thermodynamic cycle performed by a heat engine (Carnot heat engine) consists of the following steps.
-
Isothermal expansion. Heat (as an energy) is transferred reversibly from hot temperature reservoir at constant temperature TH to the gas at temperature infinitesimally less than TH (to allow heat transfer to the gas without practically changing the gas temperature so isothermal heat addition or absorption). During this step (1 to 2 on Figure 1, A to B in Figure 2), the gas is thermally in contact with the hot temperature reservoir (while thermally isolated from the cold temperature reservoir) and the gas is allowed to expand, doing work on the surroundings by gas pushing up the piston (stage 1 figure, right). Although the pressure drops from points 1 to 2 (figure 1) the temperature of the gas does not change during the process because the heat transferred from the hot temperature reservoir to the gas is exactly used to do work on the surroundings by the gas, so no gas internal energy changes (no gas temperature change for an ideal gas). Heat QH > 0 is absorbed from the hot temperature reservoir, resulting in an increase in the entropy
of the gas by the amount
.
-
Isentropic (reversible adiabatic) expansion of the gas (isentropic work output). For this step (2 to 3 on Figure 1, B to C in Figure 2) the gas in the engine is thermally insulated from both the hot and cold reservoirs, thus they neither gain nor lose heat, an ‘adiabatic’ process. The gas continues to expand with reduction of its pressure, doing work on the surroundings (raising the piston; stage 2 figure, right), and losing an amount of internal energy equal to the work done. The gas expansion without heat input causes the gas to cool to the «cold» temperature (by losing its internal energy), that is infinitesimally higher than the cold reservoir temperature TC. The entropy remains unchanged as no heat Q transfers (Q = 0) between the system (the gas) and its surroundings, so an isentropic process, meaning no entropy change in the process).
-
Isothermal compression. Heat transferred reversibly to low temperature reservoir at constant temperature TC (isothermal heat rejection). In this step (3 to 4 on Figure 1, C to D on Figure 2), the gas in the engine is in thermal contact with the cold reservoir at temperature TC (while thermally isolated from the hot temperature reservoir) and the gas temperature is infinitesimally higher than this temperature (to allow heat transfer from the gas to the cold reservoir without practically changing the gas temperature). The surroundings do work on the gas, pushing the piston down (stage 3 figure, right). An amount of energy earned by the gas from this work exactly transfers as a heat energy QC < 0 (negative as leaving from the system, according to the universal convention in thermodynamics) to the cold reservoir so the entropy of the system decreases by the amount
.[1]
because the isothermal compression decreases the multiplicity of the gas.
-
Isentropic compression. (4 to 1 on Figure 1, D to A on Figure 2) Once again the gas in the engine is thermally insulated from the hot and cold reservoirs, and the engine is assumed to be frictionless and the process is slow enough, hence reversible. During this step, the surroundings do work on the gas, pushing the piston down further (stage 4 figure, right), increasing its internal energy, compressing it, and causing its temperature to rise back to the temperature infinitesimally less than TH due solely to the work added to the system, but the entropy remains unchanged. At this point the gas is in the same state as at the start of step 1.
Figure 1: A Carnot cycle illustrated on a PV diagram to illustrate the work done. 1-to-2 (isothermal expansion), 2-to-3 (isentropic expansion), 3-to-4 (isothermal compression), 4-to-1 (isentropic compression).
In this case, since it is a reversible thermodynamic cycle (no net change in the system and its surroundings per cycle)[2][1]
or,
This is true as 


The pressure–volume graph[edit]
When a Carnot cycle is plotted on a pressure–volume diagram (Figure 1), the isothermal stages follow the isotherm lines for the working fluid, the adiabatic stages move between isotherms, and the area bounded by the complete cycle path represents the total work that can be done during one cycle. From point 1 to 2 and point 3 to 4 the temperature is constant (isothermal process). Heat transfer from point 4 to 1 and point 2 to 3 are equal to zero (adiabatic process).
Properties and significance[edit]
The temperature–entropy diagram[edit]
Figure 2: A Carnot cycle as an idealized thermodynamic cycle performed by a heat engine (Carnot heat engine), illustrated on a TS (temperature T–entropy S) diagram. The cycle takes place between a hot reservoir at temperature TH and a cold reservoir at temperature TC. The vertical axis is the system temperature, the horizontal axis is the system entropy. A-to-B (isothermal expansion), B-to-C (isentropic expansion), C-to-D (isothermal compression), D-to-A (isentropic compression).
Figure 3: A generalized thermodynamic cycle taking place between a hot reservoir at temperature TH and a cold reservoir at temperature TC. By the second law of thermodynamics, the cycle cannot extend outside the temperature band from TC to TH. The area in red, |QC|, is the amount of energy exchanged between the system and the cold reservoir. The area in white, W, is the amount of work energy exchanged by the system with its surroundings. The amount of heat exchanged with the hot reservoir is the sum of the two. If the system is behaving as an engine, the process moves clockwise around the loop, and moves counter-clockwise if it is behaving as a refrigerator. The efficiency to the cycle is the ratio of the white area (work) divided by the sum of the white and red areas (heat absorbed from the hot reservoir).
Q C (energy lost to the cold reservoir) can be seen as a direct subtraction, or expressed as the sum of a negative quantity, which can lead to different conventions.
The behavior of a Carnot engine or refrigerator is best understood by using a temperature–entropy diagram (T–S diagram), in which the thermodynamic state is specified by a point on a graph with entropy (S) as the horizontal axis and temperature (T) as the vertical axis (Figure 2). For a simple closed system (control mass analysis), any point on the graph represents a particular state of the system. A thermodynamic process is represented by a curve connecting an initial state (A) and a final state (B). The area under the curve is:
-
(1)
which is the amount heat transferred in the process. If the process moves the system to greater entropy, the area under the curve is the amount of heat absorbed by the system in that process; otherwise, it is the amount of heat removed from or leaving from the system. For any cyclic process, there is an upper portion of the cycle and a lower portion. In T—S diagrams for a clockwise cycle, the area under the upper portion will be the energy absorbed by the system during the cycle, while the area under the lower portion will be the energy removed from the system during the cycle. The area inside the cycle is then the difference between the two (the absorbed net heat energy), but since the internal energy of the system must have returned to its initial value, this difference must be the amount of work done by the system per cycle. Referring to Figure 1, mathematically, for a reversible process, we may write the amount of work done over a cyclic process as:
-
(2)
Since dU is an exact differential, its integral over any closed loop is zero and it follows that the area inside the loop on a T–S diagram is equal to the total work performed by the system on the surroundings if the loop is traversed in a clockwise direction, and is equal to the total work done on the system by the surroundings as the loop is traversed in a counterclockwise direction.
Figure 4: A Carnot cycle taking place between a hot reservoir at temperature TH and a cold reservoir at temperature TC.
The Carnot cycle[edit]
Figure 5: A visualization of a Carnot cycle
Evaluation of the above integral is particularly simple for a Carnot cycle. The amount of energy transferred as work is
The total amount of heat transferred from the hot reservoir to the system (in the isothermal expansion) will be
and the total amount of heat transferred from the system to the cold reservoir (in the isothermal compression) will be
Due to energy conservation, the net heat transferred, 
The efficiency 
-
(3)
where
The expression with the temperature 




This is the Carnot heat engine working efficiency definition as the fraction of the work done by the system to the thermal energy received by the system from the hot reservoir per cycle. This thermal energy is the cycle initiator.
Reversed Carnot cycle[edit]
A Carnot heat-engine cycle described is a totally reversible cycle. That is, all the processes that compose it can be reversed, in which case it becomes the Carnot heat pump and refrigeration cycle. This time, the cycle remains exactly the same except that the directions of any heat and work interactions are reversed. Heat is absorbed from the low-temperature reservoir, heat is rejected to a high-temperature reservoir, and a work input is required to accomplish all this. The P–V diagram of the reversed Carnot cycle is the same as for the Carnot heat-engine cycle except that the directions of the processes are reversed.[3]
Carnot’s theorem[edit]
It can be seen from the above diagram that for any cycle operating between temperatures 

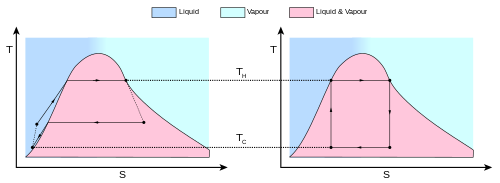
Figure 6: A real engine (left) compared to the Carnot cycle (right). The entropy of a real material changes with temperature. This change is indicated by the curve on a T–S diagram. For this figure, the curve indicates a vapor-liquid equilibrium (See Rankine cycle). Irreversible systems and losses of energy (for example, work due to friction and heat losses) prevent the ideal from taking place at every step.
Carnot’s theorem is a formal statement of this fact: No engine operating between two heat reservoirs can be more efficient than a Carnot engine operating between those same reservoirs. Thus, Equation 3 gives the maximum efficiency possible for any engine using the corresponding temperatures. A corollary to Carnot’s theorem states that: All reversible engines operating between the same heat reservoirs are equally efficient. Rearranging the right side of the equation gives what may be a more easily understood form of the equation, namely that the theoretical maximum efficiency of a heat engine equals the difference in temperature between the hot and cold reservoir divided by the absolute temperature of the hot reservoir. Looking at this formula an interesting fact becomes apparent: Lowering the temperature of the cold reservoir will have more effect on the ceiling efficiency of a heat engine than raising the temperature of the hot reservoir by the same amount. In the real world, this may be difficult to achieve since the cold reservoir is often an existing ambient temperature.
In other words, the maximum efficiency is achieved if and only if entropy does not change per cycle. An entropy change per cycle is made, for example, if there is friction leading to dissipation of work into heat. In that case, the cycle is not reversible and the Clausius theorem becomes an inequality rather than an equality. Otherwise, since entropy is a state function, the required dumping of heat into the environment to dispose of excess entropy leads to a (minimal) reduction in efficiency. So Equation 3 gives the efficiency of any reversible heat engine.
In mesoscopic heat engines, work per cycle of operation in general fluctuates due to thermal noise. If the cycle is performed quasi-statically, the fluctuations vanish even on the mesoscale.[4] However, if the cycle is performed faster than the relaxation time of the working medium, the fluctuations of work are inevitable. Nevertheless, when work and heat fluctuations are counted, an exact equality relates the exponential average of work performed by any heat engine to the heat transfer from the hotter heat bath.[5]
Efficiency of real heat engines[edit]
Carnot realized that, in reality, it is not possible to build a thermodynamically reversible engine. So, real heat engines are even less efficient than indicated by Equation 3. In addition, real engines that operate along the Carnot cycle style (isothermal expansion / isentropic expansion / isothermal compression / isentropic compression) are rare. Nevertheless, Equation 3 is extremely useful for determining the maximum efficiency that could ever be expected for a given set of thermal reservoirs.
Although Carnot’s cycle is an idealization, Equation 3 as the expression of the Carnot efficiency is still useful. Consider the average temperatures,
at which the first integral is over a part of a cycle where heat goes into the system and the second integral is over a cycle part where heat goes out from the system. Then, replace TH and TC in Equation 3 by ⟨TH⟩ and ⟨TC⟩, respectively, to estimate the efficiency a heat engine.
For the Carnot cycle, or its equivalent, the average value ⟨TH⟩ will equal the highest temperature available, namely TH, and ⟨TC⟩ the lowest, namely TC. For other less efficient thermodynamic cycles, ⟨TH⟩ will be lower than TH, and ⟨TC⟩ will be higher than TC. This can help illustrate, for example, why a reheater or a regenerator can improve the thermal efficiency of steam power plants and why the thermal efficiency of combined-cycle power plants (which incorporate gas turbines operating at even higher temperatures) exceeds that of conventional steam plants. The first prototype of the diesel engine was based on the Carnot cycle.
Carnot heat engine as an impractical macroscopic construct[edit]
A Carnot heat engine is a heat engine performing a Carnot cycle, and its realization on a macroscopic scale is impractical. For example, for the isothermal expansion part of the Carnot cycle, the following conditions must be satisfied simultaneously at every step in the expansion:[6]
- The hot reservoir temperature TH is infinitesimally higher than the system gas temperature T so heat flow (energy transfer) from the hot reservoir to the gas is made without increasing T (via infinitesimal work on the surroundings by the gas as another energy transfer); if TH is significantly higher than T, then T may be not uniform through the gas so the system would deviate from thermal equilibrium as well as not being a reversible process (i.e. not a Carnot cycle) or T might increase noticeably so it would not be an isothermal process.
- The force externally applied on the piston (opposite to the internal force on the piston by the gas) needs to be infinitesimally reduced somehow. Without this external assistance, it would not be possible to follow a gas PV (Pressure-Volume) curve downward at a constant T since following this curve means that the gas-to-piston force decreases (P decreases) as the volume expands (the piston moves outward). If this assistance is so strong that the volume expansion is significant, the system may deviate from thermal equilibrium as well as not being a reversible process (i.e. not a Carnot cycle).
These (and other) «infinitesimal» requirements make the Carnot cycle take an infinite amount of time. Other practical requirements that make the Carnot cycle hard to realize (e.g., fine control of the gas, thermal contact with the surroundings including high and low temperature reservoirs), so the Carnot engine should be thought as the theoretical limit of macroscopic scale heat engines rather than a practical device that could ever be built.
See also[edit]
- Carnot heat engine
- Reversible process (thermodynamics)
References[edit]
- Notes
- ^ a b c Planck, M. (1945). «equations 39, 40 and 65 in sections §90 & §137». Treatise on Thermodynamics. Dover Publications. pp. 75, 135.
- ^ Fermi, E. (1956). «equation 64». Thermodynamics (PDF). Dover Publications. p. 48.
- ^ Çengel, Yunus A., and Michael A. Boles. Thermodynamics: An Engineering Approach. 7th ed. New York: McGraw-Hill, 2011. p. 299. Print.
- ^ Holubec Viktor and Ryabov Artem (2018). «Cycling Tames Power Fluctuations near Optimum Efficiency». Phys. Rev. Lett. 121 (12): 120601. arXiv:1805.00848. Bibcode:2018PhRvL.121l0601H. doi:10.1103/PhysRevLett.121.120601. PMID 30296120. S2CID 52943273.
- ^ N. A. Sinitsyn (2011). «Fluctuation Relation for Heat Engines». J. Phys. A: Math. Theor. 44 (40): 405001. arXiv:1111.7014. Bibcode:2011JPhA…44N5001S. doi:10.1088/1751-8113/44/40/405001. S2CID 119261929.
- ^ D, Bob (15 January 2020). «In the isothermal expansion phase of a Carnot cycle, why does the gas expand?». StackExchange. Retrieved 2 January 2022.
{{cite web}}: CS1 maint: url-status (link)
- Sources
-
- Carnot, Sadi, Reflections on the Motive Power of Fire
- Ewing, J. A. (1910) The Steam-Engine and Other Engines edition 3, page 62, via Internet Archive
- Feynman, Richard P.; Leighton, Robert B.; Sands, Matthew (1963). The Feynman Lectures on Physics. Addison-Wesley Publishing Company. pp. Chapter 44. ISBN 978-0-201-02116-5.
- Halliday, David; Resnick, Robert (1978). Physics (3rd ed.). John Wiley & Sons. pp. 541–548. ISBN 978-0-471-02456-9.
- Kittel, Charles; Kroemer, Herbert (1980). Thermal Physics (2nd ed.). W. H. Freeman Company. ISBN 978-0-7167-1088-2.
- Kostic, M (2011). «Revisiting The Second Law of Energy Degradation and Entropy Generation: From Sadi Carnot’s Ingenious Reasoning to Holistic Generalization». AIP Conf. Proc. AIP Conference Proceedings. 1411 (1): 327–350. Bibcode:2011AIPC.1411..327K. CiteSeerX 10.1.1.405.1945. doi:10.1063/1.3665247. American Institute of Physics, 2011. ISBN 978-0-7354-0985-9. Abstract at: [1]. Full article (24 pages [2]), also at [3].
External links[edit]
- Hyperphysics article on the Carnot cycle.
- S. M. Blinder Carnot Cycle on Ideal Gas powered by Wolfram Mathematica
Просмотров 1.6к. Опубликовано 30.12.2022
Большинство современных двигателей преобразуют внутреннюю энергию углеводородного топлива в механическую энергию. То есть являются тепловыми машинами. Первым ученым, который задался вопросом о создании самой эффективной тепловой машины стал французский физик Сади Карно. В 1824 в его работе – «Размышления о движущей силе огня и о машинах, способных развивать эту силу», предложен идеальный термодинамический цикл тепловой машины. Цикл, позволяющий получить максимальный теоретический КПД, затем назвали именем Карно.

Главной характеристикой, на которую обращают внимание при проектировании любого двигателя является коэффициент полезного действия или КПД. Коэффициент КПД показывает, насколько эффективно протекает трансформация тепловой энергии в системе в полезную механическую работу. КПД любого цикла вычисляется путем отношения полезной работы к затраченной энергии (которую передают системе).
- Полезная работа – та, которую получаем на выходе системы в результате выполнения цикла.
- Затраченная энергия – та, что была подведена к системе за цикл.
Термодинамические процессы и циклы.
Цикл Карно состоит из двух изотермических и двух адиабатных процессов. Чтобы понять, что из себя представляют эти процессы, обратимся к первому закону термодинамики:
∆U = A + Q,
где ∆U – внутренняя энергия рабочего тела или системы,
A – совершаемая в цикле работа,
Q – количество теплоты, переданное за цикл, системе.
Формулировка первого закона термодинамики: при переходе системы из одного состояния в другое, изменение внутренней энергии системы равно сумме количества теплоты, переданного системе, и работы внешних сил.
Что такое изотермический и адиабатный процессы?
Изотермический процесс
Изотермический процесс – процесс, перехода рабочего тела из одного состояния в другое без изменения температуры ∆T=0.
Например, изменение объёма и давления газа при неизменной температуре.
При постоянной температуре изменение внутренней энергии газа ∆U будет равно нулю, так как ∆T = 0.
Тогда, согласно первому закону термодинамики: Q = A. Это значит:
- получая теплоту, газ будет расширяться, совершая положительную работу. При этом всё количество тепла будет потрачено на совершение работы.
- и наоборот, при отдаче теплоты объем газа будет уменьшаться.
Адиабатный процесс
Адиабатный процесс – такой процесс, который протекает без передачи или получения тепла Q от окружающей среды. То есть, процесс протекает в теплоизолированной системе или с бесконечно большой скоростью, при которой теплообменом можно пренебречь Q = 0.
Согласно первому закону термодинамики: A = -∆U.
Это значит:
- работу газ совершает за счет уменьшения внутренней энергии;
- и наоборот, приложенная к системе работа, затрачивается только на повышение внутренней энергии.

Из каких процессов состоит цикл Карно
Главная особенность всех круговых процессов или циклов состоит в том, что их работа невозможна, если приводить рабочее тело в контакт только с одним источником теплоты. Любой тепловой двигатель устроен таким образом, что за счет теплообмена между двумя источниками теплоты он способен преобразовать тепло в механическую работу. Температуры этих источников должны отличаться, но, при этом, быть постоянными.
Чтобы понять, как работает цикл Карно, нужно представить простой тепловой двигатель, например цилиндр с поршнем, внутри которого находится газ. К газу может подводиться и отводится тепло. Источники тепла, при этом, называются:
- нагреватель – источник, имеющий высокую постоянную температуру TН
- холодильник – с постоянной низкой температурой TХ.
Цикл Карно имеет четыре обратимых процесса – два изотермических, и два – адиабатных.

Изотермические процессы протекают при постоянной температуре T. Адиабатные процессы – при постоянной энтропии S, без теплообмена с окружающей средой.
Для удобства, цикл Карно представляют в:
- T-S координатах – зависимость энтропии S от температуры T.
- p-V координатах – зависимость давления p от удельного объёма V.

Изотермическое расширение
Изотермическое расширение или изотермический подвод тепла – показано процессом AB. В начале рабочее тело находится в точке A. На данном этапе рабочее тело или газ имеет начальную температуру TН. Затем, к телу подводится энергия в виде теплоты Q1. Снижение температуры при расширении отсутствует, так как подводится теплота Q1, от нагревателя. Увеличения температуры тоже не будет, так как совершается работа A1=Q1. Поэтому, при расширении рабочего тела его температура остается постоянной – изотермическое расширение TН=const. При этом, энтропия рабочего тела увеличивается, из-за увеличения его объема. Происходит это за счет совершения механической работы.

Адиабатическое расширение
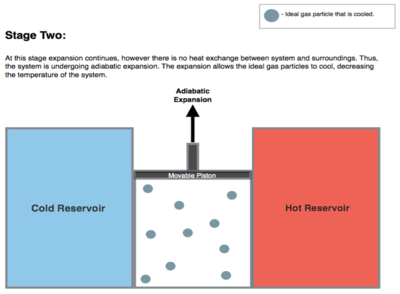
Адиабатическое расширение – показано процессом BC. После окончания изотермического подвода тепла газ находится в состоянии, характеризуемом точкой B. Далее следует адиабатическое расширение рабочего тела. На этом этапе газ в двигателе изолирован от обоих тепловых источником – как от горячего, так и от холодного. Поэтому ни источники, ни рабочее тело получают и не теряют тепло. Такой процесс называется адиабатическим. Из-за отсутствия теплообмена с окружающей средой Q=0 энтропия рабочего тела остается постоянной S=const. Работа осуществляется только за счет внутренней энергии A = -∆U. Поэтому происходит снижение температуры газа.

Рабочее тело, расширяясь, заставляет поршень двигаться вверх. Давление газа под поршнем постепенно снижается. Выталкивая подвижный поршень вверх, рабочее тело совершает механическую работу, в результате чего теряет определенное количество внутренней энергии. Количество этой энергии равно проделанной работе A = -∆U. В процессе расширения рабочего тела его температура уменьшается и становится равной TХ.
Изотермическое сжатие
Изотермическое сжатие – процесс CD. На данном этапе рабочее передаёт тепло холодному источнику при температуре TХ. К газу подводится работа сжатия путем перемещения поршня вниз. В результате этого процесса, рабочее тело передает холодильнику количество теплоты равное подводимой работе Q2=А2. Изменения внутренней энергии не будет ∆U=0. Поэтому, этот процесс считается изотермическим сжатием TХ=const. Энтропия газа уменьшается.

Адиабатическое сжатие
Адиабатическое сжатие – процесс DA. После завершения отвода тепла, газ находится в состоянии, характеризуемом точкой D. На последней стадии цикла рабочее тело снова остается изолированным обоих источников Q=0. Предполагается, что поршень движется без трения, а процесс является обратимым. Работа продолжает подводиться и поршень движется вниз, сжимая газ. В результате этого внутренняя энергия газа возрастает A = +∆U. Под давлением поршня температура рабочего тела поднимается до температуры нагревателя TН, но энтропия остается неизменной. Итогом этого этапа является то, что рабочее тело возвращается к своему изначальному состоянию в точку А.

Поскольку цикл Карно идеальный, то принято допущение, что температуры рабочего тела в процессах AB и CD равна температуре горячего и холодного источника или отличаются на бесконечно малую величину.
Формула расчета цикла Карно
Коэффициент КПД показывает, насколько совершенен цикл и входящие в него термодинамические процессы. Термический КПД любого термодинамического цикла рассчитывается по формуле:

Где Q1 – тепло, подведенное к рабочему телу от нагревателя;
Q2 – тепло, отведенное от рабочего тела к холодильнику.
Применительно для расчета КПД цикла Карно используется формула:

Где TН -температура горячего источника;
TХ -температура холодно источника.
Температура формуле вычисления КПД цикла Карно в кельвинах [К].
Обратный цикл Карно
Описанный выше цикл теплового двигателя Карно полностью обратим. Это значит, что можно пройти все процессы в обратном направлении:
- процесс отвода тепла станет процессом подвода тепла
- процесс сжатия – расширением.
При проходе процессов в обратном направлении получим циклом холодильной машины Карно или теплового насоса. Диаграммы остаются абсолютно такими же, измениться лишь направление процессов.
Единственное отличие обратного цикла Карно — это противоположные направления всех четырёх термодинамических процессов.

Тепло в обратном цикле Карно будет поглощаться из холодильника, и далее отводиться к нагревателю. Чтобы это осуществить, в соответствии со вторым законом термодинамики, необходимо затратить работу. Работа затрачивается на сжатие газа.
В результате того, что к данной системе прикладывается работа, тепло перемещается от холодного источника к горячему.
Подробнее про обратный цикл Карно и холодильные машины рекомендуем прочитать в статье.
Теорема Карно
Теорема Карно – это теорема, выявляющая некоторые ограничения для предела КПД реальных тепловых машин. Описал ее Сади Карно в своем труде о движущей силе огня. Но некоторые из современных авторов считают, что рассуждения Карно позволяют сформулировать сразу две теоремы. Звучат они так:
- КПД любого обратимого теплового двигателя, работающего по циклу Карно, не зависит от природы рабочего тела и конструкции самой машины, а является лишь функцией температур нагревателя и холодильника:
Из этой теоремы можно сделать вывод, что самую большую роль, определяющую КПД тепловой машины, играет разница температур горячего и холодного источников.
- КПД любого теплового двигателя, работающего по необратимому циклу, должен быть меньше КПД двигателя с обратимым циклом Карно, при условии равных температур нагревателей и холодильников.
Эта трактовка теоремы дает понять, что реальные двигатели неидеальны, в отличии от теоретической модели Карно. Поэтому, из-за наличия неизбежных потерь энергии, КПД реального двигателя будет снижаться в зависимости от объема этих потерь.
Исходя из этого, уравнение расчета КПД цикла Карно показывает максимальную эффективность работы для любого двигателя, в котором задействованы соответствующие температурные параметры.
Следствие теоремы Карно – все обратимые двигатели, которые работают между идентичными источниками тепла, имеют одинаковую эффективность.

Отсюда можно сделать вывод: понижение температуры холодного резервуара сильнее влияет на максимальный КПД тепловой машины, чем увеличение температуры горячего резервуара на такую же величину. На практике добиться этого довольно сложно, так как чаще всего источником для охлаждения является окружающая среда со своей температурой.
Максимальный КПД достигается только в том случае, когда значение энтропии не изменяется в течение цикла. Например, в течение цикла энтропия может изменяться при наличии трения, в результате которого при механической работе выделяется тепло. В данной ситуации цикл нельзя назвать обратимым.
Обобщенный цикл Карно
Согласно описанной ранее теореме Карно, КПД абсолютно любого реального цикла не может быть выше КПД в цикле Карно при идентичных температурных параметрах. Несмотря на это существуют примеры, термический КПД которых, при определенных условиях, равен циклу Карно. Такие циклы имеют отличия в изображении на T-S диаграмме. В данных циклах используется регенерация теплоты, поэтому они называются регенеративными.
Термодинамический цикл с регенерацией теплоты
Происходит процесс регенерации следующим образом. Доля тепла, отдаваемая рабочим телом холодильнику, переходит обратно к рабочему телу для его нагревания. Такой метод повышает термический КПД рабочего цикла, позволяя сделать расход теплоты более выгодным, и используется в теплосиловых устройствах. Например, в современных тепловых электрических станциях.
Рассмотрим T-S диаграмму регенеративного цикла.

Данный цикл состоит из двух изотермических (1-2) и (3-4) и двух политропных (произвольных) (2-3) и (4-1) обратимых и эквидистантных процессов.
- Горячий источник (нагреватель), имея начальную температуру T1, по изотерме (1-2) передает теплоту рабочему телу.
- В точке 2 начинается расширение рабочего тела в направлении (2-3) – политропный процесс. На данной кривой происходит отвод теплоты регенерации qрег.
- Точка 3 на диаграмме находится левее, чем в диаграмме для идеального цикла Карно, поскольку вследствие отвода теплоты регенерации уменьшается энтропия рабочего тела.
- Далее, на изотермической прямой (3-4) происходит сжатие рабочего тела и отведение теплоты к холодному источнику с температурой T2 (холодильник).
- В точке 4 начинается политропный процесс сжатия по кривой (4-1). Одновременно с этим к рабочему телу подводится теплота qрег.
Рабочее тело принимает и отдает равное количество теплоты qрег, значит в данном процессе происходит перенос теплоты из одной части цикла в другую, это и называется процессом регенерации.
Термический КПД регенеративного цикла
Термический КПД регенеративного цикла будет равен термическому КПД Карно при идентичных параметрах температуры. Поэтому такой регенеративный цикл так же называют обобщенным циклом Карно (только если он обратим). Подобные явления находят массовое практическое применение на различных промышленных объектах и предприятиях.
К примеру, по принципу регенерации происходит подогрев воды в паровых турбинах и подогрев воздуха в газовых турбинах.
Говоря об обобщенном цикле Карно, стоит отметить, что его реализация в идеальном виде невозможна. Обусловлено это тем, что в идеале такая система должна содержать бесконечно большое количество промежуточных регенераторов. При этом, для каждого из них температура отводимой и подводимой теплоты должна быть определенной. Любые методы регенерации, которые используются на практике, являются в определенной мере приближенными к идеальному циклу.
Эффективность реальных тепловых двигателей.
Обратимые двигатели в реальности невозможны. Реальные машины имеют еще меньший КПД, чем КПД машины Карно. Помимо этого, реальные двигатели, работающие по принципу Карно, можно встретить крайне редко. Несмотря на это, данное уравнение не теряет своей актуальности для определения максимального КПД, который можно спрогнозировать для определенной пары источников теплоты. Двигатель, работающий по принципу Карно должен рассматриваться как теоретическая модель тепловых двигателей.

Важнейшей технической задачей является повышение КПД тепловых двигателей и приближение этого значение к максимально возможному. Сравним значения термических КПД некоторых тепловых двигателей:
- Паровой двигатель – 8%
- Газотурбинная установка – 25-38%
- Паротурбинная установка – 40-50%
Начальные и конечные температуры пара для паровой турбины имеют такие приблизительные значения: Tн = 800 К, Tх = 300 К. Максимальное теоретическое значение КПД при данных температурах – 62%. Но, вследствие различных потерь энергии, в реальности экономичность достигает 45%.
На сегодня, КПД самых экономичных паротурбинных блоков на сверхперегретом паре с развитой системой регенерации и промежуточным перегревом пара достигает 52%.

Заключение
Модель работы идеального теплового двигателя, предложенная Сади Карно почти 200 лет назад, хоть и нереализуема на практике, но определенно остается актуальной и в нынешнее время.
Цикл Карно – теоретический инструмент, позволяющий рассчитать максимальную эффективность для любого теплового двигателя, что является немаловажной задачей для каждого инженера, занимающегося разработкой и моделированием термодинамических систем.
Французский
инженер Сади Карно в 1824 году впервые
дал теоретическое объяснение работы
тепловых машин. В то время еще использовалась
теория теплорода и не была установлена
единая природа теплоты и работы как
меры энергетического взаимодействия.
Однако С. Карно в своей теории тепловой
машины были высказаны основные положения
второго закона термодинамики [1, 7].
Основное
положение теории С. Карно, впоследствии
получившее название
принципа Карно,
состоит в том, что
для получения работы в тепловой машине
необходимы по крайней мере два источника
теплоты с разными температурами.
Карно
предложил идеальный цикл тепловой
машины, в котором используются два
источника теплоты с постоянными
температурами: источник с высокой
температурой – горячий источник и
источник с низкой температурой –
холодный источник. Поскольку цикл
идеальный, то он состоит из обратимых
процессов теплообмена между рабочим
телом и источниками теплоты, соответствующих
двум изотермам, и двум идеальным адиабатам
перехода рабочего тела с одной изотермы
на другую. Графическое изображение
цикла Карно в P,v- и T,s- диаграммах,
использующего в качестве рабочего тела
идеальный газ, представлено на рис.8.5.
В
цикле Карно горячий источник теплоты
с Т1=const
передает теплоту (процесс 14) рабочему
телу, это обратимый процесс, поэтому
рабочее тело получает теплоту q1
по изотерме Т1
(процесс 41). На процессе 12 рабочее тело
расширяется по обратимой адиабате от
Т1
до Т2.
В обратимом процессе 23 рабочее тело
передает теплоту q2
холодному источнику по изотерме Т2=const
(для горячего источника это процесс
23). На процессе 34 рабочее тело сжимается
по обратимой адиабате от Т2
до Т1.
Д
цикла Карно в T,s- диаграмме подведенная
теплота к рабочему телу q1
и отведенная от него q2
представляют площади под изотермическими
процессами 41 и 23, которые соответствуют
прямоугольникам с определенными
сторонами: для q1
– с Т1
и Δs, для q2
– с T2
и Δs. Величины q1
и q2
определяются по формулам изотермического
процесса:
q1
= T1Δs;
(8.5)
q2
= T2Δs.
(8.6)
Работа
цикла Карно равна разности подведенной
и отведенной теплоты:
tк
=
q1
— q2
= (T1-T2)
Δs.
(8.7)
В
соответствии с выражением (8.7) получить
работу возможно только при наличии
разности температур у горячего и
холодного источников теплоты. Максимальная
работа цикла Карно теоретически была
бы при Т2=0,
но в качестве холодного источника в
тепловых машинах, как правило, используется
окружающая среда (вода, воздух) с
температурой около 300 К. Кроме этого,
достижение абсолютного нуля в природе
невозможно (этот факт относится к
третьему закону термодинамики). Таким
образом, в цикле Карно не вся теплота
q1
превращается в работу, а только ее часть.
Оставшаяся после получения работы
теплота q2
отдается холодному источнику, и при
заданных Т1
и Т2
она не может быть использована для
получения работы, величина q2
является тепловыми потерями (тепловым
отбросом) цикла.
Термический
КПД цикла Карно может быть записан в
виде
.
(8.8)
Таким
образом, КПД цикла Карно будет тем
больше, чем больше Т1
и меньше Т2.
При Т1=Т2
КПД равен нулю, т.е. при наличии одного
источника теплоты получение работы
невозможно. Невозможность существования
Т2=0
К указывает на то, что КПД цикла Карно
не может быть равен единице, и на то, что
он всегда меньше единицы.
Анализ
выражений (8.7) и (8.8) включает в себя
выводы, которые относятся к формулировкам
второго закона термодинамики:
получение
работы в тепловой машине возможно только
при наличии двух источников теплоты,
имеющих разную температуру;
в
тепловой машине невозможно преобразовать
всю теплоту горячего источника в работу;
невозможно
создание вечного двигателя второго
рода, в котором в качестве источника
теплоты используется окружающая среда.
Необходимо
отметить, что любой цикл имеет термический
КПД ниже КПД цикла Карно, проходящего
в интервалах максимальной и минимальной
температур данного цикла. Это утверждение
легко доказать, представив сравниваемые
циклы в T,s- диаграмме (рис.8.6). Сравним
термический КПД произвольного цикла
abcd (ηt)
с КПД цикла Карно 1234 (ηtк),
проходящего в интервалах максимальной
– T1max
и минимальной – T2min
температур данного цикла – abcd. Из рис.8.6
видно, что q1к
> q1
на величину площади 1ad и 4dc, а q2
> q2к
на величину площади а2b и 3cb. В результате
имеем q2/q1
> q2к/q1к,
следовательно, получаем соотношение
η
=
1
—
>
ηt
= 1 —
.
Термический
КПД цикла Карно зависит только от
температур горячего и холодного
источников теплоты (Т1
и Т2).
Зная температуры цикла Карно, легко
определить его КПД и сопоставить его с
КПД другого цикла Карно.
Любой
обратимый цикл можно представить в виде
эквивалентного
цикла Карно,
т.е. цикла с такими же q1
и q2,
а соответственно и с такой же работой
и термическим КПД, как у исходного цикла.
Понятие эквивалентного цикла Карно
позволяет сопоставить между собой
термические КПД различных по конфигурации
обратимых циклов, используя только Т1
и Т2.
Для
преобразования произвольного обратимого
цикла в эквивалентный цикл Карно вводится
понятие среднетермодинамической
температуры.
Среднетермодинамической
температурой
Тm
называется
частное от деления теплоты процесса на
изменение его энтропии:
.
(8.9)
В
диаграмме Т,s- значению Тm
(рис.8.7) соответствует высота прямоугольника
авсd, равновеликого площади 12сd.
Используя
понятие среднетермодинамической
температуры, представим в виде
эквивалентного цикла Карно произвольный
обратимый цикл 1234 (рис.8.8). Для этого
процесс подвода теплоты в цикл 12 заменим
изотермическим процессом ав со
среднетермодинамической температурой
T1m,
а процесс отвода теплоты 34 заменим
изотермическим процессом cd со
среднетермодинамической температурой
T2m.
Полученный цикл Карно авсd имеет q1
и q2
равные подведенной и отведенной теплоте
рассматриваемого цикла 1234, т.е. это
эквивалентные циклы, для которых
термический КПД определяется по формуле
.
В
цикла Карно будет использоваться для
сопоставления тепловой экономичности
различных циклов теплоэнергетических
установок.
Соседние файлы в папке Часть 1
- #
- #
- #
- #
- #
- #