Для изотермического процесса характерен определенный процесс, который происходит с газовым веществом, который в свою очередь имеет неизменную массу и постоянную неизменяемую температуру вещества.
Изотермический процесс для температуры газа, основные формулы и величины
Формулы
Изотермический процесс характеризует состояние газа и данное состояние записывается следующими формулами:
[p_{1} V_{1}=v R T]
[p_{2} V_{2}=v R T]
Изотермический процесс для системы координат
Характерные изотермические процессы зачастую отражают на термодинамических графиках и диаграммах.
Если рассмотреть подробно график можно увидеть линию, именно ее и принято называть изотермой. Она непосредственно является основной характеристикой процесса.
Изотермический процесс — закон Бойля-Мариотта
Разделим уравнение для второго состояния газа на выражение первого состояния и получим основное уравнение изотермического процесса.
[frac{p_{2} V_{2}}{p_{1} V_{1}}=1] или [p V=mathrm{const}] (постоянное значение)
Полученное уравнение и будет называться законом Бойля-Мариотта.
Данный процесс осуществляется с использованием тепловой энергии.
В случае, когда объем увеличивается, или отводится, для его уменьшения.
Составим первое значение термодинамики.
Затем постепенно получим уравнение для определения работы.
А также вычисления внутренней энергии и количества теплоты тела при изотермическом процессе.
[delta Q=d cup+d A=frac{i}{2} v R d T+p d V]
Температура является неизменной, поэтому, изменение значения внутренней энергии будет равняться нулевому значению. [(d cup=0)].
Из этого следует, что для изотермического процесса все подводимое тепло направлено на работу, которую совершает газ:
[ Delta Q=int_{V_{1}}^{V_{2}} d A ]
где:
- [delta Q] — тепло элементарного характера, которое подводится ко всей системе;
- dA — работа элементарного типа, совершаемая газом в изотермическом процессе;
- i — количество свободных степеней газовых молекул;
- R — газовое значение постоянной;
- d — значение молей для газа;
- V1— первоначальное значение объема газа;
- V2— окончательное значение объема газа.
[A=int_{V_{1}}^{V_{2}} p d V]
Давление газа, которое зависит от уравнения газа в идеальном состоянии.
[p V=v R T rightarrow p=frac{v R T}{V}]
Подставим вышеуказанное выражение в подынтегральное выражение:
[A=int_{V_{1}}^{V_{2}} frac{v R T}{V}=v R T int_{V_{1}}^{V_{2}} frac{d V}{V}=mathrm{u} R T ln left(frac{V_{2}}{V_{1}}right)]
Составленное уравнение необходимо определения значения работы, которую совершает газ в изотермическом процессе.
[ A=v R T ln left(frac{p_{1}}{p_{2}}right) ]
[ Delta Q=A ]
Нет времени решать самому?
Наши эксперты помогут!
Как найти изотермический процесс — примеры решения задач
Пример №1
Основное содержание задания: газ идеального состояния, имеет способность расширяется, имея постоянную температуру, от объема.
[V_{1}=0.2 mathrm{~m}^{3}]
[V_{2}=0.6 mathrm{~m}^{3}]
Известно сила давления во втором состоянии и оно равняется [p_{2}=1 cdot 10^{5} mathrm{Pi a}].
Определить:
- Величину изменения внутренней энергии газа;
- Значение работы, которую совершает газовое вещество в данном процессе;
- Какое необходимое количество теплоты получает газ в процессе работы.
Методика решения:
Внутренняя энергия газа неизменна, так как процесс который рассматривается в задаче, является изотермическим:
[Delta mathrm{U}=0]
Из основного закона термодинамики можно определить:
[Delta cup=A]
[A=v R T ln left(frac{V_{2}}{V_{1}}right)]
Составим и запишем уравнение, которое отражает окончательное (конечное) состояние газа:
[p_{2} V_{2}=v R T rightarrow T=frac{p_{2} V_{2}}{v R}]
Подставим в уравнение для температуры вышеизложенные формулы и получим решение:
[A=v R frac{p_{2} V_{2}}{v R} ln left(frac{V_{2}}{V_{1}}right)=p_{2} V_{2} ln left(frac{V_{2}}{V_{1}}right) .]
Следовательно, все величины расположены в международной системе единиц (СИ), можно провести вычисления и определить неизвестные значения:
[A=0.6 cdot 10^{5} ln left(frac{0.6}{0.2}right)=0.6 cdot 10^{5} cdot 1.1=6.6 cdot 10^{4} text { (Дж) }]
Ответ задачи:
- значение изменения внутренней энергии газа в рассматриваемой процессе равно нулевому значению.
- работа, которая совершается в процессе газовым веществом равняется [6,6 cdot 10^{4} text { Дж }].
- Необходимое количество тепловой энергии равно: [6,6 cdot 10^{4} text { Дж }].
Пример №2
Задание: изображен график, где изменяется идеальное состояние массы газа равное m в координатных осях p (V).
Нужно перенесите данный процесс на координатные оси в p(T).
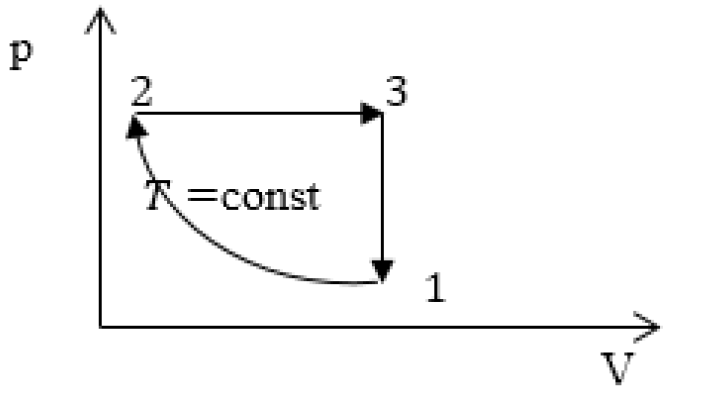
На данном графике изображен круговой процесс.
Где:
- Прямая 1-2 является изотермическим процессом с константой [(T=text { cons } t)]. Следовательно значение объема будет уменьшается [(mathrm{V} downarrow)], а давления соответственно расти [(p uparrow)].
- Прямая 2-3 отражает изобарический процесс [(p=text { const })]
const). Для данного процесса характерно увеличение объема [mathrm{V} uparrow] и применяя закон Гей-Люссака, увеличение [Т uparrow]
- Прямая (отрезок) 3-1 является изохорным процессом объем будет постоянной величиной [(mathrm{V}=text { const })], а [p downarrow],а исходя из закона Шарля [T downarrow].
Все перечисленные процессы изобразим на координатных осях p(T).
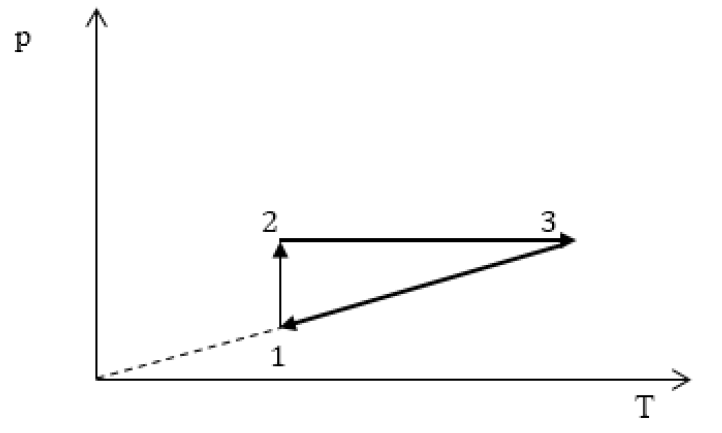
Изопроцессы
-
Темы кодификатора ЕГЭ: изопроцессы — изотермический, изохорный, изобарный процессы.
-
Изотермический процесс
-
Графики изотермического процесса
-
Изобарный процесс
-
Графики изобарного процесса
-
Изохорный процесс
-
Графики изохорного процесса
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: изопроцессы — изотермический, изохорный, изобарный процессы.
На протяжении этого листка мы будем придерживаться следующего предположения: масса и химический состав газа остаются неизменными. Иными словами, мы считаем, что:
• , то есть нет утечки газа из сосуда или, наоборот, притока газа в сосуд;
• , то есть частицы газа не испытывают каких-либо изменений (скажем, отсутствует диссоциация — распад молекул на атомы).
Эти два условия выполняются в очень многих физически интересных ситуациях (например, в простых моделях тепловых двигателей) и потому вполне заслуживают отдельного рассмотрения.
Если масса газа и его молярная масса фиксированы, то состояние газа определяется тремя макроскопическими параметрами: давлением, объёмом и температурой. Эти параметры связаны друг с другом уравнением состояния (уравнением Менделеева — Клапейрона).
Термодинамический процесс (или просто процесс) — это изменение состояния газа с течением времени. В ходе термодинамического процесса меняются значения макроскопических параметров — давления, объёма и температуры.
Особый интерес представляют изопроцессы — термодинамические процессы, в которых значение одного из макроскопических параметров остаётся неизменным. Поочерёдно фиксируя каждый из трёх параметров, мы получим три вида изопроцессов.
1. Изотермический процесс идёт при постоянной температуре газа: .
2. Изобарный процесс идёт при постоянном давлении газа: .
3. Изохорный процесс идёт при постоянном объёме газа: .
Изопроцессы описываются очень простыми законами Бойля — Мариотта, Гей-Люссака и Шарля. Давайте перейдём к их изучению.
к оглавлению ▴
Изотермический процесс
Пусть идеальный газ совершает изотермический процесс при температуре . В ходе процесса меняются только давление газа и его объём.
Рассмотрим два произвольных состояния газа: в одном из них значения макроскопических параметров равны , а во втором —
. Эти значения связаны уравнением Менделеева-Клапейрона:
Как мы сказали с самого начала,масса и молярная масса
предполагаются неизменными.
Поэтому правые части выписанных уравнений равны. Следовательно, равны и левые части:
(1)
Поскольку два состояния газа были выбраны произвольно, мы можем заключить, что в ходе изотермического процесса произведение давления газа на его объём остаётся постоянным:
(2)
Данное утверждение называется законом Бойля — Мариотта.
Записав закон Бойля — Мариотта в виде
(3)
можно дать и такую формулировку: в изотермическом процессе давление газа обратно пропорционально его объёму. Если, например, при изотермическом расширении газа его объём увеличивается в три раза, то давление газа при этом в три раза уменьшается.
Как объяснить обратную зависимость давления от объёма с физической точки зрения? При постоянной температуре остаётся неизменной средняя кинетическая энергия молекул газа, то есть, попросту говоря, не меняется сила ударов молекул о стенки сосуда. При увеличении объёма концентрация молекул уменьшается, и соответственно уменьшается число ударов молекул в единицу времени на единицу площади стенки — давление газа падает. Наоборот, при уменьшении объёма концентрация молекул возрастает, их удары сыпятся чаще и давление газа увеличивается.
к оглавлению ▴
Графики изотермического процесса
Вообще, графики термодинамических процессов принято изображать в следующих системах координат:
• -диаграмма: ось абсцисс
, ось ординат
;
• -диаграмма: ось абсцисс
, ось ординат
;
• -диаграмма: ось абсцисс
, ось ординат
.
График изотермического процесса называется изотермой.
Изотерма на -диаграмме — это график обратно пропорциональной зависимости
.
Такой график является гиперболой (вспомните алгебру — график функции ). Изотерма-гипербола изображена на рис. 1.
Рис. 1. Изотерма на -диаграмме
Каждая изотерма отвечает определённому фиксированному значению температуры. Оказывается, что чем выше температура, тем выше лежит соответствующая изотерма на —диаграмме.
В самом деле, рассмотрим два изотермических процесса, совершаемых одним и тем же газом (рис. 2). Первый процесс идёт при температуре , второй — при температуре
.
Рис. 2. Чем выше температура, тем выше изотерма
Фиксируем некоторое значение объёма . На первой изотерме ему отвечает давление
, на второй —
. Но при фиксированном объёме давление тем больше, чем выше температура (молекулы начинают сильнее бить по стенкам). Значит,
.
В оставшихся двух системах координат изотерма выглядит очень просто: это прямая, перпендикулярная оси (рис. 3):
Рис. 3. Изотермы на и
-диаграммах
к оглавлению ▴
Изобарный процесс
Напомним ещё раз, что изобарный процесс — это процесс, проходящий при постоянном давлении. В ходе изобарного процесса меняются лишь объём газа и его температура.
Типичный пример изобарного процесса: газ находится под массивным поршнем, который может свободно перемещаться. Если масса поршня и поперечное сечение поршня
, то давление газа всё время постоянно и равно
где — атмосферное давление.
Пусть идеальный газ совершает изобарный процесс при давлении . Снова рассмотрим два произвольных состояния газа; на этот раз значения макроскопических параметров будут равны
и
.
Выпишем уравнения состояния:
Поделив их друг на друга, получим:
В принципе, уже и этого могло бы быть достаточно, но мы пойдём немного дальше. Перепишем полученное соотношение так, чтобы в одной части фигурировали только параметры первого состояния, а в другой части — только параметры второго состояния (иными словами, «разнесём индексы» по разным частям):
(4)
А отсюда теперь — ввиду произвольности выбора состояний! — получаем закон Гей-Люссака:
(5)
Иными словами, при постоянном давлении газа его объём прямо пропорционален температуре:
(6)
Почему объём растёт с ростом температуры? При повышении температуры молекулы начинают бить сильнее и приподнимают поршень. При этом концентрация молекул падает, удары становятся реже, так что в итоге давление сохраняет прежнее значение.
к оглавлению ▴
Графики изобарного процесса
График изобарного процесса называется изобарой. На -диаграмме изобара
является прямой линией (рис. 4):
Рис. 4. Изобара на -диаграмме
Пунктирный участок графика означает, что в случае реального газа при достаточно низких температурах модель идеального газа (а вместе с ней и закон Гей-Люссака) перестаёт работать. В самом деле, при снижении температуры частицы газа двигаются всё медленнее, и силы межмолекулярного взаимодействия оказывают всё более существенное влияние на их движение (аналогия: медленный мяч легче поймать, чем быстрый). Ну а при совсем уж низких температурах газы и вовсе превращаются в жидкости.
Разберёмся теперь, как меняется положение изобары при изменении давления. Оказывается, что чем больше давление, тем ниже идёт изобара на —диаграмме.
Чтобы убедиться в этом, рассмотрим две изобары с давлениями и
(рис. 5):
Рис. 5. Чем ниже изобара, тем больше давление
Зафиксируем некоторое значение температуры . Мы видим, что
. Но при фиксированной температуре объём тем меньше, чем больше давление (закон Бойля — Мариотта!).
Стало быть, .
В оставшихся двух системах координат изобара является прямой линией, перпендикулярной оси (рис. 6):
Рис. 6. Изобары на и
-диаграммах
к оглавлению ▴
Изохорный процесс
Изохорный процесс, напомним, — это процесс, проходящий при постоянном объёме. При изохорном процессе меняются только давление газа и его температура.
Изохорный процесс представить себе очень просто: это процесс, идущий в жёстком сосуде фиксированного объёма (или в цилиндре под поршнем, когда поршень закреплён).
Пусть идеальный газ совершает изохорный процесс в сосуде объёмом . Опять-таки рассмотрим два произвольных состояния газа с параметрами
и
. Имеем:
Делим эти уравнения друг на друга:
Как и при выводе закона Гей-Люссака, «разносим» индексы в разные части:
(7)
Ввиду произвольности выбора состояний мы приходим к закону Шарля:
(8)
Иными словами, при постоянном объёме газа его давление прямо пропорционально температуре:
(9)
Увеличение давления газа фиксированного объёма при его нагревании — вещь совершенно очевидная с физической точки зрения. Вы сами легко это объясните.
к оглавлению ▴
Графики изохорного процесса
График изохорного процесса называется изохорой. На -диаграмме изохора
является прямой линией (рис. 7):
Рис. 7. Изохора на -диаграмме
Смысл пунктирного участка тот же: неадекватность модели идеального газа при низких температурах.
Далее, чем больше объём, тем ниже идёт изохора на —диаграмме (рис. 8):
Рис. 8. Чем ниже изохора, тем больше объём
Доказательство аналогично предыдущему. Фиксируем температуру и видим, что
. Но при фиксированной температуре давление тем меньше, чем больше объём (снова закон Бойля — Мариотта). Стало быть,
.
В оставшихся двух системах координат изохора является прямой линией, перпендикулярной оси (рис. 9):
Рис. 9. Изохоры на и
-диаграммах
Законы Бойля — Мариотта, Гей-Люссака и Шарля называются также газовыми законами.
Мы вывели газовые законы из уравнения Менделеева — Клапейрона. Но исторически всё было наоборот: газовые законы были установлены экспериментально, и намного раньше. Уравнение состояния появилось впоследствии как их обобщение.
Спасибо за то, что пользуйтесь нашими публикациями.
Информация на странице «Изопроцессы» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать нужные и поступить в ВУЗ или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из данного раздела.
Публикация обновлена:
08.05.2023
Основными процессами в термодинамике являются:
- изохорный, протекающий при постоянном объеме;
- изобарный, протекающий при постоянном давлении;
- изотермический, происходящий при постоянной температуре;
- адиабатный, при котором теплообмен с окружающей средой отсутствует;
- политропный, удовлетворяющий уравнению pvn= const.
Изохорный, изобарный, изотермический и адиабатный процессы являются частными случаями политропного процесса.
При исследовании термодинамических процессов определяют:
- уравнение процесса в p—v иT—s координатах;
- связь между параметрами состояния газа;
- изменение внутренней энергии;
- величину внешней работы;
- количество подведенной теплоты на осуществление процесса или количество отведенной теплоты.
Изохорный процесс

Изохорный процесс в p, v— , T, s— и i, s-координатах (диаграммах)
При изохорном процессе выполняется условие v = const.
Из уравнения состояния идеального газа (pv = RT) следует:
p/T = R/v = const,
т. е. давление газа прямо пропорционально его абсолютной температуре:
p2/p1 = T2/T1.
Работа расширения в изохорном процессе равна нулю (l = 0), так как объем рабочего тела не меняется (Δv = const).
Количество теплоты, подведенной к рабочему телу в процессе 1-2 при cv = const определяется по формуле:
q= cv(T2 — T1).
Т. к.l = 0, то на основании первого закона термодинамики Δu = q, а значит изменение внутренней энергии можно определить по формуле:
Δu = cv(T2 — T1).
Изменение энтропии в изохорном процессе определяется по формуле:
s2 – s1= Δs = cvln(p2/p1) = cvln(T2/T1).
Изобарный процесс
Изобарный процесс в p, v— , T, s— и i, s-координатах (диаграммах)
Изобарным называется процесс, протекающий при постоянном давлении p = const. Из уравнения состояния идеального газа слуедует:
v/T = R/p = const
или
v2/v1 = T2/T1,
т. е. в изобарном процессе объем газа пропорционален его абсолютной температуре.
Работа будет равна:
l = p(v2 – v1).
Т. к. pv1 = RT1 и pv2 = RT2, то
l = R(T2 – T1).
Количество теплоты при cp = const определяется по формуле:
q = cp(T2 – T1).
Изменение энтропии будет равно:
s2 – s1= Δs = cpln(T2/T1).
Изотермический процесс
Изотермический процесс в p, v— , T, s— и i, s-координатах (диаграммах)
При изотермическом процессе температура рабочего тела остается постоянной T = const, следовательно:
pv = RT = const
или
p2/p1 = v1/v2,
т. е. давление и объем обратно пропорциональны друг другу, так что при изотермическом сжатии давление газа возрастает, а при расширении – снижается.
Работа процесса будет равна:
l = RTln (v2 – v1) = RTln (p1 – p2).
Так как температура остается неизменной, то и внутренняя энергия идеального газа в изотермическом процессе остается постоянной (Δu = 0) и вся подводимая к рабочему телу теплота полностью превращается в работу расширения:
q = l.
При изотермическом сжатии от рабочего тела отводится теплота в количестве, равном затраченной на сжатие работе.
Изменение энтропии равно:
s2 – s1= Δs = Rln(p1/p2) = Rln(v2/v1).
Адиабатный процесс
Адиабатный процесс в p, v— , T, s— и i, s-координатах (диаграммах)
Адиабатным называется процесс изменения состояния газа, который происзодит без теплообмена с окружающей средой. Так как dq = 0, то уравнение первого закона термодинамики для адиабатного процесса будет иметь вид:
du + pdv = 0
или
Δu+ l = 0,
следовательно
Δu= —l.
В адиабатном процессе работа расширения совершается только за счет расходования внутренней энергии газа, а при сжатии, происходящем за счет действия внешних сил, вся совершаемая ими работа идет на увеличение внутренней энергии газа.
Обозначим теплоемкость в адиабатном процессе через cад, и условие dq = 0 выразим следующим образом:
dq = cадdT = 0.
Это условие говорит о том, что теплоемкость в адиабатном процессе равна нулю (cад = 0).
Известно, что
сp/cv = k
и уравнение кривой адиабатного процесса (адиабаты) в p, v-диаграмме имеет вид:
pvk = const.
В этом выражении k носит название показателя адиабаты (так же ее называют коэффициентом Пуассона).
Значения показателя адиабаты k для некоторых газов:
kвоздуха = 1,4
kперегретого пара = 1,3
kвыхлопных газов ДВС = 1,33
kнасыщенного влажного пара = 1,135
Из предыдущих формул следует:
l= — Δu = cv(T1 – T2);
i1 – i2= cp(T1 – T2).
Техническая работа адиабатного процесса (lтехн) равна разности энтальпий начала и конца процесса (i1 – i2).
Адиабатный процесс, происходящий без внутреннего трения в рабочем теле, называется изоэнтропийным. В T, s-диаграмме он изображается вертикальной линией.
Обычно реальные адиабатные процессы протекают при наличии внутреннего трения в рабочем теле, в результате чего всегда выделяется теплота, которая сообщается самому рабочему телу. В таком случае ds > 0, и процесс называется реальным адиабатным процессом.
Политропный процесс
Политропным называется процесс, который описывается уравнением:
pvn= const.
Показатель политропы n может принимать любые значения в пределах от -∞ до +∞, но для данного процесса он является постоянной величиной.
Из уравнения политропного процесса и уравнения Клайперона можно получить выражение, устанавливающее связь между p, vи Tв любых двух точках на политропе:
p2/p1 = (v1/v2)n; T2/T1 = (v1/v2)n-1; T2/T1 = (p2/p1)(n-1)/n.
Работа расширения газа в политропном процессе равна:
В случае идеального газа эту формулу можно преобразовать:
Количество подведенной или отведенной в процессе теплоты определяется с помощью первого закона термодинамики:
q = (u2 – u1) + l.
Поскольку
представляет собой теплоемкость идеального газа в политропном процессе.
При cv, k и n = const cn = const, поэтому политропный процесс иногда определят как процесс с постоянной теплоемкостью.
Политропный процесс имеет обобщающее значение, ибо охватывает всю совокупность основных термодинамических процессов.
Графическое представление политропа в p, v координатах в зависимости от показателя политропа n.
pv0 = const (n = 0) – изобара;
pv = const (n = 1) – изотерма;
p0v = const, p1/∞v = const, pv∞ = const – изохора;
pvk = const (n = k) – адиабата.
n > 0 – гиперболические кривые,
n < 0 – параболы.
По материалам моего конспекта лекций по термодинамике и учебника «Основы энергетики». Автор Г. Ф. Быстрицкий. 2-е изд., испр. и доп. — М. :КНОРУС, 2011. — 352 с.
Что такое изотермический процесс
Изотермический процесс – процесс изменения состояния идеального газа при постоянной температуре.
Главное условие: T=const
С разницей в 14 лет закон открыли Роберт Бойль (1662 г.) и Эдм Мариотт (1676 г.) Название дано в честь обоих ученых.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Закон Бойля-Мариотта
При постоянной температуре и массе идеального газа произведение его давления и объёма постоянно.
(T-const\P_1V_1=P_2V_2\\\)
Или соотношение:
(frac{p_1}{p_2}=frac{V_2}{V_1}\\\)
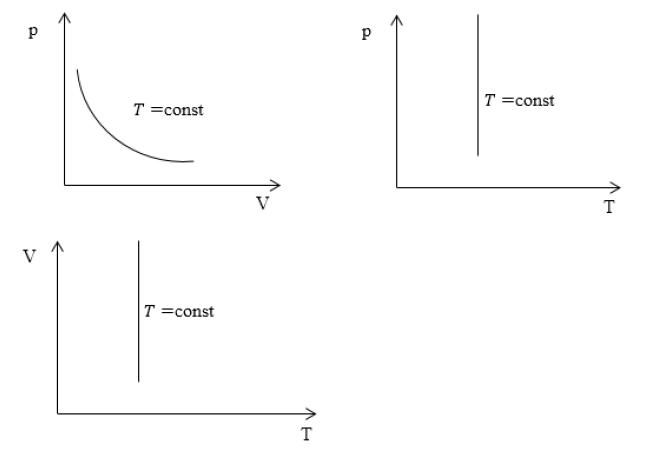
Закон выражается графиками:
1. Зависимость давления от объема:
2. Зависимость давления от температуры:
3. Зависимость объема от температуры:
Как изменяется внутренняя энергия при изотермическом процессе
Внутренняя энергия изменяется вместе с температурой. Отличительной чертой изотермического процесса является его протекание с постоянной температурой. Из этого следует, что внутренняя энергия не изменяется.
Формула количества теплоты в изотермическом процессе
Запишем первый закон термодинамики:
(Q=triangle U+A\\\ )
(Q-количество;теплоты;(Дж)\triangle U-изменение;внутренней;энергии;(Дж)\А-работа;(Дж)\\\)
Поскольку температура постоянна, то изменение внутренней энергии равно нулю. Уравнение принимает вид:
(triangle Q=A\\\)
Все тепло расходуется на работу газа.
From Wikipedia, the free encyclopedia
«Isothermal» redirects here. For other uses, see Isotherm.
In thermodynamics, an isothermal process is a type of thermodynamic process in which the temperature T of a system remains constant: ΔT = 0. This typically occurs when a system is in contact with an outside thermal reservoir, and a change in the system occurs slowly enough to allow the system to be continuously adjusted to the temperature of the reservoir through heat exchange (see quasi-equilibrium). In contrast, an adiabatic process is where a system exchanges no heat with its surroundings (Q = 0).
Simply, we can say that in an isothermal process
while in adiabatic processes:
Etymology[edit]
The adjective «isothermal» is derived from the Greek words «ἴσος» («isos») meaning «equal» and «θέρμη» («therme») meaning «heat».
Examples[edit]
Isothermal processes can occur in any kind of system that has some means of regulating the temperature, including highly structured machines, and even living cells. Some parts of the cycles of some heat engines are carried out isothermally (for example, in the Carnot cycle).[1] In the thermodynamic analysis of chemical reactions, it is usual to first analyze what happens under isothermal conditions and then consider the effect of temperature.[2] Phase changes, such as melting or evaporation, are also isothermal processes when, as is usually the case, they occur at constant pressure.[3] Isothermal processes are often used as a starting point in analyzing more complex, non-isothermal processes.
Isothermal processes are of special interest for ideal gases. This is a consequence of Joule’s second law which states that the internal energy of a fixed amount of an ideal gas depends only on its temperature.[4] Thus, in an isothermal process the internal energy of an ideal gas is constant. This is a result of the fact that in an ideal gas there are no intermolecular forces.[4] Note that this is true only for ideal gases; the internal energy depends on pressure as well as on temperature for liquids, solids, and real gases.[5]
In the isothermal compression of a gas there is work done on the system to decrease the volume and increase the pressure.[4] Doing work on the gas increases the internal energy and will tend to increase the temperature. To maintain the constant temperature energy must leave the system as heat and enter the environment. If the gas is ideal, the amount of energy entering the environment is equal to the work done on the gas, because internal energy does not change. For isothermal expansion, the energy supplied to the system does work on the surroundings. In either case, with the aid of a suitable linkage the change in gas volume can perform useful mechanical work. For details of the calculations, see calculation of work.
For an adiabatic process, in which no heat flows into or out of the gas because its container is well insulated, Q = 0. If there is also no work done, i.e. a free expansion, there is no change in internal energy. For an ideal gas, this means that the process is also isothermal.[4] Thus, specifying that a process is isothermal is not sufficient to specify a unique process.
Details for an ideal gas[edit]
Figure 1. Several isotherms of an ideal gas on a p-V diagram, where p for pressure and V the volume.
For the special case of a gas to which Boyle’s law[4] applies, the product pV (p for gas pressure and V for gas volume) is a constant if the gas is kept at isothermal conditions. The value of the constant is nRT, where n is the number of moles of the present gas and R is the ideal gas constant. In other words, the ideal gas law pV = nRT applies.[4] Therefore:
holds. The family of curves generated by this equation is shown in the graph in Figure 1. Each curve is called an isotherm, meaning a curve at a same temperature T. Such graphs are termed indicator diagrams and were first used by James Watt and others to monitor the efficiency of engines. The temperature corresponding to each curve in the figure increases from the lower left to the upper right.
Calculation of work[edit]
Figure 2. The purple area represents the work for this isothermal change.
In thermodynamics, the reversible work involved when a gas changes from state A to state B is[6]
where p for gas pressure and V for gas volume. For an isothermal (constant temperature T), reversible process, this integral equals the area under the relevant PV (pressure-volume) isotherm, and is indicated in purple in Figure 2 for an ideal gas. Again, p = nRT/V applies and with T being constant (as this is an isothermal process), the expression for work becomes:
In IUPAC convention, work is defined as work on a system by its surroundings. If, for example, the system is compressed, then the work is done on the system by the surrounding so the work is positive and the internal energy of the system increases. Conversely, if the system expands (i.e., system surrounding expansion, so free expansions not the case), then the work is negative as the system does work on the surroundings and the internal energy of the system decreases.
It is also worth noting that for ideal gases, if the temperature is held constant, the internal energy of the system U also is constant, and so ΔU = 0. Since the First Law of Thermodynamics states that ΔU = Q + W in IUPAC convention, it follows that Q = −W for the isothermal compression or expansion of ideal gases.
Example of an isothermal process[edit]
Figure 3. Isothermal expansion of an ideal gas. Black line indicates continuously reversible expansion, while the red line indicates stepwise and nearly reversible expansion at each incremental drop in pressure of 0.1 atm of the working gas.
The reversible expansion of an ideal gas can be used as an example of work produced by an isothermal process. Of particular interest is the extent to which heat is converted to usable work, and the relationship between the confining force and the extent of expansion.
During isothermal expansion of an ideal gas, both p and V change along an isotherm with a constant pV product (i.e., constant T). Consider a working gas in a cylindrical chamber 1 m high and 1 m2 area (so 1m3 volume) at 400 K in static equilibrium. The surroundings consist of air at 300 K and 1 atm pressure (designated as psurr). The working gas is confined by a piston connected to a mechanical device that exerts a force sufficient to create a working gas pressure of 2 atm (state A). For any change in state A that causes a force decrease, the gas will expand and perform work on the surroundings. Isothermal expansion continues as long as the applied force decreases and appropriate heat is added to keep pV = 2 [atm·m3] (= 2 atm × 1 m3). The expansion is said to be internally reversible if the piston motion is sufficiently slow such that at each instant during the expansion the gas temperature and pressure is uniform and conform to the ideal gas law. Figure 3 shows the p–V relationship for pV = 2 [atm·m3] for isothermal expansion from 2 atm (state A) to 1 atm (state B).
The work done (designated 
The system attains state B (pV = 2 [atm·m3] with p = 1 atm and V = 2 m3) when the applied force reaches zero. At that point, 
To pursue the nature of isothermal expansion further, note the red line on Figure 3. The fixed value of pV causes an exponential increase in piston rise vs. pressure decrease. For example, a pressure decrease from 2 to 1.9 atm causes a piston rise of 0.0526 m. In comparison, a pressure decrease from 1.1 to 1 atm causes a piston rise of 0.1818 m.
Entropy changes[edit]
Isothermal processes are especially convenient for calculating changes in entropy since, in this case, the formula for the entropy change, ΔS, is simply
where Qrev is the heat transferred (internally reversible) to the system and T is absolute temperature.[7] This formula is valid only for a hypothetical reversible process; that is, a process in which equilibrium is maintained at all times.
A simple example is an equilibrium phase transition (such as melting or evaporation) taking place at constant temperature and pressure. For a phase transition at constant pressure, the heat transferred to the system is equal to the enthalpy of transformation, ΔHtr, thus Q = ΔHtr.[3] At any given pressure, there will be a transition temperature, Ttr, for which the two phases are in equilibrium (for example, the normal boiling point for vaporization of a liquid at one atmosphere pressure). If the transition takes place under such equilibrium conditions, the formula above may be used to directly calculate the entropy change[7]
.
Another example is the reversible isothermal expansion (or compression) of an ideal gas from an initial volume VA and pressure PA to a final volume VB and pressure PB. As shown in Calculation of work, the heat transferred to the gas is
.
This result is for a reversible process, so it may be substituted in the formula for the entropy change to obtain[7]
.
Since an ideal gas obeys Boyle’s Law, this can be rewritten, if desired, as
.
Once obtained, these formulas can be applied to an irreversible process, such as the free expansion of an ideal gas. Such an expansion is also isothermal and may have the same initial and final states as in the reversible expansion. Since entropy is a state function (that depends on an equilibrium state, not depending on a path that the system takes to reach that state), the change in entropy of the system is the same as in the reversible process and is given by the formulas above. Note that the result Q = 0 for the free expansion can not be used in the formula for the entropy change since the process is not reversible.
The difference between the reversible and irreversible is found in the entropy of the surroundings. In both cases, the surroundings are at a constant temperature, T, so that ΔSsur = −Q/T; the minus sign is used since the heat transferred to the surroundings is equal in magnitude and opposite in sign to the heat Q transferred to the system. In the reversible case, the change in entropy of the surroundings is equal and opposite to the change in the system, so the change in entropy of the universe is zero. In the irreversible, Q = 0, so the entropy of the surroundings does not change and the change in entropy of the universe is equal to ΔS for the system.
See also[edit]
- Joule–Thomson effect
- Joule expansion (also called free expansion)
- Adiabatic process
- Cyclic process
- Isobaric process
- Isochoric process
- Polytropic process
- Spontaneous process
References[edit]
- ^ Keenan, J. H. (1970). «Chapter 12: Heat-engine cycles». Thermodynamics. Cambridge, Massachusetts: MIT Press.
- ^ Rock, P. A. (1983). «Chapter 11: Thermodynamics of chemical reactions». Chemical Thermodynamics. Mill Valley, CA: University Science Books. ISBN 0-935702-12-1.
- ^ a b Petrucci, R. H.; Harwood, W. S.; Herring, F. G.; Madura, J. D. (2007). «Chapter 12». General Chemistry. Upper Saddle River, NJ: Pearson. ISBN 978-0-13-149330-8.
- ^ a b c d e f Klotz, I. M.; Rosenberg, R. M. (1991). «Chapter 6, Application of the first law to gases». Chemical Thermodynamics. Meno Park, CA: Benjamin.[ISBN missing]
- ^ Adkins, C. J. (1983). Equilibrium Thermodynamics. Cambridge: Cambridge University Press.[ISBN missing]
- ^ Atkins, Peter (1997). «Chapter 2: The first law: the concepts». Physical Chemistry (6th ed.). New York, NY: W. H. Freeman and Co. ISBN 0-7167-2871-0.
- ^ a b c Atkins, Peter (1997). «Chapter 4: The second law: the concepts». Physical Chemistry (6th ed.). New York, NY: W. H. Freeman and Co. ISBN 0-7167-2871-0.






































