Нормальные и стандартные условия
Нормальными условиями принято считать давление газа P0=101.325 кПа и его температуру
T0=0 ºС или T0=273.2 К.
ГОСТы на топливные газы принято утверждать при температуре T20=+20 ºС и P0101.325 кПа (760 мм рт.ст.), в связи
с этим эти условия называют стандартными.
Нормальные и стандартные условия введены для сравнения объёмных количеств
различных газов.
Приведение газа к нормальным условиям осуществляется по следующему
уравнению:
Рисунок 252. (1)
Аналогично для приведения газа к стандартным условиям:
Рисунок 253. (2)
Иногда приходится газ, находящийся при нормальных и стандартных условиях,
приводить к заданным условиям температуры и давления. Приведенные выше соотношения
примут следующий вид:
Рисунок 254. (3)
Рисунок 255. (4)
где
-
V0— объём газа
при нормальных условиях (P0, T0),
м3; -
V
— объём газа при давлении P и температуре Т °С,
м3; -
P0 –
нормальное давление газа, P0=101.325 кПа
= 0.101325 МПа, (760 мм рт.ст.); -
273.2 – нормальная температура, то есть T0,
К; -
V20— объём
газа при стандартных условиях (температуре T20=273.2+20=293.2 и
давлении P0),
м3.
Как найти температуру газа
Для того чтобы найти абсолютную температуру идеального газа, можно воспользоваться уравнением, которое широко известно, как уравнение Клапейрона-Менделеева. Эта формула позволяет установить зависимость между давлением, температурой газа и его молярным объемом.
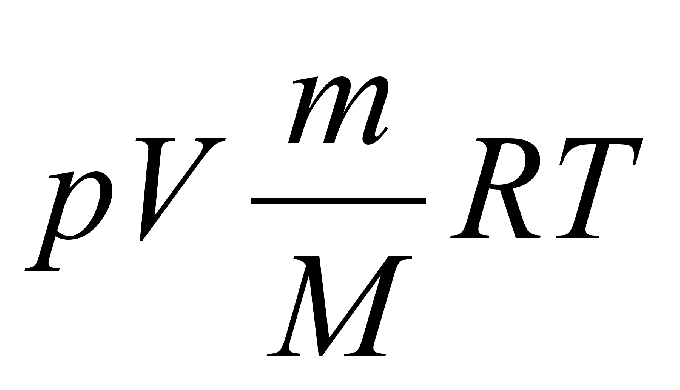
Вам понадобится
- Лист бумаги, ручка.
Инструкция
Формула выглядит следующим образом: p•Vm = R•T, где p — это давление, Vm — молярный объем газа, R — это универсальная газовая постоянная, а Т — абсолютная температура идеального газа.
Выясняем, какие данные нам доступны для того, чтобы использовать формулу, таким образом: Т = (p•Vm)/ R.
В случае если нам не известен молярный объем газа, мы можем найти его по формуле:
Vm = V/?. В этой формуле ? представляет собой количество вещества, Найти эту величину можно разделив массу газа на его молярную массу.
Формула, которая носит название закон Менделеева-Клапейрона, записывается именно в таком виде: p•V = (m/М) • R•T.
Видоизменяем эту формулу, чтобы найти температуру газа: T = (p•V • М)/(R• m).
Находим все величины, которые требуются нам для подстановки в формулу. Выполняем расчеты и находим искомую температуру идеального газа.
Обратите внимание
Внимательно разберитесь в условных обозначениях, чтобы из-за неправильно распознанного символа в формуле не допустить ошибки в расчетах.
Полезный совет
Закон Менделеева-Клапейрона также называют объединенным газовым законом, именно из него выводятся законы Шарля и Гей-Люссака, а также Бойля-Мариотта.
Источники:
- Здесь вы найдете не только информацию, которая касается непосредственно поиска абсолютной температуры идеального газа, но и массу информации о свойствах газов.
- как определить температуру газа
- Температура газовой плиты
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Содержание:
Температура:
Перед тем как, например, пойти на пляж, многие интересуются прогнозом погоды. И если ожидается температура воздуха 10 °С, то, скорее всего, планы будут изменены. А стоит ли отказываться от прогулки, если прогнозируется температура 300 К (кельвинов)? И что на самом деле вкладывают физики в понятие «температура»?
Что такое температура
Эксперименты показывают, что макроскопическая система может переходить из одного состояния в другое. Например, если в морозный день занести в комнату шарик, наполненный гелием, то гелий в шарике будет нагреваться и при этом будут изменяться давление, объем и некоторые другие параметры газа. После того как шарик пробудет в комнате некоторое время, изменения прекратятся. Один из постулатов молекулярной физики и термодинамики — его еще называют нулевое начало термодинамики — гласит: любое макроскопическое тело или система тел при неизменных внешних условиях самопроизвольно переходит в термодинамическое равновесное состояние (состояние теплового равновесия), после достижения которого все части системы имеют одинаковую температуру. Нулевое начало термодинамики фактически вводит и определяет понятие температуры.
Температура — физическая величина, характеризующая состояние теплового равновесия макроскопической системы.
Состояние теплового равновесия — это такое состояние макроскопической системы, при котором все макроскопические параметры системы остаются неизменными сколь угодно долго.
В состоянии теплового равновесия все части системы имеют одинаковую температуру; другие макроскопические параметры неизменны, но могут быть разными. Вспомните пример с шариком: после того как установится тепловое равновесие, температура окружающего воздуха и температура гелия в шарике будут одинаковыми, а давление, плотность и объем — разными.
Как работают термометры
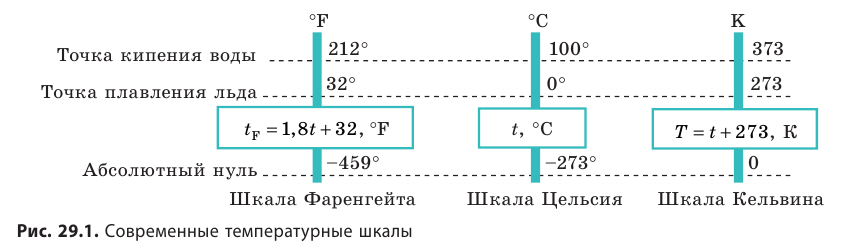
Температура — это физическая величина, и ее можно измерять. Для этого нужно установить шкалу температур. Самые распространенные температурные шкалы — шкалы Цельсия, Кельвина, Фаренгейта (рис. 29.1).
Построение шкалы температур начинается с выбора реперных (опорных) точек, которые должны быть однозначно связаны с какими-либо физическими процессами, которые легко воспроизвести. Например, за нулевую точку температурной шкалы Цельсия принята температура таяния льда при нормальном атмосферном давлении ( t = 0 °С). Температуре кипения воды при нормальном атмосферном давлении приписывают значение t =100 °С. Единица температуры по шкале Цельсия — градус Цельсия: 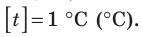
Рис. 29.2. различные виды термометров: а — жидкостный (принцип действия: изменение объема жидкости при изменении температуры); б — термометр сопротивления (изменение электрического сопротивления проводника при изменении температуры); в — биметаллический деформационный (изменение длин двух разных металлических пластин при изменении температуры)
Приборы для измерения температуры — термометры (рис. 29.2). Основные части любого термометра — термометрическое тело (ртуть или спирт в жидкостном термометре, биметаллическая пластина в металлическом деформационном термометре и т. д.) и шкала. Если термометрическое тело привести в контакт с телом, температуру которого нужно измерить, система придет в неравновесное состояние. При переходе в равновесное состояние будут изменяться некоторые параметры термометрического тела (объем, сопротивление и т. п.). Зная, как эти параметры зависят от температуры, определяют температуру тела.
Обратите внимание!
- Термометр фиксирует собственную температуру, равную температуре тела, с которым термометр находится в термодинамическом равновесии.
- Термометрическое тело не должно быть массивным, иначе оно существенно изменит температуру тела, с которым контактирует.
Температура и средняя кинетическая энергия молекул
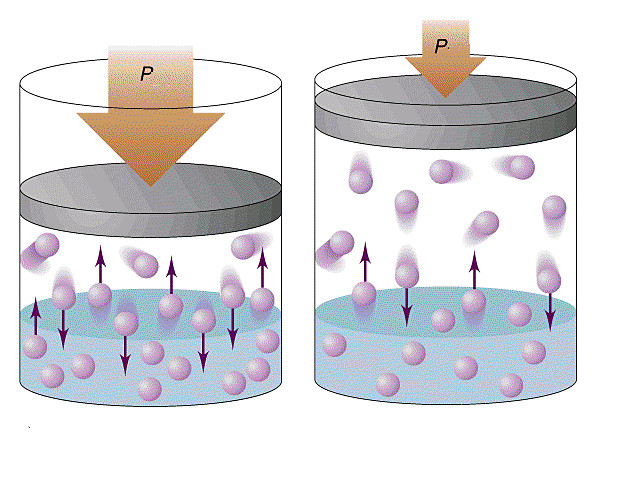
То, что температура тела должна быть связана с кинетической энергией его молекул, следует из простых соображений. Например, с увеличением температуры увеличивается скорость движения броуновских частиц, ускоряется диффузия, повышается давление газа, а это значит, что молекулы движутся быстрее и их кинетическая энергия становится больше. Можно предположить: если газы находятся в состоянии теплового равновесия, средние кинетические энергии молекул этих газов одинаковы. Но как это доказать, ведь непосредственно измерить эти энергии невозможно?
Обратимся к основному уравнению МКТ идеального газа: 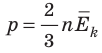
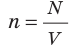
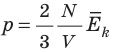
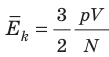
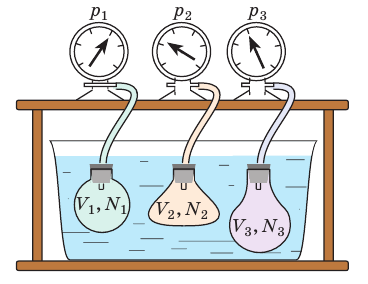
Таким образом, чтобы экспериментально убедиться в равенстве средних кинетических энергий молекул различных газов при одинаковой температуре, нужно измерить объемы (V), давления (p) и массы (m) газов и, зная их молярную массу (M), найти число молекул каждого газа (N) по формуле 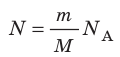
Чтобы обеспечить одинаковую температуру, можно, например, погрузить баллоны с различными газами в сосуд с водой и дождаться состояния теплового равновесия (рис. 29.3).
Рис. 29.3. опыт, позволяющий установить связь между температурой и средней кинетической энергией поступательного движения молекул газа. Газы в сосудах находятся в состоянии теплового равновесия со средой, а следовательно, и друг с другом
Эксперименты показывают, что для всех газов в состоянии теплового равновесия отношение 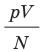
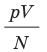
Например, при температуре 0 °С (сосуды с газами погрузили в тающий лед) 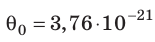
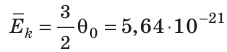
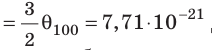
Абсолютная шкала температур
Понятно, что в джоулях представлять температуру неудобно (прежде всего потому, что значения θ очень малы), к тому же неудобно полностью отказываться от шкалы Цельсия. В 1848 г. английский физик Уильям Томсон (лорд Кельвин) (1824–1907) предложил абсолютную шкалу температур (сейчас ее называют шкалой Кельвина).
Температуру Т, измеренную по шкале кельвина, называют абсолютной температурой.
Единица абсолютной температуры — кельвин — основная единица СИ: [T] = 1 К (К).
Шкала Кельвина построена следующим образом:
- изменение температуры по шкале Кельвина равно изменению температуры по шкале Цельсия: ∆ = T t ∆ , то есть цена деления шкалы Кельвина равна цене деления шкалы Цельсия: 1 °С = 1 К; температуры, измеренные по шкалам Кельвина и Цельсия, связаны соотношениями:
- температура по шкале Кельвина связана с величиной
соотношением θ = kT, где k — постоянная Больцмана — коэффициент пропорциональности, не зависящий ни от температуры, ни от состава и количества газа:
- абсолютная температура имеет глубокий физический смысл: средняя кинетическая энергия поступательного движения молекул идеального газа прямо пропорциональна абсолютной температуре:
(1) То есть, если газ охладить до температуры T= 0 К, движение его молекул должно прекратиться (
). Таким образом, нулевая точка шкалы Кельвина — это самая низкая теоретически возможная температура. На самом деле движение молекул не прекращается никогда, поэтому достичь температуры 0 К (–273 °С) невозможно.
Абсолютный нижний предел температуры, при котором движение молекул и атомов должно прекратиться, называют абсолютным нулем температуры. Давление p газа полностью определяется его абсолютной температурой T и концентрацией n молекул газа: p=nkT (2).
Выводы:
- Физическая величина, характеризующая состояние теплового равновесия макроскопической системы, называется температурой. Абсолютный нижний предел температуры, при котором движение молекул и атомов должно прекратиться, называют абсолютным нулем температуры. Шкала, за нулевую точку которой взят абсолютный нуль температуры, называется абсолютной шкалой температур (шкалой Кельвина). Единица абсолютной температуры — кельвин (К) — основная единица СИ. Температуры по шкале Кельвина и Цельсия связаны соотношением: T=t + 273; t=T – 273.
- Средняя кинетическая энергия поступательного движения молекул идеального газа прямо пропорциональна абсолютной температуре, а давление газа определяется абсолютной температурой и концентрацией молекул газа:
— постоянная Больцмана.
- Парообразование и конденсация
- Тепловое равновесие в физике
- Изопроцессы в физике
- Твердые тела и их свойства в физике
- Механизмы, работающие на основе правила моментов
- Идеальный газ в физике
- Уравнение МКТ идеального газа
- Уравнение состояния идеального газа
Температура
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: тепловое равновесие, абсолютная температура.
Мы часто используем слово «температура» в повседневной речи. А что такое температура? В данной статье мы объясним физический смысл этого понятия.
В молекулярной физике и термодинамике рассматриваются макроскопические тела, т. е. тела, состоящие из огромного числа частиц. Например, в стакане воды содержится порядка молекул. Такое грандиозное число с трудом поддаётся осмыслению.
Термодинамическая система
Термодинамической системой называется макроскопическое тело или система тел, которые могут взаимодействовать друг с другом и с окружающими телами. Стакан с водой — пример термодинамической системы.
Термодинамическая система состоит из столь большого числа частиц, что совершенно невозможно описывать её поведение путём рассмотрения движения каждой молекулы в отдельности. Однако именно грандиозность числа молекул делает ненужным такое описание.
Оказывается, что состояние термодинамической системы можно характеризовать небольшим числом макроскопических параметров — величин, относящимся к системе в целом, а не к отдельным атомам или молекулам. Такими макроскопическими параметрами являются давление, объём, температура, плотность, теплоёмкость, удельное сопротивление и др.
Состояние термодинамической системы, при котором все макроскопические параметры остаются неизменными с течением времени, называется тепловым равновесием. В состоянии теплового равновесия прекращаются все макроскопические процессы: диффузия, теплопередача, фазовые переходы химические реакции и т. д.(Следует отметить, что тепловое равновесие является динамическим равновесием. Так, при тепловом равновесии жидкости и её насыщенного пара весьма интенсивно идут взаимные превращения жидкости и пара. Но это — процессы молекулярного масштаба, они происходят с одинаковыми скоростями и компенсируют друг друга. На макроскопическом уровне количество жидкости и пара со временем не меняется).
Термодинамическая система называется изолированной, если она не может обмениваться энергией с окружающими телами. Чай в термосе — типичный пример изолированной системы.
Тепловое равновесие
Фундаментальный постулат, вытекающий из многочисленных опытных данных, гласит: каково бы ни было начальное состояние тел изолированной системы, со временем в ней устанавливается тепловое равновесие. Таким образом, тепловое равновесие — это состояние, в которое любая система, изолированная от окружающей среды, самопроизвольно переходит через достаточно большой промежуток времени.
Температура как раз и является величиной, характеризующей состояние теплового равновесия термодинамической системы.
Температура — это макроскопический параметр, значения которого одинаковы для всех частей термодинамической системы, находящейся в состоянии теплового равновесия. Попросту говоря, температура — это то, что является одинаковым для любых двух тел, которые находятся в тепловом равновесии друг с другом. При тепловом контакте тел с одинаковыми температурами между ними не будет происходить обмен энергией (теплообмен).
В общем же случае при установлении между телами теплового контакта теплообмен начнётся. Говорят, что тело, которое отдаёт энергию, имеет более высокую температуру, а тело, которое получает энергию — более низкую температуру. Температура, таким образом, указывает направление теплообмена между телами. В процессе теплообмена температура первого тела начнёт уменьшаться, температура второго тела — увеличиваться; при выравнивании температур теплообмен прекратится — наступит тепловое равновесие.
Особенность температуры заключается в том, что она не аддитивна: температура тела не равна сумме температур его частей. Этим температура отличается от таких физических величин, как масса, длина или объём. И по этой причине температуру нельзя измерить путём сравнения с эталоном.
Измеряют температуру с помощью термометра.
Для создания термометра выбирают какое-либо вещество (термометрическое вещество), какую-либо характеристику этого вещества (термометрическую величину), и используют зависимость термометрической величины от температуры. При этом выбор термометрического вещества и термометрической величины может быть весьма произвольным.
Так, в бытовых жидкостных термометрах термометрическим веществом является ртуть (или спирт), а термометрической величиной — длина столбика жидкости. Здесь используется линейная зависимость объёма жидкости от температуры.
В идеально-газовых термометрах используется линейная зависимость давления разреженного газа (близкого по своим свойствам к идеальному) от температуры.
Действие электрических термометров (термометров сопротивления) основано на температурной зависимости сопротивления чистых металлов, сплавов и полупроводников.
В процессе измерения температуры термометр приводится в тепловой контакт(В области температур выше (раскалённые газы, расплавленные металлы) используются бесконтактные высокотемпературные термометры — пирометры. Их действие основано на измерении интенсивности теплового излучения в оптическом диапазоне.) с телом, температура которого определяется. Показания термометра после наступления теплового равновесия — это и есть температура тела. При этом термометр показывает свою температуру!
Температурная шкала. Абсолютная температура
При установлении единицы температуры чаще всего поступают следующим образом. Берут две температуры (так называемые реперные точки) — температуру таяния льда и температуру кипения воды при нормальном атмосферном давлении. Первой температуре приписывают значение , второй — значение
, а интервал между ними делят на
равных частей. Каждую из частей называют градусом (обозначают
), а полученную таким образом температурную шкалу — шкалой Цельсия.
При измерениях по шкале Цельсия с помощью жидкостных термометров возникает одна трудность: разные жидкости при изменении температуры изменяют свой объём по-разному. Поэтому два термометра с различными жидкостями, приведённые в тепловой контакт с одним и тем же телом, могут показать разные температуры. От данного недостатка свободны идеально-газовые термометры — зависимость давления разреженного газа от температуры не зависит от вещества самого газа.
Кроме того, для температурной шкалы идеально-газового термометра существует естественное начало отсчёта (исчезает произвол выбора реперной точки!): это та предельно низкая температура, при которой давление идеального газа постоянного объёма обращается в нуль. Эта температура называется абсолютным нулём температур.
Температурная шкала, началом отсчёта которой является абсолютный нуль, а единицей температуры — градус Цельсия, называется абсолютной температурной шкалой.
Температура, измеряемая по абсолютной шкале, называется абсолютной температурой и обозначается буквой . Единица абсолютной температуры называется кельвином (
).
Абсолютному нулю () соответствует температура
. Поэтому связь абсолютной температуры и температуры по шкале Цельсия даётся формулой:
В задачах достаточно использовать формулу
Благодарим за то, что пользуйтесь нашими материалами.
Информация на странице «Температура» подготовлена нашими авторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать необходимые и поступить в ВУЗ или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из данного раздела.
Публикация обновлена:
08.05.2023
Когда в физике изучают тот или иной закон или когда рассматривают свойства тела или системы, то всегда говорят об условиях, в которых этот закон выполняется, а свойства проявляются. В данной статье рассмотрим подробнее вопрос, что значит нормальные условия в физике.
Температура и давление
Абсолютная температура, описывающая кинетическую энергию составляющих систему частиц, и давление, отражающее силовое воздействие тел друг на друга, являются двумя основными физическими величинами, которые в большинстве случаев определяют свойства тел.
Действительно, например, расширение металлических предметов определяется их температурой, кипение воды и ее замерзание также зависит от этой физической величины. В общем случае можно сказать, что кинетическая энергия частиц системы определяет интенсивность протекания любых физических процессов. В физике температуру принято использовать в единицах абсолютной шкалы, то есть в кельвинах. С привычными градусами Цельсия кельвины связаны так:
T(K) = 273,15 + T(oC)
Давление — еще одна важная величина, от которой уже зависят такие свойства, как температура кипения и точка выпадения росы, расстояние между частицами в газах и возможность использования идеальной модели для их описания. Давление выражается в паскалях в системе СИ. Напомним, что на уровне моря давление на нашей планете составляет 101325 паскалей.
Нормальные условия в физике
Теперь вернемся к теме статьи. Если отвечать кратко на вопрос, что такое нормальные условия в физике, то следует привести всего две цифры — это температура 273,15 кельвина и давление 105 паскалей. Разберемся, чем же так важны эти значения, что их совокупность образует целый физический термин.
Если посмотреть на записанную в предыдущем пункте формулу, то можно понять, что температура 273,15 К равна 0 oC. Прежде всего эта температура важна человеку потому, что при ней чистая вода замерзает, а лед плавится. То есть она является точкой равновесия процессов кристаллизация-плавление самой важной для нашей жизни жидкости.
Давление 105, или 100 тысяч паскалей — это значение выбрано в качестве нормальных условий в физике, потому что оно близко к одной атмосфере, и его, как круглое число, удобно использовать в расчетах.
Иногда можно увидеть в задачах термин «стандартные условия». Это означает, что следует взять давление не 105, а точнее — 101325. Температура при стандартных условиях остается той же, что при нормальных (в некоторых случаях ее по ошибке выбирают равной 298 К).
Важность нормальных условий для газов
Использование понятия нормальных условий в физике для газов является ключевым в выборе модели для описания систем, находящихся в указанном агрегатном состоянии. Дело в том, что газы, имеющие температуру выше 0 oC, и давление меньше одной атмосферы, можно описывать на основе идеальной модели молекулярно-кинетической теории. Основным результатом этой модели является уравнение состояния идеального газа, которое известно, как закон Клапейрона-Менделеева.
Если же температура газа намного ниже указанного значения, а давление в нем намного выше одной атмосферы, то следует описывать такую систему с помощью модели реальных газов и применять уравнение Ван-дер-Ваальса.
Таким образом, нормальные условия в физике газов являются ориентировочной границей использования физических моделей описания термодинамических систем.

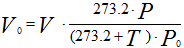
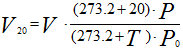
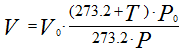
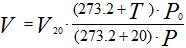


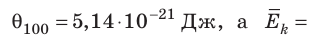
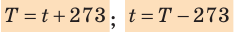
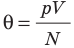 соотношением θ = kT, где k — постоянная Больцмана — коэффициент пропорциональности, не зависящий ни от температуры, ни от состава и количества газа:
соотношением θ = kT, где k — постоянная Больцмана — коэффициент пропорциональности, не зависящий ни от температуры, ни от состава и количества газа: 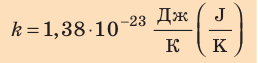
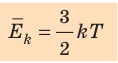 (1) То есть, если газ охладить до температуры T= 0 К, движение его молекул должно прекратиться (
(1) То есть, если газ охладить до температуры T= 0 К, движение его молекул должно прекратиться (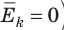 ). Таким образом, нулевая точка шкалы Кельвина — это самая низкая теоретически возможная температура. На самом деле движение молекул не прекращается никогда, поэтому достичь температуры 0 К (–273 °С) невозможно.
). Таким образом, нулевая точка шкалы Кельвина — это самая низкая теоретически возможная температура. На самом деле движение молекул не прекращается никогда, поэтому достичь температуры 0 К (–273 °С) невозможно.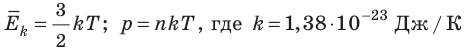 — постоянная Больцмана.
— постоянная Больцмана.