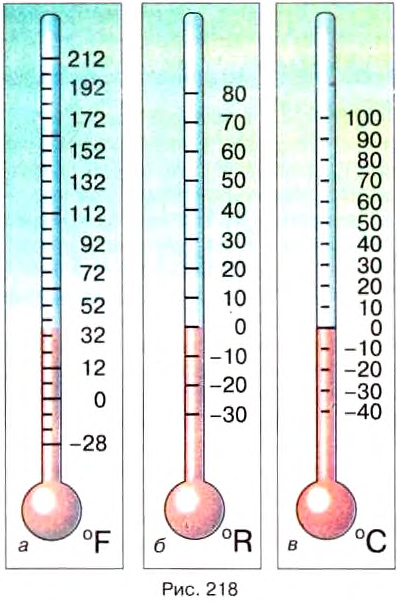
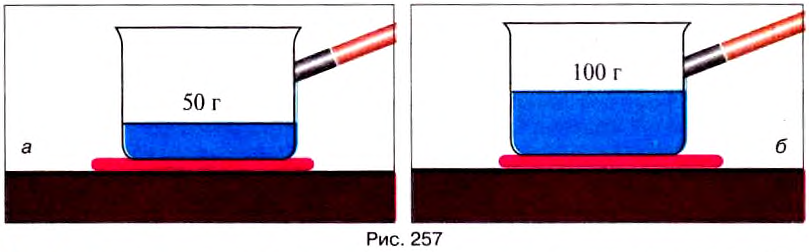
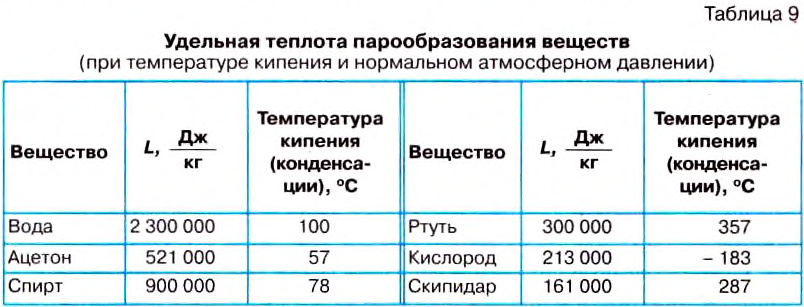
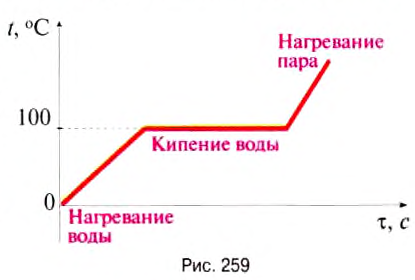
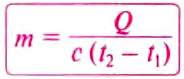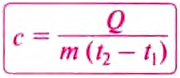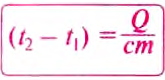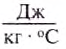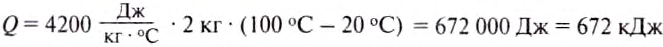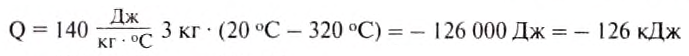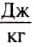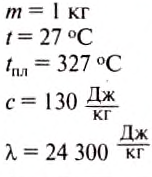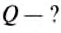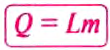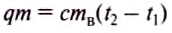| Temperature | |
|---|---|

Thermal vibration of a segment of protein alpha helix. Its amplitude increases with temperature |
|
|
Common symbols |
T |
| SI unit | K |
|
Other units |
°C, °F, °R, °Rø, °Ré, °N, °D, °L, °W |
| Intensive? | Yes |
|
Derivations from |
 , ,  |
| Dimension |  |
Temperature is a physical quantity that expresses quantitatively the perceptions of hotness and coldness. Temperature is measured with a thermometer.
Thermometers are calibrated in various temperature scales that historically have relied on various reference points and thermometric substances for definition. The most common scales are the Celsius scale with the unit symbol °C (formerly called centigrade), the Fahrenheit scale (°F), and the Kelvin scale (K), the latter being used predominantly for scientific purposes. The kelvin is one of the seven base units in the International System of Units (SI).
Absolute zero, i.e., zero kelvin or −273.15 °C, is the lowest point in the thermodynamic temperature scale. Experimentally, it can be approached very closely but not actually reached, as recognized in the third law of thermodynamics. It would be impossible to extract energy as heat from a body at that temperature.
Temperature is important in all fields of natural science, including physics, chemistry, Earth science, astronomy, medicine, biology, ecology, material science, metallurgy, mechanical engineering and geography as well as most aspects of daily life.
Effects[edit]
Average daily variation in human body temperature
Many physical processes are related to temperature; some of them are given below:
- the physical properties of materials including the phase (solid, liquid, gaseous or plasma), density, solubility, vapor pressure, electrical conductivity, hardness, wear resistance, thermal conductivity, corrosion resistance, strength
- the rate and extent to which chemical reactions occur[1]
- the amount and properties of thermal radiation emitted from the surface of an object
- air temperature affects all living organisms
- the speed of sound, which in a gas is proportional to the square root of the absolute temperature[2]
Scales[edit]
Two thermometers showing temperature in Celsius and Fahrenheit
Temperature scales need two values for definition: the point chosen as zero degrees and the magnitudes of the incremental unit of temperature.
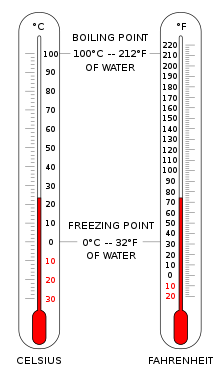
The Celsius scale (°C) is used for common temperature measurements in most of the world. It is an empirical scale that developed historically, which led to its zero point 0 °C being defined as the freezing point of water, and 100 °C as the boiling point of water, both at atmospheric pressure at sea level. It was called a centigrade scale because of the 100-degree interval.[3] Since the standardization of the kelvin in the International System of Units, it has subsequently been redefined in terms of the equivalent fixing points on the Kelvin scale, so that a temperature increment of one degree Celsius is the same as an increment of one kelvin, though numerically the scales differ by an exact offset of 273.15.
The Fahrenheit scale is in common use in the United States. Water freezes at 32 °F and boils at 212 °F at sea-level atmospheric pressure.
Absolute zero[edit]
At the absolute zero of temperature, no energy can be removed from matter as heat, a fact expressed in the third law of thermodynamics. At this temperature, matter contains no macroscopic thermal energy, but still has quantum-mechanical zero-point energy as predicted by the uncertainty principle, although this does not enter into the definition of absolute temperature. Experimentally, absolute zero can be approached only very closely; it can never be reached (the lowest temperature attained by experiment is 38 pK).[4] Theoretically, in a body at a temperature of absolute zero, all classical motion of its particles has ceased and they are at complete rest in this classical sense. The absolute zero, defined as 0 K, is exactly equal to −273.15 °C, or −459.67 °F.
Absolute scales[edit]
Referring to the Boltzmann constant, to the Maxwell–Boltzmann distribution, and to the Boltzmann statistical mechanical definition of entropy, as distinct from the Gibbs definition,[5] for independently moving microscopic particles, disregarding interparticle potential energy, by international agreement, a temperature scale is defined and said to be absolute because it is independent of the characteristics of particular thermometric substances and thermometer mechanisms. Apart from the absolute zero, it does not have a reference temperature. It is known as the Kelvin scale, widely used in science and technology. The kelvin (the unit name is spelled with a lower-case ‘k’) is the unit of temperature in the International System of Units (SI). The temperature of a body in a state of thermodynamic equilibrium is always positive relative to the absolute zero.
Besides the internationally agreed Kelvin scale, there is also a thermodynamic temperature scale, invented by Lord Kelvin, also with its numerical zero at the absolute zero of temperature, but directly relating to purely macroscopic thermodynamic concepts, including the macroscopic entropy, though microscopically referable to the Gibbs statistical mechanical definition of entropy for the canonical ensemble, that takes interparticle potential energy into account, as well as independent particle motion so that it can account for measurements of temperatures near absolute zero.[5] This scale has a reference temperature at the triple point of water, the numerical value of which is defined by measurements using the aforementioned internationally agreed Kelvin scale.
Kelvin scale[edit]
Many scientific measurements use the Kelvin temperature scale (unit symbol: K), named in honor of the physicist who first defined it. It is an absolute scale. Its numerical zero point, 0 K, is at the absolute zero of temperature. Since May, 2019, the kelvin has been defined through particle kinetic theory, and statistical mechanics. In the International System of Units (SI), the magnitude of the kelvin is defined in terms of the Boltzmann constant, the value of which is defined as fixed by international convention.[6][7]
Statistical mechanical versus thermodynamic temperature scales[edit]
Since May 2019, the magnitude of the kelvin is defined in relation to microscopic phenomena, characterized in terms of statistical mechanics. Previously, but since 1954, the International System of Units defined a scale and unit for the kelvin as a thermodynamic temperature, by using the reliably reproducible temperature of the triple point of water as a second reference point, the first reference point being 0 K at absolute zero.[citation needed]
Historically, the temperature of the triple point of water was defined as exactly 273.16 K. Today it is an empirically measured quantity. The freezing point of water at sea-level atmospheric pressure occurs at very close to 273.15 K (0 °C).
Classification of scales[edit]
There are various kinds of temperature scale. It may be convenient to classify them as empirically and theoretically based. Empirical temperature scales are historically older, while theoretically based scales arose in the middle of the nineteenth century.[8][9]
Empirical scales[edit]
Empirically based temperature scales rely directly on measurements of simple macroscopic physical properties of materials. For example, the length of a column of mercury, confined in a glass-walled capillary tube, is dependent largely on temperature and is the basis of the very useful mercury-in-glass thermometer. Such scales are valid only within convenient ranges of temperature. For example, above the boiling point of mercury, a mercury-in-glass thermometer is impracticable. Most materials expand with temperature increase, but some materials, such as water, contract with temperature increase over some specific range, and then they are hardly useful as thermometric materials. A material is of no use as a thermometer near one of its phase-change temperatures, for example, its boiling-point.
In spite of these limitations, most generally used practical thermometers are of the empirically based kind. Especially, it was used for calorimetry, which contributed greatly to the discovery of thermodynamics. Nevertheless, empirical thermometry has serious drawbacks when judged as a basis for theoretical physics. Empirically based thermometers, beyond their base as simple direct measurements of ordinary physical properties of thermometric materials, can be re-calibrated, by use of theoretical physical reasoning, and this can extend their range of adequacy.
Theoretical scales[edit]
Theoretically based temperature scales are based directly on theoretical arguments, especially those of kinetic theory and thermodynamics. They are more or less ideally realized in practically feasible physical devices and materials. Theoretically based temperature scales are used to provide calibrating standards for practical empirically based thermometers.
Microscopic statistical mechanical scale[edit]
In physics, the internationally agreed conventional temperature scale is called the Kelvin scale. It is calibrated through the internationally agreed and prescribed value of the Boltzmann constant,[6][7] referring to motions of microscopic particles, such as atoms, molecules, and electrons, constituent in the body whose temperature is to be measured. In contrast with the thermodynamic temperature scale invented by Kelvin, the presently conventional Kelvin temperature is not defined through comparison with the temperature of a reference state of a standard body, nor in terms of macroscopic thermodynamics.
Apart from the absolute zero of temperature, the Kelvin temperature of a body in a state of internal thermodynamic equilibrium is defined by measurements of suitably chosen of its physical properties, such as have precisely known theoretical explanations in terms of the Boltzmann constant.[citation needed] That constant refers to chosen kinds of motion of microscopic particles in the constitution of the body. In those kinds of motion, the particles move individually, without mutual interaction. Such motions are typically interrupted by inter-particle collisions, but for temperature measurement, the motions are chosen so that, between collisions, the non-interactive segments of their trajectories are known to be accessible to accurate measurement. For this purpose, interparticle potential energy is disregarded.
In an ideal gas, and in other theoretically understood bodies, the Kelvin temperature is defined to be proportional to the average kinetic energy of non-interactively moving microscopic particles, which can be measured by suitable techniques. The proportionality constant is a simple multiple of the Boltzmann constant. If molecules, atoms, or electrons,[10][11] are emitted from material and their velocities are measured, the spectrum of their velocities often nearly obeys a theoretical law called the Maxwell–Boltzmann distribution, which gives a well-founded measurement of temperatures for which the law holds.[12] There have not yet been successful experiments of this same kind that directly use the Fermi–Dirac distribution for thermometry, but perhaps that will be achieved in the future.[13]
The speed of sound in a gas can be calculated theoretically from the molecular character of the gas, from its temperature and pressure, and from the value of the Boltzmann constant. For a gas of known molecular character and pressure, this provides a relation between temperature and the Boltzmann constant. Those quantities can be known or measured more precisely than can the thermodynamic variables that define the state of a sample of water at its triple point. Consequently, taking the value of the Boltzmann constant as a primarily defined reference of exactly defined value, a measurement of the speed of sound can provide a more precise measurement of the temperature of the gas.[14]
Measurement of the spectrum of electromagnetic radiation from an ideal three-dimensional black body can provide an accurate temperature measurement because the frequency of maximum spectral radiance of black-body radiation is directly proportional to the temperature of the black body; this is known as Wien’s displacement law and has a theoretical explanation in Planck’s law and the Bose–Einstein law.
Measurement of the spectrum of noise-power produced by an electrical resistor can also provide accurate temperature measurement. The resistor has two terminals and is in effect a one-dimensional body. The Bose-Einstein law for this case indicates that the noise-power is directly proportional to the temperature of the resistor and to the value of its resistance and to the noise bandwidth. In a given frequency band, the noise-power has equal contributions from every frequency and is called Johnson noise. If the value of the resistance is known then the temperature can be found.[15][16]
Macroscopic thermodynamic scale[edit]
Historically, till May 2019, the definition of the Kelvin scale was that invented by Kelvin, based on a ratio of quantities of energy in processes in an ideal Carnot engine, entirely in terms of macroscopic thermodynamics.[citation needed] That Carnot engine was to work between two temperatures, that of the body whose temperature was to be measured, and a reference, that of a body at the temperature of the triple point of water. Then the reference temperature, that of the triple point, was defined to be exactly 273.16 K. Since May 2019, that value has not been fixed by definition but is to be measured through microscopic phenomena, involving the Boltzmann constant, as described above. The microscopic statistical mechanical definition does not have a reference temperature.
Ideal gas[edit]
A material on which a macroscopically defined temperature scale may be based is the ideal gas. The pressure exerted by a fixed volume and mass of an ideal gas is directly proportional to its temperature. Some natural gases show so nearly ideal properties over suitable temperature range that they can be used for thermometry; this was important during the development of thermodynamics and is still of practical importance today.[17][18] The ideal gas thermometer is, however, not theoretically perfect for thermodynamics. This is because the entropy of an ideal gas at its absolute zero of temperature is not a positive semi-definite quantity, which puts the gas in violation of the third law of thermodynamics. In contrast to real materials, the ideal gas does not liquefy or solidify, no matter how cold it is. Alternatively thinking, the ideal gas law, refers to the limit of infinitely high temperature and zero pressure; these conditions guarantee non-interactive motions of the constituent molecules.[19][20][21]
Kinetic theory approach[edit]
The magnitude of the kelvin is now defined in terms of kinetic theory, derived from the value of the Boltzmann constant.
Kinetic theory provides a microscopic account of temperature for some bodies of material, especially gases, based on macroscopic systems’ being composed of many microscopic particles, such as molecules and ions of various species, the particles of a species being all alike. It explains macroscopic phenomena through the classical mechanics of the microscopic particles. The equipartition theorem of kinetic theory asserts that each classical degree of freedom of a freely moving particle has an average kinetic energy of kBT/2 where kB denotes the Boltzmann constant.[citation needed] The translational motion of the particle has three degrees of freedom, so that, except at very low temperatures where quantum effects predominate, the average translational kinetic energy of a freely moving particle in a system with temperature T will be 3kBT/2.
Molecules, such as oxygen (O2), have more degrees of freedom than single spherical atoms: they undergo rotational and vibrational motions as well as translations. Heating results in an increase of temperature due to an increase in the average translational kinetic energy of the molecules. Heating will also cause, through equipartitioning, the energy associated with vibrational and rotational modes to increase. Thus a diatomic gas will require more energy input to increase its temperature by a certain amount, i.e. it will have a greater heat capacity than a monatomic gas.
As noted above, the speed of sound in a gas can be calculated from the molecular character of the gas, from its temperature and pressure, and from the value of the Boltzmann constant. Taking the value of the Boltzmann constant as a primarily defined reference of exactly defined value, a measurement of the speed of sound can provide a more precise measurement of the temperature of the gas.[14]
It is possible to measure the average kinetic energy of constituent microscopic particles if they are allowed to escape from the bulk of the system, through a small hole in the containing wall. The spectrum of velocities has to be measured, and the average calculated from that. It is not necessarily the case that the particles that escape and are measured have the same velocity distribution as the particles that remain in the bulk of the system, but sometimes a good sample is possible.
Thermodynamic approach[edit]
Temperature is one of the principal quantities in the study of thermodynamics. Formerly, the magnitude of the kelvin was defined in thermodynamic terms, but nowadays, as mentioned above, it is defined in terms of kinetic theory.
The thermodynamic temperature is said to be absolute for two reasons. One is that its formal character is independent of the properties of particular materials. The other reason is that its zero is, in a sense, absolute, in that it indicates absence of microscopic classical motion of the constituent particles of matter, so that they have a limiting specific heat of zero for zero temperature, according to the third law of thermodynamics. Nevertheless, a thermodynamic temperature does in fact have a definite numerical value that has been arbitrarily chosen by tradition and is dependent on the property of particular materials; it is simply less arbitrary than relative «degrees» scales such as Celsius and Fahrenheit. Being an absolute scale with one fixed point (zero), there is only one degree of freedom left to arbitrary choice, rather than two as in relative scales. For the Kelvin scale since May 2019, by international convention, the choice has been made to use knowledge of modes of operation of various thermometric devices, relying on microscopic kinetic theories about molecular motion. The numerical scale is settled by a conventional definition of the value of the Boltzmann constant, which relates macroscopic temperature to average microscopic kinetic energy of particles such as molecules. Its numerical value is arbitrary, and an alternate, less widely used absolute temperature scale exists called the Rankine scale, made to be aligned with the Fahrenheit scale as Kelvin is with Celsius.
The thermodynamic definition of temperature is due to Kelvin. It is framed in terms of an idealized device called a Carnot engine, imagined to run in a fictive continuous cycle of successive processes that traverse a cycle of states of its working body. The engine takes in a quantity of heat Q1 from a hot reservoir and passes out a lesser quantity of waste heat Q2 < 0 to a cold reservoir. The net heat energy absorbed by the working body is passed, as thermodynamic work, to a work reservoir, and is considered to be the output of the engine. The cycle is imagined to run so slowly that at each point of the cycle the working body is in a state of thermodynamic equilibrium. The successive processes of the cycle are thus imagined to run reversibly with no entropy production. Then the quantity of entropy taken in from the hot reservoir when the working body is heated is equal to that passed to the cold reservoir when the working body is cooled. Then the absolute or thermodynamic temperatures, T1 and T2, of the reservoirs are defined such that[22]
-
(1)
The zeroth law of thermodynamics allows this definition to be used to measure the absolute or thermodynamic temperature of an arbitrary body of interest, by making the other heat reservoir have the same temperature as the body of interest.
Kelvin’s original work postulating absolute temperature was published in 1848. It was based on the work of Carnot, before the formulation of the first law of thermodynamics. Carnot had no sound understanding of heat and no specific concept of entropy. He wrote of ‘caloric’ and said that all the caloric that passed from the hot reservoir was passed into the cold reservoir. Kelvin wrote in his 1848 paper that his scale was absolute in the sense that it was defined «independently of the properties of any particular kind of matter». His definitive publication, which sets out the definition just stated, was printed in 1853, a paper read in 1851.[23][24][25][26]
Numerical details were formerly settled by making one of the heat reservoirs a cell at the triple point of water, which was defined to have an absolute temperature of 273.16 K.[27] Nowadays, the numerical value is instead obtained from measurement through the microscopic statistical mechanical international definition, as above.
Intensive variability[edit]
In thermodynamic terms, temperature is an intensive variable because it is equal to a differential coefficient of one extensive variable with respect to another, for a given body. It thus has the dimensions of a ratio of two extensive variables. In thermodynamics, two bodies are often considered as connected by contact with a common wall, which has some specific permeability properties. Such specific permeability can be referred to a specific intensive variable. An example is a diathermic wall that is permeable only to heat; the intensive variable for this case is temperature. When the two bodies have been connected through the specifically permeable wall for a very long time, and have settled to a permanent steady state, the relevant intensive variables are equal in the two bodies; for a diathermal wall, this statement is sometimes called the zeroth law of thermodynamics.[28][29][30]
In particular, when the body is described by stating its internal energy U, an extensive variable, as a function of its entropy S, also an extensive variable, and other state variables V, N, with U = U (S, V, N), then the temperature is equal to the partial derivative of the internal energy with respect to the entropy:[29][30][31]
-
(2)
Likewise, when the body is described by stating its entropy S as a function of its internal energy U, and other state variables V, N, with S = S (U, V, N), then the reciprocal of the temperature is equal to the partial derivative of the entropy with respect to the internal energy:[29][31][32]
-
(3)
The above definition, equation (1), of the absolute temperature, is due to Kelvin. It refers to systems closed to the transfer of matter and has a special emphasis on directly experimental procedures. A presentation of thermodynamics by Gibbs starts at a more abstract level and deals with systems open to the transfer of matter; in this development of thermodynamics, the equations (2) and (3) above are actually alternative definitions of temperature.[33]
Local thermodynamic equilibrium[edit]
Real-world bodies are often not in thermodynamic equilibrium and not homogeneous. For the study by methods of classical irreversible thermodynamics, a body is usually spatially and temporally divided conceptually into ‘cells’ of small size. If classical thermodynamic equilibrium conditions for matter are fulfilled to good approximation in such a ‘cell’, then it is homogeneous and a temperature exists for it. If this is so for every ‘cell’ of the body, then local thermodynamic equilibrium is said to prevail throughout the body.[34][35][36][37][38]
It makes good sense, for example, to say of the extensive variable U, or of the extensive variable S, that it has a density per unit volume or a quantity per unit mass of the system, but it makes no sense to speak of the density of temperature per unit volume or quantity of temperature per unit mass of the system. On the other hand, it makes no sense to speak of the internal energy at a point, while when local thermodynamic equilibrium prevails, it makes good sense to speak of the temperature at a point. Consequently, the temperature can vary from point to point in a medium that is not in global thermodynamic equilibrium, but in which there is local thermodynamic equilibrium.
Thus, when local thermodynamic equilibrium prevails in a body, the temperature can be regarded as a spatially varying local property in that body, and this is because the temperature is an intensive variable.
Basic theory[edit]
Temperature is a measure of a quality of a state of a material.[39] The quality may be regarded as a more abstract entity than any particular temperature scale that measures it, and is called hotness by some writers.[40][41][42] The quality of hotness refers to the state of material only in a particular locality, and in general, apart from bodies held in a steady state of thermodynamic equilibrium, hotness varies from place to place. It is not necessarily the case that a material in a particular place is in a state that is steady and nearly homogeneous enough to allow it to have a well-defined hotness or temperature. Hotness may be represented abstractly as a one-dimensional manifold. Every valid temperature scale has its own one-to-one map into the hotness manifold.[43][44]
When two systems in thermal contact are at the same temperature no heat transfers between them. When a temperature difference does exist heat flows spontaneously from the warmer system to the colder system until they are in thermal equilibrium. Such heat transfer occurs by conduction or by thermal radiation.[45][46][47][48][49][50][51][52]
Experimental physicists, for example Galileo and Newton,[53] found that there are indefinitely many empirical temperature scales. Nevertheless, the zeroth law of thermodynamics says that they all measure the same quality. This means that for a body in its own state of internal thermodynamic equilibrium, every correctly calibrated thermometer, of whatever kind, that measures the temperature of the body, records one and the same temperature. For a body that is not in its own state of internal thermodynamic equilibrium, different thermometers can record different temperatures, depending respectively on the mechanisms of operation of the thermometers.
Bodies in thermodynamic equilibrium[edit]
For experimental physics, hotness means that, when comparing any two given bodies in their respective separate thermodynamic equilibria, any two suitably given empirical thermometers with numerical scale readings will agree as to which is the hotter of the two given bodies, or that they have the same temperature.[54] This does not require the two thermometers to have a linear relation between their numerical scale readings, but it does require that the relation between their numerical readings shall be strictly monotonic.[55][56] A definite sense of greater hotness can be had, independently of calorimetry, of thermodynamics, and of properties of particular materials, from Wien’s displacement law of thermal radiation: the temperature of a bath of thermal radiation is proportional, by a universal constant, to the frequency of the maximum of its frequency spectrum; this frequency is always positive, but can have values that tend to zero. Thermal radiation is initially defined for a cavity in thermodynamic equilibrium. These physical facts justify a mathematical statement that hotness exists on an ordered one-dimensional manifold. This is a fundamental character of temperature and thermometers for bodies in their own thermodynamic equilibrium.[8][43][44][57][58]
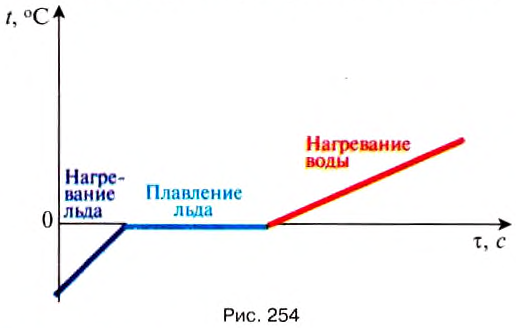
Except for a system undergoing a first-order phase change such as the melting of ice, as a closed system receives heat, without a change in its volume and without a change in external force fields acting on it, its temperature rises. For a system undergoing such a phase change so slowly that departure from thermodynamic equilibrium can be neglected, its temperature remains constant as the system is supplied with latent heat. Conversely, a loss of heat from a closed system, without phase change, without change of volume, and without a change in external force fields acting on it, decreases its temperature.[59]
Bodies in a steady state but not in thermodynamic equilibrium[edit]
While for bodies in their own thermodynamic equilibrium states, the notion of temperature requires that all empirical thermometers must agree as to which of two bodies is the hotter or that they are at the same temperature, this requirement is not safe for bodies that are in steady states though not in thermodynamic equilibrium. It can then well be that different empirical thermometers disagree about which is hotter, and if this is so, then at least one of the bodies does not have a well-defined absolute thermodynamic temperature. Nevertheless, any one given body and any one suitable empirical thermometer can still support notions of empirical, non-absolute, hotness, and temperature, for a suitable range of processes. This is a matter for study in non-equilibrium thermodynamics.[citation needed]
Bodies not in a steady state[edit]
When a body is not in a steady-state, then the notion of temperature becomes even less safe than for a body in a steady state not in thermodynamic equilibrium. This is also a matter for study in non-equilibrium thermodynamics.
Thermodynamic equilibrium axiomatics[edit]
For the axiomatic treatment of thermodynamic equilibrium, since the 1930s, it has become customary to refer to a zeroth law of thermodynamics. The customarily stated minimalist version of such a law postulates only that all bodies, which when thermally connected would be in thermal equilibrium, should be said to have the same temperature by definition, but by itself does not establish temperature as a quantity expressed as a real number on a scale. A more physically informative version of such a law views empirical temperature as a chart on a hotness manifold.[43][58][60] While the zeroth law permits the definitions of many different empirical scales of temperature, the second law of thermodynamics selects the definition of a single preferred, absolute temperature, unique up to an arbitrary scale factor, whence called the thermodynamic temperature.[8][43][61][62][63][64] If internal energy is considered as a function of the volume and entropy of a homogeneous system in thermodynamic equilibrium, thermodynamic absolute temperature appears as the partial derivative of internal energy with respect the entropy at constant volume. Its natural, intrinsic origin or null point is absolute zero at which the entropy of any system is at a minimum. Although this is the lowest absolute temperature described by the model, the third law of thermodynamics postulates that absolute zero cannot be attained by any physical system.
Heat capacity[edit]
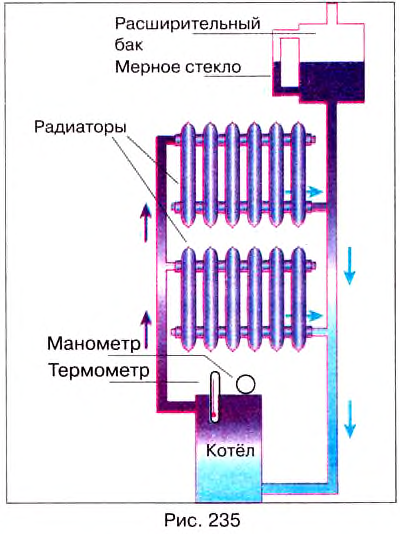
When an energy transfer to or from a body is only as heat, the state of the body changes. Depending on the surroundings and the walls separating them from the body, various changes are possible in the body. They include chemical reactions, increase of pressure, increase of temperature and phase change. For each kind of change under specified conditions, the heat capacity is the ratio of the quantity of heat transferred to the magnitude of the change.[65]
For example, if the change is an increase in temperature at constant volume, with no phase change and no chemical change, then the temperature of the body rises and its pressure increases. The quantity of heat transferred, ΔQ, divided by the observed temperature change, ΔT, is the body’s heat capacity at constant volume:
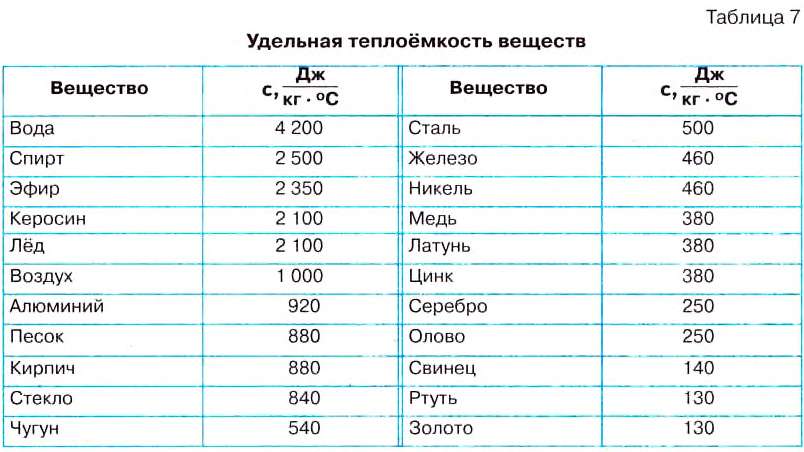
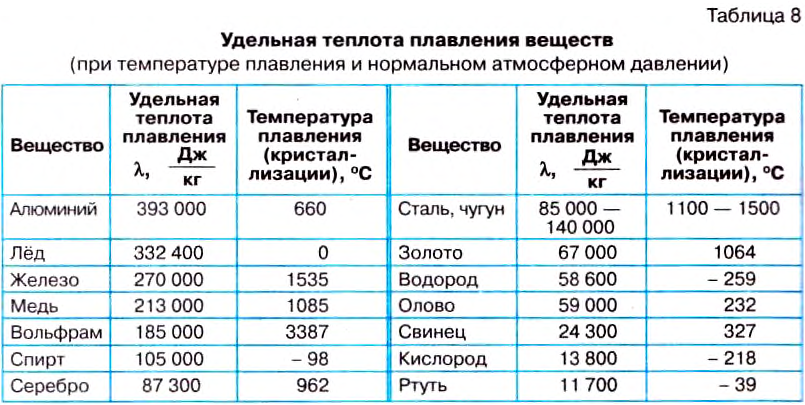
If heat capacity is measured for a well-defined amount of substance, the specific heat is the measure of the heat required to increase the temperature of such a unit quantity by one unit of temperature. For example, raising the temperature of water by one kelvin (equal to one degree Celsius) requires 4186 joules per kilogram (J/kg).
Measurement[edit]
A typical Celsius thermometer measures a winter day temperature of −17 °C
Temperature measurement using modern scientific thermometers and temperature scales goes back at least as far as the early 18th century, when Daniel Gabriel Fahrenheit adapted a thermometer (switching to mercury) and a scale both developed by Ole Christensen Rømer. Fahrenheit’s scale is still in use in the United States for non-scientific applications.
Temperature is measured with thermometers that may be calibrated to a variety of temperature scales. In most of the world (except for Belize, Myanmar, Liberia and the United States), the Celsius scale is used for most temperature measuring purposes. Most scientists measure temperature using the Celsius scale and thermodynamic temperature using the Kelvin scale, which is the Celsius scale offset so that its null point is 0 K = −273.15 °C, or absolute zero. Many engineering fields in the US, notably high-tech and US federal specifications (civil and military), also use the Kelvin and Celsius scales. Other engineering fields in the US also rely upon the Rankine scale (a shifted Fahrenheit scale) when working in thermodynamic-related disciplines such as combustion.
Units[edit]
The basic unit of temperature in the International System of Units (SI) is the kelvin. It has the symbol K.
For everyday applications, it is often convenient to use the Celsius scale, in which 0 °C corresponds very closely to the freezing point of water and 100 °C is its boiling point at sea level. Because liquid droplets commonly exist in clouds at sub-zero temperatures, 0 °C is better defined as the melting point of ice. In this scale, a temperature difference of 1 degree Celsius is the same as a 1kelvin increment, but the scale is offset by the temperature at which ice melts (273.15 K).
By international agreement,[66] until May 2019, the Kelvin and Celsius scales were defined by two fixing points: absolute zero and the triple point of Vienna Standard Mean Ocean Water, which is water specially prepared with a specified blend of hydrogen and oxygen isotopes. Absolute zero was defined as precisely 0 K and −273.15 °C. It is the temperature at which all classical translational motion of the particles comprising matter ceases and they are at complete rest in the classical model. Quantum-mechanically, however, zero-point motion remains and has an associated energy, the zero-point energy. Matter is in its ground state,[67] and contains no thermal energy. The temperatures 273.16 K and 0.01 °C were defined as those of the triple point of water. This definition served the following purposes: it fixed the magnitude of the kelvin as being precisely 1 part in 273.16 parts of the difference between absolute zero and the triple point of water; it established that one kelvin has precisely the same magnitude as one degree on the Celsius scale; and it established the difference between the null points of these scales as being 273.15 K (0 K = −273.15 °C and 273.16 K = 0.01 °C). Since 2019, there has been a new definition based on the Boltzmann constant,[68] but the scales are scarcely changed.
In the United States, the Fahrenheit scale is the most widely used. On this scale the freezing point of water corresponds to 32 °F and the boiling point to 212 °F. The Rankine scale, still used in fields of chemical engineering in the US, is an absolute scale based on the Fahrenheit increment.
Historical scales[edit]
The following temperature scales are in use or have historically been used for measuring temperature:
- Kelvin scale
- Celsius scale
- Fahrenheit scale
- Rankine scale
- Delisle scale
- Newton scale
- Réaumur scale
- Rømer scale
Plasma physics[edit]
The field of plasma physics deals with phenomena of electromagnetic nature that involve very high temperatures. It is customary to express temperature as energy in a unit related to the electronvolt or kiloelectronvolt (eV/kB or keV/kB). The corresponding energy, which is dimensionally distinct from temperature, is then calculated as the product of the Boltzmann constant and temperature, 
Theoretical foundation[edit]
Historically, there are several scientific approaches to the explanation of temperature: the classical thermodynamic description based on macroscopic empirical variables that can be measured in a laboratory; the kinetic theory of gases which relates the macroscopic description to the probability distribution of the energy of motion of gas particles; and a microscopic explanation based on statistical physics and quantum mechanics. In addition, rigorous and purely mathematical treatments have provided an axiomatic approach to classical thermodynamics and temperature.[69] Statistical physics provides a deeper understanding by describing the atomic behavior of matter and derives macroscopic properties from statistical averages of microscopic states, including both classical and quantum states. In the fundamental physical description, the temperature may be measured directly in units of energy. However, in the practical systems of measurement for science, technology, and commerce, such as the modern metric system of units, the macroscopic and the microscopic descriptions are interrelated by the Boltzmann constant, a proportionality factor that scales temperature to the microscopic mean kinetic energy.
The microscopic description in statistical mechanics is based on a model that analyzes a system into its fundamental particles of matter or into a set of classical or quantum-mechanical oscillators and considers the system as a statistical ensemble of microstates. As a collection of classical material particles, the temperature is a measure of the mean energy of motion, called translational kinetic energy, of the particles, whether in solids, liquids, gases, or plasmas. The kinetic energy, a concept of classical mechanics, is half the mass of a particle times its speed squared. In this mechanical interpretation of thermal motion, the kinetic energies of material particles may reside in the velocity of the particles of their translational or vibrational motion or in the inertia of their rotational modes. In monatomic perfect gases and, approximately, in most gas and in simple metals, the temperature is a measure of the mean particle translational kinetic energy, 3/2 kBT. It also determines the probability distribution function of energy. In condensed matter, and particularly in solids, this purely mechanical description is often less useful and the oscillator model provides a better description to account for quantum mechanical phenomena. Temperature determines the statistical occupation of the microstates of the ensemble. The microscopic definition of temperature is only meaningful in the thermodynamic limit, meaning for large ensembles of states or particles, to fulfill the requirements of the statistical model.
Kinetic energy is also considered as a component of thermal energy. The thermal energy may be partitioned into independent components attributed to the degrees of freedom of the particles or to the modes of oscillators in a thermodynamic system. In general, the number of these degrees of freedom that are available for the equipartitioning of energy depends on the temperature, i.e. the energy region of the interactions under consideration. For solids, the thermal energy is associated primarily with the vibrations of its atoms or molecules about their equilibrium position. In an ideal monatomic gas, the kinetic energy is found exclusively in the purely translational motions of the particles. In other systems, vibrational and rotational motions also contribute degrees of freedom.
Kinetic theory of gases[edit]
A theoretical understanding of temperature in a hard-sphere model of a gas can be obtained from the Kinetic theory.
Maxwell and Boltzmann developed a kinetic theory that yields a fundamental understanding of temperature in gases.[70]
This theory also explains the ideal gas law and the observed heat capacity of monatomic (or ‘noble’) gases.[71][72][73]
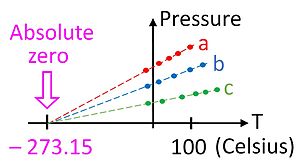
Plots of pressure vs temperature for three different gas samples extrapolated to absolute zero
The ideal gas law is based on observed empirical relationships between pressure (p), volume (V), and temperature (T), and was recognized long before the kinetic theory of gases was developed (see Boyle’s and Charles’s laws). The ideal gas law states:[74]
where n is the number of moles of gas and R = 8.314462618… J⋅mol−1⋅K−1[75] is the gas constant.
This relationship gives us our first hint that there is an absolute zero on the temperature scale, because it only holds if the temperature is measured on an absolute scale such as Kelvin’s. The ideal gas law allows one to measure temperature on this absolute scale using the gas thermometer. The temperature in kelvins can be defined as the pressure in pascals of one mole of gas in a container of one cubic meter, divided by the gas constant.
Although it is not a particularly convenient device, the gas thermometer provides an essential theoretical basis by which all thermometers can be calibrated. As a practical matter, it is not possible to use a gas thermometer to measure absolute zero temperature since the gases condense into a liquid long before the temperature reaches zero. It is possible, however, to extrapolate to absolute zero by using the ideal gas law, as shown in the figure.
The kinetic theory assumes that pressure is caused by the force associated with individual atoms striking the walls, and that all energy is translational kinetic energy. Using a sophisticated symmetry argument,[76] Boltzmann deduced what is now called the Maxwell–Boltzmann probability distribution function for the velocity of particles in an ideal gas. From that probability distribution function, the average kinetic energy (per particle) of a monatomic ideal gas is[72][77]
where the Boltzmann constant kB is the ideal gas constant divided by the Avogadro number, and 
Zeroth law of thermodynamics[edit]
When two otherwise isolated bodies are connected together by a rigid physical path impermeable to matter, there is the spontaneous transfer of energy as heat from the hotter to the colder of them. Eventually, they reach a state of mutual thermal equilibrium, in which heat transfer has ceased, and the bodies’ respective state variables have settled to become unchanging.[79][80][81]
One statement of the zeroth law of thermodynamics is that if two systems are each in thermal equilibrium with a third system, then they are also in thermal equilibrium with each other.[82][83][84]
This statement helps to define temperature but it does not, by itself, complete the definition. An empirical temperature is a numerical scale for the hotness of a thermodynamic system. Such hotness may be defined as existing on a one-dimensional manifold, stretching between hot and cold. Sometimes the zeroth law is stated to include the existence of a unique universal hotness manifold, and of numerical scales on it, so as to provide a complete definition of empirical temperature.[60] To be suitable for empirical thermometry, a material must have a monotonic relation between hotness and some easily measured state variable, such as pressure or volume, when all other relevant coordinates are fixed. An exceptionally suitable system is the ideal gas, which can provide a temperature scale that matches the absolute Kelvin scale. The Kelvin scale is defined on the basis of the second law of thermodynamics.
Second law of thermodynamics[edit]
As an alternative to considering or defining the zeroth law of thermodynamics, it was the historical development in thermodynamics to define temperature in terms of the second law of thermodynamics which deals with entropy.[citation needed] The second law states that any process will result in either no change or a net increase in the entropy of the universe. This can be understood in terms of probability.
For example, in a series of coin tosses, a perfectly ordered system would be one in which either every toss comes up heads or every toss comes up tails. This means the outcome is always 100% the same result. In contrast, many mixed (disordered) outcomes are possible, and their number increases with each toss. Eventually, the combinations of ~50% heads and ~50% tails dominate, and obtaining an outcome significantly different from 50/50 becomes increasingly unlikely. Thus the system naturally progresses to a state of maximum disorder or entropy.
As temperature governs the transfer of heat between two systems and the universe tends to progress toward a maximum of entropy, it is expected that there is some relationship between temperature and entropy. A heat engine is a device for converting thermal energy into mechanical energy, resulting in the performance of work. An analysis of the Carnot heat engine provides the necessary relationships. According to energy conservation and energy being a state function that does not change over a full cycle, the work from a heat engine over a full cycle is equal to the net heat, i.e. the sum of the heat put into the system at high temperature, qH > 0, and the waste heat given off at the low temperature, qC < 0.[85]
The efficiency is the work divided by the heat input:
-
(4)
where wcy is the work done per cycle. The efficiency depends only on |qC|/qH. Because qC and qH correspond to heat transfer at the temperatures TC and TH, respectively, |qC|/qH should be some function of these temperatures:
-
(5)
Carnot’s theorem states that all reversible engines operating between the same heat reservoirs are equally efficient.[citation needed] Thus, a heat engine operating between T1 and T3 must have the same efficiency as one consisting of two cycles, one between T1 and T2, and the second between T2 and T3. This can only be the case if
which implies
Since the first function is independent of T2, this temperature must cancel on the right side, meaning f(T1, T3) is of the form g(T1)/g(T3) (i.e. f(T1, T3) = f(T1, T2)f(T2, T3) = g(T1)/g(T2) · g(T2)/g(T3) = g(T1)/g(T3)), where g is a function of a single temperature. A temperature scale can now be chosen with the property that
-
(6)
Substituting (6) back into (4) gives a relationship for the efficiency in terms of temperature:
-
(7)
For TC = 0 K the efficiency is 100% and that efficiency becomes greater than 100% below 0 K. Since an efficiency greater than 100% violates the first law of thermodynamics, this implies that 0 K is the minimum possible temperature. In fact, the lowest temperature ever obtained in a macroscopic system was 20 nK, which was achieved in 1995 at NIST. Subtracting the right hand side of (5) from the middle portion and rearranging gives[22][85]
where the negative sign indicates heat ejected from the system. This relationship suggests the existence of a state function, S, whose change characteristically vanishes for a complete cycle if it is defined by
-
(8)
where the subscript indicates a reversible process. This function corresponds to the entropy of the system, which was described previously. Rearranging (8) gives a formula for temperature in terms of fictive infinitesimal quasi-reversible elements of entropy and heat:
-
(9)
For a constant-volume system where entropy S(E) is a function of its energy E, dE = dqrev and (9) gives
-
(10)
i.e. the reciprocal of the temperature is the rate of increase of entropy with respect to energy at constant volume.
Definition from statistical mechanics[edit]
Statistical mechanics defines temperature based on a system’s fundamental degrees of freedom. Eq.(10) is the defining relation of temperature, where the entropy 
where 
When two systems with different temperatures are put into purely thermal connection, heat will flow from the higher temperature system to the lower temperature one; thermodynamically this is understood by the second law of thermodynamics: The total change in entropy following a transfer of energy 
and is thus positive if 
From the point of view of statistical mechanics, the total number of microstates in the combined system 1 + system 2 is 
Generalized temperature from single-particle statistics[edit]
It is possible to extend the definition of temperature even to systems of few particles, like in a quantum dot. The generalized temperature is obtained by considering time ensembles instead of configuration-space ensembles given in statistical mechanics in the case of thermal and particle exchange between a small system of fermions (N even less than 10) with a single/double-occupancy system. The finite quantum grand canonical ensemble,[86] obtained under the hypothesis of ergodicity and orthodicity,[87] allows expressing the generalized temperature from the ratio of the average time of occupation 

where EF is the Fermi energy. This generalized temperature tends to the ordinary temperature when N goes to infinity.
Negative temperature[edit]
On the empirical temperature scales that are not referenced to absolute zero, a negative temperature is one below the zero-point of the scale used. For example, dry ice has a sublimation temperature of −78.5 °C which is equivalent to −109.3 °F.[89] On the absolute Kelvin scale this temperature is 194.6 K. No body can be brought to exactly 0 K (the temperature of the ideally coldest possible body) by any finite practicable process; this is a consequence of the third law of thermodynamics.[90][91][92]
The international kinetic theory temperature of a body cannot take negative values. The thermodynamic temperature scale, however, is not so constrained.
For a body of matter, there can sometimes be conceptually defined, in terms of microscopic degrees of freedom, namely particle spins, a subsystem, with a temperature other than that of the whole body. When the body is in its own state of internal thermodynamic equilibrium, the temperatures of the whole body and of the subsystem must be the same. The two temperatures can differ when, by work through externally imposed force fields, energy can be transferred to and from the subsystem, separately from the rest of the body; then the whole body is not in its own state of internal thermodynamic equilibrium. There is an upper limit of energy such a spin subsystem can attain.
Considering the subsystem to be in a temporary state of virtual thermodynamic equilibrium, it is possible to obtain a negative temperature on the thermodynamic scale. Thermodynamic temperature is the inverse of the derivative of the subsystem’s entropy with respect to its internal energy. As the subsystem’s internal energy increases, the entropy increases for some range, but eventually attains a maximum value and then begins to decrease as the highest energy states begin to fill. At the point of maximum entropy, the temperature function shows the behavior of a singularity, because the slope of the entropy as a function of energy decreases to zero and then turns negative. As the subsystem’s entropy reaches its maximum, its thermodynamic temperature goes to positive infinity, switching to negative infinity as the slope turns negative. Such negative temperatures are hotter than any positive temperature. Over time, when the subsystem is exposed to the rest of the body, which has a positive temperature, energy is transferred as heat from the negative temperature subsystem to the positive temperature system.[93] The kinetic theory temperature is not defined for such subsystems.
Examples[edit]
| Temperature | Peak emittance wavelength[a] of black-body radiation |
||
|---|---|---|---|
| Kelvin | Celsius | ||
| Absolute zero (precisely by definition) |
0 K | −273.15 °C | Infinity |
| Blackbody temperature of the black hole at the centre of our galaxy, Sagittarius A*[94] |
15 fK | −273.149999999999985 °C | 2.5×108 km (1.7 AU) |
| Lowest temperature achieved[95] |
100 pK | −273.149999999900 °C | 29000 km |
| Coldest Bose–Einstein condensate[b] |
450 pK | −273.14999999955 °C | 6400 km |
| One millikelvin (precisely by definition) |
0.001 K | −273.149 °C | 2.89777 m (radio, FM band)[c] |
| Cosmic microwave background (2013 measurement) |
2.7260 K | −270.424 °C | 0.00106301 m (millimeter-wavelength microwave) |
| Water triple point (precisely by definition) |
273.16 K | 0.01 °C | 10608.3 nm (long-wavelength IR) |
| Water boiling point[A] | 373.1339 K | 99.9839 °C | 7766.03 nm (mid-wavelength IR) |
| Iron melting point | 1811 K | 1538 °C | 1600 nm (far infrared) |
| Incandescent lamp[B] | 2500 K | ≈2200 °C | 1160 nm (near infrared)[C] |
| Sun’s visible surface[D][d] | 5778 K | 5505 °C | 501.5 nm (green-blue light) |
| Lightning bolt channel[E] |
28 kK | 28000 °C | 100 nm (far ultraviolet light) |
| Sun’s core[E] | 16 MK | 16 million °C | 0.18 nm (X-rays) |
| Thermonuclear weapon (peak temperature)[E][e] |
350 MK | 350 million °C | 8.3×10−3 nm (gamma rays) |
| Sandia National Labs’ Z machine[E][f] |
2 GK | 2 billion °C | 1.4×10−3 nm (gamma rays)[F] |
| Core of a high-mass star on its last day[E][g] |
3 GK | 3 billion °C | 1×10−3 nm (gamma rays) |
| Merging binary neutron star system[E][h] |
350 GK | 350 billion °C | 8×10−6 nm (gamma rays) |
| Relativistic Heavy Ion Collider[E][96] |
1 TK | 1 trillion °C | 3×10−6 nm (gamma rays) |
| CERN’s proton vs nucleus collisions[E][97] |
10 TK | 10 trillion °C | 3×10−7 nm (gamma rays) |
- A For Vienna Standard Mean Ocean Water at one standard atmosphere (101.325 kPa) when calibrated strictly per the two-point definition of thermodynamic temperature.
- B The 2500 K value is approximate. The 273.15 K difference between K and °C is rounded to 300 K to avoid false precision in the Celsius value.
- C For a true black-body (which tungsten filaments are not). Tungsten filament emissivity is greater at shorter wavelengths, which makes them appear whiter.
- D Effective photosphere temperature. The 273.15 K difference between K and °C is rounded to 273 K to avoid false precision in the Celsius value.
- E The 273.15 K difference between K and °C is within the precision of these values.
- F For a true black-body (which the plasma was not). The Z machine’s dominant emission originated from 40 MK electrons (soft x-ray emissions) within the plasma.
See also[edit]
- Atmospheric temperature – Physical quantity that expresses hot and cold in the atmosphere
- Body temperature – Ability of an organism to keep its body temperature within certain boundaries (thermoregulation)
- Color temperature – Property of light sources related to black-body radiation
- Dry-bulb temperature – Temperature of air as measured by a thermometer shielded from radiation and moisture
- Thermal conduction – Process by which heat is transferred within an object
- Convective heat transfer – Heat transfer due to combined effects of advection and diffusion
- Instrumental temperature record – In situ measurements that provide the temperature of Earth’s climate system
- ISO 1 – ISO standard temperature, 20°C
- International Temperature Scale of 1990 (ITS-90) – Practical temperature scale
- Laser schlieren deflectometry
- List of cities by average temperature
- Maxwell’s demon – Thought experiment of 1867
- Orders of magnitude (temperature) – Range of temperatures from absolute zero to very high
- Outside air temperature
- Planck temperature – Units defined only by physical constants
- Rankine scale – Absolute temperature scale using Fahrenheit degrees
- Relativistic heat conduction – Model compatible with special relativity
- Satellite temperature measurements – Measurements of atmospheric, land surface or sea temperature by satellites.
- Scale of temperature – Method to measure temperature quantitatively
- Sea surface temperature – Water temperature close to the ocean’s surface
- Stagnation temperature
- Thermal radiation – Electromagnetic radiation generated by the thermal motion of particles
- Thermoception – Temperature stimulus inferred from a heat flux and converted into a molecular signal
- Thermodynamic (absolute) temperature – Measure of absolute temperature
- Thermography – Use of thermograms to study heat distribution in structures or regions
- Thermometer – Device to measure temperature
- Virtual temperature – temperature of dry air parcels that have a total pressure and density equal to a moist parcel of air
- Wet-bulb globe temperature – Type of apparent temperature used to estimate the effect of temperature and other factors on humans
- Wet-bulb temperature – Temperature read by a thermometer covered in water-soaked cloth
Notes and references[edit]
- Notes
- ^ The cited emission wavelengths are for black bodies in equilibrium. CODATA 2006 recommended value of 2.8977685(51)×10−3 m K used for Wien displacement law constant b.
- ^ A temperature of 450 ±80 pK in a Bose–Einstein condensate (BEC) of sodium atoms was achieved in 2003 by researchers at MIT. Citation: Cooling Bose–Einstein Condensates Below 500 Picokelvin, A.E. Leanhardt et al., Science 301, 12 Sept. 2003, p. 1515. This record’s peak emittance black-body wavelength of 6,400 kilometers is roughly the radius of Earth.
- ^ The peak emittance wavelength of 2.89777 m is a frequency of 103.456 MHz
- ^ Measurement was made in 2002 and has an uncertainty of ±3 kelvins. A 1989 measurement Archived 2010-02-11 at the Wayback Machine produced a value of 5,777.0±2.5 K. Citation: Overview of the Sun (Chapter 1 lecture notes on Solar Physics by Division of Theoretical Physics, Dept. of Physical Sciences, University of Helsinki).
- ^ The 350 MK value is the maximum peak fusion fuel temperature in a thermonuclear weapon of the Teller–Ulam configuration (commonly known as a hydrogen bomb). Peak temperatures in Gadget-style fission bomb cores (commonly known as an atomic bomb) are in the range of 50 to 100 MK. Citation: Nuclear Weapons Frequently Asked Questions, 3.2.5 Matter At High Temperatures. Link to relevant Web page. Archived 2007-05-03 at the Wayback Machine All referenced data was compiled from publicly available sources.
- ^ Peak temperature for a bulk quantity of matter was achieved by a pulsed-power machine used in fusion physics experiments. The term bulk quantity draws a distinction from collisions in particle accelerators wherein high temperature applies only to the debris from two subatomic particles or nuclei at any given instant. The >2 GK temperature was achieved over a period of about ten nanoseconds during shot Z1137. In fact, the iron and manganese ions in the plasma averaged 3.58±0.41 GK (309±35 keV) for 3 ns (ns 112 through 115). Ion Viscous Heating in a Magnetohydrodynamically Unstable Z Pinch at Over 2×109 Kelvin, M.G. Haines et al., Physical Review Letters 96 (2006) 075003. Link to Sandia’s news release. Archived 2010-05-30 at the Wayback Machine
- ^ Core temperature of a high–mass (>8–11 solar masses) star after it leaves the main sequence on the Hertzsprung–Russell diagram and begins the alpha process (which lasts one day) of fusing silicon–28 into heavier elements in the following steps: sulfur–32 → argon–36 → calcium–40 → titanium–44 → chromium–48 → iron–52 → nickel–56. Within minutes of finishing the sequence, the star explodes as a Type II supernova. Citation: Stellar Evolution: The Life and Death of Our Luminous Neighbors (by Arthur Holland and Mark Williams of the University of Michigan). Link to Web site Archived 2009-01-16 at the Wayback Machine. More informative links can be found here «Chapter 21 Stellar Explosions». Archived from the original on 2013-04-11. Retrieved 2016-02-08., and here «Trans». Archived from the original on 2011-08-14. Retrieved 2016-02-08., and a concise treatise on stars by NASA is here «NASA — Star». Archived from the original on 2010-10-24. Retrieved 2010-10-12..
«Stellar». Archived from the original on January 16, 2009. Retrieved 2010-10-12.{{cite web}}: CS1 maint: bot: original URL status unknown (link) - ^ Based on a computer model that predicted a peak internal temperature of 30 MeV (350 GK) during the merger of a binary neutron star system (which produces a gamma–ray burst). The neutron stars in the model were 1.2 and 1.6 solar masses respectively, were roughly 20 km in diameter, and were orbiting around their barycenter (common center of mass) at about 390 Hz during the last several milliseconds before they completely merged. The 350 GK portion was a small volume located at the pair’s developing common core and varied from roughly 1 to 7 km across over a time span of around 5 ms. Imagine two city-sized objects of unimaginable density orbiting each other at the same frequency as the G4 musical note (the 28th white key on a piano). It’s also noteworthy that at 350 GK, the average neutron has a vibrational speed of 30% the speed of light and a relativistic mass (m) 5% greater than its rest mass (m0). Torus Formation in Neutron Star Mergers and Well-Localized Short Gamma-Ray Bursts Archived 2017-11-22 at the Wayback Machine, R. Oechslin et al. of Max Planck Institute for Astrophysics. Archived 2005-04-03 at the Wayback Machine, arXiv:astro-ph/0507099 v2, 22 Feb. 2006. An html summary Archived 2010-11-09 at the Wayback Machine.
- Citations
- ^ Agency, International Atomic Energy (1974). Thermal discharges at nuclear power stations: their management and environmental impacts: a report prepared by a group of experts as the result of a panel meeting held in Vienna, 23–27 October 1972. International Atomic Energy Agency.
- ^ Watkinson, John (2001). The Art of Digital Audio. Taylor & Francis. ISBN 978-0-240-51587-8.
- ^ Middleton, W.E.K. (1966), pp. 89–105.
- ^ Joanna Thompson (2021-10-14). «Scientists just broke the record for the coldest temperature ever recorded in a lab». livescience.com. Retrieved 2023-04-28.
- ^ a b Jaynes, E.T. (1965), pp. 391–398.
- ^ a b Cryogenic Society (2019).
- ^ a b Draft Resolution A «On the revision of the International System of Units (SI)» to be submitted to the CGPM at its 26th meeting (2018) (PDF), archived from the original (PDF) on 2018-04-29, retrieved 2019-10-20
- ^ a b c Truesdell, C.A. (1980), Sections 11 B, 11H, pp. 306–310, 320–332.
- ^ Quinn, T. J. (1983).
- ^ Germer, L.H. (1925). ‘The distribution of initial velocities among thermionic electrons’, Phys. Rev., 25: 795–807. here
- ^ Turvey, K. (1990). ‘Test of validity of Maxwellian statistics for electrons thermionically emitted from an oxide cathode’, European Journal of Physics, 11(1): 51–59. here
- ^ Zeppenfeld, M., Englert, B.G.U., Glöckner, R., Prehn, A., Mielenz, M., Sommer, C., van Buuren, L.D., Motsch, M., Rempe, G. (2012).
- ^ Miller, J. (2013).
- ^ a b de Podesta, M., Underwood, R., Sutton, G., Morantz, P, Harris, P, Mark, D.F., Stuart, F.M., Vargha, G., Machin, M. (2013). A low-uncertainty measurement of the Boltzmann constant, Metrologia, 50 (4): S213–S216, BIPM & IOP Publishing Ltd
- ^ Quinn, T.J. (1983), pp. 98–107.
- ^ Schooley, J.F. (1986), pp. 138–143.
- ^ Quinn, T.J. (1983), pp. 61–83.
- ^ Schooley, J.F. (1986), pp. 115–138.
- ^ Adkins, C.J. (1968/1983), pp. 119–120.
- ^ Buchdahl, H.A. (1966), pp. 137–138.
- ^ Tschoegl, N.W. (2000), p. 88.
- ^ a b Fermi, E. (1956). Thermodynamics. Dover Publications (still in print). p. 48.
eq.(64)
. - ^ Thomson, W. (Lord Kelvin) (1848).
- ^ Thomson, W. (Lord Kelvin) (1851).
- ^ Partington, J.R. (1949), pp. 175–177.
- ^ Roberts, J.K., Miller, A.R. (1928/1960), pp. 321–322.
- ^ Quinn, T.J. (1983). Temperature, Academic Press, London, ISBN 0-12-569680-9, pp. 160–162.
- ^ Tisza, L. (1966). Generalized Thermodynamics, M.I.T. Press, Cambridge MA, pp. 47, 57.
- ^ a b c Münster, A. (1970), Classical Thermodynamics, translated by E.S. Halberstadt, Wiley–Interscience, London, ISBN 0-471-62430-6, pp. 49, 69.
- ^ a b Bailyn, M. (1994). A Survey of Thermodynamics, American Institute of Physics Press, New York, ISBN 0-88318-797-3, pp. 14–15, 214.
- ^ a b Callen, H.B. (1960/1985), Thermodynamics and an Introduction to Thermostatistics, (first edition 1960), second edition 1985, John Wiley & Sons, New York, ISBN 0-471-86256-8, pp. 146–148.
- ^ Kondepudi, D., Prigogine, I. (1998). Modern Thermodynamics. From Heat Engines to Dissipative Structures, John Wiley, Chichester, ISBN 0-471-97394-7, pp. 115–116.
- ^ Tisza, L. (1966). Generalized Thermodynamics, M.I.T. Press, Cambridge MA, p. 58.
- ^ Milne, E.A. (1929). The effect of collisions on monochromatic radiative equilibrium, Monthly Notices of the Royal Astronomical Society, 88: 493–502.
- ^ Gyarmati, I. (1970). Non-equilibrium Thermodynamics. Field Theory and Variational Principles, translated by E. Gyarmati and W.F. Heinz, Springer, Berlin, pp. 63–66.
- ^ Glansdorff, P., Prigogine, I., (1971). Thermodynamic Theory of Structure, Stability and Fluctuations, Wiley, London, ISBN 0-471-30280-5, pp. 14–16.
- ^ Bailyn, M. (1994). A Survey of Thermodynamics, American Institute of Physics Press, New York, ISBN 0-88318-797-3, pp. 133–135.
- ^ Callen, H.B. (1960/1985), Thermodynamics and an Introduction to Thermostatistics, (first edition 1960), second edition 1985, John Wiley & Sons, New York, ISBN 0-471-86256-8, pp. 309–310.
- ^ Bryan, G.H. (1907). Thermodynamics. An Introductory Treatise dealing mainly with First Principles and their Direct Applications, B.G. Teubner, Leipzig, p. 3. «Thermodynamics by George Hartley Bryan». Archived from the original on 2011-11-18. Retrieved 2011-10-02.
- ^ Pippard, A.B. (1957/1966), p. 18.
- ^ Adkins,C.J. (1968/1983), p. 20.
- ^ Bryan, G.H. (1907). Thermodynamics. An Introductory Treatise dealing mainly with First Principles and their Direct Applications, B.G. Teubner, Leipzig, p. 5: «… when a body is spoken of as growing hotter or colder an increase of temperature is always implied, for the hotness and coldness of a body are qualitative terms which can only refer to temperature.» «Thermodynamics by George Hartley Bryan». Archived from the original on 2011-11-18. Retrieved 2011-10-02.
- ^ a b c d Mach, E. (1900). Die Principien der Wärmelehre. Historisch-kritisch entwickelt, Johann Ambrosius Barth, Leipzig, section 22, pp. 56–57.
- ^ a b Serrin, J. (1986). Chapter 1, ‘An Outline of Thermodynamical Structure’, pp. 3–32, especially p. 6, in New Perspectives in Thermodynamics, edited by J. Serrin, Springer, Berlin, ISBN 3-540-15931-2.
- ^ Maxwell, J.C. (1872). Theory of Heat, third edition, Longmans, Green, London, p. 32.
- ^ Tait, P.G. (1884). Heat, Macmillan, London, Chapter VII, pp. 39–40.
- ^ Planck, M. (1897/1903). Treatise on Thermodynamics, translated by A. Ogg, Longmans, Green, London, pp. 1–2.
- ^ Planck, M. (1914), The Theory of Heat Radiation Archived 2011-11-18 at the Wayback Machine, second edition, translated into English by M. Masius, Blakiston’s Son & Co., Philadelphia, reprinted by Kessinger.
- ^ J.S. Dugdale (1996). Entropy and its Physical Interpretation. Taylor & Francis. p. 13. ISBN 978-0-7484-0569-5.
- ^ F. Reif (1965). Fundamentals of Statistical and Thermal Physics. McGraw-Hill. p. 102. ISBN 9780070518001.
- ^ M.J. Moran; H.N. Shapiro (2006). «1.6.1». Fundamentals of Engineering Thermodynamics (5 ed.). John Wiley & Sons, Ltd. p. 14. ISBN 978-0-470-03037-0.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ^ T.W. Leland, Jr. «Basic Principles of Classical and Statistical Thermodynamics» (PDF). p. 14. Archived (PDF) from the original on 2011-09-28.
Consequently we identify temperature as a driving force which causes something called heat to be transferred.
- ^ Tait, P.G. (1884). Heat, Macmillan, London, Chapter VII, pp. 42, 103–117.
- ^ Beattie, J.A., Oppenheim, I. (1979). Principles of Thermodynamics, Elsevier Scientific Publishing Company, Amsterdam, ISBN 978-0-444-41806-7, p. 29.
- ^ Landsberg, P.T. (1961). Thermodynamics with Quantum Statistical Illustrations, Interscience Publishers, New York, p. 17.
- ^ Thomsen, J.S. (1962). «A restatement of the zeroth law of thermodynamics». Am. J. Phys. 30 (4): 294–296. Bibcode:1962AmJPh..30..294T. doi:10.1119/1.1941991.
- ^ Maxwell, J.C. (1872). Theory of Heat, third edition, Longman’s, Green & Co, London, p. 45.
- ^ a b Pitteri, M. (1984). On the axiomatic foundations of temperature, Appendix G6 on pp. 522–544 of Rational Thermodynamics, C. Truesdell, second edition, Springer, New York, ISBN 0-387-90874-9.
- ^ Truesdell, C., Bharatha, S. (1977). The Concepts and Logic of Classical Thermodynamics as a Theory of Heat Engines, Rigorously Constructed upon the Foundation Laid by S. Carnot and F. Reech, Springer, New York, ISBN 0-387-07971-8, p. 20.
- ^ a b Serrin, J. (1978). The concepts of thermodynamics, in Contemporary Developments in Continuum Mechanics and Partial Differential Equations. Proceedings of the International Symposium on Continuum Mechanics and Partial Differential Equations, Rio de Janeiro, August 1977, edited by G.M. de La Penha, L.A.J. Medeiros, North-Holland, Amsterdam, ISBN 0-444-85166-6, pp. 411–451.
- ^ Maxwell, J.C. (1872). Theory of Heat, third edition, Longmans, Green, London, pp. 155–158.
- ^ Tait, P.G. (1884). Heat, Macmillan, London, Chapter VII, Section 95, pp. 68–69.
- ^ Buchdahl, H.A. (1966), p. 73.
- ^ Kondepudi, D. (2008). Introduction to Modern Thermodynamics, Wiley, Chichester, ISBN 978-0-470-01598-8, Section 32., pp. 106–108.
- ^ Green, Don; Perry, Robert H. (2008). Perry’s Chemical Engineers’ Handbook, Eighth Edition (8th ed.). McGraw-Hill Education. p. 660. ISBN 978-0071422949.
- ^ The kelvin in the SI Brochure Archived 2007-09-26 at the Wayback Machine
- ^ «Absolute Zero». Calphad.com. Archived from the original on 2011-07-08. Retrieved 2010-09-16.
- ^ Definition agreed by the 26th General Conference on Weights and Measures (CGPM) Archived 2020-10-09 at the Wayback Machine in November 2018, implemented 20 May 2019
- ^ C. Caratheodory (1909). «Untersuchungen über die Grundlagen der Thermodynamik». Mathematische Annalen. 67 (3): 355–386. doi:10.1007/BF01450409. S2CID 118230148.
- ^ Swendsen, Robert (March 2006). «Statistical mechanics of colloids and Boltzmann’s definition of entropy» (PDF). American Journal of Physics. 74 (3): 187–190. Bibcode:2006AmJPh..74..187S. doi:10.1119/1.2174962. S2CID 59471273. Archived from the original (PDF) on 2020-02-28.
- ^ Balescu, R. (1975). Equilibrium and Nonequilibrium Statistical Mechanics, Wiley, New York, ISBN 0-471-04600-0, pp. 148–154.
- ^ a b Kittel, Charles; Kroemer, Herbert (1980). Thermal Physics (2nd ed.). W.H. Freeman Company. pp. 391–397. ISBN 978-0-7167-1088-2.
- ^ Kondepudi, D.K. (1987). «Microscopic aspects implied by the second law». Foundations of Physics. 17 (7): 713–722. Bibcode:1987FoPh…17..713K. doi:10.1007/BF01889544. S2CID 120576357.
- ^ The Feynman Lectures on Physics. 39–5 The ideal gas law
- ^ «2018 CODATA Value: molar gas constant». The NIST Reference on Constants, Units, and Uncertainty. NIST. 20 May 2019. Retrieved 2019-05-20.
- ^ «Kinetic Theory». galileo.phys.virginia.edu. Archived from the original on 16 July 2017. Retrieved 27 January 2018.
- ^ Tolman, R.C. (1938). The Principles of Statistical Mechanics, Oxford University Press, London, pp. 93, 655.
- ^ Peter Atkins, Julio de Paula (2006). Physical Chemistry (8 ed.). Oxford University Press. p. 9.
- ^ Maxwell, J.C. (1872). Theory of Heat, third edition, Longman’s, Green & Co, London, p. 32.
- ^ Bailyn, M. (1994). A Survey of Thermodynamics, American Institute of Physics Press, New York, ISBN 0-88318-797-3, p. 23, «…, if a temperature gradient exists, …, then a flow of heat, …, must occur to achieve a uniform temperature.»
- ^ Guggenheim, E.A. (1967). Thermodynamics. An Advanced Treatment for Chemists and Physicists, North-Holland Publishing Company., Amsterdam, (1st edition 1949) fifth edition 1965, p. 8, «… will gradually adjust themselves until eventually they do reach mutual equilibrium after which there will of course be no further change.»
- ^ Bailyn, M. (1994). A Survey of Thermodynamics, American Institute of Physics Press, New York, ISBN 0-88318-797-3, p. 22.
- ^ Guggenheim, E.A. (1967). Thermodynamics. An Advanced Treatment for Chemists and Physicists, North-Holland Publishing Company., Amsterdam, (1st edition 1949) fifth edition 1965, p. 8: «If two systems are both in thermal equilibrium with a third system then they are in thermal equilibrium with each other.»
- ^ Buchdahl, H.A. (1966). The Concepts of Classical Thermodynamics, Cambridge University Press, Cambridge, p. 29: «… if each of two systems is in equilibrium with a third system then they are in equilibrium with each other.»
- ^ a b Planck, M. (1945). Treatise on Thermodynamics. Dover Publications. p. §90 & §137.
eqs.(39), (40), & (65)
. - ^ Prati, E. (2010). «The finite quantum grand canonical ensemble and temperature from single-electron statistics for a mesoscopic device». J. Stat. Mech. 1 (1): P01003. arXiv:1001.2342. Bibcode:2010JSMTE..01..003P. doi:10.1088/1742-5468/2010/01/P01003. S2CID 118339343. arxiv.org Archived 2017-11-22 at the Wayback Machine
- ^ «Archived copy» (PDF). Archived (PDF) from the original on 2014-04-13. Retrieved 2014-04-11.
{{cite web}}: CS1 maint: archived copy as title (link) - ^ Prati, E.; et al. (2010). «Measuring the temperature of a mesoscopic electron system by means of single electron statistics». Applied Physics Letters. 96 (11): 113109. arXiv:1002.0037. Bibcode:2010ApPhL..96k3109P. doi:10.1063/1.3365204. S2CID 119209143. Archived from the original on 2016-05-14. Retrieved 2022-03-02. arxiv.org Archived 2017-11-22 at the Wayback Machine
- ^ Water Science School. «Frozen carbon dioxide (dry ice) sublimates directly into a vapor». USGS.
- ^ Guggenheim, E.A. (1967) [1949], Thermodynamics. An Advanced Treatment for Chemists and Physicists (fifth ed.), Amsterdam: North-Holland Publishing Company., p. 157: «It is impossible by any procedure, no matter how idealized, to reduce the temperature of any system to zero temperature in a finite number of finite operations.»
- ^ Pippard, A.B. (1957/1966). Elements of Classical Thermodynamics for Advanced Students of Physics, original publication 1957, reprint 1966, Cambridge University Press, Cambridge, page 51: «By no finite series of processes is the absolute zero attainable.«
- ^ Tisza, L. (1966). Generalized Thermodynamics, MIT Press, Cambridge MA, page 96: «It is impossible to reach absolute zero as a result of a finite sequence of operations.»
- ^ Kittel, Charles; Kroemer, Herbert (1980). Thermal Physics (2nd ed.). W.H. Freeman Company. p. Appendix E. ISBN 978-0-7167-1088-2.
- ^ This the Hawking Radiation for a Schwarzschild black hole of mass M = 4.145×106 M☉. It is too faint to be observed.
- ^ «World record in low temperatures». Archived from the original on 2009-06-18. Retrieved 2009-05-05.
- ^ Results of research by Stefan Bathe using the PHENIX Archived 2008-11-20 at the Wayback Machine detector on the Relativistic Heavy Ion Collider Archived 2016-03-03 at the Wayback Machine at Brookhaven National Laboratory Archived 2012-06-24 at the Wayback Machine in Upton, New York. Bathe has studied gold-gold, deuteron-gold, and proton-proton collisions to test the theory of quantum chromodynamics, the theory of the strong force that holds atomic nuclei together. Link to news release. Archived 2009-02-11 at the Wayback Machine
- ^ How do physicists study particles? Archived 2007-10-11 at the Wayback Machine by CERN Archived 2012-07-07 at the Wayback Machine.
Bibliography of cited references[edit]
- Adkins, C.J. (1968/1983). Equilibrium Thermodynamics, (1st edition 1968), third edition 1983, Cambridge University Press, Cambridge UK, ISBN 0-521-25445-0.
- Buchdahl, H.A. (1966). The Concepts of Classical Thermodynamics, Cambridge University Press, Cambridge.
- Jaynes, E.T. (1965). Gibbs vs Boltzmann entropies, American Journal of Physics, 33(5), 391–398.
- Middleton, W.E.K. (1966). A History of the Thermometer and its Use in Metrology, Johns Hopkins Press, Baltimore.
- Miller, J (2013). «Cooling molecules the optoelectric way». Physics Today. 66 (1): 12–14. Bibcode:2013PhT….66a..12M. doi:10.1063/pt.3.1840.
- Partington, J.R. (1949). An Advanced Treatise on Physical Chemistry, volume 1, Fundamental Principles. The Properties of Gases, Longmans, Green & Co., London, pp. 175–177.
- Pippard, A.B. (1957/1966). Elements of Classical Thermodynamics for Advanced Students of Physics, original publication 1957, reprint 1966, Cambridge University Press, Cambridge UK.
- Quinn, T.J. (1983). Temperature, Academic Press, London, ISBN 0-12-569680-9.
- Schooley, J.F. (1986). Thermometry, CRC Press, Boca Raton, ISBN 0-8493-5833-7.
- Roberts, J.K., Miller, A.R. (1928/1960). Heat and Thermodynamics, (first edition 1928), fifth edition, Blackie & Son Limited, Glasgow.
- Thomson, W. (Lord Kelvin) (1848). On an absolute thermometric scale founded on Carnot’s theory of the motive power of heat, and calculated from Regnault’s observations, Proc. Camb. Phil. Soc. (1843/1863) 1, No. 5: 66–71.
- Thomson, W. (Lord Kelvin) (March 1851). «On the Dynamical Theory of Heat, with numerical results deduced from Mr Joule’s equivalent of a Thermal Unit, and M. Regnault’s Observations on Steam». Transactions of the Royal Society of Edinburgh. XX (part II): 261–268, 289–298.
- Truesdell, C.A. (1980). The Tragicomical History of Thermodynamics, 1822–1854, Springer, New York, ISBN 0-387-90403-4.
- Tschoegl, N.W. (2000). Fundamentals of Equilibrium and Steady-State Thermodynamics, Elsevier, Amsterdam, ISBN 0-444-50426-5.
- Zeppenfeld, M.; Englert, B.G.U.; Glöckner, R.; Prehn, A.; Mielenz, M.; Sommer, C.; van Buuren, L.D.; Motsch, M.; Rempe, G. (2012). «Sysiphus cooling of electrically trapped polyatomic molecules». Nature. 491 (7425): 570–573. arXiv:1208.0046. Bibcode:2012Natur.491..570Z. doi:10.1038/nature11595. PMID 23151480. S2CID 4367940.
Further reading[edit]
- Chang, Hasok (2004). Inventing Temperature: Measurement and Scientific Progress. Oxford: Oxford University Press. ISBN 978-0-19-517127-3.
- Zemansky, Mark Waldo (1964). Temperatures Very Low and Very High. Princeton, NJ: Van Nostrand.
External links[edit]
- Current map of global surface temperatures
Содержание:
Тепловое движение и температура тела и её измерение:
Из уроков физики в 7 классе вы знаете, что тела состоят из молекул. Молекулы находятся в непрерывном хаотическом (беспорядочном) движении и взаимодействуют между собой. Каждая отдельная молекула совершает механическое движение, подобное тому, что мы изучали ранее. Двигаясь с большой скоростью, она сталкивается с другими молекулами и при этом изменяет направление движения. Из рис. 215 видно, что траектория отдельной молекулы — это сложная ломаная линия, но можно определить пройденный молекулой путь и скорость её движения. Наблюдать такое движение, даже вооружённым глазом, невозможно из-за чрезвычайно малых размеров движущихся частиц. Только в специальных сложных опытах можно видеть результат механического движения групп молекул.
Исследование движения молекул методами механики ешё больше усложняется из-за чрезвычайно большого количества двигающихся частиц в обычных телах. Практически невозможно проследить за всеми «участниками» движения: миллиарды миллиардов маленьких частиц движутся с большими скоростями в разных направлениях, сталкиваются друг с другом и со стенками сосуда, изменяют собственные скорости движения (рис. 216).
Как же всё-таки можно исследовать механические характеристики движущихся молекул в телах: оценить скорости молекул, пути, которые они проходят между столкновеньями и пр. ?
Оказывается, что результатом беспорядочного механического движения молекул является не только перемещение их в пространстве, но и тепловое состояние тела, степень его нагретости. Чем быстрее движутся молекулы, тем выше температура тела и наоборот: если повышается температура тела, то и увеличивается скорость движения молекул. Поэтому хаотическое движение огромного количества молекул изучают методами физики тепловых явлений, а само такое движение называют тепловым.
Тепловое движение — это беспорядочное движение молекул и атомов, определяющее температуру тела.
В свою очередь, знания о строении вещества и тепловом движении позволяют объяснить различные тепловые явления. Предположим, что в двух сосудах содержатся газообразные молекулы разной массы, например в одной — кислород, а в другой — азот. Опыты свидетельствуют, что при одинаковой температуре средние кинетические энергии молекул обоих веществ одинаковые, а значения средних скоростей молекул оказываются различными.
Таким образом, приходим к выводу, что температура тела — это физическая характеристика теплового состояния вещества, из которого состоит тело, степени его нагретости, и она определяется значением средней кинетической энергии хаотического движения частиц вещества.
Несколько столетий назад наукой ещё не была признана теория молекулярного и атомного строения вещества, поэтому представление о температуре тела возникло не в связи с движением молекул и атомов в нём, а из сравнения ощущений тепла или холода, хотя они неточны и часто субъективны. Для объективных измерений температуры во время контакта с исследуемой средой были созданы специальные приборы — термометры. Действие термометров основывается на разных физических явлениях, зависящих от температуры: тепловом расширении жидкостей, газов, твёрдых тел, изменении с температурой электрических свойств вещества и др. Чаше всего используют жидкостные термометры, с помощью которых можно измерять температуру в широких пределах.
Опыты свидетельствуют, что при контакте горячего и холодного тел их температуры со временем выравниваются, т. е. горячее тело остывает, а холодное — нагревается. Установление теплового равновесия между несколькими телами означает, что их температуры становятся одинаковыми и в дальнейшем уже не будут различаться. С молекулярной точки зрения это означает, что в состоянии теплового равновесия во всех контактирующих телах кинетическая энергия беспорядочного движения частиц вещества одинакова.
Отсюда следует, что при измерении температуры жидкостным термометром нужно соблюдать такие правила: поместить колбу термометра в ту среду, температуру которой измеряют; подождать определенное время, пока столбик жидкости в трубке термометра остановится, т. е. пока не установится теплоовое равновесие между колбой и средой; не вынимая термометр из среды, определить по шкале значение его температуры.
В 1597 г. Г. Галилей сконструировал прибор — прототип термометра, который назвал термоскопом. Термоскоп Галилея (рис. 217) состоял из тонкой стеклянной трубки с небольшой колбой на верхнем конце.
Открытый нижний конец трубки опускали в сосуд с водой, которая заполняла и часть трубки. Когда воздух в колбе нагревался или охлаждался, то столбик воды в трубке опускался или поднимался.
Поскольку высота столбика зависела как от температуры, так и от атмосферного давления, то измерять температуру термоскопом было невозможно, тем не менее он позволял сравнивать температуры разных тел в одно и то же время и в одном и том же месте. Уже тогда врач и анатом Санкториус из Падуанского университета, не зная о термоскопе Галилея, сконструировал собственный подобный термометр и применял его для измерения температуры тела человека.
Первый современный термометр (рис. 218, а) был описан в 1724 г. Габриэлем Фаренгейтом, стеклодувом из Голландии.
Современников учёного удивляло, что показания разных спиртовых термометров, изготовленных Фаренгейтом, согласовывались между собой. Секрет Фаренгейта состоял в том, что он тщательно наносил деления на шкалу, используя для этого несколько опорных точек. За О0 F — первую фиксированную точку -Фаренгейт принял температуру плавления смеси льда, воды и нашатыря (аммоний хлорида 
Во Франции в практику вошла шкала Реомюра (рис. 218, б) (около 1740 г.), построенная на точках замерзания воды (0° R) и её кипения (80°R). Реомюр на основании измерений вывел, что вода расширяется между этими двумя точками на 80 тысячных долей своего объёма (правильное значение 0,084). Спиртовые термометры Реомюра со временем были заменены ртутными термометрами Делюка (1740 г.), поскольку коэффициент расширения ртути в меньшей степени изменялся с температурой по сравнению со спиртом.
Современная температурная шкала (рис. 218, в) была предложена в 1742 г. шведским физиком А. Цельсием (1701—1744), который в своих ртутных термометрах ввёл 100-градусную шкалу.
Ему не нравились отрицательные значения температур, и он счёл нужным перевернуть старую шкалу и поместить О °С в точку кипения воды, а 100 °С — в точку её замерзания. Но «перевёрнутая» шкала не приобрела популярности и в скором времени по предложению шведского натуралиста К. Линнея возвратились к обычному размещению опорных температур.
К началу XIX в. термометр становится обычным физическим прибором. Принято, что единица температуры 1 °С (один градус Цельсия) — это одна сотая часть интервала между температурами плавления льда и кипения дистиллированной воды при нормальном атмосферном давлении (101 325 Па).
Кстати:
На Земле есть много жарких и холодных мест. В Долине смерти (Калифорния, США) зафиксирована жара + 56,7 °С, но рекорд принадлежит пустыне Сахара (Африка) + 63 °С в тени. Самыми холодными местами в Северном полушарии являются Якутия и Гренландия, где температура достигает — 70 °С. Но самое холодное место на нашей планете — это Антарктида. В её глубинных районах зафиксирована температура — 94,5 °С. На таком морозе металл становится хрупким, керосин превращается в густую желеобразную массу и не воспламеняется даже при контакте с пламенем.
Внутренняя энергия и способы её изменения
Тает снег, плавятся металлы, испаряется вода, нагревается жидкость в сосуде — всё это тепловые явления. При тепловых явлениях изменяются температура и состояние тела: лёд превращается в воду, вода — в пар и наоборот. Чтобы расплавить олово, нужно сначала его нагреть до температуры плавления, а потом плавить, непрерывно сообщая ему энергию. А какие физические величины характеризуют тепловое состояние вещества и дают возможность объяснять тепловые явления?
Вам уже известны понятия механической энергии, виды механической энергии — потенциальная и кинетическая. Сжатая или растянутая пружина обладает потенциальной энергией, каждое движущееся тело обладает кинетической энергией. Вы также знаете, что потенциальная и кинетическая енергии тела могут изменяться, что при их изменении выполняется механическая работа.
Опыт. Поднимем пластилиновый шар над столом и отпустим его. Под действием силы тяжести шар упадёт на стол и прилипнет к нему.
Проанализируем, как изменялась механическая энергия шара при этом. Шар, поднятый над столом, имел потенциальную энергию, его кинетическая энергия равнялась нулю, так как он был неподвижен (рис. 221, а). Когда шар отпустили, то во время падения его потенциальная энергия уменьшалась, так как уменьшалась высота шара над столом, а кинетическая энергия увеличивалась, так как увеличивалась скорость движения шара. Перед касанием шара поверхности стола его потенциальная энергия относительно него равнялась нулю, а значение кинетической энергии — значению потенциальной энергии шара до начала падения (рис. 221, б).
Когда шар упал на стол, то он остановился, т. е. его кинетическая энергия также стала равной нулю. Значит, механическая энергия шара относительно стола в этом положении равна нулю.
Куда же «исчезла» механическая энергия шара ?
Можно предположить, что такое «исчезновение» механической энергии связано с какими-то другими, отличными от механического движения, изменениями в состоянии тел. Действительно, если с помощью очень чувствительного термометра измерить температуры шара и поверхности стола до падения шара и после него, то окажется, что их температуры повысились. Следовательно, произошли изменения в тепловом состоянии тел при взаимодействии — увеличилась средняя скорость их молекул.
Изменение энергии теплового движения молекул тела произошло за счёт изменения кинетической энергии их движения вследствие изменения средней скорости молекул и изменения потенциальной энергии их взаимодействия из-за деформации шара.
Энергию движения и взаимодействия частиц, из которых состоит тело, называют внутренней энергией тела.
Итак, в процессе удара шара об стол произошёл переход механической энергии шара во внутреннюю энергию.
Внутренняя энергия тела зависит от его температуры. Повышается температура тела — увеличивается его внутренняя энергия и наоборот.
Внутренняя энергия тела не зависит ни от механического движения тела, ни от положения этого тела относительно других тел.
Итак, внутренняя энергия тела, в частности, связана со скоростью движения его частиц. Она изменяется, если изменяется средняя скорость движения частиц, из которых состоит тело. А каким образом можно увеличить или уменьшить эту скорость, т.е . изменить внутреннюю энергию тела?
Наблюдение 1. Вам, наверное, приходилось накачивать насосом велосипедную шину или мяч (рис. 222, а, б), и вы наблюдали, что насос при этом нагревался. 
Если вы согнёте и разогнёте несколько раз проволоку из мягкого металла (рис. 223), то обнаружите, что место сгиба нагрелось.
Если вы ударите несколько раз молотком по куску свинца (рис. 224), то он также нагреется.
Когда у вас на морозе мёрзнут руки, то вы их согреваете, потирая одну об другую. Во всех случаях внутренняя энергия тел увеличивается за счёт выполнения работы над ними.
Внутреннюю энергию тела можно увеличить, выполняя над ним работу.
Опыт. В толстостенном стеклянном сосуде, плотно закрытом пробкой, содержится водяной пар. Через специальное отверстие будем накачивать в него воздух. Спустя некоторое время пробка выскочит из сосуда (рис. 225).
В тот момент, когда пробка выскакивает, в сосуде возникает туман (водяной пар превратился в жидкость), появление которого означает, что воздух в сосуде стал холоднее. Следовательно, внутренняя энергия воздуха в сосуде уменьшилась. Объясняется это тем, что сжатый воздух, выталкивая пробку, выполнил работу.
Если работу выполняет само тело, то его внутренняя энергия уменьшается.
Внутреннюю энергию тела можно изменить и другим способом, без выполнения работы.
Наблюдение 2. Кастрюля с водой, стоящая на горячей плите (рис. 226); металлическая ложка, помещённая в стакан с горячей водой; батарея водяного отопления, по которой проходит горячая вода; камин, в котором горит огонь (рис. 227); Земля, которую освещает Солнце (рис. 228), — все они нагреваются.

Можно наблюдать и охлаждение тел, когда, например, горячую ложку помещают в холодную воду, закипевший чайник снимают с плиты.
В приведённых примерах происходило изменение внутренней энергии тел, но механическая работа при этом не выполнялась. Такой процесс изменения внутренней энергии тел называют теплообменом, или теплопередачей.
Теплообмен — это процесс передачи внутренней энергии от нагретого тела к холодному без выполнения ими или над ними механической работы.
Каким образом происходит теплообмен при контакте холодной ложки с горячей водой? Вначале средняя скорость и кинетическая энергия молекул горячей волы превышают среднюю скорость и кинетическую энергию атомов металла, из которого изготовлена ложка. Но в местах касания ложки с водой при столкновениях быстрые молекулы воды передают часть своей кинетической энергии атомам металла, и они начинают двигаться быстрее. Кинетическая энергия молекул воды при этом уменьшается, а кинетическая энергия атомов металла возрастает. Вместе с энергией изменяется и температура: вода постепенно охлаждается, а ложка — нагревается. Этот процесс будет длиться до тех пор, пока температуры воды и ложки не станут одинаковыми.
Внутреннюю энергию тела можно изменить путём выполнения работы или теплообмена.
Виды теплообмена
Теплообмен может осуществляться разными способами.
Наблюдение 1. Если прикоснуться к предметам, изготовленным из металла и дерева, то металлические предметы кажутся холоднее деревянных, хотя их температура одинакова, например комнатная. Мы в этом случае ощущаем прохладу, так как металлические предметы лучше проводят тепло и быстрее отбирают его от руки, т. е. у них высокая теплопроводность.
Наблюдение 2. Радиаторы водяного отопления размещают под окном у пола. От них внизу холодный воздух нагревается и поднимается вверх. Держа руку над зажжённой свечкой, вы ощутите, как от её пламени вверх поднимаются тёплые потоки воздуха. Видим, что теплообмен может происходить за счёт перенесения масс газа или жидкости. Такой процесс передачи тепла называют конвекцией (от латинского конвекцио — перенесение).
Наблюдение 3. Жизнь на Земле может существовать потому, что планета имеет пригодную для этого температуру за счёт тепла, получаемого со светом от Солнца. Земля и Солнце расположены на большом расстоянии (150 млн километров), в пространстве между ними нет воздуха. В этом случае передача тепла происходит за счёт ещё одного вида теплообмена — излучения.
Опыт 1. К медному стержню парафином или воском приклеим несколько спичек (рис. 229).
Один конец стержня будем нагревать в пламени спиртовки или газовой горелки. Во время нагревания парафин начнёт плавиться, и спички будут отпадать от стержня. Сначала отпадут те спички, которые размещены ближе к пламени, а потом поочерёдно — остальные.
Передачу тепла от более нагретой части тела к менее нагретой ( вследствие теплового движения частиц тела называют теплопровод ностью. При этом происходит передача энергии, а переноса вещества нет.
Опыт 2. В сосуд, в котором нагревается вода, поставим алюминиевый, деревянный, пластмассовый и стеклянный стержни (рис. 230).
Положим сверху на них парафиновые шарики. Сначала расплавится шарик на алюминиевом стержне, потом — на стеклянном. На деревянном и пластмассовом стержнях парафин не расплавится.
Различные вещества имеют разную теплопроводность.
При комнатной температуре теплопроводность различных тел разная (табл. 6).
Хорошими проводниками тепла являются металлы, особенно серебро, золото, медь. Плохими проводниками тепла является вода, кирпич, бетон, лёд. Например, теплопроводность бетона в 210 раз ниже теплопроводности алюминия. Пробка, пенопласт, воздух имеют очень низкую теплопроводность. Такие вещества называют теплоизоляторами.
Шерсть, пух содержат воздух, и поэтому имеют низкую теплопроводность. Они защищают тело животных от охлаждения или перегрева.
Для достаточной теплоизоляции здания его стены из бетона имеют толщину 30 см. Для обеспечения такой же теплоизоляции стены из алюминия имели бы толщину 63 м, а стены из пробки — 1,2 см.
Опыт 3. Если нагревать воду в верхней части пробирки (рис. 231), то она в этом месте закипит, а внизу даже могут оставаться кусочки льда.
Это свидетельствует о том, что вода — плохой проводник тепла. Если же нагревать сосуд с водой снизу, то вся вода прогреется и закипит (рис. 232), так как будет происходить перемещение верхних холодных и нижних нагретых слоёв воды.
Такое перемещение жидкости называют конвекцией.
Конвекция — процесс переноса энергии струями жидкости или газа.
Опыт 4. Зажжём свечу, разместим над пламенем вырезанную из бумаги «змейку» (рис. 233).

Под действием струй нагретого воздуха бумажная «змейка» вращается.
Явлением конвекции можно объяснить возникновение ветров в природе.
Наблюдение 4. Зажжём свечу. Когда над ней разместим сначала низкий, а потом — более высокий стеклянный цилиндр, открытый с обеих сторон (рис. 234), то заметим, что пламя свечки будет удлиняться. Такой цилиндр — это маленькая дымовая труба, создающая воздушную тягу. Чем выше труба, тем лучше тяга.
В современных домах устанавливают водяное отопление. Вода, нагретая в котле (рис. 235), поднимается по трубам вверх и отдаёт тепло радиаторам отопления.
Вследствие конвекции нагревается воздух в помещении, при этом охлаждаются радиаторы и вода в них. Охлаждённая вода опускается вниз к котлу, где снова нагревается. Чтобы вся вода, имеющаяся в системе водяного отопления, нагревалась, котлы или другие нагревательные установки размещают в доме как можно ниже.
Наблюдение 5. Сидя возле костра, мы ощущаем от него тепло. Следовательно, происходит теплопередача, но не вследствие теплопроводности, так как воздух между пламенем костра и нами — это теплоизолятор. Конвекцией в этом случае теплообмен тоже объяснить нельзя, так как мы находимся не над костром, а рядом с ним, и потоки холодного воздуха идут к костру с нашей стороны. Здесь имеем дело ещё с одним видом теплопередачи, который называют излучением, о нём мы уже упоминали, когда обсуждали нагревание Земли светом от Солнца сквозь безвоздушное пространство). Отсюда вытекает, что для теплопередачи с помощью излучения не нужно никакой промежуточной среды между телом и нагревателем.
Опыт 5. Возьмём теплоприёмник — круглую коробочку, одна сторона которой зеркальная, а вторая — покрыта чёрной краской (рис. 236), соединим его с помощью резиновой трубки с манометром.
Разместим на некотором расстоянии от теплоприёмника включённую электроплитку. Вскоре манометр покажет, что давление воздуха в коробочке теплоприёмника увеличился за счёт его нагревания от стенки коробочки, температура которой повысилась вследствие теплообмена с электроплиткой. Люди и все окружающие тела при любой температуре являются источниками теплового излучения, которое по своей природе и свойствам подобно свету и радиоволнам. Чем выше температура тела, тем интенсивнее тепловое излучение от него. Мы не видим его, но воспринимаем кожей как жар, идущий от источника. В нашем опыте раскалённая электроплитка и была мощным источником тепловых лучей, воспринимаемых теплоприёмником.
Излучение — это вид теплопередачи, который может происходить без промежуточной среды между телами и обусловлен испусканием и поглощением ими теплового излучения.
Все тела не только испускают, но и поглощают тепловые лучи. Чтобы исследовать, как влияют свойства тела на его способность поглощать тепловое излучение, повторим наш опыт дважды: сначала повернём теплоприёмник к электроплитке блестящей поверхностью, а потом — тёмной.
Опыты, подобные нашим, показали, что тела с тёмной поверхностью лучше излучают и поглощают тепловые лучи. Тела, со светлой и блестящей поверхностью, излучают и поглощают энергию хуже чем с тёмной. Теперь можно ответить на вопрос, для чего одни предметы красят тёмными красками, а другие — делают блестящими. Например, чайник с блестящей поверхностью дольше сохраняет воду тёплой, так как такая поверхность меньше излучает тепла, чем тёмная. Вагоны-холодильники красят в светлый цвет, чтобы они не нагревались на солнце. Летом мы чаще носим светлую одежду, а зимой — тёмную.
Кстати:
Средняя температура тела человека 36,6 °С поддерживается организмом в разнообразных условиях жизни и деятельности. В тканях и органах его тела непрерывно происходят процессы окисления, которые сопровождаются выделением тепла. Большая часть энергии, получаемой в результате усвоения пищи, затрачивается на механическую работу, выполнение которой также сопровождается выделением тепла в организме. Всё это тепло рассеивается телом человека в окружающую среду.
Самочувствие человека в значительной мере зависит от количества тепла, которое теряет организм. В зависимости от назначения помещения, вида выполняемой работы и влажности воздуха нормальной для человека может быть температура окружающей среды от 11 до 23 °С. Низкие температуры ускоряют процессы выделения теплоты в организме, повышение температуры вызывает усиление потовыделения, которое является средством регулирования температуры организма. Однако организм человека способен поддерживать собственную температуру постоянной только при изменении температуры окружающей среды в небольших пределах. Например, для человека, находящегося в состоянии покоя, во влажном воздухе температура тела начинает повышаться при температуре воздуха выше 30 °С, а в сухом — выше 40 °С.
Особенно чувствителен организм человека к интенсивности излучения.
Отрицательно влияет на него излучение горячих предметов. Большое влияние на самочувствие человека оказывает температура поверхностей помещений, с которыми тело человека обменивается теплом вследствие излучения. Изменение температуры стен от 20 до 10 °С сопровождается увеличением излучения тела человека на 30 %.
Пример №1
В каком состоянии внутренняя энергия 1 кг воды больше: в твёрдом, жидком или газообразном?
Ответ: внутренняя энергия 1 кг воды в газообразном состоянии больше, чем в жидком, а в твёрдом — меньше, чем в жидком состоянии.
Пример №2
Как объяснить, что пожарный в специальной одежде спокойно стоит в огне и не ощущает его (рис. 237)?
Ответ: ткань спецодежды изготовлена из материалов, обладающих очень низкой теплопроводностью. Кроме того, спецодежда имеет серебристый цвет и отражает тепловые лучи.
Пример №3
Объясните, почему птицы с большими крыльями (орлы, коршуны) могут держаться на одной высоте, не делая взмахов крыльями.
Ответ: за счёт восходящих потоков воздуха, т. е. конвекции.
Количество теплоты и удельная теплоёмкость вещества
Для количественного описания свойств теплообмена применяют специальные физические величины, одной из которых является количество теплоты.
Количество теплоты показывает, какая кинетическая энергия хаотического (беспорядочного) движения молекул передалась от одного тела к другому при теплообмене, в результате которого изменилась внутренняя энергия обоих тел, находящихся в тепловом контакте.
От каких условии теплообмена зависит количество теплоты? Всем вам, наверное, приходилось нагревать воду, и вы хорошо знаете, что для нагревания чайника, заполненного до краёв водой, нужно большее количество теплоты, чем для того же чайника, наполненного наполовину. Отсюда следует, что чем больше масса тела, тем большее количество теплоты нужно затратить, чтобы изменить его температуру на то же количество градусов.
Опыт 1. На одинаковые нагреватели поставим одинаковые сосуды, в один из которых налито 200 г воды (рис. 242, а), а во второй — 400 г (рис. 242, б).

Чем больше масса тела, тем большее количество теплоты нужно сообщить ему, чтобы нагреть до определённой температуры.
В то же время, остывающее тело передаёт окружающей среде тем большее количества теплоты, чем больше его масса. Например, если оставить остывать сосуды из предыдущего опыта, то сосуд, в котором масса воды равна 400 г, понизит свою температуру до комнатной за большее время, чем тот, в котором 200 г воды, и отдаст при этом вдвое большее количество теплоты.
Опыт 2. Поставим теперь сосуд с водой комнатной температуры на нагреватель и нагреем воду, например, на 10°С. Процесс нагревания продолжается некоторое время, за которое телу будет передано определённое количество теплоты. Если мы решим поднять температуру воды ещё на 10 °С, то процесс нагревания нужно будет продолжить, и он будет длиться такое же время, которое потребовалось в первой части опыта. Понятно, что при этом воде будет передано дополнительно такое же количество теплоты, что и ранее. Следовательно, чем больше разность конечной и начальной температур тела при нагревании, тем большее количество теплоты необходимо для этого.
Чем больше разность конечной и начальной температур тела, тем большее количество теплоты ему будет сообщено при нагревании.
Опыт 3. Возьмём два одинаковых сосуда, первый из них содержит 400 г воды (рис. 243, а), а второй — 400 г масла (рис. 243, б) комнатной температуры и поставим их на одинаковые нагреватели.
Наблюдая за показаниями термометров, погружённых в каждую из жидкостей, увидим, что масло приобретёт заданную температуру первым. Чтобы температура воды сравнялась с температурой масла, нагревание воды нужно продолжить и сообщить ей дополнительное количество теплоты.
Количество теплоты, необходимое для нагревания тела до определённой температуры, зависит от того, из какого вещества состоит тело.
Опыт 4. Нагреем железное и алюминиевое тела одинаковой массы до определённой температуры, например до 40°С (рис. 244).
Тела из разных веществ одинаковой массы и температуры, остывая, выделяют разное количество теплоты.
Количество теплоты — это тепловая энергия, которую получает или теряет тело при теплообмене. Оно зависит от вещества, из которого состоит тело, массы этого тела и разности его конечной и начальной температур.
Количество теплоты обозначают большой латинской буквой 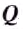
Чтобы повысить температуру воды массой 1 кг на 1°С, нужно сообщить ей количество теплоты, равное 4200 Дж; если нагревать 1 кг золота на 1°С, то понадобится лишь 130 Дж. Следовательно, для нагревания каждого вещества массой 1 кг на 1°С требуется определённое количество теплоты. При охлаждении на 1°С этих веществ массой 1 кг будут выделяться такие же количества теплоты.
Физическую величину, показывающую, какое количество теплоты необходимо для изменения температуры вещества массой 1 кг на 1°С, называют удельной теплоёмкостью вещества.
Удельную теплоёмкость вещества обозначают малой латинской буквой с. Единицей удельной теплоёмкости вещества является один джоуль, поделённый на один килограмм и один градус Цельсия 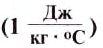
В таблице 7 приведены значения удельной теплоёмкости для многих веществ, используемых в промышленности и быту.
Что означает выражение «удельная теплоемкость серебра равна 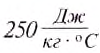
Это выражение означает, что для нагревания 1 кг серебра на 1°С нужно затратить количество теплоты, равное 250 Дж, или при охлаждении 1 кг серебра на 1°С выделяется количество теплоты, равное 250 Дж.
Анализируя табл. 7, видим, что вода имеет очень большую удельную теплоёмкость. Поэтому вода в морях и океанах, нагреваясь летом, поглощает большое количество теплоты, и в местах вблизи больших водоёмов летом не бывает так жарко, как в местах, отдалённых от воды. Зимой вода охлаждается и отдаёт значительное количество теплоты, поэтому зима в этих местах не такая суровая. Благодаря большой удельной теплоёмкости воду широко используют в системах водяного отопления, для охлаждения двигателей.
Ранее из результатов опытов был сделан вывод, что для нагревания любого тела нужно затратить определённое количество теплоты, зависящее от рода вещества, из которого оно изготовлено, и пропорциональное массе тела и разности его конечной и начальной температур.
А как вычислить количество теплоты, если заданы определённые значения всех этих величин ?
Например, нужно рассчитать, какое количество теплоты получила при нагревании медная деталь массой 5 кг, если её температура увеличилась с 20 до 520°С. В табл. 7 находим значение удельной теплоёмкости меди: она равна 380 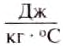

Чтобы вычислить количество теплоты, необходимое для нагревания тела, или количество теплоты, которое выделяет тело при охлаждении, нужно удельную теплоёмкость вещества умножить на массу тела и на разность конечной и начальной температур тела.
Математически это правило записывают в виде такой формулы: 
где 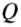
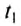
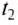
Чтобы определить массу тела, которое нагревается или охлаждается, нужно количество теплоты разделить на удельную теплоёмкость вещества и на разность конечной и начальной температур тела:
Чтобы определить удельную теплоёмкость вещества, из которого изготовлено тело, нужно количество теплоты разделить на массу тела и на разность его конечной и начальной температур:
Чтобы определить, на сколько градусов изменилась температура тела, нужно количество теплоты разделить на удельную теплоёмкость вещества и на массу тела:
Кстати:
Единицей количества теплоты с давних времён была особая единица — калория (от латинского слова калор — тепло, жар).
Калория (кал) — это количество теплоты, которое нужно сообщить 1 г воды для нагревания её на 1 °С. Можно сказать также, что калория — это количество теплоты, которую теряет 1 г воды, охлаждаясь на 1 °С.
Пользуются также большей единицей количества теплоты — килокалорией (это можно увидеть в надписях на консервах):
Тепловой баланс
Тела с разными температурами обмениваются между собой теплотой. Тела, более нагретые, отдают часть своей энергии телам, менее нагретым, до тех пор, пока у них температура не уравняется .
Количество теплоты, отданное всеми охлаждающимися телами, равно количеству теплоты, полученному всеми нагревающимися телами (при условии, что при этом не происходит превращения тепла в другие виды энергии).
При расчётах, касающихся обмена энергией между телами, всегда следует учитывать всё то количество теплоты, которое в рассматриваемых тепловых явлениях отдают тела, и то количество теплоты, которое получают другие тела, принимающие участие в тех же явлениях: эти количества теплоты должны быть равны между собой.
Применим это утверждение к смешиванию двух жидкостей разной температуры.
Обозначим массу холодной жидкости через 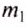
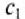
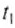
Если обе жидкости смешать в одном сосуде (для упрощения задачи будем считать, что он изготовлен из вещества, являющегося полным теплоизолятором и не принимает участия в теплообмене), то молекулы горячей жидкости будут отдавать энергию молекулам холодной жидкости до тех пор, пока не установится некоторая промежуточная температура смеси жидкостей. Обозначим окончательную температуру смеси большой греческой буквой 
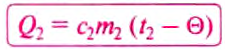
а количество теплоты, полученное жидкостью, которая нагревается,
такой: 
Поскольку количество теплоты, отданной охлаждающейся жидкостью, равно количеству теплоты, полученной нагревающейся жидкостью, т. е. 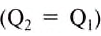

Это уравнение называют уравнением теплового баланса. В своё время для случая воды его вывел петербургский академик Георг Рихман.
Из уравнения теплового баланса можно, если остальные величины известны, определить массу одной из смешиваемых жидкостей, или её начальную температуру, или температуру смеси, а также значение неизвестной удельной теплоёмкости.
Пример №4
Какое количество теплоты нужно затратить, чтобы 2 кг води нагреть от 20 до 100°С?
Дано:
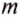
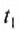
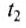
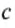
Решение:
Количество теплоты, необходимое для нагревания тела, определяется по формуле: 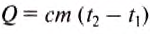
Ответ: 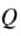
Пример №5
Какое количество теплоты выделится при охлаждении 3 кг свинца от 320 до 20 0С?
Дано:
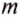
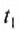
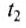
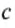
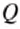
Решение:
Количество теплоты, необходимое для нагревания тела, определяется по формуле :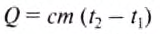
Знак «—» означает, что энергия выделилась при охлаждении тела.
Ответ: 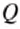
Плавление и кристаллизация твёрдых тел
Наблюдение. Лёд из морозильной камеры, положим в тарелку; через некоторое время он начинает таять и полностью превращается в воду.
Опыт 1 . Кусочки олова поместим в стальную ложку и будем нагревать на спиртовке или газовой горелке (рис. 248).

Следовательно, нагревая тела, их можно перевести из твёрдого состояния в жидкое, и, наоборот, охлаждая, — из жидкого состояния в твёрдое.
Процесс перехода вещества из твёрдого состояния в жидкое называют плавлением. Процесс перехода вещества из жидкого состояния в твёрдое называют кристаллизацией (отвердеванием).
Зимой, осенью, весной, когда температура воздуха может быть О °С. тают снег и лёд, но вместе с тем замерзает вода. При О °С снег и лёд тают (плавятся), а вода замерзает (отвердевает). На Севере, в Антарктиде, где температура воздуха может опускаться ниже — 40 «С, нельзя пользоваться ртутным термометром, так как ртуть отвердевает при температуре — 39 «С. Там используют спиртовые термометры, так как спирт замерзает при температуре -114°С.
Каждое вещество плавится или кристаллизуется при определённой температуре. Температуру, при которой вещество плавится, называют температурой плавления, а при которой отвердевает, — температурой кристаллизации. Из опыта известно, что вещества отвердевают при той же температуре, при которой плавятся. Во время плавления тела поглощают теплоту, а во время отвердевания — выделяют. Значения температур плавления для наиболее используемых веществ представлены в таблице 8 на с. 193.
Опыт 2. В сосуд с кусочками льда поместим термометр и будем его подогревать (рис. 249). Лёд будет таять, а термометр будет показывать 0 °С. Пока весь лёд не растает, температура (0 °С) в сосуде изменяться не будет.
При плавлении вещества его температура не изменяется.
Опыт 3. Поставим на чашку весов закрытый сосуд со льдом, уравновесим весы (рис. 250, а). Через некоторое время лёд превратится в воду. Равновесие весов не нарушится (рис. 250, б).
При переходе вещества из одного состояния в другого его масса не изменяется.
Опыт 4. Нальём в бутылку воды и плотно её закупорим. Поместим бутылку с водой в холодильную камеру. Когда вода замёрзнет, бутылка треснет, так как объём льда больше, чем воды (рис. 251).
При переходе вещества из одного состояния в другое изменяется его плотность, а, следовательно, и объём данной массы вещества.
Теперь выясним, от чего зависит количество теплоты, которое нужно затратить, чтобы расплавить кристаллическое тело при температуре плавления или которое выделяется во время его кристаллизации.
Опыт 5. В одном сосуде будем плавить 100 г свинца (рис.252, а), а во втором — 200 г (рис. 252, б).
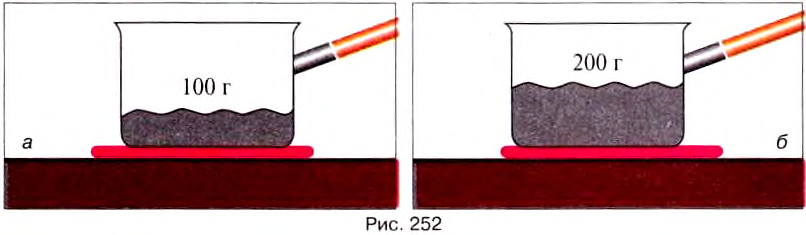
Количество теплоты, необходимое для плавлення тела, зависит от его массы.
Опыт 6. На одинаковых нагревателях в одном сосуде будем плавить 100 г свинца (рис. 253, а), а во втором — 100 г олова (рис. 253, б). В результате опыта увидим, что для плавления олова нужно затратить большее количество теплоты, чем для плавления свинца.
Количество теплоты, необходимое для плавления тела, зависит от рода вещества, из которого изготовлено тело.
Величину, характеризующую энергетические затраты на плавление определённого вещества, называют удельной теплотой плавления вещества. Её обозначают малой греческой буквой 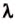
Единицей удельной теплоты плавления вещества в СИ является один джоуль на килограмм 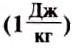
Удельную теплоту плавления вещества определяют с помощью опытов. Было установлено, что удельная теплота плавления льда равна 340 ООО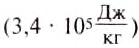
Удельная теплота плавления вещества — это физическая величина, показывающая, какое количество теплоты нужно сообщить телу массой 1 кг, чтобы превратить его в жидкость при температуре плавления.
Из опытов определена удельная теплота плавления для каждого вещества, значения которой для наиболее используемых веществ представлены в таблице 8.
Чтобы рассчитать количество теплоты 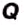

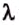
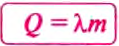
где 

Количество теплоты, которая выделяется при отвердевании тела массой 
Процессы нагревания и кристаллизации можно изобразить графически. По оси Оу откладываем значение температуры вещества, а по оси Ох -время нагревания и плавления вещества. Например, на рис. 254 графически изображены процессы нагревания льда, плавления льда и нагревания воды. График нагревания и плавления вещества состоит из трёх участков: для нагревания льда — это прямая линия с определённым углом наклона, зависящим от значения удельной теплоёмкости вещества: чем больше её значение, тем меньший наклон, температура льда возрастает прямо пропорционально времени нагревания; для плавления льда — это горизонтальная линия, температура смеси воды и льда остаётся постоянной и равна температуре плавления льда до тех пор, пока весь лёд не растает; для нагревания образовавшейся воды — прямая линия, угол наклона которой определяется удельной теплоёмкостью воды. Её значение больше, чем для льда, поэтому и наклон меньший.
Пример №6
Пользуясь таблицей 8, выясните, в каком состоянии находятся металлы: серебрю, золото, медь, алюминий, вольфрам, сталь при температуре 1000 °С?
Ответ: серебро, алюминий — в жидком состоянии; золото, медь, вольфрам, сталь — в твёрдом состоянии.
Пример №7
Какое количество теплоты нужно затратить, чтобы расплавить 1 кг свинца, взятого при температуре 27 °С?
Дано:
Решение:
Для того чтобы расплавить свинец, его нужно нагреть до температуры плавления, а потом расплавить. Количество теплоты, необходимое для нагревания свинца, определяем по формуле: 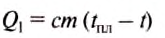
Количество теплоты, необходимое для того, чтобы расплавить свинец, определяем по формуле: 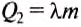
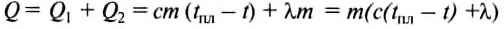
Подставив значения величин, получим:
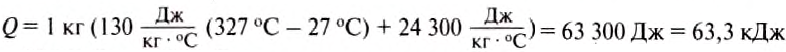
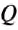
- Заказать решение задач по физике
Испарение и конденсация жидкостей
Наблюдение 1. Летом после дождя лужи быстро высыхают; вечером, когда воздух становится холоднее, выпадает роса. Если оставить на огне сосуд с водой, то спустя некоторое время воды в сосуде не останется, так как она выкипит. Следовательно, жидкости могут испаряться, т. е. переходить в газообразное состояние. Легко убедиться, что чем выше температура, тем интенсивнее происходит этот процесс. Так, летом лужи высыхают быстрее, чем весной или осенью.
Процесс перехода жидкости в пар (в газообразное состояние) называют парообразованием.
Существуют два способа перехода жидкости в газообразное состояние: испарение и кипение.
Испарение — это парообразование, происходящее со свободной поверхности жидкости.
Испарение происходит при любой температуре, но скорость его зависит от нескольких причин. Чтобы убедиться в этом, выполним такие опыты.
Опыт 1. На бумагу капнем эфира, воды, спирта, масла. Сначала испарится эфир, потом — спирт, вода, а масло будет высыхать несколько дней.
Скорость испарения зависит от вида жидкости.
Опыт 2. Нальём одинаковое количество воды в стакан и широкую тарелку. Вода сначала испарится из тарелки, а потом — из стакана.
Скорость испарения зависит от площади поверхности жидкости.
Опыт 3. Одну тарелку с водой поставим на столе в комнате, а другую — на батарею водяного отопления или другое тёплое место. Вода сначала испарится из той тарелки, которая стоит в более тёплом месте.
Скорость испарения зависит от температуры жидкости.
Наблюдение 2. Выстиранное бельё развешивают для просушки. В сухую ветреную тёплую погоду бельё сохнет намного быстрее, чем в тихую или прохладную погоду.
Скорость испарения зависит от наличия потоков воздуха и его влажности.
Теперь, зная причины, от которых зависит скорость испарения, мы можем объяснить, для чего, например, переливают чай из стакана в блюдце, дуют на горячий борщ или кашу, пользуются веером при высокой температуре воздуха.
При определённой температуре (температуре кипения) жидкости начинают интенсивно испаряться не только с поверхности, но и изнутри с образованием пузырьков. Это явление называют кипением (рис. 256).
Кипение — это интенсивное парообразование не только со свободной поверхности жидкости, но и из всего объёма внутрь пузырьков пара, которые при этом возникают.
Значение температуры кипения жидкостей зависит от атмосферного давления. В таблице 9 на с. 199 представлены значения температуры кипения некоторых жидкостей при нормальном атмосферном давлении: вода кипит при температуре 100 °С, ацетон — при 56 °С, жидкий кислород — при —183 °С.
Из опытов известно, что с охлаждением газов до определённой температуры (температуры конденсации) они начинают сжижаться и становятся жидкостями. Установлено, что это происходит при той же температуре, при которой соответствующая жидкость кипит. Это обратные процессы, как и в случае перехода воды в лёд, направление перехода зависит от конкретных физических условий: если жидкость получает теплоту, то кипит и переходит в газообразное состояние; если газ отдаёт теплоту, то он сжижается, т. е. конденсируется. Например, аммиак конденсируется при температуре —33,4°С, жидкий кислород — при —183 °С, воздух — при — 195 °С.
В воздухе содержится много водяного пара. Когда воздух охлаждается, пар переходит в жидкое состояние: образуются тучи, туман, роса.
Теперь выясним, от чего зависит количество теплоты, которое нужно затратить, чтобы испарить жидкость при температуре кипения или которое выделяется при конденсации газа.
Опыт 4. Поставим на плиту два сосуда, в один из которых нальём 50 г воды (рис. 257, а), а в другой — 100 г воды (нагреватели и сосуды одинаковы) (рис. 257, б). Доведём воду до кипения и будем испарять. Сначала испарится вода в сосуде, где было 50 г, а потом — в сосуде со 100 г воды.
Количество теплоты, необходимое для испарения жидкости при температуре кипения, зависит от массы жидкости.
Опыт 5. На одинаковые нагреватели поставим сосуды, в одном из которых 50 г воды (рис. 258, а), а во втором — 50 г спирта (рис. 258, б).
Количество теплоты, необходимое для испарения жидкости при температуре кипения, зависит от рода вещества.
Величину, которая характеризует энергетические затраты на испарение определённой жидкости массой 1 кг, называют удельной теплотой парообразования. Её обозначают большой латинской буквой L . Единицей удельной теплоты парообразование вещества в СИ является один джоуль на килограмм 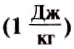
Удельную теплоту парообразования вещества определяют с помощью опытов. Установлено, что удельная теплота парообразования воды при 100 °С равна 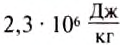
Это значит, что для превращения воды массой 1 кг в пар при 100 °С необходимо 2 300 000 Дж энергии.
При обратном процессе-конденсации — такое же количество теплоты выделится.
Удельная теплота парообразования вещества -это ■ физическая величина, определяющая, какое количество теплоты необходимо, чтобы превратить жидкость массой 1 кг в пар при температуре кипения.
Каждая жидкость имеет свою удельную теплоту парообразования. Значения удельной теплоты парообразования некоторых жидкостей приведены в таблице 9.
Чтобы рассчитать количество теплоты 

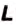
где 
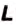

Количество теплоты, выделяющееся при конденсации пара массой 
Процессы нагревания и испарения можно изобразить графически. По оси Оу откладываем значение температуры жидкости, а по оси Ох — время нагревания и испарения жидкости. Например, на рис. 259 графически изображены процессы нагревания и испарения воды кипением.
График нагревания и испарения жидкости состоит из трёх участков: для нагревания жидкости — это прямая линия с определённым углом наклона, который зависит от значения удельной теплоёмкости жидкости; для кипения жидкости — это горизонтальная линия, температура жидкости остаётся постоянной и равна температуре кипения жидкости до тех пор, пока вся жидкость испарится; для нагревания образовавшегося пара — прямая линия, угол наклона которой определяется удельной теплоёмкостью пара, температура пара возрастает прямо пропорционально времени.
Пример №8
Почему жирный суп долго не остывает даже тогда, когда его налили в тарелку?
Ответ: жир очень медленно испаряется по сравнению с водой, поэтому тонкий слой жира на поверхности супа задерживает испарение воды, в связи с этим охлаждение супа замедляется.
Пример №9
Какое количество теплоты нужно затратить, чтобы превратить 3 кг спирта, взятого при температуре 18 °С, в пар?
Дано:
Решение:
Для превращения спирта в пар нужно сначала его нагреть до температуры кипения, а потом испарить.
Количество теплоты, необходимой для нагревания -спирта, определяем по формуле: 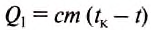
Количество теплоты, необходимое для испарения спирта
определяем по формуле: 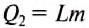
Тогда количество теплоты, затраченной на нагревание и испарение спирта, определим так:
Подставив значения величин, получим:
Ответ: 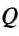
Сгорание топлива и удельная теплота
Основным источником энергии для обеспечения движения железнодорожных локомотивов, автомобилей, тракторов, самолётов и т. п. являются разные виды топлива. В промышленности, на транспорте и в быту используют такие виды топлива: уголь, горючие сланцы, нефть, бензин, дизельное топливо, природный газ и др.
Выясним, при каких условиях происходит полное сгорание топлива и каковы его результаты.
Опыт 1. Зажжём свечу. Она будет гореть. Накроем её стеклянным сосудом (рис. 261, а). Через некоторое время свеча гаснет (рис. 261, б).
Почему?
Процесс горения происходит при наличии воздуха.
Опыт 2. Цилиндр с поршнем соединяем со стеклянным шаром. На поршень ставим гирю. Нагреваем шар, сжигая сухое топливо. Воздух, нагревшийся в шаре, расширяется и выталкивает поршень, поднимая гирю, т. е. выполняет работу.
При сжигании топлива выделяется энергия, за счёт которой выполняется работа.
Уголь, нефть, мазут, дерево содержат углерод (табл. 10). При горении молекулы углерода соединяются с молекулами кислорода, содержащегося в воздухе. Каждая молекула углерода взаимодействует с двумя молекулами кислорода, образуя при этом молекулу углекислого газа. С образованием этой молекулы выделяется энергия.
При полном сгорании углерода образуется углекислый газ и выделяется энергия:
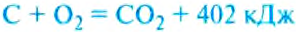
Горение связано с разрушением одних молекул и образованием других, например при горении метана образуются углекислый газ и вода (рис. 262) с выделением энергии:
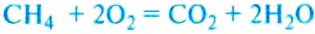
При горении изменение внутренней энергии вещества происходит не путём теплообмена или выполнения работы телом или над телом, а в результате термохимических реакций с участием топлива. При этом энергия движения молекул продуктов сгорания, а значит, и их температура будут больше, чем у молекул топлива.
Горение топлива — это процесс соединения молекул топлива с молекулами кислорода, который сопровождается выделением определённого количества теплоты и образованием новых веществ (табл. 10).
Опыт 3. Два одинаковых стакана наполним водой одинаковой массы. Под одним стаканом зажжём одну таблетку сухого топлива, а под вторым — дне таблетки. Температуру воды в стаканах измеряем с помощью термометров. После полного сгорания сухого топлива температура воды во втором стакане оказывается выше, чем в первом.
Количество теплоты, выделяющееся при полном сгорании топлива, зависит от массы топлива.
При конструировании и производстве тепловых двигателей всегда нужно знать, какое количество теплоты необходимо для работы определённого двигателя, а значит, и определять вид топлива. Для определения необходимого количества топлива нужно знать, какое количество теплоты выделяется при полном его сгорании. Чтобы сравнивать, какой вид топлива при его полном сгорании выделяет больше теплоты, ввели такую физическую величину, как удельная теплота сгорания топлива.
Количество теплоты, выделяющееся при полном сгорания 1 кг топлива, называют удельной теплотой сгорания топлива.
Удельную теплоту сгорания топлива обозначают малой латинской буквой 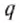
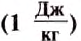
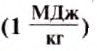
Удельная теплота сгорания топлива — это физическая величина, являющаяся энергетической характеристикой разных видов топлива.
Её значения для распространённых видов топлива приведены в таблице 11.
Следует подчеркнуть, что приведённые в таблице данные соответствуют количеству теплоты, выделяющейся при полном сгорании топлива.
Чтобы подсчитать, какое количество теплоты выделится при полном сгорании 5 кг керосина, нужно рассуждать так. При сгорании 1 кг керосина выделяется 46 Мдж теплоты. Когда сгорит 5 кг керосина, количество выделенной теплоты будет в 5 раз больше, а именно: 46 Мдж • 5 = 230 МДж.
Чтобы определить количество теплоты, выделяющейся вследствие полного сгорания данной массы определённого вида топлива, нужно удельную теплоту сгорания этого вида топлива умножить на массу топлива:
где 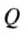
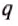
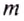
Кстати:
При неполном сгорания углерода, содержащегося в топливе, в печах или котлах, в двигателях внутреннего сгорания, выделяется оксид углерода (угарный газ): 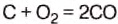
Пример №10
Каждое топливо в присутствии воздуха и в контакте с огнём загорается при определённой температуре: например, мазут — при 55 °С; сухое дерево — при 300 °С; каменный уголь — при 600 °С. Можно ли сразу засыпать в котел каменный уголь?
Ответ: нельзя, каменный уголь не загорится, так как в котле не достигнута соответствующая температура.
Пример №11
Какое количество воды можно нагреть от 0 до 100 °С, сжигая 1 кг водорода?
Дано:
Решение.
Количество теплоты, выделившееся при полном сгорании топлива, определяем по формуле: 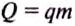
Количество теплоты, необходимой для нагревания води, определяем по формуле:
Считаем, что вся энергия, выделившаяся при сгорании водорода, пойдёт на нагревание воды. Тогда:
Отсюда: 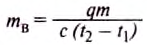
Подставим значение величины, получим:
Ответ: 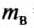
Тепловые двигатели
Тепловые машины были созданы в начале XVIII ст., в период бурного развития текстильной и металлургической отраслей промышленности. Паровую водоподъёмную установку построили англичане Т. Ньюкомен и Дж. Коули в 1712 г. В России паровой двигатель создал И. Ползунов в 1765 г., а в 1784 г. в Англии Д. Уатт получил патент на универсальный паровой двигатель. Создание паровых машин, двигателей внутреннего сгорания положило начало развитию автомобильного транспорта и самолётостроения. Газовая турбина дала толчок перестройке в авиации, самолёты с поршневыми двигателями были заменены реактивными и турбореактивными лайнерами, скорость которых
приближается или больше скорости звука 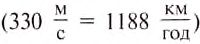
С помощью реактивных двигателей осуществлена давняя мечта человечества — выход в космическое пространство. На электростанциях паровые турбины приводят в движение электрические генераторы, вырабатывающие электрический ток.
Все тепловые машины, независимо от их устройства и назначения, разделяют на два вида: тепловые двигатели и холодильные установки.
Опыт. Нальём в пробирку немного воды, плотно закроем её пробкой (рис. 264) и нагреем воду до кипения. Под давлением пара пробка вылетит из пробирки вверх. В этом случае энергия топлива перешла во внутреннюю энергию пара, а пар, расширяясь, выполнил работу — поднял пробку. Внутренняя энергия пара превратилась в кинетическую энергию пробки. Если заменить пробирку крепким металлическим цилиндром, а пробку — припасованным поршнем, который может двигаться в цилиндре (рис. 265), то получим простейший тепловой двигатель, в котором внутренняя энергия топлива превращается в механическую энергию поршня.
Тепловыми д в и г а те л я м и называют машины, в которых внутренняя энергия топлива превращается в механическую энергию.
К тепловым двигателям относятся: паровая машина, двигатель внутреннего сгорания (карбюраторный, дизельный), паровая и газовая турбины, реактивный двигатель.
Во всех этих двигателях внутренняя энергия топлива сначала переходит во внутреннюю энергию газа или пара. Расширяясь, газ выполняет работу и при этом охлаждается — часть его внутренней энергии превращается в механическую энергию.
Двигатель внутреннего сгорания. Такое название происходит от того, что топливо сгорает в цилиндре, внутри самого двигателя.
Первый поршневой двигатель внутреннего сгорания (ДВС) был создан в 1860 г. французским инженером Э. Ленуаром. Преимущество такого двигателя перед другими тепловыми двигателями заключается в том, что он имеет сравнительно малые размеры и массу. Это дало возможность использовать его на транспорте (автомобиль, трактор, тепловоз), в авиации, на кораблях (дизель-электроход, катер, подводная лодка).
Двигатели внутреннего сгорания работают на жидком топливе (бензине, керосине, нефти) или на горючем газе. На рис. 266 показан разрез простейшего ДВС.
Двигатель состоит из цилиндра, в котором перемещается поршень 3, соединённый с помощью шатуна 4 с коленчатым валом 5. На валу закреплён тяжёлый маховик 6, предназначенный для уменьшения неравномерности вращения вала.
В верхней части цилиндра есть два клапана 1 и 2, которые во время работы двигателя автоматически открываются и закрываются в нужные моменты. Через клапан 1 в цилиндр поступает смесь, которая зажигается с помощью свечи 7, а через клапан 2 выходят отработанные газы.
Каждый ход поршня вверх или вниз называется тактом. Рассмотрим процессы, происходящие в течение каждого такта.
Пусть поршень движется вниз из крайнего верхнего положения (рис. 267, а), и впускной клапан 1 открыт. При опускании поршня через этот клапан в камеру сгорания всасывается горючая смесь — пар бензина с воздухом. В конце такта клапан 1 закрывается. Такой такт называется впуском.
Поршень начинает подниматься вверх, сжимая горючую смесь (рис. 267, б). Этот такт называется сжатием.
Третий такт двигателя (рис. 267, в) называется рабочим ходом. Во время сгорания смеси температура газов в цилиндре достигает 1600—1800 °С, а давление — 10 000 000 Па. Эти газы с большой силой давят на поршень, который опускается вниз и с помощью шатуна 4 и кривошипного механизма сообщают движение коленчатому валу.
В конце рабочего хода, когда поршень приходит в крайнее нижнее положение, открывается выпускной клапан 2 (рис. 267, г). Начинается четвертый такт — выпуск. Поршень, поднимаясь вверх, выталкивает отработанные газы в атмосферу.
Итак, работа четырёхтактного двигателя состоит из четырех процессов (тактов): впуска, сжатия, рабочего хода и выпуска.
В автомобилях чаше всего используют четырёхцилиндровые двигатели внутреннего сгорания. Работа цилиндров в нём согласована так, что в каждом из них поочерёдно осуществляется рабочий ход, и коленчатый вал всё время получает енергию от каждого из поршней. Есть также и восьмицилиндровые двигатели. Они лучше обеспечивают равномерность вращения вала и имеют большую мощность.
Паровая турбина
Это тепловой двигатель, в котором пар, нагретый до высокой температуры, находится под высоким давлением и вращает его вал без помощи поршня, шатуна и коленчатого вала. На рис. 268 приведена схема простейшей паровой турбины. На вал 1 насажен диск 2, по ободу которого закреплены лопатки 3. Возле лопаток размешены трубы, называемые соплами 4. Пар образующийся в котле, поступает в сопла, вырывается струями, действующими с большой силой на лопатки и приводящими во вращательное движение диск турбины. В современных паровых турбинах применяют не один, а много дисков, насаженных на общий вал (рис. 269). Пар последовательно проходит через лопатки всех дисков, отдавая каждому из них часть своей энергии. Паровые турбины являются незаменимыми тепловыми двигателями на тепловых и атомных электростанциях. Первую паровую турбину практического применения изготовил в 1889 г. К. Лавал.
Газовая турбина и реактивные двигатели
Преимущества паровой турбины и двигателя внутреннего сгорания объединены в газовой турбине, в которой внутренняя энергия газа превращается в кинетическую энергию вала.
В камеру сгорания 4 (рис. 270) газовой турбины с помощью компрессора 2 подаётся сжатый воздух при температуре приблизительно 200 °С и впрыскивается жидкое топливо (керосин) под высоким давлением. При горении топлива воздух и продукты сгорания нагреваются до температуры 1500—2200 °С. Газ, движущийся с большой скоростью, направляется на лопатки турбины 3. Проходя от одного диска турбины к другому, газ отдаёт свою внутреннюю энергию, приводя турбину в движение. Получаемая механическая энергия используется для вращения, например, винта самолёта 1 или электрического генератора.

Впервые возможность и необходимость использования ракетных двигателей для запуска летательных аппаратов в космическое пространство обосновал в 1903 г. К. Циолковский.
В своей жизни вы постоянно сталкиваетесь с разнообразными двигателями. Они приводят в движение автомобили и самолёты, трактора, корабли и железнодорожные локомотивы. С помощью тепловых машин на электростанциях вырабатывается электрический ток. Работа тепловых машин связана с использованием разных видов топлива. Топки тепловых электростанций, двигатели внутреннего сгорания автомобилей (рис. 272), самолётов и других машин выбрасывают в атмосферу вредные для человека, животных и растений вещества (угарный газ, углекислый газ, оксиды азота, серы и т. п.).
Эти вещества соединяются с атмосферной влагой и образуют кислоты. Это становится причиною выпадения кислотных дождей, в результате чего уничтожаются хвойные леса, гибнет рыба, снижается урожайность зерновых культур и сахарной свёклы. Увеличение количества автомашин, особенно в городах, приводит к чрезмерному загрязнению атмосферы выхлопными газами двигателей внутреннего сгорания. Чтобы уменьшить эти выбросы, проводят регулирование двигателей для полного сгорания топлива и уменьшения содержания угарного газа, внедряют двигатели в которых используют более чистое топливо.
Применение паровых турбин на электростанциях требует много воды и больших площадей, которые занимают водоёмы для охлаждения отработанного пара. Для экономии площади и водных ресурсов целесообразно строить комплексы электростанций, имеющих замкнутую систему водоснабжения.
Наиболее эффективный способ борьбы с загрязнением среды — замена двигателей внутреннего сгорания электрическими двигателями, использование энергии Земли, Солнца, ветра.
Кстати:
Мысль об использовании пара для потребностей транспорта возникла ещё в XVII в. Конструкторы сначала пытались приспособить паровые двигатели к обычным экипажам. В 1763 г. французский инженер Коньо сконструировал первую паровую тележку. Эта машина работала всего 12-15 мин. Позднее Жорж Коньо конструирует более совершенную тележку, но когда её пустили по улицам Парижа, то оказалось, что ей невозможно управлять. В 1787 г. американец Оливер Эванс сконструировал паровую тележку, но она тоже была непригодна к практическому использованию. В конце 80-х годов XVIII в. Уильям Мёрдок, ученик и помощник Дж. Уатта, создал паровую тележку с двигателем конструкции своего учителя. Он сконструировал ряд интересных моделей тележек, но создать практическую транспортную машину ему не удалось. Следует отметить, что проблема создания парового автомобиля так и не была решена, автомобиль был создан на базе двигателя внутреннего сгорания.
Многие изобретатели в ту эпоху старались сконструировать локомотив, который двигался бы по рельсам. Первым к идее применения паровых локомотивов на специальных рельсовых путях пришёл шотландский инженер и механик Ричард Тревитик. В 1803 г. он сконструировал паровоз для рельсового пути, а в следующем году провёл его испытания. В 1814 г. сконструировал и испытал свой первый паровоз Джордж Стефенсон. Его конструкция и решила проблему создания парового железнодорожного транспорта (рис. 273).
История создания парохода, как и паровоза, тоже интересная. Еще в начале XVIII в. Дени Папен сконструировал лодку, которая двигалась с помощью парового двигателя. Но из-за его несовершенства лодка двигалась довольно медленно. В 1736 г. англичанин Джонатан Кольз безуспешно пытался применить на судах паровую машину Т. Ньюкомена.
Более удачные попытки начались с изобретением двигателя Дж. Уатта. Так, в 1781 г. француз Клод Жоффруа сконструировал пароход, который с помощью парового двигателя мог целый час плыть против течения. Через четыре года американец Дж. Фитч построил лодку, в которой паровой двигатель приводил в движение вёсла. Однако испытание этого парохода были неудачными.
Первый практически пригодный пароход сконструировал ирландский инженер и механик Роберт Фультон, который, как и Стефенсон, был изобретателем-самоучкой. Свой первый ещё несовершенный пароход Фультон испытал в 1803 г. на р. Сене в Париже.
Опыт удался: судно в течение 1,5 ч плылло по Сене, развивая скорость 5 
Закон сохранения энергии в механических и тепловых процессах
При падении тела, поднятого над Землёй, его потенциальная энергия уменьшается, а кинетическая — увеличивается. При падении свинцового или пластилинового шарика на свинцовую плиту механическая энергия шарика уменьшается до нуля, но увеличивается внутренняя энергия шарика и плиты. В двигателе внутреннего сгорания автомобиля или трактора за счёт внутренней энергии топлива увеличивается механическая энергия подвижных частей двигателя.
Механическая и внутренняя энергии тел могут превращаться друг в друга.
Колёса водяной турбины вращаются за счёт кинетической энергии воды, а крылья ветряного двигателя — за счёт кинетической энергии ветра. При теплообмене внутренняя энергия одного тела изменяется за счёт изменения внутренней энергии другого (например, внутренняя энергия воды увеличивается за счёт уменьшения внутренней энергии нагретого куска железа, брошенного в воду).
Рассматривая пример смешивания горячей и холодной воды, выполнив соответствующие подсчёты, мы увидели, что количество теплоты, которую отдала горячая вода, равно количеству теплоты, которую получила холодная вода. «Изучение теплового баланса при смешивании воды разной температуры» подтвердила бы этот вывод, если бы вы выполняли её в условиях, не допускающих передачи тепла другим телам, кроме холодной воды, или учли бы всё количество теплоты, переданное всем телам.
При теплообмене в системе контактирующих тел количество теплоты сохраняется.
Наблюдения и опыты привели к открытию закона сохранения и изменения энергии.
Энергия не исчезает и не создаётся из ничего. Она только превращается из одного вида в другой, при этом полное значение её сохраняется.
Дополнительная энергия у тела может возникнуть только вследствие его взаимодействия с другим телом. Энергия воды океанских течений или ветра возникает за счёт энергии Солнца; потенциальная и кинетическая энергии ракеты — за счёт внутренней энергии топлива, израсходованного на её запуск и полёт.
Закон сохранения и изменения энергии — один из основных законов природы. Этот закон всегда нужно учитывать в науке и технике, с его помощью можно объяснить множество явлений природы.
Коэффициент полезного действия (КПД) нагревателя
Для оценки любого нагревателя очень важно знать, какую часть энергии, выделяющейся при сгорании топлива (или работы электронагревателя), он превращает в полезную работу. Чем больше эта часть энергии, тем более экономичен нагреватель. Для характеристики экономичности разных нагревателей вводят понятие коэффициента полезного действия (КПД) нагревателя.
Отношение той части энергии, которая расходуется на выполнение полезной работы нагревателя, ко всей энергии, выделяющейся вследствие сгорания топлива (или при работе электрического нагревателя), называется коэффициентом полезного действия (КПД) нагревателя.
КПД обозначают малой греческой буквой 
где 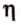
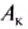
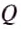
Определим, например, КПД спиртовки, газовой горелки или другого нагревателя. При сжигании массы 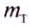
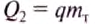
Эта энергия идет, например, на нагревание тела массой 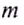
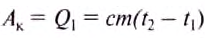
Если используем электрический нагреватель определённой мощности, то энергия, которая выделяется во время его работы, определяется по формуле: 
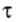
Тогда КПД нагревателя будет определяться так:
КПД нагревателя всегда меньше единицы (или меньше 100 %).
Пример №12
Почему радиатор является системой многих тонких трубок, а не сплошным резервуаром (рис. 275)?
Ответ: чтобы обеспечить достаточный теплоотвод от двигателя автомобиля за счёт увеличения площади теплообмена.
Пример №13
В каком тепловом двигателе струя пара или газа, нагретого до высокой температуры, вращает вал двигателя без помощи поршня, шатуна и коленчатого вала?
Ответ: в паровой турбине.
- Внутренняя энергия
- Теплопроводность в физике
- Конвекция в физике
- Излучение тепла в физике
- Воздухоплавание в физике
- Машины и механизмы в физике
- Коэффициент полезного действия (КПД) механизмов
- Тепловые явления в физике
Из
химии и физики 7 класса вы знаете, что все вещества имеют дискретное
строение. Иными словами, они состоят из мельчайших частиц — атомов и
молекул, между которыми существуют промежутки.
Размеры
атомов и молекул настолько малы, что увидеть их без сильных электронных
микроскопов не удаётся. Но большое количество разнообразных наблюдаемых явлений
подтверждают дискретность веществ. Среди них и хорошо знакомое вам явление диффузии
— самопроизвольное проникновение одного вещества в другое.
Диффузия в жидкости
Однако
самым убедительным доказательством дискретного строения вещества является броуновское
движение. Давайте посмотрим, в чем его суть.
Броуновское
движение — это беспорядочное движение малых частиц вещества, взвешенных в
жидкости или газе.
Взвешенными
называются частицы, плотность вещества которых сравнима с плотностью среды, в
которой они находятся. При этом размеры этих частиц в тысячу с лишним раз
превышают размеры молекул.
Впервые
такое движение наблюдал английский ботаник Р. Броун в 1827 г. Он рассматривал
движение частиц цветочной пыльцы в воде под микроскопом. Каждая частица пыльцы совершала
причудливое зигзагообразное движение.
Броуновское движение
Постепенно
становилось понятным, что мельчайшие частички вещества испытывают со всех
сторон удары ещё более мелких частиц, которые в микроскоп уже не видны.
Открытое
Р. Броуном движение неоспоримо доказало факт того, что все вещества состоят
из атомов и молекул. И самое главное, что эти мельчайшие частицы вещества
находятся в непрерывном беспорядочном движении, интенсивность которого
зависит от температуры вещества. Чем выше температура, тем быстрее
двигаются молекулы вещества, и наоборот. Именно поэтому броуновское движение ещё
называют тепловым движением.
А
что такое температура?
Многие
из вас наверняка приведут примеры того, что температура горячей воды больше чем
холодной. А кто-то скажет, что температура на улице зимой ниже, чем летом.
Стакан с холодной и горячей водой
Температура
— это физическая величина, которая характеризует тепловое состояние тела
(степень его «нагретости»).
Однако
наши с вами ощущения неоднозначны и зависят от состояния человека и окружающей
среды. Так, например, в одной и той же комнате металлические предметы всегда кажутся
более холодными, чем деревянные или пластмассовые.
Или
вот ещё один пример — опыт, который вы можете провести в домашних условиях. Погрузим
на некоторое время одну руку в горячую воду, а другую — в холодную. Теперь,
если мы обе руки поместим в воду при комнатной температуре и попытаемся на
основании своих ощущений установить, какая в сосуде вода — холодная или горячая,
то, на удивление, у нас ничего не получится, поскольку наши ощущения будут
разными: рука, которая находилась в горячей воде, будет чувствовать холод, а
рука, находившаяся в холодной воде, будет ощущать тепло.
Поэтому,
для того, чтобы сделать те или иные выводы о температуре тела, её необходимо
измерить. Для измерения температуры используется специальный измерительный
прибор — термометр. Его действие основано на зависимости свойств тела от
температуры (расширение тел при нагревании и их сжатие при охлаждении).
Термометр
Единицей
измерения температуры является градус Цельсия.
Эта
единица была названа в честь шведского учёного А. Цельсия, предложившего
использовать стоградусную шкалу температур. За 0 оС в ней
принимается температура тающего льда, а за 100 оС — температура
кипения воды при нормальных условиях.
Шкала Цельсия
Помимо
шкалы Цельсия, существуют и другие температурные шкалы. Например, термометры со
шкалой Фаренгейта до сих пор применяют в Англии и Америке. За 0о в
этой шкале была принята температура самой холодной зимы в Голландии в 1709 г.,
а вторая точка соответствовала нормальной температуре человеческого тела — 98 оF.
Шкала Фаренгейта
Во
Франции долгое время использовалась шкала Реомюра, которая в настоящее время
вышла из употребления.
Шкала Реомюра
В
физике, в частности в термодинамике, используется шкала Кельвина. В ней
температура отсчитывается от абсолютного нуля — то есть от минимальной
теоретически возможной температуры тела. В нашей привычной шкале — шкале
Цельсия, эта температура равняется −273,15 оС.
Шкала Реомюра
Вы
конечно знаете, что при любой температуре вещество, например, вода, состоит из
одних и тех же молекул. Иными словами, молекулы холодной воды ничем не
отличаются от молекул воды горячей. Но что же тогда меняется в воде при изменении
её температуры?
Изменяется
скорость движения молекул. Чем быстрее двигаются молекулы в веществе, тем более
высокой является температура вещества, и наоборот. Т. е., температура
зависит от скорости движения молекул.
Но
только ли от скорости молекул зависит температура тела? Например, при средней
скорости движения молекул в 440 м/с кислород имеет температуру 20 оС,
а азот — 16 оС. Это обусловлено тем, что молекулы азота легче
молекул кислорода. Следовательно, температура зависит и от массы молекул.
В
7 классе вы познакомились с величиной, которая также зависела от скорости и
массы — это кинетическая энергия.
Поэтому
можно утверждать, что температура является мерой средней кинетической
энергии молекул тела.
Теперь
выясним каковы особенности броуновского движения в различных агрегатных
состояниях вещества.
Вы
уже знаете, что расстояние между молекулами у газов достаточно большое, и
намного больше чем у жидкостей и твёрдых тел. Но силы взаимодействия между
молекулами газа ничтожно малы. Поэтому молекула в газе двигается свободно до момента
столкновения с другой молекулой. При столкновении молекула меняет направление своего
движения и вновь движется свободно до следующего столкновения. Именно поэтому газы
не сохраняют своей формы и занимают весь предоставленный им объём.
Расположение молекул в газе
Тепловое
движение молекул жидкости другое. Расстояния между молекулами жидкости намного меньше,
чем в газах, а сами молекулы связаны друг с другом силами притяжения и
отталкивания. Поэтому они совершают беспорядочные колебания и вращения в одном
положении, а также могут перемещаться относительно друг друга.
Расположение молекул в газе
Наличие
сил притяжения между молекулами обеспечивает жидкости сохранение объёма, а перемещения
— текучесть. Поэтому жидкость и сохраняет свой объем, но не сохраняет
форму, а принимает форму того сосуда, в котором она находится.
В
твёрдых телах частицы связаны между собой сильнее, чем в жидкостях. Поэтому их
тепловое движение главным образом сводится к хаотичному колебанию около своего положения
равновесия.
Расположение молекул в газе
Сильное
взаимодействие в твёрдом веществе частиц друг с другом, и отсутствие у них
подвижности, приводит к тому, что твёрдые тела сохраняют свою форму и
объём.
Хаотическое тепловое движение на плоскости частиц газа таких как атомы и молекулы
Существует два определения температуры. Одно — с молекулярно-кинетической точки зрения, другое — с термодинамической.
Температу́ра (от лат. temperatura — надлежащее смешение, нормальное состояние) — физическая величина, примерно характеризующая приходящуюся на одну степень свободы среднюю кинетическую энергию частиц макроскопической системы, находящейся в состоянии термодинамического равновесия.
В системе СИ температура измеряется в кельвинах. Но на практике часто применяют градусы Цельсия из-за привязки к важным характеристикам воды — температуре таяния льда (0° C) и температуре кипения (100° C). Это удобно, так как большинство климатических процессов, процессов в живой природе и т. д. связаны с этим диапазоном.
Существуют также шкалы Фаренгейта и некоторые другие.
Молекулярно-кинетическое определение
Температура с молекулярно-кинетической точки зрения — физическая величина, характеризующая интенсивность хаотического, теплового движения всей совокупности частиц системы и пропорциональная средней кинетической энергии поступательного движения одной частицы.
Связь между кинетической энергией, массой и скоростью выражается следующей формулой:
Ek = 1/2m • v 2
Таким образом частицы одинаковой массы и имеющие одинаковую скорость имеют и одинаковую температуру.
Средняя кинетическая энергия частицы связана с термодинамической температурой постоянной Больцмана:
Eср = i/2kBT
где:
- i — число степеней свободы
- kB = 1.380 6505(24) × 10−23 Дж/K — постоянная Больцмана
- T — температура;
Термодинамическое определение
Температура — величина, обратная изменению энтропии (степени беспорядка) системы при добавлении в систему единичного количества теплоты: 1/T = ΔS/ΔQ.
История термодинамического подхода
Слово «температура» возникло в те времена, когда люди считали, что в более нагретых телах содержится большее количество особого вещества — теплорода, чем в менее нагретых. Поэтому температура воспринималась как крепость смеси вещества тела и теплорода. По этой причине единицы измерения крепости спиртных напитков и температуры называются одинаково — градусами.
В равновесном состоянии температура имеет одинаковое значение для всех макроскопических частей системы. Если в системе два тела имеют одинаковую температуру, то между ними не происходит передачи кинетической энергии частиц (тепла). Если же существует разница температур, то тепло переходит от тела с более высокой температурой к телу с более низкой, потому что суммарная энтропия при этом возрастает.
Температура связана также с субъективными ощущениями «тепла» и «холода», связанными с тем, отдает ли живая ткань тепло или получает его.
Некоторые квантовомеханические системы могут находится в состоянии, при котором энтропия не возрастает, а убывает при добавлении энергии, что формально соответствует отрицательной абсолютной температуре. Однако такие состояния находятся не «ниже абсолютного нуля», а «выше бесконечности», поскольку при контакте такой системы с телом, обладающим положительной температурой, энергия передается от системы к телу, а не наоборот (подробнее см. Квантовая термодинамика).
Свойства температуры изучает раздел физики — термодинамика. Температура также играет важную роль во многих областях науки, включая другие разделы физики, а также химию и биологию.
Измерение температуры
Для измерения температуры выбирается некоторый термодинамический параметр термометрического вещества. Изменение этого параметра однозначно связывается с изменением температуры.
На практике для измерения температуры используют
- жидкостные и механические термометры,
- термопару,
- Термосопротивление
- Термометр сопротивления
- Газовый термометр
- Пирометр
Единицы и шкала измерения температуры
Из того, что температура — это кинетическая энергия молекул, ясно, что наиболее естественно измерять её в энергетических единицах (т.е. в системе СИ в джоулях). Однако измерение температуры началось задолго до создания молекулярно-кинетической теории, поэтому практические шкалы измеряют температуру в условных единицах — градусах.
Шкала температур Кельвина
Понятие абсолютной температуры было введено У. Томсоном (Кельвином), в связи с чем шкалу абсолютной температуры называют шкалой Кельвина или термодинамической температурной шкалой. Единица абсолютной температуры — кельвин (К).
Абсолютная шкала температуры называется так, потому что мера основного состояния нижнего предела температуры — абсолютный ноль, то есть наиболее низкая возможная температура, при которой в принципе невозможно извлечь из вещества тепловую энергию.
Абсолютный ноль определён как 0 K, что приблизительно равно −273.15 °C.
Шкала температур Кельвина — температурная шкала, в которой начало отсчёта ведётся от абсолютного нуля.
Используемые в быту температурные шкалы — как Цельсия, так и Фаренгейта (используемая, в основном, в США), — не являются абсолютными и поэтому неудобны при проведении экспериментов в условиях, когда температура опускается ниже точки замерзания воды, из-за чего температуру приходится выражать отрицательным числом. Для таких случаев были введены абсолютные шкалы температур.
Одна из них называется шкалой Ранкина, а другая — абсолютной термодинамической шкалой (шкалой Кельвина); температуры по ним измеряются, соответственно, в градусах Ранкина (°Ra) и кельвинах (К). Обе шкалы начинаются при температуре абсолютного нуля. Различаются они тем, что кельвин равен градусу Цельсия, а градус Ранкина — градусу Фаренгейта.
Температуре замерзания воды при стандартном атмосферном давлении соответствуют 273,15 K. Число градусов Цельсия и кельвинов между точками замерзания и кипения воды одинаково и равно 100. Поэтому градусы Цельсия переводятся в кельвины по формуле K = °C + 273,15.
Шкала Цельсия
В быту используется шкала Цельсия, в которой за 0 принимают точку замерзания воды, а за 100° точку кипения воды при нормальном атмосферном давлении. Поскольку температура замерзания и кипения воды недостаточно хорошо определена, в настоящее время шкалу Цельсия определяют через шкалу Кельвина: градус Цельсия равен кельвину, абсолютный ноль принимается за −273,15° C. Шкала Цельсия практически очень удобна, поскольку вода очень распространена на нашей планете и на ней основана наша жизнь. Ноль Цельсия — особая точка для метеорологии, поскольку связана с замерзанием атмосферной воды. Шкала предложена Андерсом Цельсием в 1742 г.
Шкала Фаренгейта
В Англии и, в особенности, в США используется шкала Фаренгейта. Ноль градусов Цельсия — это 32 градуса Фаренгейта, а градус Фаренгейта равен 5/9 градуса Цельсия.
В настоящее время принято следующее определение шкалы Фаренгейта: это температурная шкала, 1 градус которой (1 °F) равен 1/180 разности температур кипения воды и таяния льда при атмосферном давлении, а точка таяния льда имеет температуру +32 °F. Температура по шкале Фаренгейта связана с температурой по шкале Цельсия (t °С) соотношением t °С = 5/9 (t °F — 32), 1 °F = 9/5 °С + 32. Предложена Г. Фаренгейтом в 1724.
Энергия теплового движения при абсолютном нуле
Когда материя охлаждается, многие формы тепловой энергии и связанные с ней эффекты одновременно уменьшаются по величине. Вещество переходит от менее упорядоченного состояния к более упорядоченному. Газ превращается в жидкость и затем кристаллизуется в твёрдое тело (гелий и при абсолютном нуле остается в жидком состоянии при атмосферном давлении). Движение атомов и молекул замедляется, их кинетическая энергия уменьшается. Сопротивление большинства металлов падает из-за уменьшения рассеяния электронов на колеблющихся с меньшей амплитудой атомах кристаллической решётки. Таким образом даже при абсолютном нуле электроны проводимости движутся между атомами со скоростью Ферми порядка
1×106м/с.
Температура, при которой частицы вещества имеют минимальное количество движения,
сохраняющееся только благодаря квантовомеханическому движению, — это температура абсолютного нуля (Т = 0К).
Температуры абсолютного нуля достичь невозможно. Наиболее низкая температура (450±80)x10-12К конденсата Бозе-Эйнштейна атомов натрия была получена в 2003 г. исследователями из МТИ. При этом пик теплового излучения находится в области длин волн порядка 6400 км, то есть примерно радиуса Земли.
Температура с термодинамической точки зрения
Существует множество различных шкал температур. Когда-то температура определялась очень произвольно. Мерой температуры служили метки, нанесённые на равных расстояниях на стенах трубочки, в которой при нагревании расширялась вода. Потом решили измерить температуру ртутным термометром и обнаружили, что градусные расстояния не одинаковы. В термодинамике дается определение температуры, не зависящее от каких-либо частных свойств вещества.
Введем функцию
, которая не зависит от свойств вещества. Из термодинамики следует, что если какая-то тепловая машина, поглощая количество теплоты
при
выделяет тепло
при температуре в один градус, а другая машина, поглотив тепло
при
, выделяет то же самое тепло
при температуре в один градус, то машина, поглощающая
при
должна при температуре
выделять тепло
. Конечно, между теплом
и температурой
существует зависимость и тепло
должно быть пропорционально
. Таким образом, каждому количеству тепла
, выделенного при температуре в один градус, соответствует количество тепла, поглощённого машиной при температуре
, равное
, умноженному на некоторую возрастающую функцию
температуры:
Поскольку найденная функция возрастает с температурой, то можно считать, что она сама по себе измеряет температуру, начиная со стандартной температуры в один градус. Это означает, что можно найти температуру тела, определив количество тепла, которое поглощается тепловой машиной, работающей в интервале между температурой тела и температурой в один градус. Полученная таким образом температура называется абсолютной термодинамической температурой и не зависит от свойств вещества. Таким образом, для обратимой тепловой машины выполняется равенство:
где
— энтропия:
Для системы, в которой энтропия
может быть функцией
её энергии
, термодинамическая температура определяется как:
Температура и излучение
При повышении температуры растёт энергия, излучаемая нагретым телом. Энергия излучения абсолютно чёрного тела описывается законом Стефана — Больцмана
Шкала Реомюра
Предложена в 1730 году Р. А. Реомюром, который описал изобретённый им спиртовой термометр.
Единица — градус Реомюра (°R), 1 °R равен 1/80 части температурного интервала между опорными точками — температурой таяния льда (0 °R) и кипения воды (80 °R)
1 °R = 1,25° C.
В настоящее время шкала вышла из употребления, дольше всего она сохранялась во Франции, на родине автора.
Переходы из разных шкал
| виз | Кельвин | Цельсий | Фаренгейт |
|---|---|---|---|
| Кельвин (K) | = K | = С + 273,15 | = (F + 459,67) / 1,8 |
| Цельсий (° C) | = K − 273,15 | = C | = (F − 32) / 1,8 |
| Фаренгейт (°F) | = K · 1,8 − 459,67 | = C · 1,8 + 32 | = F |
Сравнение температурных шкал
| Описание | Кельвин | Цельсий | Фаренгейт | Ранкин | Делиль | Ньютон | Реомюр | Рёмер |
|---|---|---|---|---|---|---|---|---|
| Абсолютный ноль | 0 | −273.15 | −459.67 | 0 | 559.725 | −90.14 | −218.52 | −135.90 |
| Температура таяния смеси Фаренгейта (соль и лёд в равных количествах) | 255.37 | −17.78 | 0 | 459.67 | 176.67 | −5.87 | −14.22 | −1.83 |
| Температура замерзания воды (Нормальные условия) | 273.15 | 0 | 32 | 491.67 | 150 | 0 | 0 | 7.5 |
| Средняя температура человеческого тела ¹ | 310.0 | 36.6 | 98.2 | 557.9 | 94.5 | 12.21 | 29.6 | 26.925 |
| Температура кипения воды (Нормальные условия) | 373.15 | 100 | 212 | 671.67 | 0 | 33 | 80 | 60 |
| Плавление титана | 1941 | 1668 | 3034 | 3494 | −2352 | 550 | 1334 | 883 |
| Поверхность Солнца | 5800 | 5526 | 9980 | 10440 | −8140 | 1823 | 4421 | 2909 |
¹
Нормальная средняя температура человеческого тела — 36.6 ° C ±0.7 ° C, или 98.2 °F ±1.3 °F. Приводимое обычно значение 98.6 °F — это точное преобразование в шкалу Фаренгейта принятого в Германии в XIX веке значения 37 ° C. Однако это значение не входит в диапазон нормальной средней температуры тела человека, поскольку температура разных частей тела разная[1].
Накопительный водонагреватель
Накопительный водонагреватель, или бойлер (от англ. boiler) представляет собой сравнительно большую ёмкость с размещенным в ней или, реже, под ней, источником тепла. Нагрев может производиться при помощи парового или водяного теплообменника — в нём циркулирует горячая вода в замкнутом контуре, нагреваемая, например, с помощью отопительного котла. Такие бойлеры называют бойлерами (водонагревателями) косвенного нагрева.[2]
Некоторые значения в этой таблице были округлены.
Характеристика фазовых переходов
Для описания точек фазовых переходов различных веществ используют следующие значения температуры:
- Температура плавления
- Температура кипения
- Температура отжига
- Температура спекания
- Температура синтеза
- Гомологическая температура
- Тройная точка
Измерение температуры
Для измерения температуры выбирается некоторый термодинамический параметр термометрического вещества. Изменение этого параметра однозначно связывается с изменением температуры. На практике для измерения температуры используют
- термометр,
- термопару,
- оптический пирометр
- Термосопротивление
- тепловизор[3]
Примечания
- ↑ О различных измерениях температуры тела(англ.)
- ↑ Накопительный водонагреватель.
- ↑ Измерение температуры при помощи тепловизора
См. также
- Абсолютная шкала температур
- Цветовая температура
- Отрицательная абсолютная температура
Литература
- Спасский Б. И.. История физики. М., «Высшая школа», 1977.
- Том 1, часть 1-я
- Сивухин Д. В. Термодинамика и молекулярная физика. — Москва: «Наука», 1990.
Температура
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: тепловое равновесие, абсолютная температура.
Мы часто используем слово «температура» в повседневной речи. А что такое температура? В данной статье мы объясним физический смысл этого понятия.
В молекулярной физике и термодинамике рассматриваются макроскопические тела, т. е. тела, состоящие из огромного числа частиц. Например, в стакане воды содержится порядка молекул. Такое грандиозное число с трудом поддаётся осмыслению.
Термодинамическая система
Термодинамической системой называется макроскопическое тело или система тел, которые могут взаимодействовать друг с другом и с окружающими телами. Стакан с водой — пример термодинамической системы.
Термодинамическая система состоит из столь большого числа частиц, что совершенно невозможно описывать её поведение путём рассмотрения движения каждой молекулы в отдельности. Однако именно грандиозность числа молекул делает ненужным такое описание.
Оказывается, что состояние термодинамической системы можно характеризовать небольшим числом макроскопических параметров — величин, относящимся к системе в целом, а не к отдельным атомам или молекулам. Такими макроскопическими параметрами являются давление, объём, температура, плотность, теплоёмкость, удельное сопротивление и др.
Состояние термодинамической системы, при котором все макроскопические параметры остаются неизменными с течением времени, называется тепловым равновесием. В состоянии теплового равновесия прекращаются все макроскопические процессы: диффузия, теплопередача, фазовые переходы химические реакции и т. д.(Следует отметить, что тепловое равновесие является динамическим равновесием. Так, при тепловом равновесии жидкости и её насыщенного пара весьма интенсивно идут взаимные превращения жидкости и пара. Но это — процессы молекулярного масштаба, они происходят с одинаковыми скоростями и компенсируют друг друга. На макроскопическом уровне количество жидкости и пара со временем не меняется).
Термодинамическая система называется изолированной, если она не может обмениваться энергией с окружающими телами. Чай в термосе — типичный пример изолированной системы.
Тепловое равновесие
Фундаментальный постулат, вытекающий из многочисленных опытных данных, гласит: каково бы ни было начальное состояние тел изолированной системы, со временем в ней устанавливается тепловое равновесие. Таким образом, тепловое равновесие — это состояние, в которое любая система, изолированная от окружающей среды, самопроизвольно переходит через достаточно большой промежуток времени.
Температура как раз и является величиной, характеризующей состояние теплового равновесия термодинамической системы.
Температура — это макроскопический параметр, значения которого одинаковы для всех частей термодинамической системы, находящейся в состоянии теплового равновесия. Попросту говоря, температура — это то, что является одинаковым для любых двух тел, которые находятся в тепловом равновесии друг с другом. При тепловом контакте тел с одинаковыми температурами между ними не будет происходить обмен энергией (теплообмен).
В общем же случае при установлении между телами теплового контакта теплообмен начнётся. Говорят, что тело, которое отдаёт энергию, имеет более высокую температуру, а тело, которое получает энергию — более низкую температуру. Температура, таким образом, указывает направление теплообмена между телами. В процессе теплообмена температура первого тела начнёт уменьшаться, температура второго тела — увеличиваться; при выравнивании температур теплообмен прекратится — наступит тепловое равновесие.
Особенность температуры заключается в том, что она не аддитивна: температура тела не равна сумме температур его частей. Этим температура отличается от таких физических величин, как масса, длина или объём. И по этой причине температуру нельзя измерить путём сравнения с эталоном.
Измеряют температуру с помощью термометра.
Для создания термометра выбирают какое-либо вещество (термометрическое вещество), какую-либо характеристику этого вещества (термометрическую величину), и используют зависимость термометрической величины от температуры. При этом выбор термометрического вещества и термометрической величины может быть весьма произвольным.
Так, в бытовых жидкостных термометрах термометрическим веществом является ртуть (или спирт), а термометрической величиной — длина столбика жидкости. Здесь используется линейная зависимость объёма жидкости от температуры.
В идеально-газовых термометрах используется линейная зависимость давления разреженного газа (близкого по своим свойствам к идеальному) от температуры.
Действие электрических термометров (термометров сопротивления) основано на температурной зависимости сопротивления чистых металлов, сплавов и полупроводников.
В процессе измерения температуры термометр приводится в тепловой контакт(В области температур выше (раскалённые газы, расплавленные металлы) используются бесконтактные высокотемпературные термометры — пирометры. Их действие основано на измерении интенсивности теплового излучения в оптическом диапазоне.) с телом, температура которого определяется. Показания термометра после наступления теплового равновесия — это и есть температура тела. При этом термометр показывает свою температуру!
Температурная шкала. Абсолютная температура
При установлении единицы температуры чаще всего поступают следующим образом. Берут две температуры (так называемые реперные точки) — температуру таяния льда и температуру кипения воды при нормальном атмосферном давлении. Первой температуре приписывают значение , второй — значение
, а интервал между ними делят на
равных частей. Каждую из частей называют градусом (обозначают
), а полученную таким образом температурную шкалу — шкалой Цельсия.
При измерениях по шкале Цельсия с помощью жидкостных термометров возникает одна трудность: разные жидкости при изменении температуры изменяют свой объём по-разному. Поэтому два термометра с различными жидкостями, приведённые в тепловой контакт с одним и тем же телом, могут показать разные температуры. От данного недостатка свободны идеально-газовые термометры — зависимость давления разреженного газа от температуры не зависит от вещества самого газа.
Кроме того, для температурной шкалы идеально-газового термометра существует естественное начало отсчёта (исчезает произвол выбора реперной точки!): это та предельно низкая температура, при которой давление идеального газа постоянного объёма обращается в нуль. Эта температура называется абсолютным нулём температур.
Температурная шкала, началом отсчёта которой является абсолютный нуль, а единицей температуры — градус Цельсия, называется абсолютной температурной шкалой.
Температура, измеряемая по абсолютной шкале, называется абсолютной температурой и обозначается буквой . Единица абсолютной температуры называется кельвином (
).
Абсолютному нулю () соответствует температура
. Поэтому связь абсолютной температуры и температуры по шкале Цельсия даётся формулой:
В задачах достаточно использовать формулу
Благодарим за то, что пользуйтесь нашими материалами.
Информация на странице «Температура» подготовлена нашими авторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать необходимые и поступить в ВУЗ или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из данного раздела.
Публикация обновлена:
08.05.2023