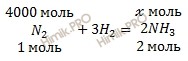Выход от теоретически возможного
Сколько литров аммиака (NH3) образуется при взаимодействии 112 килограмм азота (N2) с водородом (H2)? Выход от теоретически возможного 80% (нормальные условия).
Решение задачи
Запишем уравнение реакции образования аммиака (NH3):
Напомню, что под выходом от теоретически возможного продукта реакции понимают отношение массы (объема, числа молей) практически полученного вещества к массе (объему, числу молей), теоретически рассчитанной по уравнению реакции.
Выход от теоретически возможного. Учитывая, что молярная масса азота (N2) равна 28 г/моль (смотри таблицу Менделеева), найдем химическое количество азота (N2) по формуле, устанавливающей связь между химическим количеством вещества и массой:
Получаем:
n (N2) = 112000 /28 = 4000 (моль) = 4 (кмоль).
По уравнению реакции найдем химическое количество аммиака (NH3) (теоретическое химическое количество вещества), которое выделяется в ходе реакции образования аммиака (NH3):
из 1 моль N2 образуется 2 моль NH3
из 4000 моль N2 образуется х моль NH3
Откуда:
Выход от теоретически возможного.
По формуле, устанавливающей связь между химическим количеством вещества и объемом, вычислим объем аммиака (NH3), который образуется в ходе реакции:
Получаем:
V теор.( NH3) = 8000 ∙ 22,4 = 179200 (л).
Вычислим объем аммиака (NH3) практический (выход от теоретически возможного) по формуле:
Выход от теоретически возможного.
Получаем:
V практ. (NH3) = 80 ⋅ 179200 / 100 = 143360 (л) = 143,36 (м3).
Ответ:
объем аммиака (NH3) равен 143,36 м3.
Для расчета теоретической массы или теоретического выхода необходимо уравновесить реакцию, установить количество молей, найти реагент, который является ограничивающим, а затем рассчитать количество молей и граммов продукта, которые, как ожидается, будут получены. Эти теоретические расчеты фактически выполняются так же, как и уравнения общей химии, в том смысле, что количество молей в продукте-реагенте определяет количество молей в продукте.
Согласно руководству по органической химии, предоставленному Университетом Колорадо в Боулдере, реакция должна быть сбалансирована, чтобы можно было определить соотношение реагентов и продуктов. Как только это будет определено, каждый исходный материал должен иметь определенное количество молей.
Ограничивающий реагент должен быть определен, и важно отметить, что это не может быть что-либо, что не является частью фактической химической реакции. Следует исходить из предположения, что теоретически будет обеспечен 100-процентный выход в зависимости от реагента.
Другой расчет определяет ожидаемое количество продукта в граммах, исходя из ожидаемого числа молей реакции. Вот как рассчитать теоретическую массу в граммах, также называемую теоретическим выходом, но процентный выход также можно легко определить после расчета теоретического выхода, просто разделив фактический выход в граммах на теоретический выход и затем преобразовав цифру. в проценты.
Расчеты по химическим уравнениям массы, объема, количества вещества реагентов и продуктов реакций
Алгоритм решения расчетных задач
1. Составить уравнение химической реакции.
2. Над формулами веществ записать значения известных и неизвестных веществ с соответствующими единицами величин (только для чистых веществ).
3. Под формулами известных и неизвестных веществ записать соответствующие значения величин, найденные по уравнению реакции.
4. Составить пропорцию и решить ее.
5. Записать ответ.
Задача
Вычислите массу серной кислоты, которая потребуется, чтобы нейтрализовать раствор, содержащий гидроксид натрия массой 10 г.
Задача
К раствору, содержащему избыток хлорида железа(Ш), добавили раствор, содержащий 240 г гидроксида натрия. Определите массу и количество образовавшегося гидроксида железа(III).
Задача
Сколько образуется кубических метров оксида углерода(IV) при сжигании (н. у.): а) 5 м3 этана б) 5 кг этана?
При неизменном давлении объемы реагирующих и образующихся газов, которые относятся между собой как небольшие целые числа, а коэффициенты в уравнении реакции показывают число объемов реагирующих и образующихся газов. Найдем объем образовавшегося СO2:
Решение задач, если вещества взяты в избытке
Задача
Задача
Вычисления по уравнениям химических реакций, если один из реагентов содержит примеси
Задача
Вычислите объем углекислого газа (при н. у.), который выделится при взаимодействии 1 кг известняка, содержащего 10% примесей, с избытком соляной кислоты.
Задача
Рассчитайте массовую долю (в %) углерода в угле, если при сжигании 1 кг угля выделилось 1,12 м3 углекислого газа (при н. у.). Предположите, что примеси в угле горючие.
Вычисления по уравнениям реакций с учетом практического выхода продукта
η — практический выход
mтеор. или Vтеор. — теоретически возможную массу (объем) продукта рассчитывают по уравнению химической реакции.
mпракт. или Vпракт. — практически возможную массу (объем) продукта измеряют экспериментально после реакции.
Задача
При взаимодействии 2,24 л оксида азота(II) с кислородом образовалось 2 л оксида азота(IV). Определите выход продукта реакции (в %) от теоретически возможного.
Задача
Для производства 142,3 кг аммиачной селитры использовали аммиак объемом 50 м3 (н. у.) и 160 л раствора азотной кислоты с массовой долей 65% (плотность 1391 кг/м3). Определите выход продукта реакции (в %) от теоретически возможного.
Определение вещества, по которому необходимо вести расчеты (по наименьшему):
Расчеты проводим по NH3:
Задача
При электролизе расплава хлорида кальция на аноде выделился хлор объемом 198 л (н. у.), а на катоде — кальций массой 240 г. Предполагая, что практический выход кальция составляет 100%, вычислите практический выход хлора.
Решение задач на нахождение молекулярной формулы вещества по количественным данным о реагентах и продуктах реакции
Задача
Определите истинную формулу углеводорода, массовая доля углерода в котором составляет 0,857. Относительная плотность его паров по воздуху равна 1,45.

Решение
Данные для определения формулы вещества СхНу:
|
Элемент |
С |
н |
|
W |
0,847 |
0,143 |
|
М, г/моль |
12 |
1 |
Определение нижних индексов:
Формула простейшая — СН2.
Расчет молярной массы по относительной плотности:
M(СхНу) = 1,45 ∙ 29 г/моль = 42 г/моль.
По эмпирической формуле: М(СН2) = 14 г/моль.
Отношение молярных масс СхНу, и СН2:
Истинная формула: 3 ∙ СН2 = С3Н6.
Ответ: С3Н6.
Задача
Определите истинную формулу вещества, содержащего по массе 82,8% углерода и 17,2% водорода. Плотность вещества при н. у. равна 2,59 г/л.
Дано:
СХНУ
w(C) = 82,8%
w(H) = 17,2%
ρ(СхНу) = 2,59 г/л
СхНу — ?
Решение
Данные для определения формулы вещества СхНу:
|
Елемент |
С |
Н |
|
W |
0,828 |
0,172 |
|
М, г/моль |
12 |
1 |
Определение нижних индексов:
Эмпирическая формула — С2Н5.
Расчет молярной массы по относительной плотности:
M(СхНу) = ρ ∙ Vm = 2,59 г/л ∙ 22,4 л/моль = 58 г/моль.
По эмпирической формуле: М(С2Н5) = 29 г/моль.
Отношение молярных масс СxНу и С2Н5:
Истинная формула: 2 ∙ С2Н5 = С4Н10.
Ответ: С4Н10.
Задача
При сгорании 2,3 г органического вещества в избытке кислорода образовалось 4,4 г оксида углерода(IV) и 2,7 г воды. Относительная плотность паров этого вещества по водороду равна 23. Из каких элементов состоит вещество? Определите его формулу.
Определение индексов:
Эмпирическая формула: С2Н6O.
M(CxHyOz) = 23 ∙ 2 г/моль = 46 г/моль; по эмпирической формуле: М(С2Н6O) = 46 г/моль.
Истинная и эмпирическая формулы вещества одинаковые: C2H6O.
Ответ: C2H6O.
Задача
При сжигании 5,6 л газообразного углеводорода образовалось 33 г СO2 и 13,5 г воды. Масса 1 л газа — 1,875 г. Определите формулу вещества.
Решение комбинированных задач
Задача
Колонна синтеза аммиака дает 1500 т продукта в сутки. Рассчитайте массу раствора с массовой долей азотной кислоты равной 63%, который получают из этого количества аммиака.
Если в задаче есть цепь последовательных химических преобразований веществ, то вычисления по каждой реакции не выполняют. Следует составить уравнение всех реакций и по соотношению соответствующих коэффициентов в уравнениях — стехиометрическую схему.
Количество вещества азота должно перейти неизменно в следующие уравнения как исходное вещество. В связи с этим уравнения (1) и (3) следует умножить на 2. Тогда стехиометрическая схема имеет вид:
Задача
После нагревания смеси нитрата цинка и нитрата натрия массой 20,5 г образовавшиеся газы были пропущены через воду, причем 1,12 л газа (н. у.) не поглотилось. Определите состав смеси нитратов.
Поглотилось водой (4NO2 + O2) газов, поэтому осталось 1,12 л O2.
Расчет массы нитрата цинка:
20,5 г — 8,5 г = 12,0 г Zn(NO3)2.
Расчет массовых долей компонентов смеси:
ПРОВЕРЬТЕ СЕБЯ
1. Какие газы при выпускании их в воздух поднимаются вверх, а какие — опускаются вниз: бурый газ N02; сернистый газ — SO2; метан; водород; хлор?
2. Объемные доли водорода и кислорода в смеси составляют соответственно 23 и 77%. Определите среднюю плотность этой смеси по водороду.
3. Молярная масса кристаллогидрата состава CuSO4 ∙ nН2O равна 250 г/моль. Сколько молекул воды входит в состав кристаллогидрата?
4. Углеводород имеет формулу СnНn. Определите п, если известно, что 1,5 моль углеводорода имеют массу 117 г.
5. Образец вещества массой 5,6 г содержит 6,02 ∙ 1022 молекул. Определите молярную массу вещества.
6. Какое количество вещества водорода может быть получено при разложении 112 м3 метана (н. у.)? Вычислите объем водорода (н. у.), который выделится при этом.
7. Определите число молекул углекислого газа в 1 л воздуха, если его объемная доля составляет 0,03% при нормальных условиях.
8. Рассчитайте, какой объем при н. у. занимает смесь, состоящая из 1,44 моль кислорода, 1,83 моль азота, 1,13 моль оксида углерода(IV) и 0,60 моль оксида серы(IV).
9. Определите формулу вещества, содержащего по данным химического анализа 43,4% натрия, 11,3% углерода и 45,3% кислорода.
10. Определите формулу минерала криолит (xNaF ∙ yAlF3), в котором массовые доли NaF и AlF3 равны соответственно 60 и 40%.
11. Найдите молекулярную формулу газообразного углеводорода, если известно, что он в два раза тяжелее воздуха, а содержание в нем углерода — 81,8%.
12. При сжигании 4,4 г вещества образовалось 13,2 г углекислого газа и 7,2 г воды. Относительная плотность вещества по водороду равна 22. Определите формулу вещества.
13. При сжигании 10 г углеводорода образовалось 27,5 г углекислого газа и 22,5 г воды. Относительная плотность вещества по кислороду равна 0,5. Определите формулу вещества.
14. При сжигании 8,8 г насыщенного углеводорода образовалось 26 г углекислого газа. Плотность вещества составляет 1,96 г/л. Определите формулу вещества.
15. При сжигании углеводорода, количество вещества которого равно 0,1 моль, образовались оксид углерода(IV) объемом 6,72 л и вода массой 7,2 г. Определите формулу углеводорода.
|
Как решать задачи на практический и теоретический выход по химии?Rolatex 9 лет назад
lizakar 9 лет назад Для решения задач по химии на выход нужно лишь понять, что масса теоретическая — это масса продукта, которую возможно получить с помощью данной реакции, а масса практическая — та, которую уже получили. Запомнить требуется всего лишь две формулы: 1. эта(массовая доля продукта)=m(пр)/m(теор). 2. фи(объёмная доля продукта)=v(пр)/v(теор). комментировать
в избранное
ссылка
отблагодарить Знаете ответ? |

ПРАКТ.
Выход по току (ВТ), являющийся одним из показателей эффективности использования электроэнергии в процессе электролиза, равен отношению теоретически необходимого количества электричества QТЕОР. (по закону Фарадея) к практически затраченному при получении продукта Q
BT = QТЕОР 100 %.
QПРАКТ
Выход по току можно определить так же, как отношение массы вещества, полученной в данных условиях электролиза (mпракт), к массе вещества, теоретически вычисленной на основании закона Фарадея (mтеор).
Величина выхода по току есть не что иное, как коэффициент «использования тока». Его принято выражать в процентах.
BT = mПРАКТ 100 %.
mТЕОР
Теоретически возможная масса вещества, выделяемая на электроде, определяется по количеству кулонов пропущенного электрического тока. По закону Фарадея при пропускании через электролит 96 500 Кл электричества окисляется на аноде или восстанавливается на катоде 1 экв. любого вещества.
|
mтеор |
= |
mэ |
Iτ = |
mэ |
Iτ, |
|
96500 |
|||||
|
F |
где mТЕОР – теоретически рассчитанная масса вещества, г;
mЭ – масса химического эквивалента металла, г/моль; F – число Фарадея (96 500 Кл);
I – сила тока, А;
τ – продолжительность электролиза, с.
На практике часто используют более крупную единицу измерения количества электричества – ампер-час. Поэтому число Фарадея (F = 96 500Кл) заменяют равноценной величиной 26,8 ампер-часа (А-ч):
F = 96500 / 3600 = 26,8 А-ч.
61

Тогда теоретически возможная масса вещества определяется по числу ампер-часов пропущенного электрического тока:
mтеор = mFЭ Iτ = 26,8mЭ Iτ,
где τ – продолжительность электролиза, час.
Выход по току рассчитывается по формуле:
BT = mпракτ F100%, mэI
где ВТ – выход по току, %;
mПРАКТ – масса фактически выделившегося вещества, г; I – сила тока, А;
mЭ – масса химического эквивалента вещества, г/моль;
τ – продолжительность электролиза, (если постоянная Фарадея (F) берется в Кл, то время в секундах, если в А-ч, то время в часах).
Скорость электрохимических процессов измеряется плотностью тока на электроде. Плотность тока (i) рассчитывается по формуле:
i = I / S,
где I – сила тока, проходящего через действующий электрод, А; S – площадь поверхности электрода, см2.
При электролизе с получением металлов практическую массу металла определяют путем взвешивания катода до и после электролиза. Эквивалентная масса металла рассчитывается по формуле:
mЭМе = А / n,
где А – атомная масса металла, г/моль;
n – число электронов, принимаемых ионами металла на катоде. Толщину слоя металлического покрытия вычисляют по формуле:
h = iкFmρэ100Bтτ,
где h – толщина покрытия, мкм;
62
ρ – плотность металла, г/см3; ВТ – выход металла по току, %;
mЭ – эквивалентная масса металла, г/моль; F – постоянная Фарадея, Кл или А-ч;
τ – продолжительность электролиза, с. или час.; iК – катодная плотность тока, А/см2.
Плотность некоторых металлов равна: для цинка – 7,1 г/см3, олова – 7,3 г/см3, меди – 8,9 г/см3, никеля – 8,8 г/см3.
Другим важным показателем работы электролизера является расход энергии (в кВт-ч) на тонну или кубометр (для газов) продукции. Электрическая энергия (W), расходуемая на производство какого-то количества вещества, равна произведению количества электричества (Q), прошедшего через электролизную ванну за время электролиза, на напряжение на ванне (U):
W = Q · U.
Для практических расчетов обычно пользуются формулой:
W= 100U ,
mÝõ BT
где mЭХ – электрохимический эквивалент в г/А-ч; ВТ – выход продукта по току в долях единицы.
63
ЧАСТЬ 3. ПРАКТИЧЕСКОЕ ПРИМЕНЕНИЕ ЭЛЕКТРОХИМИЧЕСКИХ ПРОЦЕССОВ
В настоящее время электрохимические процессы находят очень широкое применение в промышленности даже в тех случаях, когда проводимые электрохимическим методом технологические процессы могут быть осуществлены и другими химическими способами.
Выбор технологии решается на основе сравнительного техникоэкономического анализа, который учитывает экономику производства, ресурсы необходимого сырья и энергетические ресурсы, сложность аппаратурного оформления, чистоту получаемых продуктов и другие вопросы.
Технико-экономические преимущества электрохимического метода определяются тем, что с его помощью можно в относительно простых технологических схемах получить достаточно чистые продукты, то есть при электролизе нужные реакции могут быть проведены с высокой степенью избирательности.
Электрохимический способ широко используется для получения и рафинирования таких металлов, как медь, серебро, золото, цинк, кадмий, хром, марганец, никель, кобальт и др., в гальванотехнике для нанесения металлических покрытий из указанных металлов. Электролизом расплавленных сред получают натрий, калий, бериллий, магний, кальций, алюминий, а также элементарные хлор и фтор.
Электрохимические методы нашли применение для получения следующих веществ:
1.Водорода и кислорода (электролиз воды).
2.Хлора, едкого натра, едкого калия, кислородных соединений хлора (электролиз водных растворов соответствующих хлоридов).
3.Перманганата калия (анодное окисление марганца).
Электролиз применяется также для синтеза неорганических веществ с получением таких продуктов, как надсерная кислота и ее соли, используемые для
64
получения перекиси водорода, получения диоксида марганца, для синтеза органических соединений и т.д.
В последнее время электрохимические методы находят все более широкое применение в машиностроении для анодно-механической обработки изделий (электрополировка, точная сложнопрофильная обработка и др.).
1. ЭЛЕКТРОМЕТАЛЛУРГИЯ
Электрохимия открыла принципиально новые и чрезвычайно перспективные методы получения многих веществ.
Электролизом расплавов в промышленном масштабе получают фтор, щелочные и щелочноземельные металлы, алюминий, бериллий, магний и многие другие, которые не удается получить из водных растворов. Отсутствие воды как растворителя и высокая температура создают специфические условия электролиза. Расплавы щелочей и солей хорошо диссоциируют на ионы при высоких температурах. Ионы их более подвижны, чем гидратированные ионы в водных растворах. Поэтому сопротивление расплавов, а также перенапряжение электродных реакций невелики.
Первое место по масштабам производства в электролизе расплавов занимает, безусловно, получение алюминия. Поскольку оксид алюминия тугоплавок (2050 °С), электролитом при получении алюминия служит криолитглиноземный расплав (Na3AlF6 + 8–15 % Al2O3), имеющий температуру плавления порядка 950 °С. В расплаве в результате частичной диссоциации глинозема (Al2O3) возможно возникновение ионов Al3+, AlO33 , AlO2 . Наиболее легко из имеющихся в расплаве ионов на катоде восстанавливаются катионы Al3+, на аноде окисляются ионы AlO2 :
2Al3+ + 6e = 2Al (на катоде), 2AlO2 – 2e = Al2O3 + 0,5О2 (на аноде).
Суммарный процесс разложения глинозема при электролизе может быть в общем виде представлен следующей схемой:
2Al2O3 ± 6e = 4Al + 3O2.
65
На практике электролиз криолитоглиноземного расплава проводят на угольных анодах, поэтому конечными анодными продуктами являются СО и СО2. Обычно электролиз ведут при температуре электролита 940–960 °С, плотности тока 0,7–1,3 А/см2 и напряжении на электролизере 4,2–4,5 В. Такой режим работы является оптимальным, выход по току при этом составляет 88–90 %. Современные электролизеры работают при больших нагрузках при силе тока 80 000–150 000 А и выше.
Алюминий-сырец очищают от неметаллических примесей и газов пропусканием через расплав газообразного хлора. Для получения более чистого алюминия его подвергают электрорафинированию, после которого в нем содержится не более 0,01 % примесей. При рафинировании алюминия в качестве анода используют расплав алюминия, содержащий до 35 % меди (для утяжеления расплава) и потому находящийся на дне электролизера. Средний жидкий слой ванны содержит расплав солей хлорида бария, фторида алюминия, фторида натрия, а верхний слой – расплавленный рафинированный алюминий – служит катодом.
Электролизом расплава гидроксида натрия получают металлический натрий. Процессы, протекающие при получении натрия:
4Na+ + 4e = 4Na (на катоде), 4ОН – 4е = О2 + 2Н2О (на аноде).
Однако образующаяся в процессе электролиза вода, снижает выход по току натрия. Потому в настоящее время 95 % мирового производства натрия получают электролизом расплава хлорида натрия.
Электролиз расплава хлорида магния (обезвоженный карналлит) – наиболее распространенный способ получения магния.
Электролизом расплавов в промышленном масштабе получают также порошки чистых тугоплавких металлов: вольфрама, молибдена, ванадия, циркония, ниобия, тантала, которые необходимы для получения сверхпрочных сплавов.
Электролиз водных растворов – важная отрасль металлургии тяжелых цветных металлов: меди, никеля, висмута, сурьмы, олова, свинца, кобальта,
66
кадмия, цинка. Он применяется также для получения благородных и рассеянных металлов, марганца, хрома.
Электролиз используют непосредственно для катодного выделения металла из водного раствора солей – электроэкстракция, а также для очистки металла – электролитическое рафинирование.
Принцип электроэкстракции весьма прост. Примером может служить электролиз кислого раствора сульфата цинка с нерастворимыми анодами. Высокое перенапряжение водорода на цинке обеспечивает возможность катодного осаждения цинка с высоким выходом по току. При электролитическом получении цинка основной катодный процесс:
Zn2+ + 2e = Zn.
Этим методом в настоящее время получают медь, цинк, кадмий, кобальт, чистое железо (99,95 % и выше), марганец (99,5 %) и хром (99,8 %).
Процесс электролитического рафинирования состоит в анодном растворении загрязненного примесями (чернового) металла и последующем его катодном осаждении. Например, при рафинировании меди аноды, изготовленные из черновой меди, растворяются с образованием катионов меди:
Сu – 2e = Cu2+.
При этом все примеси металлов, имеющие электродный потенциал более положительный, чем потенциал меди, не окисляются и выпадают в виде осадка (шлама) на дно электролитической ванны. Среди примесей в меди нередко содержатся золото, серебро, селен, теллур, платина, представляющие большую ценность как драгоценные металлы и полупроводники. В шламе содержится от 12 до 30 % меди, от 30 до 50 % серебра, от 1 до 4 % золота, от 5 до 14 % селена, от 0,3 до 1,1 % теллура. Извлечение их из шлама в значительной степени компенсирует затраты электроэнергии на рафинирование меди. Цинк, никель, железо легко окисляются на аноде, но практически не восстанавливаются на катоде при потенциале восстановления ионов меди.
На катоде, изготовленном из листа чистой меди, происходит разряд катионов меди:
67
Cu2+ + 2e = Cu
с образованием чистой рафинированной меди.
Примеси металлов, имеющие более отрицательный, чем медь электродный потенциал, остаются в растворе (например, ионы цинка, что в дальнейшем позволяет получать при рафинировании меди дополнительный побочный продукт – сульфат цинка).
После электрорафинирования медь содержит не более 0,01 % других металлов.
Обычно электролитическое рафинирование меди ведут из сернокислого электролита, содержащего 125–190 г/л сульфата меди и 185–190 г/л серной кислоты. Серная кислота увеличивает электропроводность раствора и предотвращает образование на катоде гидроксида меди (II), который может загрязнять катодный осадок меди. Температура электролита – 50–60 °С, плотность тока 0,016–0,305 А/см2, напряжение на ванне 0,18–0,46 В, выход по току 89–96 %.
Метод электролитического рафинирования применяется в крупных производственных масштабах; с его помощью очищают медь, серебро, золото, свинец, олово, висмут, никель и др. металлы.
Электролиз водных растворов используют также для приготовления металлических порошков меди, никеля, серебра, хрома.
2.ХЕМОТРОНИКА
Впоследнее время быстро развивается новая молодая отрасль электрохимии – хемотроника, занимающаяся проблемами использования электрохимических преобразователей (хемотронов) в качестве элементов различных электронных схем. Электрохимические преобразователи позволяют осуществлять восприятие, хранение, воспроизведение и передачу информации и могут функционировать в качестве элементов или блоков вычислительных или управляющих устройств. В основе действия этих приборов лежат закономерности таких электрохимических процессов, как прохождение электрического тока через систему металл–электролит–металл, сопровождающихся явлениями поляриза-
68
ции, изменением массы или объема веществ при электролизе; используются также явления, связанные с изменением поверхностного натяжения на границе металл–электролит, которое зависит от величины потенциала электрода. По указанным выше признакам хемотроны подразделяют на следующие группы: концентрационные преобразователи, электрокинетические преобразователи, преобразователи на основе фазовых переходов при электролизе.
Преобразователи первого типа основаны на закономерностях диффузионной кинетики. В этих хемотронах используются инертные электроды и обратимые окислительно-восстановительные системы (йод-йодид, бром-бромид, фер- ро-ферроцианид и др.). На практике часто применяют платиновые электроды и систему йод-йодид. На аноде такого хемотрона окисляются йодид-ионы:
2I – 2e = I2,
а на катоде восстанавливается свободный йод: I2 + 2e = 2I .
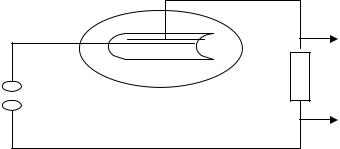
Простейший концентрационный преобразователь – электрохимический диод – представляет собой (рис. 9) миниатюрную двухэлектродную ячейку (ампулу) из стекла, заполненную раствором йодистого калия с небольшим количеством йода. В ампулу впаяны два платиновых электрода, значительно отличающиеся друг от друга по площади.
Двухэлектродная электрохимическая ячейка включается в электрическую цепь, состоящую из источника переменного тока, сопротивления и регистратора величины постоянного тока.
Выход
Вход
Рис. 9. Электрохимический диод
При пропускании через цепь электрического тока происходит электролиз. Так как сила тока определяется скоростью электродных реакций, то лимитиро-
69
вать ее может только катодный процесс вследствие малой концентрации свободного йода в растворе. На большом катоде йод восстанавливается быстро: прибор пропускает значительный ток. При смене полюсов площадь катода резко уменьшается, и в цепи протекает очень слабый ток. Таким образом, электрохимическая ячейка работает, как выпрямитель тока, то есть является электрохимическим диодом. Такую электрохимическую ячейку обычно используют как выпрямитель слабых электрических сигналов (10–200 мВ), когда обычные полупроводниковые приборы малоэффективны.
Электрохимические диоды можно использовать в качестве интеграторов (электросчетчиков), если отделить электроды пористой керамической перегородкой. Пористая перегородка не мешает прохождению электрического тока, однако не дает смешиваться растворам катодного и анодного пространства. При прохождении тока в анодном отсеке уменьшается концентрация восстановленной, а в катодном – концентрация окисленной форм. (На аноде начинает накапливаться йод.) Изменение концентрации (∆С) связано с количеством пропущенного электричества (∆Q) законом Фарадея
∆С = k∆Q / F
и может быть легко измерено по изменению интенсивности окраски раствора в анодном отсеке прибора.
На основании концентрационных преобразователей сконструированы также стабилизаторы и усилители слабых низкочастотных электрических сигналов.
Хемотроны используются также для преобразования механического воздействия в электрический сигнал. На рис. 10 представлена схема электрохимического датчика давления.
70
Соседние файлы в предмете Электрохимия
- #
- #
- #
- #
- #
- #
- #