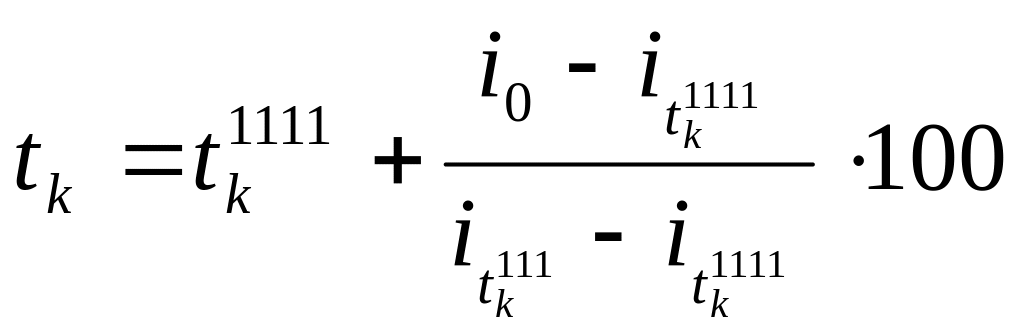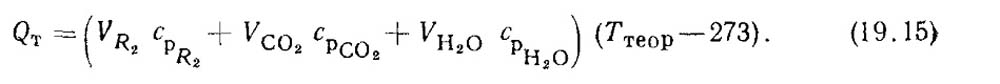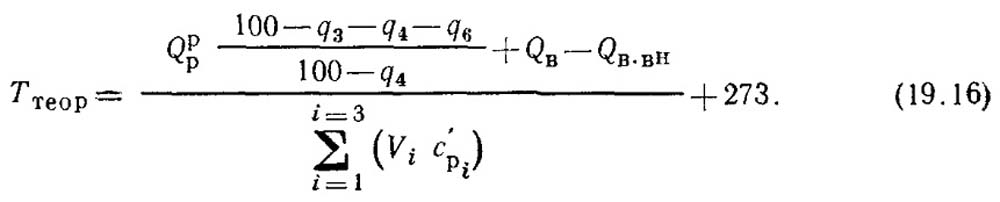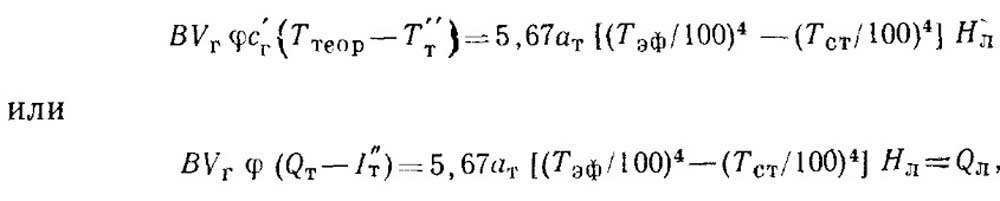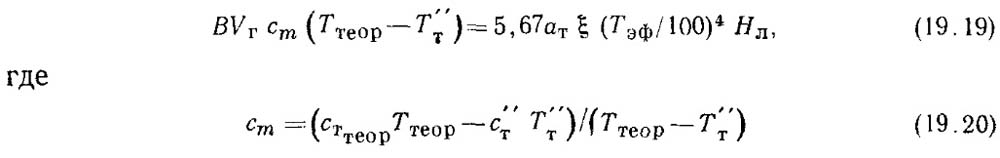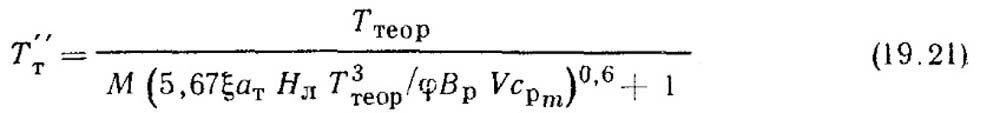Различают
три вида температур горения топлива:
калориметрическую (tk),
теоретическую
(tт)
и действительную
(tд).
Калориметрическая
температура – это температура, до
которой нагрелись бы продукты полного
горения, если бы все тепло топлива и
воздуха пошло на нагрев газов. Для
определения этой температуры составляют
уравнение теплового
баланса:
(2.13)
где
–
низшая теплотворная способность
топлива, кДж/кг;
qт
– физическое тепло топлива, кДж/кг;
qв
– физическое тепло воздуха, кДж/кг;
Vпг
– объем продуктов горения, м3/кг;
Спг
– средняя теплоемкость продуктов
горения в интервале температур 0– tk,
кДж/м3.°С.
Низшую
теплотворную способность жидкого
топлива расчитывают по эмпирической
формуле Менделеева [4]:
кДж/кг,
(2.14)
где
и
т.д. – содержания составляющих в топливе
по рабочей массе, %.
По формуле (2.14):
Физическое тепло
топлива определяется по формуле:
кДж/кг,
(2.15)
где
Ст
– теплоемкость топлива при температуре
подогрева,
кДж/(м3.°С);
tт
– температура подогрева топлива, °С;
Vт
– объем топлива, м3.
В данной курсовой
работе принято, что подаваемое топливо
не подогревается. Следовательно,
физическое тепло топлива равно нулю и
в расчетах не учитывается.
Физическое
тепло воздуха определяется по формуле:
кДж/кг,
(2.16)
где
Св
– теплоемкость воздуха при температуре
подогрева,
кДж/(м3.°С);
tт
– температура подогрева воздуха, °С;
Vт
– объем воздуха, м3.
По заданию курсовой
работы температура подогрева воздуха
tв
= 270°С. По справочной литературе для
температуры tв
= 270°С теплоемкость воздуха
равна
[2]: Св
= 1,38кДж/(м3.°С).
Объем воздуха при коэффициенте избытка
воздуха αв
= 1,2 равен: Vв
=12,3124 м3/кг.
Тогда физическое тепло воздуха по
формуле (2.16) составляет:
кДж/кг.
Таким образом,
калориметрическая температура
определяется по выражению:
°С.
(2.17)
Однако определить
калориметрическую температуру
невозможно, т.к. теплоемкость продуктов
горения является функцией искомой
температуры, поэтому калориметрическую
температуру чаще всего определяют
методом последовательного приближения,
т.е. путем подбора. Суть метода заключается
в сравнении энтальпии топлива с
энтальпией продуктов горения, определенной
с использованием известной низшей
теплоты сгорания и объема продуктов
горения. Энтальпия топлива определяется
по следующему выражению:
кДж/м3.
(2.18)
Энтальпия
продуктов горения определяется
суммированием энтальпий каждой
составляющей продуктов горения при
заранее принятой калориметрической
температуре. Исходя из экспериментальных
данных,
калориметрическую температуру выбирают
из интервала
°С.
Объем
продуктов горения, по произведенным
ранее расчетам, равен: Vпг
= 1347,069 м3/кг.
Для того, чтобы отнести объем продуктов
горения к одному килограмму топлива
необходимо разделить его на сто, т.е.
Vпг
= 13,471 м3/кг.
Тогда энтальпия топлива в соответствии
с формулой (2.18) будет составлять:
кДж/м3.
Пусть в первом
приближении калориметрическая
температура
°С.
Тогда энтальпия составляющих продуктов
горения при этой
температуре:
кДж/м3;
кДж/м3;
кДж/м3;
кДж/м3;
кДж/м3.
следовательно,
необходимо повторно произвести расчет,
приняв калориметрическую температуру
равную:
°С.
Энтальпия продуктов горения при этой
температуре равна:
кДж/м3;
кДж/м3;
кДж/м3;
кДж/м3;
кДж/м3.
следовательно,
необходимо повторно произвести расчет,
приняв калориметрическую температуру
равную:
°С.
Энтальпия продуктов горения при этой
температуре равна:
кДж/м3;
кДж/м3;
кДж/м3;
кДж/м3;
кДж/м3
следовательно,
необходимо повторно произвести расчет,
приняв калориметрическую температуру
равную:
°С.
Энтальпия продуктов горения при этой
температуре равна:
кДж/м3;
кДж/м3;
кДж/м3;
кДж/м3;
кДж/м3
следовательно,
искомая калориметрическая температура
tk
будет находиться в интервале температур
2000–2100 °С.
Искомое значение
калориметрической температуры определяют
по следующему выражению [4]:
°С;
(2.19)
По формуле (2.19):
°С.
Теоретическая
температура горения топлива – это
температура, до которой нагревались
бы продукты горения, если бы на их
нагревание пошло бы все тепло, введенное
в рабочее пространство печи за вычетом
потерь тепла на диссоциацию газов:
углекислого газа и влаги. Эту температуру
определяют по формуле:
°С,
(2.20)
где
–
низшая теплотворная способность
топлива, кДж/кг;
qт
– физическое тепло топлива, кДж/кг;
qв
– физическое тепло воздуха, кДж/кг;
qдис
– потери тепла при диссоциации газов,
кДж/кг;
Vпг
– объем продуктов горения, м3/кг;
Спг
– средняя теплоемкость продуктов
горения в интервале температур 0– tk,
кДж/м3.°С.
Поскольку
потери тепла на диссоциацию при
температурах, развивающихся в рабочем
пространстве печи (до 1500 °С), невелики,
теоретическую температуру при
практических расчетах можно считать
равной калориметрической [4].
Действительная
температура горения – это температура,
которую имеют продукты горения в
конкретных условиях процесса сжигания
топлива с учетом потерь, связанных с
теплоотдачей в рабочем пространстве
печи. Эта температура может быть
определена по формуле:
°С,
(2.21)
где
qпотерь
– количество тепла, отдаваемое в
процессе горения окружающей среде и
расходуемое на нагрев металла.
На
практике определение qпотерь
невозможно, поэтому для определения
действительной температуры горения
топлива вводится понятие пирометрического
коэффициента, равного отношению:
(2.22)
Пирометрический
коэффициент зависит от условий сжигания
топлива, конструкции и режима работы
печи. Для кузнечной камерной печи
пирометрический коэффициент лежит в
пределах [4]: ηпир
= 0,75–0,85.
Принимается ηпир
= 0,75. В этом случае действительная
температура в печи из формулы (2.22) равна:
°С;
°С.
Для дачи заключения
о годности заданного источника тепловой
энергии для нагрева заданного металла,
определяют требуемую температуру
продуктов горения топлива
и сравнивают ее с действительной
температурой tд.
Требуемую
температуру продуктов горения можно
определить по следующей формуле [4]:
°С,
(2.23)
где
–
конечная температура металла в печи
(максимальная температура начала
ковки), °С;
Δt
– температурный напор между tпп
и поверхностью садки, °С.
Максимальная
температура начала ковки определяется
по справочной литературе. Для стали
Ст4 эта температура равна [4]:
°С.
При обычном нагреве
металла температурный напор для
кузнечной камерной печи принимают
равным [4]: Δt
= 50–150 °С. Принимается Δt
= 100
°С. Тогда требуемая температура продуктов
горения по формуле (2.23) равна:
°С.
Поскольку
заданный
источник тепловой энергии пригоден
для нагрева заданного металла, т.к. он
обеспечивает необходимую температуру
печного пространства.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Предложите, как улучшить StudyLib
(Для жалоб на нарушения авторских прав, используйте
другую форму
)
Ваш е-мэйл
Заполните, если хотите получить ответ
Оцените наш проект
1
2
3
4
5
Температура горения и температура газов на выходе из топки
Рассмотрение процессов горения топлива и анализ уравнения теплового баланса котельного агрегата показывают, что для успешного сжигания топлива требуется создание в топочных устройствах соответствующих температурных режимов. Режим топочной камеры характеризуют следующие условные температура горения и температура газов на выходе из топки: 1) калориметрическая максимальная; 2) калориметрическая; 3) теоретическая.
Калориметрической максимальной называется такая температура горения, которую могли бы иметь продукты полного сгорания топлива при теоретическом количестве воздуха (α = 1) и при условии, что вся теплота, выделенная топливом, израсходовалась только на нагрев продуктов горения.
Калориметрической называется температура горения и температура газов на выходе из топки, которую приобрели бы продукты полного сгорания топлива при отсутствии потерь теплоты и любом значении коэффициента избытка воздуха α, превышающем единицу.
Теоретическая температура горения и температура газов на выходе из топкиотличается от калориметрической тем, что при ее определении учитывается эндотермический процесс диссоциации продуктов сгорания при высокой температуре (Т >2100 К). При обычно достигаемых в топках температурах (1470 — 2050 К) диссоциация СО2 и Н20 практически отсутствует (см. § 12.4), и в случае полного горения теоретическая температура горения и температура газов на выходе из топки с достаточной точностью совпадает с калориметрической.
Теоретическую температуру горения рассчитывают на основе уравнения энергетического баланса процесса сжигания 1 кг или 1 м3 топлива: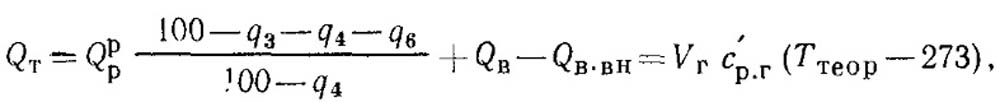
где QB — теплота, вносимая с горячим воздухом, нагреваемым в пределах котлоагрегата (в воздухоподогревателе); ср.г — средняя объемная изобарная теплоемкость продуктов сгорания; Ттеор — теоретическая температура горения.
Следует помнить, что в теплоту Qp/р входит теплота нагретого воздуха QB.BН 1см. формулу, которую он получил до входа в воздухоподогреватель (в паровом или водяном калорифере). Левая часть уравнения (19.14) представляет собой тепловыделение в топке при сжигании 1 кг или 1 м3 топлива. Величину срг можно вычислить как теплоемкость газовой смеси, состоящей из трех компонентов: двухатомных газов, сухих трехатомных газов и водяных паров. Теплоемкости этих компонентов приведены в прил. 1. В этом случае уравнение (19.14) принимает вид
Это уравнение показывает, что тепловыделение в топке равно энтальпии продуктов сгорания при Гтеор. Из равенства (19.15) определяют теоретическую температуру горения:
В этом уравнении неизвестны величина Ттеор и значения теплоемкостей CpN2, СрСо2 СРН2О которые ей соответствуют. Теоретическую температуру горения находят методом подбора или графическим путем с помощью IТ — диаграммы, которую строят следующим образом. Задаются несколькими значениями температуры газов и определяют для них энтальпию по правой части уравнения (19.15). Затем, выбрав масштабы температур и энтальпий в прямоугольной системе осей координат IT, проводят кривую I = f (T) и по диаграмме находят температуру, при которой I будет равно левой части уравнения (19.15), т.е. I = QT. В этом случае I представляет собой теоретическую энтальпию продуктов сгорания. На рис. 19.30 приведена IT — диаграмма, по которой определена теоретическая температура горения для конкретного числового примера, приведенного в конце настоящей главы.
Анализ уравнения (19.16) показывает, что теоретическая температура горения и температура газов на выходе из топки зависит в основном от четырех факторов:
- теплоты сгорания и, следовательно, от вида и свойств сжигаемого топлива (в Qp/р входит Qрн);
- коэффициента избытка воздуха, основное влияние которого сказывается на величине объема продуктов сгорания;
- температуры подогрева воздуха;
- совершенства организации процесса горения (т.е. от величины химического недожога q3).
Влияние потери с физической теплотой золы и шлаков q6 на величину Ттеор незначительно.
Для заданного вида топлива и способа его сжигания основное влияние на величину Гтеор оказывают коэффициент избытка воздуха и температура его подогрева. Например, при горении газа характер этого влияния подобен влиянию концентрации и температуры подогрева на нормальную скорость распространения пламени (см. рис. 18.4).
Другой важной характеристикой работы топочной камеры является температура газов на выходе из топки Тт Эта температура всегда меньше вычисленной теоретической вследствие отдачи газами теплоты той поверхности нагрева (котла или обжигаемого в печах изделия), которая может воспринимать теплоту с помощью лучеиспускания (радиации) непосредственно от топочных газов и горящего топлива.
Температуру газов на выходе из топки Тт находят путем совместного решения уравнений теплового баланса топки и теплоотдачи:
где QT — тепловыделение в топке; Iт и Тт — энтальпия продуктов сгорания и температура на выходе из топки; (φ.- коэффициент сохранения теплоты [φ = (100 — q5)/100]; ат = агаст — приведенная степень черноты топочной камеры (см. § 15.2); QЛ — теплота, отдаваемая топке путем излучения; Тэф — эффективная температура факела, К; Тст — температура стенки экрана, К; Нл — площадь лучевоспринимающей поверхности топки.
В топочной камере существует сложное поле температур. Лучистый тепловой поток, воспринимаемый различными частями экранов, будет неравномерным. Например, в зоне, где находится горящий факел, тепловой поток, падающий на экраны, выше, чем в верхней или нижней части топки.
Эффективная температура факела ТЭФ — это такая усредненная температура, при которой равномерный тепловой поток, падающий на Нл, равен суммарному количеству теплоты, воспринимаемой экранами от факела при фактических температурах топочной среды.
Экранные поверхности являются серыми телами. Поэтому в условиях топочной камеры существенное значение имеют отраженные тепловые потоки. При загрязнении поверхностей экранов их температура возрастает. Следовательно, возрастают и потоки собственного излучения стенок экранов, и их влияние на суммарный перенос теплоты в топочной камере. Собственное излучение экранов учитывают с помощью коэффициента загрязнения.
Вводя понятие средней теплоемкости с учетом коэффициента § по (19.18), придаем уравнению (19.17) следующий вид
средняя теплоемкость в интервале температур от Ттеор до Тт.
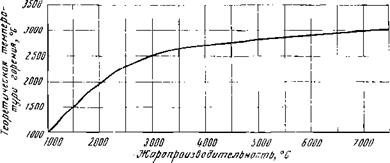
При проверочном расчете топки в соответствии с нормативным методом температуру на выходе из топки определяют по формуле
Коэффициент М учитывает влияние горения (относительное положение факела в объеме топки) на теплообмен и зависит от типа топки, вида топлива и места расположения горелок по высоте топки. В общем случае М = А — Вх. При камерном сжигании высокореакционных твердых топлив и слоевом сжигании всех топлив А = 0,59 и В = 0,5. При сжигании газа или мазута М = 0,54 ÷ 0,2х. Величина х = h1/h2, где h1 — высота расположения горелки над подом топки, a h2 — расстояние от пода топки до середины сечения для выхода газов из топки. Для слоевых топок с пневмомеханическими забрасывателями х = 0,1; при сжигании топлива в толстом слое х = 0,14.
Рассмотренный метод определения температуры газов на выходе из топки не учитывает процесса теплопередачи от наружного загрязненного слоя к теплоносителю. Метод, разработанный Всесоюзным теплотехническим институтом им. Ф. Э. Дзержинского (ВТИ) совместно с Энергетическим институтом им. Г. М. Кржижановского (ЭНИН), позволяет дополнительно учесть влияние температуры теплоносителя, термического сопротивления слоя загрязнения экранных поверхностей, степени их черноты и др. Этот метод основан на решении системы из четырех уравнений: первые два уравнения являются соответственно правой и левой частями уравнения (19.17); третье представляет собой уравнение теплопередачи между наружным слоем загрязнения поверхности нагрева и теплоносителем; четвертым является уравнение для определения эффективной температуры топочной среды. Оно учитывает влияние таких факторов, как вид топлива, угол наклона горелки и степень экранирования топочной камеры.
Подробный расчет теплообмена в топке и определение температуры на выходе из топки по методам ЦНИПКИ им. И. И. Ползунова и ВТИ — ЭНИН приведены в специальной литературе.
Теоретическая температура горения £теор отличается от жаропроизводительности £тах гем, что при подсчете ор учитывается теплота диссоциации продуктов горения. При высокой температуре С02 диссоциирует с образованием СО и 02, а Н20 — с образованием Н2 и 02.
Степень диссоциации возрастает с повышением температуры и снижением парциального давления С02 и II20.
Так, при парциальном давлении С02 0,2 ата, при сжигании углерода при атмосферном давлении в стехиометрическом объеме воздуха и содержании в продуктах сгорания 20% С0.2, при 1800° диссоциирует около 3,7% С02, при 1900° — около 6%, при 2000° — около 10%, при 2100° — около 15%, при 2200° — около 23%.
Таким образом, с повышением температуры диссоциация С02 быстро возрастает, и при 3000° диссоциирует около 90% С02.
При понижении парциального давления С02 степень диссоциации возрастает. Так, например, при 2000° и давлении С02 1 ата диссоциирует около 6% двуокиси углерода, при давлении С0.2 0,2 ата диссоциирует около 10% и при давлении 0,1 ата — около 12,5%.
Водяной пар диссоциирует при равных температурах и давлениях в значительно меньшей степени, чем двуокись углерода. Так, при 2000° и парциальном давлении 1 ата диссоциирует около 2% Н20, при давлении
0, 2 ата — около 3,5% и при давлении 0,1 ата — около 4%.
Таким образом, степень диссоциации водяного пара при температуре 2000° примерно втрое меньше степени диссоциации двуокиси углерода.
При подсчете температуры в топках при сжигании топлива с высокой жа — ропроизводительностыо, и в особенности при подогреве воздуха, необходимо считаться с понижением температуры вследствие диссоциации продуктов сгорания.
Методика подсчета температуры горепия с учетом диссоциации продуктов сгорания была разработана акад. П. С. Курнаковым и получила широкое применение в расчетах металлургических процессов [47] и процессов горения. Метод подсчета в большой степени осложняется необходимостью учета изменения вследствие диссоциации двух величин — температуры и объема продуктов горения.
Следует отметить, что при высокой температуре необходимо считаться не только с диссоциацией двуокиси углерода с образованием окиси углерода и кислорода и диссоциацией водяного пара с образованием водорода и кислорода, но и с более далеко идущей диссоциацией продуктов горения с образованием гидроксилов и атомарного водорода и кислорода, а также с появлением в составе продуктов горения окиси азота N0 в результате эндотермического процесса окисления азота. Так, подсчеты состава цродуктоп сгорания при атмосферном давлении октана (С8Н18) в стехиометрическом объеме воздуха, произведенные Я. Б. Зельдовичем и Л. И. Полярним, показали, что при 2127° (2400°К) в составе продуктов горения содержится 72,1 % N2; 12,61%НаО; 9,88% С02; 2,31 % СО; 1,14% ОН:0,41% N0:0,92?« 02, 0,12% Н и 0,09% О 148].
Таким образом, трудоемкий подсчет теоретической температуры горения, производимый по указанной выше методике [47], не вполне точен, поскольку учитывается только диссоциация С02 и Н20 с образованием СО, Н2 и 02 и не принимается во внимание содержание в продуктах горения гидроксилов и атомарных газов. Допускаемая при этом погрешность может быть оценена следующим образом. Теплота диссоциации в пересчете па 1 нм3 исходных продуктов сгорания октана равна 101 ккал с учетом образования СО, Н, и 02 и около 108 ккал с учетом образования также закиси азота, гидроксилов и атомарных газов.
Следовательно, расхождение составляет около 7 ккал на 1 нм3 продуктов горения, или около 450 ккал на 1 нмя октана.
Указанная величина составляет около 0,8% по отношению к теплоте сгорания октана. Температура горения, подсчитанная без учета более глубокой диссоциации продуктов горепия при указанной температуре, также будет примерно на 0,8%, или на 15°, отличаться от температуры горения, подсчитанной с более полным учетом продуктов ;|,иссоциации.
Теоретическая и расчетная температуры горения в большой степени зависят от точности заданного соотношения топлива и воздуха. Так, при увеличении избытка подаваемого воздуха на 1 % расчетная температура горения снижается примерно на 0,5%. Между тем контроль процесса горения, осуществляемый по газовому анализу, в большинстве случаев не позволяет поддерживать избыток воздуха с точностью, превышающей 1 %, что соответствует изменению содержания кислорода в продуктах горепия около 0,2%.
В связи с этим следует считаться с определенными погрешностями в подсчете теоретической и расчетной температур горения, производимом по принятой в настоящее время сложной и трудоемкой методике.
Как уже отмечалось, в технических расчетах при сжигании топлива без ирименения обогащенного кислородом воздуха и при поддержании температуры ниже 2100° обычно считаются с образованием в продуктах сгорания в результате диссоциации только СО, Н2 и О.,. В этих случаях с учетом указанных выше погрешностей можно приближенно подсчитать теоретическую и расчетную температуры горения по простой методике, основанной на следующих положениях.
Объем продуктов сгорания в результате диссоциации С02 и Н20 возрастает, однако теплосодержание продуктов сгорания, не диссоциированных и частично диссоциированных, при той же температуре практически почти не меняется вследствие того, что объемная теплоемкость исходных трехатомных газов С02 и Н20 более высока по сравнению с теплоемкостями образующихся двухатомных газов. Так, объемная теплоемкость С02 от 0 до 2000° равна 0,5785 ккал/нм3, теплоемкость СО — 0,3592 ккал/нм3 и теплоемкость кислорода 0,3748 ккал/нм3 (см. табл. 24). Следовательно, теплосодержание 1 нм3 СО И 0,5 НМ302, образующихся в результат© диссоциации ^ имя СО-2, мало от-
Личастся от теплосодержания исходной С0.2
Г-со + 0,5С’о. = 0,3592 + 0,5-0,3748 = 0.546(5 ккал/нм3 С02°С.
По отношению к теплосодержанию исходной С02 разность составляет
Теплосодержание продуктов диссоциации 1 нмг Н20 в большей степени отличается от теплосодержания исходного водяного пара
^д“00 = 0,4688 ккал-пм* СС;
0,3362 +0,5-0,3748 = 0,5236 ккал’нм* Н20°С;
„ (0.5**36—0,4688)-100
Н, и ————— 11%.
Итак, теплосодержание продуктов диссоциации С02 несколько ниже теплосодержания исходной двуокиси углерода, а теплосодержание продуктов диссоциации Н20 выше, чем у исходного водяного пара.
С учетом того обстоятельства, что С0.2 диссоциирует в сопоставимых условиях в большей степени, чем водяной пар, суммарные отклонения в теплосодержании продуктов диссоциации и исходных газов у большинства видов топлива в значительной степени нивелируются.
Поскольку при температурах до 2100° диссоциирует лишь малая часть С02 п Н20 и, следовательно, еще меньшая часть суммарного объема продуктов сгорания топлива, содержащих высокий процент азота, можно для упрощенного подсчета теоретической и расчетной температур горения принять, что произведение объемов продуктов сгорания на их средневзвешенную теплоемкость в температурном интервале от 0° до £теор не меняется в результате диссоциации С02 и ИХ) [6].
При таком допущении теоретическая температура горения может быть подсчитана по формуле
1 __ — ^дигг. /Т-„. оч
‘теор — у.(] «
Где (3„ — низшая теплота сгорания топлива, ккал/кг или ккал/нм3’,
С. ш.-г — теплота диссоциации продуктов сгорания, образующихся при сгорании 1 кг или 1 нм3 топлива, ккал/кг или ккал/нм3;
V — объем продуктов сгорания, нм3/кг или нмя/нм3;
С средневзвешенная теплоемкость продуктов сгорания от 0° до <теор икал/нм3, °С.
1 Значения средневзвешенной теплоемкости продуктов сгорания от 0° до t приведены в табл. 24.
Следовательно, упрощенный подсчет теоретической температуры горения /;г()[, отличается от подсчета жаропроизводительности <тах лишь необходимостью учета теплоты диссоциации <Здиес.
Данные о степени диссоциации С02 и Н30 при различных температурах и парциальных давлениях приведены в табл. 32, 33.
В качестве примера приводим подсчет теоретической температуры горения пропана.
Низшая теплота сгорлппя пропана 21 800 ккал/нмя. Уравнение горения пропана в стехиометрическом объеме воздуха
СзП3 + 502 + 5-3,Тем? — ЗС02 + 4ЧгО + 18,81’2.
Объем продуктов сгорания 25,8 им3.
Состав продуктов сгорания СО, — 11,5%; Н20 — 15,5%; 1Ч2 — 73,0%.
Задаемся температурой горения 2000° и подсчитываем значение теплоты диссоциации СО., и Н40 при парциальпых давлениях 0,115 и 0,155 ата и температуре 2000° Степень диссоциации СО, а — 0,12 (табл. 32).
Теплота диссоциации С02:
С. = ГСО/а<?СО =3.0,12-3030 = 1090 «««.
Степень диссоциации Н20 6 = 0,036 (табл. 33).
Таблица 32
Степень диссоциации двуокиси углерода а, */
|
Парциальное |
Давление двуокиси углерода, |
Ата |
||||||||||||||||||||||
|
°с |
0,03 |
0,04 |
0,05 |
0,06 |
0,07 |
0,08 |
0,09 |
0,10 |
0,12 |
0,14 |
0,16 |
0,18 |
0,20 |
0,25 |
0,30 |
0,35 |
0,40 |
0,45 |
0,50 |
0,60 |
0,70 |
0.80 |
0,90 |
1,00 |
|
1500 |
0,6 |
0,5 |
0,5 |
0,5 |
0,5 |
0,5 |
0,5 |
0,5 |
0,5 |
0,5 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
|
1600 |
2,2 |
2,0 |
,9 |
1,8 |
1,7 |
1,6 |
1,55 |
1,5 |
1,45 |
1,4 |
1,35 |
1,3 |
1,3 |
1,2 |
1,1 |
1,0 |
0,95 |
0,9 |
0,85 |
0,83 |
0,79 |
0,75 |
0,72 |
0.7 |
|
1700 |
4,1 |
3,8 |
3,5 |
3,3 |
3,1 |
3,0 |
2,9 |
2,8 |
2,6 |
2,5 |
2,4 |
2,3 |
2,2 |
2,0 |
1,9 |
1,8 |
1,75 |
1,7 |
1,65 |
1,6 |
1,5 |
1,4 |
1,3 |
1,3 |
|
1800 |
6,9 |
0,3 |
5,9 |
5,5 |
5,2 |
5,0 |
4,8 |
4,6 |
4,4 |
4,2 |
4,0 |
3,8 |
3,7 |
3,5 |
3,3 |
3,1 |
3,0 |
2,9 |
2,75 |
2,6 |
2,5 |
2,4 |
2,3 |
2,2 |
|
1900 |
11,1 |
10,1 |
9,5 |
8,9 |
8,5 |
8Д |
7,8 |
7,6 |
7,2 |
6,8 |
6,5 |
6,3 |
6,1 |
5,6 |
5,3 |
5,1 |
4,9 |
4,7 |
4,5 |
4,3 |
4,1 |
3,9 |
3,7 |
3,6 |
|
2000 |
18,0 |
16,5 |
15,4 |
14,6 |
13,9 |
13,4 |
12,9 |
12,5 |
11,8 |
11,2 |
10,8 |
10,4 |
10,0 |
9,4 |
8,8 |
8,4 |
8,0 |
7,7 |
7,4 |
7,1 |
6,8 |
6,5 |
6,2 |
6,0 |
|
2100 |
25,9 |
23,9 |
22,4 |
21,3 |
20,3 |
19,6 |
18,9 |
18,3 |
17,3 |
16,6 |
15,9 |
15,3 |
14,9 |
13,9 |
13,1 |
12,5 |
12,0 |
11,5 |
11,2 |
10,5 |
10,1 |
9,7 |
9,3 |
9,0 |
|
2200 |
37,0 |
35,1 |
33,1 |
31,5 |
30,3 |
29,2 |
28,3 |
27,5 |
26,1 |
25,0 |
24,1 |
23,3 |
22,6 |
21,2 |
20,1 |
19,2 |
18,5 |
17,9 |
17,3 |
16,4 |
15,6 |
15,0 |
14,5 |
14,0 |
|
2300 |
47,6 |
44,7 |
4′,5 |
40,7 |
39,2 |
37,9 |
36,9 |
35,9 |
34,3 |
32,9 |
31,8 |
30,9 |
30,0 |
28,2 |
26,9 |
25,7 |
24,8 |
24,0 |
>3,2 |
22,1 |
21,1 |
20,3 |
19,6 |
19,0 |
|
2400 |
59,0 |
56,0 |
53,7 |
51,8 |
50,2 |
48,8 |
47,6 |
46,5 |
44,6 |
43,1 |
41,8 |
40,6 |
39,6 |
37,5 |
35,8 |
34,5 |
33,3 |
32,3 |
31,4 |
29,9 |
28,7 |
27,7 |
26,8 |
26,0 |
|
2500 |
09,1 |
011,3 |
С4,1 |
С>2,2 |
60,6 |
59,3 |
58,0 |
56,9 |
55,0 |
53,4 |
52,0 |
50,7 |
44,7 |
47,3 |
45,4 |
43,9 |
42,6 |
41,4 |
40,4 |
38,7 |
37,2 |
36,0 |
34,9 |
34,0 |
|
2600 |
77,7 |
75,2 |
73,3 |
71,6 |
70,2 |
68,!! |
67,8 |
66,7 |
64, У |
63,4 |
62,0 |
00,8 |
59,7 |
57,4 |
55,5 |
53, Н |
52,4 |
51,2 |
50,1 |
48,2 |
46,6 |
45,3 |
44,1 |
43,0 |
|
27 00 |
84,4 |
82,5 |
81,1 |
79,8 |
78,6 |
77,6 |
76,6 |
75,7 |
74,1 |
72,8 |
71,6 |
70,5 |
69,4 |
67,3 |
65,5 |
63,9 |
62,6 |
61,3 |
00,3 |
58,4 |
56,8 |
55,4 |
54,1 |
53,0 |
|
2800 |
89,6 |
88,3 |
87,2 |
86,1 |
85,2 |
84,4 |
83,7 |
83,0 |
81,7 |
30,6 |
79,6 |
78,7 |
77,9 |
76,1 |
74,5 |
73,2 |
71,9 |
70,8 |
69,9 |
63,1 |
66,6 |
65,3 |
64,1 |
63,0 |
|
2900 |
93,2 |
92,2 |
91.4 |
90,6 |
90,0 |
89,4 |
88,8 |
88,3 |
87,4 |
86,5 |
85,8 |
85,1 |
84,5 |
83,0 |
81,8 |
80,7 |
79,7 |
78,8 |
78,0 |
76,5 |
75,2 |
74,0 |
73,0 |
72,0 |
|
3000 |
95,6 |
04,0 |
94,4 |
УЗ, 9 |
93,5 |
93,1 |
92,7 |
92,3 |
91,7 |
91,1 |
90,0 |
90,1 |
89,6 |
88,5 |
87,0 |
86,8 1 1 |
80,0 |
185,4 I |
84,7 |
83,6 |
82,5 |
41,7 |
80,8 |
80,0 |
Таблица ЯЗ
Стенонь диссоциации водяного пара, б %
Парциальное давление водяного пара, ата
|
°С |
0,03 |
0,04 |
0.0,1 |
0,06 |
0,н7 |
0,08 |
0,09 |
Одо |
0,(2 |
0,14 |
0,16 |
0,18 |
0,20 |
0,25 |
О, со |
0,35 |
0,40 |
0.45 |
0,50 |
0,60 |
0,70 |
0,80 |
0,90 |
1.04 |
|
Ігоо |
0,Е0 |
0,85 |
0,80 |
0,75 |
0,70 |
0,65 |
0,63 |
0,60 |
0,58 |
0,56 |
0,54 |
0,52 |
0,50 |
0,48 |
0,46 |
0,44 |
0,42 |
0,40 |
0,38 |
0,35 |
0,32 |
0,30 |
0,29 |
0,28 |
|
1700 |
1,60 |
1,45 |
1,35 |
1,27 |
1,20 |
1 ,16 |
1,12 |
1,08 |
1,02 |
0,95 |
0,90 |
0,85 |
0,80 |
0,76 |
0,73 |
0,70 |
0,67 |
0,64 |
0,62 |
0,60 |
0,57 |
0,54 |
0,52 |
0,50 |
|
1800 |
2,70 |
2,40 |
2,25 |
2,10 |
2,00 |
1,90 |
1,85 |
1,80 |
1,70 |
1,60 |
1,53 |
1,46 |
1,40 |
1,30 |
1,25 |
1,20 |
1,15 |
1,10 |
1,05 |
1,00 |
0,95 |
0,90 |
0,86 |
0,83 |
|
1ВОО |
4,45 |
4,05 |
3,80 |
3,60 |
3,40 |
3,25 |
3,10 |
3,00 |
2,85 |
2,70 |
2,60 |
2,50 |
2,40 |
2,20 |
2,10 |
2,00 |
1,90 |
1,80 |
1,70 |
1,63 |
1,56 |
1,50 |
1,45 |
1,40 |
|
2000 |
6,30 |
5,75 |
5,35 |
5,05 |
4,80 |
4,60 |
4,45 |
4,30 |
4,00 |
3,80 |
3,55 |
3,50 |
3,40 |
3,15 |
2,95 |
2,80 |
2,65 |
2,57 |
2,50 |
2,40 |
2,30 |
2,20 |
2,10 |
2,00 |
|
2100 |
9,35 |
8,55 |
7,95 |
7,50 |
7,10 |
6,80 |
6,55 |
6,35 |
6,00 |
5,70 |
5,45 |
5,25 |
5,10 |
4,80 |
4,55 |
4,30 |
4,10 |
3,90 |
3,70 |
3,55 |
3,40 |
3,25 |
3,10 |
3,00 |
|
2200 |
13,4 |
12,3 |
11,5 |
10,8 |
10,3 |
9,90 |
9,60 |
9,30 |
8,80 |
8,35 |
7,95 |
7,65 |
7,40 |
6,90 |
6,50 |
6,25 |
5,90 |
5,65 |
5,40 |
5,10 |
4,90 |
4,70 |
4,55 |
4,40 |
|
2300 |
17,5 |
16,0 |
15,4 |
15,0 |
14,3 |
13,7 |
13,3 |
12,9 |
12,2 |
11,6 |
11,1 |
10,7 |
10,4 |
9,6 |
9,1 |
8,7 |
8,4 |
8,0 |
7,7 |
7,3 |
6,9 |
6,7 |
6,4 |
6,2 |
|
2400 |
24,4 |
22,5 |
21,0 |
20,0 |
19,1 |
18,4 |
17,7 |
17,2 |
16,3 |
15,6 |
15,0 |
14,4 |
13,9 |
13,0 |
12,2 |
11,7 |
11,2 |
10,8 |
10,4 |
9,9 |
9,4 |
9,0 |
8,7 |
8,4 |
|
2С00 |
30,9 |
28,5 |
26,8 |
25,6 |
24,5 |
23,5 |
22,7 |
22,1 |
20,9 |
20,0 |
19,3 |
18,6 |
18,0 |
10,8 |
15,9 |
15,2 |
14,6 |
14,1 |
13,7 |
12,9 |
12,3 |
11,7 |
11,3 |
11,0 |
|
2600 |
39,7 |
37,1 |
35,1 |
33,5 |
32,1 |
31,0 |
30,1 |
29,2 |
27,8 |
26,7 |
25,7 |
24,8 |
24,1 |
22,6 |
21,5 |
20,5 |
19,7 |
19,1 |
18,5 |
17,5 |
16,7 |
16,0 |
15,5 |
15,0 |
|
2700 |
47,3 |
44,7 |
42,6 |
40,7 |
39,2 |
37,9 |
36,9 |
35,9 |
34,2 |
33,0 |
31,8 |
30,8 |
29,9 |
28,2 |
26,8 |
25,7 |
24,8 |
24,0 |
23,3 |
22,1 |
21,1 |
20,3 |
19,6 |
19,0 |
|
28С0 |
57,6 |
54,5 |
52,2 |
50,3 |
48,7 |
47,3 |
46,1 |
45,0 |
43,2 |
41,6 |
40,4 |
39,3 |
38,3 |
36,2 |
34,6 |
33,3 |
32,2 |
31,1 |
30,2 |
28,8 |
27,6 |
26,6 |
25,8 |
25,0 |
|
2900 |
65,6 |
62,8 |
СО,5 |
58,6 |
56,9 |
55,5 |
54,3 |
53,2 |
51,3 |
49,7 |
48,3 |
47,1 |
46,0 |
43,7 |
41,9 |
40,5 |
39,2 |
38,1 |
37,1 |
35,4 |
34,1 |
32,9 |
31,9 |
31,0 |
|
3000 |
72,9 |
70,6 |
Г8,5 |
66,7 |
65,1 |
63,8 |
62,6 |
61,6 |
59,6 |
58,0 |
56,6 |
55,4 |
54,3 |
51,9 |
50,0 |
43,4 |
47,0 |
43,8 |
44,7 |
42,9 |
41,4 |
40,1 |
39,0 |
38,0 |
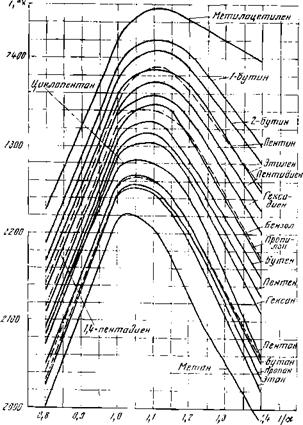
Рис. 14. Соотношение жаропроиз- нодительностп и теоретической тем-
Рис. 13. Соотношение теоретических и расчетных температур горения углеводородом
Теплота диссоциации Н20:
С = Кнг0’б<?нг = 4-0,36-580 = 370 ккал.
Суммарная теплота диссоциации:
?дисс = ?дисс + = 1090 + 370 = 1450 “ЙЛ-
Теоретическая температура горения:
— Сдисс 21800—14^0 ^ Г7- = 1970° С ^ 2240° К.
Теор УС 25,8-0,4 —
Для сопоставления на рис. 13 приведены значения теоретической температуры горения при атмосферном давлении различных углеводородов. Значение теоретической температуры горения (при а = 1) пропана равно около
2250° К.
Подсчитанная аналогичным образом по упрощенной методике теоретическая температура горения метана равна 1930° С, или — 2200° К.
Значение теоретической температуры горения метана по графику, приведенному на рис. 13, равно 2220° К. Теоретическая температура горения бензола, подсчитанная по формуле (IX. 8), равна 2060°С, или около 2330°К и мало отличается от температуры, приведенной на указанном графике (2340 К).
Таким образом, для определения теоретической температуры горения, развиваемой в условиях сжигания топлива в воздухе (до 2Ш0°С), можно пользоваться с достаточной для технических расчетов степенью точности простой методикой подсчета 16].
При £Шах порядка 2200еС /т(.ор £1П.1Т-0,93, а при <Г111к порядка 2100~С <гсо„ = /тах-0,94 [49].
Необходимо отмстить, что при сжигании топлива в кислороде или обогащенном кислородом воздухе при температурах значительно более высоких необходимо подсчитывать температуру горения с учетом образования сложной гаммы продуктов диссоциации. В этих случаях различие между теоретической температурой горения и жаропроизводительностью, подсчитываемой без учета диссоциации, очень велико, как это видно из графика (рис. 14).
Теоретическую температуру горения, подсчитанную при сжигании в абсолютно сухом воздухе, обозначают а при учете содержания в воздухе
1 «о влаги по массе /теч,.
Различие между Гт-. и 1се0р — около 30° trcol■, = t^:!^Q]i —30е
Комментирование и размещение ссылок запрещено.