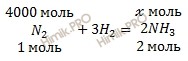❓ Что такое теория вероятностей?
Теория вероятностей использует случайные величины и распределения вероятностей для математической оценки неопределенных ситуаций. Понятие вероятности используется для присвоения числового описания вероятности наступления события. Вероятность можно определить как число благоприятных исходов, деленное на общее число возможных исходов события.
Определение теории вероятностей
Теория вероятностей – это область математики и статистики, которая занимается определением вероятностей, связанных со случайными событиями. Существует два основных подхода к изучению теории вероятностей: теоретический и экспериментальный. Теоретическая вероятность определяется на основе логических рассуждений без проведения экспериментов. В отличие от нее, экспериментальная вероятность определяется на основе исторических данных путем проведения повторных экспериментов.
Пример теории вероятностей
Предположим, нам необходимо определить вероятность выпадения числа 4 при бросании игральной кости. Число благоприятных исходов равно 1. Возможные исходы игральной кости – {1, 2, 3, 4, 5, 6}. Из этого следует, что всего существует 6 исходов. Таким образом, вероятность выпадения 4 при бросании игральной кости, используя теорию вероятности, можно вычислить как 1 / 6 ≈ 0,167.
🎲 Основы теории вероятностей
Мы можем понять эту область математики с помощью нескольких основных терминов, напрямую связанных с теорией вероятностей.
Случайный эксперимент
Случайный эксперимент в теории вероятностей – это испытание, которое повторяется несколько раз для получения четко определенного набора возможных результатов. Подбрасывание монеты является примером случайного эксперимента.
Пространство выборки
Пространство выборки можно определить как множество всех возможных исходов, полученных в результате проведения случайного эксперимента. Например, пространство выборки при подбрасывании симметричной монеты (fair coin), стороны которой – это орел и решка.
Событие
Теория вероятностей определяет событие как набор исходов эксперимента, который образует подмножество пространства выборки.
Примеры событий:
- Независимые – те, на которые не влияют другие события, являются независимыми.
- Зависимые – те, на которые влияют другие события.
- Взаимоисключающие – события, которые не могут произойти в одно и то же время.
- Равновероятные – два или более события, которые имеют одинаковые шансы произойти.
- Исчерпывающие – это события, которые равны выборочному пространству эксперимента.
Случайная величина
В теории вероятностей случайную переменную можно определить как величину, которая принимает значение при всех возможных исходах эксперимента.
Существует два типа случайных величин:
- Дискретная случайная величина – принимает точные значения, такие как 0, 1, 2…. Описывается кумулятивной функцией распределения и функцией массы вероятности.
- Непрерывная случайная величина – переменная, которая может принимать бесконечное число значений. Для определения характеристик этой переменной используются кумулятивная функция распределения и функция плотности вероятности.
Вероятность
Вероятность мы можем определить как численную вероятность наступления события. Вероятность того, что событие произойдет, всегда лежит между 0 и 1. Это связано с тем, что число желаемых исходов никогда не может превысить общее число исходов события. Теоретическая вероятность и эмпирическая вероятность используются в теории вероятностей для измерения шанса наступления события.
Условная вероятность
Ситуация, когда необходимо определить вероятность наступления события, притом что другое событие уже произошло.
Обозначается как P(A | B).
Если хочешь подтянуть свои знания по математике, загляни на наш курс «Математика для Data Science», на котором ты:
- Усвоишь специальную терминологию и сможешь читать статьи по Data Science без постоянных обращений к поисковику.
- Подготовишься к успешной сдачи вступительных экзаменов в Школу анализа данных Яндекс.
- Овладеешь математическим аппаратом, который необходим, чтобы стать специалистом в Data Science.
Ожидание
Ожидание случайной величины X можно определить как среднее значение результатов эксперимента, проводимого многократно. Ожидание обозначается как E[X]. Также известно как среднее значение случайной величины.
Дисперсия
Дисперсия – это мера, которая показывает, как распределение случайной величины изменяется относительно среднего значения. Дисперсия определяется как среднее квадратичное отклонение от среднего значения случайной величины. Обозначается как Var[X].
Функция распределения теории вероятностей
Распределение вероятностей или кумулятивная функция распределения – это функция, которая моделирует все возможные значения эксперимента, используя случайную переменную. Распределение Бернулли и биномиальное распределение – это примеры дискретных распределений вероятностей. Например, нормальное распределение представляет собой пример непрерывного распределения.
Массовая функция вероятности
Массовая функция вероятности определяется как вероятность того, что дискретная случайная величина будет в точности равна определенному значению.
Функция плотности вероятности
Функция плотности вероятности – это вероятность того, что непрерывная случайная величина принимает множество возможных значений.
Формулы теории вероятностей
В теории вероятностей существует множество формул, которые помогают рассчитать различные вероятности, связанные с событиями.
Наиболее важные формулы:
- Теоретическая вероятность: Число благоприятных исходов / Число возможных исходов.
- Эмпирическая вероятность: Число случаев, когда событие происходит / Общее число испытаний.
- Правило сложения: P(A ∪ B) = P(A) + P(B) – P(A∩B), где A и B – события.
- Правило комплементарности: P(A’) = 1 – P(A). P(A’) означает вероятность того, что событие не произойдет.
- Независимые события: P(A∩B) = P(A) ⋅ P(B).
- Условная вероятность: P(A | B) = P(A∩B) / P(B).
- Теорема Байеса: P(A | B) = P(B | A) ⋅ P(A) / P(B).
- Массовая функция вероятности: f(x) = P(X = x).
- Функция плотности вероятности: p(x) = p(x) = dF(x) / dx, где F(x) – кумулятивная функция распределения.
- Ожидание непрерывной случайной величины: ∫xf(x)dx, где f(x) является МФВ (Массовой функцией вероятности).
- Ожидание дискретной случайной величины: ∑xp(x), где p(x) – это ФПВ (Функцией плотности вероятности).
- Дисперсия: Var(X) = E[X2] – (E[X])2.
Применение теории вероятностей
Теория вероятностей используется во многих областях и помогает оценить риски, которые связаны с теми или иными решениями. Некоторые из направлений, где применяют теорию вероятностей:
- В финансовой отрасли теория вероятностей используется для создания математических моделей фондового рынка с целью прогнозирования будущих тенденций. Это помогает инвесторам вкладывать средства в наименее рискованные активы, которые дают наилучший доход.
- В потребительской индустрии теория вероятностей используется для снижения вероятности неудачи при разработке продукта.
- Казино использует теорию вероятностей для разработки азартных игр с максимизацией своей прибыли.
🏋️ Практические задания
Задача 1: При бросании двух игральных костей, какова вероятность того, что выпадет комбинация, сумма которой будет равна 8?
При бросании двух игральных костей существует 36 возможных исходов. Для получения суммы, равной 8, существует 5 благоприятных исходов: [(2, 6), (6, 2), (3, 5), (5, 3), (4, 4)]. Используя формулы теории вероятностей: Вероятность = Число благоприятных исходов / общее число возможных исходов = 5 / 36. Ответ: Вероятность получения суммы 8 при бросании двух игральных костей равна 5 / 36.
Задача 2: Какова вероятность вытащить карту королеву из колоды?
Колода карт имеет 4 масти. Каждая масть состоит из 13 карт. Таким образом, общее число возможных исходов = (4) * (13) = 52. Может быть, 4 королевы, по одной из каждой масти. Следовательно, количество благоприятных исходов = 4. Карточная вероятность = 4 / 52 = 1 / 13. Ответ: Вероятность получить королеву из колоды карт равна 1 / 13
Задача 3: Из 10 человек 3 купили карандаши, 5 купили тетради, а 2 купили и карандаши, и тетради. Если покупатель купил тетрадь, какова вероятность того, что он также купил карандаш?
Используя понятие условной вероятности, P(A | B) = P(A∩B) / P(B). Пусть A – событие, когда люди покупают карандаши, а B – событие, когда люди покупают тетради. P(A) = 3 / 10 = 0,3P(B) = 5 / 10 = 0,5P(A∩B) = 2 / 10 = 0,2. Подставим полученные значения в приведенную формулу, P(A | B) = 0,2 / 0,5 = 0,4. Ответ: Вероятность того, что покупатель купил карандаш, при условии, что он купил блокнот, равна 0,4.
В заключение
Подведем итоги:
- Теория вероятностей – это раздел математики, в котором рассматриваются вероятности случайных событий.
- Понятие вероятности объясняет возможность наступления того или иного события.
- Значение вероятности всегда лежит между 0 и 1.
- В теории вероятностей все возможные исходы случайного эксперимента составляют пространство выборки.
- Теория вероятностей использует такие важные понятия, как случайные величины и кумулятивные функции распределения для моделирования случайного события. Сюда же относится определение различных вероятностей, связанных с этим.
Если хочешь подтянуть свои знания по математике, загляни на наш курс «Математика для Data Science», который включает в себя:
- 47 видеолекций и 150 практических заданий.
- Консультации с преподавателями курса.
Выход от теоретически возможного
Сколько литров аммиака (NH3) образуется при взаимодействии 112 килограмм азота (N2) с водородом (H2)? Выход от теоретически возможного 80% (нормальные условия).
Решение задачи
Запишем уравнение реакции образования аммиака (NH3):
Напомню, что под выходом от теоретически возможного продукта реакции понимают отношение массы (объема, числа молей) практически полученного вещества к массе (объему, числу молей), теоретически рассчитанной по уравнению реакции.
Выход от теоретически возможного. Учитывая, что молярная масса азота (N2) равна 28 г/моль (смотри таблицу Менделеева), найдем химическое количество азота (N2) по формуле, устанавливающей связь между химическим количеством вещества и массой:
Получаем:
n (N2) = 112000 /28 = 4000 (моль) = 4 (кмоль).
По уравнению реакции найдем химическое количество аммиака (NH3) (теоретическое химическое количество вещества), которое выделяется в ходе реакции образования аммиака (NH3):
из 1 моль N2 образуется 2 моль NH3
из 4000 моль N2 образуется х моль NH3
Откуда:
Выход от теоретически возможного.
По формуле, устанавливающей связь между химическим количеством вещества и объемом, вычислим объем аммиака (NH3), который образуется в ходе реакции:
Получаем:
V теор.( NH3) = 8000 ∙ 22,4 = 179200 (л).
Вычислим объем аммиака (NH3) практический (выход от теоретически возможного) по формуле:
Выход от теоретически возможного.
Получаем:
V практ. (NH3) = 80 ⋅ 179200 / 100 = 143360 (л) = 143,36 (м3).
Ответ:
объем аммиака (NH3) равен 143,36 м3.
Задачи на выход продукта химической реакции. Как решать задачи на выход продукта реакции. Что такое выход продукта химической реакции. Теоретическое и практическое количество продукта химической реакции.
При решении задач на расчеты по уравнениям химических реакций мы принимаем, что в ходе реакции образуется точно рассчитанное количество продукта, исходя из мольного соотношения реагентов и продуктов. Количество продукта реакции, которое должно получится из реагентов согласно стехиометрическим расчетам — это теоретическое количество (масса, объем) или теоретический выход продукта реакции nтеор.
Однако на практике это соотношение не выполняется, и в большинстве случаев образуется меньшее количество продукта реакции, чем было рассчитано — практическое количество (масса, объем) или практический выход продукта реакции nпр.
Практический и теоретический выход не совпадают в силу разных причин — неэффективные соударения реагирующих частиц, побочные процессы, потери в ходе проведения реакции и т.д.
Обратите внимание! Понятия теоретического или практического количества реагента не существует. Ведь мы всегда берем определенное количество реагентов. А вот вступать в реакцию не полностью реагенты могут.
Массовая (мольная, объемная) доля выхода продукта реакции η или ω — это соотношение массы (количества вещества, объема) продукта, которая практически получена в ходе реакции, mпр., к массе (количеству, объему) продукта, которая рассчитана теоретически, mтеор.:
η = mпр./mтеор.
Массовую (мольную, объемную) долю выхода продукта реакции можно выражать в долях, а можно в процентах:
η = mпр./mтеор.·100%
Рассмотрим несколько задач на определение и использование выхода продукта реакции.
1. Какое количество вещества аммиака получится при действии избытка раствора гидроксида натрия на 500 г сульфата аммония, если выход в данной реакции 70%?
Решение.
2NaOH + (NH4)2SO4 = Na2SO4 + 2NH3 + 2H2O
Количество вещества сульфата аммония:
n((NH4)2SO4) = m/M = 500/132 = 3,79 моль
Теоретическое количество аммиака:
nтеор.(NH3) = 2·n((NH4)2SO4) = 2·3,79 = 7,58 моль
Зная мольную долю выхода продукта реакции, определим практический выход аммиака:
nпр.(NH3) = η·nтеор.(NH3) = 0,7·7,58 = 5,3 моль
Ответ: nпр.(NH3) = 5,3 моль
2. При хлорировании метана объемом 112 л (н. у.) получен дихлорметан массой 255 г. Определите долю выхода дихлорметана.
Решение.
CH4 + 2Cl2 = CH2Cl2 + 2HCl
Количество вещества метана:
n(CH4) = V/Vm = 112/22,4 = 5 моль
Теоретическое количество дихлорметана:
nтеор.(CH2Cl2) = n(CH4) = 5 моль
mтеор.(CH2Cl2) = M·nтеор.(CH2Cl2) = 85 г/моль·5 моль = 425 г
Масса дихлорметана, которая приведена в условии задачи — это практический выход дихлорметана.
Доля выхода дихлорметана:
η = mпр./mтеор. = 255/425 = 0,6 или 60%
Ответ: выход продукта реакции 60%
3. Определите массу оксида меди (II), которая потребуется для получения 500 г нитрата меди, если доля выхода в реакции взаимодействия оксида меди с HNO3 составляет 92%?
4. Определите объем (н.у., л) аммиака, который получится при действии избытка раствора гидроксида натрия на 48 г карбоната аммония, если выход в реакции составляет 70%?
5. Определите массу соли, г, которая образуется при растворении в избытке азотной кислоты 80 г оксида меди (II), если выход в реакции составляет 80%?
6. При термическом разложении 1700 г нитрата натрия было получено 174,4 л кислорода (н.у.). Определите массовую долю выхода в этой реакции.
7. Рассчитайте массу оксида магния, которая образуется при разложении гидроксида магния массой 50 г, если реакция разложений прошла с выходом 95,5%.
8. Какая масса бензола (кг) может получиться из 369,6 м3 (н.у.) ацетилена, если доля выхода бензола составила 65% от теоретически возможного?
9. Определите массу спирта, полученного при гидратации 40 л пропилена (н.у.), если доля выхода продукта реакции составляет 65% от теоретически возможного.
10. Определите долю выхода в реакции каталитического окисления аммиака кислородом, если при окислении 10 моль аммиака образуется 200 л оксида азота (II) при н.у.?
11. Пары брома объемом 20 л смешали с избытком водорода, в результате из смеси выделили 32 л бромоводорода. Определите долю выхода, %, если объемы газов измерялись при одинаковых условиях.
12. Оксид кальция массой 0,64 кг нагрели до 1200° С с достаточной массой оксида кремния (IV). Масса образовавшегося силиката кальция оказалась равной 1,024 кг. Определите выход (%) реакции соединения.
13. Из 36 г метанола было получено 24 г диметилового эфира. Рассчитайте выход реакции дегидратации
14. Углекислый газ объемом 6 л (н.у.) пропустили над раскалённым углем, продукт реакции пропустили через избыток известковой воды, после чего собрали 7,2 л (н.у.) газа. Определите степень превращения углекислого газа, %.
15. Определите массу, г нитрата аммония, которая содержалась в растворе, если при действии на этот раствор избытка гидроксида кальция выделилось 6 г аммиака. Реакция прошла с выходом 88,2 %.
16. При термическом разложении не загрязненного примесями карбоната кальция образовалось 20 г оксида кальция. Известно, что реакция прошла с выходом 85%. Вычислите массу карбоната кальция, взятого для проведения реакции разложений и объем (н.у.) образовавшегося углекислого газа.
17. Какой объем пропана (н.у.) потребуется для получения 42 г пропена, если доля выхода продуктов реакции составляет 60% от теоретически возможного?
18. При бромировании пентена-2 массой 8,4 г получен 2,3-дибромпентан массой 24,3 г. Определите долю выхода продукта реакции.
19. Из 69 г этанола получен бутадиен-1,3 массой 36,85 г. Определите массовую долю выхода продукта реакции.
20. При бромировании 5,4 г дивинила избытком брома образуется 28,2 г 1,2,3,4-тетрабромбутана. Определите выход продукта реакции.
21. Определите, какая масса 2-метилбутана необходима для получения 46,24 г изопрена, если доля выхода продукта реакции составляет 85%?
22. Определите объем метана, который потребуется для получения 63 л ацетилена (н.у.), если доля выхода продуктов реакции составляет 70% от теоретически возможного.
23. Определите, какую массу уксусного альдегида можно получить по реакции Кучерова из 11,2 л ацетилена (н. у.), если доля выхода продуктов реакции составляет 80% от теоретически возможного?
24. При действии избытка воды на 48 г технического карбида кальция, содержащего 10% примесей, образовался ацетилен объемом 10,08 л (н.у.). Определите долю выхода продукта реакции.
25. Определите массу технического карбида алюминия, содержащего 7% примесей, необходимого для получения 56 л метана (н.у.), если доля выхода продуктов реакции составляет 70% от теоретически возможного.
26. Из 179,2 л бутана (н.у.) с объемной долей примесей 25% двухстадийным синтезом получен бутанол-2 массой 159,84 г. Доли выхода продуктов на первой и второй стадиях одинаковы. Определите доли выхода продуктов реакций.
27. Циклогексан массой 16 г сожгли в избытке кислорода и полученный углекислый газ пропустили через избыток раствора гидроксида кальция, в результате чего выпал осадок массой 90 г. Определите массовую долю негорючих примесей в циклогексане, если доля выхода продуктов горения составляет 90% от теоретически возможного.
28. При нитровании 46,8 г бензола получен нитробензол массой 66,42 г. Определите выход продуктов реакции.
Тема урока: Решение задач на определение выхода продукта реакции.
Алгоритм решения задач.
Составьте краткое условие задачи.
Составьте уравнение реакции, расставьте коэффициенты.
Подпишите над формулами веществ известные величины( массу или объем), неизвестную обозначьте как х.
Найдите неизвестную величину(массу или объем), используя метод пропорции- это будет теоретическая mилиv.
Определите практический выход продукта реакции по формуле
η = mпракт. / m теор. или
φ = Vпракт./ Vтеор.
Запишите ответ.
Расчёт выхода продукта реакции по отношению к теоретически возможному.
Помните:первым действием в решении задачи является определение массы (объема, количествавещества) продукта реакции по уравнению и исходным данным.
|
Порядок действий (пошаговый): |
Пример: Определите выход продукта реакции синтеза аммиака, если при взаимодействии 6,72 л азота с избытком водорода получено 6,72 л аммиака. |
|
I.Запишите краткое условие задачи и уравнение химической реакции, подчеркните вещества, о которых идет речь в задаче. Переведите массу (объем) известного исходного вещества (реагента) в количество (моли): n = m : M (n = V : Vm) |
Д а н о : Решение: V(N2) = 6.72 л N2 + 3 H2 = 2 NH3 Vпракт.(NH3)=6.72 л 1 моль 2 моль φ (NH3) = ? n (N2) = 6.72 л : 22.4 л/моль = 0,3 моль |
|
II.Определите количество продукта по уравнению реакции. Т.е. теоретически возможное (если бы выход реакции составлял бы 100%) . |
По уравнению: 1 моль (N2) → 2 моль (NH3) Следовательно: 0,3 моль (N2) → 0,6 моль(NH3) nтеорет. (NH3) = 0.6 моль (или 13,44 л) |
|
III.Определите, какую часть от теоретически возможного составляет практически полученная по условию масса (объем, количество) продукта. Воспользуйтесь формулой: η = mпракт. / mтеор. или φ = Vпракт./Vтеор. Запишите ответ. |
Обратите внимание: Vпракт./Vтеор = nпракт. / nтеорет. = φ nпракт.(NH3) = 6.72 л : 22.4 л/моль = 0,3 моль φ (NH3) = 0,3моль (6,72 л) : 0,6моль (13,44л) = 0,5 (50%) Ответ:φ (NH3) = 50%. |
Решите задачи:
При взаимодействии 15 г. алюминия с серой образовалось 35 г. сульфида алюминия AL2 S 3 .Сколько это составляет процентов от теоретически возможного?
Сколько л водорода выделится при действии избытка соляной кислоты HCLна 2,7 г. алюминия, если выход водорода составляет 90% от теоретического?
При взаимодействии 60 г. железа с хлором образовалось 75 г. хлорида железа ( III ) . Сколько это составляет % от теоретически возможного?
ОпределитVводорода,который может быть получен при взаимодействии с водой 5 г. кальция ,если выход водорода составляет 90 % от теоретически возможного .
При взаимодействии 5,4 г. алюминия с соляной кислотой было получено 6,384 л водорода. Сколько это составляет % теоретически возможного ?
Выход водорода в реакции взаимодействия натрия с водой составляет 95 %. Сколько л водорода получается при растворении в воде 2.3 г. Na ?
При обработке 35,1 г. хлорида натрия Na CL избытком концентрированной серной кислоты выделилось 10,08 л хлороводорода HCL.Найдите выход HCLв данной реакции. (ответ- 75 %).
Адрес публикации: https://www.prodlenka.org/metodicheskie-razrabotki/41207-algoritm-reshenija-zadach-po-himii-na-vyhod-p
Слайд 1
РЕШЕНИЕ РАСЧЕТНЫХ ЗАДАЧ ПО ХИМИИ НА ВЫХОД ПРОДУКТА ОТ ТЕОРЕТИЧЕСКИ ВОЗМОЖНОГО Кокорина С.Е., учитель химии МБОУ СОШ №10 Г. Североморск Мурманской области 9 класс
Слайд 2
Массовая доля выхода продукта реакции ( η — « этта ») — это отношение массы полученного вещества к массе, которая должна была бы получиться в соответствии с расчетом по уравнению реакции η вых = m практическая m теоретическая
Слайд 3
Объемная доля выхода продукта реакции ( φ — «фи») — это отношение массы полученного вещества к массе, которая должна была бы получиться в соответствии с расчетом по уравнению реакции φ вых = V практический m теоретический
Слайд 4
Многие химические реакции не доходят до конца. При взаимодействии органических веществ часто образуются побочные продукты. При гетерогенных реакциях часть веществ просто не вступает в реакции. Немаловажное значение имеет оборудование, с помощью которого осуществляется химическая реакция. Негерметичность соединений приборов всегда приводит к потерям газообразных веществ. ПОЧЕМУ? … в реальных химических реакциях масса продукта всегда оказывается меньше расчетной
Слайд 5
Три типа задач с понятием «Выход продукта» 1. Даны массы(объемы) исходного вещества и продукта реакции. Определить выход продукта реакции. 2. Даны масса(объем) исходного вещества и выход продукта реакции. Определить массу продукта. 3. Даны масса (объем) продукта и выход продукта. Определить массу исходного вещества.
Слайд 6
1 ) Прочитай внимательно условие задачи 2) Запиши: «Дано» и «Найти». 3) Составь уравнение реакции (не забудь расставить коэффициенты). 4) Вычисли массу теоретическую продукта реакции, по уравнению реакции. 5) Вычисли массовую долю продукта реакции по отношению массы практической к массе теоретической, которая указана в «дано». Алгоритм решения задач первого типа (найдите «выход продукта реакции»)
Слайд 7
При действии алюминия на оксид цинка массой 32,4г получили 24 г цинка. Найдите массовую долю выхода продукта реакции. Дано: Решение: m( ZnO ) = 32,4 г m пр ( Zn) = 24 г Найти: η вых ( Zn) — ? 1. Внимательно прочитай условие задачи 2. Составьте «Дано» и «Найти»
Слайд 8
Дано: m( ZnO ) = 32,4 г m пр ( Zn) = 24 г Найти: η вых ( Zn) — ? Решение: 3. Составьте уравнение реакции, расставьте коэффициенты 3 ZnO + 2Al = 3Zn + Al 2 O 3
Слайд 9
Дано: Решение: m ( ZnO ) = 32,4 г 32,4 г ? m пр ( Zn) = 24 г 3ZnO +2 Al =3 Zn + Al 2 O 3 3 моль 3 моль Найти: η вых ( Zn) — ? По уравнению: m теор . (Zn) = n . M = 0 ,4 моль . 65г/моль = 26 г n (Zn) = n ( ZnO ) = = = 0,4 моль m (ZnO) M (ZnO) 32, 4 г 81 г/моль 4. Вычисли массу теоретическую продукта реакции
Слайд 10
Дано: Решение: m ( ZnO ) = 32,4 г 32,4 г ? m пр ( Zn) = 24 г 3ZnO +2 Al =3 Zn + Al 2 O 3 3 моль 3 моль Найти: η вых ( Zn) — ? По уравнению: m теор . (Zn) = nM = 0 ,4 моль ∙ 65г/моль = 26 г 5. Вычисли массовую долю продукта реакции по известной формуле n (Zn) = n ( ZnO ) = = = 0,4 моль m ( ZnO ) M ( ZnO ) 32, 4 г 81 г/моль η вых = = = 0, 92 (92%) m пр ( Zn) m теор ( Zn) 24 г 26 г Ответ: 92%
Слайд 11
1) Прочитай внимательно условие задачи 2) Запиши: «Дано» и «Найти». 3) Составь уравнение реакции (не забудь расставить коэффициенты). 4) Вычисли массу теоретическую продукта реакции, по уравнению реакции. 5) Вычисли массу практическую продукта реакции, воспользовавшись обратной формулой (умножь массу теоретическую на долю выхода) Алгоритм решения задач второго типа ( найдите «массу продукта реакции») (практическую)
Слайд 12
Определите массу оксида алюминия, которая может быть получена из 23,4 г гидроксида алюминия, если выход реакции составляет 92% от теоретически возможного. Дано: Решение: m (Al(OH) 3 )= 23,4 г η вых (Al 2 O 3 ) = 92% Найти: m пр ( Al 2 O 3 ) — ? 1. Внимательно прочитай условие задачи 2. Составьте «Дано» и «Найти»
Слайд 13
3) Составь уравнение реакции (не забудь расставить коэффициенты). Дано: Решение: m (Al(OH) 3 )= 23,4 г η вых (Al 2 O 3 ) = 92% Найти: m пр ( Al 2 O 3 ) — ? 2Al(OH) 3 = Al 2 O 3 +3H 2 O
Слайд 14
4. Вычисли массу теоретическую продукта реакции Дано: m (Al(OH) 3 )= 23,4 г η вых (Al 2 O 3 ) = 92% Найти: m пр ( Al 2 O 3 ) — ? Решение: 2Al(OH) 3 = Al 2 O 3 +3H 2 O 23,4 г ? 2 моль 1 моль По уравнению: n(Al 2 O 3 ) = ½ n(Al(OH) 3 = ½ = m (Al(OH) 3 ) M (Al(OH) 3 ) 23,4 г 78 г /моль = 0 ,15 моль m теор. ( Al 2 O 3 ) = n M = 0,15 моль ∙ 102 г/моль = 15,3 г
Слайд 15
5) Вычисли массу практическую продукта реакции, воспользовавшись обратной формулой (умножь массу теоретическую на долю выхода) Дано: m (Al(OH) 3 )= 23,4 г η вых (Al 2 O 3 ) = 92% Найти: m пр ( Al 2 O 3 ) — ? Решение: 2Al(OH) 3 = Al 2 O 3 +3H 2 O 23,4 г ? 2 моль 1 моль По уравнению: n(Al 2 O 3 ) = ½ n(Al(OH) 3 = ½ = m (Al(OH) 3 ) M (Al(OH) 3 ) 23,4 г 78 г /моль = 0 ,15 моль m теор . ( Al 2 O 3 ) = n∙M = 0 ,15 моль ∙ 102 г/моль = 15,3 г m пр. (Al 2 O 3 ) = 15,3 г ∙ 0,92 = 14 г Ответ: 14 г
Слайд 16
Алгоритм решения задач третьего типа ( Определить массу исходного вещества ) Прочитай внимательно условие задачи. 2) Запиши: «Дано» и «Найти». 3) Составь уравнение реакции (не забудь расставить коэффициенты). 4) Вычисли массу теоретическую продукта реакции, по обратной формуле ( m пр / η вых ) . 5) Вычисли массу исходного вещества по уравнению реакции.
Слайд 17
1. Внимательно прочитай условие задачи При действии оксида углерода (II ) на оксид железа (III ) получено железо массой 11,2 г. Найдите массу использованного оксида железа ( III ), учитывая, что доля выхода продуктов реакции составляет 80% от теоретически возможного. 2. Составьте «Дано» и «Найти» Дано: m пр ( Fe) = 11 , 2 г η вых ( Fe) = 80% Найти: m ( Fe 2 O 3 ) — ? Решение:
Слайд 18
3) Составь уравнение реакции (не забудь расставить коэффициенты). Дано: m пр ( Fe) = 11 , 2 г η вых ( Fe) = 80% Найти: m ( Fe 2 O 3 ) — ? Решение : Fe 2 O 3 + 3CO = 2Fe + 3CO 2
Слайд 19
4) Вычисли массу теоретическую продукта реакции, по обратной формуле ( m пр / η вых ) . Дано: m пр ( Fe) = 11 , 2 г η вых ( Fe) = 80% Найти: m ( Fe 2 O 3 ) — ? Решение : Fe 2 O 3 + 3CO = 2Fe + 3CO 2 m теор = = =14 г m пр ( Fe) η вых ( Fe) 11,2 г 0, 8
Слайд 20
5) Вычисли массу исходного вещества по уравнению реакции. Дано: m пр ( Fe) = 11 , 2 г η вых ( Fe) = 80% Найти: m ( Fe 2 O 3 ) — ? Решение : Fe 2 O 3 + 3CO = 2Fe + 3CO 2 m теор = = =14 г m пр ( Fe) η вых ( Fe) 11,2 г 0, 8 По уравнению: n(Fe 2 O 3 ) = ½ n ( Fe) = ½ = ½ = 0,125 моль M (Fe) m (Fe) 14 г 56 г/моль m(Fe 2 O 3 ) = n M = 0 ,125 моль ∙ 160 г/моль = 20 г Ответ: 20 г.
Слайд 21
Задачи для самостоятельного решения: При взаимодействии 37 г гидроксида кальция с сульфатом аммония было получено 15 г аммиака. Вычислите массовую долю выхода аммиака. 2. Вычислите объем аммиака ( н.у .), который можно получить, нагревая 20 г хлорида аммония с гидроксидом кальция, если объемная доля выхода аммиака составляет 98%. 3. При разложении хлорида аммония был получен аммиак объемом 38 л (н. у.). Вычислите массу взятого для реакции хлорида аммония, если объемная доля выхода аммиака составила 85 %.