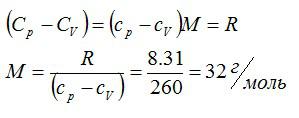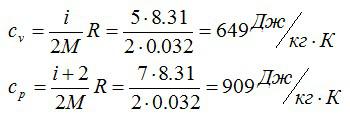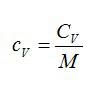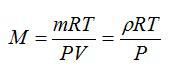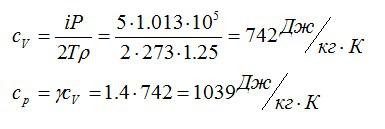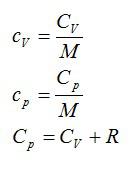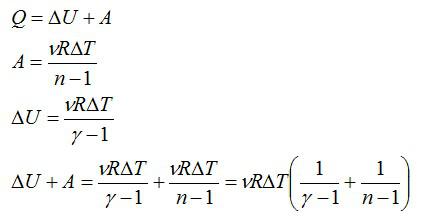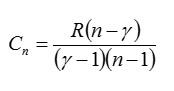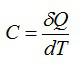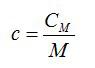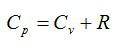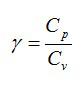Теплоемкостью
называют количество
теплоты, которое необходимо сообщить
телу (газу), чтобы повысить температуру
какой-либо количественной единицы на
1° С.
За
единицу количества энергии в системе
СИ применяют джоуль (Дж). В системе
СИ джоуль является универсальной
единицей, применяемой для измерения
всех видов энергии: тепловой, механической,
лучистой и пр. В качестве тепловой
единицы 1 Дж представляет собой такое
ее количество, которое появляется в
результате превращения механической
работы 1 Дж в теплоту. В качестве единицы
механической энергии джоуль представляет
собой работу, совершаемую силой, равной
1 ньютону при перемещении ею тела на
расстояние 1 м в направлении действия
силы (1 Дж = Н-м = 1 кг •м2/с2).
В
зависимости от выбранной количественной
единицы вещества различают мольную
теплоемкость μ
c
— кДж/(кмоль•К),
массовую теплоемкость с
— кДж/(кг•К)
и объемную теплоемкость с’
— кДж/(м3•К).
Как
было указано выше, 1 м3
газа в зависимости от параметров его
состояния имеет разные массы. В связи
с этим объемную теплоемкость всегда
относят к массе газа, заключенной в 1 м3
его при нормальных условиях (рн
= 101
325 Па (760 мм рт. ст.) и Т
н =
273 К (t
н = 0°С).
Для определения
значений перечисленных выше теплоемкостей
достаточно знать величину одной
какой-либо из них. Удобнее всего иметь
величину мольной теплоемкости. Тогда
массовая теплоемкость
с=μ
c
/ μ ,
(1)
а объемная
теплоемкость
с/
= μ c
/ 22,4
(2)
Объемная и массовая
теплоемкости связаны между собой
зависимостью
с/
= с ·ρн
где
рн
— плотность газа при нормальных условиях.
Теплоемкость
газа зависит от его температуры. По
этому признаку различают среднюю
и истинную теплоемкость.
Если
q
— количество теплоты,
сообщаемой единице количества газа
(или отнимаемого от него) при изменении
температуры газа от t1
до t2
(или, что то же, от T1
до Т2),
то
cm
=
(3)
представляет
собой среднюю
теплоемкость в пределах
t1
— t2
. Предел
этого отношения, когда разность
температур стремится к нулю, называют
истинной теплоемкостью.
Аналитически последняя
определяется как с=
Теплоемкость
идеальных газов зависит не только от
их температуры, но и от их атомности и
характера процесса. Теплоемкость
реальных газов зависит от их природных
свойств, характера процесса, температуры
и давления.
Для газов особо
важное значение имеют следующие два
случая нагревания (охлаждения):
1) изменение
состояния при постоянном объеме;
2)
изменение состояния при постоянном
давлении.
Обоим этим
случаям соответствуют различные
значения теплоемкостей.
Таким образом,
различают истинную и среднюю теплоемкости:
а)
мольную — при постоянном объеме (μсv
и μcvm)
и постоянном давлении
(μcp
и μсрт);
б)
массовую — при постоянном объеме (сv
и cvm)
и постоянном давлении
(сp
и срт);
в)
объемную—при постоянном объеме
(c‘v
и c‘vm)
и постоянном давлении
(с’р
и с’рт).
Между
мольными теплоемкостями при постоянном
давлении и постоянном объеме существует
следующая зависимость (уравнение
Майера):
μcp—
μcv
= μR
8,314 кДж/(кмоль•К).
(4)
Для
приближенных расчетов при невысоких
температурах можно принимать следующие
значения мольных теплоемкостей (табл.
5.1).
Таблица
5.1- Приближенные
значения мольных теплоемкостей при
постоянном объеме и постоянном давлении
(с= cоnst)
|
Газы |
Теплоемкость |
|
|
μсv |
μcp |
|
|
Одноатомные……… |
12,56 |
20,93 |
|
Двухатомные |
20,93 |
29,31 |
|
Трех- и многоатомные |
29,31 |
37,68 |
В
технической термодинамике большое
значение имеет отношение теплоемкостей
при постоянном давлении и постоянном
объеме, обозначаемое буквой k:
k
=
Если принять
теплоемкость величиной постоянной, то
на основании данных таблицы 5.1 получаем:
для одноатомных газов k=1,67;
для двухатомных газов k=1,4;
для трех- и многоатомных газов k=1,29.
Теплоемкость
газов изменяется с изменением температуры,
причем эта зависимость имеет криволинейный
характер.
Количество
теплоты, которое необходимо затратить
в процессе нагревания 1 кг газа в интервале
температур от t1
до
t2
,
q=
(cm)
(t2
-t1)
= cm2
t2
— cm1t1,
(5)
где cm2
и
cm1
–
соответственно средние теплоемкости
в пределах 0°-
t1
и
0°-
t2.
В
таблицах приводятся интерполяционные
формулы для истинных и средних мольных
теплоемкостей при постоянном давлении,
а также для средних массовых объемных
теплоемкостей при постоянном объеме.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
72,6% бесплатных материалов
967 руб. средняя цена курсовой работы
352 руб. средняя цена домашнего задания
119 руб. средняя цена решённой задачи
161 руб. средняя цена лабораторной работы
174 руб. средняя цена реферата
178 руб. средняя цена доклада
1624 руб. средняя цена ВКР
665 руб. средняя цена диссертации
596 руб. средняя цена НИР
358 руб. средняя цена отчёта по практике
276 руб. средняя цена ответов (шпаргалок)
202 руб. средняя цена лекций
224 руб. средняя цена семинаров
280 руб. средняя цена рабочей тетради
188 руб. средняя цена презентации
67 руб. средняя цена перевода
143 руб. средняя цена изложения
150 руб. средняя цена сочинения
308 руб. средняя цена статьи
Гарантия возврата средств
Решение задач дело полезное, но не всегда интересное. Чтобы вы справлялись с решением задач по теме «Теплоемкость идеального газа» быстрее, приведем здесь несколько примеров и вопросов с объяснениями.
Подписывайтесь на наш телеграм-канал, чтобы получать полезную и интересную рассылку.
Задачи по теме «Теплоемкость идеального газа» с решениями
Повторение и практика – залог успеха в любом деле. И решение задач не исключение. Поэтому не забываем держать под рукой памятку по задачам и полезные формулы
Задача №1. Определить удельную теплоемкость идеального газа
Условие
Определить молярную массу M двухатомного газа и его удельные теплоемкости, если известно, что разность cр — cv удельных теплоемкостей этого газа равна 260 Дж/(кг*К)
Решение
По определению:
Значит, газ из задачи – кислород. Если кто не понял, как это определяется, учитесь пользоваться таблицей Менделеева.
Считаем удельные теплоемкости:
Ответ: 32 г/моль; 649 Дж/кг*К; 909 Дж/кг*К.
Задача №2. Удельная теплоемкость
Условие
Плотность некоторого газа при нормальных условиях ρ = 1,25 кг/м3. Отношение удельных теплоемкостей γ = 1,4. Определить удельные теплоемкости cv и сp этого газа.
Решение
Исходя из отношения удельных теплоемкостей, можно сделать вывод, что газ – двухатомный, i=5. При постоянном объеме удельная теплоемкость равна:
Молярную массу можно найти из уравнения Клапейрона-Менделеева:
Отсюда:
Ответ: 742 Дж/кг*К; 1039 Дж/кг*К.
Задача №3. Молярная теплоемкость
Условие
Вычислить молярные теплоемкости газа, зная, что его молярная масса М = 4∙10 3 кг/моль и отношение удельных теплоемкостей ср/сv = 1,67.
Решение
Удельные теплоемкости равны:
Можно найти:
Ответ: 12,4 Дж/моль*К; 20,71 Дж/моль*К
Задача №4. Теплоемкость при изопроцессах
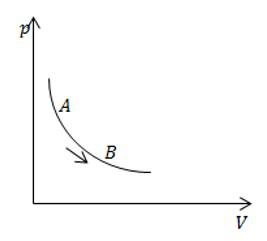
Условие
На рисунке изображен изотермический процесс с газом постоянной массы. Сравните теплоемкость в процессе АВ с теплоемкостью этой же массы газа в изохорном процессе.
Решение
Теплоемкость при изохорном процессе является постоянной величиной. При изотермическом процесса она равна бесконечности. Значит, теплоемкость в процессе АВ больше.
Ответ: Теплоемкость в процессе АВ больше.
Задача №5. Теплоемкость при политропическом процессе
Условие
Найдите молярную теплоемкость идеального газа при политропическом процессе pVn = const, если показатель адиабаты газа равен γ. При каких значениях показателя политропы n теплоемкость газа будет отрицательной?
Решение
Запишем первое начало термодинамики, выражения для работы и изменения внутренней энергии в политропическом процессе соответственно:
Если количество вещества и изменение температуры принять равными единице, это выражение будет равно молярной теплоемкости (по определению теплоемкости):
Ответ: см. выражение выше.
Вопросы по теме «Теплоемкость идеального газа»
Вопрос 1. Что такое теплоемкость идеального газа?
Ответ. Когда газу сообщается определенное количество теплоты, меняется его температура.
Отношение количества теплоты, сообщенного газу, к изменению его температуры, называется теплоемкостью идеального газа.
Вопрос 2. Что такое молярная и удельная теплоемкость идеального газа?
Ответ. Молярная и удельная теплоемкости активно используются в термодинамике. Молярная теплоемкость – это теплоемкость одного моля вещества.
Удельная теплоемкость – теплоемкость единичной массы вещества.
Вопрос 3. Как определяется теплоемкость газа при изопроцессах?
Ответ.
При изотермическом процессе T=const. Теплоемкость равна плюс/минус бесконечности.
При адиабатном процессе нет теплообмена с окружающей средой, теплоемкость равна нулю.
При изохорном процессе газ не совершает работы, а теплоемкость равна:
Здесь i – количество степеней свободы молекул газа. Для одноатомных газов i=3, для двухатомных i=5.
При изобарном процессе теплоемкость определяется соотношением Мейера:
Вопрос 4. Как еще связаны теплоемкости при постоянном давлении и постоянном объеме?
Ответ. Отношение теплоемкостей при постоянном давлении и постоянном объеме обозначается греческой буквой «гамма» и называется показателем адиабаты.
Вопрос 5. Как называются процессы, в которых теплоемкость газа остается неизменной?
Ответ. Такие процессы называются политропными. Адиабатный процесс – частный случай политропного процесса.
Теплоемкость реального газа не равна теплоемкости идеального газа и может сильно отличаться.
Нужна помощь в решении задач и выполнении других заданий? Специальный студенческий сервис готов оказать ее!