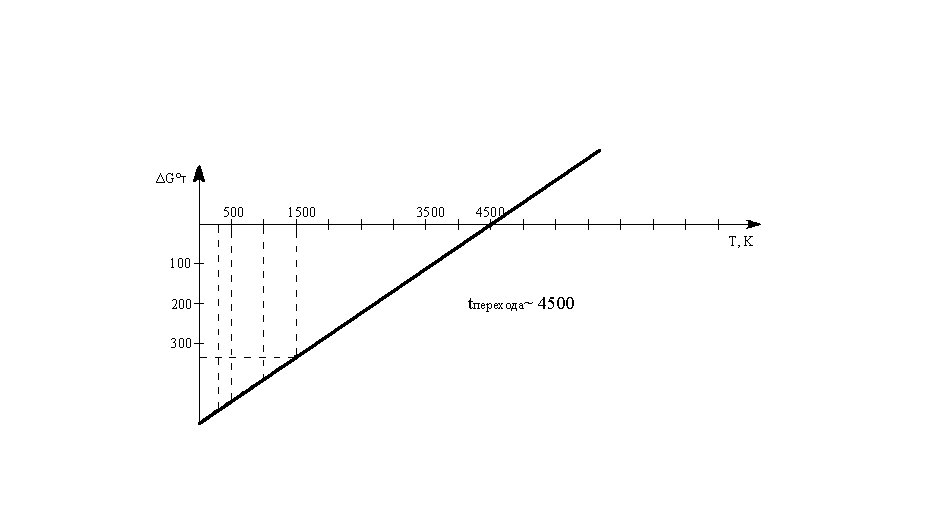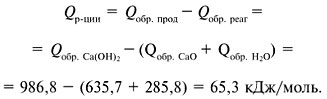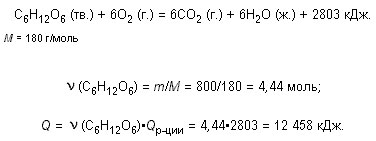Тепловой эффект химической реакции. Термохимические уравнения.
Химические реакции протекают либо с выделением теплоты, либо с поглощением теплоты.
Экзотермические реакции протекают с выделением теплоты (теплота указывается со знаком «+»). Эндотермические реакции – с поглощением теплоты (теплота Q указывается со знаком «–»).
Тепловой эффект химической реакции – это изменение внутренней энергии системы вследствие протекания химической реакции и превращения исходных веществ (реагентов) в продукты реакции в количествах, соответствующих уравнению химической реакции.
При протекании химических реакций наблюдаются некоторые закономерности, которые позволяют определить знак теплового эффекта химической реакции:
- Реакции, которые протекают самопроизвольно при обыных условиях, скорее всего экзотермические. Для запуска экзотермических реакций может потребоваться инициация – нагревание и др.
Например, после поджигания горение угля протекает самопроизвольно, реакция экзотермическая:
C + O2 = CO2 + Q
- Реакции образования устойчивых веществ из простых веществ экзотермические, реакции разложения чаще всего – эндотермические.
Например, разложение нитрата калия сопровождается поглощением теплоты:
2KNO3 → 2KNO2 + O2 – Q
- Реакции, в ходе которых из менее устойчивых веществ образуются более устойчивые, чаще всего экзотермические. И наоборот, образование более устойчивых веществ из менее устойчивых сопровождается поглощением теплоты. Устойчивость можно примерно определить по активности и стабильности вещества при обычных условиях. Как правило, в быту нас окружают вещества сравнительно устойчивые.
Например, горение амиака (взаимодействие активных, неустойчивых веществ — аммиака и кислорода) приводит к образованию устойчивых веществ – азота и воды. Следовательно, реакция экзотермическая:
4NH3 + 3O2 → 2N2 + 6H2O + Q
Количество теплоты обозначают буквой Q, измеряют в кДж (килоджоулях) или Дж (джоулях).
Количество теплоты, выделяющейся в результате реакции, пропорционально количеству вещества, вступившего в реакцию.
В термохимии используются термохимические уравнения. Это уравнение реакции с указанием количества теплоты, выделившейся в ней (на число моль вещества, равное коэффициентам в уравнении).
Например, рассмотрим термохимическое уравнение сгорания водорода:
2H2(г) + O2(г) = 2H2O(г) + 484 кДж,
Из термохимического уравнения видно, что 484 кДж теплоты выделяются при сгорании 2 моль водорода, 1 моль кислорода. Также можно сказать, что при образовании 2 моль воды выделяется 484 кДж теплоты.
Теплота образования вещества – количество теплоты, выделяющееся при образовании 1 моль данного вещества из простых веществ.
Например, при сгорании алюминия:
2Аl + 3/2О2 → Аl2О3 + 1675 кДж
теплота образования оксида алюминия равна 1675 кДж/моль. Если мы запишем термохимическое уравнение без дробных коэффициентов:
4Аl + 3О2 → 2Аl2О3 + 3350 кДж
теплота образования Al2O3 все равно будет равна 1675 кДж/моль, т.к. в термохъимическом уравнении приведен тепловой эффект образования 2 моль оксида алюминия.
Теплота сгорания – количество теплоты, выделяющееся при горении 1 моль данного вещества.
Например, при горении метана:
СН4 + 2О2 → СО2 + 2Н2О + 802 кДж
теплота сгорания метана равна 802 кДж/моль.
Разберемся, как решать задачи на термохимические уравнения (задачи на термохимию) из ЕГЭ. Для этого разберем несколько примеров термохимических задач.
1. В результате реакции, термохимическое уравнение которой:
N2 + O2 → 2NО – 180 кДж
получено 98 л (н.у.) оксида азота (II). Определите количество теплоты, которое затратили при этом (в кДж). (Запишите число с точностью до целых.).
Решение.
Из термохимического уравнения видно, что на образование 2 моль оксида азота (II) потребуется 180 кДж теплоты. 2 моль оксида азота при н.у. занимают объем 44,8 л. Составляем простую пропорцию:
на получение 44,8 л оксида азота (II) затрачено 180 кДж теплоты,
на получение 98 л оксида азота затрачено х кДж теплоты.
Отсюда х= 180*98/44,8 = 393,75 кДж. Округляем ответ до целых, как требуется в условии: Q=394 кДж.
Ответ: потребуется 394 кДж теплоты.
2. В результате реакции, термохимическое уравнение которой
2H2(г) + O2(г) = 2H2O(г) + 484 кДж,
выделилось 1452 кДж теплоты. Вычислите массу образовавшейся при этом воды (в граммах). (Запишите число с точностью до целых.)
Решение.
Из термохимического уравнения видно, что при образовании 2 моль воды выделится 484 кДж теплоты. Масса 2 моль воды равна 36 г. Составляем простую пропорцию:
при образовании 36 г воды выделится 484 кДж теплоты,
при образовании х г воды выделится 1452 кДж теплоты.
Отсюда х= 1452*36/484 = 108 г.
m (H2O)=108 г.
Ответ: образуется 108 г воды.
3. В результате реакции, термохимическое уравнение которой
S(ромб) + O2(г) = SO2(г) + 296 кДж,
израсходовано 80 г серы. Определите количество теплоты, которое выделится при этом (в кДж). (Запишите число с точностью до целых).
Решение.
Из термохимического уравнения видно, что при сгорании 1 моль серы выделится 296 кДж теплоты. Масса 1 моль серы равна 32 г. Составляем простую пропорцию:
при сгорании 32 г серы выделится 296 кДж теплоты,
при сгорании 80 г серы выделится х кДж теплоты.
Отсюда х= 80*296/32 = 740 кДж.
Q = 740 кДж.
Ответ: выделится 740 кДж теплоты.
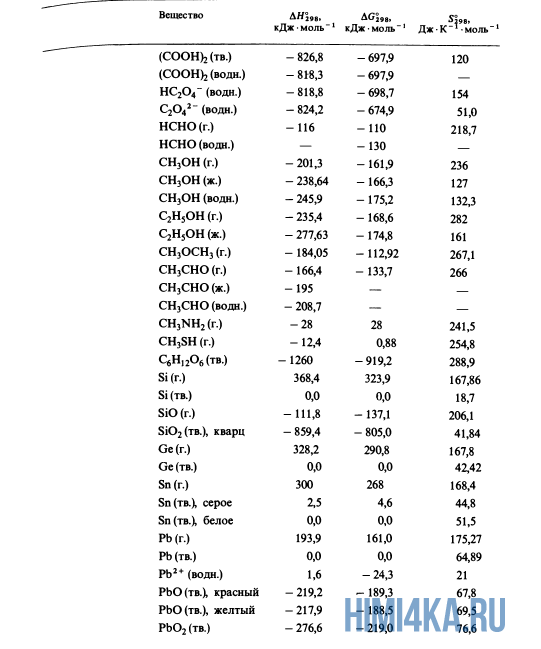
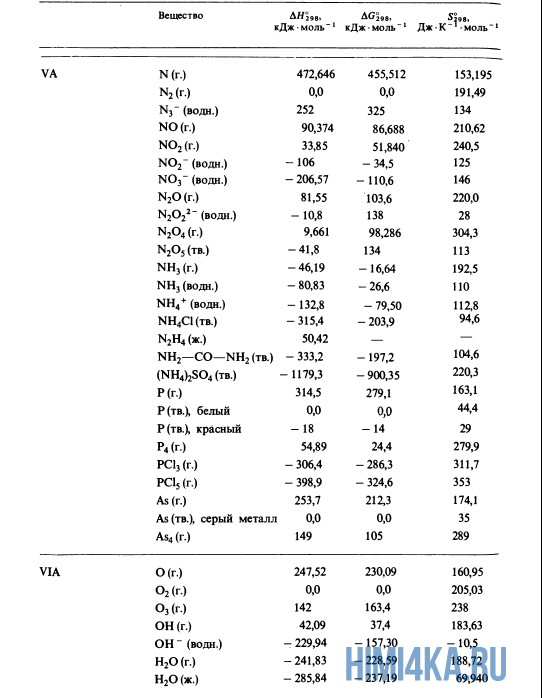
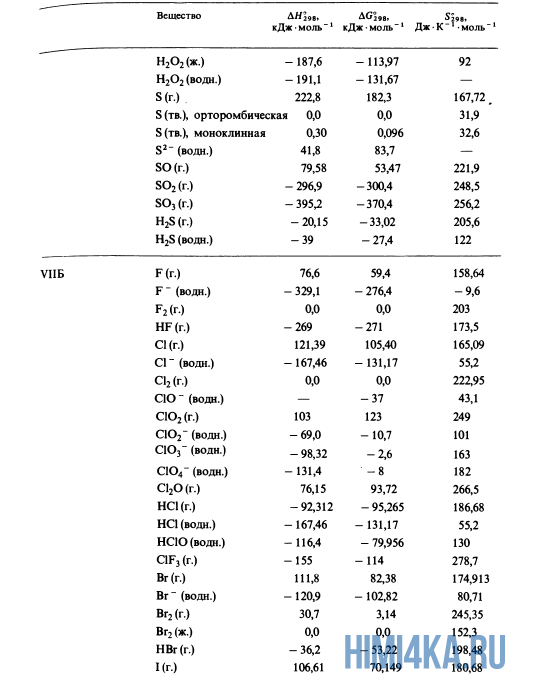
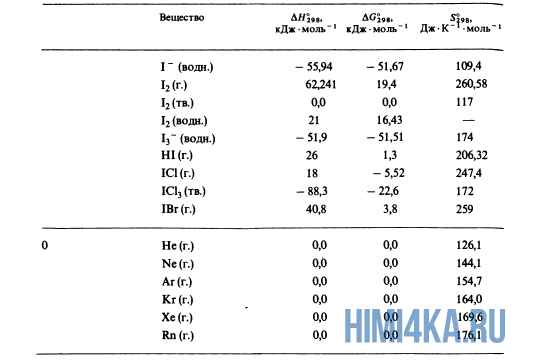
В уроке 21 «Теплота образования» из курса «Химия для чайников» рассмотрим что такое теплоты образования и откуда их брать; выясним, какие условия считаются стандартными, а также различия простых и сложных веществ; для закрепления полученных знаний решим пару задач, где используются теплоты образования и закон аддитивности теплот реакций. Будет неплохо, если перед прочтением данного урока, вы изучите материал про изменение энтальпии, а также про теплоты сгорания.
Благодаря закону Гесса (закону аддитивности теплот реакций) нам совсем не нужно считать теплоты всех реакций; достаточно иметь сведения о теплОтах лишь того минимума реакций, из которых можно получить все остальные. Подобный минимум, принятый всеми учеными и инженерами, представляет собой теплоты образования соединений из входящих в них чистых элементов в стандартных состояниях. А что же такое: стандартные состояния?
Стандартное состояние вещества
Для кристаллических и жидких веществ стандартное состояние определяется как наиболее распространенная форма элемента при 25°С (298 К*) и внешнем давлении 1 атмосфера (атм); стандартное состояние газов определяется аналогичным образом, но при парциальном** давлении 1 атм. Вот например, стандартным состоянием углерода считается графит, а не алмаз.
* Кельвин (обозначение «К») – еще один показатель измерения температуры, наряду с Цельсия. Пока вам просто следует запомнить, что 0°С = 273 К, соответственно 1°С = 274 К, -1°С = 272 К, а -273°С = 0 К. Самой низкой температурой считается 0 К и называется абсолютным нулем.
** Парциальное давление — это давление, которое имел бы газ, входящий в состав газовой смеси, если бы он один занимал объём, равный объёму смеси при той же температуре.
Простые и сложные вещества
Все вещества можно разделить на две обширные группы — простые и сложные вещества.
Простые вещества — это вещества, образованные из атомов одного элемента. Примеры простых веществ: молекулярные (O2, O3, H2, Cl2) и атомарные (He, Ar) газы; различные формы углерода, иод (I2), металлы (не в виде сплавов).
Сложные вещества (химические соединения) — это вещества, образованные атомами разных элементов. Так, оксид меди CuO образован атомами элементов меди Cu и кислорода O, вода H2O — атомами элементов водорода H и кислорода O.
Теперь вы понимаете различия простых веществ от сложных. Так вот, теплота образования простых веществ всегда равна нулю. Это, пожалуйста, запомните.
Стандартные теплоты образования
Вспомним прошлый урок, где мы пытались синтезировать алмаз. Теплоты образования всех веществ, участвующих в этом синтезе таковы:
- C(графит) + 2H2(г.) → CH4(г.) ΔH = -74,8 кДж (1)
- C(графит) → C(алмаз) ΔH = +1,9 кДж (2)
- H2(г.) + ½O2(г.) → H2O(ж.) ΔH = -285,8 кДж (3)
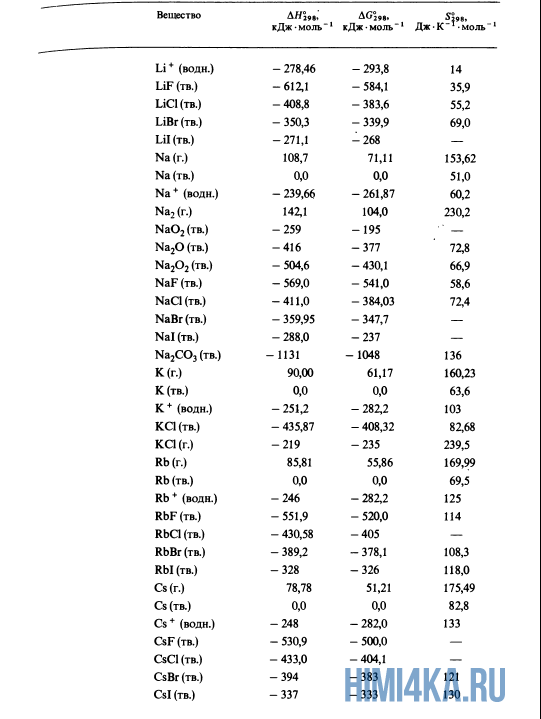
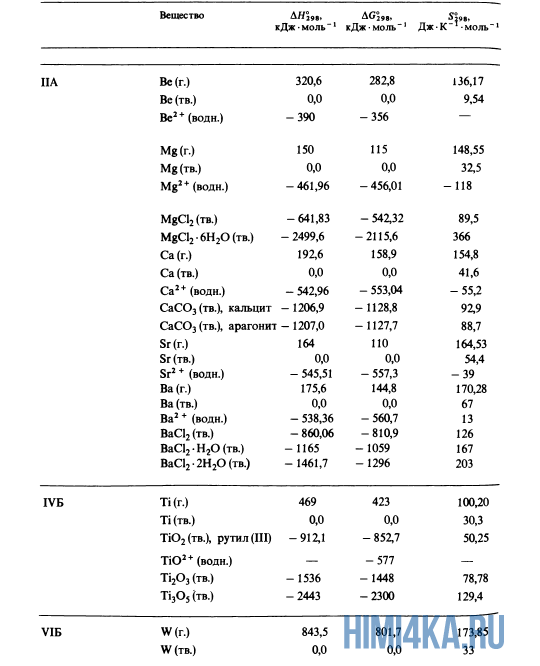
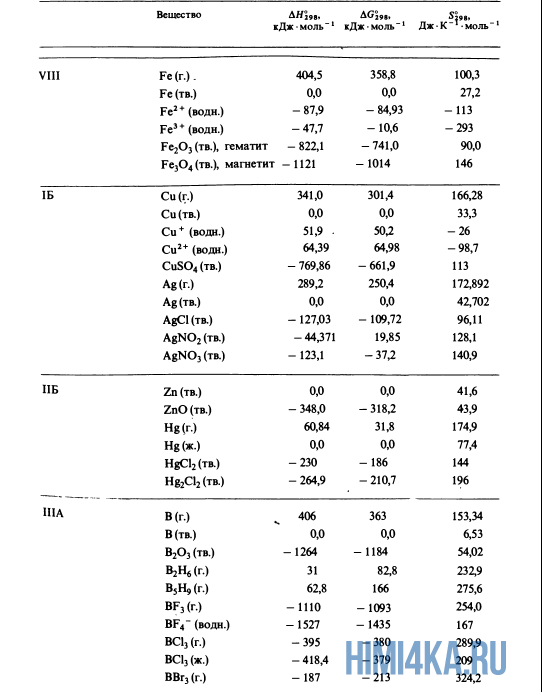
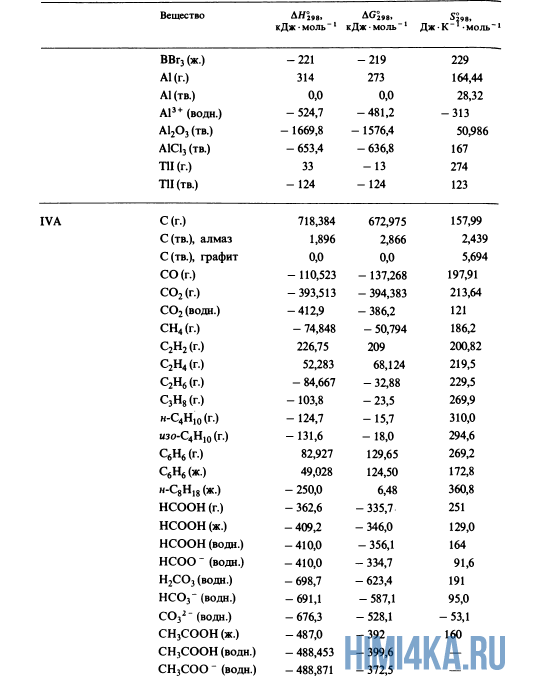
Как уже было отмечено выше, O2 относится к простым веществам, поэтому его теплота образования равна нулю. Таблицы стандартных теплот образования ΔH°298 соединений из чистых элементов приведена ниже под спойлером. В этой таблице нижний индекс 298 обозначает комнатную температуру (298 К = 25°С), а верхний индекс (знак градуса) означает, что реагенты и продукты находятся в своих стандартных состояниях. Однако не обязательно пользоваться записью ΔH°298, достаточно лишь написать ΔH.
Сейчас, на примере старой и доброй реакции (4) получения алмаза путем окисления метана, я покажу вам, как по теплотам образования веществ можно определить теплоту общей реакции. Это уравнение можно получить суммированием уравнения (2) с удвоенным уравнением (3) и обращенным уравнением (1):
- C(графит) → C(алмаз) ΔH = +1,9 кДж (2)
- 2H2(г.) + O2(г.) → 2H2O(ж.) ΔH = -571,6 кДж 2×(3)
- CH4(г.) → C(графит) + 2H2(г.) ΔH = +74,8 кДж -(1)
В итоге получаем:
- CH4(г.) + O2(г.) → C(алмаз) + 2H2O(ж.) ΔH = -494,9 кДж (4)
Теплота реакции вычисляется точно таким же способом, просто из теплот образования продуктов реакции вычитаем теплоты образования реагентов, учитывая все коэффициенты:
- ΔH = (+1,9) + 2(-285,8) — (-74,8) = -494,9 кДж
У кого возник вопрос, почему же мы не вычитаем теплоту образования кислорода, ответ ищите в таблице теплот образования.
Очевидно, что при таких вычислениях следует быть очень внимательным к знакам и коэффициентам. Чтобы не допустить ошибки, настоятельно рекомендую вам выписывать отдельно каждое уравнение с соответствующей теплотой реакции в таком виде, чтобы сумма всех индивидуальных уравнений давала требуемую реакцию. Если все коэффициенты какого-либо уравнения умножены на произвольное число n, на это же число n должна быть умножена соответствующая теплота образования, а если используется обращенное уравнение реакции образования, то следует изменить свой знак перед табличной величиной ΔH. Когда индивидуальные уравнения суммируются для получения требуемой реакции, сумма индивидуальных теплот образования дает искомую теплоту реакции. А теперь закрепим полученные знания примерами.
Пример 1. Чему равна стандартная теплота реакции восстановления оксида трехвалентного железа Fe2O3 углеродом С до железа Fe и моноксида углерода O, протекающей в доменной печи?
Решение:
Запишем уравнение реакции, указав под каждым веществом его стандартную теплоту образования:
- Fe2O3(тв.) + 3C(графит) → 2Fe(тв.) + 3CO(г.)
- -822,1 0,0 0,0 -110,5 ΔH, кДж·моль-1
Стандартная теплота образования простых элементов (С и Fe) по определению равна нулю. Стандартная теплота рассматриваемой реакции равна:
- ΔH° = 2(0,0) + 3(-110,5) — (-822,1) — 3(0,0) = +490,6 кДж
Как видите, изменение энтальпии положительно, а значит реакция эндотермическая (поглощается тепло). Полученный результат согласуется с известным фактом, что при восстановлении железной руды до свободного железа необходимо подводить к реакционной системе большое количество теплоты. Отметим, однако, что 490,6 кДж — это теплота, которая поглощалось бы, если бы реакция проводилась при 298 К, а не при 1800 К, как это происходит в доменной печи. Получается, что наше решение неверно? Нет, оно абсолютно верно, просто тепловой эффект (+490,6 кДж) следует рассматривать как телоту, поглощаемую при нагревании оксида железа (III) и углерода от 298 до 1800 К, последующей реакции между ними и охлаждением снова до комнатной температуры 298 К. Изменение энтальпии, или теплота реакции, зависит только от исходного и конечного состояний участников реакции, а нет от того, остается ли температура постоянной или поднимается до уровня, достигаемого в доменной печи, и затем опускается снова. Важно лишь то, что в конце процесса, как и в его начале, температура имеет значение 298 К. Еще раз повторяю, ибо это очень важный момент: Когда мы ссылаемся на теплоты реакции и утверждаем, что полученные значения относятся к процессу, проводимой «при давлении 1 атм и 298 К», требуется только, чтобы реакция начиналась при этих условиях и продукты были приведены к этим условиям (1 атм и 298 К).
Пример 2. Определите теплоту сгорания жидкого бензола.
Решение:
Запишем полное уравнение реакции с указанием теплот образования всех участвующих в нем веществ:
- 2C6H6(ж.) + 15O2(г.) → 12CO2(г.) + 6H2O(ж.)
- +49 0,0 -393,5 -285,8 ΔH, кДж·моль-1
Теплота этой реакции, как она записана (с 2 молями бензола), равна:
- ΔH = 12(-393,5) + 6(-285,8) — 2(+49,0) — 15(0,0) = -6540 кДж
Следовательно, теплота сгорания 1 моля бензола должна быть равна половине этой величины, т.е. -3270 кДж·моль-1.
Надеюсь урок 21 «Теплота образования» был не скучным. Если у вас возникли вопросы, пишите их в комментарии.
ВЫЧИСЛЕНИЕ
СТАНДАРТНЫХ ТЕПЛОТ ОБРАЗОВАНИЯ ВЕЩЕСТВ
И ТЕПЛОВЫХ ЭФФЕКТОВ ХИМИЧЕСКИХ РЕАКЦИЙ
Расчет
стандартной теплоты образования веществ
Пример.
Вычислите стандартную теплоту образования
этана, если известна теплота его сгорания:
ΔНосгор.=
–1560 кДж/моль.
Решение.
Напишем
уравнение реакции таким образом, чтобы
перед
формулой этана стехиометрический
коэффициент был равен
1:
С2Н6
+ 3,5О2
= 2СО2
+ 3Н2О
ΔНообр.
0 2·(–393)·
3·(–286)
ΔНосгор.=
ΔНор.
= (–286)·3.+ (–393)·2 – ΔНообр.
=
–1560 кДж/моль,
ΔНообр.
= 1560 – 286·3 – 393·2 = –84 кДж/моль.
Пример. Определите
стандартную теплоту образования
этилового спирта, если теплоты сгорания
углерода, водорода и этилового спирта
соответственно равны:
–393,51; –285,84; –1366,91
кДж/моль.
Решение.
Стандартная
теплота образования вещества равна
теплоте реакции образования одного
моля этого вещества из простых веществ
при стандартных условиях.
Образование
этилового спирта из простых веществ
можно представить так: 2С + 3Н2
+ 1/2О2
= С2Н5ОН.
Углерод сгорает до СО2,
водород – до Н2О,
а этиловый спирт–до СО2
и Н2О.
Следовательно, для определения стандартной
теплоты образования C2H5ОH
составим следующий цикл Гесса:
1. 2С
+ 2О2
= 2СО2
–393,51·2
2. 3Н2+
3/2О2
= 3Н2О
–285,84·3
3.
2СО2+
ЗН2О
= С2Н5ОН
+ 3О2
+1366,91
(1) + (2) + (3)
2С +
3Н2
+ 1/2О2
= С2Н5ОН
–277,6 кДж/моль
–393,51·2 –285,84·3 +
1366,91 = –277,6
Стандартная теплота
образования этилового спирта равна:
ΔНо298
= –277,6
кДж/моль.
Расчет теплового
эффекта реакции по стандартным теплотам
образования реагирующих веществ
Пример. Определите
количество теплоты, выделяющееся при
гашении
100 кг
извести водой, если стандартные теплоты
образования реагирующих веществ равны
(кДж/моль): ΔНо
(СаО(к))=
–635,1; ΔНо
(Са(ОН)2(к))=
–986,2;
ΔНо
(Н2О(ж))
=
–285,84.
Решение.
Реакция
гашения извести: СaO
+ H2О
= Са(ОН)2.
Тепловой эффект реакции равен
∆Hºp
=
Σ∆Hºобр.(прод.)
– Σ∆Hºобр.(исх..)
ΔНор.
= ΔНо
(Са(ОН)2(к))
–[ΔНо
(СаО(к))+
ΔНо
(Н2О(ж))]
= –986,2+635,1 +285,84 =
–65,3 кДж/моль.
Тепловой эффект
реакции рассчитан на 1 моль СаО, т.е. на
56 г СаО. При гашении 100 кг СаО выделяется
тепловая энергия:
56 г СаО —
(–65,3) кДж
100 000
г СаО — х
кДж
х
= (100
000·(–65,3)) /56
= –1,16·105
кДж.
Расчет теплового
эффекта реакции по стандартным теплотам
сгорания реагирующих веществ
Пример. Определите
тепловой эффект реакции синтеза акриловой
кислоты:
+
СО+ Н2О(ж)
→ СН2=СН–СООН(ж),
если стандартные
теплоты сгорания ацетилена, оксида
углерода и акриловой кислоты соответственно
равны (кДж/моль): –1299,63, –282,50 и –1370,0.
Решение.
Из
закона Гесса следует, что тепловой
эффект реакции равен разности между
суммой теплот сгорания исходных веществ
и суммой теплот сгорания продуктов
реакции (ΔНосгор..н2о=0,
так как Н2О
– высший оксид);
∆Hºp
=
Σ∆Hºсгор.(исх.)
– Σ∆Hºсгор.(прод.)
ΔНо
= ΔНосгор.(СН=СН)
+ ΔНосгор.(СО)
– ΔНосгор.
(СН2=СН–СООН(ж))=
–1299,63 – 282,50 + 1370,0
= –212,13 кДж/моль.
ВЫЧИСЛЕНИЕ ИЗМЕНЕНИЯ
ЭНЕРГИИ ГИББСА
Определение
возможности протекания процесса по
величине изменения энергии Гиббса.
Пример. Возможна
ли следующая реакция в стандартных
условиях:
t
SiО2
(к)
+ 2NaОH
(p)
= Na2SiО3
(к)
+ Н2О
(ж)
если
ΔGо(SiО2
(к))
= –803,75 кДж/моль; ΔGо
(Na2SiО3
(к))=
–1427,8 кДж/моль;
ΔGо
(NaОH(p))
= –419,5 кДж/моль; ΔGо
(Н2О
(ж))
= –237,5 кДж/моль?
Можно ли выпаривать
щелочь в стеклянном сосуде?
Решение.
Изменение
энергии Гиббса ΔGо298
реакции
равно:
ΔGо
=
ΣGопрод.
– ΣGоисх.;
ΔGо298
=
(–1427,8 – 237,5) – (–803,75 –419,5·2)=
–22,55 кДж;
ΔGо298
= –22,55
кДж (т. е. ΔG<0),
а следовательно, данная реакция возможна.
Щелочь нельзя выпаривать в стеклянном
сосуде, так как в состав стекла входит
SiО2.
Пример. Вычислить
ΔGо
для реакции 2Н2
(г)+О2
(г) 2Н2О(г).
при 298, 500, 1000, 1500 К.
Зависимостью ΔНо
и
ΔSo
от температуры пренебречь. Построить
график зависимости ΔGо
от
температуры и найти по графику температуру,
ниже которой указанная реакция в
стандартных условиях может протекать
самопроизвольно.
Решение.
Согласно
уравнению ΔG
= ΔН
– TΔS
влияние
температуры на ΔG
определяется
знаком и величиной ΔS.
Если
пренебречь влиянием Т
на
значения ΔН
и ΔS,
то приведённая зависимость ΔG
=ƒ(T)
является уравнением прямой, наклон
которой определяется знаком ΔS.
при ΔS>0
прямая идет вниз, при ΔS<0
– вверх.
Определим
величину ΔН°298
(исходные данные берем из табл.1)
∆Hºp
=
Σ∆Hºобр.(прод.)
– Σ∆Hºобр.(исх..)
ΔН°298
= 2ΔН°обр.(H2O)
– (2ΔН°обр.(H2)
+ 2ΔН°обр.(O2)
= 2ΔН°обр.(H2O)
=
=2(-241,84)
= –483,68 (кДж) (на 2 моля
H2O)
ΔН°обр.(Н2О)
= 0,5(–483,8)
= –241,89 кДж/моль.<0
Следовательно,
реакция экзотермическая.
Определим
изменение энтропии
данной реакции в стандартных условиях
ΔS°298
(исходные
данные берем из табл.1)
ΔSо
=
ΣSопрод.
– ΣSоисх.:
ΔS°298=
2S°298.(H2O)
– [2S°298.(H2)
+ S°
298.(O2)]=
2·188,74
– (2·130.6 +
205) =
–98,6(Дж/
К) = –0,0986(кДж/ К)
< 0, ΔG
=ƒ(T)
прямая
идет вверх.
Определим
изменение энергии Гиббса ΔG°298
в
стандартных условиях (исходные
данные берем из табл.1):
ΔGо
=
ΣGопрод.
– ΣGоисх.;
ΔG°298
=
2ΔG°298.(H2O)
– [2ΔG°298(H2)
– ΔG°298(O2)]
=
2(–228,8)
=
–457,6 кДж.
Отрицательная
величина ΔG°298
свидетельствует
о том, что в стандартных
условиях реакция самопроизвольно
протекает в
прямом направлении.
ΔG°298
=
ΔН°298
–
298·ΔS0298
=
–483,68 – 298·(–0,0986) = –457,6кДж
ΔG°500
=
ΔН°298
–
500·ΔS0298
=
–483,68 – 500·(–0,0986) = –434,38кДж
ΔG°1000
=
ΔН°298
–
1000·ΔS0298
=
–483,68 – 1000·(–0,0986) = –385,08кДж
ΔG°1500
=
ΔН°298
–
1500·ΔS0298
=
–483,68 – I500·(–0,0986) = –335,78 кДж
Построим
график ΔG°Т
=f(Т):
Температура
перехода ~4500
К
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Теплота образования
Qобр.
— это тепловой эффект реакции синтеза (1) моль вещества из простых веществ.
Например, теплота образования оксида азота((II)) равна
−87,5кДж/моль
:
0,5N2(г)+0,5O2(г)=NO(г)−87,5кДж.
Теплота сгорания
Qсгор.
— это тепловой эффект реакции горения (1) моль вещества.
Например, теплота сгорания этана равна
1560кДж/моль
:
C2H6(г)+3,5O2(г)=2CO2(г)+3H2O(г)+1560кДж.
Теплота сгорания и теплота образования определяются при стандартных условиях, т. е. при температуре (25°C) и давлении
101,3кПа
.
Обрати внимание!
Используя теплоту сгорания или образования веществ, можно вычислить тепловой эффект реакции. Для этого от суммы теплоты сгорания (образования) реагентов нужно отнять сумму теплоты сгорания (образования) продуктов.
Определим тепловой эффект реакции дегидрирования этана:
C2H6(г)→C2H4(г)+H2(г).
Теплоту сгорания этана, этилена и водорода возьмём из справочной литературы:
Qсгор.(C2H6)=1560кДж/моль;
Qсгор.(C2H4)=1410кДж/моль;
Qсгор.(H2)=242кДж/моль.
Тепловой эффект дегидрирования этана можно найти, если от теплоты сгорания этана отнять теплоту сгорания этилена и водорода:
Q=Qсгор.(C2H6)−Qсгор.(C2H4)−Qсгор.(H2);
Q=1560−1411−242=−93кДж/моль.
Термохимическое уравнение реакции:
C2H6(г)→C2H4(г)+H2(г)−93кДж.
Понятие об энтальпии реакции
Иногда тепловой эффект реакции указывают, используя энтальпию реакции.
Энтальпия химической реакции
ΔH
— это изменение внутренней энергии участвующих в реакции веществ.
Энтальпия противоположна по знаку тепловому эффекту, т. е. если указано, что
ΔH
(< 0), значит, тепловой эффект реакции положительный ((+Q)), и наоборот, если
ΔH
(> 0), то тепловой эффект реакции отрицательный ((-Q)). Например, уравнение реакции оксида кальция с водой можно записать так:
( = — 65) (кДж/моль)
или так:
CaO(тв)+H2O(ж)=Ca(OH)2(тв)+65кДж.
И.В.ТРИГУБЧАК
Пособие-репетитор по химии
ЗАНЯТИЕ 10
10-й класс (первый год обучения)
Продолжение. Начало см. в № 22/2005; 1, 2, 3, 5, 6, 8, 9, 11, 13, 15, 16/2006
Основы термохимии. Тепловые эффекты
химических реакций
План

Экзо- и эндотермические реакции.
2. Тепловой эффект химической реакции. Понятие
об энтальпии.
3. Термохимические уравнения.
4. Закон Гесса и следствия из него.
Химические реакции протекают с выделением или
поглощением энергии (обычно в виде теплоты). Химические
реакции, протекающие с выделением теплоты,
называются экзотермическими, а реакции,
протекающие с поглощением теплоты, –
эндотермическими.
Например:
С + О2 CO2
+ Q,
СaCO3 CaO + CO2
– Q.
Количество теплоты, которое выделяется или
поглощается в результате химической реакции,
называется тепловым эффектом реакции (Q).
Тепловой эффект выражается в кДж или ккал
(1 ккал = 4,187 кДж). Для экзотермических реакций Q
> 0, для эндотермических Q < 0.
Уравнения химических реакций, в которых
записывается тепловой эффект реакции, называют термохимическими
уравнениями. Величина Q указывается в
правой части уравнения со знаком «+» в случае
экзотермической реакции и со знаком «–» в случае
эндотермической реакции. В термохимическом
уравнении принято указывать агрегатные
состояния реагентов и продуктов реакции, т.к.
тепловой эффект реакции зависит от агрегатных
состояний реагирующих веществ. По
термохимическим уравнениям можно проводить
различные расчеты, поскольку тепловой эффект
реакции относится к мольным количествам
исходных веществ и продуктов реакции. Также
термохимические уравнения можно записывать с
величиной изменения энтальпии (Н).
Энтальпия – термодинамическая функция,
определяющая общий запас энергии системы
(энергетическое состояние вещества), включая
энергию, затрачиваемую на преодоление внешнего
давления. Q = –H.
Размерность энтальпии – Дж/моль.
Например:
С + О2 CO2
– Н,
СaCO3 CaO + CO2
+ Н.
Основной закон термохимии установлен русским
ученым Г.И.Гессом в 1840 г. (закон Гесса):
тепловой эффект химической реакции зависит
только от начального и конечного состояний
веществ и не зависит от промежуточных стадий
процесса.
Например:
С + 1/2О2 CO + Q1,
СO + 1/2О2 CO2
+ Q2,
С + О2 CO2
+ Q3;
Q3 = Q1 + Q2.
Первое следствие из закона Гесса:
тепловой эффект реакции равен сумме теплот
образования продуктов реакции за вычетом сумм
теплот образования исходных веществ (с учетом
коэффициентов):
Qр-ции = Qобр. прод
– Qобр. реаг.
Теплота образования (Qобр) – это
теплота, которая выделяется или поглощается при
образовании
1 моль сложного вещества из простых веществ при
стандартных условиях. Теплоты образования
простых веществ приняты равными нулю.
Стандартные условия – давление 1 атм (101,3
кПа), Т = 298К (25 °С).
Второе следствие из закона Гесса:
тепловой эффект химической реакции равен сумме
теплот сгорания исходных веществ за вычетом
суммы теплот сгорания продуктов реакции (с
учетом коэффициентов):
Qр-ции = Qсгор. реаг –
Qсгор. прод.
Теплота сгорания (Qсгор) – это
теплота, выделяющаяся при сгорании 1 моль
вещества в кислороде при стандартных условиях с
образованием оксида элемента в высшей степени
окисления. Теплоты сгорания негорючих веществ
равны нулю.
Теплоты сгорания и образования – справочные
величины, они приводятся в справочных
термодинамических таблицах при стандартных
условиях.
Тест по теме
«Основы термохимии. Тепловые эффекты химических
реакций»

При стандартных условиях теплота образования
равна 0 для:
а) водорода;
б) воды;
в) пероксида водорода;
г) алюминия.
2. Реакция, уравнение которой
N2 + O2 = 2NO – Q,
относится к реакциям:
а) эндотермического соединения;
б) экзотермического соединения;
в) эндотермического разложения;
г) экзотермического разложения.
3. При взаимодействии 10 г натрия с водой
выделяется 36,46 кДж теплоты. Какое количество
теплоты (в кДж) выделилось, если в результате
реакции образовалось 200 г гидроксида натрия?
а) 838; б) 209,5; в) 364,6; г) 419.
4. Эндотермической является реакция:
а) горения водорода; б) разложения воды;
в) горения углерода; г) горения метана.
5. Известны тепловые эффекты следующих
процессов:
2С2Н2 (г.) + 5О2 (г.) = 4СО
(г.) + 2Н2О (ж.) + 2600 кДж,
Н2О (ж.) = Н2О (г.) – 40 кДж.
Какую массу воды (в г), находящейся при
температуре кипения, можно испарить за счет
теплоты, полученной при полном сгорании 89,6 л (н.у.)
ацетилена?
а) 72; б) 1170; в) 2340; г) 4680.
6. Какое определение неверно для данной
реакции:
2NaNO3 (тв.) = 2NaNO2 (тв.) + O2
(г.) – Q?
а) Гомогенная;
б) эндотермическая;
в) реакция соединения;
г) окислительно-восстановительная.
7. Даны теплоты реакций:
С + 1/2О2 = СО + 110 кДж,
2СО + О2 = 2СО2 + 566 кДж.
Определить теплоту образования углекислого
газа из простых веществ (в кДж/моль).
а) 346; б) 786; в) 503; г) 393.
8. Дано термохимическое уравнение:
2SO2 + O2 = 2SO3 + 198 кДж.
В результате реакции выделилось 495 кДж теплоты.
Какая масса (в г) сернистого газа прореагировала
с кислородом?
а) 160; б) 640; в) 320; г) 320.
9. Теплота сгорания ацетилена – 1300 кДж/моль.
Какое количество теплоты (в кДж) выделится при
сгорании 1л ацетилена (в пересчете на н.у.)?
а) 58; б) 116; в) 1300; г) 58 000.
10. Основным законом термохимии является
закон:
а) Гей-Люссака; б) Гесса;
в) Авогадро; г) Пруста.
Ключ к тесту
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| а, г | а | г | б | в | а, в | г | в | а |
б |
Задачи на основные
термохимические расчеты

теплоту реакции получения гидроксида кальция из
оксида кальция и воды, если теплота образования
оксида кальция равна +635,7 кДж/моль, теплота
образования воды равна +285,8 кДж/моль, а теплота
образования гидроксида кальция равна +986,8
кДж/моль.
Решение
Ответ. 65,3 кДж/моль.
2. Найти теплоту образования угарного газа,
если теплота образования углекислого газа равна
+393,8 кДж/моль, а теплота реакции получения
углекислого газа из угарного газа и кислорода
равна +283,2 кДж/моль.
Ответ. +110,6 кДж/моль.
3. Теплота сгорания графита составляет +393,8
кДж/моль, а теплота сгорания алмаза равна
+395,7 кДж/моль. Определить теплоту превращения
графита в алмаз.
Ответ. –1,9 кДж/моль.
4. Теплота образования бромоводорода равна
+36 кДж/моль, теплота образования йодоводорода
равна +12,6 кДж/моль. Рассчитать тепловой эффект
реакции взаимодействия йодоводорода с бромом.
Ответ. +23,4 кДж/моль.
5. Теплота образования углекислого газа
равна +393,8 кДж/моль, теплота образования воды
равна
+285,8 кДж/моль, теплота сгорания этилена равна +1402
кДж/моль. Вычислить теплоту образования этилена.
Ответ. –42,8 кДж/моль.
6. Определить тепловой эффект реакции
разложения 1 моль известняка, если при
образовании 10 г карбоната кальция из оксида
кальция и углекислого газа выделяется 16 кДж
теплоты.
Ответ. –160 кДж/моль.
7. Термохимическое уравнение реакции
горения метана имеет вид:
СН4 (г.) + 2О2 (г.) = СО2 (г.)
+ 2Н2О (г.),
Н = –802,2 кДж.
Найти, какое количество теплоты выделится при
сгорании 44,8 л (н.у.) метана.
Ответ. 1604,4 кДж.
8. При соединении 11,16 г железа с серой
выделилось 20,06 кДж теплоты. Определить теплоту
образования сульфида железа.
Ответ. 100,3 кДж/моль.
9. Термохимическое уравнение реакции
окисления водорода имеет вид:
Н2 (г.) + 1/2О2 (г.) = Н2О (г.),
Н = –241,8 кДж.
Определить количество теплоты, выделяющейся
при взрыве 8,4 л (н.у.) гремучего газа.
Ответ. 60,45 кДж.
10. При сгорании этилена выделилось 6226 кДж
теплоты. Найти объем (н.у.) кислорода, вступившего
в реакцию, если тепловой эффект данной реакции
составляет 1410,9 кДж. Ответ. 296,5 л.
11. Окисление глюкозы в организме может
протекать по реакции:
С6Н12О6 (тв.) + 6О2
(г.) = 6СО2 (г.) + 6Н2О (ж.),
Н = –2803 кДж.
Какое количество теплоты выделится при
окислении 800 г глюкозы?
Решение
Ответ. 12 458 кДж.
12. При стандартных условиях теплота полного
сгорания белого фосфора равна 760,1 кДж/моль, а
теплота полного сгорания черного фосфора равна
722,1 кДж/моль. Определить теплоту превращения
черного фосфора в белый при стандартных
условиях.
Ответ. –38 кДж/моль.
13. При сжигании уксусной кислоты в
кислороде выделилось 235,9 кДж теплоты и осталось 10
л непрореагировавшего кислорода (измерено при
давлении 104,1 кПа и температуре 40 °С).
Рассчитать массовые доли компонентов в исходной
смеси, если теплоты образования углекислого
газа, паров воды и уксусной кислоты равны
соответственно 393,5 кДж/моль, 241,8 кДж/моль и
484,2 кДж/моль.
Ответ. 36% СН3СООН и 64% О2.
14. 48 г минерала, содержащего 46,7% железа и 53,3%
серы по массе, сожгли в избытке кислорода, а
твердый продукт сгорания прокалили с 18,1 г
алюминия. Какое количество теплоты выделилось в
результате каждого из этих процессов, если
известно, что реакции проводились при постоянной
температуре, а теплоты образования при данной
температуре таковы: сульфид железа – 174 кДж/моль,
оксид железа(III) – 824 кДж/моль, сернистый газ – 297
кДж/моль, оксид алюминия – 1675 кДж/моль?
Ответ. 332,8 кДж и 170,2 кДж.
15. Тонко измельченную смесь алюминия и
железной окалины (термит) применяют для сварки
металлических изделий, поскольку при ее
поджигании выделяется большое количество
теплоты и развивается высокая температура.
Рассчитать минимальную массу термитной смеси,
которую необходимо взять для того, чтобы
выделилось 665,3 кДж теплоты в процессе
алюмотермии, если теплоты образования железной
окалины и оксида алюминия равны 1117 кДж/моль и 1670
кДж/моль соответственно.
Ответ. 182,4 г.